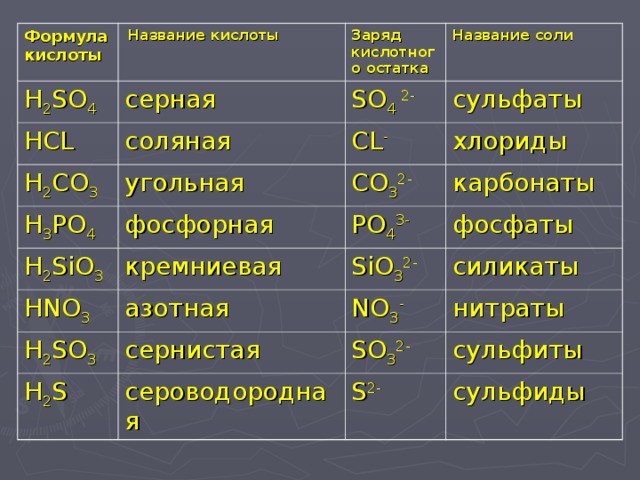
Хлорноватая кислота — Госстандарт
В вашем браузере отключена поддержка JavaScript. Для просмотра этой страницы нужно включить JavaScript. Чтобы узнать, как это сделать, нажмите здесь.
- >
Кислоты
- > Азотистая кислота
- > Азотная кислота
- > Бромоводородная кислота
- > Дихромовая кислота
- > Иодоводородная кислота
- > Марганцовая кислота
- > Марганцовистая кислота
- > Метаалюминиевая кислота
- > Метаборная кислота
- > Метакремниевая кислота
- > Метафосфорная кислота
- > Ортоалюминиевая кислота
- > Ортоборная кислота
- > Ортокремниевая кислота
- > Ортофосфорная кислота
- > Ортохромистая кислота
- > Серная кислота
- > Сернистая кислота
- > Сероводородная кислота
- > Тетраборная кислота
- > Угольная кислота
- > Фосфористая кислота
- > Фтороводородная кислота
- > Хлористая кислота
- > Хлорная кислота
- > Хлорноватая кислота
- > Хлорноватистая кислота
- > Хлороводородная кислота
- > Хромовая кислота
- > Циановодородная кислота
- >
Соли
- > Хлорид натрия
- > Хлорид кальция
- > Хлорат калия
- > Карбонат калия
- > Карбонат натрия
- > Гидрокарбонат натрия
- > Сульфат натрия
- > Сульфат кальция
- > Сульфат аммония
- > Сульфат магния
HClO3 — хлорноватая кислота.
Степень окисления хлора = +5
В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — Cl2O5.
Сильная кислота — окислитель: HClO3 + S + h3O= h3SO4 + HCl
Соли — хлораты.
Хлорноватая кислота — HClO3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается:
- 8HClO3 = 4HClO4 + 3O2 + 2Cl2 + 2H2O
Химические свойства
Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры. HClO3 легко восстанавливается до соляной кислоты:
- HClO3 + 6HBr → HCl + 3Br2 + 3H2O
В слабокислой среде HClO3 восстанавливается сернистой кислотой H2SO3 до Сl—, но при пропускании смеси SO2 и воздуха сквозь сильнокислый раствор, получается диоксид хлора:
- 2HClO3 + H2SO3 → 2ClO2 + H2SO4 + H2O
В 40%-ной хлорноватой кислоте воспламеняется, например, фильтровальная бумага.
Получение
Хлорноватая кислота образуется при разложении хлорноватистой кислоты, при электролизе растворов хлоридов; в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой:
- Ba (ClO3)2 + H2SO4 = BaSO4 + 2HClO3
Хлораты
Хлорноватой кислоте соответствуют соли — хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния.
Соли хлорноватой кислоты (хлораты) — сильные окислители, в смеси с восстановителями взрывоопасны.
Система комментирования SigComments
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.
Главная Новости портала Черный список Архив Обратная связь
Кислородосодержащие соединения галогенов (оксиды, гидроксиды, соли). Их получение и химические свойства. Хлорная известь
Оксиды
Галогены непосредственно с кислородом не реагируют, так как эти реакции эндотермичны (rH > 0), rS < 0 и, следовательно, rG > 0. Оксиды галогенов – кислотные оксиды. Оксиды хлора устойчивее оксидов брома.
Фторид кислорода OF2
O IIF2 -I – светло-жёлтый газ, не растворяющийся в воде и не реагирующий с ней: 2NaOH(разб.) + 2F2 = 2NaF + OF2 + h3O.
OF2 – сильный окислитель: 2h3 + OF2 = 2HF + h3O
4Nh4 + 3OF2 = 2N2 + 6HF + 3h3O.
Оксид дихлора, Cl2O
Получение: 2Cl2 + 2HgO = ClHgOHgCl + Cl2O↑,
при 0 °C 2HClO = Cl2O↑ + h3O — в h3SO4.
Разложение: 4Cl2O = 2ClO2 + 3Cl2.
Реакция с водой: Cl2O + h3O = 2HClO.
Диоксид хлора, ClO2
Получение: а) KClO3 + h3SO4 = HClO3 + KHSO4 3HClO3 = 2ClO2↑ + HClO4 + h3O
б) 2KClO3 + h3C2O4 + h3SO4 = K2SO4 + 2CO2↑ + 2ClO2↑ + 2h3O
в) 2KClO3 + SO2 + h3SO4 = 2ClO2↑ + KHSO4.
Разложение: 2ClO2 = Cl2 + 2O2 – со взрывом.
Реакции с водой и щёлочью: 6ClO2 + 3h3O = 5HClO3 + HCl 2ClO2 + 2KOH = KClO2 + KClO3 + h3O.
Гексаоксид дихлора, Cl2O6
Получение: 2ClO2 + 2O3 = 2O2 + Cl2O6.
Разложение: Cl2O6 = 2ClO2 + O2.
Cl2O6 = 2ClO3 – при нагревании.
Реакция со щёлочью: Cl2O6 + 2KOH = KClO3 + KClO4 + h3O.
Гептаоксид дихлора, Cl2O7
Получение: 2HClO4 + P2O5 = Cl2O7 + 2HPO3.
Разложение: 2Cl2O7 = 2Cl2 + 7O2 – выше 120 °C со взрывом.
Реакция с водой: Cl2O7 + h3O = 2HClO4.
Пентаоксид дииода, I2O5
Получение: 2HIO3 = I2O5 + h3O – при 240 °C.
Разложение: 2I2O5 = 2I2 + 5O2 – при 300 °C.
Реакция с водой: I2O5 + h3O = 2HIO3.
Реакция для количественного определения CO: I2O5 + 5CO = I2 + 5CO2.
Кислородсодержащие кислоты галогенов
Большинство кислот неустойчивы в свободном состоянии и разлагаются. Известны следующие кислоты в свободном состоянии: HClO4, HIO3, H5IO6. Соли кислот стабильнее самих кислот. Кислоты и их соли являются сильными окислителями, особенно в кислой среде.
Известны следующие кислоты в свободном состоянии: HClO4, HIO3, H5IO6. Соли кислот стабильнее самих кислот. Кислоты и их соли являются сильными окислителями, особенно в кислой среде.
Хлорноватистая, бромноватистая, иодноватистая кислоты, HHlgO
Получение (хлорная, бромная, иодная вода): Hlg2 + h3O = HHlg + HHlgO. В щелочной среде равновесие смещено вправо.
При 20 °C: Cl2 + 2KOH = KClO + KCl + h3O – жавелевая вода,
Cl2 + Ca(OH)2 = h3O + CaCl(OCl) – хлорная (белильная) известь,
При нагревании: 3Cl2 + 6KOH = KClO3 + 5KCl + 3h3O,
При 20 °C: 3Br2 + 6KOH = KBrO3 + 5KBr + 3h3O 3I2 + 6KOH = KIO3 + 5KI + 3h3O.
Разложение.
В темноте: 3HClO = 2HCl + HClO3 HClO3 + 5HCl = 3Cl2 + 3h3O,
На свету: 2HClO = 2HCl + O2.
Гипохлориты
Сильные окислители в кислых средах: NaOCl + 2NaI + h3SO4 = NaCl + I2 + Na2SO4 + h3O.
CaOCl2 + HCl = CaCl2 + Cl2 + h3O,
CaOCl2 + CO2 + h3O = HClO + CaCl(HCO3),
HClO + CaCl(HCO3) = CaCO3 + Cl2 + h3O.
Разложение при нагревании (Co2+): 2CaOCl2 = 2CaCl2 + O2.
Хлористая кислота, HClO2
Получение: 2ClO2 + h3O2 + 2NaOH = 2NaClO2 + O2 + 2h3O,
NaClO2 + h3SO4 = HClO2 + NaHSO4.
Разложение: 4HClO2 = HCl + HClO3 + 2ClO2 + h3O.
Хлорноватая кислота, HClO3
Получение: 6Ba(OH)2 + 6Cl2 = 5BaCl2 + Ba(ClO3)2 + 6h3O.
Ba(ClO3)2 + h3SO4 = 2HClO3 + BaSO4↓.
Разложение: 3HClO3 = 2ClO2 + HClO4 + h3O.
Хлораты
Сильные окислители в кислой среде. KClO3 – хлорат калия, бертолетова соль 2KClO3 + 3S = 3SO2 + 2KCl.
5KClO3 + 6P = 3P2O5 + 5KCl.
KClO3 + Al = Al2O3 + KCl.
Разложение.
При 400 °C : 4KClO3 = 3KClO4 + KCl.
При 200-250 °C (MnO2): 2KClO3 = 2KCl + 3O2.
Бромноватая кислота, HBrO3. Иодноватая кислота, HIO3
Получение HBrO3 (См. HClO3): Br2 + 5Cl2 + 6h3O = 2HBrO3 + 10HCl.
Разложение: 4HBrO3 = 2Br2 + 5O2 + 2h3O.
Получение HIO3: 3I2 + 10HNO3 = 6HIO3 + 10NO + 2h3O.
Хлорная кислота, HClO4
Получение — электролиз растворов KClO3 или KCl: KClO3 + h3O = KClO4 + h3,
KCl + h3O = KClO4 + 4h3,
KClO4 + h3SO4 = HClO4 + KHSO4.
Разложение при нагревании: 4HClO4 = 4ClO2 + 3O2 + 2h3O.
Перхлораты
Перхлораты в растворах не проявляют окислительных свойств.
Разложение при нагревании : 4Nh5ClO4 = 2N2O + 2Cl2 + 8h3O + 3O2.
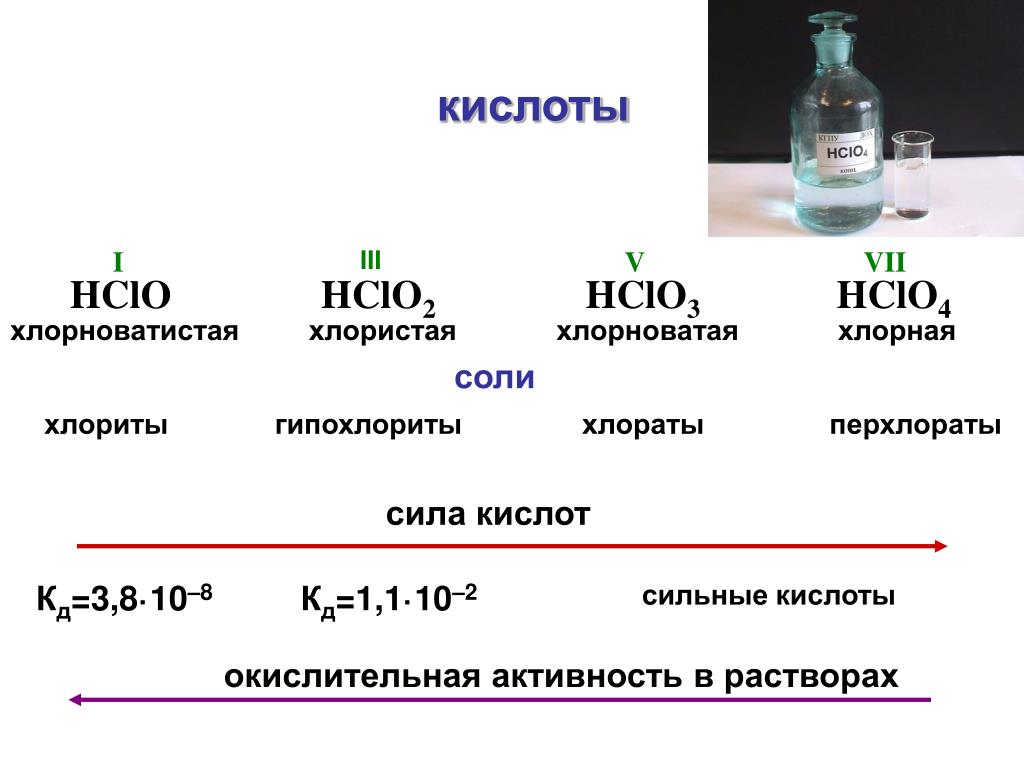
Сила кислот: Чем меньше отрицательный заряд на атомах кислорода аниона кислоты, тем сильнее кислота.
Является ли HClO3 сильной кислотой?
Home > Химия > Является ли HClO3 сильной кислотой?
Хлорная кислота является важной оксокислотой хлора, представленной химической формулой HClO 3 . Он выглядит как бесцветная жидкость при комнатной температуре. HClO 3 является сильным окислителем и вызывает коррозию тканей и металлов. Известно также, что он увеличивает горение горючих материалов.
HClO 3 является сильным окислителем и вызывает коррозию тканей и металлов. Известно также, что он увеличивает горение горючих материалов.
У многих студентов возникает вопрос относительно кислотной силы хлористоводородная кислота (HClO 3 ) молекула, т. е. сильная или слабая?
В этой статье мы ответим на этот вопрос и обсудим кислотную силу молекулы HClO 3 .
Итак, является ли HClO 3 сильной кислотой или слабой?
Хлорная кислота (HClO 3 ) является сильной кислотой. Полностью диссоциирует на H + и ClO 3 – ионов при растворении в водном растворе.
Сопряженное основание (ClO 3 – ) хлорной кислоты обладает высокой стабильностью благодаря сильной делокализации отрицательного заряда. Высокая степень окисления (+5) центрального атома Cl в молекуле хлористоводородной кислоты (HClO 3 ) приводит к слабой связи O-H.
Следовательно, поскольку HClO 3 быстро удаляет протон (H + ), это сильная кислота со значением K a больше 1,
| Name of molecule | Chloric acid |
| Chemical formula | HClO 3 |
| Molar mass | 84.45 g mol −1 |
| Природный | Сильная кислота |
| Сопряженное основание | ClO 3 – 9 | >>1 |
Чтобы узнать, почему HClO 3 действует как кислота? Мы должны изучить теории кислот и оснований. Одна из них — кислотно-щелочная теория Аррениуса .
Одна из них — кислотно-щелочная теория Аррениуса .
Эта теория утверждает, что соединение является кислым, если оно образует ионы H + при растворении в водном растворе и образует ионы H 3 O + при соединении с водой.
HClO 3 диссоциирует в водном растворе с образованием H + и ClO 3 – .
Затем протон (H + ) соединяется с молекулой воды и образует H 3 O + .
Также по Аррениусу кислота – это соединение, повышающее концентрацию ионов водорода (H + ) в растворе.
В случае HClO 3 , он высвобождает ионы H + , увеличивая концентрацию ионов водорода в водном растворе.
Итак, HClO 3 соответствует всем условиям, необходимым для кислоты Аррениуса. Следовательно, HClO 3 является кислотой Аррениуса .
Теперь мы ищем другую важную кислотно-щелочную теорию, теорию Бренстеда-Лоури.
Эта теория утверждает, что соединение является кислотой, если оно отдает протон другим видам и образует сопряженное основание. короче Кислота Бренстеда-Лоури является донором протона (H + ) .
Давайте проверим, соответствует ли HClO 3 требованиям классификации как кислота Бренстеда-Лоури.
Рассмотрим реакцию HClO 3 при взаимодействии с NH 3 .
Здесь HClO 3 реагирует с NH 3 и отдает протон, образуя сопряженное основание ClO 3 – .
HClO 3 действует как кислота Бренстеда-Лоури, поскольку отдает протон и образует сопряженное основание.
Ион хлората (ClO 3 – ) является сопряженным основанием кислоты HClO 3 .
Является ли HClO 3 сильной или слабой кислотой? Кислота, которая легко выделяет ионы H + и полностью диссоциирует в растворе, называется сильной кислотой.![]() Некоторыми примерами сильных кислот являются HCl, HClO 4 , HI, H 2 9.0008 SO 4, и т.д.
Некоторыми примерами сильных кислот являются HCl, HClO 4 , HI, H 2 9.0008 SO 4, и т.д.
Свойства сильной кислоты:-
- Они являются сильными электролитами и обладают высокой проводимостью.
- Их значение pH составляет от 1 до 3.
- Они полностью диссоциируют и выделяют много ионов H + в растворе.
Напротив, кислота, которая не выделяет быстро ионы H + и лишь частично диссоциирует в растворе, называется слабой кислотой. Некоторыми примерами слабых кислот являются CH 3 COOH, H 3 PO 4 , HF и т. д.
Свойства слабых кислот:-
- Они являются слабыми электролитами и имеют меньшую проводимость, чем сильные кислоты.
- Их значение pH составляет от 3 до 7.
- Они проявляют частичную ионизацию с образованием H + в растворе.
Теперь Является ли HClO 3 сильной или слабой кислотой? HClO 3 — сильная кислота. Следующие факторы объяснят силу хлорной кислоты (HClO 3 ):
Следующие факторы объяснят силу хлорной кислоты (HClO 3 ):
- ионизация в водном растворе
- CISCEADS DISSOCAIATE водный раствор
Кислота, полностью диссоциирующая (100% ионизированная) в растворе, считается сильной.
HClO 3 является сильной кислотой, поскольку полностью ионизируется в водном растворе с образованием H + и ClO 3 – . Все части полностью отрываются и ионизируются в водном растворе.
Как и при растворении HClO 3 в водном растворе, с ним не остается связанных частей H + , что означает повышение концентрации иона водорода в растворе. Следовательно, мы можем сказать, что HClO 3 является сильной кислотой.
Константа диссоциации кислоты (K a )
Сила кислоты также может быть рассчитана с помощью другого фактора, известного как константа диссоциации кислоты (K и ).

Константа диссоциации кислоты (Ka) является количественной мерой силы кислоты в растворе.
Кислоты с постоянным значением диссоциации больше 1 считаются сильными кислотами.
Хлористая кислота (HClO 3 ) также имеет большое значение константы кислотной диссоциации (K a ) ( K a = >> 1).
Высокое значение K a указывает на то, что хлористая кислота (HClO 3 ) является сильной.
Прочность связи ОН
Сила связи ОН также может определять силу оксокислот .
Прочность связей O-H напрямую связана со степенью окисления центрального атома в оксокислотах. Чем выше степень окисления центрального атома, тем слабее связь ОН.
В результате кислота с более слабой связью O-H будет сильнее, так как ионы H + будут легко высвобождаться.
В HClO 3 центральный атом (Cl) окружен тремя атомами O и имеет степень окисления +5.
 Следовательно, он может высвобождать ионы H + из-за более слабой связи O-H. Следовательно, HClO 3 является сильной кислотой.
Следовательно, он может высвобождать ионы H + из-за более слабой связи O-H. Следовательно, HClO 3 является сильной кислотой. Стабильность сопряженного основания
Кислотная сила кислоты напрямую связана с силой сопряженного основания. Чем выше стабильность сопряженного основания, тем сильнее будет кислотная сила соединения.
Из-за сильной делокализации отрицательного заряда сопряженное основание хлористоводородной кислоты, то есть ClO 3 – , высоко стабилизировано.
В результате хлористая кислота (HClO 3 ) является сильной кислотой.
Свойства хлорной кислоты (HClO 3 )- Хлорная кислота является сильной кислотой.
- Молярная масса хлорной кислоты 84,45 г/моль.
- Это сильный окислитель.
- Чрезвычайно разъедает ткани и металлы.
- Представляет собой бесцветный раствор при комнатной температуре.

Также проверьте –
- Как определить сильные или слабые кислоты или основания?
- Как определить, является ли вещество кислотой или основанием?
- Является ли HClO 4 кислотой или основанием? – Сильный или слабый
- Является ли HNO 2 кислотой или основанием? – Сильный или слабый
- Является ли HNO 3 кислотой или основанием? – Сильный или слабый
Хлорная кислота (HClO 3 ) сильная или слабая? Хлорная кислота (HClO 3 ) является сильной кислотой. Что более кислое, HClO 3 или HClO 4 ? Силу кислоты можно сравнить по относительной легкости, с которой она высвобождает протон (H + ion), что, в свою очередь, зависит от прочности связей O-H в оксокислотах, таких как HClO 4 и HClO 3 .

Чем выше степень окисления центрального атома, тем слабее связь O-H.
Степень окисления хлора в HClO 4 и HClO 3 равна +7 и +5 соответственно.
В результате из-за более слабой связи O-H в хлорной кислоте (HClO 4 ) она легче высвобождает ионы H+.
Следовательно, HClO 4 сильнее, чем HClO 3 .
РезюмеЧто более кислое, HClO 3 или HClO 2 ? Чем выше степень окисления центрального атома в оксокислотах, тем выше кислотная сила.
Причина в том, что склонность кислоты к высвобождению звена H + увеличивается с увеличением степени окисления из-за результирующего снижения прочности связей O-H.
Степень окисления хлора в HClO 3 и HClO 2 составляет +5 и +3 соответственно.
В результате из-за более слабой связи O-H в хлористоводородной кислоте (HClO 3 ) она легче высвобождает ионы H+.

Следовательно, HClO 3 сильнее, чем HClO 2 .
- HClO 3 является кислотой. Он высвобождает ионы H + при растворении в растворе, увеличивая концентрацию ионов водорода в растворе.
- Сопряженное основание HClO 3 представляет собой ион хлората (ClO 3 – ). Он образуется после удаления одного протона из хлорной кислоты (HClO 3 ).
- Хлорная кислота является сильной кислотой. В водном растворе полностью диссоциирует на ионы H + и ClO 3 – .
- Сопряженное основание (ClO 3 – ) хлористоводородной кислоты очень стабильно из-за сильной делокализации отрицательного заряда.
- Высокая степень окисления (+5) центрального атома Cl в молекуле хлористоводородной кислоты (HClO 3 ) приводит к слабой связи O-H.

- В заключение, поскольку HClO 3 быстро удаляет протон (H + ), это сильная кислота с высоким значением K a , приблизительно равным 10 3 .
«Хлорная кислота» Википедия, Бесплатная энциклопедия. Фонд Викимедиа, Инк. [Онлайн]. Доступно: https://en.wikipedia.org/wiki/Chloric_acid.
«Таблица кислот с Ka и pKa» (PDF). Калифорнийский университет Санта-Барбары. [В сети]. Доступно: https://clas.sa.ucsb.edu/staff/Resource%20Folder/Chem109ABC/Acid,%20Base%20Strength/Table%20of%20Acids%20w%20Kas%20and%20pKas.pdf.
Наблюдение HClO3 и HClO4 в арктической атмосфере
- Там, Йи Джун
- Сарнела, Нина ;
- Куэвас, Карлос А. ;
- Сиддхарт, Айер ;
- Бек, Лиза ;
- Саис-Лопес, Альфонсо ;
- Сипиля, Микко
Аннотация
Известно, что химия атмосферных галогенов, такая как каталитическая реакция радикалов брома и хлора с озоном (O3), вызывает весеннее разрушение поверхностного озона в полярных регионах.


- Публикация:
Тезисы конференции Генеральной Ассамблеи EGU
- Дата публикации:
- Май 2020
- DOI:
- 10.



 Следовательно, он может высвобождать ионы H + из-за более слабой связи O-H. Следовательно, HClO 3 является сильной кислотой.
Следовательно, он может высвобождать ионы H + из-за более слабой связи O-H. Следовательно, HClO 3 является сильной кислотой. 





Leave A Comment