§16. Эндоплазматическая сеть. Рибосомы. Комплекс Гольджи. Биология 9 класс Пасечник
1. Какие функции выполняют белки в клетке?
Белки выполняют несколько основных ролей в нашем организме:
• являются материалом для построения всех клеток, тканей и органов;
• обеспечивают иммунитет организма и выступают в качества антител;
• участвуют в пищеварительном процессе и энергетическом обмене и др.
2. Какое строение имеют молекулы белков?
Белки — это природные органические вещества, состоящие из аминокислот.
Вопросы
1. Чем образованы стенки эндоплазматической сети и комплекса Гольджи?
Стенки эндоплазматической сети и комплекса Гольджи образованы мембраной, сходной с той, что составляет наружную оболочку клетки.
2. Назовите функции эндоплазматической сети.
Основная функция шероховатой ЭПС — синтез белков в рибосомах.
Гладкая ЭПС выполняет в основном транспортную функцию.
3. Какую функцию выполняют рибосомы?
На рибосомах происходит синтез белков.
4. Почему большинство рибосом расположены на каналах эндоплазматической сети?
Белки, синтезируемые рибо¬сомами, расположенными на каналах эн-доплазматической сети, сразу же транс¬портируются к тому месту, где они необ¬ходимы.
5. Почему аппарат Гольджи чаще расположен вблизи от ядра клетки?
Основная функция аппарата Гольджи — накапливание веществ, которые синтези¬рует клетка. Эти вещества важны для основных процессов жизнедеятельности клетки, особенно при ее делении. В резуль¬тате этого процесса образуются дочерние клетки, которым нужен запас органиче¬ских веществ, играющих роль строитель¬ного материала и энергетических ресурсов.
6. Где формируется лизосома?
Где формируется лизосома?
Лизосомы формируются в комплексе Гольджи.
Задания
1. Проанализируйте текст параграфа и рисунки 26-29, установите, какова связь между эндоплазматической сетью, рибосомами, комплексом Гольджи и лизосомами.
В цитоплазме рибосомы чаще всего расположены на шероховатой эндоплазматической сети. Часть белков, синтезируемых рибо¬сомами, расположенными здесь, по каналам ЭПС поступает в комплекс Гольджи для хранения. Лизосомы формируются в комплексе Гольджи.
2. Вспомните, какое строение имеют эритроциты и какую функцию они выполняют. Придумайте и выдвиньте предположения, объясняющие, почему в эритроцитах аппарат Гольджи отсутствует. Обсудите этот вопрос в классе.
Эритроциты представляют собой специ¬ализированные клетки крови, выполняю¬щие газотранспортную функцию. Зрелые эритроциты имеют постоянную форму, не имеют ядра, не растут и не делятся.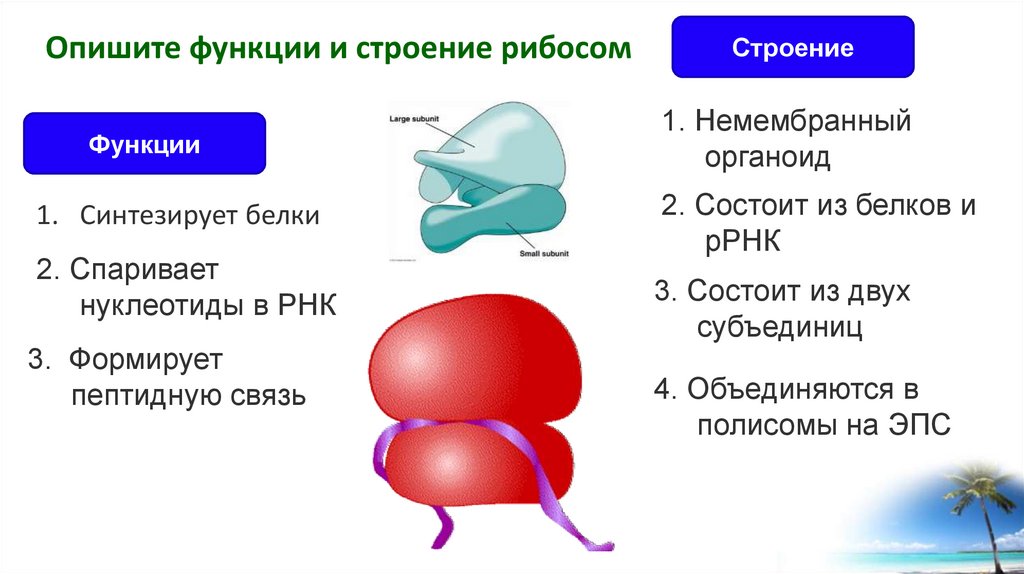
Строение клетки. Комплекс Гольджи. Эндоплазматическая сеть. Лизосомы. Клеточные включения 10 класс онлайн-подготовка на
Тема: Основы цитологии
Урок: Строение клетки. Эндоплазматическая сеть. Комплекс Гольджи.
Лизосомы. Клеточные включения
Классификация органоидов. Эндоплазматическая сеть
Мы продолжаем изучать органоиды клетки.
Все органоиды делятся на мембранные и немембранные.
Немембранные органоиды мы рассмотрели на предыдущем занятии, напомним, что к ним относятся рибосомы, клеточный центр и органоиды движения.
Среди мембранных органоидов различают одномембранные и двумембранные.
В этой части курса мы рассмотрим одномембранные органоиды: эндоплазматическую сеть, аппарат Гольджи и лизосомы.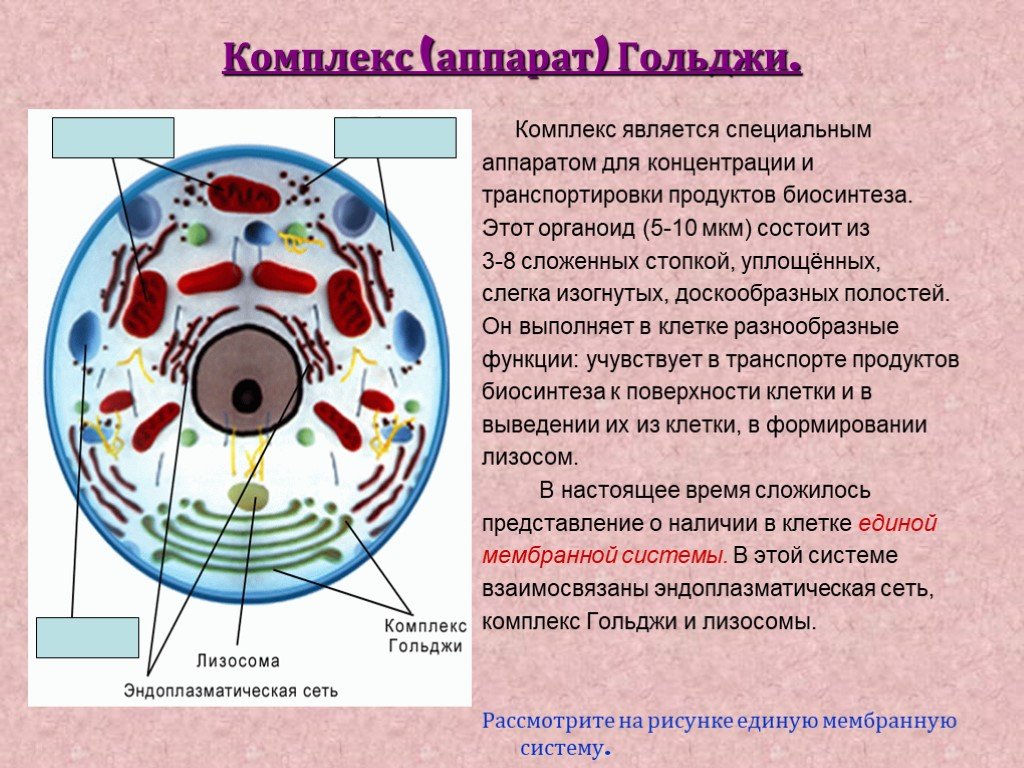
Кроме этого, мы рассмотрим включения – непостоянные образования клетки, которые возникают и исчезают в процессе жизнедеятельности клетки.
Эндоплазматическая сеть
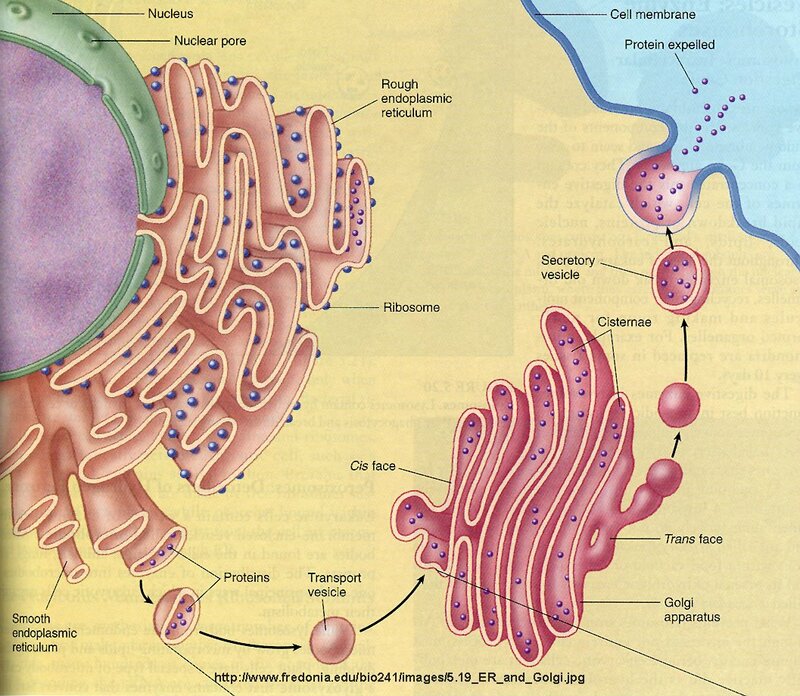
Одним из самых важных открытий, сделанных с помощью электронного микроскопа, было обнаружение сложной системы мембран, пронизывающей цитоплазму всех эукариотических клеток. Эта сеть мембран в дальнейшем получила название ЭПС (эндоплазматической сети) (рис. 1) или ЭПР (эндоплазматического ретикулума). ЭПС представляет систему трубочек и полостей, пронизывающей цитоплазму клетки.
Рис. 1. Эндоплазматическая сеть
Слева – среди других органоидов клетки. Справа – отдельно выделенная
Мембраны ЭПС (рис. 2) имеют такое же строение, как и клеточная или плазматическая мембрана (плазмалемма). ЭПС занимает до 50% объема клетки. Она нигде не обрывается и не открывается в цитоплазму.
Различают гладкую ЭПС и шероховатую, или гранулярную ЭПС (рис.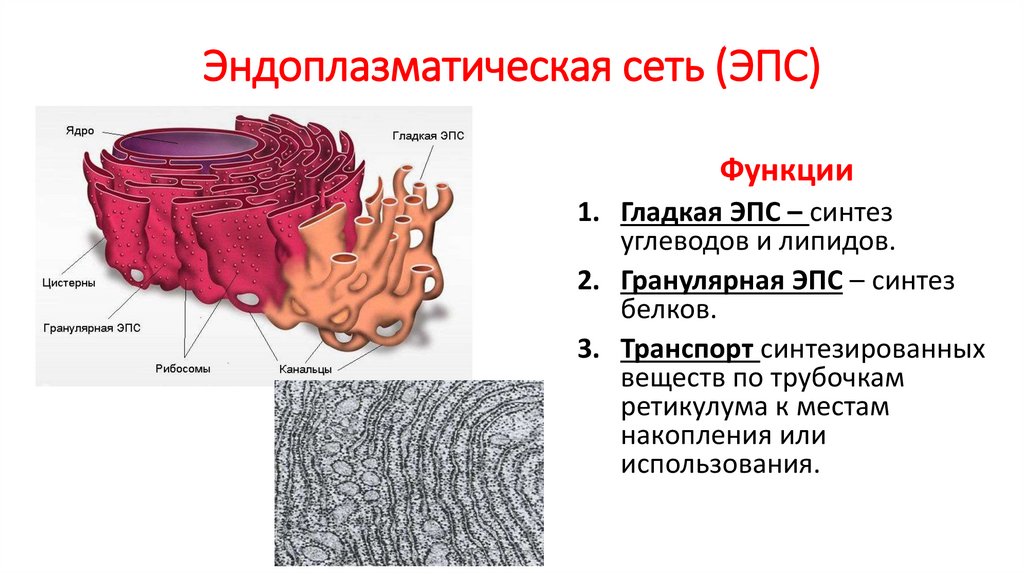 2). На внутренних мембранах шероховатой ЭПС располагаются рибосомы – здесь идет синтез белков.
2). На внутренних мембранах шероховатой ЭПС располагаются рибосомы – здесь идет синтез белков.
Рис. 2. Виды ЭПС
Шероховатая ЭПС (слева) несет на мембранах рибосомы и отвечает за синтез белка в клетке. Гладкая ЭПС (справа) не содержит рибосом и отвечает за синтез углеводов и липидов.
На поверхности гладкой ЭПС (рис. 2) идет синтез углеводов и липидов. Вещества, синтезированные на мембранах ЭПС, переносятся в трубочки и затем транспортируются к местам назначения, где депонируются или используются в биохимических процессах.
Шероховатая ЭПС лучше развита в клетках, которые синтезируют белки для нужд организма, например, белковые гормоны эндокринной системы человека. А гладкая ЭПС – в тех клетках, которые синтезируют сахара и липиды.
В гладкой ЭПС накапливаются ионы кальция (важные для регуляции всей функций клеток и целого организма).
Комплекс (аппарат) Гольджи
Структуру, известную сегодня как комплекс или аппарат Гольджи (АГ) (рис. 3), впервые обнаружил в 1898 году итальянский ученый Камилло Гольджи (Источник).
3), впервые обнаружил в 1898 году итальянский ученый Камилло Гольджи (Источник).
Подробно изучить строение комплекса Гольджи удалось значительно позже с помощью электронного микроскопа. Эта структура содержится практически во всех эукариотических клетках, и представляет собой стопку уплощенных мембранных мешочков, т. н. цистерн, и связанную с ними систему пузырьков, называемых пузырьками Гольджи.
Рис. 3. Комплекс Гольджи
Слева – в клетке, среди других органоидов.
Справа – комплекс Гольджи с отделяющимися от него мембранными пузырьками
Во внутриклеточных цистернах накапливаются вещества, синтезированные клеткой, т. е. белки, углеводы, липиды.
В этих же цистернах вещества, поступившие из ЭПС, претерпевают дальнейшие биохимические превращения, упаковываются в мембранные пузырьки и доставляются к тем местам клетки, где они необходимы. Они участвуют в достройке клеточной мембраны или выделяются наружу (секретируются) из клетки.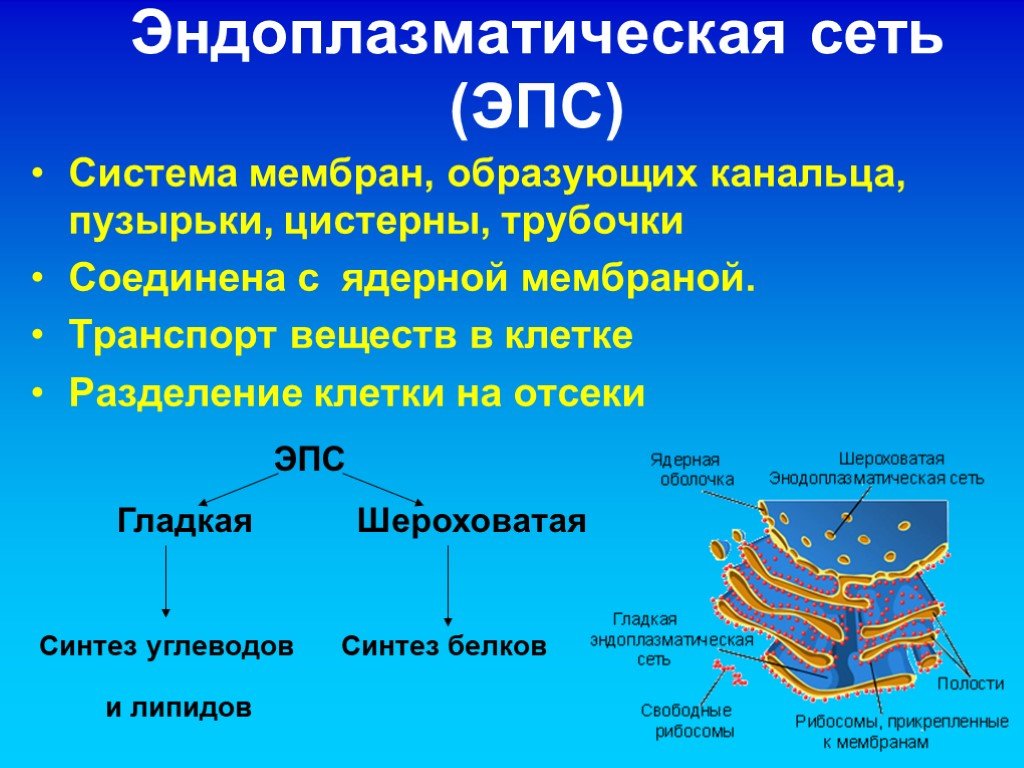
Комплекс Гольджи построен из мембран и расположен рядом с ЭПС, но не сообщается с её каналами.
Все вещества, синтезированные на мембранах ЭПС (рис. 2), переносятся в комплекс Гольджи в мембранных пузырьках, которые отпочковываются от ЭПС и сливаются затем с комплексом Гольджи, где они претерпевают дальнейшие изменения.
Одна из функций комплекса Гольджи – сборка мембран. Вещества, из которых состоят мембраны – белки и липиды, как вы уже знаете, – поступают в комплекс Гольджи из ЭПС.
В полостях комплекса собираются участки мембран, из которых образуются особые мембранные пузырьки (рис. 4), они передвигаются по цитоплазме в те места, где необходима достройка мембраны.
Рис. 4. Синтез мембран в клетке комплексом Гольджи (см. видео)
В комплексе Гольджи синтезируются практически все полисахариды, необходимые для построения клеточной стенки клеток растений и грибов. Здесь они упаковываются в мембранные пузырьки, доставляются к клеточной стенке и сливаются с ней.
Таким образом, основные функция комплекса (аппарата) Гольджи – химическое превращение синтезированных в ЭПС веществ, синтез полисахаридов, упаковка и транспорт органических веществ в клетке, формирование лизосомы.
Лизосомы
Лизосомы (рис. 5) обнаружены у большинства эукариотических организмов, но особенно много их в клетках, которые способны к фагоцитозу. Они представляют собой одномембранные мешочки, наполненные гидролитическими или пищеварительными ферментами, такими как липазы, протеазы и нуклеазы, т. е. ферменты, которые расщепляют жиры, белки и нуклеиновые кислоты.
Рис. 5. Лизосома – мембранный пузырек, содержащий гидролитические ферменты
Содержимое лизосом имеет кислую реакцию – для их ферментов характерен низкий оптимум pH. Мембраны лизосомы изолируют гидролитические ферменты, не давая им разрушать другие компоненты клетки. В клетках животных лизосомы имеют округлую форму, их диаметр – от 0,2 до 0,4 микрон.
В растительных клетках функцию лизосом выполняют крупные вакуоли. В некоторых растительных клетках, особенно погибающих, можно заметить небольшие тельца, напоминающие лизосомы.
Клеточные включения
Скопление веществ, которые клетка депонирует, использует для своих нужд, или хранит для выделения вовне, называют клеточными включениями.
Среди них зерна крахмала (запасной углевод растительного происхождения) или гликогена (запасной углевод животного происхождения), капли жира, а также гранулы белков.
Эти запасные питательные вещества располагаются в цитоплазме свободно и не отделены от неё мембраной.
Функции ЭПС
Одна из самых важных функций ЭПС – синтез липидов. Поэтому ЭПС обычно представлена в тех клетках, где интенсивно происходит этот процесс.
Как происходит синтез липидов? В клетках животных липиды синтезируются из жирных кислот и глицерина, которые поступают с пищей (в клетках растений они синтезируются из глюкозы).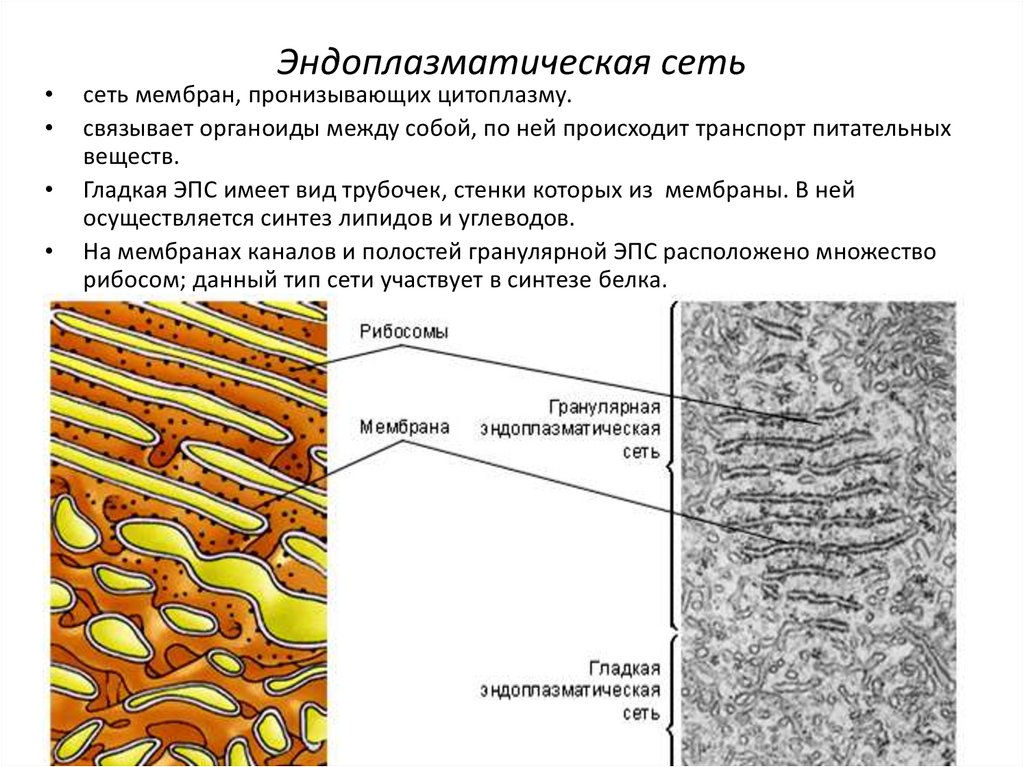 Синтезированные в ЭПС липиды передаются в комплекс Гольджи, где «дозревают».
Синтезированные в ЭПС липиды передаются в комплекс Гольджи, где «дозревают».
ЭПС представлена в клетках коры надпочечников и в половых железах, поскольку здесь синтезируются стероиды, а стероиды – гормоны липидной природы. К стероидам относится мужской гормон тестостерон, и женский гормон эстрадиол.
Ещё одна функция ЭПС – участие в процессах детоксикации. В клетках печени шероховатая и гладкая ЭПС участвуют в процессах обезвреживания вредных веществ, поступающих в организм. ЭПС удаляет яды из нашего организма.
В мышечных клетках присутствуют особые формы ЭПС – саркоплазматический ретикулум. Саркоплазматический ретикулум – один из видов эндоплазматической сети, который присутствует в поперечнополосатой мышечной ткани. Его основной функцией является хранение ионов кальция, и введение их в саркоплазму – среду миофибрилл.
Секреторная функция комплекса Гольджи
Функцией комплекса Гольджи является транспорт и химическая модификация веществ.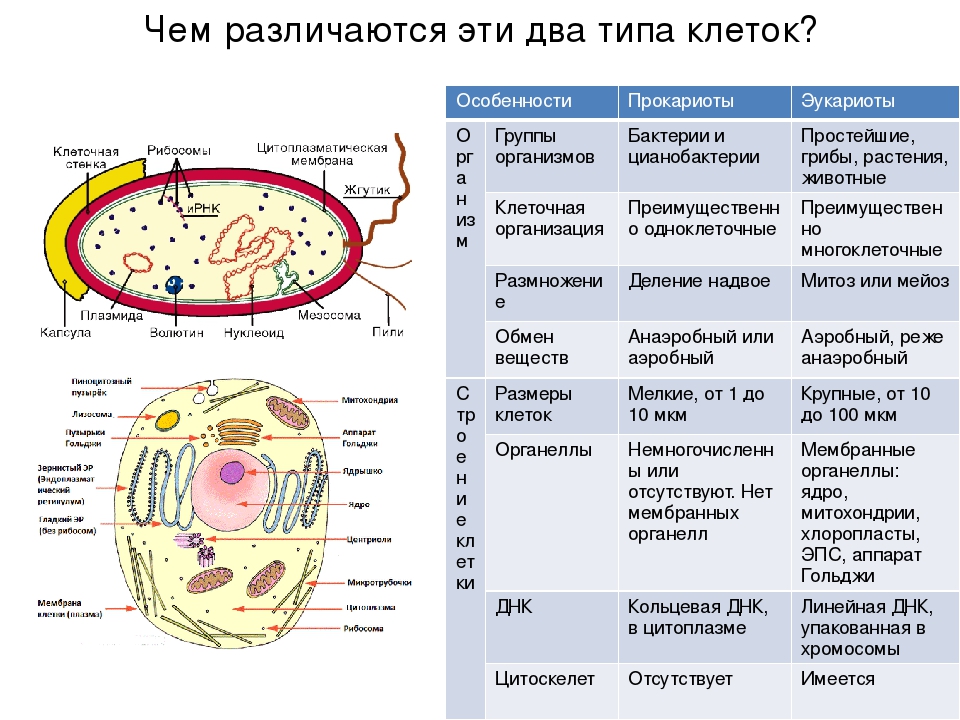 Особенно хорошо это видно в секреторных клетках.
Особенно хорошо это видно в секреторных клетках.
В качестве примера можно привести клетки поджелудочной железы, синтезирующие ферменты панкреатического сока, который затем выходит в проток железы, открывающийся в двенадцатиперстную железу.
Исходным субстратом для ферментов служат белки, поступающие в комплекс Гольджи из ЭПС. Здесь с ними происходят биохимические превращения, они концентрируются, упаковываются в мембранные пузырьки и перемещаются к плазматической мембране секреторной клетки. Затем они выделяются наружу посредством экзоцитоза.
Ферменты поджелудочной железы секретируются в неактивной форме, чтобы они не разрушали клетку, в которой образуются. Неактивная форма фермента называется проферментом или энзимогеном. Например, фермент трипсин, образуется в неактивной форме в виде трипсиногена в поджелудочной железе и переходит в свою активную форму – трипсин в кишечнике.
Комплексом Гольджи синтезируется также важный гликопротеин – муцин. Муцин синтезируется бокаловидными клетками эпителия, слизистой оболочки желудочно-кишечного тракта и дыхательных путей. Муцин служит барьером, защищающим расположенные под ним эпителиальные клетки от разных повреждений, в первую очередь, механических.
Муцин синтезируется бокаловидными клетками эпителия, слизистой оболочки желудочно-кишечного тракта и дыхательных путей. Муцин служит барьером, защищающим расположенные под ним эпителиальные клетки от разных повреждений, в первую очередь, механических.
В желудочно-кишечном тракте эта слизь защищает нежную поверхность эпителиальных клеток от действия грубого комка пищи. В дыхательных путях и желудочно-кишечном тракте муцин защищает наш организм от проникновения патогенов – бактерий и вирусов.
В клетках кончика корня растений комплекс Гольджи секретирует мукополисахаридную слизь, которая облегчает продвижение корня в почве.
В железах на листьях насекомоядных растений, росянки и жирянки (рис. 6), аппарат Гольджи производит клейкую слизь и ферменты, с помощью которых эти растения ловят и переваривают добычу.
Рис. 6. Клейкие листья насекомоядных растений. Росянка (слева) и Жирянка (справа)
В клетках растений комплекс Гольджи также участвует в образовании смол, камедей и восков.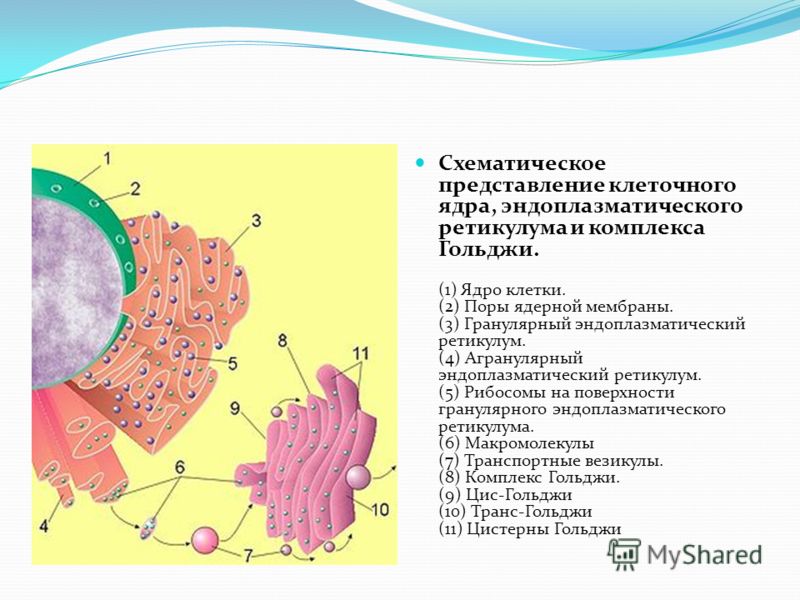
Автолиз
Автолиз – это саморазрушение клеток, возникающее вследствие высвобождения содержимого лизосом внутри клетки.
Благодаря этому лизосомы в шутку называют «орудиями самоубийства». Автолиз представляет собой нормальное явление онтогенеза, он может распространяться как на отдельные клетки, так и на всю ткань или орган, как это происходит при резорбции хвоста головастика во время метаморфоза, т. е. при превращении головастика в лягушку (рис. 7).
Рис. 7. Резорбция хвоста лягушки благодаря автолизу в ходе онтогенеза
Автолиз происходит в мышечной ткани, остающейся долго без работы.
Кроме этого, автолиз наблюдается у клеток после гибели, поэтому вы могли наблюдать, как продукты питания сами портятся, если они не были заморожены.
Таким образом, мы рассмотрели основные одномембранные органоиды клетки: ЭПС, комплекс Гольджи и лизосомы, выяснили их функции в процессах жизнедеятельности отдельной клетки и организма в целом. Установили связь между синтезом веществ в ЭПС, транспортом их в мембранных пузырьках в комплекс Гольджи, «дозреванием» веществ в комплексе Гольджи и выделением их из клетки при помощи мембранных пузырьков, в том числе лизосом. Также мы говорили о включениях – непостоянных структурах клетки, которые представляют собой скопления органических веществ (крахмала, гликогена, капель масла или гранул белка). Из приведенных в тексте примеров мы можем сделать вывод о том, что процессы жизнедеятельности, которые происходят на клеточном уровне, отражаются на функционировании целого организма (синтез гормонов, автолиз, накопление питательных веществ).
Установили связь между синтезом веществ в ЭПС, транспортом их в мембранных пузырьках в комплекс Гольджи, «дозреванием» веществ в комплексе Гольджи и выделением их из клетки при помощи мембранных пузырьков, в том числе лизосом. Также мы говорили о включениях – непостоянных структурах клетки, которые представляют собой скопления органических веществ (крахмала, гликогена, капель масла или гранул белка). Из приведенных в тексте примеров мы можем сделать вывод о том, что процессы жизнедеятельности, которые происходят на клеточном уровне, отражаются на функционировании целого организма (синтез гормонов, автолиз, накопление питательных веществ).
Домашнее задание
1. Что такое органоиды? Чем органоиды отличаются от клеточных включений?
2. Какие группы органоидов бывают в клетках животных и растений?
3. Какие органоиды относятся к одномембранным?
4. Какие функции выполняет ЭПС в клетках живых организмов? Какие виды ЭПС выделяют? С чем это связано?
5. Что такое комплекс (аппарат) Гольджи? Из чего он состоит? Каковы его функции в клетке?
Что такое комплекс (аппарат) Гольджи? Из чего он состоит? Каковы его функции в клетке?
6. Что такое лизосомы? Для чего они нужны? В каких клетках нашего организма они активно функционируют?
7. Как связаны друг с другом ЭПС, комплекс Гольджи и лизосомы?
8. Что такое автолиз? Когда и где он происходит?
9. Обсудите с друзьями явление автолиза. Каково его биологическое значение в онтогенезе?
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Сайт о химии (Источник).
2. YouTube (Источник).
3. Единая коллекция Цифровых Образовательных Ресурсов (Источник).
4. Единая коллекция Цифровых Образовательных Ресурсов (Источник).
5. Единая коллекция Цифровых Образовательных Ресурсов (Источник).
6. Земная флора (Источник).
7. YouTube (Источник).
8. Микроскопическая техника в биологии (Источник).
9. Здоровый Образ Жизни (Источник).
Список литературы
1. Каменский А. А., Криксунов Е. А., Пасечник В. В. Общая биология 10-11 класс Дрофа, 2005.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Общая биология 10-11 класс Дрофа, 2005.
2. Беляев Д. К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
3. Биология 11 класс. Общая биология. Профильный уровень / В. Б. Захаров, С. Г. Мамонтов, Н. И. Сонин и др. – 5-е изд., стереотип. – Дрофа, 2010. – 388 с.
4. Агафонова И. Б., Захарова Е. Т., Сивоглазов В. И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Рибосомозависимая АТФаза взаимодействует с консервативным мембранным белком в Escherichia coli для модуляции синтеза белка и окислительного фосфорилирования
1. Xu J, Kiel MC, Golshani A, Chosay JG, Aoki H, et al. Молекулярная локализация рибосомозависимой АТФазы на рибосомах Escherichia coli. Нуклеиновые Кислоты Res. 2006; 34: 1158–1165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Рамакришнан В. Структура рибосомы и механизм трансляции. Клетка. 2002; 108: 557–572. [PubMed] [Академия Google]
Клетка. 2002; 108: 557–572. [PubMed] [Академия Google]
3. Ganoza MC, Cunningham C, Green RM. Новый фактор из Escherichia coli влияет на транслокацию мРНК. Дж. Биол. Хим. 1995; 270:26377–26381. [PubMed] [Google Scholar]
4. Baba T, Ara T, Hasegawa M, Takai Y, Okumura Y, et al. Конструирование мутантов Escherichia coli K-12 с нокаутом одного гена в кадре: коллекция Keio. Мол Сист Биол. 2006;2:2006 0008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Devaraj A, Shoji S, Holbrook ED, Fredrick K. Роль сайта 30S-субъединицы E в поддержании трансляционной рамки считывания . РНК. 2009 г.;15:255–265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Ganoza MC, Kiel MC. Рибосомная АТФаза является мишенью для ингибирования гигромицином В на рибосомах Escherichia coli. Противомикробные агенты Chemother. 2001;45:2813–2819. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Jewett MC, Miller ML, Chen Y, Swartz JR. Непрерывный синтез белка при низком уровне [АТФ] и [ГТФ] обеспечивает клеточную адаптацию при ограничении энергии. J Бактериол. 2009; 191:1083–1091. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Бактериол. 2009; 191:1083–1091. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Батланд Г., Перегрин-Альварес Дж. М., Ли Дж., Ян В., Ян X и др. Сеть взаимодействия, содержащая консервативные и незаменимые белковые комплексы в Escherichia coli. Природа. 2005; 433: 531–537. [PubMed] [Google Scholar]
9. Диас-Мехиа Дж. Дж., Бабу М., Эмили А. Вычислительные и экспериментальные подходы к составлению диаграммы протеома и интерактома, ассоциированного с клеточной оболочкой Escherichia coli. Обзоры микробиологии FEMS. 2009; 33:66–97. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Kiel MC, Ganoza MC. Функциональные взаимодействия рибосомной АТФазы Escherichia coli. Евр Дж Биохим. 2001; 268: 278–286. [PubMed] [Академия Google]
11. Mamat U, Meredith TC, Aggarwal P, Kühl A, Kirchhoff P, et al. Единичные аминокислотные замены либо в YhjD, либо в MsbA придают жизнеспособность Escherichia coli, обедненной 3-дезокси-d-манно-окт-2-улозоновой кислотой. Мол микробиол.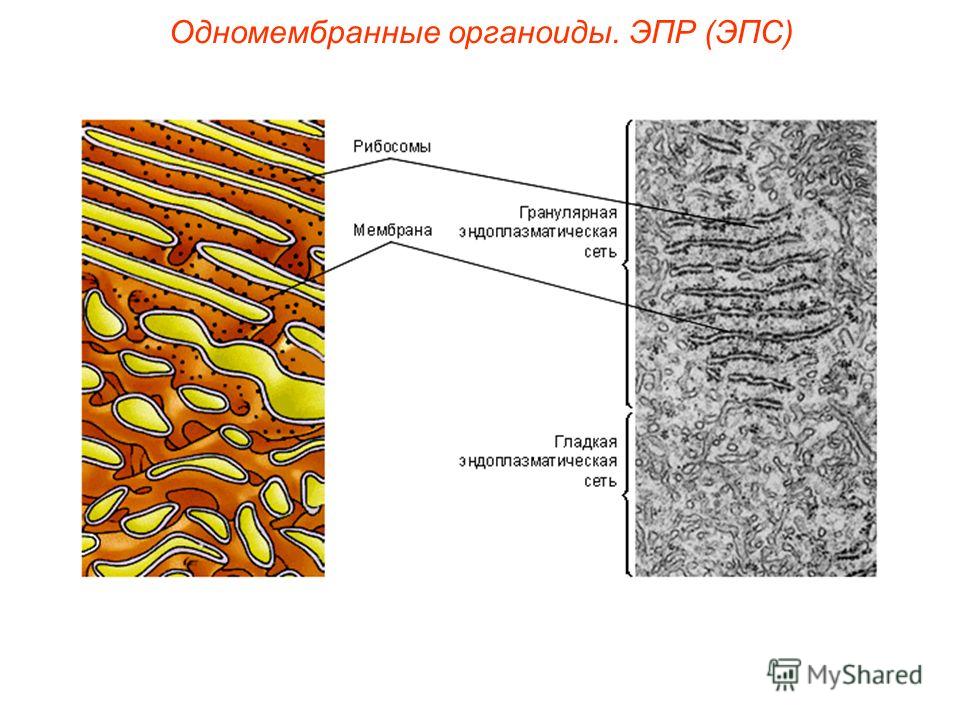 2008; 67: 633–648. [PubMed] [Google Scholar]
2008; 67: 633–648. [PubMed] [Google Scholar]
12. Tran AX, Trent MS, Whitfield C. Белок LptA Escherichia coli представляет собой периплазматический липид-A-связывающий белок, участвующий в пути экспорта липополисахарида. Дж. Биол. Хим. 2008; 283:20342–20349. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Hu P, Janga SC, Babu M, Diaz-Mejia JJ, Butland G, et al. Глобальный функциональный атлас Escherichia coli, включающий ранее не охарактеризованные белки. PLoS биол. 2009;7:e96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. де Бур П.А., Кроссли Р.Е., Хэнд А.Р., Ротфилд Л.И. Белок MinD представляет собой мембранную АТФазу, необходимую для правильного размещения сайта деления Escherichia coli. EMBO J. 1991; 10: 4371–4380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Rowland SL, Fu X, Sayed MA, Zhang Y, Cook WR, et al. Мембранное перераспределение белка MinD Escherichia coli, индуцированное MinE. J Бактериол. 2000; 182: 613–619.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Асато Ю. Контроль синтеза рибосом во время циклов клеточного деления E. coli и Synechococcus. Curr выпускает Mol Biol. 2005; 7: 109–117. [PubMed] [Google Scholar]
Асато Ю. Контроль синтеза рибосом во время циклов клеточного деления E. coli и Synechococcus. Curr выпускает Mol Biol. 2005; 7: 109–117. [PubMed] [Google Scholar]
17. Jaffe A, Vinella D, D’Ari R. Гистоноподобный белок Escherichia coli HU влияет на инициацию ДНК, разделение хромосом через MukB и деление клеток через MinCDE. J Бактериол. 1997; 179:3494–3499. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Hartwell LH, Hopfield JJ, Leibler S, Murray AW. От молекулярной к модульной клеточной биологии. Природа. 1999;402:С47–52. [PubMed] [Google Scholar]
19. Butland G, Babu M, Diaz-Mejia JJ, Bohdana F, Phanse S, et al. eSGA: анализ синтетического генетического массива E. coli. Нат Методы. 2008; 5: 789–795. [PubMed] [Google Scholar]
20. Диксон С.Дж., Костанцо М., Барышникова А., Эндрюс Б., Бун С. Систематическое картирование сетей генетического взаимодействия. Анну Рев Жене. 2009; 43: 601–625. [PubMed] [Google Scholar]
21. Johnson JE, Lackner LL, de Boer PA. Нацеливание комплексов (D)MinC/MinD и (D)MinC/DicB на септальные кольца в Escherichia coli указывает на многоступенчатый механизм опосредованного MinC разрушения зарождающихся колец FtsZ. J Бактериол. 2002;184:2951–2962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нацеливание комплексов (D)MinC/MinD и (D)MinC/DicB на септальные кольца в Escherichia coli указывает на многоступенчатый механизм опосредованного MinC разрушения зарождающихся колец FtsZ. J Бактериол. 2002;184:2951–2962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Laub MT, Goulian M. Специфичность двухкомпонентных путей передачи сигнала. Анну Рев Жене. 2007; 41: 121–145. [PubMed] [Google Scholar]
23. Анохина М.М., Барта А., Ниерхаус К.Х., Спиридонова В.А., Копылов А.М. Картирование второго сайта связывания тетрациклина на малой субъединице рибосом E.coli. Нуклеиновые Кислоты Res. 2004; 32: 2594–2597. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Hirokawa G, Iwakura N, Kaji A, Kaji H. Роль GTP во временном расщеплении 70S рибосом с помощью RRF (фактор рециркуляции рибосом) и EF-G ( коэффициент удлинения G). Нуклеиновые Кислоты Res. 2008; 36: 6676–6687. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Савелсберг А., Роднина М.В., Винтермейер В.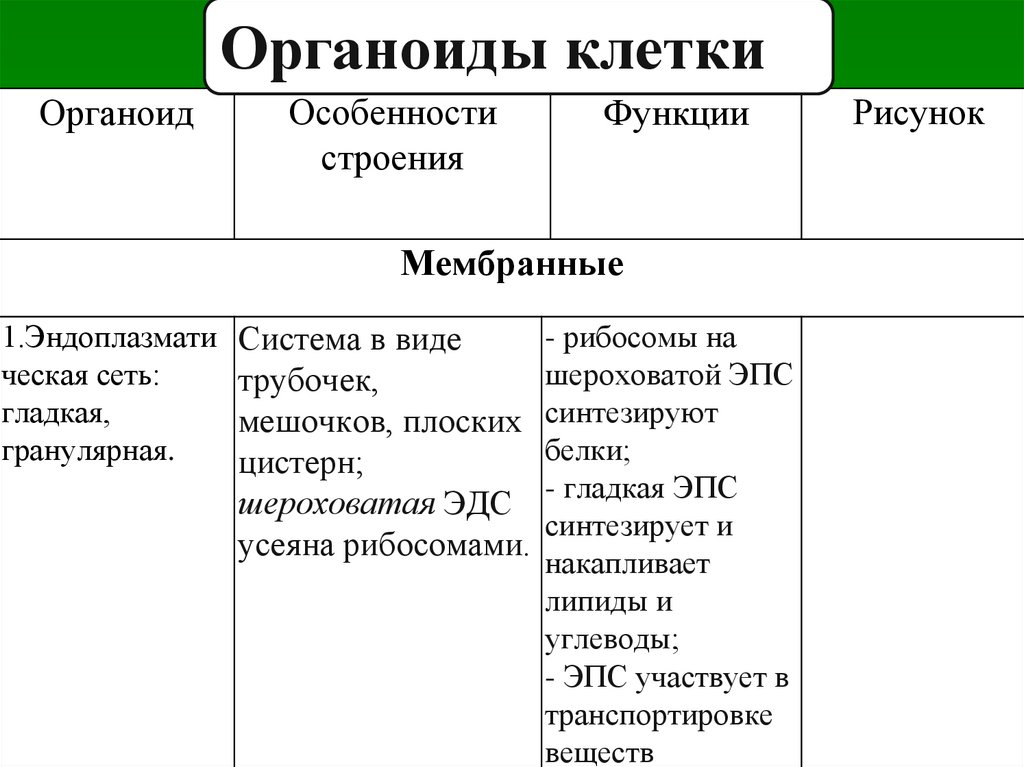 Различные функции фактора элонгации G при рециклинге и транслокации рибосом. рна. 2009; 15: 772–780. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Различные функции фактора элонгации G при рециклинге и транслокации рибосом. рна. 2009; 15: 772–780. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Grentzmann G, Kelly PJ, Laalami S, Shuda M, Firpo MA, et al. Фактор высвобождения RF-3 ГТФазная активность действует при разборке комплекса терминации рибосомы. рна. 1998; 4: 973–983. [Статья бесплатно PMC] [PubMed] [Google Scholar]
27. Southworth DR, Brunelle JL, Green R. EFG-независимая транслокация комплекса мРНК:тРНК стимулируется модификацией рибосомы тиол-специфичными реагентами. Дж Мол Биол. 2002; 324: 611–623. [PubMed] [Академия Google]
28. Carter AP, Clemons WM, Brodersen DE, Morgan-Warren RJ, Wimberly BT, et al. Функциональные выводы из структуры 30S рибосомной субъединицы и ее взаимодействия с антибиотиками. Природа. 2000;407:340–348. [PubMed] [Google Scholar]
29. Shoji S, Walker SE, Fredrick K. Рибосомальная транслокация: на шаг ближе к молекулярному механизму. ACS Chem Biol. 2009; 4: 93–107.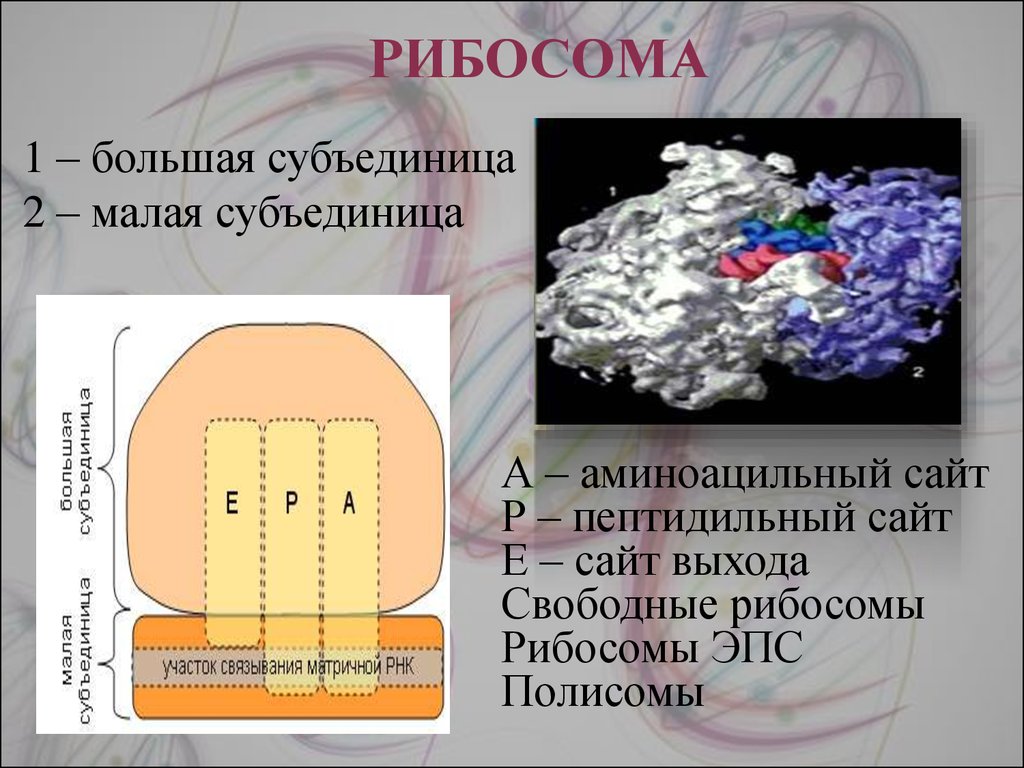 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Cox GB, Newton NA, Gibson F, Snoswell AM, Hamilton JA. Функция убихинона в кишечной палочке. Биохим Дж. 1970;117:551–562. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Friedrich T, van Heek P, Leif H, Ohnishi T, Forche E, et al. Два сайта связывания ингибиторов НАДН: убихиноноксидоредуктаза (комплекс I). Связь одного сайта с убихинон-связывающим сайтом бактериальной глюкозы: убихиноноксидоредуктаза. Евр Дж Биохим. 1994; 219: 691–698. [PubMed] [Google Scholar]
32. Stolpe S, Friedrich T. NADH: убихиноноксидоредуктаза Escherichia coli (комплекс I) является первичным протонным насосом, но может быть способна к вторичному антипорту натрия. Дж. Биол. Хим. 2004;279: 18377–18383. [PubMed] [Google Scholar]
33. Krulwich TA, Quirk PG, Guffanti AA. Разобщающие устойчивые мутанты бактерий. Microbiol Rev. 1990; 54:52–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Strahl H, Hamoen LW. Мембранный потенциал важен для деления бактериальных клеток. Proc Natl Acad Sci U S A. 2010;107:12281–12286. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мембранный потенциал важен для деления бактериальных клеток. Proc Natl Acad Sci U S A. 2010;107:12281–12286. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Резник М., Шульдинер С., Берковье Х. Анализ потенциала бактериальной мембраны с помощью спектрофлюороцитометрии. Карр микробиол. 1985;12:183–186. [Google Scholar]
36. van Dalen A, Schrempf H, Killian JA, de Kruijff B. Для эффективной сборки мембраны калиевого канала KcsA в Escherichia coli требуется протондвижущая сила. EMBO Rep. 2000; 1: 340–346. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Ganoza MC, Kiel MC, Aoki H. Эволюционное сохранение реакций при переводе. Microbiol Mol Biol Rev. 2002;66:460–485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Thomsen ND, Berger JM. Структурные основы для рассмотрения микробных белок- и нуклеиновых кислот-зависимых моторных АТФаз. Мол микробиол. 2008;69: 1071–1090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Andersen CB, Becker T, Blau M, Anand M, Halic M, et al. Структура eEF3 и механизм высвобождения транспортной РНК из E-сайта. Природа. 2006; 443: 663–668. [PubMed] [Google Scholar]
Структура eEF3 и механизм высвобождения транспортной РНК из E-сайта. Природа. 2006; 443: 663–668. [PubMed] [Google Scholar]
40. Zhang YM, Rock CO. Мембранный липидный гомеостаз у бактерий. Nat Rev Microbiol. 2008; 6: 222–233. [PubMed] [Google Scholar]
41. Митчелл П. Связь фосфорилирования с транспортом электронов и переносом водорода по хемиосмотическому механизму. Природа. 1961;191:144–148. [PubMed] [Google Scholar]
42. Crooke E, Castuma CE, Kornberg A. Хромосомное происхождение Escherichia coli стабилизирует белок DnaA во время омоложения фосфолипидами. Дж. Биол. Хим. 1992; 267:16779–16782. [PubMed] [Google Scholar]
43. Norris V, Woldringh C, Mileykovskaya E. Гипотеза, объясняющая выбор места деления у Escherichia coli путем сочетания нуклеоидной окклюзии и Min. ФЭБС лат. 2004; 561:3–10. [PubMed] [Google Scholar]
44. Hu Z, Lutkenhaus J. Топологическая регуляция клеточного деления в E. coli. пространственно-временные колебания MinD требуют стимуляции его АТФазы MinE и фосфолипидом. Мол Ячейка. 2001; 7: 1337–1343. [PubMed] [Академия Google]
Мол Ячейка. 2001; 7: 1337–1343. [PubMed] [Академия Google]
45. Маркуссен М., Ларсен П.Дж. Зависимая от клеточного цикла регуляция концентрации клеточного АТФ и деполимеризация интерфазной сети микротрубочек, вызванная повышенной концентрацией клеточного АТФ в цельных фибробластах. Клеточный подвижный цитоскелет. 1996; 35: 94–99. [PubMed] [Google Scholar]
46. Джонс Н.К., Доначи В.Д. Хромосомная репликация, транскрипция и контроль клеточного деления у Escherichia coli. Нэт Нью Биол. 1973; 243: 100–103. [PubMed] [Google Scholar]
47. Лам В.К., Акопян Д., Рим М., Хеннингсен Д., Шан С.О. Липидная активация рецептора частицы распознавания сигнала обеспечивает пространственную координацию нацеливания на белок. Джей Селл Биол. 2010;190: 623–635. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Мюллер М., Кох Х.Г., Бек К., Шафер У. Транспорт белков в бактериях: несколько путей от рибосомы к мембране и через нее. Prog Nucleic Acid Res Mol Biol. 2001; 66: 107–157. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
49. Mauro VP, Edelman GM. Гипотеза рибосомного фильтра. Proc Natl Acad Sci U S A. 2002; 99:12031–12036. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Baba T, Ara T, Hasegawa M, Takai Y, Okumura Y, et al. Конструирование мутантов Escherichia coli K-12 с нокаутом одного гена в кадре: коллекция Keio. Мол Сист Биол. 2006;2:2006.0008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Babu M, Butland G, Pogoutse O, Li J, Greenblatt JF, et al. Система последовательной пептидной аффинной очистки для систематического выделения и идентификации белковых комплексов из Escherichia coli. Методы Мол Биол. 2009; 564: 373–400. [PubMed] [Google Scholar]
52. Kitagawa M, Ara T, Arifuzzaman M, Ioka-Nakamichi T, Inamoto E, et al. Полный набор клонов ORF библиотеки Escherichia coli ASKA (полный набор архива ORF E. coli K-12): уникальные ресурсы для биологических исследований. Рез. ДНК 2005;12:291–299. [PubMed] [Google Scholar]
53. Jiang M, Sullivan SM, Walker AK, Strahler JR, Andrews PC, et al. Идентификация новых белков, связанных с рибосомами Escherichia coli, с использованием изобарических меток и методов многомерной идентификации белков. J Бактериол. 2007; 189:3434–3444. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Jiang M, Sullivan SM, Walker AK, Strahler JR, Andrews PC, et al. Идентификация новых белков, связанных с рибосомами Escherichia coli, с использованием изобарических меток и методов многомерной идентификации белков. J Бактериол. 2007; 189:3434–3444. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Томпсон Дж., О’Коннор М., Миллс Дж.А., Дальберг А.Е. Ингибиторы синтеза белка, оксазолидиноны и хлорамфеникол, вызывают значительную неточность трансляции in vivo. Дж Мол Биол. 2002; 322: 273–279.. [PubMed] [Google Scholar]
55. Girgis HS, Hottes AK, Tavazoie S. Генетическая архитектура внутренней чувствительности к антибиотикам. ПЛОС Один. 2009;4:e5629. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Musser SM, Chan SI. Эволюция протонной помпы цитохром с оксидазы. Дж Мол Эвол. 1998; 46: 508–520. [PubMed] [Google Scholar]
57. Karcher A, Schele A, Hopfner KP. Рентгеновская структура полного фермента ABC ABCE1 из Pyrococcus abyssi. Дж. Биол. Хим. 2008; 283:7962–7971. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
Толкание и толкание — фактор стоимости синтеза белка
Когда клетки растут и размножаются, им необходимо производить большое количество белка. Весь этот белок производится рибосомами, поэтому для быстрого роста требуется много рибосом. Поскольку рибосомы являются дорогостоящими машинами для клетки, клетка должна использовать их эффективно. В новом исследовании, опубликованном в PNAS, группа исследователей из MPI of Colloids and Interfaces в Потсдаме и из университетов Канады, Дании и США изучает, как бактерия Escherichia coli решает эту проблему и показывает, что ее экономическая стратегия использования рибосом близка к оптимальной. Эта стратегия связывает увеличение содержания рибосом в клетке с увеличением скорости их работы: Всякий раз, когда клетка производит больше рибосом, это также заставляет их работать быстрее? Кроме того, исследование определило медленную диффузию в клетке как ограничение скорости рибосом и как источник дорогостоящего увеличения скорости.
Когда компания растет, ей необходимо вкладывать средства в оборудование для производства большего количества продукции. То же верно и для клеток, которые растут и размножаются. Им нужно вкладывать свои ресурсы в такие машины, как рибосомы, чтобы производить белок и, в конечном итоге, новую клетку. При этом им приходится принимать экономические решения, например, лучше ли иметь меньше рибосом, которые работают быстрее, или больше рибосом, которые работают медленнее. Клетка может либо направить свои ресурсы на создание большого количества рибосом, либо на их быстрое создание. Новое исследование исследует, какая стратегия используется, систематически сравнивая теоретическую модель распределения протеомных ресурсов с экспериментальными данными для бактерий Escherichia coli, растущих с различными источниками питательных веществ и, следовательно, с разной скоростью роста.
Бактерии, как оказалось, используют комбинацию двух стратегий: когда рост клетки ускоряется, увеличивается как содержание рибосом, так и скорость, с которой эти рибосомы работают (но не так сильно, как могло бы быть, если бы все ресурсы были помещены в него в одиночку).
Почему сделать рибосомы более быстрыми дорого? Белки представляют собой цепочки различных аминокислот, которые в правильном порядке соединяются рибосомами. Для этого аминокислоты должны быть доставлены к рибосоме, что осуществляется с помощью так называемых тройных комплексов. Чтобы рибосома работала быстрее, эта доставка должна быть более быстрой, но увеличение скорости этой доставки сталкивается с физическим пределом: внутренняя часть клетки довольно переполнена белками и другими молекулами, и поэтому большие тройные комплексы доставляются медленно. через. Единственный способ заставить их прибыть быстрее — это иметь их много, чтобы один из них мог вовремя добраться до рибосомы.

Leave A Comment