Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой — КиберПедия
Ca + HNO3 → N2O + Ca(NO3)2 + H2O
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
4 вариант
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1) Zn(OH)2
2) KMnO4
3) Mg(HCO3)2
4) CaСO3
2. Сокращённое ионное уравнение 2H+ + FeS = H2S + Fe2+ соответствует взаимодействию сульфида железа и
1) фосфорной кислоты
2) соляной кислоты
3) кремниевой кислоты
4) сернистой кислоты
3. К неэлектролитам относится вещество, формула которого –
1) NaBr
2) CO
3) H2SO4
4) CuSO4
Алюминий взаимодействует с каждым из двух веществ
1) K2O и K2SO4
2) S и LiCl
3) Cl2 и H2SO4
4) H2O и Cu(OH)2
Сульфат магния в растворе взаимодействует с каждым из двух веществ
1) KOH и BaCl2
2) Na2CO3 и HCl
3) Ba(NO3)2 и HNO3
4) Cu и Cu(OH)2
Газ выделяется при взаимодействии соляной кислоты с
1) NaOH
2) BaCO3
3) NH4Br
4) AgNO3
Оксид железа(II) реагирует с
1) гидроксидом натрия
2) водородом
3) водой
4) сульфатом калия
Между какими веществами протекает химическая реакция?
1) хлоридом магния и нитратом цинка
2) карбонатом кальция и азотной кислотой
3) силикатом натрия и гидроксидом калия
4) фосфатом бария и сульфидом свинца
В реакции, схема которой
NO2 + Ва(OH)2 → Ва(NO2)2 + Ва(NO3)2 + Н2О,
восстановителем является
1) Ва2+
2) О-2
3) N+4
4) H+
10. Для уксусной кислоты характерно(а)
Для уксусной кислоты характерно(а)
1) наличие в молекуле четырёх атомов водорода
2) плохая растворимость в воде
3) наличие в молекуле двойной связи между атомами углерода
4) взаимодействие с цинком
5) взаимодействие с оксидом кремния
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
S + KOH → K2S + K2SO3 + H2O
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
5 вариант
1. К катионам относится каждая из двух частиц:
1) H2, Fe2+
2) PO43−, Cl−
3) H+, Mg2+
4) SO3, NH4+
Реакция ионного обмена идёт практически до конца между растворами
1) Ca(NO3)2 и K3PO4
2) KCl и H2SO4
3) NaNO3 и MgCl2
4) K2SO4 и NaOH
3. К неэлектролитам относится вещество, формула которого –
К неэлектролитам относится вещество, формула которого –
1) LiOH
2) CH3OH
3) HI
4) CH3COOH
Алюминий не реагирует с раствором
1) серной кислоты
2) сульфата магния
3) гидроксида натрия
4) нитрата меди(II)
Оксид фосфора(V) реагирует с
1) NaOH
2) SO3
3) N2O
4) MgSO4
Верны ли следующие суждения о свойствах кислот?
А. Все кислоты реагируют с металлами с выделением водорода.
Б. Концентрированная серная кислота реагирует с медью.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны
Какое из веществ реагирует с оксидом кремния?
1) H2O
2) H2SO4
3) CuCl2
4) KOH
И гидроксид кальция, и раствор серной кислоты взаимодействуют с
1) BaCl2
2) SiO2
3) Mg(OH)2
4) Na2CO3
В уравнении реакции между оксидом алюминия и соляной кислотой коэффициент перед формулой воды равен
1) 1
2) 2
3) 3
4) 4
Метан
1) является составной частью природного газа
2) относится к непредельным углеводородам
3) хорошо растворяется в воде
4) не реагирует с кислородом
5) вступает в реакцию с хлором
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Mg + H2SO4 → MgSO4 + H2S + H2O
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
6 вариант
В реакции, схема которой
NO2 + H2O → HNO2 + HNO3,
Восстановителем является
1) N+3
2) N+4
3) О-2
4) H+
2. Веществом X в сокращённом ионном уравнении X + 2Н+ = Zn2+ + 2Н2О является
1) Zn
2) ZnCl2
3) ZnО
4) Zn(OH)2
К неэлектролитам относится вещество, формула которого
1) Ca(OH)2
2) C2H4
3) K2S
4) CuCl2
И железо, и фосфор реагируют с
1) водородом
2) хлором
3) щелочами
4) соляной кислотой
Раствор гидроксида бария взаимодействует с
1) Fe(OH)2
2) H3PO4
3) NaCl
4) N2O
Разбавленная серная кислота реагирует с
1) аммиаком
2) хлоридом калия
3) серебром
4) углекислым газом
7. Реагируют с серной кислотой, но не реагируют с гидроксидом натрия:
Реагируют с серной кислотой, но не реагируют с гидроксидом натрия:
1. Аl(ОН)3
2. Р2O5
3. Mg
4. Sr(OH)2
5. Zn(OH)2
Из предложенного перечня веществ выберите одно вещество, с которым реагирует водород.
1) оксид железа(III)
2) кремний
3) разбавленная азотная кислота
4) гидроксид натрия
Азот является восстановителем при взаимодействии с
1) O2
2) H2
3) Mg
4) Fe
Уксусная кислота
1) содержит в молекуле 4 атома водорода и 2 атома кислорода
2) может реагировать как с карбонатом натрия, так и с хлором
3) обесцвечивает бромную воду
4) взаимодействует с хлоридом натрия
5) малорастворима в воде
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
С + SiO2 + Са3(РO4)2 → Р + СО + CaSiO3.
Определите окислитель и восстановитель.
Итоговая контрольная работа по химии
(9 класс)
7 вариант
Сера является окислителем в реакции
1) H2S + I2 = S + 2HI
2) 3S + 2Al = Al2S3
3) 2SO2 + О2 = 2SO3
4) S + 3NO2 = SO3 + 3NO
2. Краткое ионное уравнение Н+ + ОН— = Н2O отвечает взаимодействию веществ:
1) H2S и KOH
2) H2S и Cu(OH)2
3) HNO3 и Ва(ОН)2
4) HNO3 и Zn(OH)2
Центр дистанционного обучения ГБУ ДППО ЦПКС «Информационно-методический центр» Красногвардейского района Санкт-Петербурга
Перейти к основному содержанию
Пропустить новости сайта
Новости сайта
Поиск курса
Пропустить курсы
Курсы
Развернуть всё
Пропустить Календарь
Нет событий, Суббота 1 Апрель 1 | Нет событий, Воскресенье 2 Апрель 2 Нет событий, Воскресенье 2 Апрель 2 | |||||
Нет событий, Понедельник 3 Апрель 3 Нет событий, Понедельник 3 Апрель 3 | Нет событий, Вторник 4 Апрель 4 Нет событий, Вторник 4 Апрель 4 | Нет событий, Среда 5 Апрель 5 Нет событий, Среда 5 Апрель 5 | Нет событий, Четверг 6 Апрель 6 Нет событий, Четверг 6 Апрель 6 | Нет событий, Пятница 7 Апрель 7 Нет событий, Пятница 7 Апрель 7 | Нет событий, Суббота 8 Апрель 8 Нет событий, Суббота 8 Апрель 8 | Нет событий, Воскресенье 9 Апрель 9 Нет событий, Воскресенье 9 Апрель 9 |
Нет событий, Понедельник 10 Апрель 10 Нет событий, Понедельник 10 Апрель 10 | Нет событий, Вторник 11 Апрель 11 Нет событий, Вторник 11 Апрель 11 | Нет событий, Среда 12 Апрель 12 Нет событий, Среда 12 Апрель 12 | Нет событий, Четверг 13 Апрель 13 Нет событий, Четверг 13 Апрель 13 | Нет событий, Пятница 14 Апрель 14 Нет событий, Пятница 14 Апрель 14 | Нет событий, Суббота 15 Апрель 15 Нет событий, Суббота 15 Апрель 15 | Нет событий, Воскресенье 16 Апрель 16 Нет событий, Воскресенье 16 Апрель 16 |
Нет событий, Понедельник 17 Апрель 17 Нет событий, Понедельник 17 Апрель 17 | Нет событий, Вторник 18 Апрель 18 Нет событий, Вторник 18 Апрель 18 | Нет событий, Среда 19 Апрель 19 Нет событий, Среда 19 Апрель 19 | Нет событий, Четверг 20 Апрель 20 Нет событий, Четверг 20 Апрель 20 | Нет событий, Пятница 21 Апрель 21 Нет событий, Пятница 21 Апрель 21 | Нет событий, Суббота 22 Апрель 22 | Нет событий, Воскресенье 23 Апрель 23 Нет событий, Воскресенье 23 Апрель 23 |
Нет событий, Понедельник 24 Апрель 24 Нет событий, Понедельник 24 Апрель 24 | Нет событий, Вторник 25 Апрель 25 Нет событий, Вторник 25 Апрель 25 | Нет событий, Среда 26 Апрель 26 Нет событий, Среда 26 Апрель 26 | Нет событий, Четверг 27 Апрель 27 Нет событий, Четверг 27 Апрель 27 | Нет событий, Пятница 28 Апрель 28 Нет событий, Пятница 28 Апрель 28 | Нет событий, Суббота 29 Апрель 29 Нет событий, Суббота 29 Апрель 29 | Нет событий, Воскресенье 30 Апрель 30 Нет событий, Воскресенье 30 Апрель 30 |
Нет пользователей на сайте (последние 5 минут)
Пропустить Основное меню Пропустить Навигация Пропустить Последние объявления19 мар 09:50
Сидорова Екатерина
Сайт размещен на другом хостинге с 10 мая 2017 года
2.
 13: Уравновешивание химических уравнений — Химия LibreTexts
13: Уравновешивание химических уравнений — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49455
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Теперь мы определили символы и формулы для всех составляющих химических уравнений, но остался один важный шаг. Мы должны быть уверены, что закон сохранения массы соблюдается. В каждой части уравнения должно стоять одинаковое количество атомов (или молей атомов) данного типа . Это отражает нашу веру в третий постулат Дальтона о том, что атомы не создаются, не разрушаются и не превращаются из одного вида в другой в ходе химического процесса. Когда соблюдается закон сохранения массы, говорят, что уравнение имеет вид сбалансированный.
Когда соблюдается закон сохранения массы, говорят, что уравнение имеет вид сбалансированный.
В каждой части уравнения должно стоять одинаковое количество атомов (или молей атомов) данного типа.
В качестве простого примера того, как сбалансировать уравнение, возьмем реакцию, происходящую при соединении большого избытка ртути с бромом. На видео выше показано, как жидкий бром (темно-коричневый) сочетается с блестящим серебристым (тоже жидким) Меркурием. В этом случае продукт представляет собой белое твердое вещество, которое не плавится, а превращается в газ при нагревании выше 345°C. Он нерастворим в воде и приобретает лососевый цвет в присутствии УФ-излучения. По этим свойствам его можно определить как бромид ртути, Hg 9.0044 2 Бр 2 . Уравнение реакции будет выглядеть так:
\[ \text{Hg} + \text{Br}_{2} \rightarrow \text{Hg}_{2}\text{Br}_{2} \label{1} \]
, но оно не сбалансировано, потому что в правой части уравнения 2 атома ртути (в Hg 2 Br 2 ) и только 1 в левой.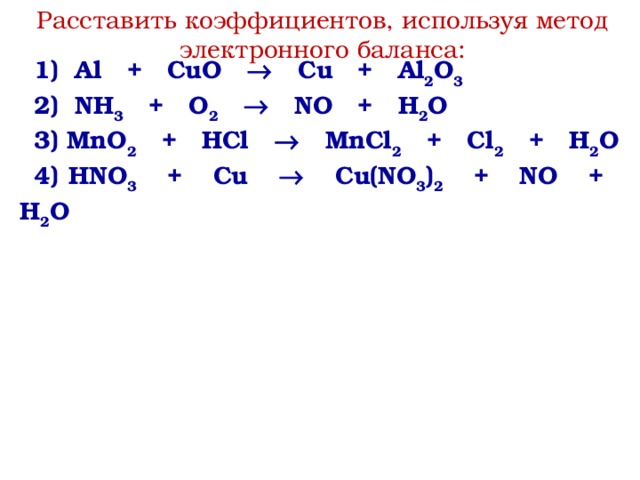
Неправильный способ получения сбалансированного уравнения — изменить его на
.\[ \text{Hg} + \text{Br}_{2} \rightarrow \cancel{\text{Hg}\text{Br}_{2}} \label{2} \]
Это уравнение неверно, потому что мы уже определили из свойств продукта, что продукт был Hg 2 Br 2 . Уравнение \(\ref{2}\) сбалансировано, но оно относится к другой реакции, которая дает другой продукт. Уравнение также может быть неправильно записано как
.\[ \cancel{\text{Hg}_{2}} + \text{Br}_{2} \rightarrow \text{Hg}_{2}\text{Br}_{2}\label{3 } \]
Формула Hg 2 предполагает участие молекул, содержащих 2 атома ртути каждая, но наш предыдущий микроскопический опыт с этим элементом показывает, что такие молекулы не встречаются.
При балансировке уравнения необходимо помнить, что индексы в формулах определены экспериментально . Изменение их указывает на изменение природы реагентов или продуктов. Однако допустимо изменять количества вовлеченных реагентов или продуктов. Например, рассматриваемое уравнение правильно сбалансировано следующим образом:
Например, рассматриваемое уравнение правильно сбалансировано следующим образом:
\[ \underline{2}\text{Hg} + \text{Br}_{2} \rightarrow \text{Hg}_{2}\text{Br}_{2} \label{4} \]
Химическое уравнение выражается в терминах его атомарного представления. 2 белые сферы реагируют с 2 связанными красными сферами. Двусторонняя стрелка указывает на правильную решетчатую структуру из связанных красных и белых сфер.
изображение предоставлено: CCoil (обсуждение) — собственная работа, CC BY-SA 3.0, Commons Wikimedia [commons.wikimedia.org]
2, записанная перед символом Hg, называется коэффициентом . Это указывает на то, что на микроскопическом уровне для реакции с молекулой требуется 2 атома Hg. В макроскопическом масштабе коэффициент 2 означает, что 2 9Для реакции с 1 моль Br 2 молекул требуется 0032 моль атомов Hg. Обратите также внимание, что Br 2 имеет коэффициент 1, что означает, что на микроскопическом уровне 1 молекула Br 2 реагирует с каждыми 2 атомами Hg, а на макроскопическом уровне 1 моль Br 2 взаимодействует с требуется на каждые 2 моля ртути. Наконец, на микроскопическом уровне 1 молекулу Hg 2 Br 2 можно рассматривать как единое целое в структуре решетки, показанной выше. На макроскопическом уровне 1 моль Hg 2 Br 2 составляет 6,02 x 10 23 молекул бромида ртути (I), расположенных в решетчатой структуре, показанной выше.
Наконец, на микроскопическом уровне 1 молекулу Hg 2 Br 2 можно рассматривать как единое целое в структуре решетки, показанной выше. На макроскопическом уровне 1 моль Hg 2 Br 2 составляет 6,02 x 10 23 молекул бромида ртути (I), расположенных в решетчатой структуре, показанной выше.
Подводя итог: после определения формул (индексов) уравнение уравновешивается корректирующими коэффициентами . Ничего другого изменить нельзя.
Пример \(\PageIndex{1}\) : Балансирующие уравнения
Балансируйте уравнение
\( \ce{Hg2Br2 + Cl2 -> HgCl2 + Br2}\)
Решение:
Хотя Br и Cl сбалансированы, рт нет. Коэффициент 2 с HgCl 2 необходимо:
\( \text{Hg}_{2}\text{Br}_{2} + \text{Cl}_{2} \rightarrow \underline{2}\text{HgCl} _{2} + \text{Br}_{2}\)
Теперь Cl не сбалансирован. Нам нужно 2 Cl 2 молекул слева:
\( \text{Hg}_{2}\text{Br}_{2} + \underline{2}\text{Cl}_{2} \ rightarrow \text{2HgCl}_{2} + \text{Br}_{2}\)
Теперь у нас есть атомы 2Hg, атомы 2Br и атомы 4Cl с каждой стороны, и поэтому балансировка завершена.
Большинство химиков используют несколько методов балансировки уравнений. 1 Например, полезно знать, какой элемент следует сбалансировать в первую очередь. Когда каждый химический символ появляется в одной формуле с каждой стороны уравнения (например, \(\PageIndex{1}\) ), вы можете начать с любого места, и процесс будет работать. Однако, когда символ появляется в трех или более формулах, этот конкретный элемент будет труднее сбалансировать, и его обычно следует оставлять напоследок.
1 Лоуренс Э. Стронг, Уравновешивание химических уравнений, Химия , том. 47, нет. 1, стр. 13-16, январь 1974 г., более подробно обсуждаются некоторые приемы.
Пример \(\PageIndex{2}\) : Уравнение реакции
Когда бутан (C 4 H 10 ) сжигается в кислородном газе (O 2 ), единственными продуктами являются двуокись углерода (CO 2 ) и вода. Напишите сбалансированное уравнение, описывающее эту реакцию.
Решение Сначала напишите несбалансированное уравнение, показывающее правильные формулы всех реагентов и продуктов:
\( \ce{C4h20 + O2 -> CO2 + h3O}\)
Отметим, что атомы O фигурируют в трех формулах, один слева и два справа. Поэтому сначала мы уравновешиваем C и H. Формула C 4 H 10 определяет, сколько атомов C и H должно остаться после реакции, поэтому запишем коэффициенты 4 для CO 2 и 5 для H 2 O:
\( \text {C}_{4}\text{H}_{10} + \text{O}_{2} \rightarrow \underline{4}\text{CO}_{2} + \underline{5}\text {Н}_{2}\текст{О}\)
Теперь у нас всего 13 атомов O в правой части, и уравнение можно сбалансировать, используя коэффициент \(\frac{13}{2}\) перед O 2 :
\( \text{C}_{4}\text{H}_{10} + \frac{13}{2}\text{O}_{2} \rightarrow \text{4CO}_{2} + \text{5H}_{2}\text{O}\)
Обычно предпочтительнее удалять дробные коэффициенты, так как они могут быть интерпретированы как часть молекулы. (Половина молекулы O 2 будет атомом O, который имеет совершенно другую химическую активность.) Поэтому мы умножаем все коэффициенты в обеих частях уравнения на два, чтобы получить окончательный результат:
(Половина молекулы O 2 будет атомом O, который имеет совершенно другую химическую активность.) Поэтому мы умножаем все коэффициенты в обеих частях уравнения на два, чтобы получить окончательный результат:
\( \underline{2}\text{C}_{4}\text{H}_{10} + \underline{13}\text{O}_{2} \rightarrow \underline{8}\ text{CO}_{2} + \underline{10}\text{H}_{2}\text{O}\)
(Иногда, когда нас интересуют моли, а не отдельные молекулы, может быть полезно чтобы опустить этот последний шаг.Очевидно, что идея о половине моля O 2 молекул, то есть 3,011 × 10 90 106 23 90 107 молекул, гораздо более логична, чем идея о половине молекулы.)
Другой полезный метод: показано в примере \(\PageIndex{2}\). Когда элемент (например, O 2 ) появляется сам по себе, обычно его коэффициент лучше выбирать последним. Кроме того, такие группы, как NO 3 , SO 4 и т. д., часто остаются неизменными в реакции и могут рассматриваться как состоящие из одного атома. Когда такая группа атомов заключена в круглые скобки, за которыми следует нижний индекс, нижний индекс применяется ко всем из них. То есть формула включает Ca(NO 3 ) 2 включает 1Ca, 2N и 2 × 3 = 6 атомов O.
Когда такая группа атомов заключена в круглые скобки, за которыми следует нижний индекс, нижний индекс применяется ко всем из них. То есть формула включает Ca(NO 3 ) 2 включает 1Ca, 2N и 2 × 3 = 6 атомов O.
Пример \(\PageIndex{3}\) : уравнения балансировки
Сбалансируйте уравнение
\( \ce{NaMnO4 + h3O2 + h3SO4 -> MnSO4 + Na2SO4 + O2 + h3O}\)
Решение
Отметим, что атомы кислорода встречаются в каждой из семи формул в уравнение, что делает его особенно трудно сбалансировать. Однако Na появляется только в двух формулах:
\( \underline{2}\text{NaMnO}_{4} + \text{H}_{2}\text{O}_{2} + \text{ H}_{2}\text{SO}_{4} \rightarrow \text{MnSO}_{4} + \text{Na}_{2}\text{SO}_{4} + \text{O }_{2} + {Н}_{2}\текст{О}\)
как и марганец, Mn:
\( \text{2NaMnO}_{4} + \text{H}_{2}\text{O}_{2} + \text{H}_{2} \text{SO}_{4} \rightarrow \underline{2}\text{MnSO}_{4} + \text{Na}_{2}\text{SO}_{4} + \text{O} _{2} + \text{H}_{2}\text{O}\)
Теперь заметим, что элемент S всегда появляется с 4 атомами O, поэтому мы уравновешиваем группы SO 4 :
\( \text{2NaMnO}_{4} + \text{H}_{2}\text{O}_{2} + \underline{3}\text{H}_{2}\text{SO} _{4} \rightarrow \text{2MnSO}_{4} + \text{Na}_{2}\text{SO}_{4} + \text{O}_{2} + \text{H} _{2}\текст{О}\)
Теперь мы можем сбалансировать водород:
\( \text{2NaMnO}_{4} + \text{H}_{2}\text{O}_{2} + \text{3H} _{2}\text{SO}_{4} \rightarrow \text{2MnSO}_{4} + \text{Na}_{2}\text{SO}_{4} + \text{O}_ {2} + \underline{4}\text{H}_{2}\text{O}\)
и, наконец, кислород. (Нам помогает тот факт, что он появляется как элемент.)
(Нам помогает тот факт, что он появляется как элемент.)
\( \text{2NaMnO}_{4} + \text{H}_{2}\text{O}_{2} + \text {3H}_{2}\text{SO}_{4} \rightarrow \text{2MnSO}_{4} + \text{Na}_{2}\text{SO}_{4} + \underline{ 3}\text{O}_{2} + \text{4H}_{2}\text{O}\)
Обратите внимание, что в этом примере мы следовали правилу уравновешивания сначала тех элементов, символы которых встречаются в наименьшем числе формул: Na и Mn по два, S (или SO 4 ) и H по три и, наконец, O Однако даже при использовании этого правила уравнения, в которых один или несколько элементов входят в четыре или более формул, трудно уравновесить без некоторых дополнительных методов, которые мы разработаем при исследовании реакций в водных растворах.
Уравновешивание химических уравнений имеет для нас важное экологическое значение. Если атомы сохраняются в химической реакции, то мы не можем от них избавиться. Другими словами мы ничего не можем выбросить . Есть только две вещи, которые мы можем делать с атомами: перемещать их с места на место или из соединения в соединение. Таким образом, когда мы «избавляемся» от чего-либо, сжигая это, выбрасывая или смывая в раковину, мы на самом деле вовсе не избавились от этого. Атомы, из которых она состоит, все еще находятся где-то рядом, и не менее важно знать, где они находятся и в какой молекуле они находятся. Выброшенные атомы в местах, где они нам не нужны, и в нежелательных молекулах известны как загрязнение.
Таким образом, когда мы «избавляемся» от чего-либо, сжигая это, выбрасывая или смывая в раковину, мы на самом деле вовсе не избавились от этого. Атомы, из которых она состоит, все еще находятся где-то рядом, и не менее важно знать, где они находятся и в какой молекуле они находятся. Выброшенные атомы в местах, где они нам не нужны, и в нежелательных молекулах известны как загрязнение.
Эта страница под названием 2.13: Balancing Chemical Equations распространяется под лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- коэффициент
Balancing Redox Reactions – Introductory Chemistry – 1st Canadian Edition
Глава 14. Окисление и восстановление
- Научитесь уравновешивать простые окислительно-восстановительные реакции путем проверки.
- Научитесь уравновешивать сложные окислительно-восстановительные реакции методом половинной реакции.
- Используйте растворитель или его части в качестве реагента или продукта для уравновешивания окислительно-восстановительной реакции.
Уравновешивание простых окислительно-восстановительных реакций может заключаться в простом переключении между продуктами и реагентами. Например, в окислительно-восстановительной реакции Na и Cl 2 :
Na + Cl 2 → NaCl
должно быть сразу ясно, что атомы Cl не уравновешены. Мы можем исправить это, поставив перед произведением коэффициент 2:
Мы можем исправить это, поставив перед произведением коэффициент 2:
Na + Cl 2 → 2NaCl
Однако теперь натрий несбалансирован. Это можно исправить, включив коэффициент 2 перед реагентом Na:
2Na + Cl 2 → 2NaCl
Теперь эта реакция уравновешена. Это было довольно просто; мы говорим, что можем уравновесить реакцию проверкой . Многие простые окислительно-восстановительные реакции можно сбалансировать путем проверки.
Сбалансируйте эту окислительно-восстановительную реакцию путем проверки.
SO 2 + O 2 → SO 3
Решение
В обеих частях уравнения есть по одному атому S, поэтому сера сбалансирована. Однако сторона реагента имеет четыре атома O, а сторона продукта — три. Очевидно, что нам нужно больше атомов O на стороне продукта, поэтому давайте начнем с включения коэффициента 2 в SO 3 :
SO 2 + O 2 → 2SO 3
Это теперь дает нам шесть атомов O на стороне продукта, а также дисбаланс атомов S. Мы можем сбалансировать оба элемента, добавив коэффициент 2 к SO 2 со стороны реагента:
Мы можем сбалансировать оба элемента, добавив коэффициент 2 к SO 2 со стороны реагента:
2SO 2 + O 2 → 2SO 3
Это дает нам два атома S с обеих сторон и всего шесть атомов O с обеих сторон химического уравнения. Эта окислительно-восстановительная реакция теперь уравновешена.
Проверьте себя
Сбалансируйте эту окислительно-восстановительную реакцию путем проверки.
AL + O 2 → AL 2 O 3
Ответ
4AL + 3 O 2 → 2AL 2 O 3
Первое, что вы должны сделать, столкнувшись с несбалансированной окислительно-восстановительной реакцией, это попытаться сбалансировать ее путем проверки.
Некоторые окислительно-восстановительные реакции нелегко сбалансировать путем проверки. Рассмотрим эту окислительно-восстановительную реакцию:
Al + Ag + → Al 3+ + Ag
На первый взгляд это уравнение кажется сбалансированным: с обеих сторон имеется по одному атому Ag и по одному атому Al с обеих сторон. Однако, если вы посмотрите на общий заряд с каждой стороны, вы увидите дисбаланс заряда: на стороне реагента общий заряд 1+, а на стороне продукта общий заряд 3+. Что-то не так с этим химическим уравнением; несмотря на равное количество атомов с каждой стороны, он не уравновешен.
Однако, если вы посмотрите на общий заряд с каждой стороны, вы увидите дисбаланс заряда: на стороне реагента общий заряд 1+, а на стороне продукта общий заряд 3+. Что-то не так с этим химическим уравнением; несмотря на равное количество атомов с каждой стороны, он не уравновешен.
Фундаментальным моментом окислительно-восстановительных реакций, который ранее не возникал, является то, что общее количество потерянных электронов должно равняться общему количеству приобретённых электронов , чтобы окислительно-восстановительная реакция была сбалансированной. Это не относится к реакции алюминия и серебра: атом Al теряет три электрона, чтобы стать ионом Al 3+ , в то время как ион Ag + получает только один электрон, чтобы стать элементарным серебром.
Чтобы сбалансировать это, мы запишем каждую реакцию окисления и восстановления отдельно, указав количество электронов в каждой из них. По отдельности реакции окисления и восстановления называются полуреакции . Затем мы будем брать кратные каждой реакции до тех пор, пока количество электронов на каждой стороне полностью не сократится, и объединять половинные реакции в общую реакцию, которая затем должна быть сбалансирована. Этот метод уравновешивания окислительно-восстановительных реакций называется методом половинной реакции . (Есть и другие способы уравновешивания окислительно-восстановительных реакций, но это единственный способ, который будет использоваться в этом тексте. Причина этого будет рассмотрена в разделе «Применение окислительно-восстановительных реакций: гальванические элементы».)
Затем мы будем брать кратные каждой реакции до тех пор, пока количество электронов на каждой стороне полностью не сократится, и объединять половинные реакции в общую реакцию, которая затем должна быть сбалансирована. Этот метод уравновешивания окислительно-восстановительных реакций называется методом половинной реакции . (Есть и другие способы уравновешивания окислительно-восстановительных реакций, но это единственный способ, который будет использоваться в этом тексте. Причина этого будет рассмотрена в разделе «Применение окислительно-восстановительных реакций: гальванические элементы».)
В полуреакции окисления участвует алюминий, который окисляется:
алюминий → алюминий 3+
Эта полуреакция не полностью уравновешена, потому что общие заряды на каждой стороне не равны. Когда атом Al окисляется до Al 3+ , он теряет три электрона. Мы можем явно записать эти электроны как произведения:
Al → Al 3+ + 3e −
Теперь эта полуреакция уравновешена — как по атомам, так и по зарядам.
В полуреакции восстановления участвует серебро:
Ag + → Ag
Общий заряд не сбалансирован с обеих сторон. Но мы можем исправить это, добавив один электрон со стороны реагента, потому что ион Ag + должен принять один электрон, чтобы стать нейтральным атомом Ag:
Ag + + e − → Ag
Эта полуреакция теперь также уравновешена.
При объединении двух полуреакций в сбалансированное химическое уравнение ключевым моментом является то, что общее количество электронов должно компенсировать , поэтому количество электронов, потерянных атомами, равно количеству электронов, полученных другими атомами. Для этого может потребоваться умножить одну или обе полуреакции на целое число, чтобы количество электронов с каждой стороны было равным. С тремя электронами в качестве продуктов и одним в качестве реагента наименьшее общее кратное этих двух чисел равно трем: мы можем использовать одну реакцию с алюминием, но должны взять в три раза больше реакции с серебром:
3 во второй реакции распространяется на все виды в реакции:
Теперь две полуреакции можно сложить так же, как два алгебраических уравнения, со стрелкой в качестве знака равенства. Те же виды на противоположных сторонах стрелки могут быть отменены:
Те же виды на противоположных сторонах стрелки могут быть отменены:
Итоговая сбалансированная окислительно-восстановительная реакция выглядит следующим образом:
В каждой части химического уравнения по-прежнему есть только один атом Al, но теперь есть три атома Ag, а общий заряд в каждой части уравнения одинаков (3+ для обеих сторон). Эта окислительно-восстановительная реакция сбалансирована. Использование метода половинной реакции потребовало больше усилий, чем проверка, но была получена правильная сбалансированная окислительно-восстановительная реакция.
Сбалансируйте эту окислительно-восстановительную реакцию, используя метод полуреакции.
Fe 2+ + Cr → Fe + Cr 3+
Решение
Начнем с записи двух полуреакций. Хром окисляется, а железо восстанавливается:
Затем мы включаем соответствующее количество электронов с правильной стороны, чтобы сбалансировать заряды для каждой реакции:
В первой реакции участвуют три электрона, а во второй реакции участвует два электрона. Наименьшее общее кратное этих двух чисел равно шести, поэтому, чтобы получить шесть электронов в каждой реакции, нам нужно удвоить первую реакцию и утроить вторую:
Наименьшее общее кратное этих двух чисел равно шести, поэтому, чтобы получить шесть электронов в каждой реакции, нам нужно удвоить первую реакцию и утроить вторую:
Мы можем объединить две последние реакции, заметив, что электроны компенсируют:
Общая сбалансированная окислительно-восстановительная реакция:
Ответить
Многие окислительно-восстановительные реакции протекают в водном растворе — в воде. Из-за этого во многих случаях H 2 O или фрагмент молекулы H 2 O (H + или ОН — , в частности) могут участвовать в окислительно-восстановительной реакции. Таким образом, нам нужно научиться включать растворитель в сбалансированное окислительно-восстановительное уравнение.
Рассмотрим следующую полуреакцию окисления в водном растворе, который имеет по одному атому Cr с каждой стороны:
Cr 3+ → CrO 4 −
Здесь атом Cr переходит из степени окисления +3 в +7. Для этого атом Cr должен потерять четыре электрона. Начнем с перечисления четырех электронов как произведений:
Для этого атом Cr должен потерять четыре электрона. Начнем с перечисления четырех электронов как произведений:
Cr 3+ → CrO 4 − + 4e −
Но откуда берутся атомы О? Они происходят из молекул воды или общего фрагмента молекулы воды, который содержит атом О: ион ОН — . Когда мы уравновешиваем эту полуреакцию, мы должны свободно включать любой из этих видов в реакцию, чтобы сбалансировать элементы. Давайте использовать H 2 O для баланса атомов O; нам нужно включить четыре молекулы воды, чтобы сбалансировать четыре атома O в продуктах:
4H 2 O + Cr 3+ → CrO 4 − + 4e −
Это уравновешивает атомы O, но теперь в реакцию вводится водород. Мы можем сбалансировать атомы H, добавив ион H + , который является еще одним фрагментом молекулы воды. Нам нужно добавить восемь ионов H + на сторону продукта:
4H 2 O + Cr 3+ → CrO 4 − + 4e − + 8H +
Сбалансированы атомы Cr, сбалансированы атомы O и сбалансированы атомы H; если мы проверим общий заряд с обеих сторон химического уравнения, они будут одинаковыми (в данном случае 3+). Эта полуреакция теперь уравновешена, используя молекулы воды и части молекул воды в качестве реагентов и продуктов.
Эта полуреакция теперь уравновешена, используя молекулы воды и части молекул воды в качестве реагентов и продуктов.
Реакции восстановления можно уравновесить аналогичным образом. Когда полуреакции окисления и восстановления уравновешены по отдельности, их можно комбинировать так же, как и раньше: взяв кратное количество каждой полуреакции, необходимое для компенсации всех электронов. Другие виды, такие как H + , OH — и H 2 O, возможно, также придется отменить в окончательной сбалансированной реакции.
Если не указано иное, не имеет значения, добавляете ли вы H 2 O или OH − в качестве источника атомов O, хотя реакция может указывать кислый раствор или щелочной раствор в качестве намека на то, какие вещества следует использовать. использовать или какие виды следует избегать. Ионы OH — не очень распространены в кислых растворах, поэтому их следует избегать в таких обстоятельствах.
Сбалансируйте эту окислительно-восстановительную реакцию. Предположим базовое решение.
MnO 2 + CrO 3 − → Mn + CrO 4 −
Раствор
Мы можем начать каждую реакцию окисления пополам, разделив реакции окисления и
. Реакция окисления выглядит следующим образом:
CrO 3 − → CrO 4 −
Атом Cr переходит из степени окисления +5 в +7 и теряет в процессе два электрона. Мы добавляем эти два электрона к стороне продукта:
CrO 3 − → CrO 4 − + 2e −
Теперь мы должны сбалансировать атомы O. Because the solution is basic, we should use OH − rather than H 2 O:
OH − + CrO 3 − → CrO 4 − + 2e −
Мы ввели атомы Н как часть реагентов; мы можем сбалансировать их, добавив H + в качестве продуктов:
OH − + CrO 3 − → CrO 4 − + 2e − + H +
сбалансированный.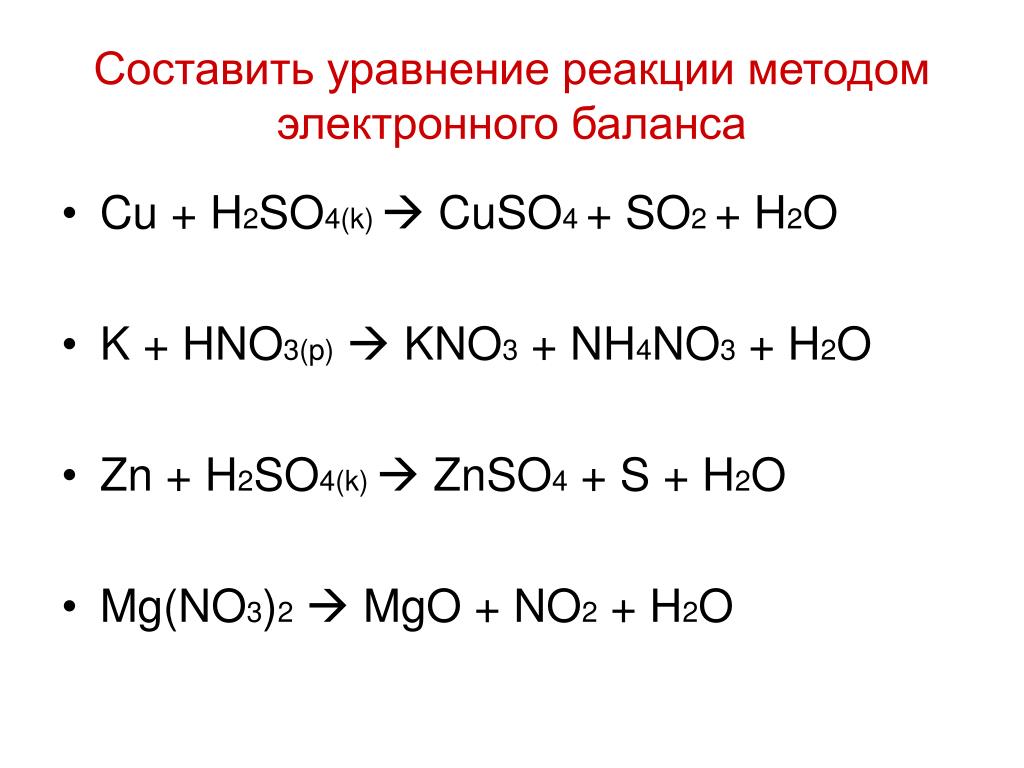 Однако, если реакция протекает в щелочном растворе, маловероятно, что ионы Н + будут присутствовать в количестве. Чтобы решить эту проблему, добавьте дополнительный ион OH − к каждой стороне уравнения:
Однако, если реакция протекает в щелочном растворе, маловероятно, что ионы Н + будут присутствовать в количестве. Чтобы решить эту проблему, добавьте дополнительный ион OH − к каждой стороне уравнения:
OH − + CrO 3 — + OH — → CRO 4 — + 2E — + H + + OH — 907
. вместе как 2OH — . С правой стороны ионы H + и OH — могут быть сгруппированы в H 2 O Молекула:
2OH — + CRO 3 — → CRO 4 010101010101010101010101010101010101010101010101010101010101010101010101010101010101010101010101010101010101011010106. — . + 2e − + H 2 O
Это более подходящая форма для основного раствора.
Теперь уравновешиваем реакцию восстановления:
MnO 2 → Mn
Атом Mn изменяется от +4 до 0 в степени окисления, что требует прироста четырех электронов:
4e − + MnO 2 → Mn
Затем уравновешиваем атомы O, а затем атомы H:
4e − + MnO 2 → Mn + 2 OH −
2 H + + 4e0106 − + MnO 2 → Mn + 2 OH −
Добавляем по два иона OH − с каждой стороны для устранения иона H + в реагентах; реагенты объединяются, образуя две молекулы воды, и количество ионов OH − в продукте увеличивается до четырех: −
Эта реакция сбалансирована для основного раствора.
Теперь объединим две уравновешенные полуреакции. В реакции окисления два электрона, в реакции восстановления четыре. Наименьшее общее кратное этих двух чисел равно четырем, поэтому умножаем реакцию окисления на 2, чтобы электроны были сбалансированы:
2 × [2OH — + CRO 3 — → CRO 4 — + 2E — + H 2 O]
2H 2 4 2 07 + 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4 2 4. 2 → MN + 4 OH —
Объединение этих двух уравнений. Приводит к следующему уравнению:
4 OH — + 2Cro 3 — 907 + 2H 2 o + 4e 4e 4101011010110106 — + 2H 2 o + 4e 410106 — + 2H 2 o + 4e 4. MnO 2 → 2CrO 4 − + 4e − + 2H 2 O + Mn + 4OH −
Четыре электрона компенсируются. То же самое делают две молекулы H 2 O и четыре иона OH − . Остается
То же самое делают две молекулы H 2 O и четыре иона OH − . Остается
2CrO 3 − + MnO 2 → 2CrO 4 − + Mn
, что является нашей последней сбалансированной окислительно-восстановительной реакцией.
Проверь себя
Сбалансируй эту окислительно-восстановительную реакцию. Предположим базовое решение.
Cl − + MnO 4 — → MNO 2 + CLO 3 —
Ответ
H 2 O + CL — + 2MNO 4 4 4.1104 4 9044 4 9044 4. 4044 4 9044 4 9044 4 9044 4 9044 4 9044 4 9044 4 9004 4 4044 4 9044 4 4. 4 4044 4 9044 4 9044 4 9044 4 9044 4 4. 4 9044 4 4. 9034 4 4 4 4 4. 9034. − + 2ОН −
- Окислительно-восстановительные реакции могут быть уравновешены наблюдением или методом полуреакции.

- Растворитель может участвовать в окислительно-восстановительных реакциях; в водных растворах H 2 O, H + и OH — могут быть реагентами или продуктами.
- Сбалансируйте эти окислительно-восстановительные реакции путем проверки.
- Na + F 2 → NaF
- Al 2 O 3 + H 2 → Al + H 2 O
- Сбалансируйте эти окислительно-восстановительные реакции путем проверки.
- Fe 2 S 3 + O 2 → Fe 2 O 3 + S
- Cu 2 O + H 2 → Cu + H 2 O
- Сбалансируйте эти окислительно-восстановительные реакции путем проверки.
- CH 4 + O 2 → CO 2 + H 2 O
- P 2 O 5 + Cl 2 → PCl 3 + O 2
- Сбалансируйте эти окислительно-восстановительные реакции путем проверки.

- PbCl 2 + FeCl 3 → PbCl 4 + FeCl 2
- SO 2 + F 2 → SF 4 + 2
- Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Ca + H + → Ca 2+ + H 2
- Sn 2+ → Sn + Sn 4+ (Подсказка: обе полуреакции начнутся с одним и тем же реагентом.)
- Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Fe 3+ + Sn 2+ → Fe + Sn 4+
- Pb 2+ → Pb + Pb 4+ (Подсказка: обе полуреакции начнутся с одним и тем же реагентом.)
- Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.
- Na + Hg 2 Cl 2 → NaCl + Hg
- Al 2 O 3 + C → Al + CO 2
- Сбалансируйте эти окислительно-восстановительные реакции методом половинной реакции.

- Br − + I 2 → I − + Br 2
- CrCl 3 + F 2 → CrF 3 + Cl 2
- Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе. Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
- Cu + NO 3 − → Cu 2+ + NO 2
- Fe + MnO 4 − → Fe 3+ + Mn
- Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе. Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
- CrO 3 + Ni 2+ → Cr 3+ + Ni 3+
- OsO 4 + C 2 H 4 → Os + CO 2
- Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе.
 Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.- ClO − + Ti 2+ → Ti 4+ + Cl −
- БрО 3 − + Ag → Ag + + BrO 2
- Сбалансируйте эти окислительно-восстановительные реакции, происходящие в водном растворе. Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
- H 2 O 2 + NO → N 2 O 3 + H 2 O
- VO 2 + + НО → V 3+ + НО 2
- Объясните, почему это химическое уравнение не сбалансировано, и сбалансируйте его, если его можно сбалансировать.
Cr 2+ + Cl 2 → Cr 3+ + 2Cl −
- Объясните, почему это уравнение не сбалансировано, и сбалансируйте его, если его можно сбалансировать.

O 2 + 2H 2 O + Br 2 → 4OH − + 2Br −
- 2Na + F 2 → 2NaF
- Al 2 O 3 + 3H 2 → 2Al + 3H 2 O
- CH 4 + 2O 2 → CO 2 + 2H 2 O
- 2P 2 O 5 + 6Cl 2 → 4PCl 3 + 5O 2
- Ca + 2H + → Ca 2+ + H 2
- 2Sn 2+ → Sn + Sn 4+
- 2Na + Hg 2 Cl 2 → 2NaCl + 2Hg
- 2Al 2 O 3 + 3C → 4Al + 3CO 2
- 4H + + Cu + 2NO 3 − → Cu 2+ + 2NO 2 + 2H 2 O в кислом растворе; 2H 2 O + Cu + 2NO 3 − → Cu 2+ + 2NO 2 + 4OH − в основном растворе
- 24H + + 3MnO 4 − + 7Fe → 7Fe 3+ + 3Mn + 12H 2 O в кислом растворе; 12H 2 O + 3MnO 4 − + 7Fe → 7Fe 3+ + 3Mn + 24OH − в основном растворе
- 2H + + ClO − + Ti 2+ → Cl − + H 2 O + Ti 4+ в кислом растворе; H 2 O + ClO − + Ti 2+ → Cl − + Ti 4+ + 2OH − в основном растворе
- 2H + + BrO 3 − + Ag → BrO 2 + H 2 O + Ag + в кислом растворе; H 2 O + BrO 3 − + Ag → BrO 2 + Ag + + 2OH − в основном растворе
- Заряды не сбалансированы должным образом.






 Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.
Используйте любые виды, полученные из воды, которые необходимы; может быть более одного правильного сбалансированного уравнения.

Leave A Comment