Йодид калия и хлорная вода
При пропускании хлора в 400 г йодида калия получено 50.8 г галогена. Какова была массовая доля соли в исходном
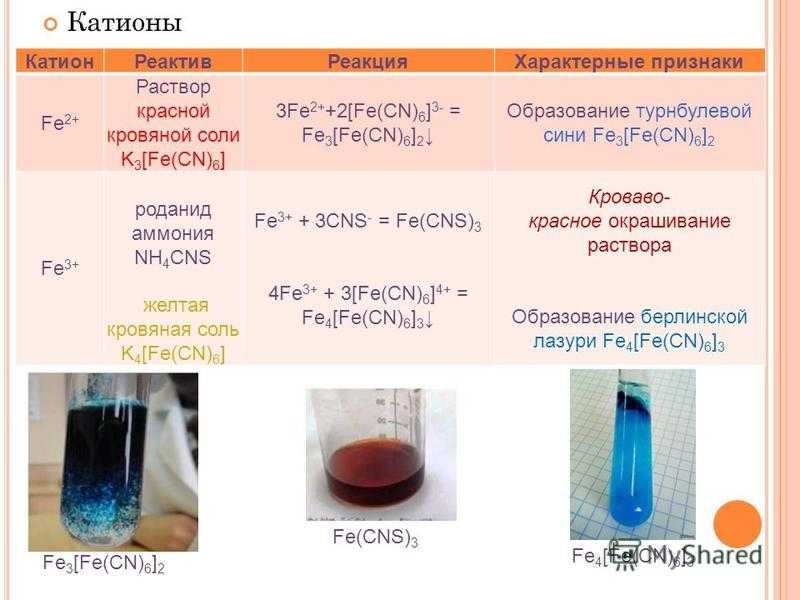
Cl2 + 2KI = I2 + 2KCl
ищем по таблице M всех веществ
зная M хлорида калия составляем пропорцию 332 149 вычисляем массу хлорида калия179.5
400 х
составляем новую пропорцию и вычисляем массу хлора = 85.5г
складываем 85.5+400 = 485.5 масса всего раствора
400\485.5=0.82=82%
Ответ: 82%(с огруглением)
Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем его полное растворение. Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели.
Какое явление наблюдается при смешивании йодида калия и хлора? ? Срочно
2 Г смеси хлорида калия и йодида калия растворили в воде. Через раствор пропустили хлор в избытке, после чего
В йодированной поваренной соли массой 100 г в среднем содержится 1.12мг йодида калия какрое число атомов хлора
Индикаторные бумажки для распознавания хлора
Вообще индикаторые бумажки смочены лакмусом.
2 Окислители хлорная вода . Окисляют иодид ионы до свободного йода.К 1-2 каплям иодида калия прибавьте 2-3 капли раствора серной кислоты, 3-4 капли хлорной воды, встряхните содержимое пробирки.
Раствор йодида калия и крахмала
так называемая йодокрахмальная бумага
Раствором йодида калия и крахмала. При воздействии хлора высвобождается элементарный йод, который изменяет окраску крахмала на сине-фиолетовую с бесцветной.
Какова масса хлора, прореагировавшего с йодидом калия, если масса полученного йода составляет 25,4 г. ??
7,1 г
Проведем реакции между следующими веществами а сероводородная и хлорная вода. Наблюдаемые явления образуется остаток серы желтого цвета. Уравнения реакции б раствор иодида калия и хлорная вода.
Какой объём хлора потребуется для вытеснения йода из 300 граммов 15 % раствора йодида калия?какое количество новой соли
Решение:
Высчитываем массу йодида калия в растворе 300*0,15=45 г
Составляем уравнение реакции:
2KI + Cl2 => 2KCl + I2
332 г—22,4 л—2моль
45 г—-х л——у моль
х=3,04 л
у=0,27 моль
Хлорида калия образовалось 0,27 моль, хлора потребуется 3,04 л
7 Раствор иодида калия обработали раствором хлора. 19 Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем его полное растворение.
19 Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем его полное растворение.
Помогите пожалуйста. какой объем хлора пойдет на взаимодействие с 166 г раствора содержащего 10 % йодида калия
Масса иодида калия равна 166 умножить на 0,1 и равно 16, 6
кол-во вещества иодида калия равно 16, 6 разделить на 166 ( молярную массу) и равно 0,1
кол-во вещества хлора в 2 раза меньше и равно 0,05
объем хлора 0,05 умножить на 22, 4 и равно 1,12 л
3 капли раствора йодида калия подкисляют 1 каплей разбавленной серной кислоты, прибавляют 0,5 мл хлороформа и затем, по каплям, при энергичном встряхивании, 2 3 капли хлорной воды.
Помогите, пожалуйста, химики!
Химики, на помощь! Нужно смешать йодид калия с хлорной водой. напишите мне уравнение реакции, не понимаю как (((
2KI+ Cl2 → 2KCl + I2
Хлорная вода выделяет из растворов йодидов свободный йод, который окрашивает предварительно прилитый индикатор (сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала — в синий)
2KBr + Cl2 → 2KCl + Br2↑
KI 3h3O 3Cl2 HIO3 KCl 5HCl. Проверить балансировку . Реакция взаимодействия иодида калия, воды и хлора с образованием иодноватой кислоты, хлорида калия и хлороводорода. Найти другую реакцию.
Проверить балансировку . Реакция взаимодействия иодида калия, воды и хлора с образованием иодноватой кислоты, хлорида калия и хлороводорода. Найти другую реакцию.
2KI+ Cl2 → 2KCl + I2
Помогите решить задачу по химии, пожалуйта
Делай через пропорции молей
Свежеприготовленные реактивы хлорная вода, сероводородная вода, сульфид натрия или аммония, 0,5% раствор крахмала.В одну прибавляют 5 капель концентрированного HNO3, в другую 5 капель раствора йодида калия и наблюдают выделение осадка.
68,3 г смеси нитрата калия, йодида калия и хлорида калия растворено в воде и обработанно хлорной водой. в рез-те выдели
Ну и все очень рады а в чем вопрос собственно? Решение такого количества задач денег стоит, ты лохов здесь ищешь?
В пробирку внесли 3 капли 0,5 р раствора йодида калия, добавили 5 капель хлороформа и 54 капли хлорной воды.Напишите уравнения реакции.
Система контроль дезинфекции?
Как. объем хлора потреб для вытеснения всего йода из 300 г.
 15% раствора йодида калия? как кол-во новой соли образуется?
15% раствора йодида калия? как кол-во новой соли образуется?А у меня по-другому получилось. 0,2л хлора и 0,018 моль соли образовавшейся. Решение написать?
Уравнения реакции Выводы В результате данной реакции хлор проявляет окислительные свойства, а сероводород, за счет серы в низшей степени окисления, восстановительные. б Действия Проводим реакции между раствором иодида калия и хлорной водой.
Здравствуйте. Как узнать вещество хлор в домашних условиях??? Самые простые способы.
По запаху и цвету ( газ бледно жёлтого цвета)
В каждую из пробирок добавляем равный объем хлорной воды. В пробирке с йодидом калия выделился йод, в пробирке с бромидом натрия бром, в пробирке с хлоридом натрия, конечно, никаких изменений не произошло.
Да, это не аммиак. Но представь как пахнет в бассейне и умножь это на 100. Так и будет пахнуть хлор.
Химия. какие 2 таблетки нужно смешать (в порошковом виде), чтобы при нагревании они дымились?
У Менделеева спроси
Избыток хлорной воды , получившийся вследствие конденсации паров воды, вносимых хлором, отводится в аппарат 2 для отпарки хлора. В раствор иодида калия было добавлено небольшое количество бромной воды, затем избыток хлорной воды .
В раствор иодида калия было добавлено небольшое количество бромной воды, затем избыток хлорной воды .
Анальгин и гидроперит всё продается в аптеке
Какие химические элементы (а именно галогены) участвуют в процессе проявления фотопленки? Бром и хлор?
Бром. Фотобумага так называлась «бром-портрет».
18. Раствор иодида калия обработали избытком хлорной воды, при этом наблюдали сначала образование осадка, а затем — его полное растворение.20. Даны оксид серы IV , кислород, хлорная вода, раствор гидроксида калия горячий .
Метол. гидрохинон.. фенидон
В состав светочувствительной эмульсии входит бромистое серебро. В состав проявителя — бромистый калий.
Бром
Галогены делают серебро чувствительным к свету и позволяют вести обработку, усиливающую чувствительность в миллионы раз. Металлическое серебро, полученное в результате проявки, создаёт изображение, а бромистое незасвеченное легко выводится дешёвым тиосульфатом натрия в раствор или промывную воду.
Галогены в процессе проявки не участвуют. Проявляющие вещества — метол, гидрохинон, фенидон и др. — слабые восстановители — восстанавливают серебро из галоидного до металлического.
Галоидное серебро, (хлористое и бромистое) входят в состав фотоэмульсии пленок. В состав ф\эмульсии фотобумаг может входить также йодид серебра.
При добавлении хлорной воды к раствору бромида калия хлор вытесняет бром из соединения, молекулы хлора окисляют анионы брома, образуется молекулярный бром.
Дагерротипия -это что такое? Когда придумали? Используется в настоящее время?
Придумана на заре освоения фотографии… не думаю что сегодня кто-то использует (если интересуетесь углублённо -есть смысл поискать в инете).
3 Цинкат калия при взаимодействии с соляной кислотой образует хлорид цинка, хлорид калия и воду4 При взаимодействии йодида алюминия с раствором сульфида калия в осадок выпадает Al OH 3 и выделяется h3S.
Дагеротипия — одно из первых названий фотографии.
Дагеротипия создана французским изобретателем Жозефом Нисефором Ньепсом ок. 1822 года и обнародована художником Луи Дагером в 1839 году
1822 года и обнародована художником Луи Дагером в 1839 году
Зеваю… Неужели Яндекс Вас забанил? https://ru.wikipedia.org/wiki/Дагеротипия
Дагероти́пия или дагерроти́пия (англ. daguerreotypy) — ранний фотографический процесс, основанный на использовании светочувствительной посеребрённой медной пластинки. Первый способ получения позитивного изображения непосредственного на фотоматериале, на который производится съёмка.
Химический процесс получения фотографии разработанный Луи Манде Дагером на основе идей Жозефора Ньепса в 30-х годах XIX века. Несмотря на то, что начал свое триумфальное шествие в 1837-м во Франции, затем был представлен на промышленных выставках в Германии, Австрии и России, постепенно угас из-за сложности и дороговизны. Вытеснен «амбротипией» и негатив-позитивными процессами уже к концу 50-х годов. Однако, до сих пор есть энтузиасты, работающие с медными посереберными пластинками и цианистым калием в качестве фиксажа.
Междунароное сообщество дагеротипистов
http://www. cdags.org/
cdags.org/
В дополнение к ссылке к Википеди, если там не найдете эту ссылку.
Иодид калия, иодистый калий, KI калиевая соль иодоводородной кислоты.Иодид калия реагирует с иодом, образуя раствор Люголя, содержащий трииодид-анион, который обладает лучшей растворимостью в воде, чем элементарный иод
Помогите кто нибудь с химией
Могу помочь советом: в тетрадке с дз сдай учителю 1000Р, глядишь и 5 поставит
5. проделайте реакции между следующими веществами а сероводородной и хлорной водой б раствором иодида калия и хлорной водой в соляной кислотой и алюминием г концентрированной серной кислотой и медью при нагревании . составьте уравнения реакций…
Посмотри, как подобные задачи решали.
Косвенное титрование или титрование заместителя.
Хлор реагирует с йодидом калия с выделение йода
Cl2+2KI=I2+2KCl
Cl2+2e=2Cl(-) 1/2,(Cl2)=1/2
М (1/2,Сl2)=M/2=35,5 г/моль
а выделившийся йод реагируют с тиосульфатом
2S2O3(-2)+I2=2I(-)+S4O6(-2)
2S2O3(-2)+2e=S4O6(-2) 1/1,Na2S2O3
m(Cl2)=[C(1/1,Na2S2O3)*V(Na2S2O3)*M(1/2,Cl2)/1000]*Vk/Vп=
0,2*15*(70,90/2) *300 / 1000*10=3,1905 г — это в 300 мл раствора, а 100 мл 3 раза меньше
Даны три раствора: хлорид калия, бромид калия, иодид калия.
Хлор будет реагировать с бромидом калия и йодидом калия
Cl2+2KBr⇒2KCl+Br2
Cl2+2KY⇒2KCl+Y2
бром будет реагировать только с йодидом калия
Br2+2KY⇒2KBr+Y2
химическая активность галогенов возрастает от йода к фтору. фтор самый активный галоген. более сильный галоген может вытеснять из солей более слабый
9. Приготовление хлорной воды раствора хлора в воде . Можно получать хлорную воду традиционным способом, пропуская газообразный хлор через воду.К раствору иодида калия или натрия 50 мл 5% добавьте 2-3 мл хлорной воды.
Помогите ПлиЗ, решить задачку по химии!!!
В сторону йодида калия
Даны вещества сульфит натрия, вода, гидроксид калия, перманганат калия, фосфорная кислота.Даны вещества алюминий, хлор, йодид калия, серная кислота конц. .
Определите содержимое посуды
Хлорная известь
Йодид калия менее гигроскопичен поглощает воду менее охотно , чем йодид натрия, поэтому с ним легче работать.А основным сырьем для промышленного получения йода являются буровые воды или некоторые виды водорослей.
Взаимjдействие йодида калия с хлорной водой
Как бы щедро не наградила нас природа, не стоит пренебрегать советами и услугами косметологов. В этой рубрике мы будем посвящать вас в косметологические тайны, которые помогут вам вернуть коже сияние молодости и с помощью новейших технологий остановить на время биологические часы. Сегодня мы поговорим об одном из самых быстрых способов безоперационного устранения мимических морщин – это инъекции препаратов ботулинического токсина. Ботулотоксин используется в медицинских целях уже более 30 лет в неврологической практике при таких заболеваниях, как спастическая кривошея, и в офтальмологии – при блефароспазме. Чуть меньше 20 лет назад Каррутерс со своей женой первыми предложили идею применения ботулинического токсина в косметических целях.
Какие химические элементы (а именно галогены) участвуют в процессе проявления фотопленки? Бром и хлор?
Бром. Фотобумага так называлась «бром-портрет».
8. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует сВещество, полученное на аноде при электролизе раствора йодида натрия с инертными электродами, ввели в реакцию с калием. Хлорная вода имеет запах хлора.
Хлорная вода имеет запах хлора.
Метол. гидрохинон.. фенидон
В состав светочувствительной эмульсии входит бромистое серебро. В состав проявителя — бромистый калий.
Бром
Галогены делают серебро чувствительным к свету и позволяют вести обработку, усиливающую чувствительность в миллионы раз. Металлическое серебро, полученное в результате проявки, создаёт изображение, а бромистое незасвеченное легко выводится дешёвым тиосульфатом натрия в раствор или промывную воду.
Галогены в процессе проявки не участвуют. Проявляющие вещества — метол, гидрохинон, фенидон и др. — слабые восстановители — восстанавливают серебро из галоидного до металлического.
Галоидное серебро, (хлористое и бромистое) входят в состав фотоэмульсии пленок. В состав ф\эмульсии фотобумаг может входить также йодид серебра.
3. Метод возгонки хлора при взаимодействии хлорной извести с аммиачной селитрой.соляной кислоты, в которой растворяют 7 г йодида калия, а затем 3,5 г кристаллического йода. Второй раствор готовят следующим образом в 125 мл воды растворяют 25 г хлорной…
Второй раствор готовят следующим образом в 125 мл воды растворяют 25 г хлорной…
Дагерротипия -это что такое? Когда придумали? Используется в настоящее время?
Придумана на заре освоения фотографии… не думаю что сегодня кто-то использует (если интересуетесь углублённо -есть смысл поискать в инете).
2.3. Взаимодействие йодида калия с перекисью водорода.Перекись водорода окисляет сульфид свинца и образуется белый осадок сульфата свинца. 2.6. Взаимодействие натрия с водой.
Дагеротипия — одно из первых названий фотографии.
Дагеротипия создана французским изобретателем Жозефом Нисефором Ньепсом ок. 1822 года и обнародована художником Луи Дагером в 1839 году
Зеваю… Неужели Яндекс Вас забанил? https://ru.wikipedia.org/wiki/Дагеротипия
Дагероти́пия или дагерроти́пия (англ. daguerreotypy) — ранний фотографический процесс, основанный на использовании светочувствительной посеребрённой медной пластинки. Первый способ получения позитивного изображения непосредственного на фотоматериале, на который производится съёмка.
Химический процесс получения фотографии разработанный Луи Манде Дагером на основе идей Жозефора Ньепса в 30-х годах XIX века. Несмотря на то, что начал свое триумфальное шествие в 1837-м во Франции, затем был представлен на промышленных выставках в Германии, Австрии и России, постепенно угас из-за сложности и дороговизны. Вытеснен «амбротипией» и негатив-позитивными процессами уже к концу 50-х годов. Однако, до сих пор есть энтузиасты, работающие с медными посереберными пластинками и цианистым калием в качестве фиксажа.
Междунароное сообщество дагеротипистов
http://www.cdags.org/
В дополнение к ссылке к Википеди, если там не найдете эту ссылку.
Как качественная реакция по определению золота может быть использована взаимодействие золотохлористводородной кислоты с раствором йодида калия Также в этой реакции можно использовать хлорную воду которую получают взаимодействием хлора с водой
Помогите ПлиЗ, решить задачку по химии!!!
В сторону йодида калия
Получают взаимодействием иода с гидроксидом калия или восстановлением иодата калия углем. Йодид калия лекарственное средство Potassium iodide Химическое соединение ИЮПАК Иодид калия Брутто формула
Йодид калия лекарственное средство Potassium iodide Химическое соединение ИЮПАК Иодид калия Брутто формула
Определите содержимое посуды
Хлорная известь
Вообем береться насыщенный раствор йодида калия,моющее средство и добавляеться перекись,выделяеться кислород,вспенивается моющее средство и получается много пены. Я никак понять не могу как тут кислород…
Найдите степени окисления и напишите названия бинарных соединений 2 столбца
Si(+4)C(-4) карбид кремния
Al(+3)Br(-)3 бромид алюминия
Fe(+2)O(-2) оксид железа (II)
Cl(+7)2O(-2)7 оксид хлора (VII)
Mg(+2)I(-)2 йодид магния
K(+)H(-) гидрид калия
Ca(+2)F(-)2 фторид кальция
Fe(+3)Cl(-)3 хлорид железа (III)
Zn(+2)3N(-3)2 нитрид цинка
Ag(+)2S(-2) сульфид серебра
Основными недостатками хлорной извести являются постоянное снижение активного хлора, сложность хранения, плохая растворимость в воде.Хорошо растворяются в растворе йодида калия, а также спирте, эфире и других органических растворителях.
Si(+4)C(-4) карбид кремния
Al(+3)Br(-)3 бромид алюминия
Fe(+2)O(-2) оксид железа (II)
Cl(+7)2O(-2)7 оксид хлора (VII)
Mg(+2)I(-)2 йодид магния
K(+)H(-) гидрид калия
Ca(+2)F(-)2 фторид кальция
Fe(+3)Cl(-)3 хлорид железа (III)
Zn(+2)3N(-3)2 нитрид цинка
Si(+4)C(-4) карбид кремния
Al(+3)Br(-)3 бромид алюминия
Fe(+2)O(-2) оксид железа (II)
Cl(+7)2O(-2)7 оксид хлора (VII)
Mg(+2)I(-)2 йодид магния
K(+)H(-) гидрид калия
Ca(+2)F(-)2 фторид кальция
Fe(+3)Cl(-)3 хлорид железа (III)
Zn(+2)3N(-3)2 нитрид цинка
Ag(+)2S(-2) сульфид серебра
Si(+4)C(-4) карбид кремния
Al(+3)Br(-)3 бромид алюминия
Fe(+2)O(-2) оксид железа (II)
Cl(+7)2O(-2)7 оксид хлора (VII)
Mg(+2)I(-)2 йодид магния
K(+)H(-) гидрид калия
Ca(+2)F(-)2 фторид кальция
Fe(+3)Cl(-)3 хлорид железа (III)
Zn(+2)3N(-3)2 нитрид цинка
Ag(+)2S(-2) сульфид серебра
Помогите, пожалуйста, химики!
Помогите пожалуйста сделать химию 🙁
А что именно вам непонятно, в этих достаточно простых задачах? Задавайте конкретные вопросы — отвечу
Она окисляется кислородом воздуха, нитритом натрия, дихроматом калия, перманганатом калия и другими окислителями. Реакция является фармакопейной. 2. Хлорная вода при взаимодействии с растворами йодидов окисляет йодид-ион в молекулярный йод, который…
Реакция является фармакопейной. 2. Хлорная вода при взаимодействии с растворами йодидов окисляет йодид-ион в молекулярный йод, который…
Из чего сделан антистрес
Ретинола пальмитат (вит. А) 1500 МЕ
бетакаротен (вит. А) 1500 МЕ
D,L-α-токоферола ацетат (вит. E)60 МЕ
колекальциферол (вит. D3)250 МЕ
фитоменадион (вит. К) 25 мкг
аскорбиновая кислота (вит. С) 120 мг
тиамина гидрохлорид (вит. B1)15 мг
рибофлавин (вит. B2)10 мг
никотинамид (вит. В3)40 мг
кальция пантотенат (вит. B5)20 мг
пиридоксина гидрохлорид (вит. B6)6 мг
фолиевая кислота (вит. Bc)400 мкг
цианокобаламин (вит. B12)18 мкг
биотин (вит. Н) 40 мкг
калий (в форме хлорида) 80 мг
кальций (в форме фосфата и цитрата) 100 мг
магний (в форме оксида) 40 мг
фосфор (в форме кальция фосфата) 48 мг
железо (в форме фумарата) 18 мг
медь (в форме оксида) 2 мг
цинк (в форме оксида) 15 мг
марганец (в форме сульфата) 4 мг
йод (в форме калия йодида) 150 мкг
молибден (в форме натрия молибдата) 75 мкг
селен (в форме натрия селената) 70 мкг
хром (в форме хлорида) 120 мкг
никель (в форме сульфата) 5 мкг
ванадий (в форме натрия метаванадата) 10 мкг
бор (в форме натрия бората) 60 мкг
олово (в форме хлорида) 10 мкг
кремний (в форме диоксида) 4 мг
хлор (в форме калия хлорида) 73.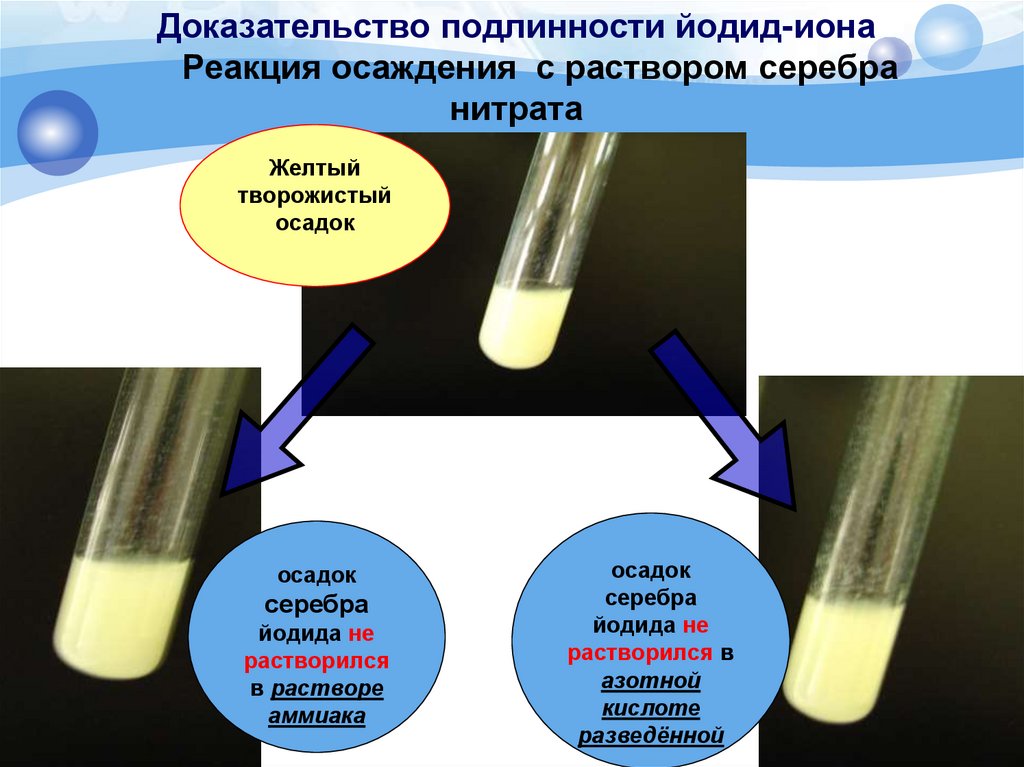 2 мг
2 мг
экстракт листьев гинкго билоба59 мг
экстракт корня женьшеня1 мг
2. Составить уравнения реакций окисления йодида калия концентрированной серной кислотой15. Хлороводород в лаборатории можно получить. А кипячением хлорной воды .
Подущка из маленьких шариков пенопласта.
В основном из рекламы.
Какой именно?
Тесты по химии за 8 класс)
При пропускании хлора в 400 г йодида калия получено 50.8 г галогена. Какова была массовая доля соли в исходном
Cl2 + 2KI = I2 + 2KCl
ищем по таблице M всех веществ
зная M хлорида калия составляем пропорцию 332 149 вычисляем массу хлорида калия179.5
400 х
составляем новую пропорцию и вычисляем массу хлора = 85.5г
складываем 85.5+400 = 485.5 масса всего раствора
400\485.5=0.82=82%
Ответ: 82%(с огруглением)
Почему растворимость иода в воде увеличивается, если в ней содержится раствор нный йодид калия или натрия 157.Какие это вещества Что происходит с хлорной водой при ее хранении на свету 182.
Чем морская соль отличается от обычной, каменной? Это такой же натрий хлор? Химические цепочки различаются ?
Полезная она, добывается из моря
В пробирки с раствором бромида и иодида натрия внести по 3-4 капли хлорной воды, а в пробирку с раствором иодида натрия — столько же бромной воды.- Составить уравнение реакции взаимодействия дихромата калия с йодидом калия, учитывая, что дихромат калия…
Какие цепочки? Это же не органика, а кристалл с ионным строением. Единственная разница — примеси.
В морской соли кроме натрия и хлора есть, в том или ином количестве, почти все элементы периодической таблицы. Иначе говоря, она богата минералами. И некоторые из них вполне даже полезны для человека.
На вкус более соленая, в приготовлении пищи нужно делать на это поправку.
После очистки и расфасовки ни какой разницы, то что морская полезнее это миф, у обоих одно и тоже происхождение.
Поваренная соль (она же каменная, галит) в чистом (беспримесном) виде представляет собой кристаллы всего одного соединения — NaCl.
В морской же соли находятся, кроме хлоридов, еще и йодиды, и фториды, и бромиды. Более того, в морской воде присутствуют сульфаты, карбонаты, соединения фосфора и черт знает что еще. С другой стороны, в ней наличествуют не только соединения натрия, но и калия, магния, кальция и, в микроскопических дозах, — всех остальных элементов, включая золото.
Получение и свойства хлорной воды. 1. Растворение хлора в воде. Насытить 5-10 мл дистиллированной воды хлором.2. Взаимодействие растворов йодида и бромида калия с хлорной водой.
Помогите кто нибудь с химией
Могу помочь советом: в тетрадке с дз сдай учителю 1000Р, глядишь и 5 поставит
Взаимодействие хлора с растворами бромида и йодида калия. Хлорная вода. Пробирку с 5 7 мл дистиллированной воды поместите в стакан со льдом и водой и пропустите хлор, очищенный от следов хлороводорода, до насыщения.
Посмотри, как подобные задачи решали.
Я хочу узнать про микстуру Вотчала, которую изготавливают в аптеке.

Микстура Вотчала (содержит Зг эуфиллина, 0,4 (0,6) г эфедрина, 16 г калия йодида, 200 мл дистиллированной воды) применяется по 1 чайной (детям в возрасте до 5 лет), 1 десертной (6 — 10 лет), 1 столовой (старше 10 лет) ложке 4 раза в день с молоком.
2KI Cl2 2KCl I2. Хлорная вода выделяет из растворов йодидов свободный йод, который окрашивает предварительно прилитый индикатор сероуглерод или хлороформ в красновато-фиолетовый цвет, а раствор крахмала в синий .
Йод позеленел
Если хотел чтото получить по вычитанной цепочке реакций то посмотри фих хим свойства всех полностью продуктов реакции. Если мешал на угад то забудь. Если нужен иод без всяких примесей промой его слабощёлочным раствором. Влажный отложи у баночку. Промывные води содержат йодид калия или натрия. Если капнуть сюда сульфат ртути то моментально выпадет ярко красный осадок йодида ртути (как качественная реакция) . Достать иод из прозрачного раствора можно добавив перекиси водорода и серной кислоты (электролит) . оно будет булькать кислородом и выбрасывать на дно хлопья иода. Вобщем весь мокрый иод. Надо попытаться заморозить вода отстоится сверху её иглой надо собрать и (очистить от иода) . Осушить можно продувая над иодом воздух уже сухой (из хлоркальциевой трубки осушителя) . Потом сублимируешь его у колбу он там будет водой а потом закристализуется. Но посуда должна быть на шлифах. Иначе большие потери. Иод может просачиваться сквозь неплотную пластмассу. Она для него какбы немного рыхлая.
оно будет булькать кислородом и выбрасывать на дно хлопья иода. Вобщем весь мокрый иод. Надо попытаться заморозить вода отстоится сверху её иглой надо собрать и (очистить от иода) . Осушить можно продувая над иодом воздух уже сухой (из хлоркальциевой трубки осушителя) . Потом сублимируешь его у колбу он там будет водой а потом закристализуется. Но посуда должна быть на шлифах. Иначе большие потери. Иод может просачиваться сквозь неплотную пластмассу. Она для него какбы немного рыхлая.
К 2мл раствора йодида калия прилейте несколько капель хлорной воды. Отметьте признаки реакции. Повторите опыт, заменив раствор йодида калия раствором бромида калия.
Какое явление наблюдается при смешивании йодида калия и хлора? ? Срочно
Решите пожалуйста умоляю все что в ваших силах
Помогите решить несколько задач! Я вас очень прошу, очень нужно. Осталось всего лишь 9 штук, а решить не могу.
Уу
Образовавшуюся при этом иодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
Полученный оксид прореагировал с угарным газом. Запишите уравнения описанных реакций.
А их и было 9. Ну что ж, спасти твою жизнь, конечно, можно… При условии предварительного согласования размера благодарности и способа ее выражения. На халяву не проскочишь.
Даны три раствора: хлорид калия, бромид калия, иодид калия.
Хлор будет реагировать с бромидом калия и йодидом калия
Cl2+2KBr⇒2KCl+Br2
Cl2+2KY⇒2KCl+Y2
бром будет реагировать только с йодидом калия
Br2+2KY⇒2KBr+Y2
химическая активность галогенов возрастает от йода к фтору. фтор самый активный галоген. более сильный галоген может вытеснять из солей более слабый
Взаимодействие галогенидов с хлорной водой. Хлор вытесняет бром и иод из их соединений.В каждую из пробирок добавляем равный объем хлорной воды. В пробирке с иодидом калия выделился иод
Химия помогите пожалуйста! какую массу соли можно получить если
2 Г смеси хлорида калия и йодида калия растворили в воде. Через раствор пропустили хлор в избытке, после чего
Прошу помощи с химией, 1 задачка 9 класс
Помогите с примерами по химии, все ответы есть, но не могу понять почему они такие
1)хлором и йодидом натрия
3)хлорид железа (III)
4) с водой
5) свежеполученный гидроксид меди (II)
6) при атмосферном давлении
7) хлорид магния
остальное сам
Химические свойства. Растворимость в воде. при 6 C 128 г 100 мл.Получают взаимодействием иода с гидроксидом калия или восстановлением иодата калия угл м.Йодид калия лекарственное средство .
Растворимость в воде. при 6 C 128 г 100 мл.Получают взаимодействием иода с гидроксидом калия или восстановлением иодата калия угл м.Йодид калия лекарственное средство .
Галогены в водном растворе и реакции их замещения | Эксперимент
- Пять из пяти
Этот классный эксперимент или демонстрация исследует некоторые химические свойства галогенов, сравнивая цвета трех галогенов в водном растворе и в неполярном растворителе, а также наблюдая их отбеливающие свойства и реакции замещения
Галогены в небольшой степени реагируют с водой, образуя кислые растворы с отбеливающими свойствами. Они также вступают в окислительно-восстановительные реакции с галогенидами металлов в растворе, вытесняя менее реакционноспособные галогены из их соединений. Эти реакции замещения используются для установления порядка реакционной способности в группе 17 периодической таблицы Менделеева.
Эти реакции замещения используются для установления порядка реакционной способности в группе 17 периодической таблицы Менделеева.
Эта серия простых экспериментов иллюстрирует некоторые химические свойства галогенов после знакомства с физическими свойствами элементов группы 17. Это может быть сделано как демонстрация или как эксперимент класса.
Исследование растворимости галогенов в неполярном растворителе может быть опущено или показано только в качестве демонстрации.
Если действие проводится в виде демонстрации, оно должно занять около 15 минут. Если это делается в качестве эксперимента в классе, вы должны выделить 30 минут.
Оборудование
Аппаратура
- Защита глаз
- Штатив для 10 пробирок
- Пробирки x10
- Пробковые или резиновые пробки, 4 шт.
- Пластиковые пипетки-капельницы x 6
- Белая пятнистая плитка
- Белая плитка
- Стеклянный стержень
- Бумажные полотенца или салфетки
Химикаты
- Около 10 см 3 каждого из следующих растворов галогенов в закрытых пробирках (см.
 примечания 1 и 2):
примечания 1 и 2):- Хлорная вода, 0,1% (вес/объем) (ВРЕДНО)
- Бромная вода, 0,1% (вес/объем) (ВРЕДНО)
- Раствор йода, 0,1 М
- Половина пробирки с 0,1 М растворами каждого из следующих веществ:
- Калий хлорид
- Бромид калия
- Калия йодид
- Универсальная индикаторная бумага (полоски около 2 см), 3 шт.
Опционально
- Циклогексан (ЛЕГКОВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) или другой подходящий неполярный растворитель, около 10 см 3 (см. примечание 1)
Заметки о химических веществах
- Каждая группа учащихся должна быть снабжена закупоренными пробирками, содержащими около 10 см 3 каждого из водных растворов галогенов и один раствор циклогексана (по желанию).
- Растворы галогенов могут быть дополнительно разбавлены, чтобы свести к минимуму количество выделяемых паров хлора или брома, но они не должны быть разбавлены настолько, чтобы их характерные цвета не были четко видны в пробирках (для хлорной воды может потребоваться белый фон).

- По окончании экспериментов все смеси и растворы должны быть возвращены в подходящий контейнер для отходов в вытяжном шкафу для безопасной утилизации.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Позаботьтесь о том, чтобы ограничить воздействие паров хлора и бромной воды на учащихся. У некоторых учащихся с респираторными заболеваниями может проявляться аллергическая реакция на хлор, начало которой может быть отсрочено.
- Хлорная вода, Cl
- Бромная вода, Br 2 (водн.), (ВРЕДЕН) – см. карточку опасности CLEAPSS HC015b и книгу рецептов CLEAPSS RB017.

- Раствор йода, I 2 (водн.) — см. карточку опасности CLEAPSS HC054 и книгу рецептов CLEAPSS RB050. Раствор йода на самом деле представляет собой йод, растворенный в водном растворе йодида калия.
- Растворы хлорида калия, KCl (водн.), бромида калия, KBr (водн.) и йодида калия, KI (водн.) представляют НИЗКУЮ ОПАСНОСТЬ — см. карту опасности CLEAPSS HC047b и книгу рецептов CLEAPSS RB068. Соли натрия можно использовать, если соли калия недоступны. Концентрацию раствора йодида калия следует отрегулировать таким образом, чтобы при добавлении хлорной воды он давал раствор светло-коричневого цвета. Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода.
- Циклогексан, C 6 H 12 (л), (ЛЕГКО ОГНЕОПАСНО, ВРЕДНО, ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC045b.
Процедура
Галогены в воде и углеводородном растворителе (дополнительно)- Налейте около 2 см 3 каждого из водных растворов галогенов в отдельные пробирки.

- Дайте осесть двум слоям. Наблюдайте и записывайте цвет каждого слоя. Может потребоваться еще раз встряхнуть пробирки, чтобы больше галогена перешло из воды в углеводородный слой.
- Поместите лист универсальной индикаторной бумаги на белую плитку. Перенесите каплю хлорной воды на бумагу с помощью стеклянной палочки. Наблюдайте и записывайте цвет бумаги.
- Повторите шаг 2, используя раствор йода.
- Используя пластиковую пипетку, капните по две капли раствора хлора в каждую из трех лунок на пятне, как показано ниже.
 Таким же образом и с помощью чистой пластиковой пипетки для каждого раствора добавьте в пятнистую плитку бромную воду и раствор йода.
Таким же образом и с помощью чистой пластиковой пипетки для каждого раствора добавьте в пятнистую плитку бромную воду и раствор йода.
Источник: Королевское химическое общество
С помощью пластиковой пипетки добавьте хлорную воду, бромную воду и раствор йода в углубления на пластинке для пятен.
- Добавьте по две капли раствора хлорида калия в каждую из трех лунок в столбце 1 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
- Добавьте по две капли раствора бромида калия в каждую из трех лунок в столбце 2 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
- Добавьте по две капли раствора йодида калия в каждую из трех лунок в столбце 3 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
Дополнительно

Учебные заметки
Для записи результатов можно использовать таблицу результатов, подобную приведенной ниже. Он был завершен с ожидаемыми наблюдениями.
Углеводородный слой: от бесцветного до бледно-желто-зеленого
Краснеет, затем быстро обесцвечивается
Нет реакции
Появляется желто-оранжевый цвет брома
Появляется коричневый цвет йода
Водный слой: от желто-оранжевого до бесцветного
Углеводородный слой: от бесцветного до бледно-желто-оранжевого
Краснеет, затем медленно обесцвечивается
Нет реакции
Нет реакции
Цвет темнеет от желто-оранжевого до коричневого
Водный слой: от коричневого до бесцветного
Углеводородный слой: от бесцветного до фиолетового
Бумага окрашена в коричневый цвет
Нет реакции
Нет реакции
Нет реакции
Галогены более растворимы в углеводороде и перемещаются в этот верхний слой при встряхивании с углеводородным растворителем. Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода характерно изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода характерно изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Если между раствором галогена и раствором галогенида не происходит реакции замещения, может наблюдаться некоторое осветление цвета раствора, что можно объяснить эффектом разбавления.
Позаботьтесь о том, чтобы ограничить воздействие паров хлора и бромной воды на учащихся. У некоторых учащихся с респираторными заболеваниями может проявляться аллергическая реакция на хлор, начало которой может быть отсрочено.
Йод является наименее растворимым из галогенов в воде. Он более растворим в растворе йодида калия, поэтому «раствор йода» здесь на самом деле является йодом в растворе йодида калия.
Обратите внимание учащихся на сходство цвета паров йода с его цветом в неполярном растворителе. Полярные молекулы воды взаимодействуют с молекулами йода, изменяя длину волны света, который они поглощают.
Все три галогена реагируют с водой с образованием сильной кислоты (HX) и слабой кислоты (HOX), которая обладает отбеливающими свойствами и является окислителем.
X 2 (водн.) + H 2 O(ж) → HX(водн.) + HOX(водн.)
Степень реакции уменьшается вниз по группе 17. С йодом она настолько мала, что кислая и отбеливающая свойства раствора в этом эксперименте не проявляются.
В реакциях замещения хлор вытесняет бром и йод из их соединений, а бром вытесняет йод. Например:
Cl 2 (водн.) + 2KI (водн.) → I 2 (водн.) + 2KCl (водн.)
Следовательно, порядок реакционной способности следующий: хлор > бром > йод. Более продвинутая обработка идентифицирует галогены как окислители, принимающие электрон с образованием ионов галогенидов:
Cl 2 (водн.) + 2I — (водн.) → I 2 (водн.) + 2Cl — (aq)
Вопреки мнению многих студентов, эта реакция не имеет ничего общего с реакционной способностью калия, «захватывающего» хлор. Калий присутствует здесь только в виде очень нереакционноспособных ионов калия (ионов-спектаторов) в растворе.
Калий присутствует здесь только в виде очень нереакционноспособных ионов калия (ионов-спектаторов) в растворе.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
- Пять из пяти
Калия йодид, 0,5% вес.
 /об., для хлора, диоксид хлора
/об., для хлора, диоксид хлора27,60 $
27 $ и выше
| Изображение | Артикул | Описание | Упаковка | Размер | Количество | Цена | Добавить в корзину |
|---|---|---|---|---|---|---|---|
| LC197001 | Калия йодид, 0,5% мас./об., для хлора, диоксид хлора | Эмбер Поли | 500 мл | 1 каждый | |
Пользовательский… | |
| LC197007 | Калия йодид, 0,5% мас./об., для хлора, диоксид хлора | Белый Поли | 125 мл | 1 каждый | 00″> 27 долларов |
Пользовательский… |
Калия йодид, 0,5% мас./об., для хлора, диоксид хлора
| Артикул | ЛК197001 | ЛК197007 |
|---|---|---|
| Номер CAS | 7681-11-0 | 7681-11-0 |
| Сборники Ссылки | APHA 4500-Cl F,G, 4500-ClO₂ D (20-е изд.
|

 примечания 1 и 2):
примечания 1 и 2):


 Таким же образом и с помощью чистой пластиковой пипетки для каждого раствора добавьте в пятнистую плитку бромную воду и раствор йода.
Таким же образом и с помощью чистой пластиковой пипетки для каждого раствора добавьте в пятнистую плитку бромную воду и раствор йода.
Leave A Comment