а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия; в) сульфата цинка, хлорида магния и орто-фосфата натрия; г) хлорида железа (III) и сульфата магния. При сливании каких растворов реакции обмена пойдут д
Источник:  Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
Решебник
по
химии
за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №3
к главе «Глава I §§ 4-6 стр. 20».
Все задачи >
Ответ: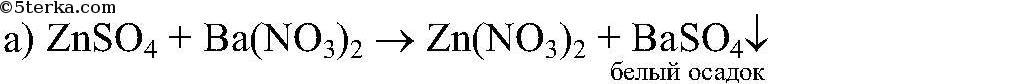 реакция пойдет до конца, т.к.
реакция пойдет до конца, т.к.  выпадает в осадок.
выпадает в осадок. 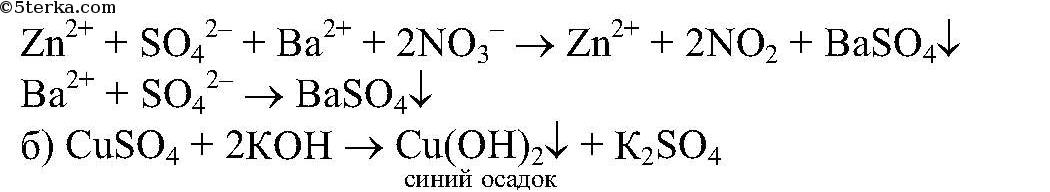
 выпадает в осадок.
выпадает в осадок. 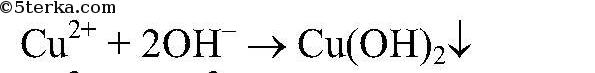
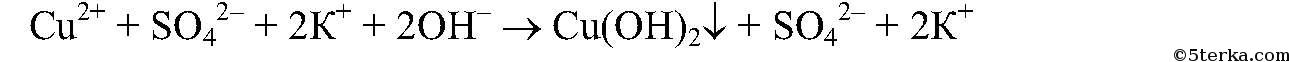 в) Реакции идут до конца,т.к.
в) Реакции идут до конца,т.к. 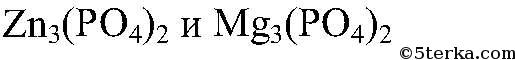

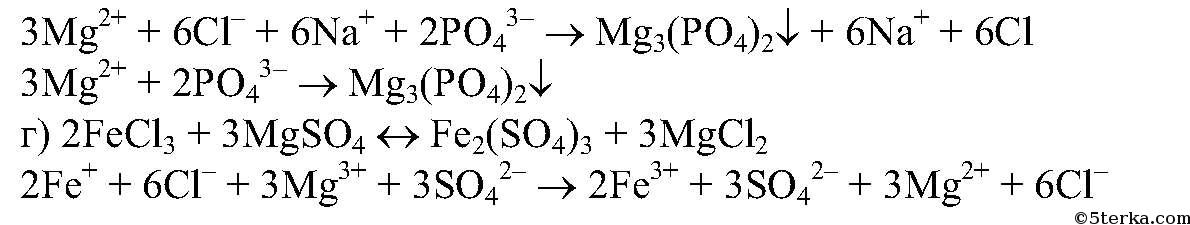
 — растворимая соль;
— растворимая соль; 
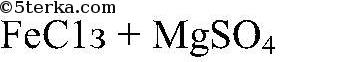 протекать не будет. ← Вопрос № 2 Даны растворы, содержащие ионы Ag+, SO42-,H+,I-. С помощью каких реакций можно определить эти растворы? Напишите уравнения реакций. Вопрос № 4 Даны схемы a) 2H+ + CO32- →; б) 2H+ + S2- →; в) 2H+ + SO32- →. Составьте уравнения реакций в молекулярном виде. →
протекать не будет. ← Вопрос № 2 Даны растворы, содержащие ионы Ag+, SO42-,H+,I-. С помощью каких реакций можно определить эти растворы? Напишите уравнения реакций. Вопрос № 4 Даны схемы a) 2H+ + CO32- →; б) 2H+ + S2- →; в) 2H+ + SO32- →. Составьте уравнения реакций в молекулярном виде. →- Вконтакте
а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия;… решение задачи
ответ:
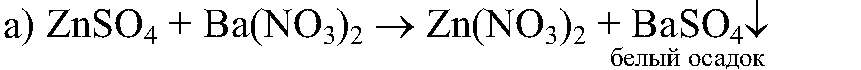 реакция пойдет до конца, т.к.
реакция пойдет до конца, т.к.
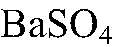 выпадает в осадок.
выпадает в осадок.
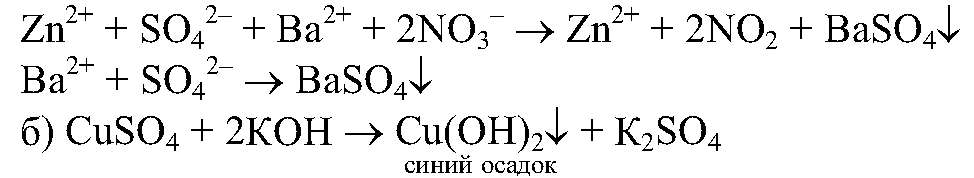 реакция идет до конца, т.к.
реакция идет до конца, т.к.
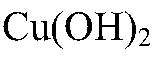
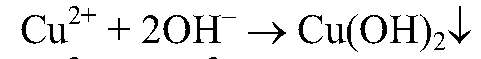
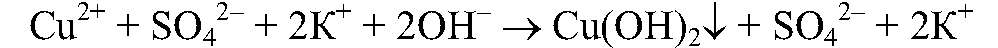 в) реакции идут до конца,т.к.
в) реакции идут до конца,т.к.
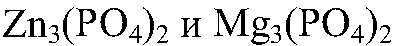
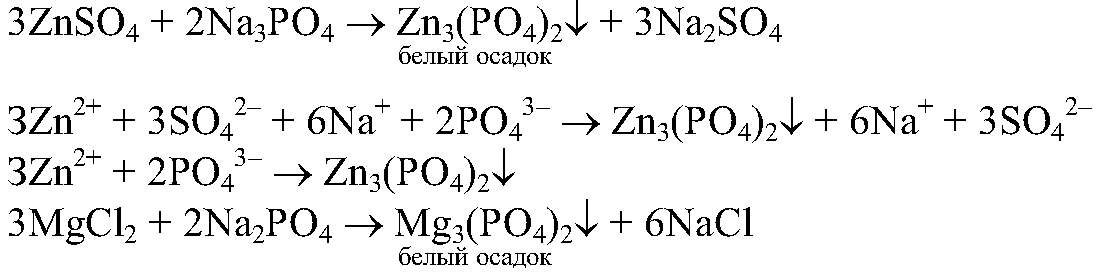
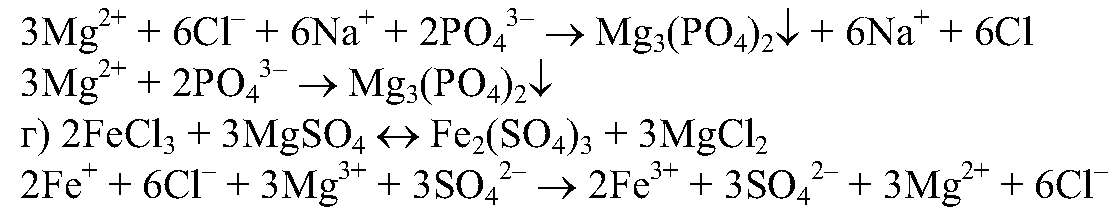
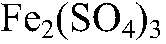 — растворимая соль;
— растворимая соль;
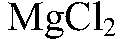
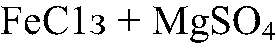 протекать не будет.
протекать не будет.
Физматика Вопрос № 3 Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия; в) сульфата цинка, хлорида магния и орто-фосфата натрия; г) хлорида железа (III) и сульфата магния. При сливании каких растворов реакции обмена пойдут д
| Решебник по химии за 9 класс (Г. Е. Рудзитис, Ф. Г. Фельдман, 1999 год), №3 к главе «Глава I §§ 4-6 стр. 20». Все задачи > |
Условие задачи: Вопрос № 3 Даны растворы: а) сульфата цинка и нитрата бария; б) сульфата меди (II) и гидроксида калия; в) сульфата цинка, хлорида магния и орто-фосфата натрия; г) хлорида железа (III) и сульфата магния. При сливании каких растворов реакции обмена пойдут д
Ответ:
реакция пойдет до конца, т. к.
выпадает в осадок.
Реакция идет до конца, т. к.
выпадает в осадок.
в) Реакции идут до конца, т.к.
нерастворимы.
— растворимая соль;
растворимая соль, значит, реакция
протекать не будет.
Хлорид железа (ⅠⅠⅠ) и кристаллогидрат сульфата магния. Задачи 119
Уравнения реакции осаждения кристаллогидрата сульфата магния и хлорида железа (ⅠⅠⅠ)
Задача 119.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество MgSO
Na2HPO4 . 12H2O, концентрация 6%.
Решение:
Уравнение реакции осаждения:
3MgSO4 . 7H2O + 2Na2HPO4 . 12H2O = Mg3(PO4)2↓ + 2Na2SO4 + Н2SO4 + 19H2O
Так как вещества реагируют в химических реакциях равным чис¬лом грамм-эквивалентов, то n
Согласно закону равенства эквивалентов:
Рассчитаем массу Na2HPO4 . 12H2O:
m(Na2HPO4 . 12H2O) = MЭ(Na2HPO4 . 12H2O) . n(Na2HPO4 . 12H2O) = (119,318 . 0,006) = 0,73г.
Теперь рассчитаем объём раствора Na2HPO4 . 12H2O, теоретически необходимый для осаждения 1,20г MgSO
100 : 6 = х : 0,73;
х = (0,73 . 100)/6 = 12,16см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём Na2HPO4 . 12H2O, необходимый для осаждения:
V(Na2HPO4 . 12H2O) = (1,5 . 12,16) = 18,9см3.
Условия осаждения:
Определение осложняется тем, что Mg3(PO4)2 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(Na2HPO4 . 12H2O) = 18,9см3.
Уравнения реакции осаждения хлорида железа (ⅠⅠⅠ)
Задача 120.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество FeCl3, навеска массой 1,00г; осадитель NH4OH, концентрация 12%.
Решение:
Уравнение реакции осаждения:
FeCl3 + 3NH4OH = Fe(OH)3↓ + 3NH4Cl
Так как вещества реагируют в химических реакциях равным чис¬лом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:
Рассчитаем массу NH4OH:
m(NH4OH) = MЭ(NH4OH) . n(NH4OH) = (35 . 0,0062) = 0,215г.
Теперь рассчитаем объём раствора NH4OH, теоретически необходимый для осаждения 1,00г FeCl3 из пропорции:
100 : 12 = х : 0,215;
х = (0,215 . 100)/12 = 1,8см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём NH4OH, необходимый для осаждения:
V(NH4OH) = (1,5 . 1,8) = 2,7см3.
Условия осаждения: Определение осложняется тем, что Fe(OH)3 — аморфное соединение, склонено к уплотнению, что затрудняет последующее отмывание осадка, кроме того при стоянни увеличивается количество примесей, адсорбированных развитой поверхностью аморфного осадка. Поэтому Fe(OH)3 отфильтровывают сразу же после осаждения и кратковременного отстаивания.
Необходимые условия осаждения:
Осаждение ведут в присутствии подходящего электролита-коагулятора (обычно это соли аммония), из нагретого анализируемого раствора нагретым раствором осадителя.
- Осаждение ведут из достаточно концентрированного исследуемого раствора концентрированным раствором осадителя.
- Медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка.
- Повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(NH4OH) = 2,7см3.
Кто решил? Практическая работа 7 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
1. Добавляем раствор соляной кислоты. В пробирке с карбонатом натрия выделяется газ.
Оставшиеся вещества растворяем в воде и к
полученным растворам добавляем фенолфталеин.
В одной пробирке со щелочью раствор розовеет.
К оставшимся растворам добавляем раствор нит-
рата серебра. В пробирке с хлоридом магния обра-
зуется белый осадок.

К оставшемуся раствору добавляем концентри-
рованную серную кислоту и кусочек меди. Нагре-
ваем. Выделяется газ бурого цвета, что свидетель-
ствует о наличие нитрата натрия в пробирке:

2. Ко всем веществам добавляем раствор соляной
кислоты. В пробирке с карбонатом выделяется
углекислый газ:

В пробирке с сульфидом натрия выделяется газ
с запахом тухлых яиц — h3S.

После растворения оставшихся веществ в воде
добавляем раствор сульфата натрия.
В пробирке с нитратом стронция образуется
белый осадок.

К оставшемуся раствору добавляем раствор хло-
рида бария. Образуется белый осадок сульфата
бария:

3. К выданному веществу добавляем раствор
хлорида бария. Выпадает белый осадок, что свиде-
тельствует о наличии сульфат-иона.

При взаимодействии со щелочью или гидрокси-
дом аммония выпадает белый осадок гидроксида
алюминия:

4. Хлорид натрия окрашивает пламя горелки в
желтый цвет.
Хлорид стронция определяем по реакции с суль-
фатом аммония, в результате которой выделится
белый осадок:
Хлорид алюминия доказываем реакцией с гид-
роксидом натрия
5. Растворяем кристаллы в воде и добавляем
раствор NaOH. Образуется зеленый и бурый осадки.

Если сульфат железа (II) содержал Fe3+, то в
зеленом осадке будут прожилки или пятна бурого
цвета.
6. В воду, содержащую MgSО4, добавляем рас-
твор Na2CО3. Образуется белый осадок.

Ионы Mg2+ обуславливают постоянную жест-
кость воды. Такую воду можно умягчить, добавив
раствор карбоната натрия, так как при этом проис-
ходит связывание ионов Mg2+.
В воду, содержащую Са(НСО3)2, добавляем:
раствор Na2CО3, известковое молоко, то есть насы-
щенный раствор Са(ОН)2; кипятим ее. Образуется
белый осадок.

Присутствие Са(НСО3)2 обуславливает времен-
ную жесткость воды. Эту воду можно умягчить
добавлением известкового молока, соды или кипя-
чением, так как все эти процессы сопровождаются
образованием СаСО3.
7.

Реальный ЕГЭ по химии 2020. Задание 34
Представляем вашему вниманию задания 34 из реального ЕГЭ 2020 основного периода (16 июля 2020 года) с подробными видео-объяснениями, текстовыми решениями и ответами.
Реальный ЕГЭ 2020. Задание 34. Вариант 1.
Железную пластину полностью растворили в 500г раствора азотной кислоты. При этом выделилась смесь оксида азота(II) и оксида азота (IV) общим объемом 20,16л. Соотношение атомов кислорода к атомам азота в этой газовой смеси соответственно равно 5:3. Вычислите массовую долю соли в полученном растворе.
Видео-объяснение:
Ответ: 24,6%
Реальный ЕГЭ 2020. Задание 34. Вариант 2.
Смесь оксида алюминия и сульфида алюминия, в которой массовая доля алюминия составляет 50%, растворили в избытке 700г соляной кислоты. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди (II), причём исходные вещества прореагировали без остатка. Вычислите массовую долю соли, образовавшейся при взаимодействии исходной твёрдой смеси с соляной кислотой.
Видео-объяснение:
Ответ: 27,52%
Реальный ЕГЭ 2020. Задание 34. Вариант 3.
Смесь меди и оксида меди (II), в которой массовая доля атомов меди составляет 96%, растворили в концентрированной серной кислоте массой 472 г, взятой в избытке. Полученный газ растворили в минимальном количестве раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%. Вычислите массовую долю соли в растворе, полученном после реакции исходной смеси с кислотой.
Видео-объяснение:
Ответ: 20%
Реальный ЕГЭ 2020. Задание 34. Вариант 4.
К смеси пероксида и оксида бария, где отношение количества атомов бария к количеству атомов кислорода равно 5:9, добавили 490г холодного 20%-го раствора серной кислоты. В результате соединения бария прореагировали полностью, а полученный раствор оказался нейтральным. Найдите массовую долю воды в образовавшемся растворе.
Видео-объяснение:
Ответ: 93,57%
Реальный ЕГЭ 2020. Задание 34. Вариант 5.
Смесь цинка и карбоната цинка, в которой соотношение атомов цинка и кислорола 5:6, обработали 500 г раствора разбавленной серной кислоты. В результате исходная смесь и кислота прореагировали без остатка и выделилось 2,24 л газов (н.у.). К получившемуся раствору прилили 500 г раствора гидроксида натрия с массовой долей 40%. Найдите массовую долю сульфата натрия в получившемся растворе.
Видео-объяснение:
Ответ: 1,4%
Реальный ЕГЭ 2020. Задание 34. Вариант 6.
Смесь твёрдых сульфата железа (II) и сульфата железа (III), в которой соотношение атомов серы и железа 4:3, добавили в подкисленный 5% раствор перманганата калия массой 126,4 г. Все вещества, участвовавшие в окислительно-восстановительной реакции, прореагировали полностью. Расчитайте максимальную массу 20%-го раствора гидроксида натрия, который прореагирует с полученным раствором.
Видео-объяснение:
Ответ: 376 г
Реальный ЕГЭ 2020. Задание 34. Вариант 7.
В холодный раствор серной кислоты добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Видео-объяснение:
Ответ: 40,5%
Реальный ЕГЭ 2020. Задание 34. Вариант 8.
Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в избытке соляной кислоты массой 300 г. После завершения всех реакций масса раствора составила 330 г, а выделившуюся газовую смесь пропустили через 200 г 8%-ного раствор гидроксида натрия. В результате чего один из газов полностью поглотился. Определите массовую долю соли в конечном растворе.
Видео-объяснение:
Ответ: 15,44%
Реальный ЕГЭ 2020. Задание 34. Вариант 9.
Смесь оксида кальция и карбоната кальция, в которой массовая доля кальция 62,5%, растворили в 300 г соляной кислоты, которая была в избытке. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Видео-объяснение:
Ответ: 18,92%
Реальный ЕГЭ 2020. Задание 34. Вариант 10.
Смесь карбида кальция и карбида алюминия, в которой массовая доля углерода 30%, растворили в 547,5 г соляной кислоты, взятой в необходимом стехиометрическом количестве. В полученный раствор добавляли 1260 г 8%-ного раствора гидрокарбоната натрия до завершения реакции. Найдите массовую долю хлороводорода в растворе, в котором растворяли смесь карбидов.
Видео-объяснение:
Ответ: 10%
Реальный ЕГЭ 2020. Задание 34. Вариант 11.
Смесь железной окалины и оксида железа (III), в которой отношение числа атомов железа к числу атомов кислорода 7/10, полностью растворили в 500 г концентрированной азотной кислоты. Для поглощения полученного газа необходимо 20 г 20%-ного раствора гидроксида натрия. Найдите массовую долю соли железа в растворе, полученном после растворения смеси оксидов в кислоте.
Видео-объяснение:
Ответ: 30,77%
Реальный ЕГЭ 2020. Задание 34. Вариант 12.
Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равна 3:2, нагрели с избытком углекислого газа. Образовавшееся вещество растворили в воде и получили раствор массой 600 г. К полученному раствору добавили 229,6 г раствора хлорида железа (III). При этом получился раствор массой 795 г, а массовая доля карбоната натрия в этом растворе составила 4%. Найдите массу оксида натрия в исходной смеси.
Видео-объяснение:
Ответ: 24,8 г
Реальный ЕГЭ 2020. Задание 34. Вариант 13.
В смеси оксида магния и фосфида магния массовая доля атомов магния составляет 54,4%. Для полного растворения этой смеси потребовалось 365 г 34% соляной кислоты. К полученному раствору добавили 232 г 30% раствора фторида калия. Найдите массовую долю хлорида калия в конечном растворе.
Видео-объяснение:
Ответ: 14,88%
Реальный ЕГЭ 2020. Задание 34. Вариант 14.
Смесь оксида лития и нитрида лития с массовой долей атомов лития 56%, растворили в 365 г 20% соляной кислоты, причём все вещества полностью прореагировали. Затем к образовавшемуся раствору добавили 410г 20% раствора фосфата натрия. Найдите массовую долю хлорида натрия в конечном растворе.
Видео-объяснение:
Ответ: 11,96%
Реальный ЕГЭ 2020. Задание 34. Вариант 15.
В растворе хлоридов железа (II) и (III) на 3 иона железа приходится 8 хлорид-ионов. Через 200 г этого раствора пропустили хлор до прекращения реакции. К полученному раствору добавили раствор гидроксида натрия, в результате чего вещества прореагировали без остатка и получили 526,5 г 20% раствора соли. Рассчитайте массовую долю щёлочи в добавленном растворе.
Видео-объяснение:
Ответ: 18,8%
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
Практическая работа №3
Опыт 1. Осуществление цепочки превращений.
MgO + 2HCl ⟶ MgCl2 + H2O
MgO + 2H+ + 2Cl— ⟶ Mg2+ + 2Cl— + H2O
MgO + 2H+ ⟶ Mg2+ + H2O
MgCl2 + 2NaOH ⟶ 2NaCl + Mg(OH)2↓
Mg2+ + 2Cl— + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Mg(OH)2↓
Mg2+ + 2OH— ⟶ Mg(OH)2↓
Mg(OH)2 + H2SO4 ⟶ MgSO4 + 2H2O
Mg(OH)2 + 2H+ + SO42- ⟶ Mg2+ + SO42- + 2H2O
Mg(OH)2 + 2H+ ⟶ Mg2+ + 2H2O
MgSO4 + Na2CO3 ⟶ Na2SO4 + MgCO3↓
Mg2+ + SO42- + 2Na+ + CO32- ⟶ 2Na+ + SO42- + MgCO3↓
Mg2+ + CO32- ⟶ MgCO3↓
Опыт 2. Получение соединений металлов и изучение их свойств.
При добавлении щелочи к хлориду железа (II) образуется осадок темно-зеленого цвета:
FeCl2 + 2NaOH ⟶ 2NaCl + Fe(OH)2↓
Fe2+ + 2Cl— + 2Na+ + 2OH— ⟶ 2Na+ + 2Cl— + Fe(OH)2↓
Fe2+ + 2OH— ⟶ Fe(OH)2↓
Получим из хлорида железа (II) хлорид железа (III), используя в качестве окислителя пероксид водорода:
2FeCl2 + 2HCl + H2O2 ⟶ 2FeCl3 + 2H2O
2Fe3+ + 4Cl— + 2H+ + 2Cl— + H2O2 ⟶ 2Fe3+ + 6Cl— + 2H2O
2Fe3+ + 2H+ + H2O2 ⟶ 2Fe3+ + 2H2O
При добавлении щелочи к хлориду железа (III) образуется осадок рыжего цвета:
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl— + 3Na+ + 3OH— ⟶ 3Na+ + 3Cl— + Fe(OH)3↓
Fe3+ + 3OH— ⟶ Fe(OH)3↓
Опыт 3. Распознавание соединений металлов.
1) Во все пробирки добавить воды.
2) Добавить раствор гидроксида натрия. В пробирках с сульфатом магния и сульфатом цинка образуются осадки:
MgSO4 + 2NaOH ⟶ Na2SO4 + Mg(OH)2↓
Mg2+ + SO42- + 2Na+ + 2OH— ⟶ 2Na+ + SO42- + Mg(OH)2↓
Mg2+ + 2OH— ⟶ Mg(OH)2↓
ZnSO4 + 2NaOH ⟶ Na2SO4 + Zn(OH)2↓
Zn2+ + SO42- + 2Na+ + 2OH— ⟶ 2Na+ + SO42- + Zn(OH)2↓
Zn2+ + 2OH— ⟶ Zn(OH)2↓
При дальнейшем добавлении раствора гидроксида натрия, в пробирки с выпавшими осадками, в одной из пробирок произойдет растворение осадка:
Zn(OH)2 + 2NaOH ⟶ Na2[Zn(OH)4]
Zn(OH)2 + 2Na+ + 2OH— ⟶ 2Na+ + [Zn(OH)4]—
Zn(OH)2 + 2OH— ⟶ [Zn(OH)4]—
В пробирке, где произошло растворение осадка, находился сульфат цинка, а где не растворился осадок – находился сульфат магния.
3) В две пробирки с нераспознанным веществами добавим соляную кислоту, в пробирке с карбонатом кальция будет наблюдаться выделение газа:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl— ⟶ Ca2+ + 2Cl— + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
4) В оставшуюся пробирку (с сульфатом натрия) добавим хлорид бария, выпадет белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl— ⟶ 2Na+ + 2Cl— + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Преимущества хлорида магния
Для клеточной детоксикации и очищения тканей наиболее эффективной формой магния является хлорид магния, который оказывает сильное выделительное действие на токсины и застойные энергии, застрявшие в тканях тела, вытягивая их через поры кожи. Хлорид необходим для выработки большого количества желудочной кислоты каждый день, а также для стимуляции ферментов , переваривающих крахмал.
Согласно Дэниелу Рейду, автору книги Дао детокса , сульфат магния, широко известный как английская соль, быстро выводится через почки и поэтому плохо усваивается.Это частично объясняет, почему воздействие ванн с английской солью длится недолго и почему вам нужно больше сульфата магния в ванне, чем хлорида магния, чтобы получить аналогичные результаты. Хлорид магния легко усваивается и метаболизируется в организме человека.

Хлопья хлорида магния
Помимо своих функций как электролита, хлорид соединяется с водородом в желудке, образуя соляную кислоту, мощный пищеварительный фермент, который отвечает за расщепление белков, абсорбцию других металлических минералов и активацию внутреннего фактора, который, в свою очередь, поглощает витамин B12.
Использование других солей магния менее выгодно, потому что они все равно должны преобразовываться в хлориды в организме. Мы можем использовать магний в виде оксида или карбоната, но тогда нам нужно произвести дополнительную соляную кислоту для их поглощения. Многие стареющие люди, особенно с хроническими заболеваниями, которые отчаянно нуждаются в большем количестве магния, не могут производить достаточное количество соляной кислоты и, следовательно, не могут поглощать оксид или карбонат.
Хлорид — очень важный и жизненно важный минерал, необходимый как для жизни человека, так и для животных.Без хлорида человеческое тело не смогло бы поддерживать жидкость в кровеносных сосудах, проводить нервную передачу, двигать мускулами или поддерживать надлежащую функцию почек. Как основной минерал-электролит в организме, хлорид выполняет множество функций и быстро выводится из организма.
Раствор хлорида магния не только безвреден для тканей, но также оказывает сильное влияние на лейкоцитарную активность и фагоцитоз; поэтому он идеально подходил для лечения внешних ран. — Д-р Жан Дурлах
Нужно больше магния? ПОЛУЧИТЬ СЕЙЧАСДоктор.Жан Дурлах и др. Из Университета П. М. Кюри в Париже написали статью об относительной токсичности сульфата магния и хлорида магния. Они пишут: «Причина токсичности фармакологических доз магния с использованием сульфат-аниона, а не хлорид-аниона, возможно, может быть связана с соответствующими химическими структурами обеих солей магния. С химической точки зрения и MgSO4, и MgCl2 представляют собой гекса-водные комплексы. Однако кристаллы MgCl2 состоят из дианионов с магнием, координированным с шестью молекулами воды в виде комплекса, [Mg (h3O) 6] 2+, и двух независимых анионов хлорида, Cl-.В MgSO4 седьмая молекула воды связана с сульфат-анионом [Mg (h3O) 6] 2 + [SO4. h3O]. Следовательно, более гидратированная молекула MgSO4 может иметь химические взаимодействия с параклеточными компонентами, а не с клеточными компонентами, предположительно усиливая токсические проявления при одновременном снижении терапевтического эффекта ».
MgSO4 не всегда является подходящей солью в клинической терапии. MgCl2 кажется лучшей анион-катионной ассоциацией для использования во многих клинических и фармакологических показаниях.[1] -Доктор. Жан Дурлах и др.
Исследователи, изучающие потоки ионов в двух направлениях между матерью и плодом, обнаружили, что использование MgCl2 дает больший положительный эффект и что MgSO4 не может гарантировать потребности плода в обмене натрия и калия, как это может сделать MgCl2. Они также обнаружили, что MgCl2 взаимодействует со всеми обменниками в клеточной мембране, в то время как действие MgSO4 ограничивается параклеточными компонентами без взаимодействия с клеточными компонентами. ДокторДурлах резюмировал, говоря: «MgCl2 взаимодействует со всеми обменниками, в то время как взаимодействие MgSO4 ограничивается параклеточными обменниками, и MgCl2 увеличивает соотношение потоков между матерью и плодом, а MgSO4 снижает его».
Высокие дозы токолитического сульфата магния (MgSO4), вводимые беременным женщинам во время преждевременных родов, могут быть токсичными, а иногда и смертельными для их новорожденных. [2]
Хлорид против хлора
Минеральная добавка хлорида сильно отличается от газового хлора.Элементарный хлор — опасный газ, который не существует в природе в свободном элементарном состоянии из-за его реакционной способности, хотя он широко распространен в сочетании с другими элементами. Однако хлорид связан с хлором, поскольку одним из наиболее распространенных соединений хлора является поваренная соль NaCl. Хлорид — это побочный продукт реакции между хлором и электролитом, таким как калий, магний или натрий, которые необходимы для метаболизма человека. Хлоридные соли необходимы для поддержания метаболизма человека и не имеют эффекта изолированного газообразного хлора.
Хлорид, бромид и йод магния
Доктор Дэвид Браунштейн продвигает использование хлорида магния в качестве «синергической» добавки к лечению йодом. Хлорид конкурирует с бромидом на почечном уровне и увеличивает почечный клиренс бромида [3], таким образом, хлорид магния идеально подходит для добавления магния. Некоторым пациентам требуется до двух лет йодной терапии, чтобы снизить уровень бромида в моче после нагрузки ниже 10 мг / 24 часа, если хлоридная нагрузка не включена в программу детоксикации брома.Доктор Браунштейн говорит: «Как и при использовании любой пищевой добавки, комплексный целостный план лечения обеспечивает наилучшие результаты. Магний — важная часть плана лечения йодом. Дефицит магния очень распространен. Магний — это природное расслабляющее средство. Следует оценить уровни магния (по уровням магния в эритроцитах) и назначить добавки. Добавки магния, вероятно, обеспечат оптимальные результаты с йодом »[4]

Для получения более подробной информации, не стесняйтесь обращаться к моей цифровой версии книги Трансдермальная магниевая терапия по разумной цене, или для более индивидуального подхода посетите мою страницу Консультации.
[1] Исследование магния . Volume 18, Number 3, 187-92, сентябрь 2005 г., оригинальная статья
[2] Mittendorf R, Dammann O, Lee KS. Поражения головного мозга у новорожденных, подвергшихся воздействию высоких доз сульфата магния во время преждевременных родов. Отделение акушерства и гинекологии, Медицинский центр Университета Лойола, Мейвуд, Иллинойс, США. J Perinatol, 2005, 1 декабря; DOI: 10.1038 / sj.jp.7211419.
[3] Раус, А.Г., Обзор фармакокинетики бромид-иона. Fd. Chem. Toxic., 21: 379-382, 1983
. .Ангидрат сульфата магния — Купить продукт безводного сульфата магния на Alibaba.com
Ангидрат сульфата магния
I. Физические и химические свойства:
Гептагидрат сульфата магния (молекулярная формула MgSO4 • 7h3O), также известный как горькая сера, горькая соль, соль Эпсома , белый или бесцветный игольчатый или косой столбчатый кристалл, без запаха, прохладный и слегка горький.
Форма: белые или бесцветные кристаллы, без запаха, прохладные и слегка горькие, растворимые в воде, слабо растворимые в этаноле, легко превращаются в порошок на воздухе (в сухом виде), постепенно очищаются от кристаллической воды до безводного сульфата магния, когда с подогревом.
Внешний вид и характер: относится к ромбической системе, это четырехугольный зернистый или ромбический кристалл, бесцветный, прозрачный, агрегат белый, розовый или зеленый стеклянный блеск. Форма может быть волокнистой, игольчатой, гранулированной или порошковой.Без запаха, горький привкус.
Китайское название | Гептагидрат сульфата магния | Английское название | Гептагидрат сульфата магния |
Химическая формула | MgSO4 · 7h3O | ||
Молекулярная масса | 246.47 | Номер CAS | 10034-99-8 |
Номер EINECS | 231-298-2 | Температура плавления | 1124 ℃ |
Водорастворимый h3O: | h3O: 1 M при 20 ° C, прозрачный, бесцветный | плотность | .68 |
Вид снаружи | Белый порошок | Растворимость: | растворим в воде, мало растворим в этаноле и глицерине |
Технические показатели
Внешний вид | Белый гранулированный | |||
Содержание% мин. | ≥99.5% | |||
MgSO4 | ≥48,59% | |||
MgO | ≥16,27% | |||
Mg% | 9,83 9003 | 9,89,8 PH (5 мас. / Об.% Раствор.) | 5-8 | |
Железо (Fe)% макс. | ≤0,002% | |||
Хлорид (Cl)% макс. | ≤0.02% | |||
Тяжелый металл (в виде Pb)% макс. | ≤0,001% | |||
Мышьяк (As)% макс. | ≤0,0002% | |||
Нерастворим в воде | ≤0,01% | |||
Размер гранул (мм) | 0,1-1,1-3,2-4 |
Три основных функции
1 В основном используется в производстве удобрений, кожи, печати и крашения, катализаторов, бумаги, пластика, фарфора, пигментов, спичек, взрывчатых и огнестойких материалов.Его можно использовать для печати и окрашивания тонкой хлопчатобумажной ткани, шелка, в качестве утяжелителя хлопкового шелка и упаковки изделий из капока; в медицине используется как английская соль.
2, в качестве обогатителя пищи. Правила Китая могут использоваться для молочных продуктов в количестве 3 ~ 7 г / кг; количество, используемое в напитках и молочных напитках, составляет 1,4 ~ 2,8 г / кг; максимальная дозировка в минеральных напитках составляет 0,05 г / кг.
3. В основном используется с кальциевой солью для воды сакэ, а добавление 4,4 г / 100 л воды может улучшить жесткость на 1 градус.Универсальная вода будет иметь горький вкус и запах сероводорода.
4. Используется для дубления, производства взрывчатых веществ, изготовления бумаги, фарфора, удобрений, слабительных средств для приема внутрь и добавок к минеральной воде.
Сульфат магния используется в сельском хозяйстве в качестве удобрения, так как он является одним из основных компонентов хлорофилла. Он часто используется для выращивания горшечных растений или культур с недостатком магния, таких как помидоры, картофель, розы и т. Д. Сульфат магния имеет преимущество более высокой растворимости, чем у других удобрений.Сульфат магния также используется в качестве соли для ванн.
IV. Характеристики хранения и транспортировки
Меры предосторожности при транспортировке:
1. Упаковка должна быть укомплектованной, а загрузка должна быть безопасной. Во время транспортировки контейнер не должен протекать, складываться, падать или иметь повреждения.
2. Строго запрещено смешивать с кислотами и пищевыми химикатами и избегать смешанного хранения.
3, во время транспортировки следует предотвратить попадание солнца, дождя, высокую температуру.Транспортные средства после транспортировки следует тщательно очистить.
4. Хранить в прохладном и вентилируемом складе. Беречь от огня и тепла.
Зона хранения должна быть оборудована подходящими материалами для поглощения утечки.
V. Эксплуатация, утилизация и хранение
Примечания по эксплуатации:
1. Работа в закрытом режиме для улучшения вентиляции. Операторы должны быть специально обучены, чтобы строго соблюдать рабочие процедуры. Операторам рекомендуется носить самовсасывающий респиратор с фильтром, химзащитные очки, газопроницаемый комбинезон и резиновые перчатки.Избегайте попадания пыли. Избегайте контакта с кислотами.2
2. Легкая погрузка и разгрузка во время погрузки-разгрузки для предотвращения повреждения упаковки. Оснащен оборудованием для ликвидации утечек. Пустой контейнер может оставлять вредные остатки. Когда концентрация пыли в воздухе превышает норму, необходимо надевать пылезащитный респиратор с самовсасывающим фильтром. Во время аварийно-спасательных работ или эвакуации следует надевать противогазы.
Company Information Co., Ltd является производителем хлорида железа, сульфата железа, хлорида железа, сульфата железа, сульфата алюминия, удаления азота и фосфора, дезодоранта, раствора перекиси водорода, оксида кальция, метабисульфита натрия, с хорошо оборудованными испытательными центрами и прочными техническая сила.
Благодаря широкому ассортименту, хорошему качеству, разумным ценам и стильному дизайну наша продукция широко используется в химической промышленности для очистки сточных вод и в других отраслях промышленности.
Наша продукция широко известна и пользуется доверием пользователей, она может удовлетворить постоянно меняющиеся экономические и социальные потребности.
Мы приветствуем новых и старых клиентов из всех слоев общества, которые хотят связаться с нами для будущих деловых отношений и взаимного успеха!
FAQ
Доставка
Наши партнеры
.Фарма хлорид магния 98% Усп / Бп ранг
медициныФармацевтический хлорид магния 98% Фармакокинетика Фармакопеи США / ВР
Описание продукта
Персонажи:
Белый, без запаха, горький, легко растворимый в воде. Находясь на влажном воздухе, легко намокнуть.
Разлагается до хлористого водорода и оксида магния при высокой температуре.
Наименование продукта | Высококачественная пищевая добавка хлорид магния 46.4% белые хлопья | ||||
Цвет | Белый | ||||
Химическое название | Гексагидрат хлорида магния / магноген | ||||
Чистота | Мин. | Сорт | Food Garde MgCl2 | ||
CAS | 7791-18-6 | ||||
Внешний вид | Белые хлопья / гранулы | Хлорид магния 03 | Цзянсу, Китай | ||
Порт | LIANYUNGANG | ||||
Приложение | 1 .Хлорид магния чаще всего используется для борьбы с пылью и стабилизации дорог. Его второе по распространению использование — контроль льда. Помимо производства металлического магния, хлорид магния также используется для множества других применений: удобрения, минеральные добавки для животных, очистка сточных вод, стеновые плиты, искусственная морская вода, кормовые добавки, текстиль, бумага, огнезащитные средства, цементы и охлаждающий рассол. . Смешанный с гидратированным оксидом магния хлорид магния образует твердый материал, называемый цементом Сореля. 2 . Это соединение также используется в огнетушителях: получается реакцией гидроксида магния и соляной кислоты (HCl) в жидкой форме вместе с водой в газообразном состоянии. 3 .Хлорид магния также используется в нескольких медицинских и местных (связанных с кожей) приложениях. Он использовался в таблетках в качестве дополнительных источников магния, где он служит растворимым соединением, которое не является таким слабительным, как сульфат магния, и более биодоступным, чем гидроксид магния и оксид магния, поскольку не требует желудочной кислоты для производства растворимого иона Mg2 +. . 4 . Его также можно использовать в качестве эффективного анестетика для головоногих моллюсков, некоторых видов ракообразных и некоторых видов двустворчатых моллюсков, включая устриц. MgCl2 также обычно используется в полимеразной цепной реакции (ПЦР). Ион магния необходим как для синтеза ДНК in vivo / vitro. 5 . Его можно использовать в качестве коагулянта при приготовлении тофу и других видов бобовых продуктов 6 . Это необходимое сырье для косметики в качестве минеральных добавок и увлажняющего агента 7 .Это минеральные вещества, обогащающие здоровую пищу, энергетические напитки и другие спортивные напитки. |
Упаковка и доставка
Высококачественная пищевая добавка Хлорид магния 46,4% белые хлопья
Крафт-бумажные мешки по 25 кг + поддон
25 кгПЭ + ПП + поддон
Наши услуги
-Сырье было выбрано из соленого озера, история которого насчитывает 200 миллионов лет, на
меньше примесей и тяжелых металлов.
-Мы прошли сертификацию Hlalal FFC.
-Чтобы соответствовать требованиям CAC, мы создали совершенную систему управления GMP, SSOP, HACCP.
-Это 18 км от порта и железной дороги, поэтому мы наслаждаемся очень удобным транспортным сообщением.
Мы можем изготовить различные химические продукты хлорида магния OEM по запросу.
Если вас интересуют наши продукты, не стесняйтесь обращаться к нам.
FAQ
1.В: вы производитель или торговая компания?
A: Мы являемся производителем. И мы китайско-японская компания.
2. Q: Где находится ваш завод? Как я могу там побывать?
A: Наш завод находится в Цзянсу, Китай, вы можете лететь в Ляньюньган.
3. Q: Min.Order Количество вашей продукции может быть изменено?
A: Да, минимальное количество заказа можно изменить.
4. Q: Каковы условия оплаты?
А: Аккредитив, Т / Т
5.В: Как ваша фабрика относится к контролю качества?
A: Наша фабрика получила сертификаты CIQ, SGS и т. Д.
6. Q: Сколько времени занимает опережающее время?
A: В течение 15 дней после подтверждения.
Уважаемые сэр или мадам, Если у вас есть другие вопросы, мы можем связаться с нами, Спасибо.
.Pharma Grade Mgcl2 7791-18-6 Гранулированная добавка Ингредиенты Хлорид магния
Описание продукта
1. Химическое название: хлорид магния
2. Молекулярная формула: MgCl2 MgCl2 · 6h3O
3. Молекулярный вес: ) 203,30 (гексагидрат)
4. CAS: 7786-30-3 (ангидрат) 7791-18-6 (гексагидрат)
5. Характер: безводный MgCl2 представляет собой белый порошок. Гексагидрат MgCl2 представляет собой белые или серые хлопьевидные белые кристаллические гранулы, легко растворимые в воде.Он гигроскопичен во влажной среде, разлагается на хлористый водород и оксид магния при высокой температуре.
6. Применение: Может использоваться как питательная добавка, коагулятор, стабилизатор. Его также можно использовать для приготовления творога из бобов. Для приготовления творога из бобов использовать рассол (раствор хлорида магния) гораздо лучше, чем гипс. Его также можно использовать в качестве пищевых добавок в других отраслях пищевой промышленности.
7. Упаковка: полиэтиленовый мешок в качестве внутреннего слоя и пластиковый тканый мешок в качестве внешнего слоя.Вес нетто каждого мешка 25 кг.
8. Хранение и транспортировка: Хранить в сухом и вентилируемом складе, вдали от воды и влаги во время транспортировки, аккуратно выгружать, чтобы не повредить. Кроме того, его необходимо хранить отдельно от ядовитых веществ.
Параметры продукта
Спецификация | GB25584-2010 / FCC V | ||
Цвет, статус | кристалл | Белый кристалл | |
Содержание, мас.% | MgCl 2 6h3O | ≥% | 99.0 |
MgCl 2 | ≥% | 46,4 | |
Ca | ≤% | 0,10 | |
Am ≤% | 0,005 | ||
As | ≤% | 0,00005 | |
Pb | ≤% | 0.0001 | |
Сульфаты | ≤% | 0,40 | |
Цветность / градус | ≤ | 30 | |
Нерастворимый в воде 03 ≤% | 0,10 | ||
Прочие детали
1. Упаковка: Внутренний слой упакован в полиэтиленовый мешок, а в качестве внешнего слоя — полиэтиленовый мешок.Вес нетто каждого мешка 25 кг.
2. Хранение и транспортировка:
Следует хранить в сухом и вентилируемом складе, вдали от воды и влаги во время транспортировки, осторожно выгружать, чтобы не повредить. Кроме того, его необходимо хранить отдельно от ядовитых веществ.3. О образце: Бесплатные образцы доступны для потенциальных клиентов.
Упаковка и доставка
Упаковка: 25 кг / полипропилен или крафт-мешок, или индивидуальная упаковка.
Срок поставки: Зависит от вашего количества и наличия на складе.
1. Мешок 25 кг / пп или мешок 25 кг / крафт с поддонами и оберточной пленкой
2. Большой мешок 500/750/1000 кг
3. Картонный барабан по 25 кг
4. Также доступен индивидуальный пакет.
Вы можете выбрать следующие способы доставки: морским, воздушным, наземным или курьером.
Наши услуги
1.Мы можем ответить в течение 12 часов. (Онлайн-сервис)
2. Бесплатные образцы высылаются по вашему запросу.
3. Также доступно небольшое количество.
4. У нас около 10 лет опыта в продажах и производстве.
5. Возможна индивидуальная упаковка.
6. Ваши товары могут быть доставлены в срок.
Информация о компании
LIANYUNAGNG ZHONGHONG CHEMICAL CO., LTD
FAQ
1.Как долго я смогу получить ваш ответ?
A: В течение 12 часов.
2. Могу я получить образцы?
A: Бесплатный образец может быть выслан по вашему запросу.
3. Правильно ли указана цена на странице?
A: Цена указана только для справки, для получения последней информации свяжитесь с нами напрямую.
4. Каковы сроки доставки?
A: обычно 3-5 рабочих дней.
5. Каковы ваши условия оплаты?
A: аккредитив или T / T.
.
Leave A Comment