Энергия ионизации. Степень ионности связи | Задачи 228
Задача 228.
Энергия ионизации атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону 3,45 и 3,61 эВ. для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях.
Решение:
Энергия ионизации – это энергия, которую необходимо затратить для удаления электрона из изолированного, свободного атома, находящегося в основном состоянии, на бесконечно большое расстояние.
Сродство к электрону – это энергия, которая выделяется в результате присоединения электрона электроотрицательным атомом и превращения его в анион.
Таким образом, фтор, обладая большей энергией ионизации, чем хлор, способен сильнее удерживать неспаренный электрон, т.е. проявляет в большей степени неметаллические свойства. Фтор обладает самой высокой электроотрицательностью из всех химических элементов, поэтому обладает более выраженной способностью к образованию ионных соединений, чем хлор.
Обладая меньшей энергией сродства к электрону фтор в большей степени, чем хлор, способен образовывать ионы.
Электронная конфигурация валентного энергетического уровня атомов фтора и хлора может быть представлена формулой ns2np5, т.е на внешнем валентном слое их атомы содержат по семь электронов и, присоединяя недостающий восьмой электрон, превращаются в однозарядные анионы F— и Cl—, которые имеют устойчивую электронную конфигурацию благородного газа аргона.
Таким образом, для фтора более характерно образование ионных соединений, чем для хлора. Фтор и хлор образуют ионы знак заряда, которых
Задача 229.
Указать тип химической связи в молекулах Н2, С12, НСI. Привести схему перекрывания электронных облаков.
Решение:
В молекулах Н2 и Cl2 наблюдается ковалентная неполярная связь, а в HCl – ковалентная полярная.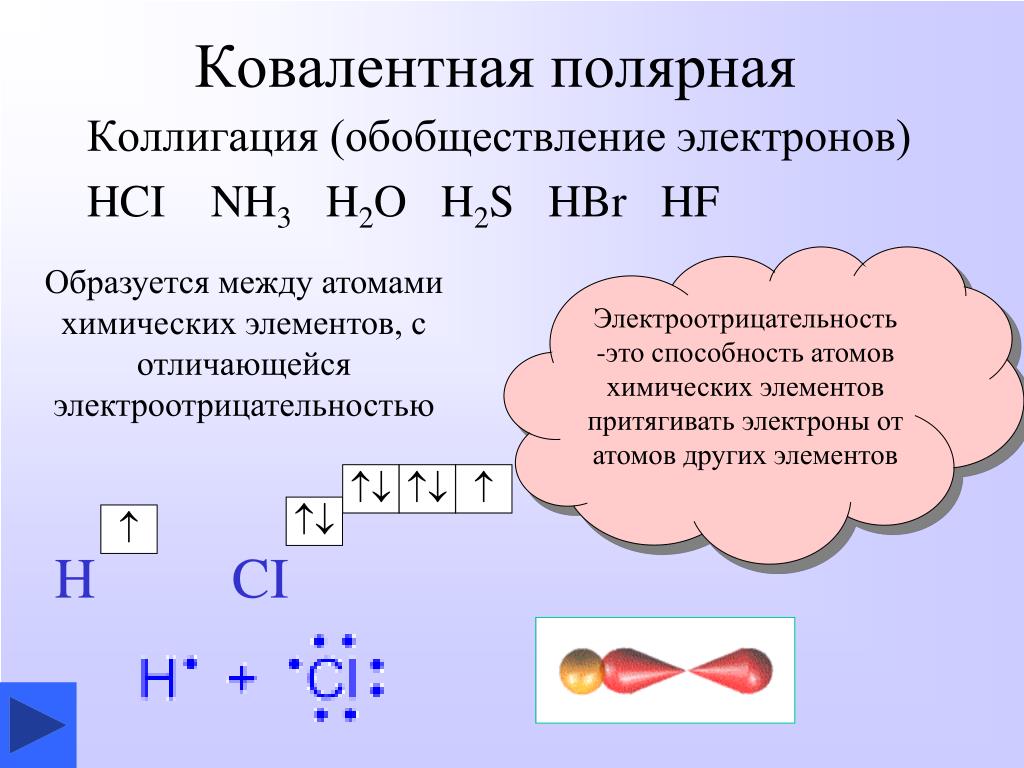
Ковалентная химическая связь образуется двумя электронами от двух разных атомов, причём электроны с противоположно направленными спинами. Эта электронная пара принадлежит одновременно двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Например:
Схемы перекрывания электронных облаков имеют вид:
а) Для Н2.
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов водорода – связь ковалентная неполярная.
б) Для Cl2
Общая электронная пара расположена на одинаковом расстоянии от центров обоих атомов хлора – связь ковалентная неполярная.
в) Для HCl
Общая электронная пара атомов водорода и хлора смещена в сторону более электроотрицательного атома хлора – связь ковалентная полярная.
Во всех случаях перекрывание атомных орбиталей происходит на межъядерной оси, т.е. образуются -связи (сигма-связь).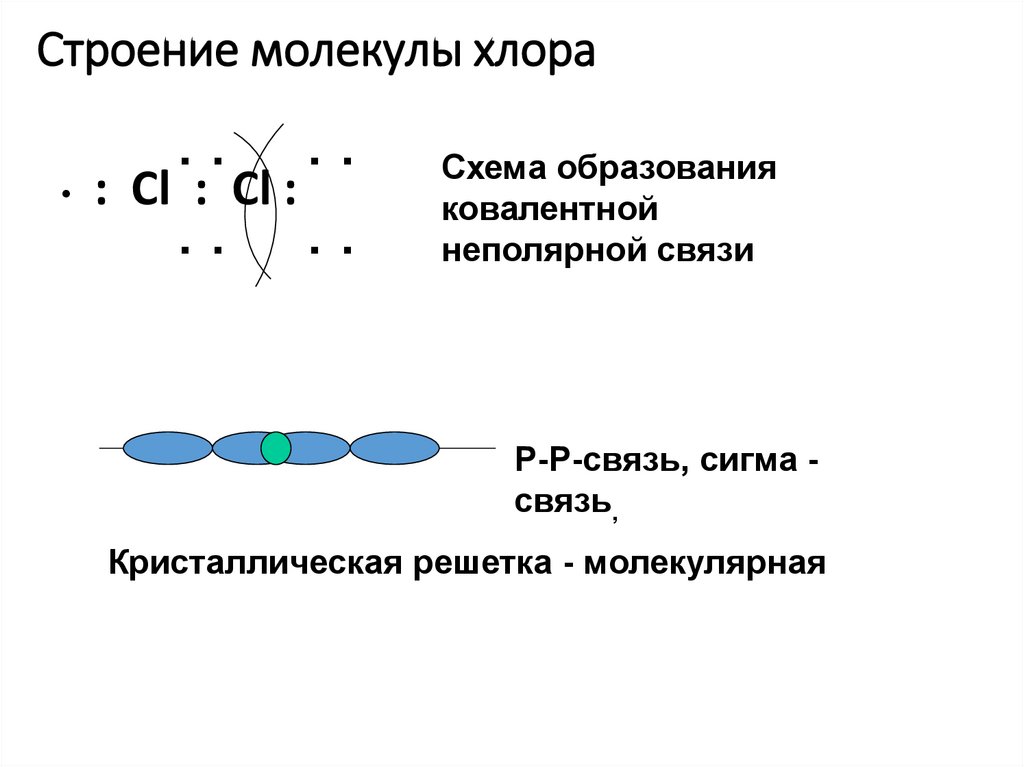
В молекулах Н2 и Cl2 электронная пара расположена на одинаковом расстоянии от атомных ядер, потому что электроотрицательность атомов в молекулах простых веществ Н2 и Cl2 одинаковая, связь ковалентная неполярная. В молекуле HCl электронная пара смещена в сторону более электроотрицательного атома Cl (электроотрицательность Cl равна 2,9, а Н – 2,16), связь ковалентная полярная, образующаяся между разными атомами.
Задача: 230.
Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей К — С1, Са — С1, Fе — С1, Gе — С1. Какая из связей характеризуется наибольшей степенью ионности?
Решение:
По данным таблицы «Относительная электроотрицательность элементов» вычисляем разность электроотрицательностей для связей:
Наибольшей разностью электроотрицательности характеризуется связь K—Cl. Таким образом, связь K—Cl характеризуется наибольшей ионностью, так как она более полярная.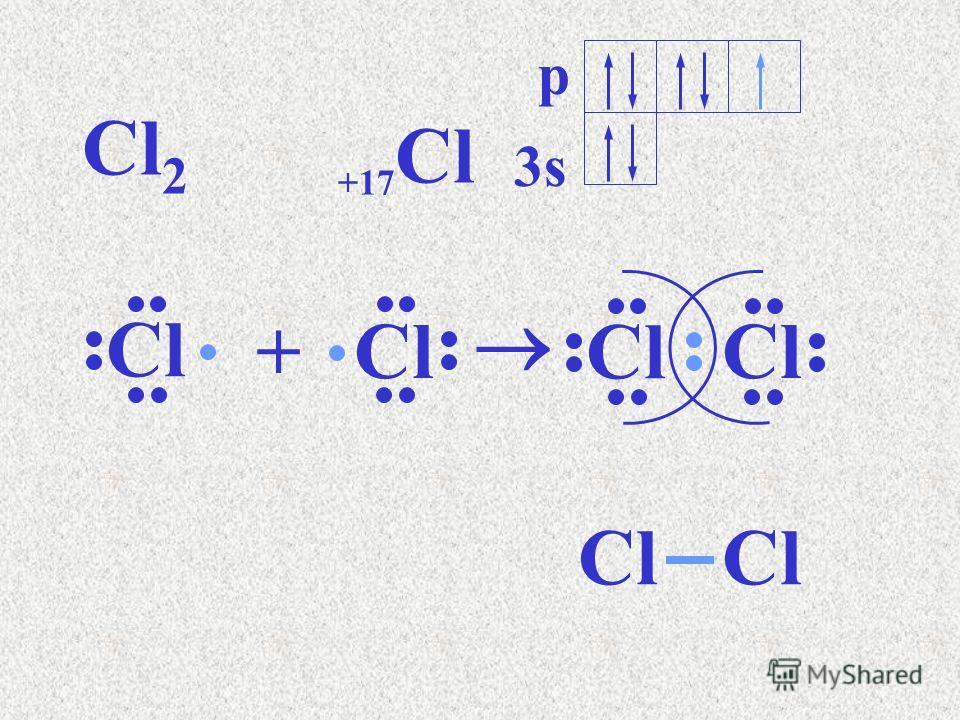 Диссоциация по связи K—Cl в водных растворах будет проходить легче, чем во всех других случаях, при этом образуются ионы:
Диссоциация по связи K—Cl в водных растворах будет проходить легче, чем во всех других случаях, при этом образуются ионы:
KCl ⇔ K+ + Cl—
Задача 231.
Какой характер имеют связи в молекулах NCl3, СS2, JCl5, NF3, OF2, ClF, СО2? Указать для каждой из них направление смещения общей электронной пары.
Решение:
а) При соединении атома азота с тремя атомами хлора образуется молекула NCl3, в которой каждый из трёх атомов хлора связан с атомом азота парой общих электронов (один электрон от атома хлора, другой – от атома азота). Схема молекулы NCl3 имеет вид:
Разность электроотрицательностей связи N—C равна 0,26 ( = 3,16 – 2,9 = 0,26), т. е. имеет незначительное численное значение, значит, связь ковалентная слабополярная (<1). Так как азот более электроотрицательнее (3,16), чем хлор (2,9), то направление смещения общей электронной пары будет в сторону атома азота.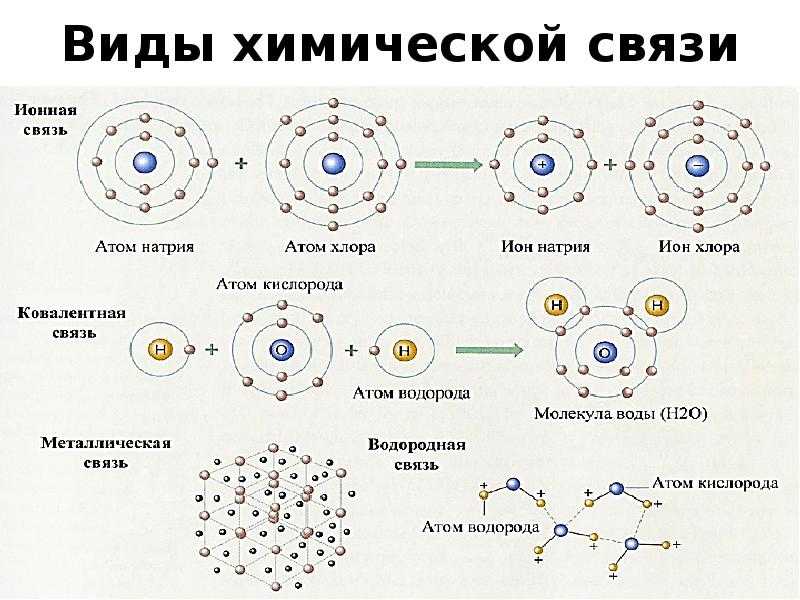
б) При соединении атома углерода с двумя атомами серы образуется молекула СS2, в которой каждый из двух атомов серы связан с атомом углерода двумя парами электронов (два электрона от атома серы и два других от атома углерода). Схема строения молекулы СS
Атом углерода имеет на внешнем электронном слое четыре sp3-гибридных электронных облака, которые перекрываются с электронными облаками четырёх p-электронов атомов серы (по два неспаренных электрона от каждого атома серы). Так как атом углерода более электроотрицательней (2,57), чем атом серы (2,5), то направление смещения общей электронной пары будет в сторону атома углерода. Разность электроотрицательностей связи С—S равна 0,07 ( = 2,57 – 2,5 = 0,07). Связь малополярная, характеризуется ничтожно малой степенью ионности ( <1).
в) При соединении атома йода с пятью атомами хлора образуется молекула JCl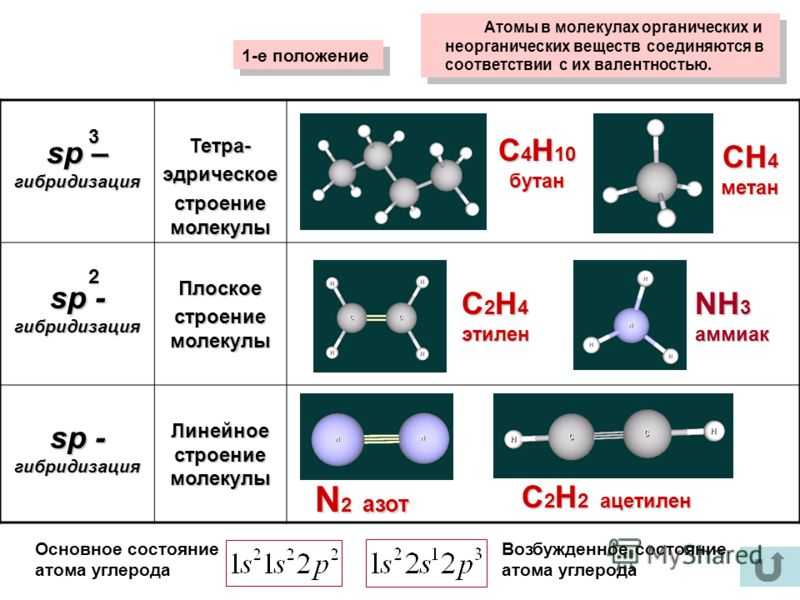 Схема строения молекулы JCl5:
Схема строения молекулы JCl5:
Разность электроотрицательностей связи J—Cl равна 0,62 (= 2,9 – 2, 28 = 0,62), значит, связь ковалентная полярная, в которой наблюдается смещение электронной пары в сторону более электроотрицательного атома хлора. Связь слабополярная, характеризуется небольшой степенью ионности
(<1).
г) При соединении атома азота с тремя атомами фтора образуется молекула NF3
Разность электроотрицательностей связи N—F равна 1,04 (= 4,2 – 3,16 = 1,04). Связь N—F сильно полярна, т.е. характеризуется большой степенью ионности ( >1). Смещение электронной пары связи N—F будет в сторону более электроотрицательного атома – фтору.
д) При соединении атома кислорода с двумя атомами фтора образуется молекула OF2, в которой каждый из атомов фтора соединён с атомом кислорода парой общих электронов (один от атома фтора, другой – от кислорода).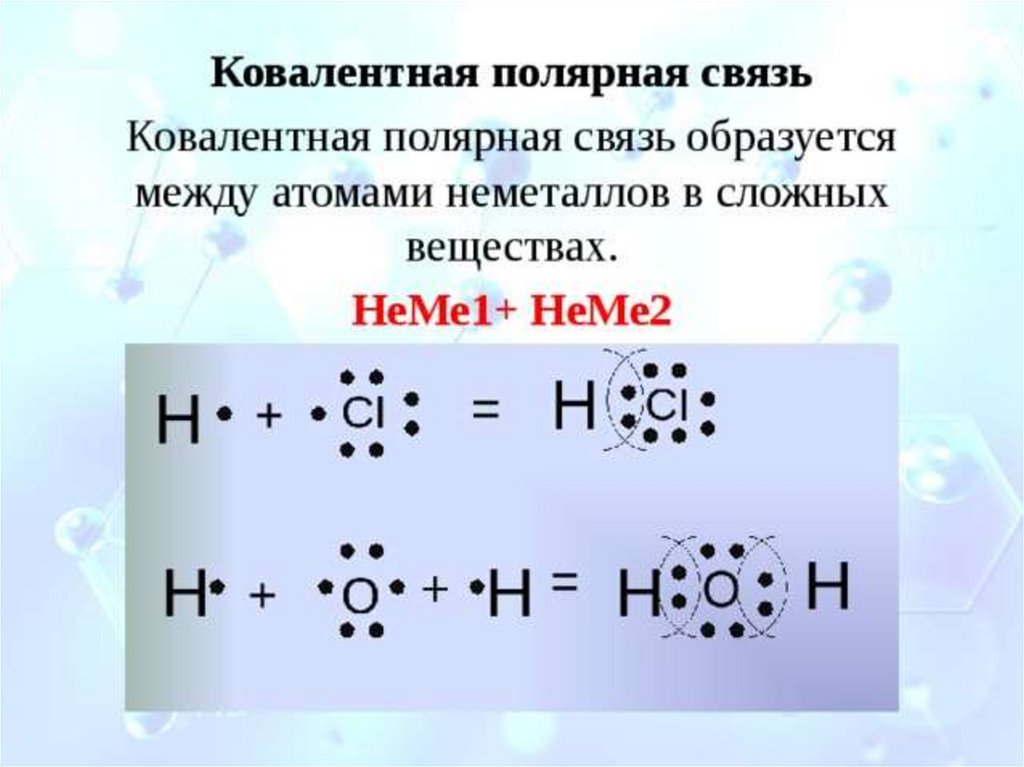
Разность электроотрицательностей связи F—O равна 0,6 (= 4,2 – 3,6 = 0,6), т. е. является ковалентной слабополярной, так как меньше единицы. Смещение электронной пары связи F—O будет в сторону более электроотрицательного атома – фтору.
е) При соединении атома фтора с атомом хлора образуется молекула ClF, в которой атом фтора соединён с атомом хлора электронной парой за счёт одного электрона от атома фтора, другого – от атома хлора. Электронная схема строения молекулы ClF:
Разность электроотрицательностей связи F—Cl равна 1,3 (= 4,2 – 2,9 = 1,3), т. е. имеет большое численное значение, что указывает на большую степень ионности. Связь сильнополярная. Смещение электронной пары связи F—Cl будет в сторону более электроотрицательного атома – фтору.
ж) При соединении атома углерода с двумя атомами кислорода образуется молекула СО2, в которой каждый из двух атомов кислорода связан с атомом углерода двумя парами электронов (два электрона от атома кислорода, другие два – от углерода). Электронная схема строения молекулы СО2:
Электронная схема строения молекулы СО2:
Разность электроотрицательностей связи С—О равна 0,5 = 3,6 – 2,9 = 0,5), т. е. имеет небольшое численное значение, что указывает на слабую степень ионности. Связь слабополярная. Смещение электронной пары связи С—О будет в сторону более электроотрицательного атома – кислороду.
100 ballov.kz образовательный портал для подготовки к ЕНТ и КТА
Для начинающих водителей выбор покрышек для автомобиля может быть очень сложным. Ведь среди огромного ассортимента, необходимо выбрать подходящие изделия с учетом размера колес (ширины и высоты), типа шины, параметров нагрузки и скорости.
Однако учитывая основные характеристики, совершить покупку будет гораздо проще. При этом рекомендуется совершать покупку в крупной торговой сети, где профессиональные консультанты помогут совершить выбор.
Как правильно выбрать покрышки для автомобиля
Решив купить покрышки, в первую очередь определяют сезонность. В регионах, где летом жарко, а зимой холодно, требуется иметь летние и зимние шины. Последние имеют маркировку в виде снежинки или букв M.S. Для регионов с переменным климатом, можно выбрать всесезонные изделия. Далее уделяют внимание следующим характеристикам.
В регионах, где летом жарко, а зимой холодно, требуется иметь летние и зимние шины. Последние имеют маркировку в виде снежинки или букв M.S. Для регионов с переменным климатом, можно выбрать всесезонные изделия. Далее уделяют внимание следующим характеристикам.
- Типу протектора. В зависимости от рисунка, шины бывают симметричными или ассиметричными. От этого зависит эффективность отвода влаги и, соответственно, устойчивость авто. Шины с симметричным рисунком имеют доступную стоимость и пользуются популярностью у водителей. Ассиметричные более дорогие, зато они лучше отводят воду.
- Размеру. Покрышки должны соответствовать размеру колес автомобиля. Данное значение указывается производителем авто и его важно выдерживать.
- Конструкции. Шины могут быть камерными или бескамерными. Многие современные покрышки являются бескамерными. На это указывает маркировка TL или Tubeless.
- Если предстоит покупка только шин без дисков, учитывают посадочный диаметр.
 Значение должно соответствовать диаметру диска.
Значение должно соответствовать диаметру диска. - Нагрузка. Шины имеют допустимый индекс нагрузки. Суммарно, он должен превышать массу автомобиля, при этом значение нагрузки каждой покрышки умножают на число 4.
- Скорость. Покрышки одного размера могут иметь разные индексы скорости. Это допустимое значение, при котором шины сохраняют свои эксплуатационные характеристики. Если Вы предпочитаете быстрое движение, то нужно выбрать покрышки с более высоким уровнем скорости.
Как продлить ресурс использования покрышек
Существует несколько правил, соблюдая которые, можно значительно продлить время использования шин.
- Поддерживать давление воздуха. Это значительно снижает износ покрышек.
- Контролировать вес, который перевозится в автомобиле. Избыточный вес создает дополнительный износ покрышек и увеличивает расход топлива.
- Рекомендуется периодически менять передние и задние покрышки местами, чтобы уравновесить износ.

- Выбирать покрышки надо правильно. Когда шины соответствуют климатическим условиям и стилю вождения, уменьшается их износ.
- Важно регулярно проверять шины на предмет повреждений, таких как порезы и проколы. В случае образования дефекта, его необходимо сразу устранить.
- Вождение без резких торможений и ускорений, помогает продлить срок службы покрышек.
Качественное обслуживание и уход за покрышками продлевают срок их службы, увеличивает безопасность во время поездок.
Ковалентная связь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3619
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице объясняется, что такое ковалентная связь. Он начинается с простого изображения одинарной ковалентной связи.
Он начинается с простого изображения одинарной ковалентной связи.
Важность структур благородных газов
На простом уровне большое значение придается электронным структурам благородных газов, таких как неон или аргон, которые имеют восемь электронов на своих внешних энергетических уровнях (или два в случае гелия). Эти структуры благородных газов считаются в некотором роде «желательными» для атома. Возможно, у вас сложилось сильное впечатление, что когда другие атомы реагируют, они пытаются получить структуру благородного газа. Помимо создания структур благородных газов путем передачи электронов от одного атома к другому, как при ионной связи, атомы также могут достигать этих стабильных структур, разделяя электроны для образования ковалентных связей.
Некоторые очень простые ковалентные молекулы
Хлор
Например, два атома хлора могут образовать стабильные структуры, разделяя один неспаренный электрон, как показано на схеме.
Тот факт, что на одном хлоре электроны отмечены крестиками, а на другом — точками, просто показывает, откуда берутся все электроны.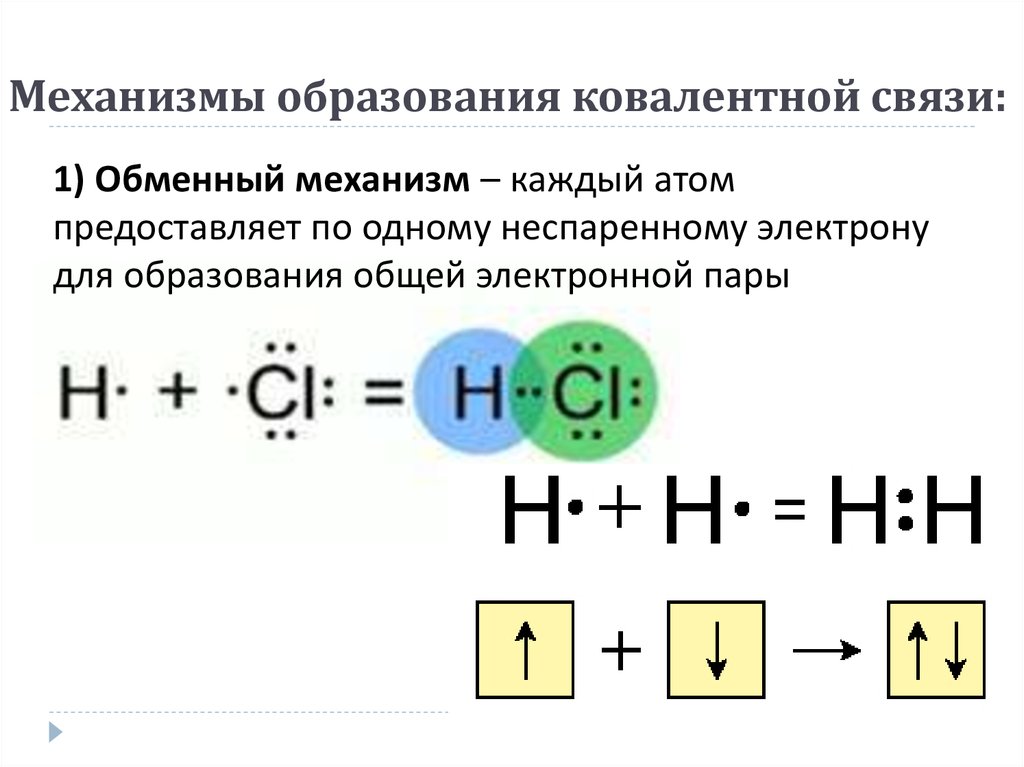 На самом деле между ними нет никакой разницы. Говорят, что два атома хлора соединены ковалентной связью. Причина, по которой два атома хлора слипаются, заключается в том, что общая пара электронов притягивается к ядрам обоих атомов хлора.
На самом деле между ними нет никакой разницы. Говорят, что два атома хлора соединены ковалентной связью. Причина, по которой два атома хлора слипаются, заключается в том, что общая пара электронов притягивается к ядрам обоих атомов хлора.
Водород
Атомам водорода нужно всего два электрона на внешнем уровне, чтобы достичь структуры благородного газа гелия. Опять же, ковалентная связь удерживает два атома вместе, потому что пара электронов притягивается к обоим ядрам.
Хлористый водород
Водород имеет структуру гелия, а хлор — структуру аргона. Большинство простых молекул, которые вы рисуете, на самом деле имеют все атомы со структурой благородного газа. Например:
Даже с более сложной молекулой, такой как \(PCl_3\), проблем нет. В этом случае для простоты показаны только внешние электроны. Каждый атом в этой структуре имеет внутренние слои из 2 и 8 электронов. Опять же, все присутствующее имеет структуру благородного газа.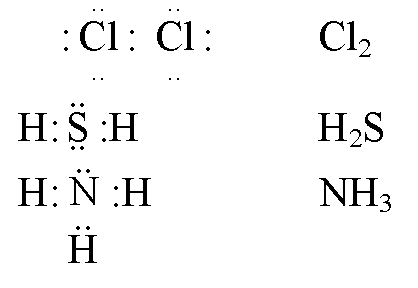
Случаи, когда простая точка зрения вызывает проблемы
Трифторид бора, BF
3Атом бора имеет только 3 электрона на внешнем уровне, и он не может достичь структуры благородного газа путем простого обмена электронов. Это проблема? Нет. Бор образовал максимально возможное количество связей в данных обстоятельствах, и это совершенно правильная структура.
При образовании ковалентной связи высвобождается энергия. Поскольку энергия теряется из системы, она становится более стабильной после образования каждой ковалентной связи. Отсюда следует, что атом будет стремиться образовать как можно больше ковалентных связей. В случае бора в BF 3 три связи являются максимально возможными, потому что бор имеет только 3 общих электрона.
Возможно, вы спросите, почему бор не образует ионных связей с фтором. Бор не образует ионов, потому что полная энергия, необходимая для удаления трех электронов для образования B 3 + ион просто слишком велик, чтобы его можно было восстановить, когда между ионами бора и фтора возникает притяжение.
Хлорид фосфора(V), PCl
5В случае фосфора возможны 5 ковалентных связей — как в PCl 5 . Фосфор образует два хлорида — PCl 3 и PCl 5 . Когда фосфор сгорает в хлоре, образуются оба продукта — большинство продуктов в зависимости от того, сколько хлора доступно. Мы уже рассмотрели структуру PCl 9.0068 3 . Диаграмма PCl 5 (как и предыдущая диаграмма PCl 3 ) показывает только внешние электроны.
Обратите внимание, что у фосфора теперь есть 5 пар электронов на внешнем уровне — это определенно не структура благородного газа. Вы были бы довольны тем, что нарисовали PCl 3 на выпускных экзаменах в школе, но PCl 5 выглядело бы очень тревожно.
Почему фосфор иногда отрывается от структуры благородного газа и образует пять связей? Чтобы ответить на этот вопрос, нам нужно исследовать территорию, выходящую за рамки большинства текущих программ A’level. Не пугайтесь этого! Это не особенно сложно и чрезвычайно полезно, если вы собираетесь понять связь в некоторых важных органических соединениях.
Не пугайтесь этого! Это не особенно сложно и чрезвычайно полезно, если вы собираетесь понять связь в некоторых важных органических соединениях.
Более сложный взгляд на ковалентную связь
Связь в метане, CH
4Что не так с изображением связи в метане, состоящим из точек и крестиков?
Мы начнем с метана, потому что это самый простой случай, который иллюстрирует тип задействованных процессов. Вы помните, что картина метана с точками и крестиком выглядит так.
Существует серьезное несоответствие между этой структурой и современной электронной структурой углерода, 1s 2 2s 2 2p x 1 2p y 1 . Современная структура показывает, что у водородов есть только 2 неспаренных электрона вместо 4, которые требуются в простом представлении.
Вы можете увидеть это более легко, используя обозначение электронов в ящиках. Показаны только двухуровневые электроны. 1s 2 электронов находятся слишком глубоко внутри атома, чтобы участвовать в образовании связи. Единственными электронами, непосредственно доступными для совместного использования, являются 2p-электроны. Почему тогда метан не CH 2 ?
1s 2 электронов находятся слишком глубоко внутри атома, чтобы участвовать в образовании связи. Единственными электронами, непосредственно доступными для совместного использования, являются 2p-электроны. Почему тогда метан не CH 2 ?
Продвижение электрона
При образовании связей высвобождается энергия и система становится более стабильной. Если углерод образует 4 связи, а не 2, высвобождается в два раза больше энергии, и поэтому полученная молекула становится еще более стабильной. Между 2s- и 2p-орбиталями существует лишь небольшая энергетическая щель, поэтому углерод платит за предоставление небольшого количества энергии для продвижения электрона с 2s на пустую 2p, чтобы получить 4 неспаренных электрона. Дополнительная энергия, высвобождаемая при образовании связей, более чем компенсирует первоначальный вклад.
Теперь говорят, что атом углерода находится в возбужденном состоянии. Теперь, когда у нас есть 4 неспаренных электрона, готовых к соединению, возникает другая проблема.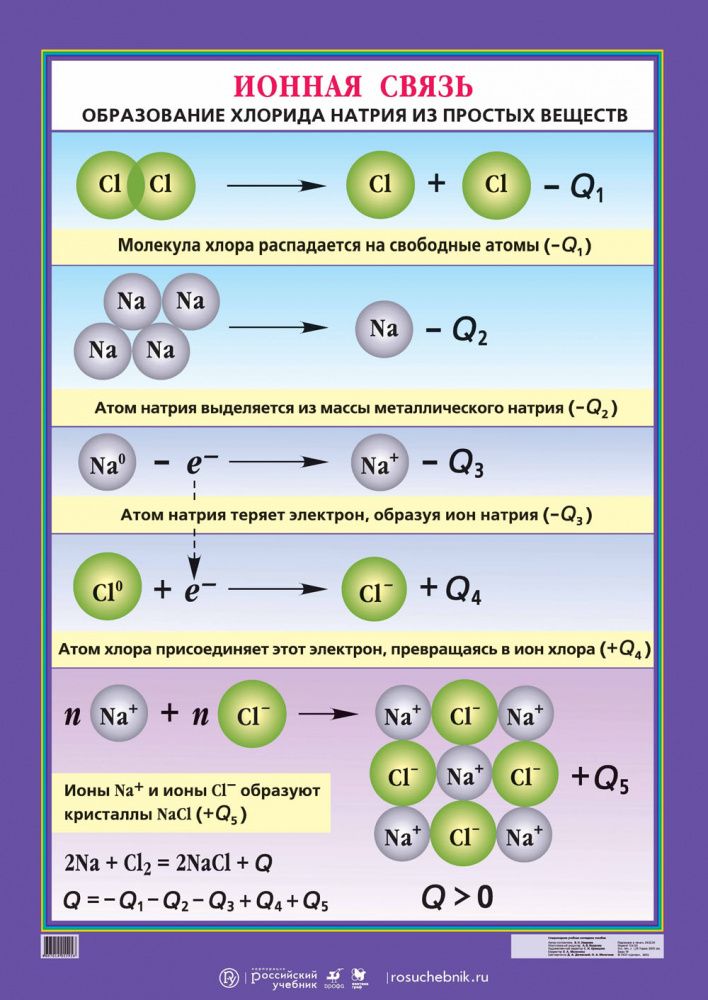 В метане все связи углерод-водород идентичны, но наши электроны находятся на двух разных орбиталях. Вы не получите четырех одинаковых связей, если не начнете с четырех одинаковых орбиталей.
В метане все связи углерод-водород идентичны, но наши электроны находятся на двух разных орбиталях. Вы не получите четырех одинаковых связей, если не начнете с четырех одинаковых орбиталей.
Гибридизация
Электроны снова перестраиваются в процессе, называемом гибридизацией. Это реорганизует электроны в четыре идентичных гибридных орбитали, называемых sp 3 гибриды (поскольку они состоят из одной s-орбитали и трех p-орбиталей). Вы должны читать «sp 3 » как «sp three», а не как «sp в кубе».
sp 3 гибридные орбитали немного напоминают половину р-орбитали, и они располагаются в пространстве так, чтобы быть как можно дальше друг от друга. Вы можете представить себе ядро как находящееся в центре тетраэдра (пирамида с треугольным основанием) с орбиталями, указывающими на углы. Для наглядности ядро нарисовано намного крупнее, чем оно есть на самом деле.
Что происходит, когда формируются связи?
Помните, что электрон водорода находится на 1s-орбитали — сферически симметричной области пространства, окружающей ядро, где существует некоторая фиксированная вероятность (скажем, 95%) найти электрон.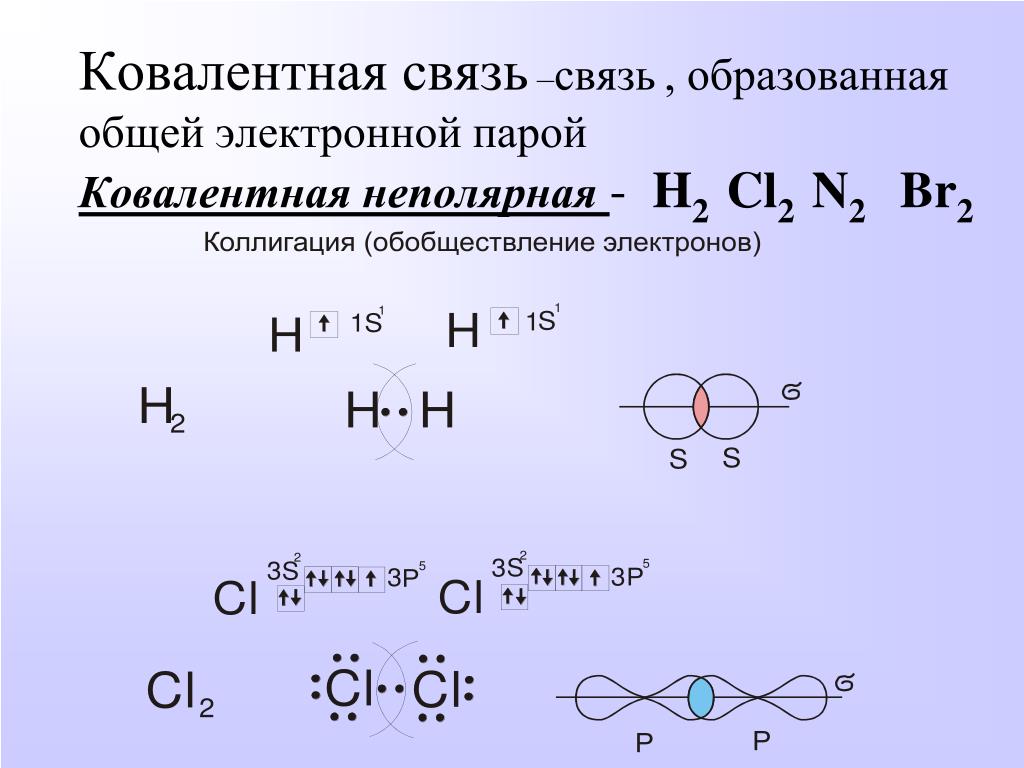 Когда образуется ковалентная связь, атомные орбитали (орбитали в отдельных атомах) сливаются, образуя новую молекулярную орбиталь, которая содержит электронную пару, создающую связь.
Когда образуется ковалентная связь, атомные орбитали (орбитали в отдельных атомах) сливаются, образуя новую молекулярную орбиталь, которая содержит электронную пару, создающую связь.
Образуются четыре молекулярные орбитали, похожие на исходные sp 3 гибриды, но с ядром водорода, встроенным в каждую долю. Каждая орбиталь содержит 2 электрона, которые мы ранее нарисовали в виде точки и креста. Используемые принципы — продвижение электронов, если необходимо, затем гибридизация с последующим образованием молекулярных орбиталей — могут быть применены к любой ковалентно связанной молекуле.
Связывание в хлоридах фосфора, PCl
3 и PCl 5Что не так с простым видом PCl 3 ? На этой диаграмме показаны только внешние (связывающие) электроны.
В этом нет ничего плохого! (Хотя он не учитывает форму молекулы должным образом.) Если бы вы собирались взглянуть на это более современным взглядом, аргумент выглядел бы так:
Фосфор имеет электронную структуру 1s 2 2s 2 2p 6 3s 2 3p x 1 3p y 1 3p z 1 . Если мы посмотрим только на внешние электроны как на «электроны в ящиках»:
Если мы посмотрим только на внешние электроны как на «электроны в ящиках»:
Есть 3 неспаренных электрона, которые можно использовать для образования связей с 3 атомами хлора. Четыре трехуровневых орбитали гибридизуются, образуя 4 эквивалентных гибрида sp 3 , точно так же, как в углероде, за исключением того, что одна из этих гибридных орбиталей содержит неподеленную пару электронов.
Затем каждый из 3 атомов хлора образует ковалентную связь путем слияния атомной орбитали, содержащей его неспаренный электрон, с одним из неспаренных электронов фосфора, образуя 3 молекулярные орбитали. Вы можете задаться вопросом, стоит ли все это заморачиваться! Возможно нет! Стоит с PCl 5 , однако.
Что не так с простым представлением PCl
5 ? Вы помните, что изображение PCl 5 в точках и крестиках выглядит нелепо, потому что фосфор не имеет структуры благородного газа. На этой диаграмме также показаны только внешние электроны.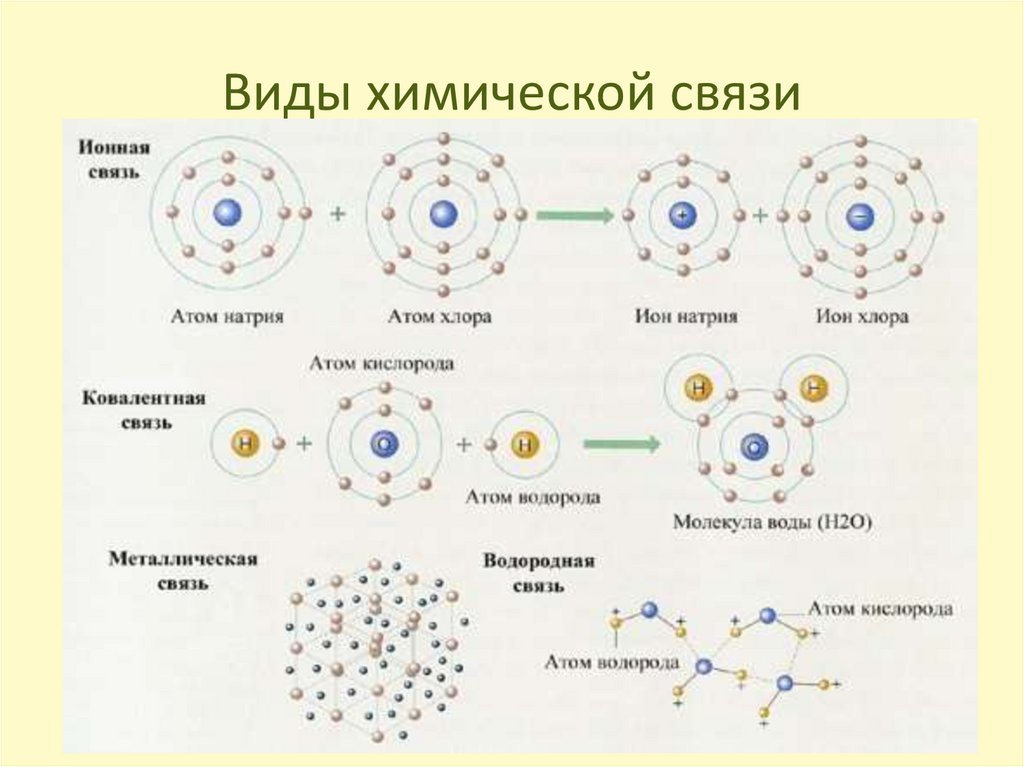
В этом случае более современный вид делает вещи лучше, отказываясь от любых притворных беспокойств о структурах благородных газов. Если фосфор собирается сформировать PCl 5 он должен сначала произвести 5 неспаренных электронов. Он делает это, перемещая один из электронов на 3s-орбитали на следующую доступную орбиталь с более высокой энергией. Какая орбиталь с более высокой энергией? Он использует одну из трехмерных орбиталей. Вы могли ожидать, что он будет использовать орбиталь 4s, потому что это орбиталь, которая заполняется до 3d, когда атомы строятся с нуля. Не так! За исключением случаев, когда вы строите атомы в первую очередь, 3d всегда считается орбиталью с более низкой энергией.
Остается фосфор с таким расположением электронов:
Теперь электроны 3-го уровня перестраиваются (гибридизуются), образуя 5 гибридных орбиталей, все с одинаковой энергией. Их можно было бы назвать sp 3 d гибридами, потому что они сделаны из этого материала.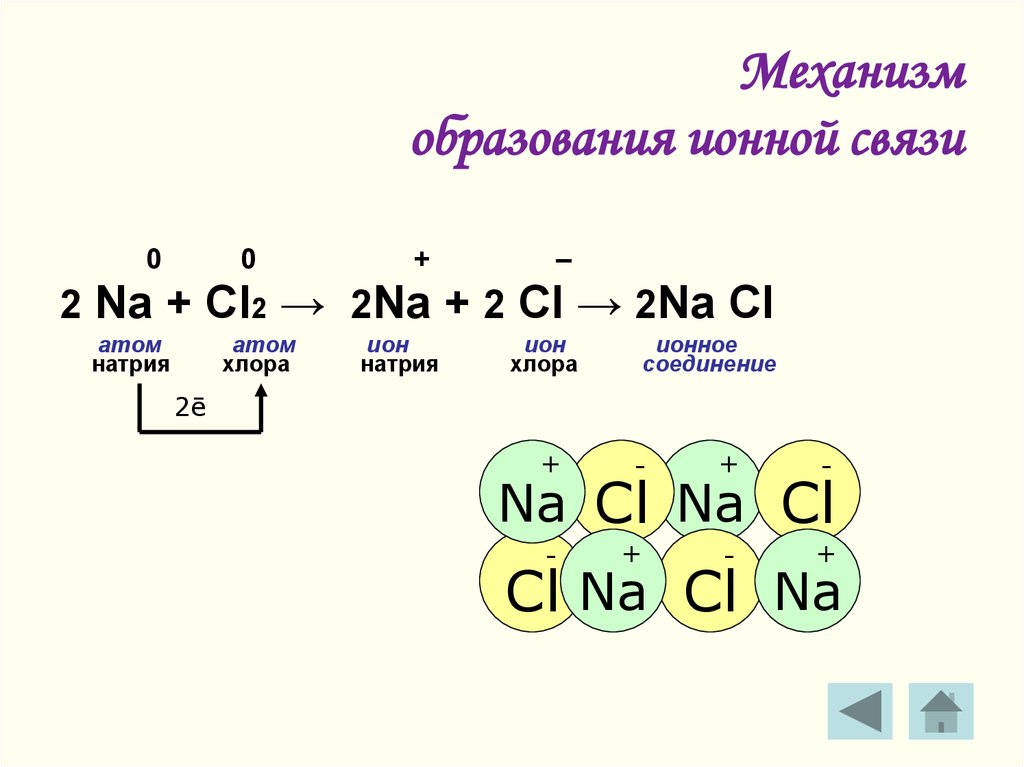
Электроны на каждой из этих орбиталей делили бы пространство с электронами пяти атомов хлора, образуя пять новых молекулярных орбиталей — и, следовательно, пять ковалентных связей. Почему фосфор образует эти дополнительные две связи? Он вкладывает определенное количество энергии для продвижения электрона, которое более чем окупается при образовании новых связей. Проще говоря, фосфору энергетически выгодно образовывать дополнительные связи. Преимущество такого подхода в том, что он полностью игнорирует вопрос о том, есть ли у вас структура благородного газа, и поэтому вы не беспокоитесь об этом.
Несуществующее соединение — NCl
5 Азот находится в той же группе Периодической таблицы, что и фосфор, и можно ожидать, что он образует аналогичный ряд соединений. На самом деле это не так. Например, соединение NCl 3 существует, но такого понятия, как NCl 5 , не существует. Азот 1s 2 2s 2 2p x 1 2p y 1 2p z 1 900. Причина, по которой NCl 5 не существует, заключается в том, что для образования пяти связей азот должен продвигать один из своих 2s-электронов. Проблема в том, что нет никаких 2d-орбиталей, на которые можно было бы перевести электрон, а энергетический зазор до следующего уровня (3s) слишком велик.
Причина, по которой NCl 5 не существует, заключается в том, что для образования пяти связей азот должен продвигать один из своих 2s-электронов. Проблема в том, что нет никаких 2d-орбиталей, на которые можно было бы перевести электрон, а энергетический зазор до следующего уровня (3s) слишком велик.
В этом случае энергии, высвобождаемой при образовании дополнительных связей, недостаточно, чтобы компенсировать энергию, необходимую для продвижения электрона, поэтому этого продвижения не происходит. Атомы будут образовывать столько связей, сколько возможно, если это энергетически выгодно.
Авторы и авторство
Эта страница под названием «Ковалентная связь» используется в соответствии с лицензией CC BY-NC 4.0, автором, ремиксом и/или куратором которой является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Химические связи
Химические связиХимические связи
Когда атомы разных элементов соединяются вместе, они образуют соединения . Знакомые соединения включают обычную поваренную соль (хлорид натрия) и воду. Поваренная соль состоит из комбинации атомов натрия (Na) и хлора (Cl). в соотношении 1:1 с образованием соединения NaCl. Вода представляет собой сочетание водород (H) и кислород (O) в соотношении 2:1 образуют соединение H 2 O.
Существуют различные типы химических связей. Некоторые облигации предполагают перенос электронов. Другие связаны с обменом электронами. Все еще другие связи представляют собой слабые притяжения между молекулами. Давайте посмотрим на каждый тип облигации.
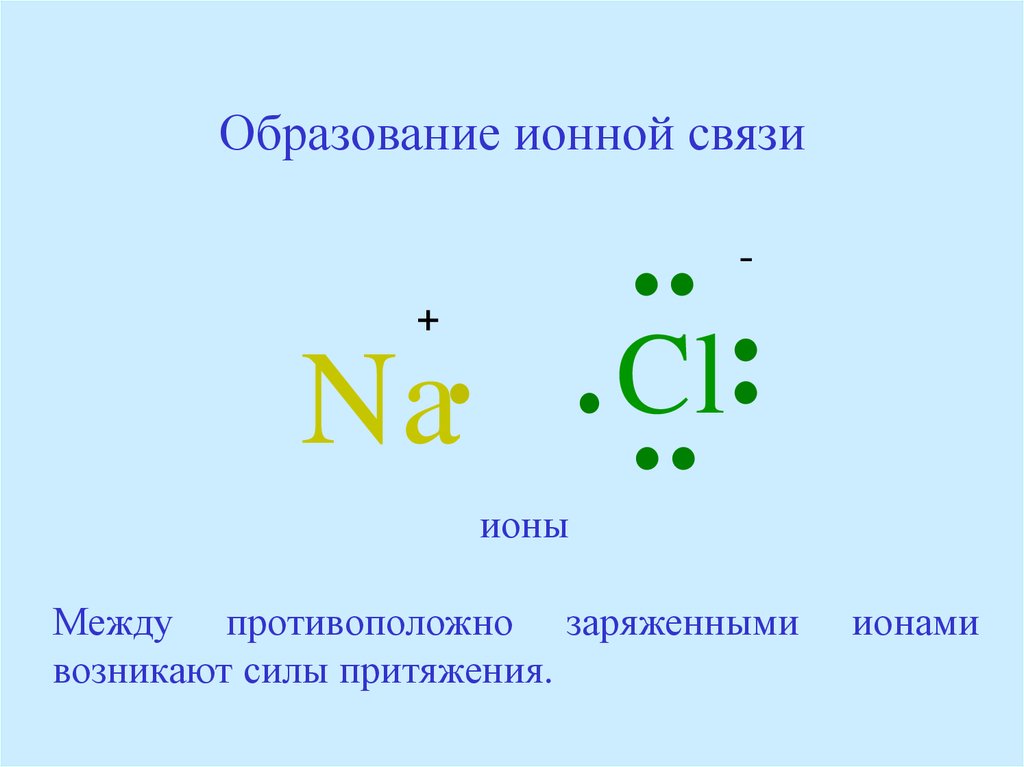
1. Ионные связи .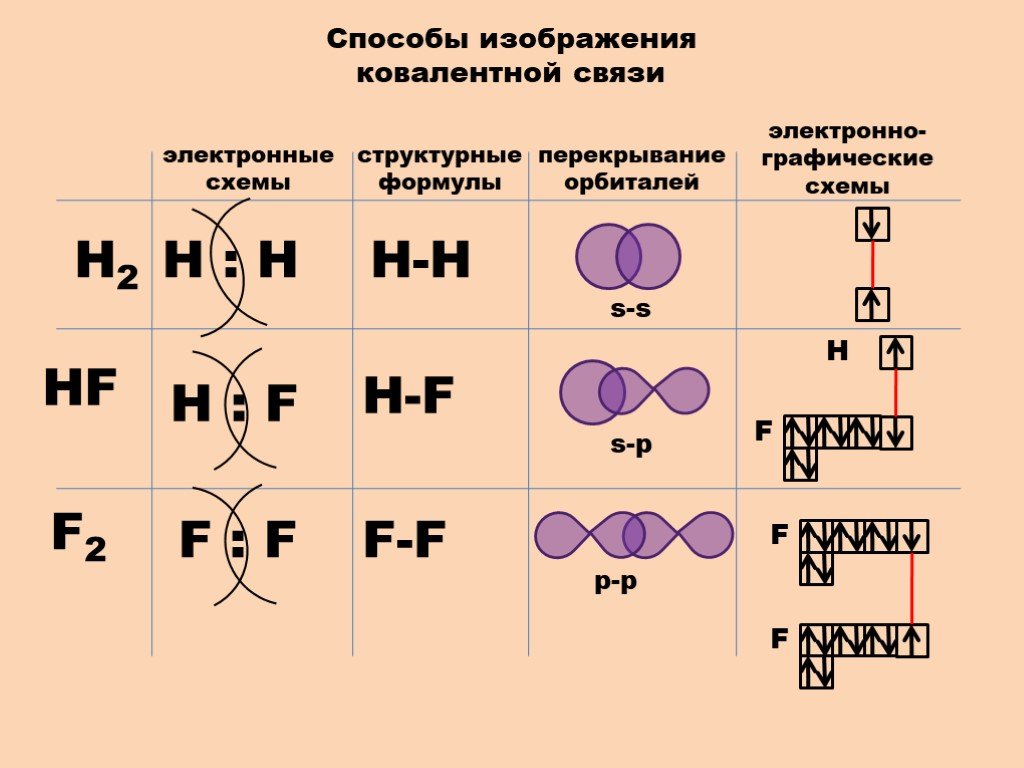
Ионы образованы атомами, которые имеют неполную внешние электронные оболочки, чтобы стать более похожими на благородные газы в группе 8 Периодической таблицы (см. раздел об ионах). Некоторый атомы добавляют электроны, чтобы получить полную оболочку, таким образом становясь отрицательным ионом. Другие атомы вычитают электроны из своей внешней оболочки, оставляя полную оболочку. и общий положительный заряд иона. В предыдущем разделе мы видели что атомы с менее чем 4 электронами во внешней оболочке склонны образовывать положительные ионы, а те, у которых более 4 электронов, имеют тенденцию образовывать отрицательные ионы. Ионные связи образуются, когда атомы передают электроны друг другу, образуя ионы, которые электрически притягиваются друг к другу, образуя связь между ними. Хлорид натрия (NaCl) является типичным ионным соединением. На картинке ниже показаны как ион натрия, так и ион хлора.
У натрия на внешней оболочке 1 электрон, а у хлора 7
электроны.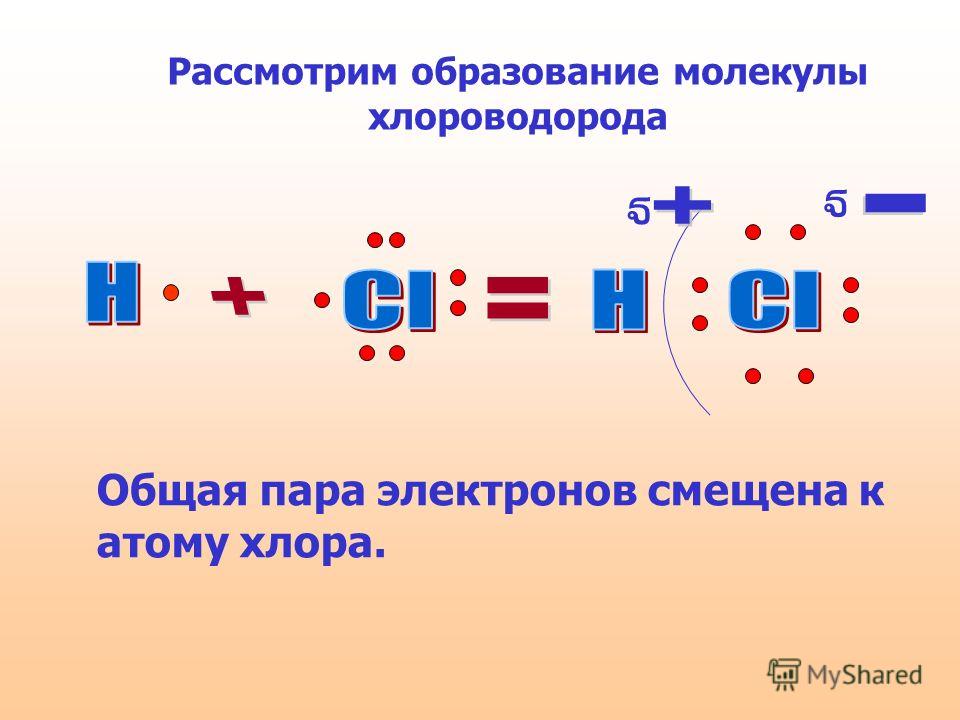 Натрию проще всего потерять свой электрон и образовать +1
ион, а для хлора получить электрон, образуя ион -1. Если натрий может
передать свой «запасной» электрон хлору (как показано выше), оба
атомы полностью удовлетворят свои требования к внешней оболочке, а ионная связь будет
формироваться. Если таким образом связаны большие группы атомов натрия и хлора,
В результате получается трехмерная структура с чередованием натрия и хлора.
ионы:
Натрию проще всего потерять свой электрон и образовать +1
ион, а для хлора получить электрон, образуя ион -1. Если натрий может
передать свой «запасной» электрон хлору (как показано выше), оба
атомы полностью удовлетворят свои требования к внешней оболочке, а ионная связь будет
формироваться. Если таким образом связаны большие группы атомов натрия и хлора,
В результате получается трехмерная структура с чередованием натрия и хлора.
ионы:
Синие точки — атомы натрия; бледно-зеленые точки — это более крупные атомы хлора. Ионные связи между каждым атомом образуют относительно прочная связь и трехмерная кубическая структура. Ниже рассмотрим только один слой:
Обратите внимание, что каждый положительный ион натрия находится рядом с отрицательным ион хлора. Теперь представьте, что это расположение продолжается наружу во все стороны. направлений с тысячами миллиардов атомов. Ух ты!
2.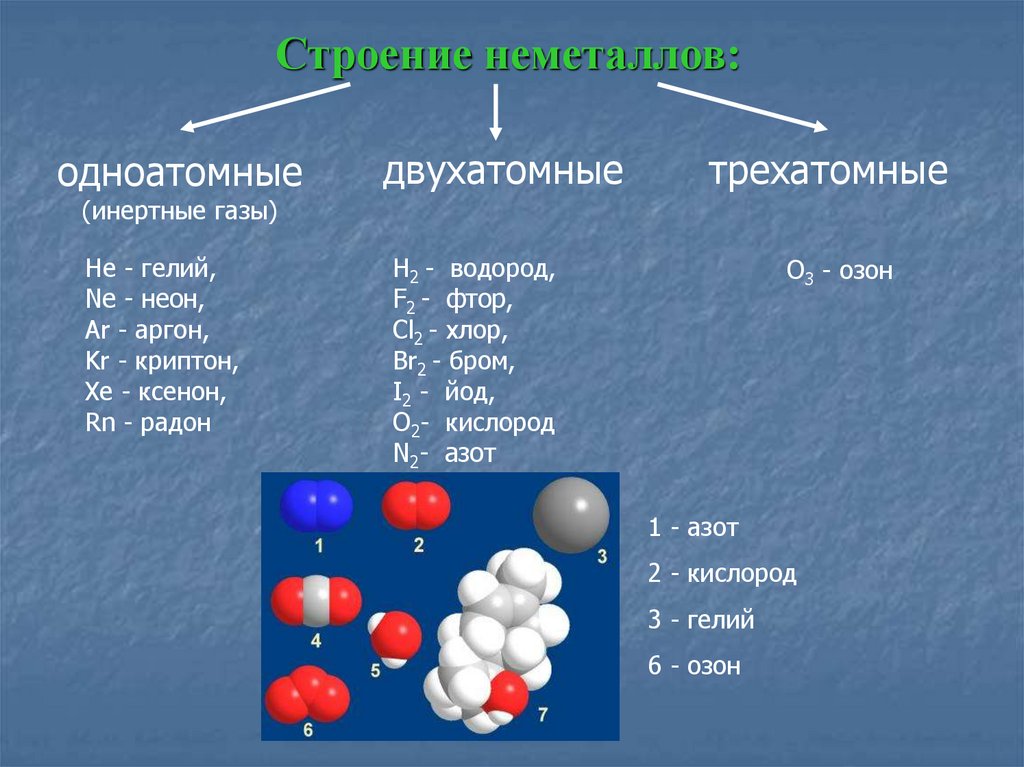 Ковалентные связи .
Ковалентные связи .
Иногда атомы будут делиться электронами вместо передачи их между двумя атомами. Это совместное использование позволяет обоим атомам заполнить свои внешняя оболочка, образуя очень прочную связь между атомами. Такие элементы, как углерод (C) и кремний (Si), образуют прочные ковалентные связи. Ниже приведена картина, показывающая обмен электронами, происходящий в минерале. алмаз. Алмазы сделаны из чистого углерода, и именно так углерод атомы связаны, что делает алмаз самым твердым веществом.
Каждый атом углерода имеет 4 электрона (синие точки) во внешнем
оболочка. Это позволяет атому делиться электронами с 4 другими атомами углерода.
окружающих его (как это делает средний атом углерода). Каждый из них в свою очередь
разделит оставшиеся 3 электрона с соседними атомами углерода рядом, выше
а под ним и те, что с другими атомами углерода и т. д., образуя смыкающиеся,
трехмерная сеть тесно связанных атомов углерода.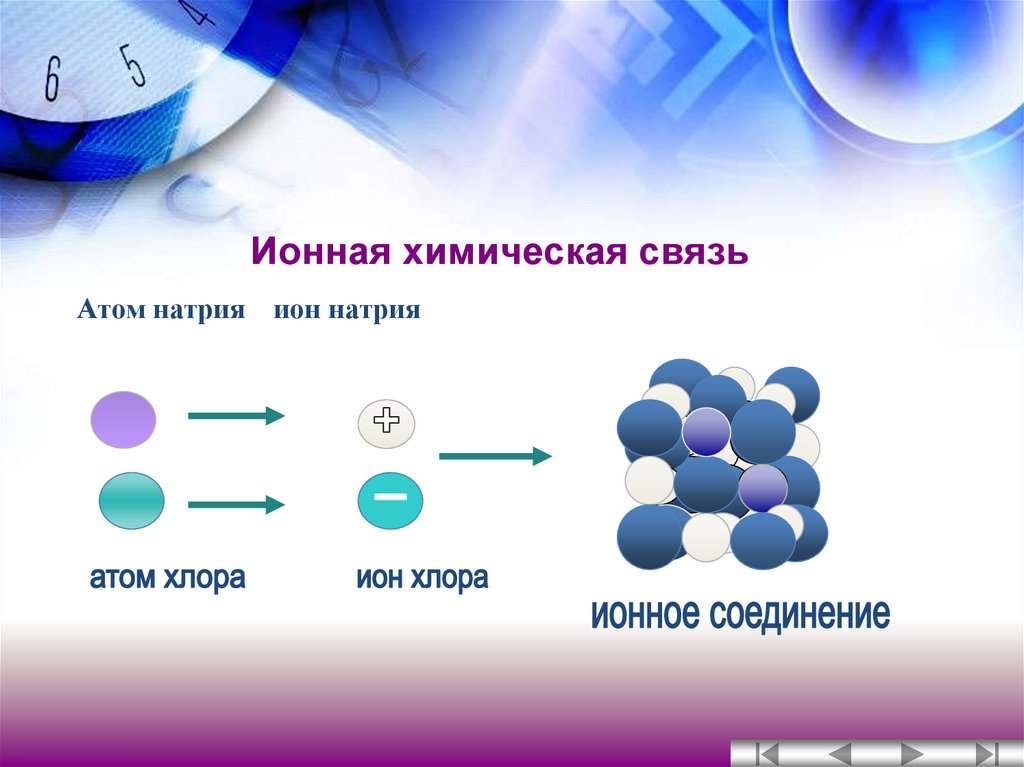 Сходным образом,
ковалентная связь между атомами кремния и кислорода образует прочные связи, образующие
большую группу минералов, называемых силикатами (подробнее о них позже).
Сходным образом,
ковалентная связь между атомами кремния и кислорода образует прочные связи, образующие
большую группу минералов, называемых силикатами (подробнее о них позже).
3. Металлические и Ван-дер-Ваальсовые связи .
Металлические связи образуются, когда электроны внешней оболочки являются общими. между соседними атомами. Однако, в отличие от ковалентной связи, недостаточное количество электронов в большинстве атомов металлов (таких как медь или серебро) с образованием чистых ковалентных связей. Таким образом, электроны распределяются между все ближайшие соседние ионы металлов, образуя металлическую связь. Это странно расположение «ионы металлов — это море электронов» дает металлы их особые физические свойства.
Металлические связи также объясняются зонной теорией. Группа
Теория утверждает, что плотно упакованные атомы имеют перекрывающиеся энергетические уровни электронов.
в результате образуется «зона проводимости», в которой электроны могут свободно
бродить между атомами, тем самым связывая их вместе.

 Значение должно соответствовать диаметру диска.
Значение должно соответствовать диаметру диска.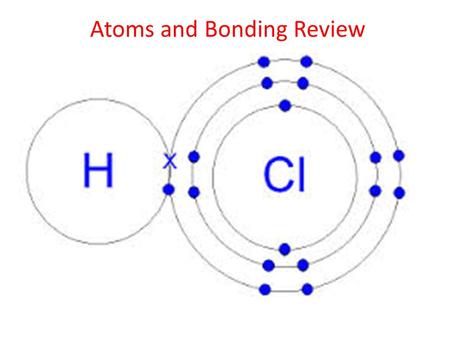

Leave A Comment