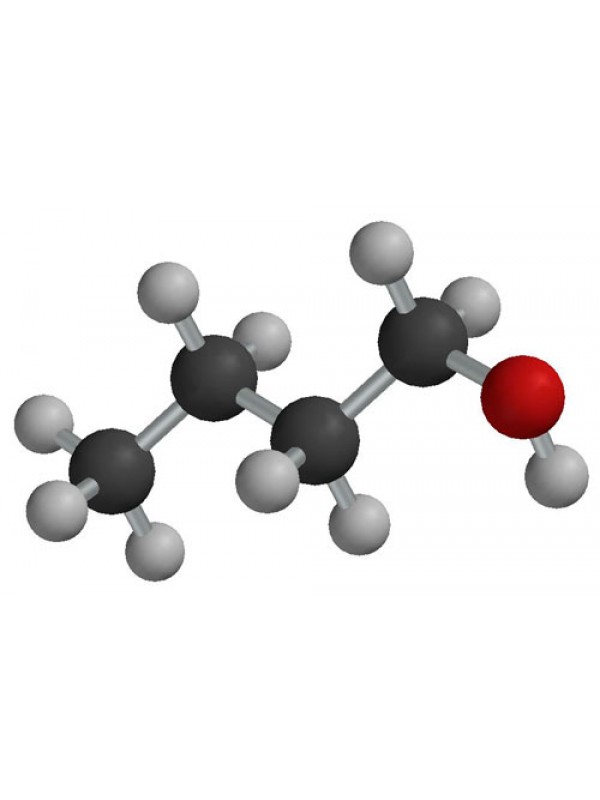
Бутанол-1: химические свойства и получение
Бутанол-1, бутиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому бутанол-1 – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Бутанол-1 смешивается с водой в любых соотношениях.
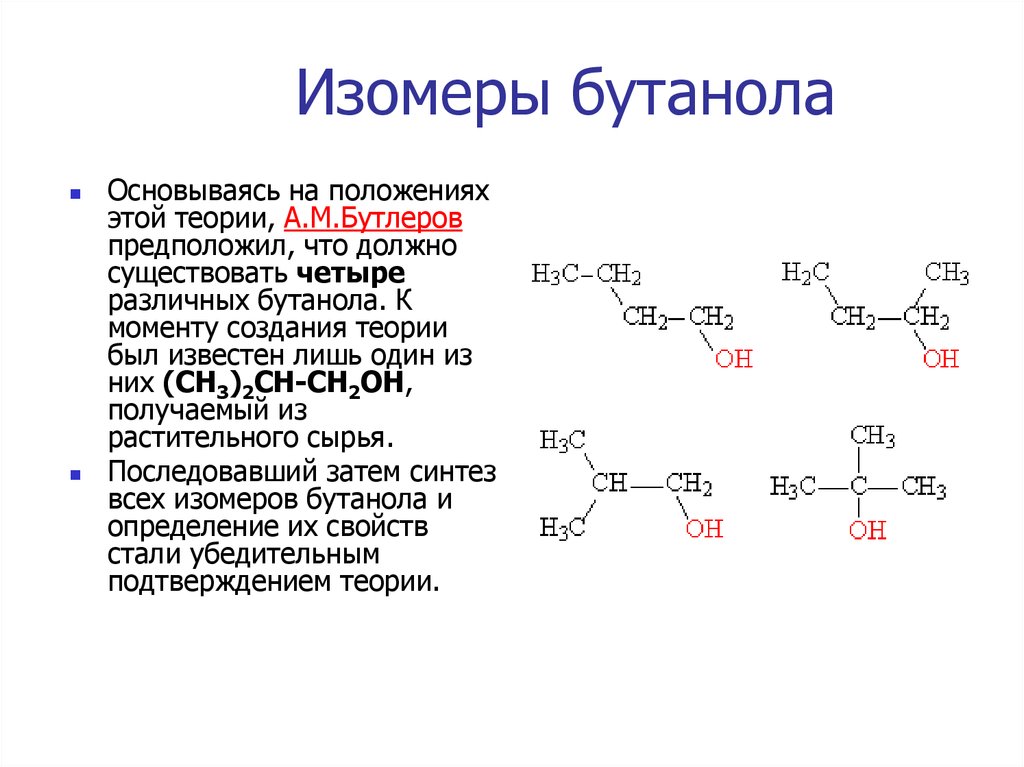
Структурная изомерия
Для бутанола-1 характерна структурная изомерия – изомерия положения гидроксильной группы, изомерия углеродного скелета и межклассовая изомерия.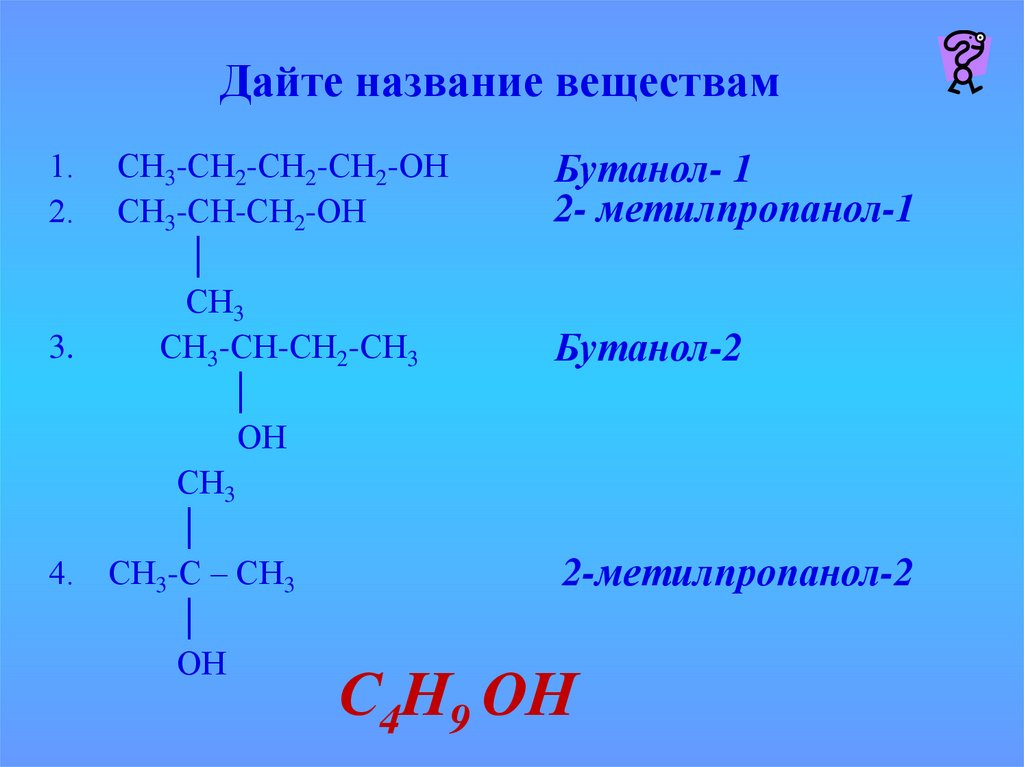
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С4Н10О бутиловый спирт СН3–CH2–CH2–CH2–OH, метилпропиловый эфир CH3–O–CH2–CH2–CH3, метилизопропиловый эфир CH3 |
| Бутиловый спирт | Метилпропиловый эфир |
| СН3–CH2–CH2–CH2–OH | CH3–O–CH2–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле.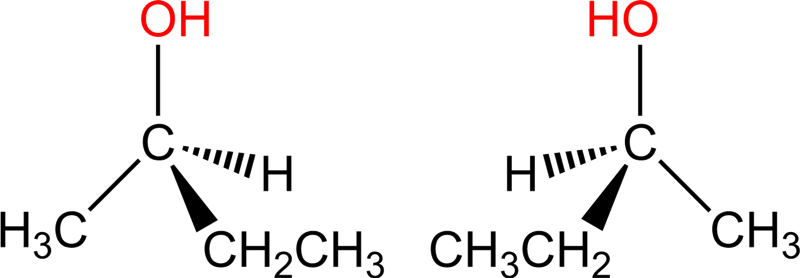 Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Бутанол-1 и бутанол-2 |
| Бутанол-1 | Бутанол-2 |
| СН3–CH2–CH2–CH2–OH | СН3–CH(OH)–CH2–CH3 |
Изомеры углеродного скелета отличаются положением строением углеродного скелета. Такая изомерия характерна для спиртов, которые содержат 4 или больше атомов углерода.
| Например. Бутанол-1 и изобутанол-2 |
| Бутанол-1 | Изобутанол |
| СН3–CH2–CH2–CH2–OH | СН3–CH(CH3)–CH2–OH |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства бутанола-1
Кислотные свойства бутанола-1
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому бутанол-1 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Бутанол-1 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, бутанол-1 взаимодействует с калием с образованием бутилата калия и водорода. |
2СН
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, бутилат калия разлагается водой: |
СН3–CH2–CH2–CH2–OK + H2O → СН3–CH2–CH2–CH2–OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, бутанол-1 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии бутанола-1 с аммиаком образуется бутиламин. |
СН3–CH2–CH2–CH2–OH + NH3 → СН3–CH2–CH2–CH2–NH2 + H2O
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя
| Например, бутанол-1 реагирует с уксусной кислотой с образованием бутилацетата (бутилового эфира уксусной кислоты): |
СН3–CH2–CH2–CH2–OH + СH3COOH → СH3COO–CH2–CH2–CH2–СН3 + H2O
2.
 4. Взаимодействие с кислотами-гидроксидами
4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии бутанола-1 с азотной кислотой образуется бутилнитрат. |
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из бутанола-1 под действием концентрированной серной кислоты при высокой температуре образуется бутен-1: |
СН3–CH2–CH2–CH2–OH → СH3–CH2–CH=CH2 + H2O
3.
 2. Межмолекулярная дегидратация
2. Межмолекулярная дегидратацияПри низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации бутанола-1 при низкой температуре образуется дибутиловый эфир: |
2СН3–CH2–CH2–CH2–OH → СН3–CH2–CH2–CH2–O–СH2–CH2–CH2–CH2 + H2O
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов.
| Например, бутанол-1 окисляется оксидом меди до бутаналя. |
СН3–CH2–CH2–CH2–OH + CuO → СН3–CH2–CH2–CH=O + H2O + Cu
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов.
| Например, при окислении бутанола-1 образуется бутаналь |
2СН3–CH2–CH2–CH2–OH + O2 → 2СН3–CH2–CH2–CH=O + 2H2O
4.
 3. Жесткое окисление
3. Жесткое окислениеПри жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии бутанола-1 с перманганатом калия в серной кислоте образуется бутановая кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания бутанола-1: |
C4H9OH + 6O2 = 4CO2 + 5H2O
5.
 Дегидрирование спиртов
Дегидрирование спиртов При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании бутанола-1 образуется бутаналь. |
СН3–CH2–CH2–CH2–OH → СН3–CH2–CH2–CH=O + H2
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 1-хлорбутана с водным раствором гидроксида натрия образуется бутанол-1 |
СН3–CH2–CH2–CH2–Cl + NaOH → СН3–CH2–CH2–CH2–OH + NaCl
2.
 Гидрирование карбонильных соединений
Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты.
| Например, при гидрировании бутаналя образуется бутанол-1 |
СН3–CH2–CH2–CH=O + H2 → СН3–CH2–CH2–CH2–OH
Понравилось это:
Нравится Загрузка…
н-Бутанол
- Подробности
- Опубликовано 14 Сентябрь 2013
- Автор: Administrator
Очистка и абсолютизированиен-Бутанол, содержащий 9% воды, может быть обезвожен фракционной перегонкой. Способ 1. Кипячение спирта с обратным холодильником в присутствии свежепрокаленного CaO с последующем фракционированием. Источник: Smyth C.P., Stoops W.N., J. Am. Chem. Soc., 1929, v.51, 3312, 3330. Способ 2. Кипячение 1600 г спирта с обратным холодильником в присутствии свежепрокаленного CaO (50 г) в течение 4 часов без доступа влаги. Спирт отделяют декантацией и кипятят с магниевыми стружками, затем фракционируют. Источник: Jones G., Christian S.M., J. Am. Chem. Soc., 1939, v.61, 82. Способ 3. Удаление оснований, альдегидов, кетонов и сложных эфиров. Спирт промывают разбавленной серной кислотой, раствором бисульфита натрия. Затем кипятят в течение 1. Источник: Clarke J., Robinson R., Smith J.C., J. Chem. Soc., 1927, 2647. |
|
||||||||||
|
|||||||||||
|
|||||||||||
|
ICSC 0112 — 2-БУТАНОЛ
ICSC 0112 — 2-БУТАНОЛ« вернуться к списку результатов поиска
Китайский — ZHАнглийский — ENФинский — FIFФранцузский — FRНемецкий — DEИврит — HEВенгерский — HUIИтальянский — ITЯпонский — JAKКорейский — KOPперсидский — FAПольский — PLПортугальский — PTРусский — RUSиспанский — ES
| 2-БУТАНОЛ | ICSC: 0112 (май 2018 г.) |
| втор-бутиловый спирт Бутан-2-ол 1-Метилпропанол Метилэтилкарбинол Бутиленгидрат | |
| Номер CAS: 78-92-2 |
| № ООН: 1120 |
| Номер ЕС: 201-158-5 |
| ОСТРЫЕ ОПАСНОСТИ | ПРЕДУПРЕЖДЕНИЕ | ПОЖАРОТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Легковоспламеняющийся. При температуре выше 24°C могут образовываться взрывоопасные смеси пар/воздух. При температуре выше 24°C могут образовываться взрывоопасные смеси пар/воздух. | ЗАПРЕЩАЕТСЯ открытому огню, искрам и курению. При температуре выше 24°C используйте закрытую систему, вентиляцию и взрывозащищенное электрооборудование. | Используйте распыление воды, порошка, пены, двуокиси углерода. В случае пожара: охлаждайте бочки и т. д., обрызгивая их водой. |
| СИМПТОМЫ | ПРЕДУПРЕЖДЕНИЕ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Головная боль. Головокружение. Сонливость. | Используйте вентиляцию, местную вытяжку или защиту органов дыхания. | Свежий воздух, отдых. Обратитесь за медицинской помощью. |
| Кожа | Сухая кожа. | Защитные перчатки. | Снять загрязненную одежду. Промойте кожу большим количеством воды или примите душ. Промойте кожу большим количеством воды или примите душ. |
| Глаза | Покраснение. Боль. | Наденьте защитные очки. | Сначала промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно), затем обратиться за медицинской помощью. |
| Проглатывание | Головокружение. Сонливость. | Не ешьте, не пейте и не курите во время работы. | Прополоскать рот. Дайте выпить один или два стакана воды. Не вызывает рвоту. Обратитесь за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Средства индивидуальной защиты: респиратор с фильтром для органических газов и паров, адаптированный к концентрации вещества в воздухе. Соберите подтекающую и пролитую жидкость в герметичные контейнеры, насколько это возможно. Абсорбировать оставшуюся жидкость песком или инертным абсорбентом. Затем храните и утилизируйте в соответствии с местным законодательством. Смойте остатки большим количеством воды. Соберите подтекающую и пролитую жидкость в герметичные контейнеры, насколько это возможно. Абсорбировать оставшуюся жидкость песком или инертным абсорбентом. Затем храните и утилизируйте в соответствии с местным законодательством. Смойте остатки большим количеством воды. | В соответствии с критериями СГС ООН ПРЕДУПРЕЖДЕНИЕ Легковоспламеняющаяся жидкость и парМожет причинить вред при проглатывании Вызывает раздражение глаз Может вызвать раздражение дыхательных путей Может вызвать сонливость или головокружение Может нанести вред при проглатывании и попадании в дыхательные пути Транспортировка |
| ХРАНЕНИЕ | |
| Огнестойкий. Отдельно от сильных окислителей и алюминия. | |
| УПАКОВКА | |
| 2-БУТАНОЛ | КМГС: 0112 |
| ФИЗИЧЕСКАЯ И ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физические опасности Химическая опасность | Формула: C 4 H 1 0 O / CH 3 CHOHCH 2 CH 3 |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Последствия кратковременного воздействия | Опасность при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА РАБОЧЕМ МЕСТЕ |
|---|
| TLV: 100 частей на миллион как TWA |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Проверка на пероксиды перед перегонкой; устранить в случае обнаружения. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС Символ: Си; Р: 10-36/37-67; С: (2)-7/9-13-24/25-26-46; Примечание: C |
Все права защищены. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий.
Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. Опубликованный материал распространяется без каких-либо явных или подразумеваемых гарантий.
Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. | |
MMB (растворитель на спиртовой основе) | kuraray
Информация о продукте
Химикаты/эластомеры/резина Производные изопрена
- Общее наименование
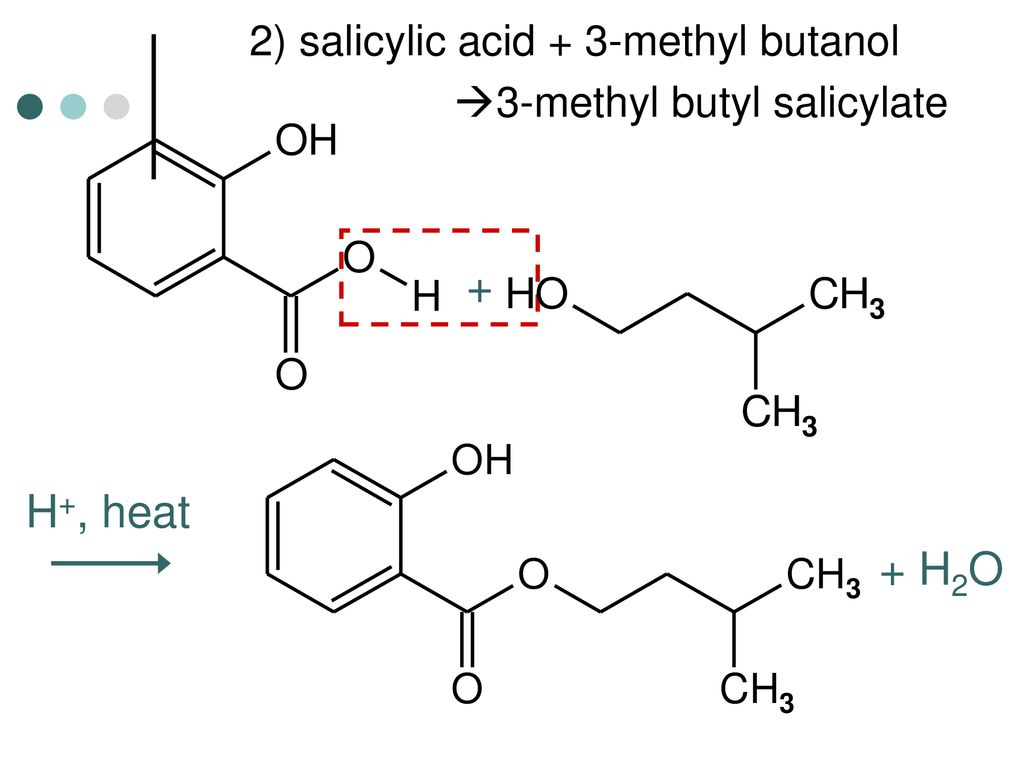
- 3-метокси-3-метил-1-бутанол
- Примеры
Безопасный для рабочих и окружающей среды растворитель
MMB (3-метокси-3-метил-1-бутанол) — это специальный химикат, производимый Kuraray. Это прозрачная, бесцветная, полностью растворимая в воде жидкость со слабым запахом. Благодаря низкой токсичности ММБ и легкому биоразложению его можно использовать в рецептурах с европейской экомаркировкой. Он также прошел скрининг DfE Агентства по охране окружающей среды США и с 2009 года включен в CleanGredients, список более безопасных ингредиентов в США.
Он также прошел скрининг DfE Агентства по охране окружающей среды США и с 2009 года включен в CleanGredients, список более безопасных ингредиентов в США.
Применение
Бытовое чистящее средство (ванна, туалет, одежда и т. д.)
Промышленное чистящее средство
Освежитель воздуха
Краска и чернила
Материалы для печати (увлажняющая вода, очиститель офсетного полотна)
Эмульсия и клеи
Электронные материалы
Пенное огнетушащее вещество
Характеристики
Чистящее средство
Улучшенные возможности очистки: улучшенная эффективность очистки за счет корректировки состава
Контроль повреждения субстрата: возможность контролировать растворимость смолы путем корректировки формулы
Улучшенная стабильность высококонцентрированных составов: Более низкая вязкость и улучшенная стабильность высококонцентрированных составов чистящих средств
Стабильность pH: стабилен в широком диапазоне pH
Сухость: возможность контролировать скорость испарения с помощью корректировок формулы.
Освежитель воздуха
Слабый запах: Слабый запах
Высокая совместимость с ароматическими соединениями: Обеспечивает высокую совместимость с широким спектром ароматических соединений
Уникальные свойства летучести: возможность регулировать скорость испарения ароматических соединений и минимизировать изменения состава во время испарения
Поверхностно-активные добавки: позволяет сократить использование поверхностно-активных веществ в ароматических соединениях на водной основе.
Стандартные марки и свойства
| Температура вспышки | 68ºC (Закон о пожарных службах, категория IV, класс II, нефть, растворимость в воде) |
|---|---|
| | При смешивании с водой температура воспламенения отсутствует, когда соотношение воды достигает 20% и более |
| Температура кипения | 174ºC |
| Точка замерзания | <-50ºC |
| Вязкость | 7,35 мПа・с при 20°C |
| Удельный вес | 0,927 (20/20ºC) |
| Поверхностное натяжение | 29,9 дин/см при 20ºC |
| Скорость испарения (бутилацетат=100) | 7 |
| Растворимость в воде | ∞ |
| Значение КБ | > 400 |
| Значение SP | 9,88 |
Связанный веб-сайт
Веб-сайт MMB (растворитель на спиртовой основе)
Связаться с нами
Нажмите здесь для запросов (MMB (растворитель на спиртовой основе))- Химический отдел изопрена Отдел маркетинга и продаж химикатов
- Башня Токивабаси, 2-6-4, Отэмати, Тиёда-ку, Токио, 100-0004, Япония
Тел.

 Вода отгоняется в виде азеотропа (37% воды).
Вода отгоняется в виде азеотропа (37% воды). 5 часа с 20% раствором едкого натра. Спирт сушат над поташом, окисью бария и фракционируют.
5 часа с 20% раствором едкого натра. Спирт сушат над поташом, окисью бария и фракционируют. 726 °С (760 мм. рт. ст.)
726 °С (760 мм. рт. ст.) д.
д.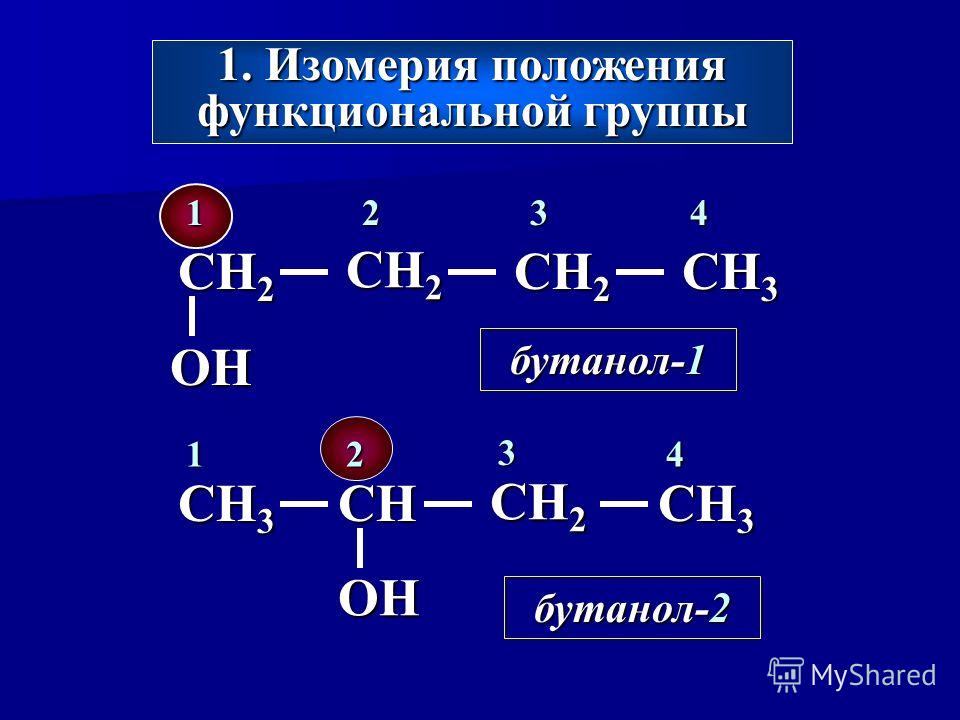 7 °C, 57.5% масс.
7 °C, 57.5% масс.
 % в воздухе: 1,7-9,0
% в воздухе: 1,7-9,0 
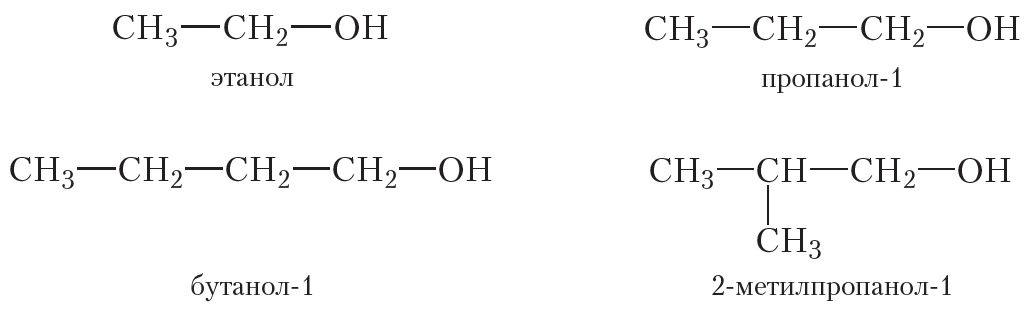
Leave A Comment