что, как сбалансировать и часто задаваемые вопросы —
By Тулума Дас
HCl является кислотой и MgSO4 является солью. Давайте представим, как они реагируют друг на друга.
Компания химическая формула соляной кислоты — это HCl, а сульфата магния — MgSO.4. HCl представляет собой водный раствор газообразного хлористого водорода, который выглядит как бесцветная жидкость. MgSO4 соль состоит из Mg2+ катион и SO42- (сульфатный) анион. Это водорастворимое кристаллическое твердое вещество.
Здесь мы поговорим обо всех необходимых аспектах реакции между HCl и MgSO4, таких как продукты, балансировка уравнения, природа реакции и т. д.
Что является продуктом HCl и MgSO4Продукты реакции HCl + MgSO4 представляют собой хлорид магния (химическая формула MgCl2) и серная кислота ( H2SO4). Реакция показана ниже.
HCl (водн.) + MgSO4 (водн.) = MgCl2 (вод) + H2SO4 (Водно)
Какой тип реакции HCl + MgSO4Тип реакция HCl + MgSO4является реакцией смещения.
Как сбалансировать HCl + MgSO4Неуравновешенное уравнение реакции HCl + MgSO4 is
HCl (водн.) + MgSO4 (водн.) = MgCl2 (вод) + H2SO4 (Водно)
Следующие шаги должны быть выполнены, чтобы получить сбалансированное уравнение
- Подсчитайте количество атомов каждого элемента на стороне реагента и на стороне продукта.
- Количество атомов каждого элемента должно быть одинаковым как на стороне реагента, так и на стороне продукта.
- Если это не то же самое, мы должны умножить формулу на наименьшую возможную цифру.

- Здесь количество атомов H и Cl неодинаково с обеих сторон, но количество Mg, S и O одинаково с обеих сторон.
- Чтобы количество атомов H и Cl было одинаковым с обеих сторон, мы умножим HCl на 2 в левой части.
Сбалансированное уравнение
2HCl (водн.) + MgSO4 (водн.) = MgCl2 (вод) + H2SO4 (Водно)
HCl + MgSO4 титрованиеКомпания титрование между HCl и MgSO4 невозможно, так как он не подпадает ни под одну категорию методов титрования. В основном существует четыре типа титрования; кислотно-щелочной, окислительно-восстановительный, прецизионный и комплексонометрический.
HCl + MgSO4 чистое ионное уравнениеПолная реакция выглядит следующим образом
2H+ (водн.) + 2Cl– (водн.) + Mg2+ (водн. ) + SO42- (водн.) = Mg2+ (водн.) + 2Cl– (водн.) + 2H+ (водн.) + SO42- (Водно)
) + SO42- (водн.) = Mg2+ (водн.) + 2Cl– (водн.) + 2H+ (водн.) + SO42- (Водно)
Поскольку все ионы являются ионами-наблюдателями, чистой реакции нет. Мы должны написать полный ионное уравнение перед написанием чистого ионного уравнения. В нем участвуют ионы-спектаторы, которые мы можем получить, ионизируя все растворимые ионные соединения в соответствующие катионы и анионы.
HCl + MgSO4 сопряженные парыДля реакции HCl + MgSO4, сопряженным основанием HCl является Cl–. Для MgSO невозможна сопряженная пара.4. Сопряженные пары (также называемые сопряженными кислотно-основными парами) отличаются друг от друга наличием или отсутствием протона.
HCl + MgSO4 межмолекулярные силы- В HCl два межмолекулярные силы присутствуют; диполь-дипольная и лондоновская дисперсионные силы, из которых преобладает первая, так как HCl является полярной молекулой.

- В MgSO4присутствуют три межмолекулярные силы; Ионная, диполь-дипольная и лондонская дисперсия, из которых первая преобладает в виде MgSO.4 представляет собой ионную молекулу.
Значение энтальпия реакции для реакции HCl + MgSO4 составляет около -87.3 кДж/моль. Энтальпию реакции рассчитывают, взяв разность энтальпий образования продуктов MgCl2 и Н2SO4 и реагентов HCl и MgSO4.
HCl + MgSO4 буферный растворВ реакции HCl + MgSO4, tсмесь HCl и MgSO4 не может сформировать буферный раствор. Буферный раствор образуется между слабой кислотой и сопряженным с ней основанием или наоборот. Здесь HCl — сильная кислота, а в MgSO4, сульфат-ион не является сопряженным основанием HCl.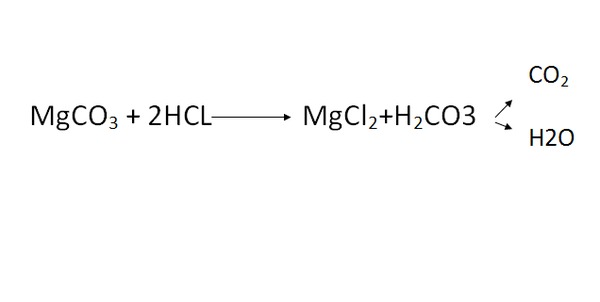
HCl + MgSO4 является полной реакцией, так как после образования продуктов MgCl2 и Н2SO4, дальнейшая реакция невозможна.
HCl + MgSO4 экзотермическая или эндотермическая реакцияHCl + MgSO4 реакция экзотермический в природе с выделением тепла.
HCl + MgSO4 окислительно-восстановительная реакцияHCl + MgSO4 не окислительно-восстановительная реакция так как нет изменений в степени окисления атомов, присутствующих в молекулах реагентов и продуктов.
HCl + MgSO4 реакция осажденияHCl + MgSO4 не реакция осаждения. Продукт MgCl2 растворим в воде, осадка не происходит.
Продукт MgCl2 растворим в воде, осадка не происходит.
HCl + MgSO4 реакция есть необратимая реакция.
HCl + MgSO4 реакция смещенияHCl + MgSO4 реакция представляет собой реакцию замещения, когда два иона обмениваются между двумя молекулами.
Заключение
В заключение можно сказать, что при взаимодействии соляной кислоты с сульфатом магния хлорид-ион соляной кислоты вытесняет сульфат-ион сульфата магния с образованием в качестве продуктов хлорида магния и серной кислоты. Хлорид магния — это соль, а серная кислота — это кислота.
Magnesii sulfas — магния сульфат – MgSo4•7h3o
Описание:
Бесцветные, прозрачные кристаллы,
выветривающиеся на воздухе.
Растворимость: растворим в 1 части воды, 0,3 ч кипящей воды, практически не растворим в 95% спирте.
Подлинность:
Mg2+ + Na2HPO4 + NH4OH + 5H2O MgNH4PO4•6h3O + 2Na+
Белый крист., растворим в уксусной и минеральных кислотах
SO42- + BaCl2 BaSO4
Осадок нерастворим в минеральных кислотах.
Натрия бромид, NaBr, M. в. 102,90
Описание. Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен.
Подлинность:
1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет
2. С цинкуранилацетатом
выпадает желтый кристаллический осадок.
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl
2Br— + Cl2 Br2 + 2Cl— Х/формный слой окрашивается в желто-бурый цвет.
Natrii benzoas
Натрия бензоат
Описание: белый мелкокристаллический порошок, легко растворим в воде, трудно в спирте и органических растворителях
Подлинность:
Количественное определение:
Ацидиметрия
Магния сульфат: Прямая комплексонометрия в среде аммиачного буфера с рН 9,5-10,0. Индикатор эриохром черный Т. Титруют раствором трилона Б (0,05 моль/л) до синего окрашивания.
Добавляем индикатор:
Титруем трилоном Б:
КТТ:
Натрия бромид: метод Мора
Точную
навеску препарата растворяют в воде и
титруют 0,1М AgNO3 с индикатором K2CrO4 при pH=6-8
до оранжево-желтого окрашивания.
NaBr + AgNO3 NaNO3 + AgBr
КТТ: K2CrO4 + 2AgNO3 KNO3 + Ag2CrO4 кирпично-красный.
Ограничения:
в кислой среде CrO
Среда для титрования нейтральная или слабощелочная, т.к. в сильнощелочной среде выпадает черный осадок:
Ag+ + OH— AgOH Ag2O
Натрия бензоат:
Прямая ацидиметрия:
,
в присутствии хлороформа (извлекает,
выделяющуюся бензойную кислоту, если
её не убрать, то точка эквивалентности
наступает раньше.
ФАРМАКОГНОЗИЯ
Мята перечная
Собранные и фазу цветения механизированным способом и обмолоченные, высушенные листья многолетнего культивируемого травянистого растения мяты перечной
Мята
перечная – корневищный многолетник с
прямостоячими ветвистыми четырехгранными
стеблями. Листья накрест супротивные,
короткочерешковые, продолговатояйцевидные,
с заостренной верхушкой и сердцевидным
основанием. Край листа неравномерно
остропильчатый, с верхней стороны
листья темно-зеленые, с нижней —
светло-зеленые, с обеих сторон имеют
многочисленные эфирно-масличные железки.
Цветки собраны в соцветие «колосовидный
тирс». Чашечка цветков пятизубчатая,
почти правильная, фиолетовая. Венчик
слегка неправильный, четырехлопастный,
розоватый или бледно-фиолетовый; 4
тычинки, фиолетовые, короче венчика.
В диком виде не встречается. Культивируется преимущественно на Украине, а также в Краснодарском крае, Беларуси, Молдове и Воронежской области. Размножают главным образом отрезками корневищ.
Химический состав. Листья содержат эфирное масло. Главный компонент эфирного масла — L-ментол, в листьях содержатся также олеаноловая и урсоловая кислоты, флавоноиды, каротиноиды.
Заготовка и сушка. Заготовку листьев мяты проводят при наступлении цветения примерно у половины растений. Траву скашивают, подвяливают в валках и досушивают в воздушных сушилках, на токах или под навесами, а высушенную траву обмолачивают, отделяют и отбрасывают стебли.
Внешние
признаки. Кусочки
листьев различной формы. Край листа
остропильчатый, кусочки листьев
голые и по всей пластинке золотисто-желтые
или более темные железки (рис. 15). Запах
листьев сильный, приятный, вкус слегка
жгучий, холодящий.
15). Запах
листьев сильный, приятный, вкус слегка
жгучий, холодящий.
Микроскопия. на поверхности препаратов листа обнаруживаются простые многоклеточные волоски с бородавчатой кутикулой и головчатые волоски с одноклеточной ножкой и обратнояйцевидной и одноклеточной головкой. Устьица диацитные. По поверхности в углублениях видны многочисленные эфирно-масличные железки, характерные для губоцветных. Эти элементы имеют диагностическое значение. Эпидермис извилистостенный.
Хранение. Хранят листья мяты в сухих, хорошо проветриваемых помещениях на стеллажах или подтоварниках, отдельно от других видов сырья.
Использование. Получение
эфирного масла. Из эфирного масла
выделяют ментол. Из листьев готовят
настойку и мятную воду. Листья используют
в виде настоя в качестве спазмолитического,
желчегонного средства, при тошноте.
Входит в состав ветрогонного, желудочного,
желчегонного сборов, в сбор Здренко.
Валериана лекарственная.
Собранные осенью или ранней весной, освобожденные от остатков листьев и стеблей, отмытые от земли и высушенные корневища с корнями многолетнего культивируемого и дикорастущего травянистого растения валерианы лекарственной Valeriana officinalis
Валериана
лекарственная — двулетнее травянистое
растение. Корневище короткое, вертикальное,
с многочисленными тонкими шнуровидными
корнями. Листья первого года — розеточные,
черешковые, непарноперисторассеченные.
Стебли, развивающиеся на втором году,
прямостоячие, ребристые, полые, в
верхней части ветвистые, с супротивными,
непарноперисторассеченными листьями
(нижние — черешковые, верхние — сидячие).
Цветки мелкие, белой, розовой или лиловой
окраски, собраны в щитковидное соцветие
(тирс). Плод — семянка коричневого цвета
с хохолком.
Плод — семянка коричневого цвета
с хохолком.
Валериана лекарственная имеет европейский тип ареала.
Химический состав. Корнев. с корн. валерианы содержат эфирное масло, в состав которого входят борнилизовалерианат, изовалсриановая кислота, борнеол, пинен, терпинеол, сесквитерпеноиды (валсрснон, валереновая кислота), свободная валериановая кислота.
Заготовка, первичная обработка и сушка. Уборку корневищ с корнями валерианы проводят поздней осенью. Корневища с корнями очищают от остатков надземных частей и земли, толстые корневища режут вдоль, быстро промывают водой и подвяливают.
Сушат в тепловых сушилках при температуре не выше 35—40°С или на воздухе в тени, под навесом при хорошем проветривании.
Внешние
признаки. Цельное
сырье представляет
собой цельные или разрезанные вдоль
корневища длиной до 4 см, толщиной до 3
см, с рыхлой сердцевиной, часто полые,
с поперечными перегородками. От
корневища со всех сторон отходят
многочисленные тонкие придаточные
корни, иногда подземные побеги — столоны.
Корни часто отделены от корневища; они
гладкие, ломкие, различной длины,
толщиной до 3 мм. Цвет корневища и корней
снаружи желтовато-коричневый, на изломе
— от бледно-желтого до коричневого.
Запах сильный, специфичный. Вкус пряный,
сладковато-горький.
От
корневища со всех сторон отходят
многочисленные тонкие придаточные
корни, иногда подземные побеги — столоны.
Корни часто отделены от корневища; они
гладкие, ломкие, различной длины,
толщиной до 3 мм. Цвет корневища и корней
снаружи желтовато-коричневый, на изломе
— от бледно-желтого до коричневого.
Запах сильный, специфичный. Вкус пряный,
сладковато-горький.
Микроскопия. Часто вытянутые в сосочки эпидермальные клетки; гиподерма с каплями эфирного масла; паренхимные клетки коры, заполненные 2—5 сложными крахмальными зернами; эндодерма с радиально утолщенными стенками.
Использование. Применяют
корневища с корнями валерианы в виде
настоя, настойки, экстракта как седативное
средство при нервном возбуждении,
бессоннице, головных болях, неврастении,
климактерическом синдроме, вегетоневрозах,
неврозах сердечно-сосудистой системы,
для профилактики и лечения ранних
стадий стенокардии, гипертонической
болезни, при спазмах коронарных сосудов,
желудка, кишечника, для лечения
нейродермитов; они входят в состав
успокоительного, желудочных и
ветрогонных сборов.
ФАРМАКОЛОГИЯ
Микстура обладает седативным действием.
Магния сульфат – седативное, спазмолитическое и п/судорожное действие. П/судорожный эффект обусловлен не только непосредственным действием на ЦНС, но и вытеснением кальция в саркоплазматическом ретикулуме, а также действием на пресинаптическую мембрану и уменшением выделения медиаторов нервной системы – АХ.
Натрия бромид – успокаительное действие, усиливая процессы торможения в КБП, не влияет на процессы возбуждения. Применяют при невротических состояниях, неврозах.
Натрия бензоат – отхаркивающее при бронхитах.
АТЛ
Выписана сложная
ЛФ для внутреннего применения, дозируемая
ложками – микстура. В поставку отмеривают
необходимое количество воды очищенной
и растворяют в ней натрия бензоат, магния
сульфат, натрия бромид, фильтруем во
флакон для отпуска. Затем добавляем
настойку валерианы (70%), настойка мяты
(90%). Укупориваем. Этикетка «Внутреннее»,
«Микстура».
Затем добавляем
настойку валерианы (70%), настойка мяты
(90%). Укупориваем. Этикетка «Внутреннее»,
«Микстура».
ППК:
Aqua purificata
Natrii benzoas
Magnesii sulfas
Natrii bromidum
T-ra Valerianae
T-ra Menthae
ЗТЛ
Приготовл.настоек.
Настойки – это спирто-водные извлечения ЛРС, полученные без нагревания и удаления экстрагента. Это прозрачные окрашенные жидкости обладающие вкусом и запахом растения из которых их готовили. Для их получения используют высушенный растительный материал, в некоторых случаях свежее сырье.
Методы: мацерация,
мацерация с использованием
турбоэкстракционной циркуляции
экстрагентата, дробнная мацерация,
перколяция, раствор густых и сухих
экстрактов. Экстрагент – этанол (40-95%).
Для настоек принято массо-объемное
соотношение между сырьем и готовым
продуктом. Для несильнодействующих –
1:5. Для сильнодействующих – 1:10.
Для несильнодействующих –
1:5. Для сильнодействующих – 1:10.
Настойку мяты готовят методом дробной мацерации. Состав: листья Мяты — 50гр, масло Мяты – 50гр, Спирт 90% до 1л. Соотн – 1:20 (с учет.поглощ.экстраг.сырьем – 1:23). Исп.90% спирт, т.к.в лист.Мяты сод.эф.масла. 1:20 для расч.сырья, 1:23 – для расчета экстрагента.
mсырья=Vнаст/20,
Vспитрта=mсырья*23,
исп.96%спирт (т.к.учет) mспирта=Р*в/а,
где р-mспирта нужн.конц.(экстраг – 90%сп.), в-массов.доля. нужн конц.%, а – массов.доля 96% сп. Р=Vэкстр-та*плотн.90%. V(96%)=mсп/плотн.96%. Vводы=р-mсп.
В
перклол.загруж.сырье
(лист.Мяты).Экстр-т
делим
на
3-4 части
и
послед.наст.сырье
в
1части
экстраг,
затем
во
2,3 и
4.Кажд.раз
слив.вытяжк.
время
наст.подбир.индивид,
в
завис.от
раст.матер.
Затем
отстаив.получ.извлеч.в
теч.неск.дней
в
холод-ке.
В период
отстаив.коагулир.и выпад.в осад.многие
ВМС, разл.механич.прим. Далее фильтр.ч/з
друк-фильтр. Проверка кач. по содерж.экстр.в-в,
регламентир.тяж.мет. (не более 0,001%). Если
кол-во ДВ установл.предела
их разбавл.добавл.чист.экстр-та или
более слаб.наст-ой. При сод-ии ДВ нормы,
укрепл.добавл.более конц.наст-ки.
Сод.этанола устанавл.по tкип.или
методом дестил.с послед.опред.плотн.отгона
пикнометром. Мятн.масло добавл.после
пригот.наст. Хр.в хор.закр.бут., в защ.от
света месте. На свету мног.наст.мен.цв.
Цв.светлеет. Хран.при t=15
не
8, во избеж.образ.осадка. С теч.врем.осадки
м.появ.и при соблюд.правил
хранен.-наст.стареют. Это связ.с
измен.раств-ти БАВ и образ.нераств.соед.
в рез-те взаимод.вещ-в. На
образ.осад.оказ.влиян.налич.ферм-в,t-режим
и т.д. Наст.с осад.отфильтр.и воновь
стандартиз. В случ.соотв. ч.пок.треб.ГОСТа
их разреш.прим.
по содерж.экстр.в-в,
регламентир.тяж.мет. (не более 0,001%). Если
кол-во ДВ установл.предела
их разбавл.добавл.чист.экстр-та или
более слаб.наст-ой. При сод-ии ДВ нормы,
укрепл.добавл.более конц.наст-ки.
Сод.этанола устанавл.по tкип.или
методом дестил.с послед.опред.плотн.отгона
пикнометром. Мятн.масло добавл.после
пригот.наст. Хр.в хор.закр.бут., в защ.от
света месте. На свету мног.наст.мен.цв.
Цв.светлеет. Хран.при t=15
не
8, во избеж.образ.осадка. С теч.врем.осадки
м.появ.и при соблюд.правил
хранен.-наст.стареют. Это связ.с
измен.раств-ти БАВ и образ.нераств.соед.
в рез-те взаимод.вещ-в. На
образ.осад.оказ.влиян.налич.ферм-в,t-режим
и т.д. Наст.с осад.отфильтр.и воновь
стандартиз. В случ.соотв. ч.пок.треб.ГОСТа
их разреш.прим.
Мерник д/воды
Мерник д/спирта
мерник д/вод-сп.смеси
Перколятор
Сборник д/получ.жидк.
Друк-фильтр
сборник д/гот.
 прод.
прод.Мерник д/масла мятн.
Полн.анал-з субст. кофф.НБ.
Получ:
Кач.анал-з
Колич.опред.
БИЛЕТ №3
Rp.: Reserpini сп. А
Barbitali- natrii сп. Б
Dibasoli сп. Б
Hypothyazidi (Dichlothyazidi) сп. Б
ФАРМХИМИЯ
Резерпин (l-резерпин)
В основе структуры резерпина лежит йохимбан:
11,17-диметокси-15-карбометокси-18(3’,4’,5’-триметоксибеноилокси)-аллойохимбан. или
3, 4, 5-Триметоксибензоат метилрезерпата.
A, B – индол
С, D – дегидрохинолизидин
D, E – гидрированный изохинолин
E – циклогексан
Резерпин –
левовращающий изомер.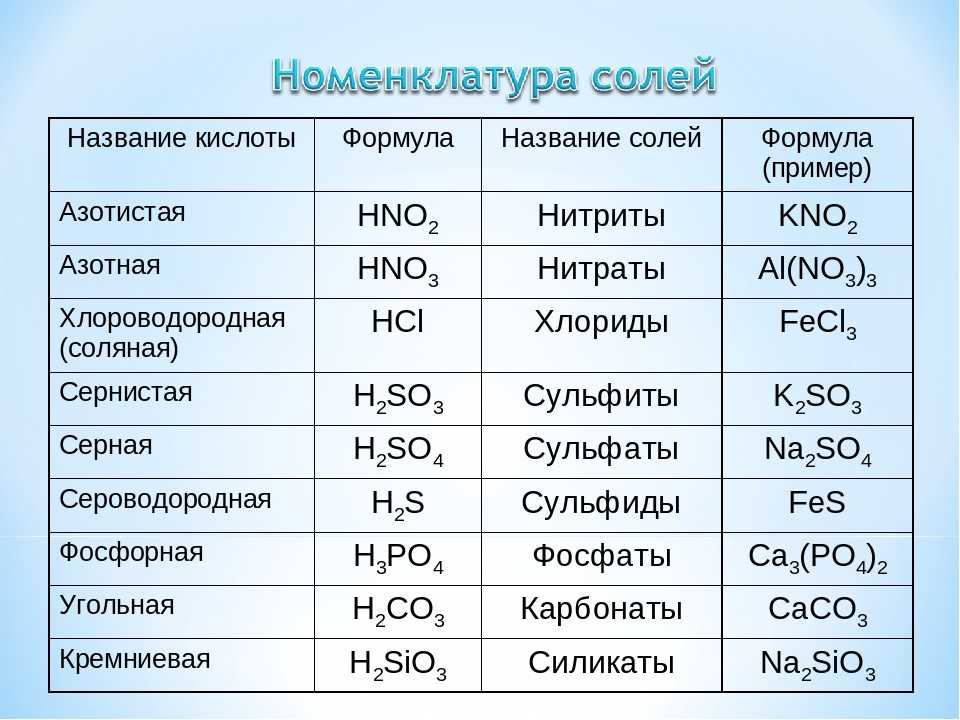
Описание: белый кристаллический порошок с желтоватым оттенком, без запаха, не обладает горьким вкусом.
Подлинность:
1) С раствором ванилина в к. HCl розовое окрашивание. Реакцию проводят капельным путем.
2) Раствор препарата + H2SO4 + NaNO2 зеленая флюорисценция. Это самая специфическая реакция:
3) С хлорной водой пурпурное окрашивание
4) С H2O2 желто-сиреневое окрашивание
5) С KMnO4 темнолиловое
6) Щелочной гидролиз:
Количественное определение:
Неводное титрование. Основано на основных свойствах атома азота в 4 положении. f=1
Растворяют в безводной уксусной кислоте и титруют раствором хлорнрй кислоты:
2) Ацидиметрия в
спиртовой среде. Титрант 0,1 М HCl.
Титрование происходит также по 4 атому
азоата. Индикатор МК. f=1
Титрант 0,1 М HCl.
Титрование происходит также по 4 атому
азоата. Индикатор МК. f=1
Барбитал – натрий:
5,5-Диэтилбарбитурат натрия
Белый кристаллический порошок без запаха, горького вкуса, ЛР в воде, МР в спирте, ПНР в эфире.
Подлинность:
Количественное определение: ацидиметрия. Титрант HCl, Ind.: метиловый оранжевый, титруют до розового окрашивания.
Гипотиазид (Дихлотиазид) – 6-хлор-7-сульфамоил-3,4-дигидро-1,2,4-бензотиадиазин-1,1-диокись
Дибазол – 2-бензилбензимидазола гидрохлорид
Белый кристаллический порошок, гигроскопичен. ТР в воде и х/форме, ЛР в спирте, МР в ацетоне, ПНР в эфире.
Подлинность:
1) на хлориды
Количественное определение:
метод Фольгарда:
Осадок отфильтровывают и обрабатывают HNO3 при нагревании:
AgNO3 оттитровывают роданометрически:
AgNO3 + NH4SCN AgSCN + NH4NO3
NH4SCN + FeNH4(SO4)2Fe(SCN)3 кроваво-красный
What, How to Balance & FAQs —
Автор Tuluma Das
HCl — это кислота, а MgSO 4 — это соль. Давайте представим, как они реагируют друг на друга.
Давайте представим, как они реагируют друг на друга.
Химическая формула соляной кислоты – HCl, а сульфата магния – MgSO 4 . HCl представляет собой водный раствор газообразного хлористого водорода, который выглядит как бесцветная жидкость. Соль MgSO 4 состоит из катиона Mg 2+ и аниона SO 4 2- (сульфат). Это водорастворимое кристаллическое твердое вещество.
Здесь мы поговорим обо всех необходимых аспектах реакции между HCl и MgSO4, таких как продукты, балансировка уравнения, характер реакции и т. д.
Что является продуктом HCl и MgSO 4Продуктами реакции HCl + MgSO 4 являются хлорид магния (химическая формула MgCl 2 ) и серная кислота (H 2 SO 4 ). Реакция показана ниже.
HCl (aq) + Mgso 4 (aq) = Mgcl 2 (aq) + H 2 SO 4 (AQ)
Какой тип реакции является HCl + Mgso 4 69 .
Тип реакции HCl + MgSO 4 реакция замещения.
Как сбалансировать HCl + MgSO 4Несбалансированное уравнение реакции HCl + MgSO 4 IS
HCl (aq) + Mgso 4 (aq) = Mgcl 2 (aq) + h 2 SO 4 (aq)
Следующие шаги должны быть выполнены. чтобы получить сбалансированное уравнение
- Подсчитайте количество атомов каждого элемента на стороне реагента и на стороне продукта.
- Количество атомов каждого элемента должно быть одинаковым на стороне реагента и продукта.
- Если это не одно и то же, мы должны умножить формулу на наименьшую возможную цифру.
- Здесь количество атомов H и Cl неодинаково с обеих сторон, а количество Mg, S и O одинаково с обеих сторон.

- Чтобы количество атомов H и Cl было одинаковым с обеих сторон, мы умножим HCl на 2 в левой части.
Сбалансированное уравнение:
2HCl (водн.) + MgSO 4 (aq) = mgcl 2 (aq) + h 2 So 4 (aq)
Hcl + Mgso 4 ТитроваяТит поскольку он не подпадает ни под одну категорию методов титрования. В основном существует четыре типа титрования; кислотно-щелочной, окислительно-восстановительный, прецизионный и комплексонометрический.
HCl + MgSO 4 результирующее ионное уравнениеПолная реакция выглядит следующим образом
2H + (aq) + 2Cl — (aq) + Mg 2+ (aq) + SO 4 2- (aq) = Mg 2+ (AQ) + + + MG 2+ (AQ) +. 2Cl – (водн.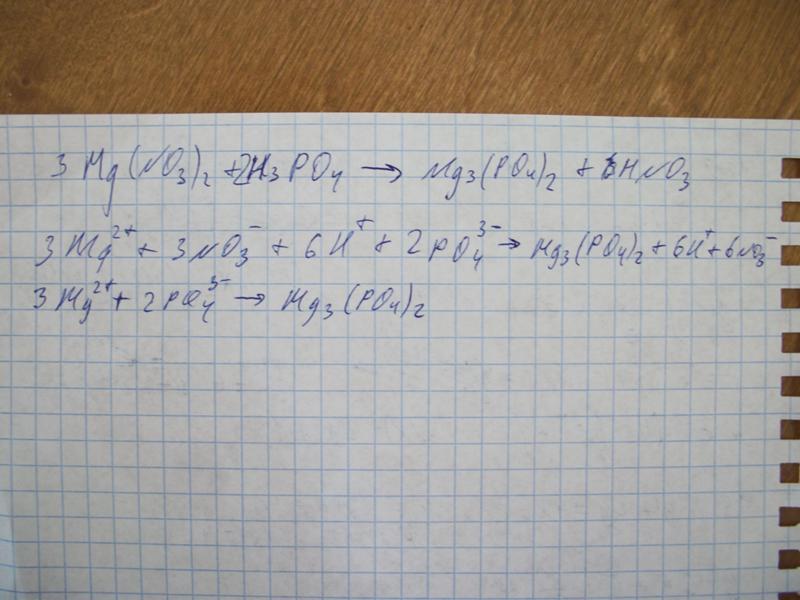 ) + 2H + (водн.) + SO 4 2- (водн.)
) + 2H + (водн.) + SO 4 2- (водн.)
Поскольку все ионы являются ионами-спектаторами, чистой реакции нет. Мы должны написать полное ионное уравнение, прежде чем писать итоговое ионное уравнение. В нем участвуют ионы-спектаторы, которые мы можем получить, ионизируя все растворимые ионные соединения в соответствующие катионы и анионы.
HCl + MgSO 4 сопряженные парыДля реакции HCl + MgSO 4 сопряженное основание HCl 014 – 9 0 Cl14 – 9 0 Для MgSO 4 сопряженная пара невозможна. Сопряженные пары (также называемые сопряженными кислотно-основными парами) отличаются друг от друга наличием или отсутствием протона.
HCl + MgSO 4 межмолекулярные силы- В HCl присутствуют две межмолекулярные силы; диполь-дипольная и лондоновская дисперсионные силы, из которых преобладает первая, так как HCl является полярной молекулой.

- В MgSO 4 присутствуют три межмолекулярные силы; Ионная, диполь-дипольная и лондоновская дисперсия, из которых преобладает первая, так как MgSO 4 является ионной молекулой.
Значение энтальпии реакции для реакции HCl + MgSO 4 составляет около -87,3 кДж/моль. Энтальпию реакции рассчитывают, взяв разность между энтальпиями образования продуктов MgCl 2 и H 2 SO 4 и энтальпией образования реагентов HCl и MgSO 4 .
Is HCl + MgSO 4 буферный раствор В реакции HCl + MgSO 4 , 0 , 0Смесь HCl и MgSO 4 не может образовывать буферный раствор. Буферный раствор образуется между слабой кислотой и сопряженным с ней основанием или наоборот.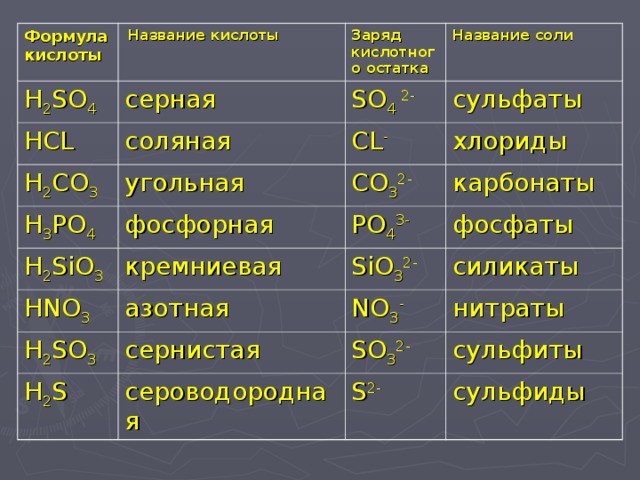 Здесь HCl является сильной кислотой, а в MgSO 4 ион сульфата не является сопряженным основанием HCl.
Здесь HCl является сильной кислотой, а в MgSO 4 ион сульфата не является сопряженным основанием HCl.
HCl + MgSO 4 полная реакция как после образования продуктов0005 2 SO 4 , дальнейшая реакция невозможна.
Is HCl + MgSO 4 экзотермическая или эндотермическая реакцияHCl + MgSO 4 9002
Is HCl + MgSO 4 окислительно-восстановительная реакцияHCl + MgSO 4 не является окислительно-восстановительной реакцией, т.к. молекулы продукта.
Is HCl + MgSO 4 реакция осаждения HCl + MgSO 4 не является реакцией осаждения. Продукт MgCl 2 растворим в воде, и осаждение не происходит.
Продукт MgCl 2 растворим в воде, и осаждение не происходит.
HCL + MGSO 4 Реакция — неверная реакция.
IS HCL + MGSO 4 Реакция смещенияHCL + MGSO 4 . Двух. молекулы.
Заключение
В заключение можно сказать, что при реакции соляной кислоты с сульфатом магния хлорид-ион соляной кислоты вытесняет сульфат-ион сульфата магния с образованием хлорида магния и серной кислоты в качестве продуктов. Хлорид магния — это соль, а серная кислота — это кислота.
Оценка динамики жидкости у матери во время токолитической терапии ритодрина гидрохлоридом и сульфатом магния
. 1992 г., сен; 167 (3): 758-65.
1992 г., сен; 167 (3): 758-65.
doi: 10.1016/s0002-9378(11)91585-3.
Б А Армсон 1 , P Samuels, F Miller, J Verbalis, EK Main
принадлежность
- 1 Отделение акушерства и гинекологии, Больница Пенсильванского университета, Филадельфия.
- PMID: 1530035
- DOI: 10.1016/s0002-9378(11)91585-3
Б. А. Армсон и др. Am J Obstet Gynecol. 1992 сент.
. 1992 г., сен; 167 (3): 758-65.
doi: 10.1016/s0002-9378(11)91585-3.
Авторы
Б А Армсон 1 , П. Самуэльс, Ф. Миллер, Дж. Вербалис, Э. К. Мейн
принадлежность
- 1 Отделение акушерства и гинекологии, больница Пенсильванского университета, Филадельфия.
- PMID: 1530035
- DOI: 10.1016/s0002-9378(11)91585-3
Абстрактный
Цель: Цель исследования состояла в наблюдении и сравнении эффектов гидрохлорида ритодрина и сульфата магния на динамику материнской жидкости.
Дизайн исследования: Четырнадцать женщин с преждевременными родами были проспективно обследованы во время токолитической терапии либо ритодрина гидрохлоридом, либо сульфатом магния. Сердечно-сосудистые и почечные эффекты инфузии кристаллоидов перед лечением сравнивали с теми, которые наблюдались во время токолитической терапии. Профильный анализ и повторные измерения дисперсии использовались для анализа данных.
Полученные результаты: Гидрохлорид ритодрина был связан со снижением коллоидно-осмотического давления, гематокрита и белков сыворотки, а также с увеличением частоты сердечных сокращений матери и плода. Уровни аргинин-вазопрессина повышались в течение первых 2 часов терапии, затем возвращались к исходному уровню. Экскреция натрия снижена, отмечается задержка жидкости. Внутривенное введение сульфата магния также приводило к снижению коллоидно-осмотического давления, но гематокрит, концентрация сывороточного белка, аргинин-вазопрессин, частота сердечных сокращений матери и плода и среднее артериальное давление были минимальными. Экскреция натрия увеличивалась до максимума через 6–8 часов лечения, а затем возвращалась к исходному уровню. Положительный баланс жидкости также был отмечен у пациентов, получавших сульфат магния, но в меньшей степени, чем у пациентов, получавших ритодрин.
Экскреция натрия увеличивалась до максимума через 6–8 часов лечения, а затем возвращалась к исходному уровню. Положительный баланс жидкости также был отмечен у пациентов, получавших сульфат магния, но в меньшей степени, чем у пациентов, получавших ритодрин.
Выводы: Задержка натрия, по-видимому, является основной причиной увеличения объема плазмы у пациентов, получавших ритодрин, тогда как увеличение объема при терапии сульфатом магния, вероятно, связано с внутривенной гипергидратацией. При отсутствии факторов риска повреждения мембраны легочных капилляров имеющиеся данные подтверждают, что объемная перегрузка является основным механизмом отека легких во время токолитической терапии.
Похожие статьи
Дополнительная инфузия сульфата магния не влияет на метаболические изменения, связанные с токолизом ритодрина.

Фергюсон Дж. Э. 2-й, Холбрук Р. Х. младший, Стивенсон Д. К., Хенсли П. А., Креденцер Д. Ferguson JE 2nd, et al. Am J Obstet Gynecol. 1987 г., январь; 156 (1): 103-7. doi: 10.1016/0002-9378(87)
-8. Am J Obstet Gynecol. 1987. PMID: 3541613 Клиническое испытание.Сульфат магния и гидрохлорид ритодрина: рандомизированное сравнение.
Холландер Д.И., Нагей Д.А., Пупкин М.Ю. Холландер Д.И. и соавт. Am J Obstet Gynecol. 1987 март; 156 (3): 631-7. doi: 10.1016/0002-9378(87)-4. Am J Obstet Gynecol. 1987. PMID: 3548382 Клиническое испытание.
Эффективность комбинированного введения сульфата магния и ритодрина при лечении преждевременных родов.
Hatjis CG, Swain M, Nelson LH, Meis PJ, Ernest JM.
 Hatjis CG, et al.
Акушерство Гинекол. 1987 март; 69 (3 часть 1): 317-22.
Акушерство Гинекол. 1987.
PMID: 3822278
Клиническое испытание.
Hatjis CG, et al.
Акушерство Гинекол. 1987 март; 69 (3 часть 1): 317-22.
Акушерство Гинекол. 1987.
PMID: 3822278
Клиническое испытание.Комбинация токолитиков для предотвращения преждевременных родов.
Vogel JP, Nardin JM, Dowswell T, West HM, Oladapo OT. Фогель Дж. П. и соавт. Cochrane Database Syst Rev. 2014 Jul 11;(7):CD006169. doi: 10.1002/14651858.CD006169.pub2. Кокрановская система базы данных, ред. 2014 г. PMID: 25010869 Обзор.
Различные схемы лечения сульфатом магния при токолизе у женщин при преждевременных родах.
McNamara HC, Crowther CA, Brown J. Макнамара Х.К. и др. Cochrane Database Syst Rev. 2015 Dec 14;2015(12):CD011200. doi: 10.1002/14651858.CD011200.




 прод.
прод.

Leave A Comment