Карбонат бария: способы получения и химические свойства
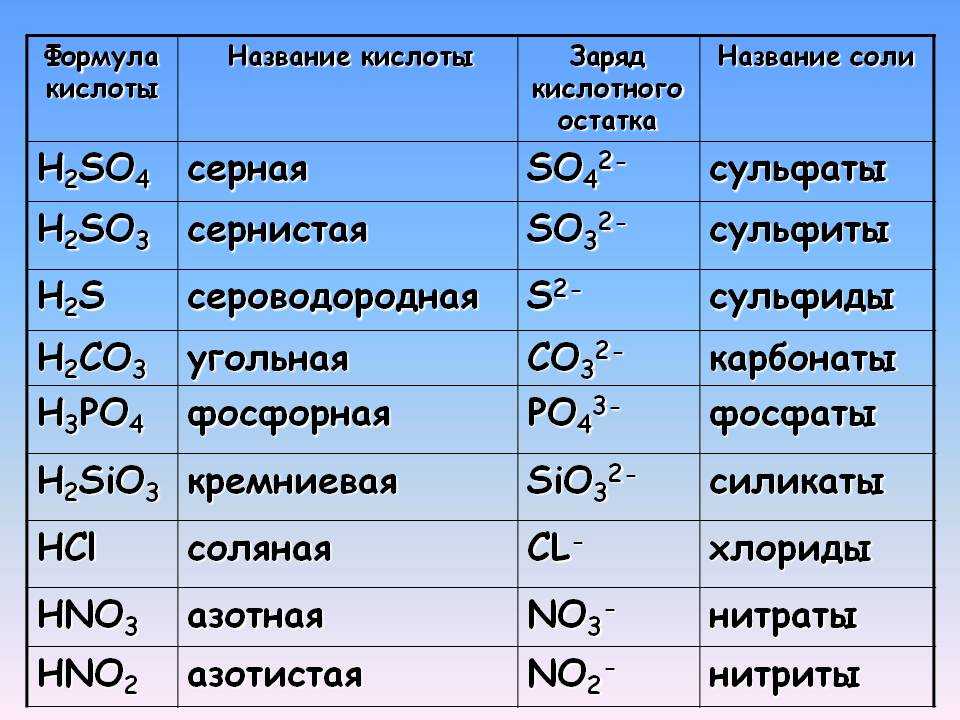
Карбонат бария BaCO3 — соль бария и угольной кислоты. Белый, при нагревании на воздухе разлагается, плавится под избыточным давлением CO2. Не растворяется в воде.
Относительная молекулярная масса Mr = 197,34; относительная плотность для тв. и ж. состояния d= 4,43; tпл = 1555º C при избыточном давлении.
1. Гидроксид бария вступает в взаимодействие с углекислым газом и образует карбонат бария и воду:
Ba(OH)2 + СO2 = BaСO3 + H2O
2. Оксид бария вступает в взаимодействие с углекислым газом при комнатной температуре с образованием карбоната бария:
BaO + CO2 = BaCO3
3. Хлорид бария вступает в реакцию с концентрированным раствором карбоната натрия и образует карбонат бария и хлорид натрия:
Хлорид бария вступает в реакцию с концентрированным раствором карбоната натрия и образует карбонат бария и хлорид натрия:
BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
Качественная реакция на карбонат бария — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат бария образует хлорид бария, углекислый газ и воду:
BaCO3 + 2HCl = BaCl2 + CO2↑ + H2O
1. Карбонат бария разлагается при температуре выше 1000 — 1450º С, с образованием оксида бария и углекислого газа:
BaCO3 = BaO + CO2
2. Карбонат бария вступает в реакцию со сложными веществами:
Карбонат бария вступает в реакцию со сложными веществами:
2.1. Карбонат бария реагирует с кислотами:
2.1.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат бария образует хлорид бария, углекислый газ и воду:
BaCO3 + 2HCl = BaCl2 + CO2↑ + H2O
2.1.2. Карбонат бария реагирует с плавиковой кислотой при 900 — 1100º С. Взаимодействие карбоната бария с плавиковой кислотой приводит к образованию фторида бария, воды и углекислого газа:
BaCO3 + 2HF = BaF2 + CO2 + H2O
2.1.3. Карбонат бария взаимодействует с сероводородной кислотой при 1000º С и образует сульфид бария, воду и углекислый газ:
BaCO3 + H2S = BaS + H2O + CO2
3. Карбонат бария реагирует с простыми веществами:
Карбонат бария реагирует с простыми веществами:
3.1. Карбонат бария при температуре выше 1000º С вступает в реакцию с углеродом (коксом) образуя оксид бария и угарный газ:
BaCO3 + C = BaO + 2CO
Понравилось это:
Нравится Загрузка…
к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.Название вещества А) иодид натрия Б) карбонат бария В) азотная кислота (разб.) Г) диоксид углерода Реагенты 1) соляная кислота, гидроксид бария, сульфат меди(II) 2) диоксид кремния, алюминий, медь 3) карбонат кальция, гидроксид бария, гидроксид калия 4) соляная кислота, уксусная кислота, диоксид углерода 5) нитрат серебра, азотная кислота, хлор
Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать в водном растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. Название вещества А) иодид натрия Б) карбонат бария В) азотная кислота (разб.) Г) диоксид углерода Реагенты 1) соляная кислота, гидроксид бария, сульфат меди(II) 2) диоксид кремния, алюминий, медь 3) карбонат кальция, гидроксид бария, гидроксид калия 4) соляная кислота, уксусная кислота, диоксид углерода 5) нитрат серебра, азотная кислота, хлор
Название вещества А) иодид натрия Б) карбонат бария В) азотная кислота (разб.) Г) диоксид углерода Реагенты 1) соляная кислота, гидроксид бария, сульфат меди(II) 2) диоксид кремния, алюминий, медь 3) карбонат кальция, гидроксид бария, гидроксид калия 4) соляная кислота, уксусная кислота, диоксид углерода 5) нитрат серебра, азотная кислота, хлор
Учебник Курсы Книги Тесты Вопросы Личный кабинет
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Задание ЕГЭ по химии
Линия заданий — 7
Наслаждайтесь
интересным учебником
и решайте
десятки тестов
на Studarium,
мы всегда рады вам! =)
7384.
Название вещества
А) иодид натрия
Б) карбонат бария
В) азотная кислота (разб.)
Г) диоксид углерода
Реагенты
1) соляная кислота, гидроксид бария, сульфат меди(II)
2) диоксид кремния, алюминий, медь
3) карбонат кальция, гидроксид бария, гидроксид калия
4) соляная кислота, уксусная кислота, диоксид углерода
Верный ответ: 5433
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 7384.
P.S. Мы нашли статью, которая относится к данной теме, изучите ее — Азотная кислота 😉
Реакция осаждения (гидроксид натрия и нитрат бария)
- Печать
- Распечатать PDF
Реакция осаждения (гидроксид натрия и нитрат бария): Не могли бы вы помочь мне с другой запутанной химической реакцией, которую мы наблюдали в нашей лаборатории.
При добавлении гидроксида натрия к нитрату бария мы ожидали получения прозрачного раствора, поскольку листы химических данных WACE и наши паспорта безопасности для гидроксида бария указывают на то, что он растворим, как и все нитраты.
Однако образовался белый осадок.
Можете ли вы сказать мне, что происходит?
Голосование:
Дата публикации: 19 ноября 2015 г.
Автор вопроса: Аноним
Теги
Метки
- осадок
- гидроксид натрия
- нитрат бария
- бария гидроксид
- неожиданный осадок
Войдите, чтобы ответить на этот вопрос
Представлено командой Science ASSIST в понедельник, 23 ноября 2015 г., 20:46
Ответ эксперта
Ответ пересмотрен 17 февраля 2023 г.
Теоретически при взаимодействии водного раствора 0,1 М гидроксида натрия с водным раствором 0,1 М нитрата бария не должно быть видимых изменений, так как водные растворы обесцвечиваются. производят нитрат натрия и гидроксид бария.
2 NaOH + Ba(NO 3 ) 2 → 2NaNO 3 + Ba(OH) 2
В большинстве случаев образуется бледно-белый осадок гидроксида бария. Гидроксид бария мало растворим в воде и может образовывать раствор с концентрацией около 0,1 М при комнатной температуре; но гидроксид бария выше 0,1 М будет нерастворимым. Образование бледно-белого осадка может быть связано с тем, что
- гидроксид бария умеренно растворим в воде;
- концентрация образующегося гидроксида бария близка к максимальной концентрации, необходимой для образования осадка;
- любые неточности, которые могли произойти при приготовлении реагентов;
- возможное присутствие ионов карбоната в растворе гидроксида натрия с образованием осадка карбоната бария.

Рекомендации Science ASSIST
- Используйте растворы более низкой концентрации, чтобы избежать осаждения гидроксида бария. При использовании 0,05 М водных растворов нитрата бария и едкого натра образуется прозрачный раствор — видимых изменений нет.
- Убедитесь, что используемый раствор гидроксида натрия свежий. Со временем растворы гидроксида натрия могут поглощать атмосферный углекислый газ с образованием ионов карбоната и даже могут осаждаться в виде карбоната натрия вокруг горлышка бутылки. Барий может реагировать с ионами карбоната с образованием твердого карбоната бария, который не растворяется.
- Замените нитратом бария нитрат группы 1, чтобы получить прозрачный раствор, или нитратом магния или кальция, чтобы получить белый осадок.
- Замените это занятие пробирками и используйте либо ацетатный лист с напечатанной на нем таблицей, либо плитки для нанесения пятен, чтобы уменьшить количество производимых химических отходов. В этом методе используется только одна капля каждого реагента, а ацетатные листы/плитки для пятен можно просто мыть.

- Держите все контейнеры и бутылки закрытыми, когда они не используются.
Дополнительная информация
При понижении группы 2 растворимость гидроксида увеличивается:
Металл | Растворимость гидроксида |
Магний | Нерастворимый |
Кальций | Нерастворимый |
Стронций | Малорастворимый |
Барий | Умеренно растворим |
Радий | Растворимый |
Произведение растворимости (Ksp) является числовой мерой растворимости. Kуд гидроксида бария при 25°С составляет 5 х 10 -3 моль 3 дм -6 . По Ksp можно определить максимальную концентрацию ионов Ba 2+ и OH — , которую можно смешать до образования осадка.
По Ksp можно определить максимальную концентрацию ионов Ba 2+ и OH — , которую можно смешать до образования осадка.
Ba (OH) 2 (s) → Ba 2+ (водн.) + 2OH —
2 , который растворяется до образования осадка;
Концентрация BA 2+ = x
Концентрация OH — = 2x
KSP = [BA 2+ ] [OH — ] 2 = 4x 6161 3 3 3 3 3 3 3 3 3 3 2 3 2 2 2 2 2 2 . Концентрация
4X 3 = 5 x 10 -3
Х = 0,107 М ~ 0,1 М
Соль считается:
Нерастворимой — если она растворяется в воде с образованием водного раствора с концентрацией менее 0,01 моль/л
Малорастворимая — , если он растворяется в воде с образованием водного раствора с концентрацией от 0,01 моль/л до 0,1 моль/л.
Растворимый — , если он растворяется в воде с образованием водного раствора с концентрацией более 0,1 моль/л.
Это произвольная шкала, используемая в WACE. Значения, полученные из приведенных выше расчетов, показывают, что гидроксид бария находится как раз между растворимыми и малорастворимыми солями и дает осадок при высокой концентрации.
Спасибо за ответ на этот вопрос. Ваш ответ отправлен нашей администрации для модерации.
Гидроксид бария — wikidoc
Template:Chembox new
Содержимое
- 1 Подготовка
- 2 использования
- 2.1 Разное применение
- 3 Безопасность
- 4 Каталожные номера
- 5 Внешние ссылки
Подготовка
Гидроксид бария можно получить путем растворения оксида бария (BaO) в воде.
- BaO + 9H 2 O → Ba(OH) 2 ·8H 2 O
Кристаллизуется в виде октагидрата, который при нагревании на воздухе превращается в моногидрат. При 100 °C в вакууме моногидрат дает BaO. [1]
Применение
Гидроксид бария используется в аналитической химии для титрования слабых кислот, особенно органических кислот. Его прозрачный водный раствор гарантированно не содержит карбоната, в отличие от растворов гидроксида натрия и гидроксида калия, поскольку карбонат бария нерастворим в воде. Это позволяет использовать такие индикаторы, как фенолфталеин или тимолфталеин (с изменением щелочной окраски) без риска ошибок титрования из-за наличия слабоосновных карбонат-ионов. [2]
Гидроксид бария используется в органическом синтезе как сильное основание, например для гидролиза эфиров [3] и нитрилов. [4] [5] [6]
- Файл: 2-карбокси-1,3-дигидроксинафталин преп.
 png
png
- Файл: Метилянтарная кислота была использована 90 07 для гидролиза одной из двух эквивалентных сложноэфирных групп в диметилгендекандиоате. [7]
Также используется при получении циклопентанона, [8] диацетоновый спирт [9] и D -Гулоновый γ-лактон. [10]
- File:Diacetone Alcohol prepn.png
Гидроксид бария используется для демонстрации эндотермических реакций, поскольку при смешивании с солью аммония реакция становится холодной, поскольку тепло поглощается из окружающей среды.
Разное применение
- Под названием барит используется в гомеопатических препаратах.
- Также используется для очистки разливов кислоты.
- Также под названием барит используется в производстве фотобумаги для печати.
Безопасность
Гидроксид бария представляет такую же опасность, как и другие сильные основания и водорастворимые соединения бария: он вызывает коррозию и токсичен.

Ссылки
- ↑ Gmelins Handbuch der anorganischen Chemie (8. Aufl.) , Weinheim: Verlag Chemie, 1960, p. 289.
- ↑ Шаблон: VogelQuantitative
- ↑ Мейер, К.; Блох, HS (1945). «Нафторозорцин». Орг. Синтез. 25 :73; Сб. Том. 3 :637.
- ↑ Браун, Великобритания (1946). «Метилянтарная кислота». Орг. Синтез. 26 :54; Сб. Том. 3 :615.
- ↑ Форд, Джаред Х. (1947). «β-аланин». Орг. Синтез. 27 :1; Сб. Том. 3 :34.
- ↑ Anslow, WK; Кинг, Х .; Ортен, JM; Хилл, Р. М. (1925). «Глицин». Орг. Синтез. 4 :31; Сб. Том. 1 :298.
- ↑ Дарем, LJ; Маклеод, DJ; Кейсон, Дж. (1958). «Гендекандиоат метилового водорода». Орг. Синтез. 38 :55; Сб. Том. 4 :635.
- ↑ Торп, Дж. Ф.; Кон, ГАР (1925). «Циклопентанон». Орг. Синтез. 5 :37; Сб.




 png
png

Leave A Comment