9.Классификация мутаций
Мутационная изменчивость возникает в случае появления мутаций — стойких изменений генотипа (т.е. молекул днк), которые могут затрагивать целые хромосомы, их части или отдельные гены. Мутации могут быть полезными, вредными или нейтральными. Согласно современной классификации мутации принято делить на следующие группы. 1. Геномные мутации — связанные с изменением числа хромосом. Особый интерес представляет ПОЛИПЛОИДИЯ — кратное увеличение числа хромосом. Возникновение полиплоидии связанно с нарушением механизма деления клеток. В частности, нерасхождение гомологичных хромосом во время первого деления мейоза приводит к появлению гамет с 2n набором хромосом. Полиплоидия широко распространена у растений и значительно реже у животных (аскарид, шелкопряда, некоторых земноводных). Полиплоидные организмы, как правило, характеризуются более крупными размерами, усиленным синтезом органических веществ, что делает их особенно ценными для селекционных работ.
1. По характеру изменения фенотипа мутации могут быть биохимическими, физиологическими, анатомо-морфологическими.
2. По степени приспособительности мутации делятся на полезные и вредные. Вредные — могут быть летальными и вызывать гибель организма еще в эмбриональном развитии.
3. Мутации бывают прямые и обратные. Последние встречаются гораздо реже. Обычно прямая мутация связана с дефектом функции гена. Вероятность вторичной мутации в обратную сторону в той же точке очень мала, чаще мутируют другие гены.
Мутации чаще рецессивные, так как доминантные проявляются сразу же и легко «отбрасываются» отбором.
4. По характеру изменения генотипа мутации делятся на генные, хромосомные и геномные.
Генные, или точковые, мутации — изменение нуклеотида в одном гене в молекуле ДНК, приводящее к образованию аномального гена, а следовательно, аномальной структуры белка и развитию аномального признака. Генная мутация — это результат «ошибки» при репликации ДНК.
Хромосомные мутации — изменения структуры хромосом, хромосомные перестройки. Можно выделить основные типы хромосомных мутаций:
а) делеция — потеря участка хромосомы;
б) транслокация — перенос части хромосом на другую негомологичную хромосому, как результат — изменение группы сцепления генов;
в) инверсия — поворот участка хромосомы на 180°;
г) дупликация — удвоение генов в определенном участке хромосомы.
Хромосомные мутации приводят к изменению функционирования генов и имеют значение в эволюции вида.
Геномные мутации — изменения числа хромосом в клетке, появление лишней или потеря хромосомы как результат нарушения в мейозе. Кратное увеличение числа хромосом называется полиплоидией. Этот вид мутации часто встречается у растений. Многие культурные растения полиплоидны по отношению к диким предкам. Увеличение хромосом на одну-две у животных приводит к аномалиям развития или гибели организма.
Зная изменчивость и мутации у одного вида, можно предвидеть возможность их появления и у родственных видов, что имеет значение в селекции.
Классификация мутаций | Kursak.NET
9.Классификация мутаций
Мутационная изменчивость возникает в случае появления мутаций – стойких изменений генотипа (т.е. молекул днк), которые могут затрагивать целые хромосомы, их части или отдельные гены.
Мутации могут быть полезными, вредными или нейтральными. Согласно современной классификации мутации принято делить на следующие группы.
1. Геномные мутации – связанные с изменением числа хромосом. Особый интерес представляет ПОЛИПЛОИДИЯ – кратное увеличение числа хромосом. Возникновение полиплоидии связанно с нарушением механизма деления клеток. В частности, нерасхождение гомологичных хромосом во время первого деления мейоза приводит к появлению гамет с 2n набором хромосом.
2. Хромосомные мутации – это перестройки хромосом, изменение их строения. Отдельные участки хромосом могут теряться, удваиваться, менять свое положение.
Как и геномные мутации, хромосомные мутации играют огромную роль в эволюционных процессах.
3. Генные мутации связаны с изменением состава или последовательности нуклеотидов ДНК в пределах гена. Генные мутации наиболее важны среди всех категорий мутаций.
Мутации в естественных условиях случаются редко – одна мутация определенного гена на 1000-100000 клеток. Но мутационный процесс идет постоянно, идет постоянное накопление мутаций в генотипах. А если учесть, что число генов в организме велико, то можно сказать, что в генотипах всех живых организмов имеется значительное число генных мутаций.
1. По характеру изменения фенотипа мутации могут быть биохимическими, физиологическими, анатомо-морфологическими.
2. По степени приспособительности мутации делятся на полезные и вредные. Вредные — могут быть летальными и вызывать гибель организма еще в эмбриональном развитии.
3. Мутации бывают прямые и обратные. Последние встречаются гораздо реже. Обычно прямая мутация связана с дефектом функции гена. Вероятность вторичной мутации в обратную сторону в той же точке очень мала, чаще мутируют другие гены.
Мутации чаще рецессивные, так как доминантные проявляются сразу же и легко «отбрасываются» отбором.
4. По характеру изменения генотипа мутации делятся на генные, хромосомные и геномные.
Генные, или точковые, мутации — изменение нуклеотида в одном гене в молекуле ДНК, приводящее к образованию аномального гена, а следовательно, аномальной структуры белка и развитию аномального признака. Генная мутация — это результат «ошибки» при репликации ДНК.
Хромосомные мутации — изменения структуры хромосом, хромосомные перестройки. Можно выделить основные типы хромосомных мутаций:
а) делеция — потеря участка хромосомы;
б) транслокация — перенос части хромосом на другую негомологичную хромосому, как результат — изменение группы сцепления генов;
в) инверсия — поворот участка хромосомы на 180°;
г) дупликация — удвоение генов в определенном участке хромосомы.
Хромосомные мутации приводят к изменению функционирования генов и имеют значение в эволюции вида.
Геномные мутации — изменения числа хромосом в клетке, появление лишней или потеря хромосомы как результат нарушения в мейозе. Кратное увеличение числа хромосом называется полиплоидией. Этот вид мутации часто встречается у растений. Многие культурные растения полиплоидны по отношению к диким предкам. Увеличение хромосом на одну-две у животных приводит к аномалиям развития или гибели организма.
Зная изменчивость и мутации у одного вида, можно предвидеть возможность их появления и у родственных видов, что имеет значение в селекции.
10.Фенотип и генотип – их различия
Генотип — это совокупность всех генов организма, являющихся его наследственной основой.
Фенотип — совокупность всех признаков и свойств организма, которые выявляются в процессе индивидуального развития в данных условиях и являются результатом взаимодействия генотипа с комплексом факторов внутренней и внешней среды.
Фенотип в общем случае — это то, что можно увидеть (окрас кошки), услышать, ощутить (запах), а также поведение животного.
Каждый биологический вид имеет свойственный только ему фенотип. Он формируется в соответствии с наследственной информацией, заложенной в генах. Однако в зависимости от изменений внешней среды состояние признаков варьирует от организма к организму, в результате чего возникают индивидуальные различия — изменчивость.
45. Цитогенетический мониторинг в животноводстве.
Организация цитогенетического контроля должна строиться с учетом ряда основных принципов. 1. необходимо организация оперативного обмена информацией межу учреждениями, занимающимися вопросами цитогенетического контроля, с этой целью необходимо создание единого банка данных, который включал бы сведения о носителях хромосомной патологии. 2. включение сведений о цитогенетической характеристике животного в племенные документы. 3. закупка семени и племенного материала из-за рубежа должна проводиться лишь при наличии цитогенетического сертификата.
Цитогенетическое обследование в регионах осуществляется с использованием информации о распространенности хромосомных аномалий в породах и линиях:
1) породы и линии, в которых зарегистрированы случаи хромосомной патологии, передающейся по наследству , а также потомки носителей хромосомных аномалий при отсутствии на них цитогенетического паспорта;
2) породы и линии, не исследованные цитогенетически ранее;
3) все случаи массового нарушения репродукции или генетической патологии неясной природы.
В первую очередь обследованию подлежат производители и самцы, предназначенные для ремонта стада, а также племенной молодняк двух первых категорий. Хромосомные аберрации можно разделить на два больших класса: 1.конституциональные – присущие всем клеткам, унаследованные от родителей или возникшие в процессе созревания гамет и 2. соматические – возникающие в отдельных клетках в ходе онтогенеза. С учетом генетической природы и фенотипического проявления хромосомных аномалий несущие их животные могут быть подразделены на четыре группы: 1) носители наследуемых аномалий с предрасположенностью к снижению репродуктивных качеств в среднем на 10 %. Теоретически 50 % потомков наследуют патологию. 2) носители наследуемых аномалий, приводящих к четко выраженному снижению репродукции (30-50 %) и врожденной патологии. Около 50 % потомков наследуют патологию.
3) Животные с аномалиями, возникающими de novo, приводящими к врожденной патологии (моносомии, трисомии и полисомии в системе аутосом и половых хромосом, мозаицизм и химеризм). В подавляющем большинстве случаев такие животные бесплодны. 4) Животные с повышенной нестабильностью кариотипа. Репродуктивная функция снижена, возможна наследственная предрасположенность.
46. плейтропия (множественное действие генов)
Плейотропное действие генов – это зависимость нескольких признаков от одного гена, то есть множественное действие одного гена.
Плейотропное действие гена может быть первичным и вторичным. При первичной плейотропии ген проявляет свой множественный эффект.
При вторичной плейотропии есть один первичный фенотипний проявление гена, вслед за которым развивается ступенчатый процесс вторичных изменений, приводящих к множественным эффектам. При плейотропии, ген, воздействуя на какой то один основной признак, может также менять, модифицировать проявление других генов, в связи с чем введено понятие о генах-модификаторах. Последние усиливают или ослабляют развитие признаков, кодируемых «основным» геном.
Показателями зависимости функционирования наследственных задатков от характеристик генотипа является пенетрантность и экспрессивность.
Рассматривая действие генов, их аллелей необходимо учитывать и модифицирующее влияние среды, в которой розвивается организм. Такое колебание классов при расщеплении в зависимости от условий среды получило название пенетрантность – сила фенотипного проявления. Итак, пенетрантность – это частота проявления гена, явление появления или отсутствия признака у организмов, одинаковых по генотипу.
Пенетрантность значительно колеблется как среди доминантных, так и среди рецессивных генов. Она может быть полной, когда ген проявляется в 100% случаев, или неполной, когда ген проявляется не у всех особей, содержащих его.
Пенетрантностью измеряется процентом организмов с фенотипным признаком от общего количества обследованных носителей соответствующих аллелей.
Если ген полностью, независимо от окружающей среды, определяет фенотипное проявление, то он имеет пенетрантность 100 процентов. Однако некоторые доминантные гены проявляются менее регулярно.
Множественное или плейотропное действие генов связывают с тем, на какой стадии онтогенеза проявляются соответствующие аллели. Чем раньше проявится аллель, тем больше эффект плейотропии.
Учитывая плейотропный эффект многих генов, можно предположить, что часто одни гены выступают в роли модификаторов действия других генов.
47. современные биотехнологии в животноводстве. Применение селекцион.- ген-ое.значение(исск.осем; транспл. Плода).
Трансплантация эмбрионов
Разработка метода искусственного осеменения сельскохозяйственных животных и его практическое применение обеспечили большой успех в области улучшения генетики животных. Использование этого метода в сочетании с длительным хранением семени в замороженном состоянии открыло возможность получения десятков тысяч потомков от одногопроизводителя в год. Этот прием, по существу, решает проблему рационального использования производителей в практике животноводства.
Что касается самок, то традиционные методы разведения животных позволяют получать от них лишь несколько потомков за всю жизнь. Низкий уровень воспроизводства у самок и длительный интервал времени между поколениями (6—7 лет у крупного рогатого скота) ограничивают генетический процесс в животноводстве. Решение этой проблемы ученые видят в применении метода трансплантации эмбрионов. Суть метода состоит в том, что генетически выдающиеся самки освобождаются от необходимости вынашивания плода и вскармливания потомства. Кроме того, их стимулируют с целью увеличения выхода яйцеклеток, которые затем извлекают на стадии ранних зародышей и пересаживают менее ценным в генетическом отношении реципиентам.
Технология трансплантации эмбрионов включает такие основные звенья, как вызывание суперовуляции, искусственное осеменение донора, извлечение эмбрионов (хирургическое или нехирургическое), оценка их качества, кратковременное или длительное хранение и пересадка.
Стимуляция суперовуляции. Самки млекопитающих рождаются с большим (несколько десятков и даже сотен тысяч) числом половых клеток. Большинство из них постепенно погибают в результате атрезии фолликулов. Только небольшое число примордиальных фолликулов переходят в антральные в процессе роста. Однако практически все растущие фолликулы реагируют на гонадотропную стимуляцию, которая приводит их к конечному созреванию. Обработка самок гонадотропинами в фолликулярной фазе полового цикла или в лютеиновой фазе цикла в сочетании с индуцированием регрессии желтого тела простагландином Ф2 (ПГФ2) или его аналогами приводит к множественной овуляции или так называемой суперовуляции.
Крупный рогатый скот. Индукцию суперовуляции у самок крупного рогатого скота проводят обработкой гонадотропинами, фолликулостимулирующим гормоном (ФСГ) или сывороткой крови жеребой кобылы (СЖК), начиная с 9—14-го дня полового цикла. Через 2—3 дня после начала обработки животным вводят простагландин Ф2а или его аналоги, чтобы вызвать регрессию желтого тела.
В связи с тем, что сроки овуляции у гормонально обработанных животных увеличиваются, изменяется и технология их осеменения. Первоначально рекомендовалось многократное осеменение коров с использованием нескольких доз спермы. Обычно вводят 50 млн. живых сперматозоидов в начале охоты и через 12—20 ч осеменение повторяют.
Извлечение эмбрионов. Эмбрионы крупного рогатого скота поступают из яйцевода в матку между 4-м и 5-м днем после начала охоты (между 3-м и 4-м днем после овуляции),
В связи с тем, что нехирургическое извлечение возможно только из рогов матки, то эмбрионы извлекают не ранее 5-го дня после начала охоты.
Несмотря на то что при хирургическом извлечении эмбрионов у крупного рогатого скота достигнуты отличные результаты, этот метод неэффективен — относительно дорогостоящий, неудобный для применения в условиях производства.
Нехирургическое извлечение эмбрионов состоит в использовании катетора.
Наиболее оптимальные сроки для извлечения эмбрионов — 6—8-й день после начала охоты, так как ранние бластоцисты этого возраста наиболее пригодны для глубокого замораживания и могут быть с высокой эффективностью пересажены нехирургическим способом. Корову-донора используют 6—8 раз в год, извлекая по 3—6 эмбрионов.
У овец и свиней нехирургическое извлечение эмбрионов невозможно
ввиду трудности прохождения катетера через шейку в рога матки. Одна
ко хирургическая операция у этих видов животных относительно проста
и непродолжительна.
Пересадка эмбрионов. Параллельно с разработкой хирургического метода извлечения эмбрионов у крупного рогатого скота значительный прогресс был достигнут и в нехирургической пересадке эмбрионов. В пайету набирают свежую питательную среду (столбик длиной 1,0—1,3 см), затем небольшой пузырек воздуха (0,5 см) и далее основной объем среды с эмбрионом (2—3 см). После этого засасывают немного воздуха (0,5 см) и питательную среду (1,0—1,5 см). Пайету с эмбрионом помещают в катетер Кассу и до момента пересадки хранят в термостате при 37°С. Нажатием на шток катетера выдавливают содержимое пайеты вместе с эмбрионом в рог матки.
Хранение эмбрионов. Применение метода трансплантации эмбрионов потребовало разработки эффективных методов их хранения в период между извлечением и пересадкой. В производственных условиях эмбрионы обычно извлекают утром, а пересаживают в конце дня. Для хранения эмбрионов в течение этого времени используют фосфатный буфер с некоторыми модификациями при добавлении эмбриональной сыворотки крупного рогатого скота и при комнатной температуре или температуре 37°С.
Наблюдения показывают, что эмбрионы крупного рогатого скота можно культивировать in vitro до 24 ч без заметного снижения их последующей приживляемости.
Пересадка эмбрионов свиней, культивируемых 24 ч, сопровождается нормальной приживляемостью.
Выживаемость эмбрионов в определенной степени может быть увеличена охлаждением их ниже температуры тела. Чувствительность эмбрионов к охлаждению зависит от вида животного.
Эмбрионы свиней особенно чувствительны к охлаждению. Пока не удалось сохранить жизнеспособность эмбрионов свиней на ранних стадиях развития после охлаждения их ниже 10—15°С .
Эмбрионы крупного рогатого скота на ранних стадиях развития также очень чувствительны к охлаждению до 0°С.
Эксперименты последних лет позволили определить оптимальные соотношения между скоростью охлаждения и оттаивания эмбрионов крупного рогатого скота. Установлено, что если эмбрионы охлаждают медленно (1°С/мин) до очень низкой температуры (ниже— 50°С) с последующим переносом в жидкий азот, то они требуют и медленного оттаивания (25°С/мин или медленнее). Быстрое оттаивание таких эмбрионов может вызвать осмотическую регидратацию и разрушение. Если эмбрионы замораживают медленно (1°С/мин) только до – 25 и 40°С с последующим переносом в жидкий азот, то их можно оттаивать очень быстро (300°С/мин). В этом случае остаточная вода при переносе в жидкий азот трансформируется в стекловидное состояние .
Выявление этих факторов привело к упрощению процедуры замораживания и оттаивания эмбрионов крупного рогатого скота. В частности, оттаивают эмбрионы, как и сперму, в теплой воде при 35°С в течение 20 с непосредственно перед пересадкой без применения специального оборудования с заданной скоростью повышения температуры.
Оплодотворение яйцеклеток вне организма животного
Разработка системы оплодотворения и обеспечения ранних стадий развития эмбрионов млекопитающих вне организма животного (in vitro) имеет огромное значение в решении ряда научных задач и практических вопросов, направленных на повышение эффективности разведения животных.
Для этих целей необходимы эмбрионы на ранних стадиях развития, которые можно извлечь только хирургическими методами из яйцеводов, что является трудоемким и не дает достаточного числа зародышей для проведения этой работы.
Оплодотворение яйцеклеток млекопитающих in vitro включает следующие основные этапы: созревание ооцитов, капацитацию сперматозоидов, оплодотворение и обеспечение ранних стадий развития.
Созревание ооцитов in vitro. Большое число половых клеток в яичниках млекопитающих, в частности у крупного рогатого скота, овец и свиней с высоким генетическим потенциалом, представляет источник огромного потенциала воспроизводительной способности этих животных в ускорении генетического прогресса по сравнению с использованием возможностей нормальной овуляции. У этих видов животных, как и других млекопитающих, число ооцитов, овулирующих спонтанно во время охоты, составляет только незначительную часть от тысяч ооцитов, находящихся в яичнике при рождении животного. Остальные ооциты регенерируют внутри яичника или, как говорят обычно, подвергаются атрезии. Естественно возникал вопрос, нельзя ли выделить ооциты из яичников путем соответствующей обработки и провести их дальнейшее оплодотворение вне организма животного. В настоящее время не разработаны методы использования всего запаса ооцитов в яичниках животных, но значительное число ооцитов может быть получено из полостных фолликулов для дальнейшего их созревания и оплодотворения вне организма.
В настоящее время применение на практике нашло созревание in vitro только ооцитов крупного рогатого скота. Ооциты получают из яичников коров после убоя животных и путем прижизненного извлечения, 1—2 раза в неделю. В первом случае яичники берут от животных после убоя, доставляют в лабораторию в термостатированном контейнере в течение 1,5—2,0 ч. В лаборатории яичники дважды промывают свежим фосфатным буфером. Ооциты извлекают из фолликулов, диаметр которых 2—6 мм, путем отсасывания или разрезания яичника на пластинки. Ооциты собирают в среду ТСМ 199 с добавлением 10 % сыворотки крови от коровы в охоте, затем дважды промывают и отбирают для дальнейшего созревания in vitro только ооциты с компактным кумулюсом и однородной цитоплазмой.
В последнее время разработан способ прижизненного извлечения ооцитов из яичников коров с помощью ультразвукового прибора или лапароскопа. При этом ооциты отсасывают из фолликулов, диаметр которых не менее 2 мм, 1—2 раза в неделю от одного и того же животного. В среднем получают однократно 5—6 ооцитов на животное. Менее 50 % ооцитов пригодны для созревания in vitro.
Положительное значение – несмотря на низкий выход ооцитов, при каждом извлечении возможность многократного использования животного.
Капацитация сперматозоидов. Важным этапом в разработке метода оплодотворения у млекопитающих было открытие явления капацитации спермиев. В 1951 г. М.К. Чанг и одновременно с ним Г.Р. Аустин установили, что оплодотворение у млекопитающих наступает только в том случае, если спермин в течение нескольких часов до овуляции находятся в яйцеводе животного. Основываясь на наблюдениях по изучению проникновения спермиев яйцеклетки крысы в различные сроки после спаривания Аустин ввел термин капацитации. Он означает, что в спермин должны произойти некоторые физиологические изменения до того, как сперматозоид приобретет способность к оплодотворению.
Разработано несколько методов капацитации эякулированных спермиев домашних животных. Для удаления белков с поверхности спермиев, которые, по-видимому, тормозят капацитацию спермиев, была использована среда с высокой ионной силой.
Однако наибольшее признание получил способ капацитации сперматозоидов с использованием гепарина (Дж. Парриш и др., 1985). Пайеты с замороженным семенем быка оттаивают в водяной бане при 39°С в течение 30—40 с. Примерно 250 мкл оттаянного семени подслаивают под 1 мл среды для капацитации. Среда для капацитации состоит из модифицированной среды Тиройда, без ионов кальция. После инкубации в течение одного часа верхний слой среды объемом 0,5—0,8 мл, содержащий большинство подвижных сперматозоидов, удаляют из пробирки и промывают дважды центрифугированием при 500 g в течение 7—10 мин. После 15 мин инкубации с гепарином (200 мкг/мл) суспензию разбавляют до концентрации 50 миллионов сперматозоидов в мл.
Оплодотворение in vitro и обеспечение ранних стадий развития эмбрионов. Оплодотворение яйцеклеток у млекопитающих осуществляется в яйцеводах. Это затрудняет доступ исследователя к изучению условий среды, в которой происходит процесс оплодотворения. Поэтому система оплодотворения in vitro была бы ценным аналитическим инструментом для изучения биохимических и физиологических факторов, включающихся в процесс успешного соединения гамет.
Применяют следующую схему оплодотворения in vitro и культивирования ранних эмбрионов крупного рогатого скота. Оплодотворение in vitro проводят в капле модифицированной среды Тироида. После созревания in vitro ооциты частично очищают от окружающих экспандированных кумулюсных клеток и переносят в микрокапле по пять ооцитов в каждой. Суспензия сперматозоидов объемом 2—5 мкл добавляется к среде с ооцитами, чтобы достичь концентрации сперматозоидов в каплях 1—1,5 млн/мл. Через 44—48 ч после осеменения определяют наличие дробления ооцитов. Затем эмбрионы помещают на монослой эпителиальных клеток для дальнейшего развития в течение 5 дней.
Межвидовые пересадки эмбрионов и получение химерных животных
Принято считать, что успешная пересадка эмбрионов может быть осуществлена только между самками одного вида. Пересадка эмбрионов, например, овец козам и наоборот сопровождается их приживляемостью, но не завершается рождением потомства. Во всех случаях межвидовых беременностей непосредственной причиной абортов является нарушение функции плаценты, по-видимому, за счет иммунологической реакции материнского организма на инородные антигены плода. Эта несовместимость может быть преодолена получением химерных эмбрионов с помощью микрохирургии.
Сначала были получены химерные животные путем объединения бластомеров из эмбрионов одного вида. С этой целью получали сложные химерные эмбрионы овец объединением 2-, 4-, 8-клеточных эмбрионов от 2—8 родителей.
Эмбрионы вводили в агар и переносили в лигатированные яйцеводы овец для развития до стадии ранней бластоцисты. Нормально развивающиеся бластоцисты пересаживали реципиентам и получили живых ягнят, большинство из которых оказались химерными по данным анализа крови и внешним признакам.
Получены химеры и у крупного рогатого скота (Г. Брем и др., 1985) соединением половинок 5—6,5-дневных эмбрионов. Пять из семи телят, полученных после нехирургической пересадки агрегированных эмбрионов, не имели признаков химеризма.
Клонирование животных
Число потомков от одной особи, как правило, у высших животных бывает небольшим, а специфический комплекс генов, определяющий высокую продуктивность, возникает редко и в последующих поколениях претерпевает значительные изменения.
Получение однояйцовых близнецов имеет большое значение для животноводства. С одной стороны, увеличивается выход телят от одного донора, а с другой — появляются генетически идентичные двойни.
Возможность микрохирургического разделения эмбрионов млекопитающих на ранних стадиях развития на две и более части, чтобы каждая в последующем развивалась в отдельный организм, была высказана несколько десятилетий назад.
На основе этих исследований можно предположить, что резкое уменьшение числа клеток эмбриона является основным фактором, понижающим способность этих эмбрионов развиваться в жизнеспособные бластоцисты, хотя стадия развития, на которой происходит разделение, имеет малое значение.
В настоящее время применяют простую технику разделения эмбрионов на различной стадии развития (от поздней морулы до вылупившейся бластоцисты) на две равные части.
Простая техника разделения разработана и для 6-дневных эмбрионов свиней. При этом стеклянной иглой разрезают внутреннюю клеточную массу эмбриона.
kursak.net
Классификация мутаций
Мутационная изменчивость возникает в случае появления мутаций — стойких изменений генотипа (т.е. молекул днк), которые могут затрагивать целые хромосомы, их части или отдельные гены.
Мутации могут быть полезными, вредными или нейтральными. Согласно современной классификации мутации принято делить на следующие группы.
1. Геномные мутации — связанные с изменением числа хромосом. Особый интерес представляет ПОЛИПЛОИДИЯ — кратное увеличение числа хромосом, т.е. вместо 2n хромосомного набора возникает набор 3n,4n,5n и более. Возникновение полиплоидии связанно с нарушением механизма деления клеток. В частности, нерасхождение гомологичных хромосом во время первого деления мейоза приводит к появлению гамет с 2n набором хромосом.
Полиплоидия широко распространена у растений и значительно реже у животных (аскарид, шелкопряда, некоторых земноводных). Полиплоидные организмы, как правило, характеризуются более крупными размерами, усиленным синтезом органических веществ, что делает их особенно ценными для селекционных работ.
Изменение числа хромосом, связанное с добавлением или потерей отдельных хромосом, называется анеуплоидией. Мутацию анеуплоидии можно записать как 2n-1, 2n+1, 2n-2 и т.д. Анеуплоидия свойственна всем животным и растениям. У человека ряд заболеваний связан именно с анеуплоидией. Например, болезнь Дауна связана с наличием лишней хромосомы в 21-й паре.
2. Хромосомные мутации — это перестройки хромосом, изменение их строения. Отдельные участки хромосом могут теряться, удваиваться, менять свое положение.
Схематично это можно показать следующим образом:
ABCDE нормальный порядок генов
ABBCDE удвоение участка хромосомы
ABDE потеря одного участка
ABEDC поворот участка на 180 градусов
ABCFG обмен участками с негомологичной хромосомой
Как и геномные мутации, хромосомные мутации играют огромную роль в эволюционных процессах.
3. Генные мутации связаны с изменением состава или последовательности нуклеотидов ДНК в пределах гена. Генные мутации наиболее важны среди всех категорий мутаций.
Синтез белка основан на соответствии расположения нуклеотидов в гене и порядком аминокислот в молекуле белка. Возникновение генных мутаций (изменение состава и последовательности нуклеотидов) изменяет состав соответствующих белков-ферментов и в итоге к фенотипическим изменениям. Мутации могут затрагивать все особенности морфологии, физиологии и биохимии организмов. Многие наследственные болезни человека также обусловлены мутациями генов.
Мутации в естественных условиях случаются редко — одна мутация определенного гена на 1000-100000 клеток. Но мутационный процесс идет постоянно, идет постоянное накопление мутаций в генотипах. А если учесть, что число генов в организме велико, то можно сказать, что в генотипах всех живых организмов имеется значительное число генных мутаций.
Мутации — это крупнейший биологический фактор, обуславливающий огромную наследственную изменчивость организмов, что дает материал для эволюции.
Причинами мутаций могут быть естественные нарушения в метаболизме клеток (спонтанные мутации), так и действие различных факторов внешней среды (индуцированные мутации). Факторы, вызывающие мутации называют мутагенами. Мутагенами могут быть физические факторы — радиация, температура …. К биологическим мутагена относят вирусы, способные осуществлять перенос генов между организмами не только близких, но далеких систематических групп.
Хозяйственная деятельность человека принесла в биосферу огромное количество мутагенов.
Большинство мутаций неблагоприятны для жизни особи, но иногда возникают такие мутации, которые могут представлять интерес для ученых-селекционеров. В настоящее время созданы методы направленного мутагенеза.
1. По характеру изменения фенотипа мутации могут быть биохимическими, физиологическими, анатомо-морфологическими.
2. По степени приспособительности мутации делятся на полезные и вредные. Вредные — могут быть летальными и вызывать гибель организма еще в эмбриональном развитии.
Чаще мутации вредны, так как признаки в норме являются результатом отбора и адаптируют организм к среде обитания. Мутация всегда изменяет адаптацию. Степень ее полезности или бесполезности определяется временем. Если мутация дает возможность организму лучше приспособиться, дает новый шанс выжить, то она «подхватывается» отбором и закрепляется в популяции.
3. Мутации бывают прямые и обратные. Последние встречаются гораздо реже. Обычно прямая мутация связана с дефектом функции гена. Вероятность вторичной мутации в обратную сторону в той же точке очень мала, чаще мутируют другие гены.
Мутации чаще рецессивные, так как доминантные проявляются сразу же и легко «отбрасываются» отбором.
4. По характеру изменения генотипа мутации делятся на генные, хромосомные и геномные.
Генные, или точковые, мутации — изменение нуклеотида в одном гене в молекуле ДНК, приводящее к образованию аномального гена, а следовательно, аномальной структуры белка и развитию аномального признака. Генная мутация — это результат «ошибки» при репликации ДНК.
Результатом генной мутации у человека являются такие заболевания, как серповиднокле-точная анемия, фенилкетонурия, дальтонизм, гемофилия. Вследствие генной мутации возникают новые аллели генов, что имеет значение для эволюционного процесса.
Хромосомные мутации — изменения структуры хромосом, хромосомные перестройки. Можно выделить основные типы хромосомных мутаций:
а) делеция — потеря участка хромосомы;
б) транслокация — перенос части хромосом на другую негомологичную хромосому, как результат — изменение группы сцепления генов;
в) инверсия — поворот участка хромосомы на 180°;
г) дупликация — удвоение генов в определенном участке хромосомы.
Хромосомные мутации приводят к изменению функционирования генов и имеют значение в эволюции вида.
Геномные мутации — изменения числа хромосом в клетке, появление лишней или потеря хромосомы как результат нарушения в мейозе. Кратное увеличение числа хромосом называется полиплоидией (Зп, 4/г и т. д.). Этот вид мутации часто встречается у растений. Многие культурные растения полиплоидны по отношению к диким предкам. Увеличение хромосом на одну-две у животных приводит к аномалиям развития или гибели организма. Пример: синдром Дауна у человека — трисомия по 21-й паре, всего в клетке 47 хромосом. Мутации могут быть получены искусственно с помощью радиации, рентгеновских лучей, ультрафиолета, химическими агентами, тепловым воздействием.
Закон гомологических рядов Н.И. Вавилова. Русский ученый-биолог Н.И. Вавилов установил характер возникновения мутаций у близкородственных видов: «Роды и виды, генетически близкие, характеризуются сходными рядами наследственной изменчивости с такой правильностью, что, зная ряд форм в пределах одного вида, можно предвидеть нахождение параллельных форм у других видов и родов».
Открытие закона облегчило поиски наследственных отклонений. Зная изменчивость и мутации у одного вида, можно предвидеть возможность их появления и у родственных видов, что имеет значение в селекции.
biofile.ru
1).Генные мутации. Причина их возникновения. Классификация генных мутаций.
Генные, или точковые, мутации связаны с изменением состава или последовательности нуклеотидов в пределах участка ДНК — гена. Нуклеотид внутри гена может быть заменен на другой или потерян, может быть вставлен лишний нуклеотид и т.д. Генные мутации могут привести к тому, что мутантный ген либо перестанет работать и тогда не образуются соответствующие и-РНК и белок, либо синтезируется белок с измененными свойствами, что приводит к изменению фенотипических признаков особи. Вследствие генных мутаций образуются новые аллели, что имеет большое эволюционное значение.
В результате генных мутаций происходят замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена. Если под действием мутации изменяется один нуклеотид, говорят о точковых мутациях . Точковые мутации с заменой оснований разделяют на два класса: транзиции (замена пурина на пурин или пиримидина на пиримидин) и трансверсии (замена пурина на пиримидин или наоборот). Из-за вырожденности генетического кода могут быть три генетических последствия точковых мутаций: сохранение смысла кодона ( синонимическая замена нуклеотида ), изменение смысла кодона, приводящее к замене аминокислоты в соответствующем месте полипептидной цепи ( миссенс-мутация ) или образование бессмысленного кодона с преждевременной терминацией ( нонсенс-мутация ). В соответствии с этим получают название и мутации, приводящие к образованию бессмысленных триплетов (например амбер-мутация).
Причины возникновения мутаций
По причинам возникновения различают спонтанные и индуцированные мутации.
Спонтанные (самопроизвольные) мутации возникают без видимых причин. Эти мутации иногда рассматривают как ошибки трех Р: процессов репликации, репарации и рекомбинации ДНК. Это означает, что процесс возникновения новых мутаций находится под генетическим контролем организма. Например, известны мутации, которые повышают или понижают частоту других мутаций; следовательно, существуют гены-мутаторы и гены-антимутаторы.
В то же время, частота спонтанных мутаций зависит и от состояния клетки (организма). Например, в условиях стресса частота мутаций может повышаться.
Индуцированные мутации возникают под действием мутагенов.
Мутагены – это разнообразные факторы, которые повышают частоту мутаций.
Впервые индуцированные мутации были получены отечественными генетиками Г.А. Надсоном и Г.С. Филипповым в 1925 г. при облучении дрожжей излучением радия.
Различают несколько классов мутагенов:
– Физические мутагены: ионизирующие излучения, тепловое излучение, ультрафиолетовое излучение.
– Химические мутагены: аналоги азотистых оснований (например, 5-бромурацил), альдегиды, нитриты, метилирующие агенты, гидроксиламин, ионы тяжелых металлов, некоторые лекарственные препараты и средства защиты растений.
– Биологические мутагены: чистая ДНК, вирусы, антивирусные вакцины.
– Аутомутагены – промежуточные продукты обмена веществ (интермедиаты). Например, этиловый спирт сам по себе мутагеном не является. Однако в организме человека он окисляется до ацетальдегида, а это вещество уже является мутагеном.
studfiles.net
3.4.2.3. Изменения нуклеотидных последовательностей днк. Генные мутации
Нескорректированные изменения химической структуры генов, воспроизводимые в последовательных циклах репликации и проявляющиеся у потомства в виде новых вариантов признаков, называют генными мутациями.
Изменения структуры ДНК, образующей ген, можно разделить на три группы. Мутации первой группы заключаются в замене одних оснований другими. Они составляют около 20% спонтанно возникающих генных изменений. Вторая группа мутаций обусловлена сдвигом рамки считывания, происходящим при изменении количества нуклеотидных пар в составе гена. Наконец, третью группу представляют мутации, связанные с изменением порядка нуклеотидных последовательностей в пределах гена (инверсии).
Мутации по типу замены азотистых оснований. Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид. Примером может служить дезаминирование цитозина, превращающегося в урацил самопроизвольно или под влиянием азотистой кислоты (рис. 3.18). Образующийся при этом урацил, не замеченный ферментом ДНК-гликозилазой, при репликации соединяется с аденином, который впоследствии присоединяет тимидиловый нуклеотид. В результате пара Ц—Г замещается в ДНК парой Т—А (рис. 3.19, I). Дезаминирование метилированного цитозина превращает его в тимин (см. рис. 3.18). Тимидиловый нуклеотид, являясь естественным компонентом ДНК, не обнаруживается ферментами репарации как изменение и при следующей репликации присоединяет адениловый нуклеотид. В результате вместо пары Ц—Г в молекуле ДНК также появляется пара Т—А (рис. 3.19, II).
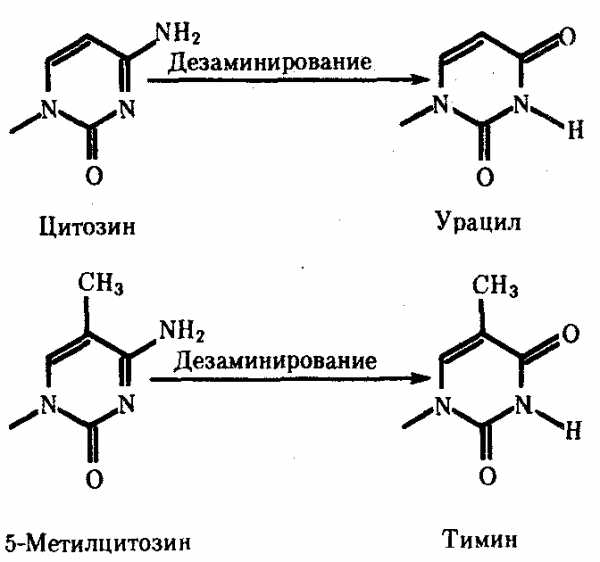
Рис. 3.18. Спонтанное дезаминирование цитозина
Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую. Примером этого может служить присоединение в ходе репликации к аденину материнской цепи нуклеотида с 5-бромурацилом (5-БУ), аналогичного тимидиловому нуклеотиду. При последующей репликации 5-БУ охотнее присоединяет к себе не аденин, а гуанин. Гуанин в ходе дальнейшего удвоения образует комплементарную пару с цитозином. В итоге пара А—Т заменяется в молекуле ДНК парой Г—Ц (рис. 3.20).
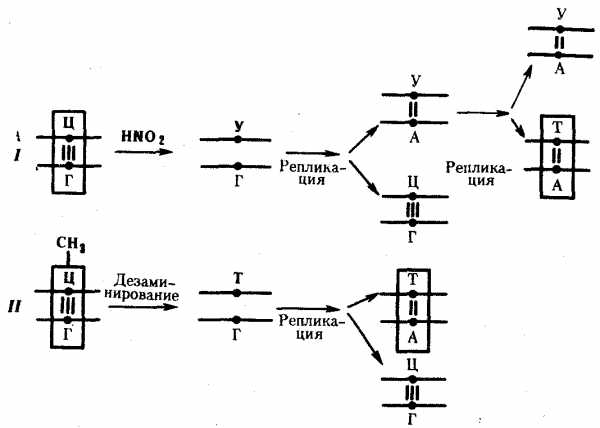
Рис. 3. 19. Мутации по типу замены основания
(дезаминирование азотистых оснований в цепи ДНК):
I — превращение цитозина в урацил, замена Ц—Г-пары на Т—А-пару;
II — превращение метил—цитозина в тимин, замена Ц—Г-пары на Т—А-пару
Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК.
Рис. 3.20. Мутации по типу замены оснований
(включение аналога азотистого основания при репликации ДНК)
Следствием замены одной пары комплементарных нуклеотидов на другую является образование нового триплета в нуклеотидной последовательности ДНК, кодирующей последовательность аминокислот в пептидной цепи. Это может и не отразиться на структуре пептида в том случае, если новый триплет будет «синонимом» прежнего, т.е. будет кодировать ту же аминокислоту. Например, аминокислота валин шифруется четырьмя триплетами: ЦАА, ЦАГ, ЦАТ, ЦАЦ. Замена третьего основания в любом из этих триплетов не изменит его смысла (вырожденность генетического кода).
В том случае, когда вновь возникший триплет шифрует другую аминокислоту, изменяются структура пептидной цепи и свойства соответствующего белка. В зависимости от характера и места случившейся замены специфические свойства белка изменяются в разной степени. Известны случаи, когда замена лишь одной аминокислоты в пептиде существенно влияет на свойства белка, что проявляется в изменении более сложных признаков. Примером может служить изменение свойств гемоглобина человека при серповидно-клеточной анемии (рис. 3.21). В таком гемоглобине—(HbS) (в отличие от нормального НbА) — в р-глобиновых цепях в шестом положении глутаминовая кислота заменена валином. Это является следствием замены одного из оснований в триплете, шифрующем глутаминовую кислоту (ЦТТ или ЦТЦ). В результате появляется триплет, шифрующий валин (ЦАТ или ЦАЦ). В данном случае замена одной аминокислоты в пептиде существенно изменяет свойства глобина, входящего в состав гемоглобина (снижается его способность связываться с 02), у человека развиваются признаки серповидно-клеточной анемии.
В некоторых случаях замена одного основания на другое может привести к появлению одного из нонсенс-триплетов (АТТ, АТЦ, АЦТ), не шифрующего никакой аминокислоты. Последствием такой замены будет прерывание синтеза пептидной цепи. Подсчитано, что замены нуклеотидов в одном триплете приводят в 25% случаев к образованию триплетов-синонимов; в 2—3 —бессмысленных триплетов, в 70— 75% —к возникновению истинных генных мутаций.
Таким образом, мутации по типу замены оснований могут возникать как в результате спонтанных изменений структуры основания в одной из цепей уже существующей двойной спирали ДНК, так и в ходе репликации во вновь синтезируемой цепи. В том случае, если эти изменения не исправляются в процессе репарации (или, наоборот, возникают в ходе репарации), они фиксируются в обеих цепях и далее будут воспроизводиться в следующих циклах репликации. Следовательно, важным источником возникновения таких мутаций являются нарушения процессов репликации и репарации.
Мутации со сдвигом рамки считывания. Этот тип мутаций составляет значительную долю спонтанных мутаций. Они происходят вследствие выпадения или вставки в нуклеотидную последовательность ДНК одной или нескольких пар комплементарных нуклеотидов. Большая часть изученных мутаций, вызывающих сдвиг рамки, обнаружена в последовательностях, состоящих из одинаковых нуклеотидов.
Изменению числа нуклеотидных пар в цепи ДНК способствуют воздействия на генетический материал некоторых химических веществ, например акридиновых соединений. Деформируя структуру двойной спирали ДНК, они приводят к вставке дополнительных оснований или их выпадению при репликации. Примером служат мутации, полученные у фага Т4 при воздействии профлавина. Они состоят во включении или удалении всего одной нуклеотидной пары. Важной причиной изменения количества нуклеотидных пар в гене по типу крупных делений (выпадений) может быть рентгеновское облучение. У плодовой мухи, например, известна мутация гена, контролирующего окраску глаза, которая вызывается облучением и состоит в делении порядка 100 нуклеотидных пар.
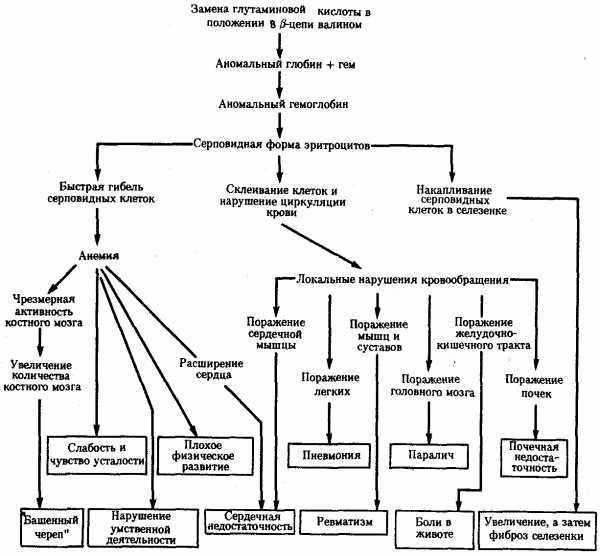
Рис. 3.21. Плейотропный эффект замены одной аминокислоты в β-цепи гемоглобина человека, приводящей к развитию серповидно-клеточной анемии
Большое число мутаций по типу вставок происходит вследствие включения в последовательность нуклеотидов подвижных генетических элементов — транспозонов. Транспозоны — это достаточно протяженные нуклеотидные последовательности, встроенные в геномы эу- и прокариотических клеток, способные самопроизвольно менять свое положение (см. разд. 3.6.4.3). С определенной вероятностью вставки и делении могут возникать в результате ошибок рекомбинации при неравноценном внутригенном кроссинговере (рис. 3.22).
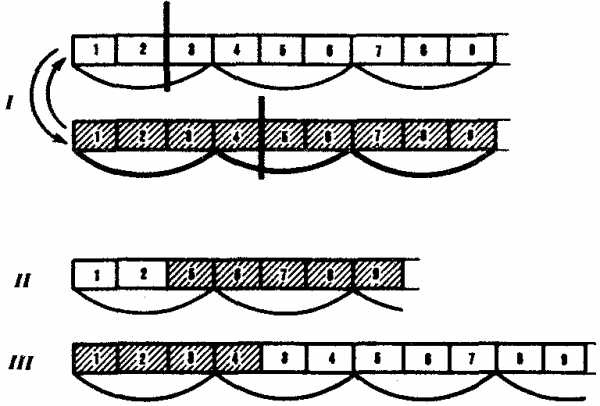
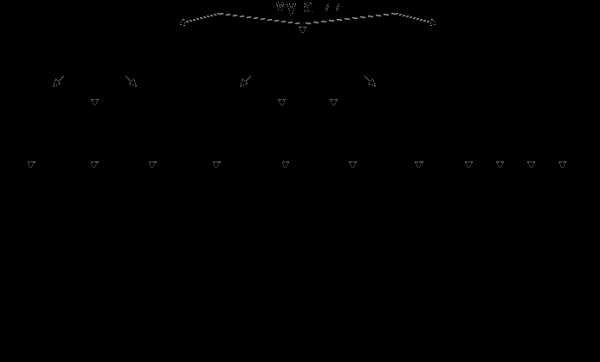
Рис. 3.22. Мутации со сдвигом рамки считывания (неравноценный обмен при внутригенном кроссинговере):
I — разрывы аллельпых генов в разных участках и обмен фрагментами между ними;
II — выпадение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания;
III —удвоение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания
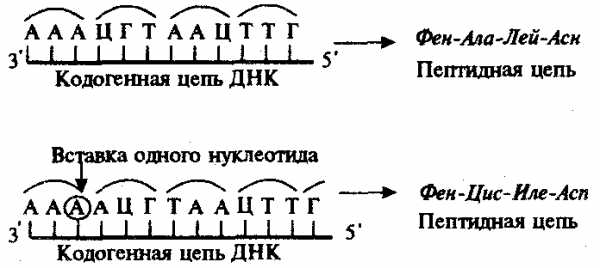
Рис. 3.23. Следствие изменения количества нуклеотидных пар в молекуле ДНК
Сдвиг рамки считывания в результате вставки одного нуклеотида в кодогенную цепь приводит к изменению состава зашифрованного в ней пептида
При непрерывности считывания и неперекрываемости генетического кода изменение количества нуклеотидов, как правило, приводит к сдвигу рамки считывания и изменению смысла биологической информации, записанной в данной последовательности ДНК (рис. 3.23). Однако, если количество вставленных или утраченных нуклеотидов кратно трем, сдвига рамки может не произойти, но это приведет к включению дополнительных аминокислот или выпадению части их из полипептидной цепи. Возможным следствием сдвига рамки является возникновение нонсенс-триплетов, ведущее к синтезу укороченных пептидных цепей.
Мутации по типу инверсии нуклеотидных последовательностей в гене. Данный тип мутаций происходит вследствие поворота участка ДНК на 180°. Обычно этому предшествует образование молекулой ДНК петли, в пределах которой репликация идет в направлении, обратном правильному.
В пределах инвертированного участка нарушается считывание информации, в результате изменяется аминокислотная последовательность белка.
studfiles.net
5. По уровню возникновения:
— генные – затрагивают один или несколько нуклеотидов внутри одного гена;
— хромосомные – затрагивают множество нуклеотидов или структуру хромосомы в целом (происходит перестройка хромосом):
1) дупликация — удвоение участка;
2) делеция – нехватка участка;
3) инверсия – поворот участка на 180;
4) транслокация – перемещение участка на негомологичную хромосому.
— геномные– когда происходит нарушение численности хромосом (полиплоидия – кратное увеличение числа хромосом).
Остановимся подробнее на этой классификации.
Генные мутации (изменения нуклеотидных последовательностей днк)
Нескорректированные изменения химической структуры генов, воспроизводимые в последовательных циклах репликации и проявляющиеся у потомства в виде новых вариантов признаков, называют генными мутациями.
Изменения структуры ДНК, образующей ген, можно разделить на три группы.
1. Мутации первой группы заключаются в замене одних оснований другими. Они составляют около 20% спонтанно возникающих генных изменений.
2. Вторая группа мутаций обусловлена сдвигом рамки считывания, происходящим при изменении количества нуклеотидных пар в составе гена.
3. Третью группу представляют мутации, связанные с изменением порядка нуклеотидных последовательностей в пределах гена (инверсии).
1. Мутации по типу замены азотистых оснований. Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид.
Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую.
Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК.
В том случае, когда вновь возникший триплет шифрует другую аминокислоту, изменяются структура пептидной цепи и свойства соответствующего белка. В зависимости от характера и места случившейся замены специфические свойства белка изменяются в разной степени. Известны случаи, когда замена лишь одной аминокислоты в пептиде существенно влияет на свойства белка, что проявляется в изменении более сложных признаков.
Примером может служить изменение свойств гемоглобина человека при серповидно-клеточной анемии (рис. 3.21). В таком гемоглобине—(HbS) (в отличие от нормального НbА) — в р-глобиновых цепях в шестом положении глутаминовая кислота заменена валином. Это является следствием замены одного из оснований в триплете, шифрующем глутаминовую кислоту (ЦТТ или ЦТЦ). В результате появляется триплет, шифрующий валин (ЦАТ или ЦАЦ). В данном случае замена одной аминокислоты в пептиде существенно изменяет свойства глобина, входящего в состав гемоглобина (снижается его способность связываться с 02), у человека развиваются признаки серповидно-клеточной анемии.
В некоторых случаях замена одного основания на другое может привести к появлению одного из нонсенс-триплетов (АТТ, АТЦ, АЦТ), не шифрующего никакой аминокислоты. Последствием такой замены будет прерывание синтеза пептидной цепи. Подсчитано, что замены нуклеотидов в одном триплете приводят в 25% случаев к образованию триплетов-синонимов; в 2—3 —бессмысленных триплетов, в 70— 75% —к возникновению истинных генных мутаций.
Таким образом, мутации по типу замены оснований могут возникать как в результате спонтанных изменений структуры основания в одной из цепей уже существующей двойной спирали ДНК, так и в ходе репликации во вновь синтезируемой цепи. В том случае, если эти изменения не исправляются в процессе репарации (или, наоборот, возникают в ходе репарации), они фиксируются в обеих цепях и далее будут воспроизводиться в следующих циклах репликации. Следовательно, важным источником возникновения таких мутаций являются нарушения процессов репликации и репарации.
Мутации со сдвигом рамки считывания. Этот тип мутаций составляет значительную долю спонтанных мутаций. Они происходят вследствие выпадения или вставки в нуклеотидную последовательность ДНК одной или нескольких пар комплементарных нуклеотидов. Большая часть изученных мутаций, вызывающих сдвиг рамки, обнаружена в последовательностях, состоящих из одинаковых нуклеотидов.
Изменению числа нуклеотидных пар в цепи ДНК способствуют воздействия на генетический материал некоторых химических веществ, например акридиновых соединений. Деформируя структуру двойной спирали ДНК, они приводят к вставке дополнительных оснований или их выпадению при репликации.
Важной причиной изменения количества нуклеотидных пар в гене по типу крупных делений (выпадений) может быть рентгеновское облучение. У плодовой мухи, например, известна мутация гена, контролирующего окраску глаза, которая вызывается облучением и состоит в делении порядка 100 нуклеотидных пар.
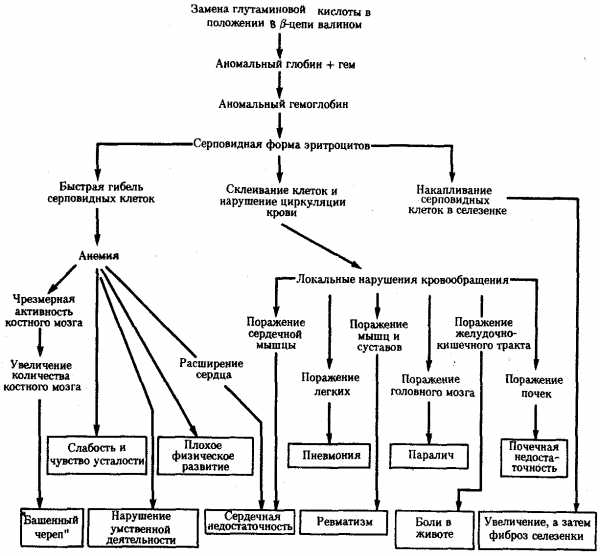
Рис. 3.21. Плейотропный эффект замены одной аминокислоты в β-цепи гемоглобина человека, приводящей к развитию серповидно-клеточной анемии
Большое число мутаций по типу вставок происходит вследствие включения в последовательность нуклеотидов подвижных генетических элементов — транспозонов. Транспозоны — это достаточно протяженные нуклеотидные последовательности, встроенные в геномы эу- и прокариотических клеток, способные самопроизвольно менять свое положение (см. разд. 3.6.4.3). С определенной вероятностью вставки и делении могут возникать в результате ошибок рекомбинации при неравноценном внутригенном кроссинговере (рис. 3.22).
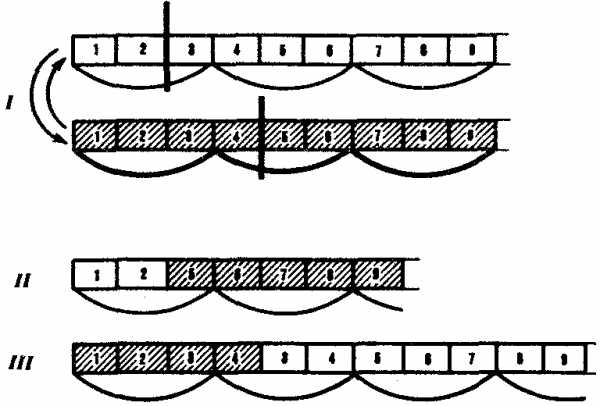
Рис. 3.22. Мутации со сдвигом рамки считывания (неравноценный обмен при внутригенном кроссинговере):
I — разрывы аллельпых генов в разных участках и обмен фрагментами между ними;
II — выпадение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания;
III —удвоение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания
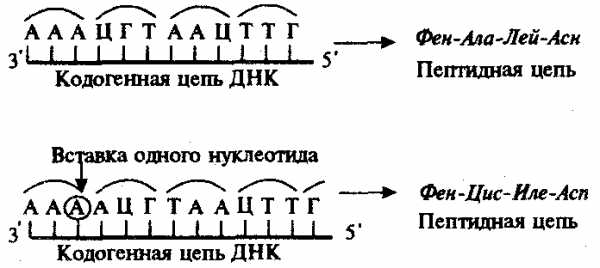
Рис. 3.23. Следствие изменения количества нуклеотидных пар в молекуле ДНК
Сдвиг рамки считывания в результате вставки одного нуклеотида в кодогенную цепь приводит к изменению состава зашифрованного в ней пептида
При непрерывности считывания и неперекрываемости генетического кода изменение количества нуклеотидов, как правило, приводит к сдвигу рамки считывания и изменению смысла биологической информации, записанной в данной последовательности ДНК (рис. 3.23). Однако, если количество вставленных или утраченных нуклеотидов кратно трем, сдвига рамки может не произойти, но это приведет к включению дополнительных аминокислот или выпадению части их из полипептидной цепи. Возможным следствием сдвига рамки является возникновение нонсенс-триплетов, ведущее к синтезу укороченных пептидных цепей.
Мутации по типу инверсии нуклеотидных последовательностей в гене. Данный тип мутаций происходит вследствие поворота участка ДНК на 180°. Обычно этому предшествует образование молекулой ДНК петли, в пределах которой репликация идет в направлении, обратном правильному.
В пределах инвертированного участка нарушается считывание информации, в результате изменяется аминокислотная последовательность белка.
studfiles.net
3.4.2.3. Изменения нуклеотидных последовательностей днк. Генные мутации
Нескорректированные изменения химической структуры генов, воспроизводимые в последовательных циклах репликации и проявляющиеся у потомства в виде новых вариантов признаков, называют генными мутациями.
Изменения структуры ДНК, образующей ген, можно разделить на три группы. Мутации первой группы заключаются в замене одних оснований другими. Они составляют около 20% спонтанно возникающих генных изменений. Вторая группа мутаций обусловлена сдвигом рамки считывания, происходящим при изменении количества нуклеотидных пар в составе гена. Наконец, третью группу представляют мутации, связанные с изменением порядка нуклеотидных последовательностей в пределах гена (инверсии).
Мутации по типу замены азотистых оснований. Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид. Примером может служить дезаминирование цитозина, превращающегося в урацил самопроизвольно или под влиянием азотистой кислоты (рис. 3.18). Образующийся при этом урацил, не замеченный ферментом ДНК-гликозилазой, при репликации соединяется с аденином, который впоследствии присоединяет тимидиловый нуклеотид. В результате пара Ц—Г замещается в ДНК парой Т—А (рис. 3.19, I). Дезаминирование метилированного цитозина превращает его в тимин (см. рис. 3.18). Тимидиловый нуклеотид, являясь естественным компонентом ДНК, не обнаруживается ферментами репарации как изменение и при следующей репликации присоединяет адениловый нуклеотид. В результате вместо пары Ц—Г в молекуле ДНК также появляется пара Т—А (рис. 3.19, II).
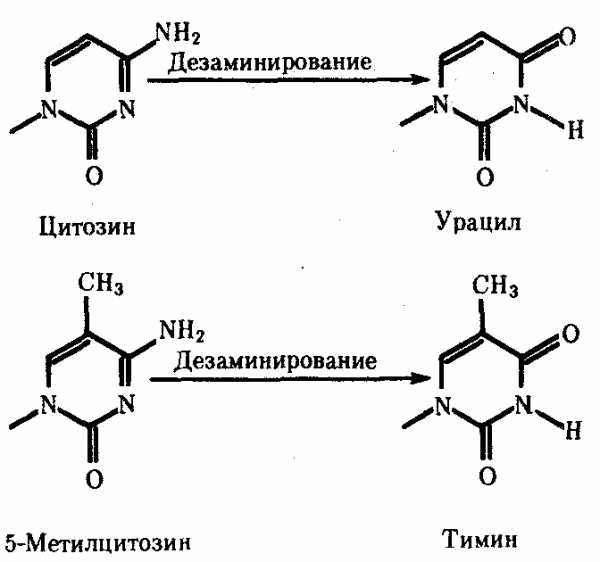
Рис. 3.18. Спонтанное дезаминирование цитозина
Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую. Примером этого может служить присоединение в ходе репликации к аденину материнской цепи нуклеотида с 5-бромурацилом (5-БУ), аналогичного тимидиловому нуклеотиду. При последующей репликации 5-БУ охотнее присоединяет к себе не аденин, а гуанин. Гуанин в ходе дальнейшего удвоения образует комплементарную пару с цитозином. В итоге пара А—Т заменяется в молекуле ДНК парой Г—Ц (рис. 3.20).
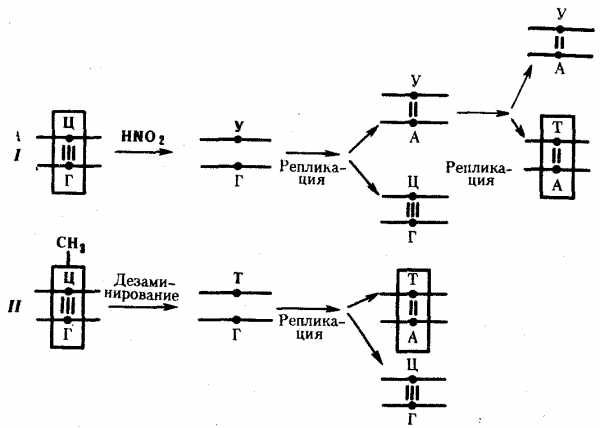
Рис. 3. 19. Мутации по типу замены основания
(дезаминирование азотистых оснований в цепи ДНК):
I — превращение цитозина в урацил, замена Ц—Г-пары на Т—А-пару;
II — превращение метил—цитозина в тимин, замена Ц—Г-пары на Т—А-пару
Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК.
Рис. 3.20. Мутации по типу замены оснований
(включение аналога азотистого основания при репликации ДНК)
Следствием замены одной пары комплементарных нуклеотидов на другую является образование нового триплета в нуклеотидной последовательности ДНК, кодирующей последовательность аминокислот в пептидной цепи. Это может и не отразиться на структуре пептида в том случае, если новый триплет будет «синонимом» прежнего, т.е. будет кодировать ту же аминокислоту. Например, аминокислота валин шифруется четырьмя триплетами: ЦАА, ЦАГ, ЦАТ, ЦАЦ. Замена третьего основания в любом из этих триплетов не изменит его смысла (вырожденность генетического кода).
В том случае, когда вновь возникший триплет шифрует другую аминокислоту, изменяются структура пептидной цепи и свойства соответствующего белка. В зависимости от характера и места случившейся замены специфические свойства белка изменяются в разной степени. Известны случаи, когда замена лишь одной аминокислоты в пептиде существенно влияет на свойства белка, что проявляется в изменении более сложных признаков. Примером может служить изменение свойств гемоглобина человека при серповидно-клеточной анемии (рис. 3.21). В таком гемоглобине—(HbS) (в отличие от нормального НbА) — в р-глобиновых цепях в шестом положении глутаминовая кислота заменена валином. Это является следствием замены одного из оснований в триплете, шифрующем глутаминовую кислоту (ЦТТ или ЦТЦ). В результате появляется триплет, шифрующий валин (ЦАТ или ЦАЦ). В данном случае замена одной аминокислоты в пептиде существенно изменяет свойства глобина, входящего в состав гемоглобина (снижается его способность связываться с 02), у человека развиваются признаки серповидно-клеточной анемии.
В некоторых случаях замена одного основания на другое может привести к появлению одного из нонсенс-триплетов (АТТ, АТЦ, АЦТ), не шифрующего никакой аминокислоты. Последствием такой замены будет прерывание синтеза пептидной цепи. Подсчитано, что замены нуклеотидов в одном триплете приводят в 25% случаев к образованию триплетов-синонимов; в 2—3 —бессмысленных триплетов, в 70— 75% —к возникновению истинных генных мутаций.
Таким образом, мутации по типу замены оснований могут возникать как в результате спонтанных изменений структуры основания в одной из цепей уже существующей двойной спирали ДНК, так и в ходе репликации во вновь синтезируемой цепи. В том случае, если эти изменения не исправляются в процессе репарации (или, наоборот, возникают в ходе репарации), они фиксируются в обеих цепях и далее будут воспроизводиться в следующих циклах репликации. Следовательно, важным источником возникновения таких мутаций являются нарушения процессов репликации и репарации.
Мутации со сдвигом рамки считывания. Этот тип мутаций составляет значительную долю спонтанных мутаций. Они происходят вследствие выпадения или вставки в нуклеотидную последовательность ДНК одной или нескольких пар комплементарных нуклеотидов. Большая часть изученных мутаций, вызывающих сдвиг рамки, обнаружена в последовательностях, состоящих из одинаковых нуклеотидов.
Изменению числа нуклеотидных пар в цепи ДНК способствуют воздействия на генетический материал некоторых химических веществ, например акридиновых соединений. Деформируя структуру двойной спирали ДНК, они приводят к вставке дополнительных оснований или их выпадению при репликации. Примером служат мутации, полученные у фага Т4 при воздействии профлавина. Они состоят во включении или удалении всего одной нуклеотидной пары. Важной причиной изменения количества нуклеотидных пар в гене по типу крупных делений (выпадений) может быть рентгеновское облучение. У плодовой мухи, например, известна мутация гена, контролирующего окраску глаза, которая вызывается облучением и состоит в делении порядка 100 нуклеотидных пар.
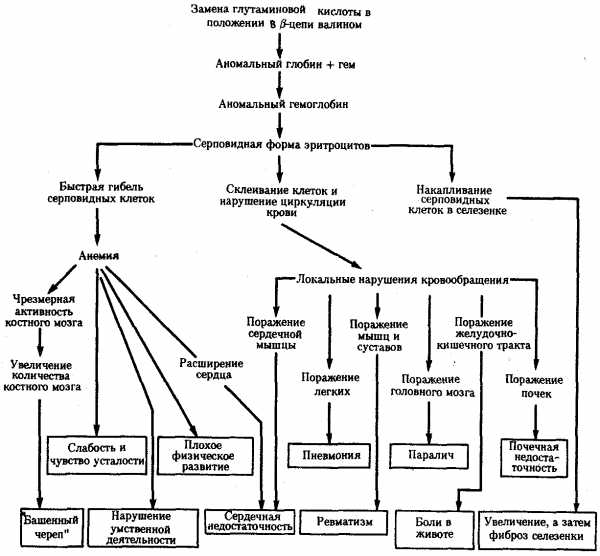
Рис. 3.21. Плейотропный эффект замены одной аминокислоты в β-цепи гемоглобина человека, приводящей к развитию серповидно-клеточной анемии
Большое число мутаций по типу вставок происходит вследствие включения в последовательность нуклеотидов подвижных генетических элементов — транспозонов. Транспозоны — это достаточно протяженные нуклеотидные последовательности, встроенные в геномы эу- и прокариотических клеток, способные самопроизвольно менять свое положение (см. разд. 3.6.4.3). С определенной вероятностью вставки и делении могут возникать в результате ошибок рекомбинации при неравноценном внутригенном кроссинговере (рис. 3.22).
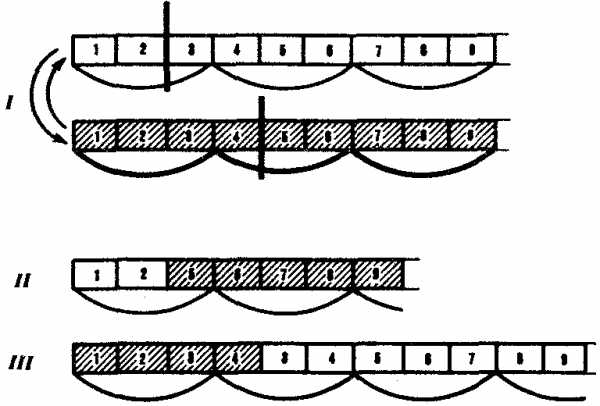
Рис. 3.22. Мутации со сдвигом рамки считывания (неравноценный обмен при внутригенном кроссинговере):
I — разрывы аллельпых генов в разных участках и обмен фрагментами между ними;
II — выпадение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания;
III —удвоение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания
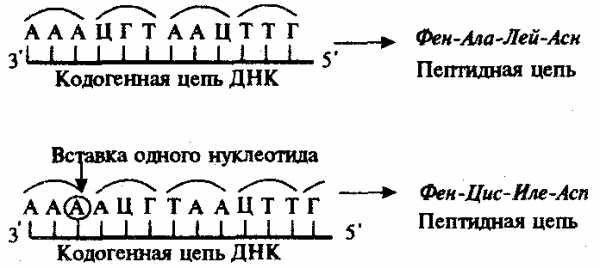
Рис. 3.23. Следствие изменения количества нуклеотидных пар в молекуле ДНК
Сдвиг рамки считывания в результате вставки одного нуклеотида в кодогенную цепь приводит к изменению состава зашифрованного в ней пептида
При непрерывности считывания и неперекрываемости генетического кода изменение количества нуклеотидов, как правило, приводит к сдвигу рамки считывания и изменению смысла биологической информации, записанной в данной последовательности ДНК (рис. 3.23). Однако, если количество вставленных или утраченных нуклеотидов кратно трем, сдвига рамки может не произойти, но это приведет к включению дополнительных аминокислот или выпадению части их из полипептидной цепи. Возможным следствием сдвига рамки является возникновение нонсенс-триплетов, ведущее к синтезу укороченных пептидных цепей.
Мутации по типу инверсии нуклеотидных последовательностей в гене. Данный тип мутаций происходит вследствие поворота участка ДНК на 180°. Обычно этому предшествует образование молекулой ДНК петли, в пределах которой репликация идет в направлении, обратном правильному.
В пределах инвертированного участка нарушается считывание информации, в результате изменяется аминокислотная последовательность белка.
studfiles.net

Leave A Comment