Определение формулы вещества в тестах ЕГЭ
В условиях некоторых задач фигурируют данные, позволяющие определить только молекулярную массу органического вещества. По ним требуется узнать формулу. Чаще всего такие задачи составляются в отношении углеводородов, причем без указания на гомологический ряд, к которому он относится. В этом случае существует иная стратегия решения. Рассмотрим ее на примере.
Задача 54
Определите молекулярную формулу углеводорода, у которого относительная плотность паров по метану составляет 6,875.
Дано: относительная плотность паров углеводорода по метану D(СН4) = 6,875.
Найти: молекулярную формулу углеводорода.
Решение:
В данном случае использовать обычный пошаговый алгоритм не возможно. Но есть иной путь решения, предполагающий составление математического уравнения с несколькими переменными.
Непосредственно из условия задачи установить зависимость между индексами у углерода и водорода не представляется возможным.
С другой стороны, значение молярной массы нашего вещества можно выразить с помощью молярных масс компонентов:
М(СхНY) = (12 . x) + (1 . y)
Приравниваем полученное выражение к значению истинной молярной массы, определенной по относительной плотности паров:
(12. x) + (1 .y) = 110
Получили одно уравнение с двумя неизвестными. Других данных, позволяющих составить еще одно уравнение, в условии не содержится.
Полученное нами математическое уравнение имеет бесконечное количество решений. Наша задача — выбрать из них то единственное значение, которое согласуется с физическим смыслом. Посмотрим, какие ограничения на значения «х» и «у» накладывает условие задачи.
1. Значения «х» и «у» в этом уравнении являются индексами в реальной формуле искомого углеводорода, следовательно, они должны быть положительными и целыми числами.
2. В состав молекул углеводорода входит только углерод и водород. Атомы этих элементов значительно различаются по массе. Поэтому вклад атомов углерода в молярную массу всего углеводорода значительно больше, чем вклад атомов водорода
Этот факт позволяет по значению молярной массы углеводорода примерно оценить количество атомов углерода в молекуле. Для этого мы пренебрегаем массовым вкладом водорода и упрощаем математическое уравнение. Таким образом, мы избавляемся от члена, отвечающего за вклад водорода в молярную массу (1 .у), и получаем одно уравнение с одним неизвестным2:
12 . х = 110
Решая его, получаем х = 9,17. Полученное значение не является индексом в формуле углеводорода, но позволяет ограничить количество вариантов при переборе.
|
Значение«х» (индекс углерода) |
Уравнение | Вычисление значения «y» (индекс у водорода) |
Выводы |
| х = 9 | (12 . 9)+ + (1 .  у) у) |
Y = 2 | Недостаточное количество атомов атомов углерода. Не соответствует ни одному классу углеводородов. Предло- жить структурную формулу вещества |
| ч = 8 | (12 . 8) + + (1 . у) |
Y = 14 | Углеводород с формулой С8Н14 реально существует. Он соответствует общей формуле СnН2n + 2, которая описывает алкины, алкадиены и циклоалкены. |
Дальнейший перебор приводит к избыточному количеству атомов водорода по сравнению с количеством атомов углерода.
Ответ: С8Н14.
———————
Сокращение количества вариантов перебора путем примерного определения количества атомов углерода в молекуле возможно не только для углеводородов. Эта стратегия применима и для других органических веществ, когда возможно упрощение математического уравнения до одного неизвестного. Так, например, задача на определение формулы одноосновной карбоновой кислоты сводится, в конечном итоге, к определению индексов углерода и водорода. Количества атомов кислорода и его вклад в молярную массу известен и определяется одноосновностыо кислоты. Общая формула такой кислоты будет С
(12 . х) + (1 .у) + (16 . 2) = М(СхНуО2).
При известной молярной массе кислоты мы получим одно уравнение с двумя неизвестными, одним из которых (1 . у) можно пренебречь для примерного определения числа атомов углерода в молекуле:
Комментарии:
1 Даже у алканов, у которых вклад атомов водорода в общую молярную массу будет наибольшим среди всех углеводородов, массовая доля водорода не превышает 25% (у метана).
2 Применительно к любому углеводороду это упрощенное уравнение будет иметь вид: (12 . х) = М(СхНу).
Алгоритм решения задач на вывод формулы органических веществ. | Учебно-методическое пособие по химии (10 класс):
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
- Образовательные:
- закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
- научить школьников решать задачи на нахождение молекулярной формулы органического вещества;
- сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
- Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
- Воспитательные: способствовать формированию научного мировоззрения.

2. Обеспечение занятия: таблица «Периодическая система», инструкции для учащихся 10 класса, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, Ch4 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4h22 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая Dh3 = 15.
Тогда M(CxHy) = 15 M(h3) = 15•2 г/моль = 30 г/моль.
Поскольку M(Ch4) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов Сnh3n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) = (CO2) = 2 моль.
5. Найти количество вещества воды:
(h3O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2(h3O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) : (Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4h20.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н. у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(h3O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) : (H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(Ch3) = 14,
Mr(в-ва) : Mr(Ch3) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
- Общая формула алканов Cnh3n+2, общая формула монохлоралканов Cnh3n+1Cl
- Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(Cnh3n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
- Общая формула монобромлканов Cnh3n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
- Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
- Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
- Уравнения реакций:
Cnh3n + Н Сl = Cnh3n+1Cl
Cnh3n + Н Br = Cnh3n+1Br
- Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(Cnh3n+1Cl) = n(Cnh3n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н. у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
- Находим количество вещества алкена:
n(Cnh3n) = 1,012/22,4 = 0,045 моль
- По уравнению реакции
Cnh3n +Сl2 = Cnh3nCl2
n(Cnh3nCl2)= n(Cnh3n) =0,045 моль
- М(Cnh3nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. | Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. | Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
Задача 3. | Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. | Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). | Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н. у.) равна 1,875 г. Найти его молекулярную формулу.
у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Остальная часть истории: расчет плотности пара
 Обычно, когда история закончена, слушатель лучше понимает, почему все так, а не иначе — остальную часть истории, если хотите.
Обычно, когда история закончена, слушатель лучше понимает, почему все так, а не иначе — остальную часть истории, если хотите.Эта же концепция во многих отношениях применима и к реагированию на опасные материалы. Одна из тем, где остальная часть информации может фактически повысить безопасность спасателя, касается плотности паров. Большинство спасателей узнали несколько вещей о плотности паров, но эта тема гораздо шире, чем то, что обычно включается в большинство учебных занятий по опасным веществам. На самом деле плотность паров обычно изображается как общее понятие, но в интересах безопасности необходимо более полное представление. Таким образом, точные расчеты, касающиеся концепции плотности паров, позволят персоналу реагирования безопасно реагировать на аварийные ситуации с опасными материалами и проводить более эффективную оценку рисков.
Плотность пара определяется как относительный вес газа или пара по сравнению с воздухом, который имеет произвольное значение, равное единице.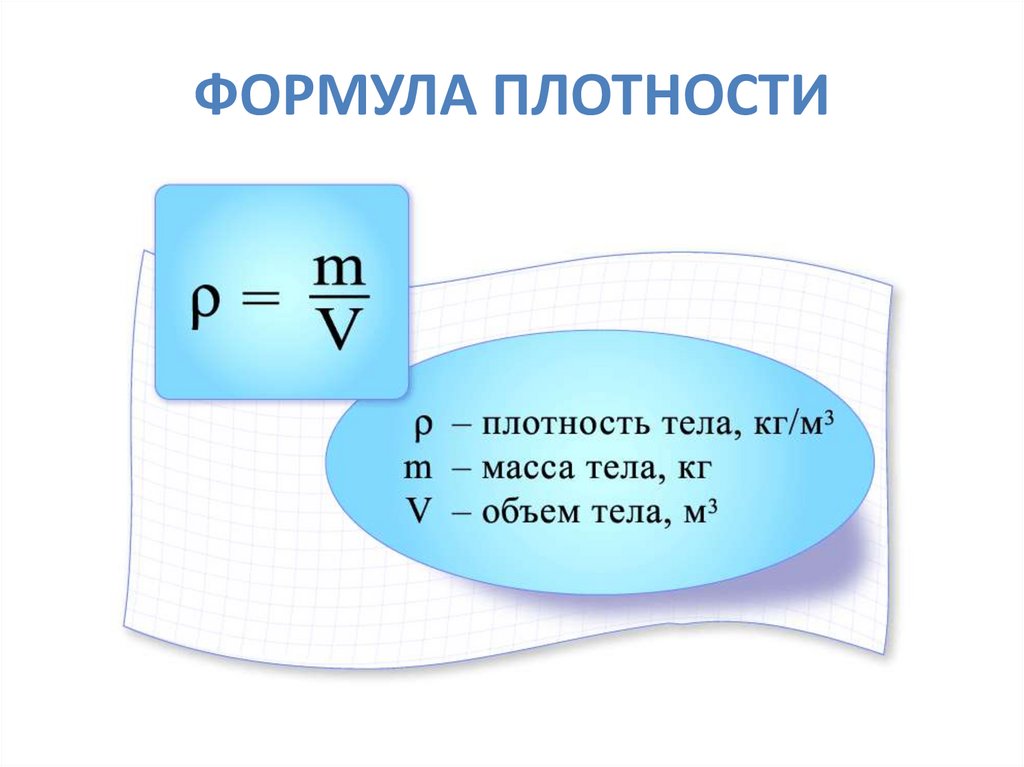
Эта концепция важна для ликвидаторов, поскольку она указывает, где обычно можно ожидать местонахождение газа или паров при выбросе опасных веществ. Соответственно, ликвидаторы могут лучше выбрать свои места для подготовки и установки оборудования, а также зоны изоляции опасности для инцидента. Кроме того, знание того, где можно найти газ, может лучше определить стратегию использования инструментов мониторинга при каждом инциденте.
Единственная проблема заключается в том, что концепция плотности пара, которую также называют «удельной массой пара», предлагает лишь расплывчатое значение того, куда может перемещаться газ или пар. Другими словами, руководства по реагированию, такие как Руководство по реагированию на чрезвычайные ситуации Министерства транспорта (ERG), в которых говорится, что «пары могут быть тяжелее воздуха и обнаруживаться в низинах», не указывают, насколько тяжелыми будут пары. Чтобы быть более точным, можно рассчитать плотность пара.
Чтобы быть более точным, можно рассчитать плотность пара.
Плотность воздуха
Воздух представляет собой сложную смесь нескольких газов, наиболее распространенными из которых являются азот и кислород. Состав воздуха на уровне моря по весу:
- Азот — 75,53%
- Кислород — 23,16%
- Прочие — 1,31% (Аргон, диоксид углерода, неон, гелий, метан, криптон, закись азота, водород, ксенон, 020 900 900 900 020)
Воздух по объему состоит из следующих газов;
- азот — 78,00%
- кислород — 20,95%
- Аргон — 93%
- CO2 — 0,033%
- — <0,003%
- азот — 78,00%
- — <0,003%
- — <0,003%
- Кроме того, воздух имеет молекулярную массу 29 атомных единиц массы (а.е.м.) на уровне моря. По сути, это вес образца воздуха, который можно использовать для целей сравнения с другими газами и парами.
Плотность газов
Учитывая идентичность материала, его молекулярную массу можно рассчитать по химической формуле и в сочетании с периодической таблицей элементов.
 Все атомы имеют массу, а вес — это притяжение массы под действием силы тяжести. Для наших целей мы называем массу соединения его весом. Нахождение химической формулы соединения и добавление массы всех его атомов позволяет рассчитать молекулярную массу. Например, молекулярная масса безводного аммиака равна 17, потому что формула — Nh4, где один атом азота (N) равен 14 а.е.м., а три атома водорода (Н) — 3 а.е.м.
Все атомы имеют массу, а вес — это притяжение массы под действием силы тяжести. Для наших целей мы называем массу соединения его весом. Нахождение химической формулы соединения и добавление массы всех его атомов позволяет рассчитать молекулярную массу. Например, молекулярная масса безводного аммиака равна 17, потому что формула — Nh4, где один атом азота (N) равен 14 а.е.м., а три атома водорода (Н) — 3 а.е.м.Расчет плотности пара
Чтобы вычислить плотность паров соединения, просто разделите молекулярную массу соединения на молекулярную массу воздуха. Это обеспечит числовое значение, которое можно сравнить со значением воздуха, равным единице.
Например, молекулярная масса водорода составляет 2 а.е.м. (газообразный водород двухатомный), а молекулярная масса воздуха равна 29 (точнее, 28,9). Частное 2/29 равно 0,068. Поскольку этот ответ меньше единицы, водород будет подниматься в воздух (помните Гинденбург?). И наоборот, такой продукт, как гексан, выделяет пары, которые тонут в воздухе.
 Расчет веса гексана основан на его химической формуле C6h24, которая дает молекулярную массу 84 а.е.м. Частное 84/29составляет 2,9. Таким образом, пары гексана в 2,9 раза тяжелее воздуха.
Расчет веса гексана основан на его химической формуле C6h24, которая дает молекулярную массу 84 а.е.м. Частное 84/29составляет 2,9. Таким образом, пары гексана в 2,9 раза тяжелее воздуха.Мнемоника плотности пара
Чтобы помочь запомнить, какие газы легче воздуха, были разработаны некоторые мнемоники или аббревиатуры. Офицер пожарной охраны Нью-Йорка на рубеже веков разработал хорошо известную мнемоническую формулу плотности паров. Для обучения своих товарищей-пожарных он использовал термин «ХА-ХА-МУШИ», чтобы запомнить газы легче воздуха. Буквы означают;
H — Водород
A — Аммиак
H — Гелий
A — АцетиленM — Метан
I — Газы для освещения (старый термин для обозначения природного газа)
C — Окись углерода
E — ЭтиленЭта аббревиатура использовалась в течение многих лет, но сегодня мы знаем, что существует более восьми газов, которые легче (или имеют такой же вес, как) воздух.
 Чтобы запомнить 13 газов, которые легче воздуха, можно использовать новую аббревиатуру в качестве мнемоники. Термин «4H MEDIC ANNA» обозначает газы легче воздуха, и они на самом деле;
Чтобы запомнить 13 газов, которые легче воздуха, можно использовать новую аббревиатуру в качестве мнемоники. Термин «4H MEDIC ANNA» обозначает газы легче воздуха, и они на самом деле;Газ Молекулярная формула АМУ Плотность пара H — Водород h3 2 0,07 H — Гелий Он 4 .14 H — Цианистый водород ХСН 29 1,0 H — фтороводород ВЧ 10 .  34
34 М — Метан Ч5 16 .55 E — Этилен C2h5 28 .96 D — Диборан B2H6 27,7 .96 I — светящиеся газы Ч5/С2Н6 17.4 .6 C — Угарный газ СО 28 .96 А — Ацетилен C2h3 26 .9 N — Неон Не 10 .34 N — Азот N2 28 .  96
96 А — Аммиак Nh4 17 .59 Примечание; Осветительным газом является «природный газ», представляющий собой смесь примерно 90% метана и 10% этана. Если вы помните эту мнемонику для газов, которые легче воздуха, все остальное тяжелее, включая пары легковоспламеняющихся жидкостей. В общих чертах, чем тяжелее пар, тем меньше он будет накапливаться при выпуске.
Меры предосторожности и применение
Плотность паров — это просто общее понятие, позволяющее иметь представление о том, где могут быть обнаружены пары при выбросе. Однако этот физический параметр не является абсолютным и на него можно повлиять;
- воздушные потоки, которые смешивают все газы и пары, несмотря на разную плотность паров.
- температура, которая может привести к подъему или опусканию газов и паров.

- Кроме того, материал, выпущенный из контейнера под давлением, может изменить ожидаемую плотность пара.
- влажность – которая может поглощаться газами или парами и снижать их плавучесть.
- точка росы, которая позволит водяному пару в воздухе подняться, что может повлиять на поведение паров.
- аэрозоли — наличие мелких капель в парах может сделать облако тяжелым.
Еще одна мера предосторожности, связанная с концепцией плотности пара, заключается в предположении, что отношения, обнаруженные между газом или паром и воздухом, являются абсолютными. На самом деле, это вряд ли когда-либо так. Значения плотности паров часто неправильно истолковываются в тех случаях, когда вещество высвобождается при температуре окружающей среды, не позволяющей ему существовать в виде чистого газа или пара при нормальном атмосферном давлении. Неверный вывод может ввести ликвидаторов в заблуждение относительно действия высвободившегося газа или пара и поставить под угрозу безопасность ликвидатора.

Поскольку многие вещества (жидкости) имеют точки кипения намного выше температуры окружающей среды, они не будут испаряться или превращаться в чистые пары при высвобождении. (Чистые пары определяются как 100% концентрация над разливом). Этот момент важен, потому что плотность паров рассчитывается с использованием соотношений молекулярных масс, предполагающих наличие чистых паров. Более точным методом определения плотности паров вещества было бы сравнение смеси паров вещества в воздухе со смесью паров чистого воздуха. Это соотношение позволит более точно определить плотность паров вещества. Процедура для этого следующая;
Шаг 1: Рассчитайте приблизительную плотность чистого химического вещества при определенной температуре.
pV = 1,3691 X молекулярная масса вещества, деленная на температуру (в Fo) + 460Шаг 2: Рассчитайте приблизительную плотность воздуха при температуре окружающей среды.
pA = 39,566 разделить на температуру (в Fo) + 460Шаг 3: Рассчитайте относительную плотность паров воздушно-химической смеси.

Относительная плотность паров = (C X pV) + [(100 — C) X pA], деленная на 100 X pA (C означает «концентрацию насыщения» химических паров в воздухе в процентах по объему)* Умножение 100 на давление паров вещества и деление полученного произведения на 760 позволяет вычислить насыщенную концентрацию.
Хорошим примером этой концепции является бензол. Бензол имеет молекулярную массу, основанную на формуле C6H6, 78,1 а.е.м. Коэффициент плотности пара становится 2,69когда молекулярная масса бензола, равная 78,1, делится на молекулярную массу воздуха (29). Это соотношение указывает на то, что пары бензола будут скапливаться у поверхности разлива и на местности при выбросе. На самом деле пары будут лишь немного тяжелее воздуха, если вычислить по приведенным выше формулам.
Давление паров бензола составляет 100 мм/рт.ст. при 79°F, поэтому, умножив 100 мм/рт.ст. на 100 и разделив результат на 760, можно рассчитать концентрацию насыщения. Ответ 13,16%, что указывает на максимальную концентрацию паров бензола выше выброса при 79из.
 Использование этих значений в приведенных выше уравнениях при температуре воздуха 79°F дает более точное значение плотности пара 1,22. Это значение означает, что смесь бензола с воздухом непосредственно над разливом бензола при температуре 79°F только в 1,22 раза тяжелее воздуха, а не в 2,7, что часто указывается как плотность паров бензола.
Использование этих значений в приведенных выше уравнениях при температуре воздуха 79°F дает более точное значение плотности пара 1,22. Это значение означает, что смесь бензола с воздухом непосредственно над разливом бензола при температуре 79°F только в 1,22 раза тяжелее воздуха, а не в 2,7, что часто указывается как плотность паров бензола.Эти уравнения и концепции используются в программных приложениях для рассеивания паров, чтобы лучше прогнозировать, куда и как далеко будут перемещаться паровые облака при выпуске. Смесь со значениями плотности паров, близкими к плотности воздуха, будет быстро смешиваться с воздухом по мере удаления от разлива. Вскоре эта смесь приблизится к плотности воздуха и будет вести себя как паровоздушная смесь с нейтральной плавучестью. Смеси с отрицательной плавучестью будут вести себя как смеси тяжелее воздуха на большом расстоянии от разлива. Кроме того, смеси с положительной плавучестью будут вести себя как смеси легче воздуха.
Точность такой информации поможет нам в оценке рисков и может изменить нашу тактику.
 С целью повышения личной безопасности рассмотрите возможность использования этих концепций и формул в своих будущих ответных действиях. Как и во всех концепциях и теориях, есть исключения; обязательно сохраняйте бдительность и будьте осторожны! И, теперь вы знаете остальную часть истории!
С целью повышения личной безопасности рассмотрите возможность использования этих концепций и формул в своих будущих ответных действиях. Как и во всех концепциях и теориях, есть исключения; обязательно сохраняйте бдительность и будьте осторожны! И, теперь вы знаете остальную часть истории!Ресурс:
- «Справочник по процедурам анализа химической опасности» Федерального агентства по чрезвычайным ситуациям (FEMA), Министерства транспорта США (DOT), Агентства по охране окружающей среды США (EPA)
стехиометрия — Как рассчитать плотность паров смеси?
спросил
Изменено 2 года, 7 месяцев назад
Просмотрено 14 тысяч раз
$\begingroup$
У меня есть газообразная смесь $\ce{h3}$ и $\ce{CO2}$, содержащая $66\%$ по массе $\ce{CO2}$.
 Я должен выяснить плотность пара смеси (определяемую как массу определенного объема вещества, деленную на массу того же объема водорода).
Я должен выяснить плотность пара смеси (определяемую как массу определенного объема вещества, деленную на массу того же объема водорода).Мой подход: предположим, что $\pu{100 г}$ смеси содержит $\pu{66 г}$ $\ce{CO2}$ и $\pu{34 г}$ $\ce{h3} $. Следовательно, количество вещества $\ce{CO2} = \pu{1,5 моль}$ и количество вещества $\ce{h3} = \pu{17 моль}$. Общее количество вещества $= \pu{18,5 моль}$.
Масса $\pu{1 моль}$ смеси составляет 5,4 г (масса 18,5 моль равна 100 г), а плотность паров $\text{VD} = 2,7$.
Я правильно ответил, но теперь сомневаюсь в своем подходе. Можно ли было предположить, что количество вещества смеси равно количеству вещества обоих газов?
- стехиометрия
- газовые законы
- смеси
$\endgroup$
6
$\begingroup$
Можно ли было предположить, что количество вещества смеси равно количеству вещества обоих газов?
Количество вещества аддитивно, как и масса.



 Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода
Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода Все атомы имеют массу, а вес — это притяжение массы под действием силы тяжести. Для наших целей мы называем массу соединения его весом. Нахождение химической формулы соединения и добавление массы всех его атомов позволяет рассчитать молекулярную массу. Например, молекулярная масса безводного аммиака равна 17, потому что формула — Nh4, где один атом азота (N) равен 14 а.е.м., а три атома водорода (Н) — 3 а.е.м.
Все атомы имеют массу, а вес — это притяжение массы под действием силы тяжести. Для наших целей мы называем массу соединения его весом. Нахождение химической формулы соединения и добавление массы всех его атомов позволяет рассчитать молекулярную массу. Например, молекулярная масса безводного аммиака равна 17, потому что формула — Nh4, где один атом азота (N) равен 14 а.е.м., а три атома водорода (Н) — 3 а.е.м.
Leave A Comment