Этилат натрия, C2H5ONa, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ICSC 0674 — ЭТИЛАТ НАТРИЯ
ICSC 0674 — ЭТИЛАТ НАТРИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ЭТИЛАТ НАТРИЯ | ICSC: 0674 (Октябрь 2002) |
| CAS #: 141-52-6 |
| EINECS #: 205-487-5 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Очень легко воспламеняется. Риск взрыва при контакте с водой. Риск взрыва при контакте с водой. |
НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. | НЕ использовать воду. Использовать сухой порошок, сухой песк. НЕ использовать водные агенты. В случае пожара: охлаждать бочки и т.д. распыляя воду. НЕ допускать прямого контакта с водой. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! ИЗБЕГАТЬ ЛЮБЫХ КОНТАКТОВ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущения жжения. Кашель. Затрудненное дыхание. Сбивчивое дыхание. Боли в горле. | Применять замкнутую систему или вентиляцию. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение.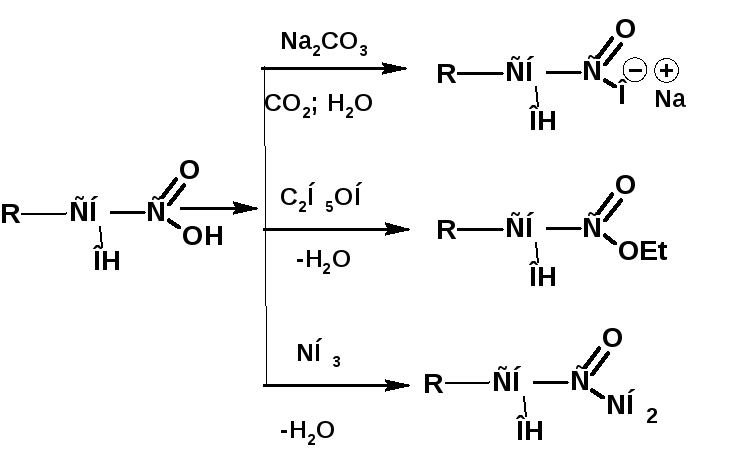 Боль. Волдыри. Ожоги кожи. Боль. Волдыри. Ожоги кожи. |
Защитные перчатки. Защитная одежда. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. Сильные глубокие ожоги. | Использовать закрытые защитные очки или средства защиты глаз в комбинации со средствами защиты органов дыхания если вещество в порошкообразном соостоянии. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. Боль в животе. Шок или сильная слабость. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: костюм химической защиты. Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Удалить все источники воспламенения. Воздухонероницаемые сухиеСмести просыпанное вещество в закрытые контейнеры. Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Удалить все источники воспламенения. Воздухонероницаемые сухиеСмести просыпанное вещество в закрытые контейнеры. |
Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Хранить сухим. Хорошо закрывать. | |
| УПАКОВКА | |
| Герметичная. |
| ЭТИЛАТ НАТРИЯ | ICSC: 0674 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C2H5ONa |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: F, C; R: 11-14-34; S: (1/2)-8-16-26-43-45 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Карбоновая кислота — Sciencemadness Wiki
Карбоновая кислота представляет собой органическое соединение, содержащее по крайней мере одну карбоксильную группу (-COOH ) или (-C(=O)OH ). Общая формула карбоновой кислоты: R–COOH , где R является заместителем, обычно органическим.
Содержимое
- 1 Тип
- 2 Общие свойства
- 3 Наличие
- 4 Подготовка
- 5 Безопасность
- 6 ссылок
- 6.1 Соответствующие темы Sciencemadness
Типы
Карбоновые кислоты можно разделить на несколько категорий:
- Монокарбоновые кислоты: имеют только одну группу -COOH. Большинство из них жидкие при комнатной температуре и имеют сильный запах. Пример: муравьиная кислота, уксусная кислота;
- Дикарбоновые кислоты: имеют две группы -COOH. Твердое и малолетучее при стандартных условиях.
 Пример: щавелевая кислота, янтарная кислота;
Пример: щавелевая кислота, янтарная кислота; - Поликарбоновые кислоты: могут иметь более трех групп -COOH. Твердый и нелетучий. Пример: лимонная кислота;
- Органический: заместитель R представляет собой органическую группу. Например: уксусная кислота, бензойная кислота.
- Неорганический: заместитель R представляет собой неорганическую группу (за исключением муравьиной кислоты, где R представляет собой Н и является органическим из-за связи С-Н). Пример: угольная кислота, трифторуксусная кислота;
- Аминокислоты: органические карбоновые кислоты, которые также содержат аминогруппу (-NH 2 ). Пример: глицин;
Соли и сложные эфиры карбоновых кислот называются карбоксилатами. Карбоксилат-анион R–COO — обычно называют с суффиксом -ate (например, муравьиная кислота — форма ate ).
Общие свойства
Монокарбоновые кислоты жидкие (кроме ароматических), летучие и имеют сильный резкий запах. Поликарбоновые кислоты, с другой стороны, все твердые и нелетучие. Карбоновые кислоты являются полярными соединениями.
Поликарбоновые кислоты, с другой стороны, все твердые и нелетучие. Карбоновые кислоты являются полярными соединениями.
Карбоновые кислоты являются кислотами Бренстеда–Лоури, поскольку они являются донорами протона (H + ). Обычно это слабые кислоты.
Наличие
Концентрированная муравьиная кислота продается в различных пчеловодческих магазинах, как и уксусная и щавелевая кислоты.
Лимонную кислоту можно приобрести в виде лимонной соли в большинстве магазинов, а разбавленную уксусную кислоту можно приобрести в виде уксуса.
Бензойная кислота может быть получена путем подкисления бензоата натрия, который продается в качестве пищевого консерванта. Точно так же из виннокислого калия можно легко получить винную кислоту.
Препарат
Окисление первичных спиртов, таких как метанол или этанол, перманганатом калия в присутствии серной кислоты дает соответствующие карбоновые кислоты. Окисление Джонса — еще один путь.
- CH 3 OH + [O] → HCOOH + H 2 O
- CH 3 CH 2 OH + [O] → CH 3 COOH + H 2 O
Карбонизация Гриньяра и литийорганические реагенты с последующим подкислением:
- RLi + CO 2 → RCO 2 Li
- RCO 2 Li + HCl → RCO 2 H + LiCl
Карбоксилаты являются побочными продуктами реакции галоформа. Следующие кетоны/спирты дадут следующие карбоксилаты:
Следующие кетоны/спирты дадут следующие карбоксилаты:
- Этанол/ацетальдегид — формиат
- Ацетон/изопропанол — Ацетат
- Метилэтилкетон/втор-бутанол — пропаноат
- Ацетилацетон — Ацетат
- Ацетофенон-бензоат
- Фенилацетон — Фенилацетат
Безопасность
Концентрированные карбоновые кислоты, такие как муравьиная или уксусная кислоты, разъедают кожу и имеют сильный раздражающий запах. При работе с ними носите надлежащую защиту.
Поликарбоновые кислоты менее агрессивны и летучи, хотя конц. водные растворы раздражают.
Ссылки
Соответствующие темы Sciencemadness
- Тест на карбоновые кислоты
- Карбоновая кислота -> Алкан
- Восстановление карбоновой кислоты до спирта!
Этанол — Sciencemadness Wiki Он более известен как
алкоголь или просто алкоголь 9.0004, а его растворы с водой составляют основу всех алкогольных напитков. Это легко получаемый и производимый лабораторный растворитель, а также обычный реагент в органической химии.
Это легко получаемый и производимый лабораторный растворитель, а также обычный реагент в органической химии.Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Этанол представляет собой первичный спирт с прямой цепью. Он часто используется в качестве растворителя в лабораторных условиях, но также имеет огромное разнообразие применений в качестве реагента.
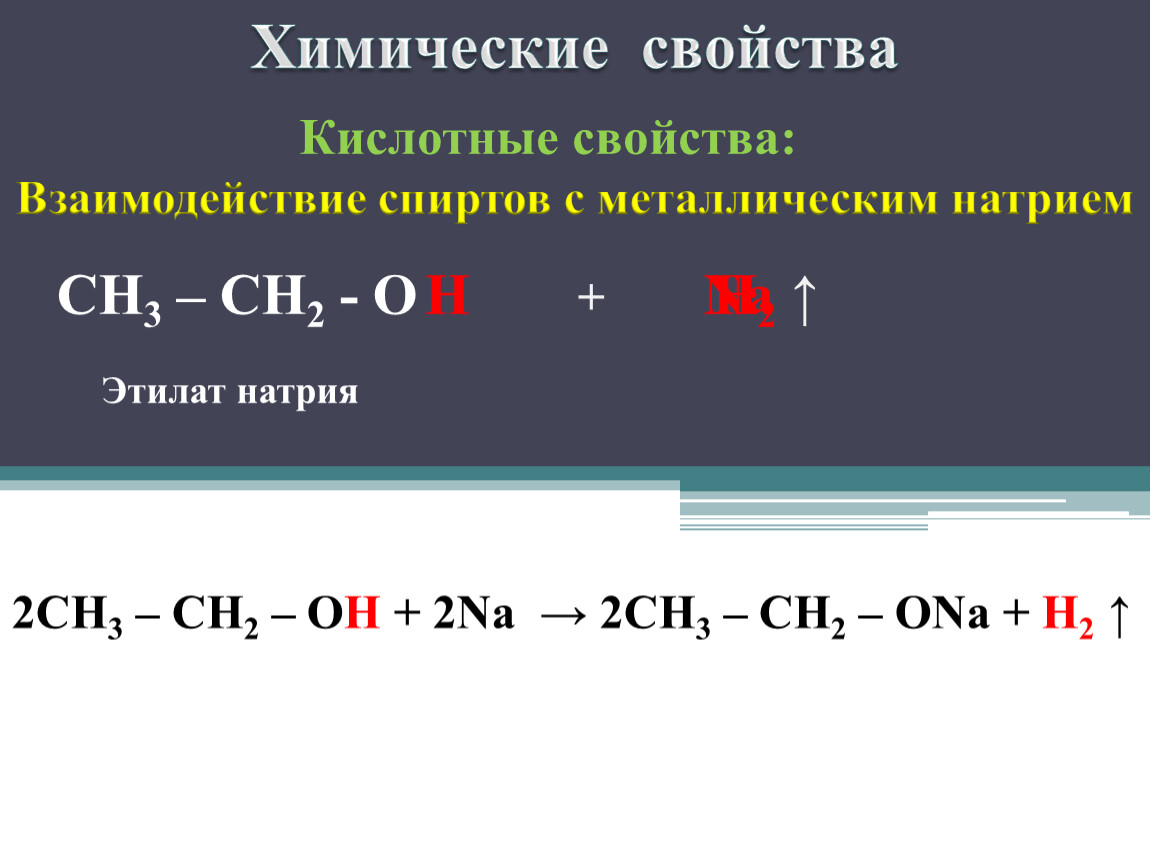
Реагирует с натрием и некоторыми другими металлами, особенно с другими щелочными металлами, с образованием этоксидов. Получение триэтоксида алюминия таким способом возможно с использованием йода и хлорида ртути (II) в небольших количествах в качестве катализатора.
Этанол можно окислить с помощью дихромата калия в кислых условиях до ацетальдегида, который можно дополнительно окислить до уксусной кислоты, если условия достаточно холодные, чтобы предотвратить выкипание ацетальдегида. Ацетальдегид также можно получить из этанола двумя менее затратными способами, хотя для этого необходимо специальное оборудование. Первый — это окисление этанола кислородом на серебряном или медном катализаторе при температуре выше 500 ° C, но реакция является экзотермической и самоподдерживающейся, пока кислород присутствует в достаточном количестве, даже в концентрациях нормального воздуха. Другой метод заключается в дегидрировании этанола на медном катализаторе без использования кислорода. Этот маршрут не требует кислорода и проходит при более приемлемой температуре 260–29°С.0 °C, но является эндотермическим и требует постоянного нагревания. Условия, необходимые для любого из этих каталитических путей, могут быть достигнуты путем пропускания этанола в форме пара через нагретую трубку из плавленого кварца, содержащую катализатор.
Этанол также может быть окислен до уксусной кислоты с использованием перманганата калия в щелочных условиях, вызывая немедленную нейтрализацию уксусной кислоты с образованием соли. Третий и последний путь получения уксусной кислоты из этанола включал биохимический процесс анаэробной ферментации уксуснокислыми бактериями, как это делается в промышленности для производства уксуса.
Из-за того, что этанол является широко доступным первичным спиртом, он желателен для получения сложных эфиров путем этерификации Фишера путем кипячения с обратным холодильником с карбоновой кислотой в условиях дегидратации.
Физический
Этанол представляет собой прозрачную летучую жидкость со сладким запахом, кипящую при 78 °C. Этанол имеет плотность 0,789 г/см 3 и смешивается с водой, а также с большинством органических растворителей. Этанол образует азеотроп с водой на 95,6%, а растворы с более высокой концентрацией этанола агрессивно гигроскопичны. Сушку этанола можно осуществить с помощью молекулярных сит 3А, осушителей или путем высаливания с использованием карбоната калия. Также можно использовать оксид кальция. Этанол, как и большинство других спиртов, легко воспламеняется даже при низких концентрациях в растворе, хотя при низких концентрациях температура вспышки увеличивается.
Также можно использовать оксид кальция. Этанол, как и большинство других спиртов, легко воспламеняется даже при низких концентрациях в растворе, хотя при низких концентрациях температура вспышки увеличивается.
Доступность
Водные растворы 40% этанола доступны в большинстве винных магазинов в виде чистой водки, но для ее покупки необходимо быть совершеннолетним (21 год в США). Этанол 90-95% доступен как Everclear в винных магазинах в некоторых местах. В 14 штатах США продажа Everclear ограничена. Высококонцентрированный этанол также доступен в виде ректификованного спирта с максимальной концентрацией 96% (точнее, 95,6%). Некоторые ректифицированные спирты, как правило, содержат следы фенолфталеина или других химических веществ, добавленных для ограничения чрезмерного употребления алкоголя, и если они могут помешать каким-либо предполагаемым реакциям, этанол необходимо перегнать, чтобы удалить их. Ректифицированный спирт доступен как пищевой во многих странах (Финляндия, Венгрия, Польша, Румыния, например) и в некоторых штатах США, хотя он часто довольно дорогой, в некоторых случаях 26 долларов за л. Высококонцентрированный этанол также может продаваться в качестве дезинфицирующего средства (так называемый этанол «медицинского качества»), обычно смешанный с изопропанолом; в зависимости от страны он может квалифицироваться или не квалифицироваться как пищевой.
Высококонцентрированный этанол также может продаваться в качестве дезинфицирующего средства (так называемый этанол «медицинского качества»), обычно смешанный с изопропанолом; в зависимости от страны он может квалифицироваться или не квалифицироваться как пищевой.
Метилированные спирты или денатурированные спирты сильно различаются в зависимости от региона и торговой марки, но обычно содержат некоторую долю этанола и метанола, причем этанол составляет большую долю. Эти продукты могут также содержать метилэтилкетон, что делает их непригодными для питья. Этанол для промышленного использования денатурируют, чтобы его никто не пьет, а это означает, что он дешевле, поскольку обходит налог на алкоголь и доступен для продажи несовершеннолетним. Денатурирующие или горькие агенты включают бензоат денатония и пиридин, которые придают спирту очень неприятный горький вкус.
Некоторые виды топлива для кемпинга/биотоплива состоят из этанола с добавлением небольшого количества метанола для денатурации. Другие комбинации могут содержать изопропанол, глицерин или масло.
Другие комбинации могут содержать изопропанол, глицерин или масло.
Перегонка этанола, даже для научных целей и очистки, в некоторых местах считается незаконной, хотя часто можно получить разрешение, разрешающее это.
Приготовление
Один галлон домашнего спирта из сахара. Через семь дней после начала брожения он содержит 20% этанола и готов к перегонке.
Приготовление этанола для лабораторного использования, как правило, осуществляется путем ферментации сахара (столовый сахар-песок отлично подходит) с использованием дрожжей, в частности быстроферментирующих дрожжей с высокой устойчивостью к алкоголю, используемых для этой цели. Чтобы стимулировать ферментацию, а не рост дрожжей, смесь необходимо поместить в контейнер с воздушным шлюзом, чтобы позволить углекислому газу выходить, но не попадать кислороду. Этот процесс обычно может производить только растворы, содержащие 20% этанола, возможно, вместе с другие продукты, такие как метанол или ацетон, которые необходимо удалить. Если вы используете чистую сахарозу (рафинированный тростниковый или свекловичный сахар) для приготовления этанола, вы защищены от загрязнения метанолом; однако пектин и некоторые другие углеводы, присутствующие во фруктах, действительно выделяют метанол при ферментации, поэтому фруктовые пюре требуют особых мер предосторожности при дистилляции.
Если вы используете чистую сахарозу (рафинированный тростниковый или свекловичный сахар) для приготовления этанола, вы защищены от загрязнения метанолом; однако пектин и некоторые другие углеводы, присутствующие во фруктах, действительно выделяют метанол при ферментации, поэтому фруктовые пюре требуют особых мер предосторожности при дистилляции.
Тщательной перегонкой смеси после того, как она была достаточно ферментирована, можно получить азеотроп 96% этанола, 4% воды по объему. Для получения чистого этанола из смеси этанола и воды можно использовать высаливание, при котором карбонат калия растворяется в смеси, в результате чего образуются 2 отдельных слоя. Слой этанола можно снять сверху и перегнать в безводной среде; или его можно охладить до температуры ниже 0°C для осаждения большинства примесей, если перегонка невозможна.
Если домашнее пивоварение этанола не является привлекательным способом, его можно перегонять из купленных в магазине спиртных напитков, таких как водка или джин, которые часто содержат около 40% этанола по объему. Важно иметь в виду, что дистилляция этанола является незаконной во многих юрисдикциях без разрешения, и, возможно, не менее важно отметить, что этанол, произведенный таким образом, особенно с использованием лабораторной посуды, небезопасен для употребления. Перегонка безопасного, пригодного к употреблению этанола — это целое искусство и ремесло под названием самогоноварение , и вам нужно изучить этот навык и получить или сконструировать специальный аппарат для дистилляции, если вы хотите синтезировать пищевой этанол. Проконсультируйтесь со своим юристом, чтобы узнать, является ли эта практика законной там, где вы живете; в некоторых юрисдикциях самогоноварение является законным ремеслом, если оно не приносит прибыли, а в некоторых оно полностью незаконно.
Важно иметь в виду, что дистилляция этанола является незаконной во многих юрисдикциях без разрешения, и, возможно, не менее важно отметить, что этанол, произведенный таким образом, особенно с использованием лабораторной посуды, небезопасен для употребления. Перегонка безопасного, пригодного к употреблению этанола — это целое искусство и ремесло под названием самогоноварение , и вам нужно изучить этот навык и получить или сконструировать специальный аппарат для дистилляции, если вы хотите синтезировать пищевой этанол. Проконсультируйтесь со своим юристом, чтобы узнать, является ли эта практика законной там, где вы живете; в некоторых юрисдикциях самогоноварение является законным ремеслом, если оно не приносит прибыли, а в некоторых оно полностью незаконно.
Проекты
- Получение ацетальдегида окислением дихроматом
- Получение уксусной кислоты путем окисления перманганатом
- Получение этилацетата, полезного растворителя
- Приготовление диэтилового эфира, другого растворителя
- Получение этиловых эфиров с помощью этерификации Фишера.

- Изготовление криоголя для холодных ванн
- Сделать этилиодид
- Употребление этанола из-за его рекреационных эффектов, изменяющих сознание (просто не пейте этанол лабораторного качества)
Обращение
Безопасность
Этанол, потребляемый в небольших количествах время от времени, не особенно опасен, но очень большие количества немедленно опасны для здоровья. тело, в то время как умеренные и большие количества в течение длительного периода могут привести к повреждению печени. Он может вызывать привыкание, и он необычен среди наркотиков тем, что его симптомы отмены могут убить. Прием внутрь небольшого количества этанола вызывает опьянение, которое замедляет время реакции и суждение. Следует отметить, что этанол, произведенный в лаборатории, НЕ пригоден для употребления, особенно с учетом риска загрязнения метанолом, который в организме распадается на муравьиную кислоту, потенциально вызывая слепоту или смерть. Всегда держите кухонный этанол отдельно от лаборатории, не используйте его для дистилляции непищевых химикатов и учитесь искусству самогоноварение , которое включает в себя методы приготовления и перегонки безопасного питьевого спиртного напитка, не загрязненного метанолом или другими токсикантами. Научитесь использовать методы фракционной дистилляции, многоступенчатой дистилляции и ректификации, которые полезны для избавления от форшотов и финтов , содержащих токсичные вещества.
Научитесь использовать методы фракционной дистилляции, многоступенчатой дистилляции и ректификации, которые полезны для избавления от форшотов и финтов , содержащих токсичные вещества.
Воспламеняемость растворов этанола зависит от концентрации. Температура воспламенения чистого спирта составляет 17°С, а для концентрации всего 10% температура вспышки составляет около 49°С.°С. Однако серьезная воспламеняемость начинается с 40% (минимальная концентрация, при которой воспламеняется чайная ложка).
Перегонка спирта без разрешения во многих юрисдикциях является незаконной, поэтому домашнее пивоварение может не подойти для производства этанола подходящего качества для использования в лаборатории.
Хранение
Этанол следует хранить в закрытых пластиковых или стеклянных бутылях вдали от источников огня или окислителей. Он слегка гигроскопичен, образуя азеотроп с водой при 95,6%. Если требуется чистый этанол, его можно высушить с помощью сильного осушителя, такого как молекулярные сита.

 Пример: щавелевая кислота, янтарная кислота;
Пример: щавелевая кислота, янтарная кислота;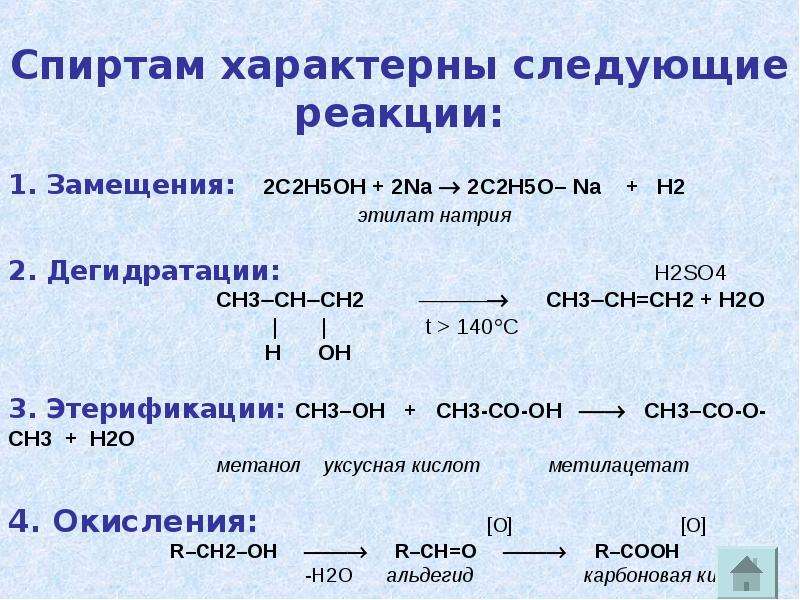
Leave A Comment