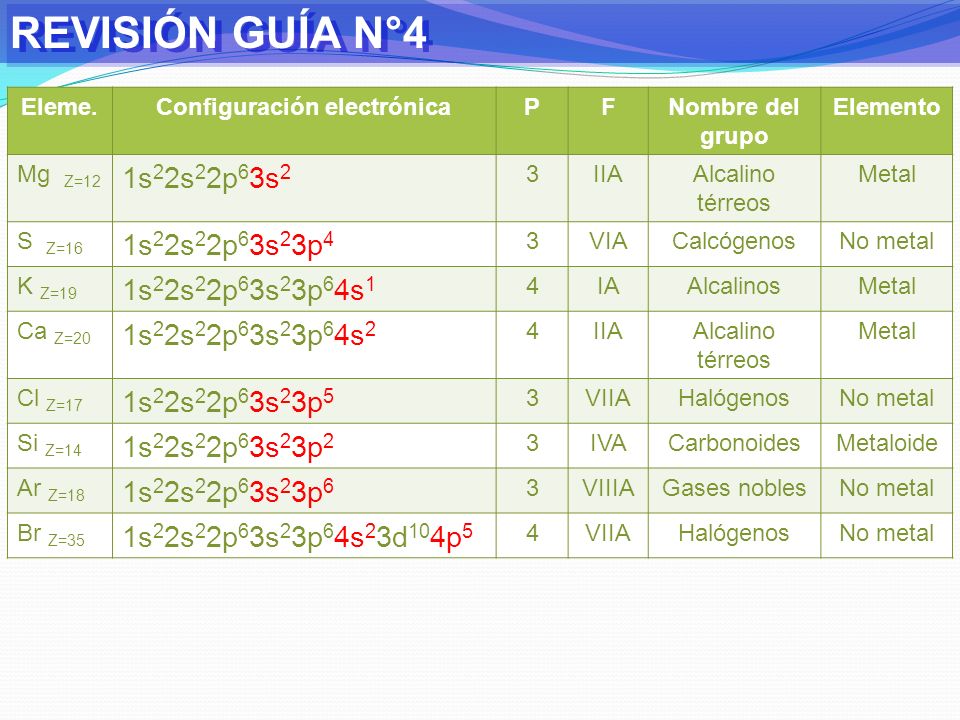
Задания №1 с решениями
Рассмотрим задания №1 из вариантов ЕГЭ за 2016 год.
Перед решением рекомендуем повторить раздел «Строение атома. Электронные конфигурации».
Задание №1.
Электронная формула внешнего электронного слоя 3s²3p6 соответствует строению каждой из двух частиц:
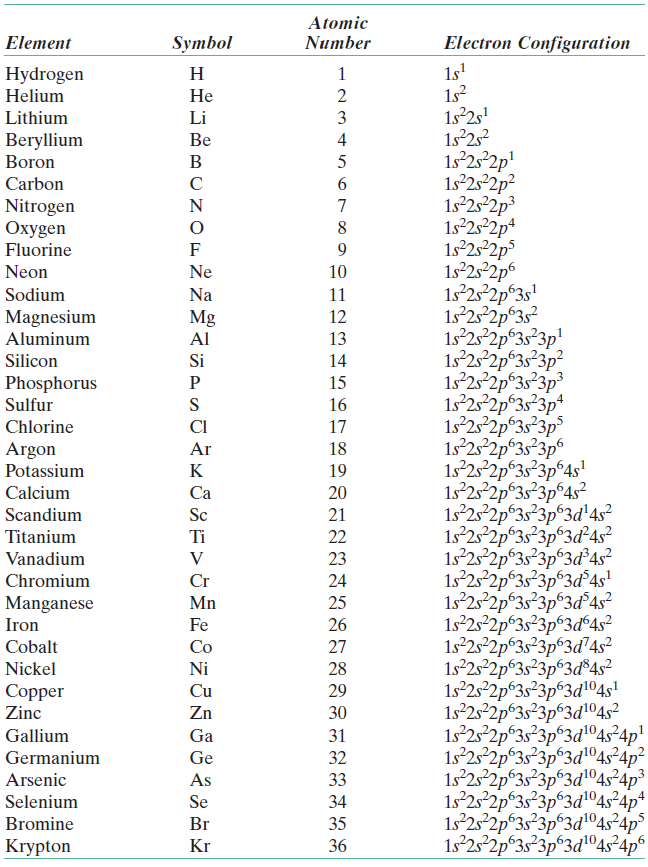
1. Arº и Kº 2. Cl‾ и K+ 3. S²‾ и Naº 4. Clº и Ca2+
Объяснение: среди вариантов ответа приведены атомы в невозбужденном и возбужденном состояниях, то есть электронная конфигурация, допустим иона калия не соответствует его положению в периодической системе. Рассмотрим вариант 1 Arº и Kº. Напишем их электронные конфигурации: Arº: 1s2 2s2 2p6 3s2 3p6; Kº: 1s2 2s2 2p6 3s2 3p6 4s1 — подходящая электронная конфигурация только у аргона. Рассмотрим вариант ответа №2 — Cl‾ и K+. K+: 1s2 2s2 2p6 3s2 4s0; Cl‾: 1s2 2s2 2p6 3s2 3p6. Следовательно, правильный ответ — 2.
Задание №2.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы:
1. Caº 2. K+ 3. Cl+ 4. Zn2+
Объяснение: для напишем электронную конфигурацию аргона: 1s2 2s2 2p6 3s2 3p6. Кальций не подходит, так как у него на 2 электрона больше. У калия: 1s2 2s2 2p6 3s2 3p6 4s0. Правильный ответ — 2.
Задание №3.
Элемент, электронная конфигурация атома которого 1s2 2s2 2p6 3s2 3p4, образует водородное соединение
1. Ch5 2. Sih5 3. h3O 4. h3S
Объяснение: посмотрим в периодическую систему, такую электронную конфигурацию имеет атом серы. Правильный ответ — 4.
Задание №4.
Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1. Кальция 2. Хрома 3. Кремния 4. Алюминия
Кремния 4. Алюминия
Объяснение: у магния конфигурация внешнего энергетического уровня: 3s2. У кальция: 4s2, у хрома: 4s2 3d4, у кремния: 3s2 2p2, у алюминия: 3s2 3p1. Правильный ответ — 1.
Задание № 5.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы:
1. S²‾ 2. Zn2+ 3. Si4+ 4. Seº
Объяснение: электронная конфигурация аргона в основном состоянии — 1s2 2s2 2p6 3s2 3p6. У S²‾ электронная конфигурация: 1s2 2s2 2p6 3s2 3p(4+2). Правильный ответ — 1.
Задание №6.
Сходную конфигурацию внешнего энергетического уровня имеют атомы фосфора и
1. Ar 2. Al 3. Cl 4. N
Объяснение: напишем электронную конфигурацию внешнего уровня атома фосфора: 3s2 3p3.
У алюминия: 3s2 3p1;
У аргона: 3s2 3p6;
У хлора: 3s2 3p5;
У азота: 2s2 2p3.
Правильный ответ — 4.
Задание №7.
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 соответствует частице
1. S4+ 2. P3- 3. Al3+ 4. O2-
Объяснение: данная электронная конфигурация соответствует атому аргона в основном состоянии. Рассмотрим варианты ответа:
S4+: 1s2 2s2 2p6 3s2 2p0
P3-: 1s2 2s2 2p6 3s2 3p(3+3)
Правильный ответ — 2.
Задание №8.
Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома:
1. 3d2 4s2 2. 3s2 3p4 3. 3d5 4s1 4. 4s2 4p6
Объяснение: напишем электронную конфигурацию хрома в основном состоянии: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Валентные электроны находятся на последних двух подуровнях 4s и 3d (здесь происходит перескок одного электрона с подуровня s на d). Правильный ответ — 3.
Задание №9.
Три неспаренных электрона на внешнем электронном уровне в основном состоянии содержит атом
1. Титана 2. Кремния 3. Магния 4. Фосфора
Объяснение: для того, чтобы иметь 3 неспаренных электрона, нужно, чтобы элемент находился в пятой группе. Следовательно, правильный ответ — 4.
Задание №10.
Атом химического элемента, высший оксид которого RO2, имеет конфигурацию внешнего уровня:
1. ns2 np4 2. ns2 np2 3. ns2 4. ns2 np1
Объяснение: данный элемент имеет степень окисления (в этом соединении) +4, то есть он должен иметь 4 валентных электрона на внешнем уровне. Следовательно, правильный ответ — 2.
(можно подумать, что правильный ответ — 1, но у такого атома максимальная степень окисления будет +6 (так как 6 электронов на внешнем уровне), но нам нужно, чтобы высший оксид имел формулу RO2, а такой элемент будет иметь высший оксид RO3)
Автор решения: Лунькова Е.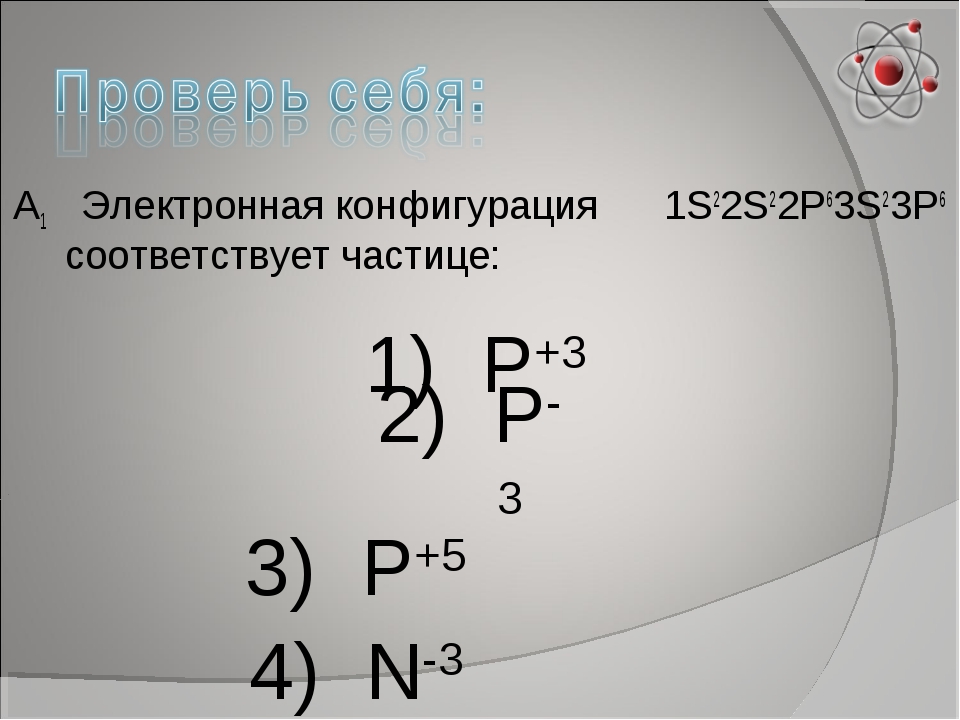 Ю.
Ю.
Задания для самостоятельной работы.
1. Электронная конфигурация 1s2 2s2 2p6 3s2 3p5 соответствует атому
1. Алюминия 2. Азота 3. Хлора 4. Фтора
2. Восьмиэлектронную внешнюю оболочку имеет частица
1. P3+ 2. Mg2+ 3. Cl5+ 4. Fe2+
3. Порядковый номер элемента, электронное строение атома которого 1s2 2s2 2p3, равен
1. 5 2. 6 3. 7 4. 4
4. Число электронов в ионе меди Cu2+ равно
1. 64 2. 66 3. 29 4. 27
5. Сходную конфигурацию внешнего энергетического уровня имеют атомы азота и
1. Серы 2. Хлора 3. Мышьяка 4. Марганца
6. Какое соединение содержит катион и анион с электронной конфигурацией 1s2 2s2 2p6 3s3 3p6?
1. NaCl 2. NaBr 3. KCl 4. KBr
7. Число электронов в ионе железа Fe2+ равно
1. 54 2. 28 3. 58 4. 24
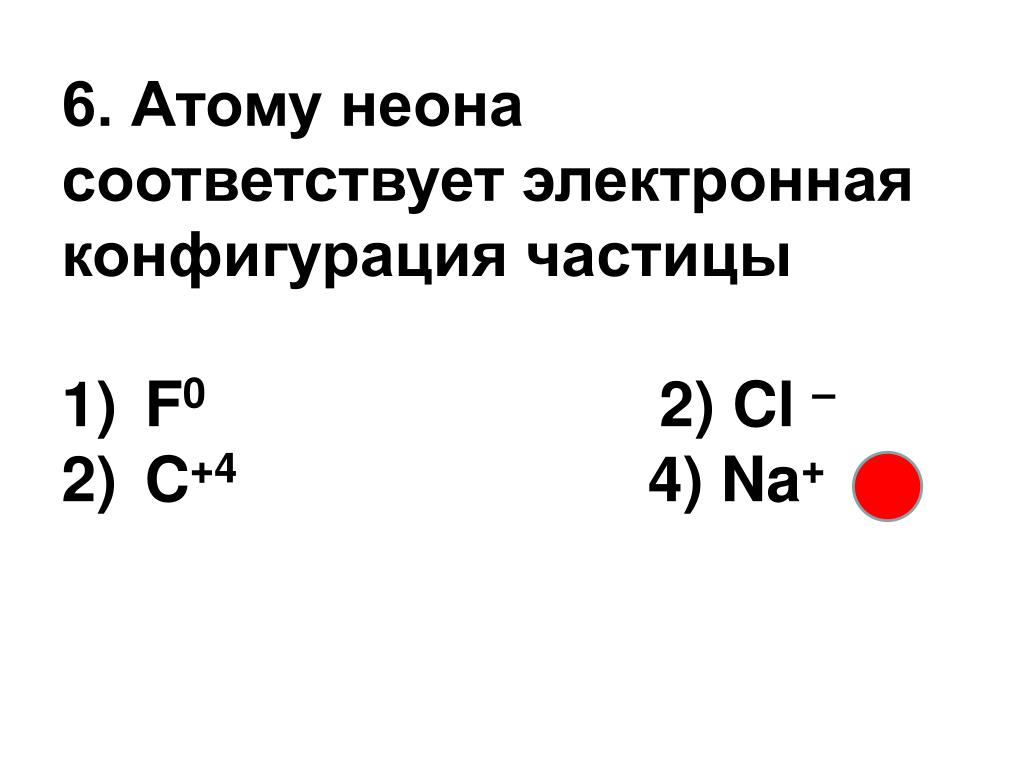
8. Электронную конфигурацию инертного газа имеет ион
1.
9. Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и
1. Кислорода 2. Лития 3. Брома 4. Неона
10. Элементу, электронная формула атома которого 1s2 2s2 2p6 3s2 3p4, соответствует водородное соединение
1. HCl 2. Ph4 3. h3S 4. Sih5
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
Задания ЕГЭ 1 | Тест по химии (11 класс) на тему:
Сульфид-иону соответствует электронная формула
1) 1s2 2s22р63s23p6 2) 1s2 2s22p63s23p4 3) 1s2 2s2 2p6 4) 1s2 2s2 2p63s23p2
Установите соответствие между элементом и электронной конфигурацией атомов.
ЭЛЕМЕНТЫ ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ АТОМОВ
1) He
2) N
3) B
4) C
А) 1s22s22p3
Б) 1s22s22p1
В) 1s2
Г) 1s22s2
Д) 1s22s22p2
Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно 1) 4, 6 2) 2, 5 3) 3, 7 4) 4, 5
Распределению электронов по энергетическим уровням в атоме элемента соответствует ряд чисел: 2, 8, 18, 6. В периодической системе этот элемент расположен в группе
В периодической системе этот элемент расположен в группе
1) VA 2) VIA 3) VБ 4) VIБ
Химический элемент расположен в IV периоде, IА группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2, 8, 8, 2 2) 2, 8, 18, 1 3) 2, 8, 8, 1 4) 2, 8, 18, 2
Ядра атомов изотопов различаются числом
1) протонов 2) нейтронов 3) протонов и нейтронов 4) протонов и электронов
Число нейтронов в ядре атома 39K равно 1) 19 2) 20 3) 39 4) 58
Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
1) Ba 2) Mg 3) Ca 4) Sr
Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
Число неспаренных электронов в атоме алюминия равно
1) 1 2) 2 3) 3 4) 0
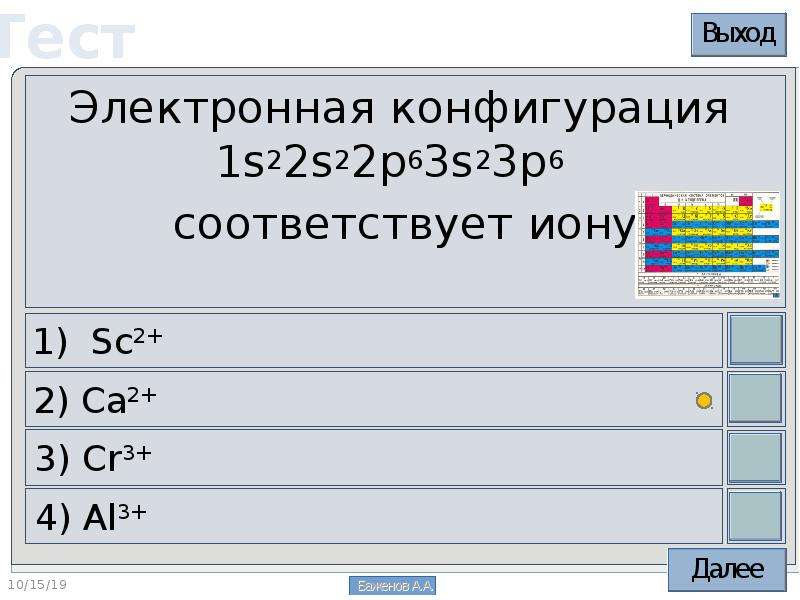
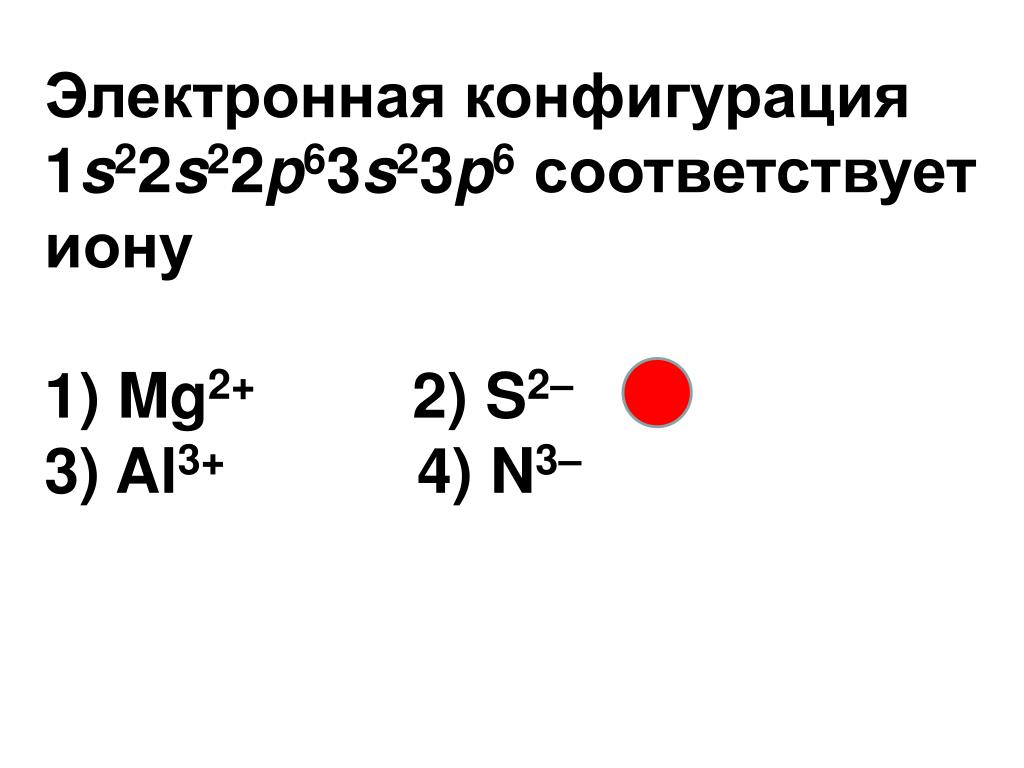
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sc2+ 2) Al3+ 3) Cr3+ 4) Ca2+
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) Li+ 2) K+ 3) Cs+ 4) Na+
Химический элемент, формула высшего оксида которого R2O7, имеет электронную конфигурацию атома:
1) 1s22s22p63s1 2) 1s22s22p63s23p5 3) 1s22s22p63s23p64s1 4) 1s22s1
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) S+4
2) S-2
3) S0
4) S+6
А) 1s22s22p63s23p4
Б) 1s22s22p63s23p6
В) 1s22s22p63s2
Г) 1s22s22p6
Установите соответствие между частицей и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) Cl+7
2) Cl+5
3) Cl 0
4) Cl–1
А) 1s22s22p63s23p5
Б) 1s22s22p63s23p6
В) 1s22s22p6
Г) 1s22s22p63s2
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) Р0
2) Р+3
3) Р–3
4) Р+5
А) 1s22s22p63s2
Б) 1s22s22p63s23p3
В) 1s22s22p6
Г) 1s22s22p63s23p6
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) С0
2) С–2
3) С–4
4) С+4
А) 1s2
Б) 1s22s22p6
В) 1s22s22p2
Г) 1s22s22p4
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) S+4
2) Cl+3
3) P0
4) N-2
А) 1s22s22p63s23p3
Б) 1s22s22p63s23p2
В) 1s22s22p63s2
Г) 1s22s22p5
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) S0
2) Cl+7
3) P+3
4) N–2
А) 1s22s22p63s2
Б) 1s22s22p63s23p4
В) 1s22s22p5
Г) 1s22s22p6
Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
1) P+5
2) N+4
3) C–2
4) F0
А) 1s22s22p5
Б) 1s22s22p6
В) 1s22s1
Г) 1s22s22p4
Установите соответствие между формулой частицы и общим числом электронов, содержащихся в ней.
ЧАСТИЦА ЧИСЛО ЭЛЕКТРОНОВ
1) Al3+
2) Mg0
3) P– 3
4) K0
А) 18
Б) 15
В) 19
Г) 10
Д) 12
Одинаковое число протонов и нейтронов содержится в атоме
1) железа-56 2) иода-127 3) кобальта-59 4) углерода-12
Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) Al3+ 3) Na+ 4) F-
Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 1s22s22p1 2) 1s22s22p63s1 3) 1s22s2 4) 1s22s22p63s23p1
В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2 2) O2, h3O, CO2 3) h3O, Nh4, Ch5 4) NaBr, HBr, CO
Атом элемента, максимальная степень окисления которого + 4, в основном состоянии имеет электронную конфигурацию внешнего энергетического уровня:
1) 3s23p4 2) 2s22p2 3) 2s22p4 4) 2s22p6
Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p63s23p4?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна + 4.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2– 3) Cr3+ 4) Fe2+
Порядковый номер элемента, электронное строение атома которого [He] 2s22p3, равен
1) 5 2) 6 3) 7 4) 4
Восьмиэлектронную внешнюю оболочку имеет ион
1) P3+ 2) S2– 3) Cl5+ 4) Fe2+
Восьмиэлектронную внешнюю оболочку имеет ион
1) S4+ 2) S2– 3) Br5+ 4) Sn2+
Электронную конфигурацию инертного газа имеет ион
1) Fe3+ 2) Cl– 3) Cu2+ 4) Fe2+
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Mg2+ 2) S2– 3) Al3+ 4) N3–
Какое соединение содержит катион и анион с электронной конфигурацией 1s22s22p63s23p6?
1) NaCl 2) NaBr 3) KCl 4) KBr
Элементу, электронная формула атома которого 1s22s22p63s23p4, соответствует водородное соединение
1) HCl 2) Ph4 3) h3S 4) Sih5
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) Ca0 2) K+ 3) Cl+1 4) Sc0
Элемент, электронная формула атома которого 1s22s22p63s23p2, образует водородное соединение
1) Ch5 2) Sih5 3) h3O 4) h3S
Три неспаренных электрона на внешнем уровне в основном состоянии содержит атом
1) титана 2) кремния 3) магния 4) фосфора
Атому аргона в основном состоянии соответствует электронная конфигурация частицы
1) S2– 2) Zn2+ 3) C4+ 4) Se0
Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Fe2+ 2) S2– 3) Al3+ 4) N3–
Сходную конфигурацию внешнего энергетического уровня имеют атомы P и
1) Ar 2) Al 3) Cl 4) N
Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1) кальция 2) хрома 3) кремния 4) алюминия
Электронная конфигурация 1s22s22p63s23p3 соответствует атому
1) алюминия 2) азота 3) фосфора 4) серы
Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и
1) кислорода 2) лития 3) брома 4) неона
Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома? 1) 3d 24s 2 2) 3s 23p 4 3) 3d 54s 1 4) 4s 24p 6
Электронная конфигурация 1s22s22p6 соответствует иону
1) Al3+ 2) Fe3+ 3) Zn2+ 4) Cr3+
В основном состоянии три неспаренных электрона имеет атом
1) кремния 2) фосфора 3) серы 4) хлора
В какой частице распределение электронов по энергетическим уровням соответствует ряду чисел 2; 8; 8? 1) S–2 2) S0 3) P0 4) P+5
Элементу с электронной конфигурацией атома 1s22s22p63s23p4 соответствует водородное соединение 1) h4P 2) Nh4 3) h3S 4) Ch5
Атом углерода в возбуждённом состоянии имеет электронную конфигурацию
1) 1s22s22p2 2) 1s22s12p3 3) 1s22s22p3 4) 1s22s12p4
Какая частица имеет электронную конфигурацию 1s22s22p63s23p6?
1) K+ 2) О2– 3) S0 4) K0
Какая электронная конфигурация соответствует фторид-иону?
1) 1s22s22p5 2) 1s22s22p6 3) 1s22s22p3 4) 1s22s22p4
Атом какого химического элемента в основном состоянии имеет электронную конфигурацию 1s22s22p63s1? 1) натрия 2) магния 3) калия 4) меди
У атома какого из указанных элементов в основном состоянии все валентные электроны расположены на 3s-орбитали? 1) магния 2) алюминия 3) азота 4) бора
На 2s-энергетическом подуровне расположены все валентные электроны атома
1) кремния 2) бериллия 3) натрия 4) магния
Восьмиэлектронную внешнюю оболочку имеет каждая из двух частиц:
1) С4+ и C4– 2) S2– и Cl7+ 3) Cl5+ и Li+ 4) H+ и Ca2+
Электронная формула внешнего электронного слоя 3s23p6 соответствует строению каждой из двух частиц:
1) Ar0 и K0 2) Cl– и K+ 3) S2– и Na0 4) Cl0 и Са2+
Ряд чисел: 2, 8, 8, характеризующий распределение электронов по энергетическим уровням, соответствует частице 1) S–2 2) Cl+7 3) Cl+5 4) S+6
Анион O2− имеет электронную конфигурацию
1) 1s22s22p4 2) 1s22s22p5 3) 1s22s22p6 4) 1s22s22p2
Электронную конфигурацию внешнего энергетического уровня ns2np1
в основном состоянии имеет атом 1) Ca 2) Li 3) B 4) Na
Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) Mg2+ 2) S2– 3) Al3+ 4) Si4+
14.
 Электронная конфигурация 1s22s22p63s23p6 соответствует частице. 3. Электронная конфигурация 1s22s22p63s23p6 соответствует иону.
Электронная конфигурация 1s22s22p63s23p6 соответствует частице. 3. Электронная конфигурация 1s22s22p63s23p6 соответствует иону.
Тема «Строение атома» 11 класс
Контрольные измерительные материалы
1 – задания базового уровня сложности, с кратким ответом;
Обозначение уровня сложности заданий: Б – базовый уровень сложности;
П – повышенный уровень сложности; В – высокий уровень сложности.
№ зада-
ния в работе
Проверяемые элементы
содержания
Коды
прове-
ряемыхэлементов
содержа
ния по
кодифи-
каторуКоды
требо-
ванийУро-
веньсложностизада-
нияМакс
балл
за вы-
пол-
нениезада-
нияПри
мерное
время
выпол-
нения
задания
(мин.)
1 Строение электронных оболочек
атомов элементов первых четырех
периодов: s-, p- и d-элементы.
Электронная конфигурация атома.
1.
 1.1
1.11.2.1
2.3.1
Б
1 2
2 Закономерности изменения химических свойств
элементов и их соединений
по периодам и группам
Общая характеристика металлов
IА–IIIА групп в связи с их положением в ПCХЭ
Д.И. Менделеева
и особенностями строения их атомов.
Характеристика переходных элементов
меди, цинка, хрома, железа
– по их положению в ПСХЭ и особенностям
строения их атомов.
Общая характеристика неметаллов
IVА–VIIА групп в связи с их положением
а и особенностями строения их атомов
1.2.1
1.2.2
1.2.3
1.2.4
1.2.3
2.4.1
2.3.1
Б 1 2
Примеры заданий
Базовый уровень сложности
1. Число электронных энергетических уровней и число внешних электронов атома кремния равно соответственно
1) 2, 4 2) 4, 3 3) 3, 4 4) 3, 2
2. Число протонов, нейтронов и электронов в атоме 37Cl равно соответственно
1) 17, 17, 37 2) 17, 20, 37 3) 17, 20, 17 4) 37, 20, 17
3.

1) 14, 29, 15 2) 14, 15, 14 3) 14, 14, 15 4) 29, 15, 14
4. Число протонов и нейтронов в ядре атома 39К соответственно равно
1) 39, 19 2) 19, 39 3) 19, 20 4) 20, 19
9. 5. Изотопы одного и того же химического элемента отличаются друг от друга
1) числом протонов 3) числом нейтронов
2) числом электронов 4) зарядом ядра
6. Одинаковое число протонов и нейтронов содержится в атоме
1) 16O 2) 14C3) 80Br 4) 34S
7. Одинаковое число электронов содержится в атоме аргона и в ионе
1) Li+ 2) Mg2+ 3) F 4) Cl
8. Число электронных энергетических уровней и число внешних электронов в атоме серы равно соответственно
1) 3, 16 2) 3, 6 3) 6, 3 4) 3, 4
9. Число неспаренных электронов в атоме хлора в основном состоянии равно
1) 1 2) 3 3) 5 4) 7
10. Число неспаренных электронов в атоме фосфора в основном состоянии равно
1) 1 2) 3 3) 5 4) 0
11. Хлорид-иону соответствует электронная конфигурация
1) 1s22s22p63s23p5 3) 1s22s22p63s23p6
2) 1s22s22p63s2 4) 1s22s22p63s23p4
12.
 Иону Са2+ соответствует электронная конфигурация
Иону Са2+ соответствует электронная конфигурация1) 1s22s22p63s23p6 3) 1s22s22p63s23p64s2
2) 1s22s22p63s2 4) 1s22s22p63s23p64s24p2
13. Электронная конфигурация 1s22s22p6 соответствует иону
1) Са2+ 2) Cl 3) О2 4) K+
14. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
1) K+ 2) Al3+ 3) Mg2+ 4) F
15. Химическим элементом, у атомов которого валентные электроны имеют конфигурацию 3s23p4, является
1) кремний 2) сера 3) хром 4) селен
16. Химическим элементом, у атомов которого валентные электроны имеют конфигурацию 3d34s2, является
1) кальций 2) стронций 3) мышьяк 4) ванадий
17. Химическим элементом, у атомов которого валентные электроны имеют конфигурацию 3d104s1, является
1) калий 2) рубидий 3) медь 4) серебро
18. Химическим элементом, у атомов которого валентные электроны имеют конфигурацию 3d104s2, является
1) кальций 2) стронций 3) цинк 4) кадмий
19. Электронную конфигурацию 1s22s22p63s23p6 имеет частица
1) Mg+2 2) Ca+2 3) Be+2 4) Zn+2
20.
 Электронную конфигурацию 1s22s22p63s23p6 имеет частица
Электронную конфигурацию 1s22s22p63s23p6 имеет частица1) S2 2) Р+5 3) S+6 4) O2
21. Электронную конфигурацию 1s22s22p63s2 имеет атом химического элемента
1) Be 2) Mg 3) Ca 4) BaПовышенный уровень сложности
22. Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) S+6 1) 1s22s22p63s23p4
Б) S0 2) 1s22s22p6
В) S+4 3) 1s22s22p63s2
Г) S2 4) 1s22s22p63s23p6
А Б В Г
23. Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) N+5 1) 1s22s1
Б) N0 2) 1s22s22p3
В) N+4 3) 1s2
Г) N3 4) 1s22s22p6
А Б В Г
24. Установите соответствие между элементом и электронной конфигурацией его атомов.
ЭЛЕМЕНТ ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) N 1) 1s22s22p63s23p4
Б) S 2) 1s22s22p3
В) P 3) 1s22s22p63s23p3
Г) Cl4) 1s22s22p63s23p5
А Б В Г
25. Установите соответствие между формулой частицы и общим числом электронов, содержащихся в ней.
ЧАСТИЦА ОБЩЕЕ ЧИСЛО ЭЛЕКТРОНОВ
А) C+4 1) 10
Б) Al+3 2) 6
В) F 3) 2
Г) C0 4) 13
А Б В Г
26. Восьмиэлектронную внешнюю оболочку имеют ионы
1) Мg2+ 4) Cl
2) Cr2+ 5) Fe2+
3) S2 6) Sc2+
27. Восьмиэлектронную внешнюю оболочку имеют ионы
1) Ca2+ 4) Cr3+
2) N3 5) Fe3+
3) S4+ 6) Al3+
28. Электронную конфигурацию 1s2 имеют частицы
1) Li+ 4) С+4
2) С4 5) F
3) N+5 6) N3
29. Электронную конфигурацию 1s22s22p6 имеют частицы
1) Mg2+ 4) С4
2) Al3+ 5) Cl+1
3) Na0 6) Сl
30. Структуру внешнего электронного слоя 4s1 имеют атомы химических элементов
1) Ca 4) Cu
2) Cr 5) Ag
3) Na 6) K
31. Один s-электрон на внешнем электронном уровне имеют атомы химических элементов
1) Ca 4) Аl2) Cr 5) Ag
3) Na 6) Zn
32. Один неспаренный электрон содержат невозбужденные атомы химических элементов
1) Mg 4) Cl2) B 5) S
3) K 6) Zn
33. Один неспаренный электрон содержат невозбужденные атомы химических элементов
1) Na 4) F
2) O 5) Si
3) Sc 6) N
Вариант 1
1.
 Число протонов и нейтронов в ядре атома 40К соответственно равно
Число протонов и нейтронов в ядре атома 40К соответственно равно1) 40, 19 2) 19, 40 3) 20, 20 4) 19, 21
2. Число неспаренных электронов в атоме серы в основном состоянии равно
1) 0 2) 2 3) 4 4) 6
3. Электронная конфигурация 1s22s22p6 соответствует иону
1) F 2) Cl 3) S2 4) Li+
4. Восьмиэлектронную внешнюю оболочку имеет ион
1) Ba2+ 2) Cr2+ 3) Pb2+ 4) Mn2+
5. Число электронов в ионе Se2 равно
1) 34 2) 32 3) 36 4) 33
6. Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) S+6 1) 1s22s22p63s23p4
Б) P+5 2) 1s22s22p6
В) S2 3) 1s22s22p63s2
Г) P+3 4) 1s22s22p63s23p6
А Б В Г
7. Установите соответствие между элементом и электронной конфигурацией его атомов.
ЭЛЕМЕНТ ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) C 1) 1s22s22p63s23p64s1
Б) Ar2) 1s22s22p2
В) Al 3) 1s22s22p63s23p1
Г) K 4) 1s22s22p63s23p6
А Б В Г
8. Электронную конфигурацию 1s22s22p63s23p6 имеют частицы
1) K+ 4) Cr3+
2) N3 5) Cl
3) S2 6) Al3+
9.
 Структуру внешнего электронного слоя 4s2 имеют атомы химических элементов
Структуру внешнего электронного слоя 4s2 имеют атомы химических элементов1) Ca 4) Fe
2) Mn5) Mg
3) Sr6) Cr
10. Два неспаренных электрона содержат невозбужденные атомы химических элементов
1) Ba4) F
2) Al 5) C
3) S 6) Ti
Вариант 2
1. Число протонов и нейтронов в ядре атома 39Ar соответственно равно
1) 39, 18 2) 18, 39 3) 39, 39 4) 18, 21
2. Число неспаренных электронов в атоме железа в основном состоянии равно
1) 2 2) 3 3) 4 4) 6
3. Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Mg2+ 2) S2 3) О2 4) Li+
4. Восьмиэлектронную внешнюю оболочку имеет ион
1) Cr3+ 2) Br 3) Sn2+ 4) Mn2+
5. Число электронов в ионе Cu2+ равно
1) 29 2) 27 3) 30 4) 31
6. Установите соответствие между формулой частицы и ее электронной конфигурацией.
ЧАСТИЦА ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) Cl 1) 1s22s22p63s2
Б) P3 2) 1s22s22p6
В) S+4 3) 1s22s22p63s23p2
Г) P+5 4) 1s22s22p63s23p6
А Б В Г
7.
 Установите соответствие между элементом и электронной конфигурацией его атомов.
Установите соответствие между элементом и электронной конфигурацией его атомов.ЭЛЕМЕНТ ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
А) Ne 1) 1s22s22p1
Б) Mg 2) 1s22s22p6
В) B 3) 1s22s22p63s2
Г) F 4) 1s22s22p5
А Б В Г
8. Электронную конфигурацию 1s22s22p6 имеют частицы
1) Li+ 4) Ne
2) O2 5) Cl+5
3) Na+ 6) Al0
9. Структуру внешнего электронного слоя 4s2 имеют атомы химических элементов
1) Cu 4) Zn
2) Ti 5) Ag
3) Ca 6) Se
10. Три неспаренных электрона содержат невозбужденные атомы химических элементов
1) P 4) Se
2) Аl5) V
3) Со 6) B
Что можно приготовить из кальмаров: быстро и вкусно
Рассмотрим задания №1 из вариантов ЕГЭ за 2016 год.
Задание №1.
Электронная формула внешнего электронного слоя 3s²3p6 соответствует строению каждой из двух частиц:
1. Arº и Kº 2. Cl‾ и K+ 3. S²‾ и Naº 4. Clº и Ca2+
Объяснение: среди вариантов ответа приведены атомы в невозбужденном и возбужденном состояниях, то есть электронная конфигурация, допустим иона калия не соответствует его положению в периодической системе. Рассмотрим вариант 1 Arº и Kº. Напишем их электронные конфигурации: Arº: 1s2 2s2 2p6 3s2 3p6; Kº: 1s2 2s2 2p6 3s2 3p6 4s1 — подходящая электронная конфигурация только у аргона. Рассмотрим вариант ответа №2 — Cl‾ и K+. K+: 1s2 2s2 2p6 3s2 4s0; Cl‾: 1s2 2s2 2p6 3s2 3p6. Следовательно, правильный ответ — 2.
Рассмотрим вариант 1 Arº и Kº. Напишем их электронные конфигурации: Arº: 1s2 2s2 2p6 3s2 3p6; Kº: 1s2 2s2 2p6 3s2 3p6 4s1 — подходящая электронная конфигурация только у аргона. Рассмотрим вариант ответа №2 — Cl‾ и K+. K+: 1s2 2s2 2p6 3s2 4s0; Cl‾: 1s2 2s2 2p6 3s2 3p6. Следовательно, правильный ответ — 2.
Задание №2.
1. Caº 2. K+ 3. Cl+ 4. Zn2+
Объяснение: для напишем электронную конфигурацию аргона: 1s2 2s2 2p6 3s2 3p6. Кальций не подходит, так как у него на 2 электрона больше. У калия: 1s2 2s2 2p6 3s2 3p6 4s0. Правильный ответ — 2.
Задание №3.
Элемент, электронная конфигурация атома которого 1s2 2s2 2p6 3s2 3p4, образует водородное соединение
1. Ch5 2. Sih5 3. h3O 4. h3S
Объяснение: посмотрим в периодическую систему, такую электронную конфигурацию имеет атом серы. Правильный ответ — 4.
Задание №4.
Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
1. Кальция 2. Хрома 3. Кремния 4. Алюминия
Кальция 2. Хрома 3. Кремния 4. Алюминия
Объяснение: у магния конфигурация внешнего энергетического уровня: 3s2. У кальция: 4s2, у хрома: 4s2 3d4, у кремния: 3s2 2p2, у алюминия: 3s2 3p1. Правильный ответ — 1.
Задание № 5.
Атому аргона в основном состоянии соответствует электронная конфигурация частицы:
1. S²‾ 2. Zn2+ 3. Si4+ 4. Seº
Объяснение: электронная конфигурация аргона в основном состоянии — 1s2 2s2 2p6 3s2 3p6. У S²‾ электронная конфигурация: 1s2 2s2 2p6 3s2 3p(4+2). Правильный ответ — 1.
Задание №6.
Сходную конфигурацию внешнего энергетического уровня имеют атомы фосфора и
1. Ar 2. Al 3. Cl 4. N
Объяснение: напишем электронную конфигурацию внешнего уровня атома фосфора: 3s2 3p3.
У алюминия: 3s2 3p1;
У аргона: 3s2 3p6;
У хлора: 3s2 3p5;
У азота: 2s2 2p3.
Правильный ответ — 4.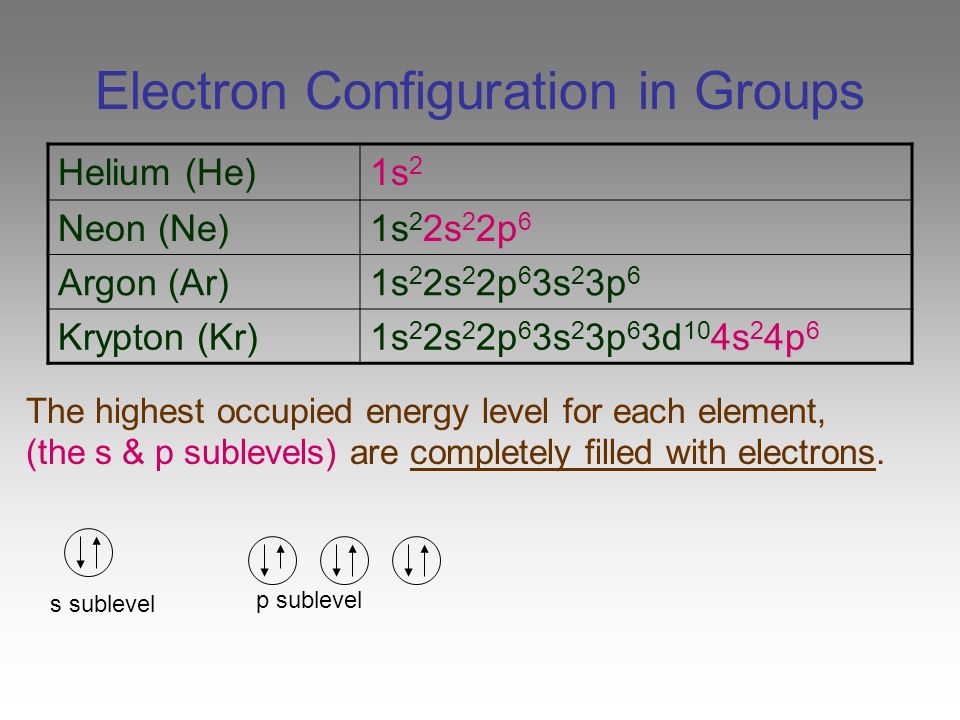
Задание №7.
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 соответствует частице
1. S4+ 2. P3- 3. Al3+ 4. O2-
Объяснение: данная электронная конфигурация соответствует атому аргона в основном состоянии. Рассмотрим варианты ответа:
S4+: 1s2 2s2 2p6 3s2 2p0
P3-: 1s2 2s2 2p6 3s2 3p(3+3)
Правильный ответ — 2.
Задание №8.
Какая электронная конфигурация соответствует распределению валентных электронов в атоме хрома:
1. 3d2 4s2 2. 3s2 3p4 3. 3d5 4s1 4. 4s2 4p6
Объяснение: напишем электронную конфигурацию хрома в основном состоянии: 1s2 2s2 2p6 3s2 3p6 4s1 3d5. Валентные электроны находятся на последних двух подуровнях 4s и 3d (здесь происходит перескок одного электрона с подуровня s на d). Правильный ответ — 3.
Задание №9.
Три неспаренных электрона на внешнем электронном уровне в основном состоянии содержит атом
1. Титана 2. Кремния 3. Магния 4. Фосфора
Титана 2. Кремния 3. Магния 4. Фосфора
Объяснение: для того, чтобы иметь 3 неспаренных электрона, нужно, чтобы элемент находился в пятой группе. Следовательно, правильный ответ — 4.
Задание №10.
Атом химического элемента, высший оксид которого RO2, имеет конфигурацию внешнего уровня:
1. ns2 np4 2. ns2 np2 3. ns2 4. ns2 np1
Объяснение: данный элемент имеет степень окисления (в этом соединении) +4, то есть он должен иметь 4 валентных электрона на внешнем уровне. Следовательно, правильный ответ — 2.
(можно подумать, что правильный ответ — 1, но у такого атома максимальная степень окисления будет +6 (так как 6 электронов на внешнем уровне), но нам нужно, чтобы высший оксид имел формулу RO2, а такой элемент будет иметь высший оксид RO3)
Задания для самостоятельной работы.
1. Электронная конфигурация 1s2 2s2 2p6 3s2 3p5 соответствует атому
1. Алюминия 2. Азота 3. Хлора 4. Фтора
Азота 3. Хлора 4. Фтора
2. Восьмиэлектронную внешнюю оболочку имеет частица
1. P3+ 2. Mg2+ 3. Cl5+ 4. Fe2+
3. Порядковый номер элемента, электронное строение атома которого 1s2 2s2 2p3, равен
1. 5 2. 6 3. 7 4. 4
4. Число электронов в ионе меди Cu2+ равно
1. 64 2. 66 3. 29 4. 27
5. Сходную конфигурацию внешнего энергетического уровня имеют атомы азота и
1. Серы 2. Хлора 3. Мышьяка 4. Марганца
6. Какое соединение содержит катион и анион с электронной конфигурацией 1s2 2s2 2p6 3s3 3p6?
1. NaCl 2. NaBr 3. KCl 4. KBr
7. Число электронов в ионе железа Fe2+ равно
1. 54 2. 28 3. 58 4. 24
8. Электронную конфигурацию инертного газа имеет ион
1. Cr2+ 2. S2- 3. Zn2+ 4. N2-
9. Сходную конфигурацию внешнего энергетического уровня имеют атомы фтора и
1. Кислорода 2. Лития 3. Брома 4. Неона
10. Элементу, электронная формула атома которого 1s2 2s2 2p6 3s2 3p4, соответствует водородное соединение
1. HCl 2. Ph4 3. h3S 4. Sih5
HCl 2. Ph4 3. h3S 4. Sih5
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
Важнейшим достижением ТКП является хорошее объяснение причин той или иной окраски комплексных соединений. Прежде чем мы попытаемся объяснить причину появления окраски у комплексных соединений, напомним, что видимый свет представляет собой электромагнитное излучение, длина волны которого находится в пределах от 400 до 700 нм. Энергия этого излучения обратно пропорциональна его длине волны:
Е = h×n = h×c/l
Энергия 162 193 206 214 244 278 300
Е, кДж/моль
Длина волны 760 620 580 560 490 430 400
Оказывается, энергия расщепления d-уровня кристаллическим полем, обозначаемая символом D, имеет величину такого же порядка, что и энергия фотона видимого света. Поэтому комплексы переходных металлов могут поглощать свет в видимой области спектра. Поглощаемый фотон возбуждает электрон с нижнего энергетического уровня d-орбиталей на более высокий уровень. Поясним сказанное на примере 3+ . У титана (III) только 1 d-электрон, комплекс имеет в видимой области спектра лишь один пик поглощения. Максимум интенсивности 510 нм. Свет с этой длиной волны заставляет d-электрон переместиться с нижнего энергетического уровня d‑орбиталей на верхний. В результате поглощения излучения молекула поглощаемого вещества переходит из основного состояния с минимальной энергией Е 1 в более высокое энергетическое состояние Е 2 . Энергия возбуждения распределяется по отдельным энергетическим колебательным уровням молекулы, превращаясь в тепловую. Электронные переходы, вызванные поглощением строго определенных квантов световой энергии, характеризуются наличием строго определенных полос поглощения. Причем, поглощение света происходит только в том случае, когда энергия поглощаемого кванта совпадает с разностью энергий DЕ между квантовыми энергетическими уровнями в конечном и начальном состояниях поглощающей молекулы:
Поясним сказанное на примере 3+ . У титана (III) только 1 d-электрон, комплекс имеет в видимой области спектра лишь один пик поглощения. Максимум интенсивности 510 нм. Свет с этой длиной волны заставляет d-электрон переместиться с нижнего энергетического уровня d‑орбиталей на верхний. В результате поглощения излучения молекула поглощаемого вещества переходит из основного состояния с минимальной энергией Е 1 в более высокое энергетическое состояние Е 2 . Энергия возбуждения распределяется по отдельным энергетическим колебательным уровням молекулы, превращаясь в тепловую. Электронные переходы, вызванные поглощением строго определенных квантов световой энергии, характеризуются наличием строго определенных полос поглощения. Причем, поглощение света происходит только в том случае, когда энергия поглощаемого кванта совпадает с разностью энергий DЕ между квантовыми энергетическими уровнями в конечном и начальном состояниях поглощающей молекулы:
DЕ = Е 2 – Е 1 = h×n = h×c/l,
где h — постоянная Планка; n — частота поглощаемого излучения; с- скорость света; l — длина волны поглощаемого света.
Когда образец какого-либо вещества освещается светом, в наш глаз поступают отраженные от него лучи всех непоглощенных образцом цветов. Если образец поглощает свет всех длин волн, лучи от него не отражаются, и такой предмет кажется нам черным. Если же образец вообще не поглощает света, мы его воспринимаем как белый или бесцветный. Если образец поглощает все лучи кроме оранжевого, то он кажется оранжевым. Возможен и еще один вариант — образец может казаться оранжевым и тогда, когда в наш глаз попадают лучи всех цветов кроме голубого. И наоборот, если образец поглощает только оранжевые лучи, он кажется голубым. Голубой и оранжевый цвет называются дополнительными.
Последовательность спектральных цветов: к аждый о хотник ж елает з нать, г дес идит ф азан — к расный, о ранжевый, ж елтый, з еленый, г олубой, с иний, ф иолетовый.
Для аквакомплекса 3+ числовому значению D расщ. = 163 кДж/моль соответствует граница видимого красного излучения, поэтому водные растворы солей Fe 3+ практически бесцветны. Гексацианоферрат (III) имеет D расщ. = 418 кДж/моль, что соответствует поглощению в сине-фиолетовой части спектра и отражению в желто-оранжевой. Растворы, содержащие гексацианоферрат (III)-ионы, окрашены в желтый цвет с оранжевым оттенком. Значение D расщ. 3+ невелико, по сравнению с 3- , что отражает не очень большую энергию связи Fe 3+ -OH 2 . Большая энергия расщепления 3- свидетельствует о том, что энергия связи Fe 3+ -CN – больше, и, следовательно, для отщепления CN – нужна большая энергия. Из экспериментальных данных известно, что молекулы Н 2 О в координационной сфере 3+ имеют среднее время жизни около 10 -2 с, а комплекс 3- чрезвычайно медленно отщепляет лиганды CN — .
= 163 кДж/моль соответствует граница видимого красного излучения, поэтому водные растворы солей Fe 3+ практически бесцветны. Гексацианоферрат (III) имеет D расщ. = 418 кДж/моль, что соответствует поглощению в сине-фиолетовой части спектра и отражению в желто-оранжевой. Растворы, содержащие гексацианоферрат (III)-ионы, окрашены в желтый цвет с оранжевым оттенком. Значение D расщ. 3+ невелико, по сравнению с 3- , что отражает не очень большую энергию связи Fe 3+ -OH 2 . Большая энергия расщепления 3- свидетельствует о том, что энергия связи Fe 3+ -CN – больше, и, следовательно, для отщепления CN – нужна большая энергия. Из экспериментальных данных известно, что молекулы Н 2 О в координационной сфере 3+ имеют среднее время жизни около 10 -2 с, а комплекс 3- чрезвычайно медленно отщепляет лиганды CN — .
Рассмотрим несколько примеров, позволяющих решать задачи с применением ТКП.
Пример: комплексный ион транс‑ + поглощает свет главным образом в красной области спектра — 640 нм.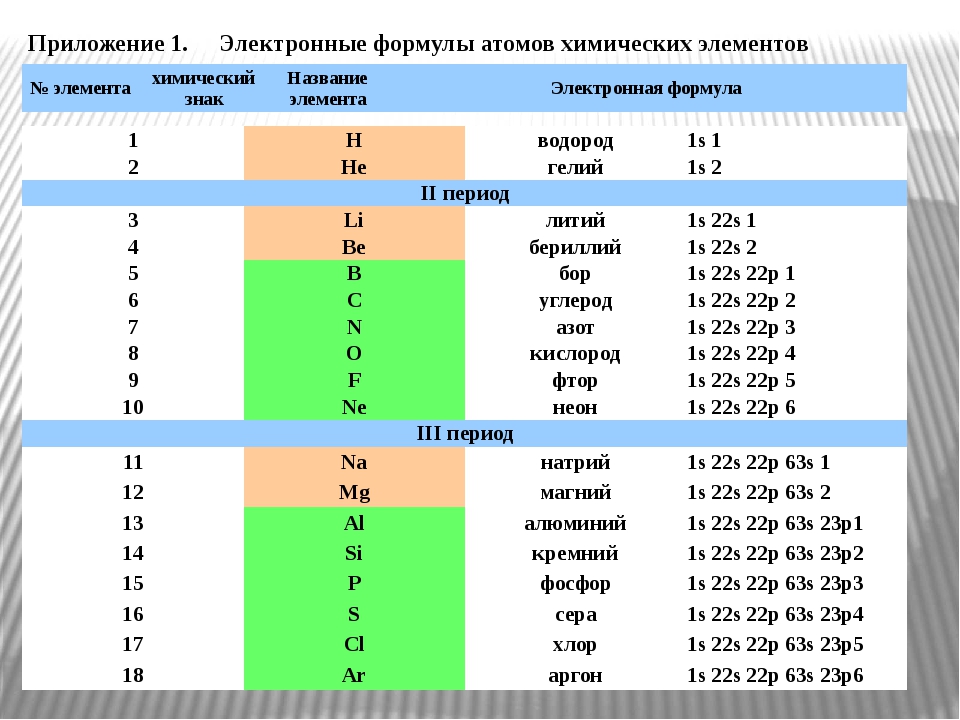 Какова окраска этого комплекса?
Какова окраска этого комплекса?
Решение : поскольку рассматриваемый комплекс поглощает красный свет, его окраска должна быть дополнительной к красному цвету — зеленой.
Пример: ионы А1 3+ , Zn 2+ и Co 2+ находятся в октаэдрическом окружении лигандов. Какой из этих ионов может поглощать видимый свет и вследствие этого представляется нам окрашенным?
Решение : ион А1 3+ имеет электронную конфигурацию . Поскольку у него нет внешних d‑электронов, он не окрашен. Ион Zn 2+ имеет электронную конфигурацию — 3d 10 . В этом случае все d-орбитали заполнены электронами. Орбитали d x 2– y2 и d x 2 не могут принять электрон, возбуждаемый с нижнего энергетического уровня орбиталей d xy , d yz , d xz . Поэтому комплекс Zn 2+ тоже бесцветен. Ион Со 2+ имеет электронную конфигурацию — d 7 . В этом случае возможно перемещение одного d-электрона с нижнего энергетического уровня орбиталей d xy , d yz , d xz на верхний энергетический уровень орбиталей d x 2– y2 и d x 2 . Поэтому комплекс иона Со 2+ окрашен.
Поэтому комплекс иона Со 2+ окрашен.
Пример: как объяснить, почему окраска диамагнитных комплексов 3+ , 3+ , 3– оранжевая, тогда как у парамагнитных комплексов 3– , 0 окраска голубая?
Решение : оранжевое окрашивание комплексов указывает на поглощение в сине-фиолетовой части спектра, т.е. в области коротких длин волн. Таким образом, расщепление для этих комплексов — большая величина, что и обеспечивает их принадлежность к низкоспиновым комплексам (D>Р). Спаривание электронов (d 6 -конфигурация, все шесть электронов на t 2g подуровне) связано с тем, что лиганды NH 3 , en, NO 2 — принадлежат к правой части спектрохимического ряда. Поэтому они при комплексообразовании создают сильное поле. Окрашивание второй группы комплексов в голубой цвет означает, что они поглощают энергию в желто‑красной, т.е. длинноволновой части спектра. Так как длина волны, при которой комплекс поглощает свет, определяет величину расщепления, можно сказать, что значение D в этом случае относительно мало (D
Пример: используя теорию кристаллического поля, объясните, почему комплексный ион — в водном растворе бесцветный, а 2 – окрашен в зеленый цвет?
Решение: комплекс — образован катионом меди Cu + с электронной конфигурацией 3d 10 4s 0 , все d-орбитали заполнены, переход электронов невозможен, поэтому раствор не окрашен. Комплекс 2- образован катионом Cu 2+ , электронная конфигурация которого 3d 9 4s 0 , следовательно на d– подуровне имеется вакансия. Переход электронов при поглощении света на d-подуровне определяет окраску комплекса. Аквакомплексы меди (П) имеют в водном растворе голубую окраску, введение во внутреннюю сферу комплекса хлорид-ионов приводит к образованию смешанно-лигандного комплекса, что и вызывает изменение окраски раствора на зеленую.
Комплекс 2- образован катионом Cu 2+ , электронная конфигурация которого 3d 9 4s 0 , следовательно на d– подуровне имеется вакансия. Переход электронов при поглощении света на d-подуровне определяет окраску комплекса. Аквакомплексы меди (П) имеют в водном растворе голубую окраску, введение во внутреннюю сферу комплекса хлорид-ионов приводит к образованию смешанно-лигандного комплекса, что и вызывает изменение окраски раствора на зеленую.
Пример : По методу валентных связей с учетом теории кристаллического поля определите тип гибридизации центрального атома и предскажите геометрическую форму комплексов:
— + —
Решение : выберем среди указанных комплексов соединения, образованные Э + , это:
+ — 3-
— + .
Химическая связь в данных комплексах образована по донорно-акцепторному механизму, донорами электронов являются лиганды: молекулы аммиака и цианид-ионы (монодентатные лиганды) и тиосульфат ионы (бидентатный лиганд).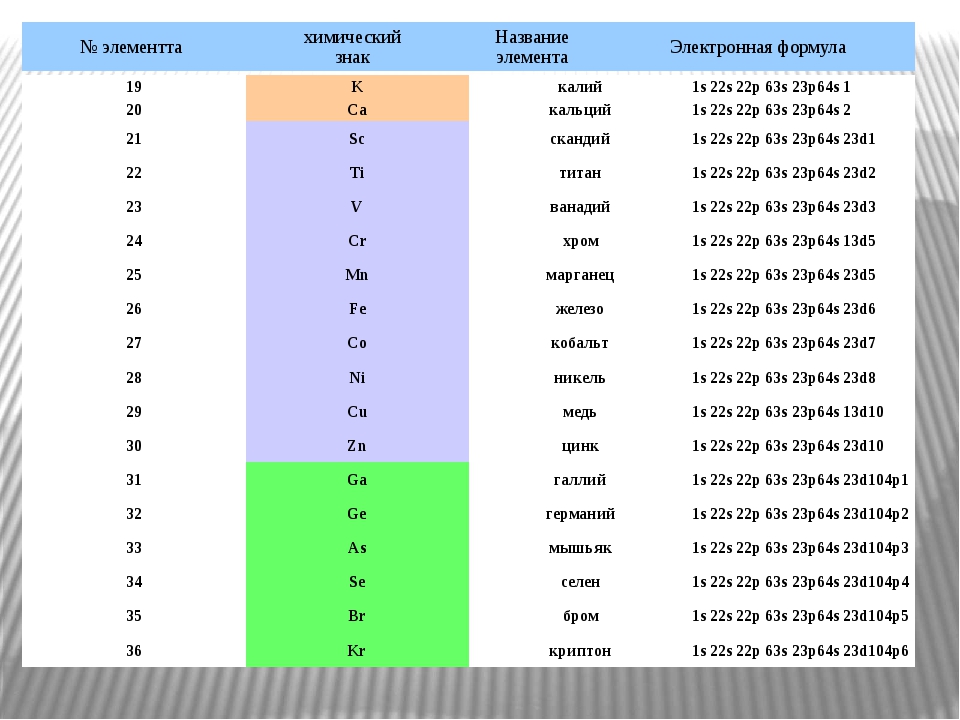 Акцептор электронов – катион Э + . Электронная конфигурация (n-1)d 10 ns 0 np 0 . В образовании двух связей с монодентатными лигандами принимают участие внешние ns- и np- орбитали, тип гибридизации центрального атома sp, геометрическая форма комплексов линейная, нет неспаренных электронов, ион диамагнитен. При образовании четырех донорно-акцепторных связей с бидентатным лигандом по МВС принимают участие одна s –орбиталь и три p-орбитали центрального атома, тип гибридизации sp 3 , геометрическая форма комплекса тетраэдрическая, нет неспаренных электронов.
Акцептор электронов – катион Э + . Электронная конфигурация (n-1)d 10 ns 0 np 0 . В образовании двух связей с монодентатными лигандами принимают участие внешние ns- и np- орбитали, тип гибридизации центрального атома sp, геометрическая форма комплексов линейная, нет неспаренных электронов, ион диамагнитен. При образовании четырех донорно-акцепторных связей с бидентатным лигандом по МВС принимают участие одна s –орбиталь и три p-орбитали центрального атома, тип гибридизации sp 3 , геометрическая форма комплекса тетраэдрическая, нет неспаренных электронов.
Вторая группа комплексов:
— — — 3+
образована ионом золота (III), электронная конфигурация которого 5d 8 6s 0 . Лиганды, принимающие участие в образовании комплексов, можно в соответствии со спектрохимическим рядом лигандов разделить на слабые: хлорид- и бромид-ионы и сильные: аммиак и цианид-ионы. На 5d-орбиталях в соответствии с правилом Хунда имеется два неспаренных электрона и они сохраняются при образовании донорно-акцепторных связей с лигандами слабого поля. Для образования связей катион золота предоставляет одну 6s- и три 6p-орбитали. Тип гибридизации центрального атома sp 3 . Пространственная структура комплексного иона – тетраэдрическая. Имеется два неспаренных электрона, комплекс парамагнитен.
Для образования связей катион золота предоставляет одну 6s- и три 6p-орбитали. Тип гибридизации центрального атома sp 3 . Пространственная структура комплексного иона – тетраэдрическая. Имеется два неспаренных электрона, комплекс парамагнитен.
Под воздействием лигандов сильного поля происходит спраривание электронов иона золота (III) с освобождением одной 5d-орбитали. В образовании четырех донорно-акцепторных связей принимают участие одна 5d- ,одна 6s- и две 6р-орбитали центрального атома. Тип гибридизации dsp 2 .Это приводит к плоско-квадратной структуре комплексного иона. Нет неспаренных электронов, комплексы диамагнитны.
Окраска раствора комплекса зависит от его состава, строения и определяется длиной волны l max , отвечающей максимуму полосы поглощения, интенсивностью полосы, зависящей от того, запрещен ли квантовохимически соответствующий электронный переход, размытостью полосы поглощения, зависящий от ряда параметров, таких, как электронная структура комплекса, интенсивность теплового движения в системе, степень искажения правильной геометрической формы координационного полиэдра и др.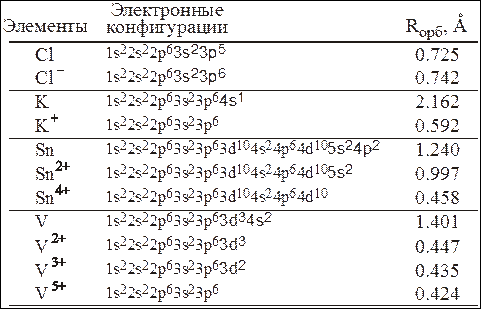
Теория метода валентных связей
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 6 4p 0 4d 0
В соответствии с правилом Хунда электроны на внешнем энергетическом уровне располагаются следующим образом:
Комплексообразователь имеет координационное число к.ч. = 6, поэтому может присоединить 6 лигандов, каждый из которых имеет неподеленную электронную пару и является, таким образом, донором электронов. Акцептор (комплексообразователь) для размещения шести электронных пар должен предоставить шесть вакантных орбиталей. При образовании комплексного иона 3+ четыре неспаренных электрона в d – состоянии Co 3+ сначала образуют электронные пары, в результате чего две 3d-орбитали освобождаются:
Затем образуется сам комплексный ион 3+ , имеющий следующее строение:
В образовании этого комплексного иона принимают участие внутренние 3d-орбитали и внешние 4s- и 4p-орбитали. Тип гибридизации — d 2 sp 3 .
Наличие только спаренных электронов говорит о диамагнитных свойствах иона.
Теория кристаллического поля
Теория кристаллического поля основывается на допущении, что связь между комплексообразователем и лигандами частично . Однако принимается во внимание влияние электростатического поля лигандов на энергетическое состояние электронов центрального иона.
Рассмотрим две комплексные соли: K 2 и K 3 .
K 2 – имеет тетраэдрическую пространственную структуру (sp 3 — гибридизация)
K 3 – имеет октаэдрическую пространственную структуру (sp 3 d 2 -гибридизация)
Комплексообразователи имеют следующую электронную конфигурацию:
d – электроны одного и того же энергетического уровня одинаковы в случае свободного атома или иона. Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
CN — > NO 2 — > NH 3 > SCN — > H 2 O > OH — > F — > Cl — > Br — > I —
Строение комплексного иона влияет на характер расщепления энергетических уровней комплексообразователя.
При октаэдрическом строении комплексного иона, d γ -орбитали (d z 2 -, d x 2 — y 2 -орбитали) подвержены сильному взаимодействию поля лигандов , и электроны этих орбиталей могут иметь большую энергию, чем электроны d ε -орбитали (d xy , d xz , d yz – орбитали).
Расщепление энергетических уровней для электронов в d-состоянии в октаэдрическом поле лигандов можно представить в виде схемы:
Здесь Δ окт – энергия расщепления в октаэдрическом поле лигандов.
При тетраэдрической структуре комплексного иона d γ -орбитали обладают более низкой энергией, чем d ε -орбитали:
Здесь Δ тетр – энергия расщепления в тетраэдрическом поле лигандов.
Энергию расщепления Δ определяют экспериментально по спектрам поглощения веществом квантов света, энергия которых равна энергии соответствующих электронных переходов. Спектр поглощения, а также и окраска комплексных соединений d-элементов, обусловлены переходом электронов с d-орбитали низшей энергии на d-орбиталь с более высокой энергией.
Так, в случае соли K 3 , при поглощении кванта света, вероятен переход электрона с d ε -орбитали на d γ -орбиталь. Этим объясняется, что данная соль имеет оранжево-красную окраску. А соль K 2 не может поглощать свет и, вследствие этого, она бесцветна. Это объясняется тем, что переход электронов с d γ -орбитали на d ε -орбиталь неосуществим.
Теория молекулярных орбиталей
Метод МО был ранее рассмотрен в разделе .
С помощью этого метода изобразим электронную конфигурацию высокоспинового комплексного иона 2+ .
Электронная конфигурация иона Ni 2+ :
1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 3d 8 4p 0 4d 0 или …4s 0 3d 8 4p 0 4d 0
В комплексном ионе 2+ в образовании химической связи принимают участие 8 электронов центрального иона Ni 2+ и 12 электронов шести лигандов NH 3.
Комплексный ион имеет октаэдрическое строение . Образование МО возможно только в том случае, когда энергии исходных взаимодействующих частиц близки по своим значениям, а также ориентированы в пространстве соответствующим образом.
В нашем случае, орбиталь 4s иона Ni 2+ равноценно перекрывается с орбиталями каждого из шести лигандов. В результате этого образуются молекулярные орбитали: связывающая σ s св и разрыхляющая σ s разр.
Перекрывание трех 4p-орбиталей комплексообразователя с орбиталями лигандов приводит к образованию шести σp-орбиталей: связывающих σ х св, σ y св, σ z св и разрыхляющих σ х разр, σ y разр, σ z разр.
Перекрывание d z 2 и d x 2 — y 2 комплексообразователя с орбиталями лигандов способствует образованию четырех молекулярных орбиталей: двух связывающих σ св х 2 — y 2 , σ св z 2 и двух разрыхляющих σ разр х 2 — y 2 , σ разр z 2 .
Орбитали d xy , d xz , d yz иона Ni 2+ не связываются с орбиталями лигандов, т.к. не направлены к ним. Вследствие этого, они не принимают участия в образовании σ-связи, и являются несвязывающими орбиталями: π xz , π xy , π yz .
Итого, комплексный ион 2+ содержит 15 молекулярных орбиталей. Расположение электронов можно изобразить следующим образом:
(σ s св) 2 (σ х св) 2 (σ y св) 2 (σ z св) 2 (σ св х 2 — y 2) 2 (σ св z 2) 2 (π xz) 2 (π xy) 2 (π yz) 2 (σ разр х 2 — y 2) (σ разр z 2)
Схематично образование молекулярных орбиталей изображено на диаграмме ниже:
Категории , You need to enable JavaScript to run this app.
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона, грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
M l — номер орбитали
M s — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число m l
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1». Магнитное квантовое число обозначается буквой m l .
Магнитное квантовое число обозначается буквой m l .
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения M l =-2,M l =-1,M l =0, M l =1,M l =2.
Спиновое квантовое число m s
Спин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается m s
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,. ..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, M l =0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Тетрафторид дицинка
Zn 2 F 4 (г). Термодинамические свойства газообразного тетрафторида дицинка в стандартном состоянии в интервале температур 100 — 6000 К приведены в табл. Zn 2 F 4 .
Молекулярные
постоянные, использованные для расчета термодинамических функций Zn 2 F 4
приведены в табл. Zn.8 .
Структура молекулы Zn 2 F 4 экспериментально не
исследовалась. По аналогии с Be 2 F 4 [ 82СОЛ/ОЗЕ ], Mg 2 F 4
[ 81СОЛ/САЗ ] (см. также [ 94GUR/VEY ]) и Аl 2 F 4
[ 82ZAK/CHA ] для Zn 2 F 4 в основном электронном состоянии 1 A g
принята плоская циклическая структура (группа симметрии D 2h ).
Статический вес основного электронного состояния Zn 2 F 4
рекомендован равным I, исходя из того, что ион Zn 2+ имеет…d 10 электронную конфигурацию.
Произведение моментов инерции, приведенное в табл. Zn.8 , вычислено по оцененным структурным
параметрам: r (Zn-
F t ) = 1.75 ±
0.05 Å
(концевая Zn-
F
связь), r (Zn-
F b ) = 1.95 ±
0.05 Å
(мостиковая Zn-
F
связь) и Ð
F b —
Zn-
F b = 80 ±
10 o .
Длина связи Zn-
F t принята такой
же, как r (Zn-
F) в молекуле ZnF 2 , величина r(Zn-F b), рекомендована больше по величине на
0.2 Å концевой связи, как это наблюдается в димерах галогенидов Al, Ga, In, Tl, Be и Fe. Значение угла F b —
Zn-
F b оценено по соответствующим величинам в молекулах Be 2 F 4 , Mg 2 F 4 и Al 2 F 4 .
Zn.8 .
Структура молекулы Zn 2 F 4 экспериментально не
исследовалась. По аналогии с Be 2 F 4 [ 82СОЛ/ОЗЕ ], Mg 2 F 4
[ 81СОЛ/САЗ ] (см. также [ 94GUR/VEY ]) и Аl 2 F 4
[ 82ZAK/CHA ] для Zn 2 F 4 в основном электронном состоянии 1 A g
принята плоская циклическая структура (группа симметрии D 2h ).
Статический вес основного электронного состояния Zn 2 F 4
рекомендован равным I, исходя из того, что ион Zn 2+ имеет…d 10 электронную конфигурацию.
Произведение моментов инерции, приведенное в табл. Zn.8 , вычислено по оцененным структурным
параметрам: r (Zn-
F t ) = 1.75 ±
0.05 Å
(концевая Zn-
F
связь), r (Zn-
F b ) = 1.95 ±
0.05 Å
(мостиковая Zn-
F
связь) и Ð
F b —
Zn-
F b = 80 ±
10 o .
Длина связи Zn-
F t принята такой
же, как r (Zn-
F) в молекуле ZnF 2 , величина r(Zn-F b), рекомендована больше по величине на
0.2 Å концевой связи, как это наблюдается в димерах галогенидов Al, Ga, In, Tl, Be и Fe. Значение угла F b —
Zn-
F b оценено по соответствующим величинам в молекулах Be 2 F 4 , Mg 2 F 4 и Al 2 F 4 . Погрешность рассчитанного
значения I A I B I C составляет 3·10 ‑113 г 3 ·cм 6 .
Погрешность рассчитанного
значения I A I B I C составляет 3·10 ‑113 г 3 ·cм 6 .
Частоты валентных колебаний концевых связей Zn-F n
1 и n
2
приняты по работе Гивана и Левеншусса [ 80GIV/LOE ], исследовавших ИК спектр и
спектры КР молекул Zn 2 F 4 , изолированных в матрице из
криптона. Частоты колебаний всех мостиковых связей Zn-F (n
3)
приняты одинаковыми, и их значения оценены в предположении, что (n b / n t ) ср = 0.7,
как в димерах галогенидов Fe, Al, Ga и In. Величины частот деформационных
колебаний концевых связей (n
4 — n
5) Zn 2 F 4
рекомендованы, предполагая, что отношение их значений в Zn 2 F 4
и Zn 2 Cl 4 такое же, как для ZnF 2 и ZnCl 2 .
Частота неплоского деформационного колебания цикла (n
7), принята
немного большей, чем соответствующая частота для Zn 2 Cl 4 .
Значение частоты деформационного колебания цикла в плоскости (n
6)
оценено сравнением с величиной, принятой для Zn 2 Cl 4 , и
принимая во внимание отношение величин частот колебаний мостиковых связей Zn-F
и Zn-Cl в Zn 2 F 4 и Zn 2 Cl 4 . Погрешности экспериментально наблюденных частот колебаний составляют 20 см ‑1 ,
оцененных 20% от их величины.
Погрешности экспериментально наблюденных частот колебаний составляют 20 см ‑1 ,
оцененных 20% от их величины.
Возбужденные электронные состояния Zn 2 F 4 в расчете термодинамических функций не учитывались.
Термодинамические функции Zn 2 F 4 (г) вычислены в приближении «жесткий ротатор — гармонический осциллятор» по уравнениям (1.3) — (1.6) , (1.9) , (1.10) , (1.122) — (1.124) , (1.128) , (1.130) . Погрешности рассчитанных термодинамических функций обусловлены неточностью принятых значений молекулярных постоянных, а также приближенным характером расчета и составляют 6, 16 и 20 Дж× К ‑1 × моль ‑1 в значениях Φº(T ) при 298.15, 3000 и 6000 К.
Таблица термодинамических функций Zn 2 F 4 (г) публикуется впервые.
Константа равновесия Zn 2 F 4 (г) = 2Zn(г) + 4F(г) вычислена c использованием принятого значения
D at H º(Zn 2 F 4. г, 0) = 1760 ± 30 кДж× моль ‑1 .
Значение
оценено сравнением энтальпий сублимации и димеризации включенных в данное
издание дигалогенидов.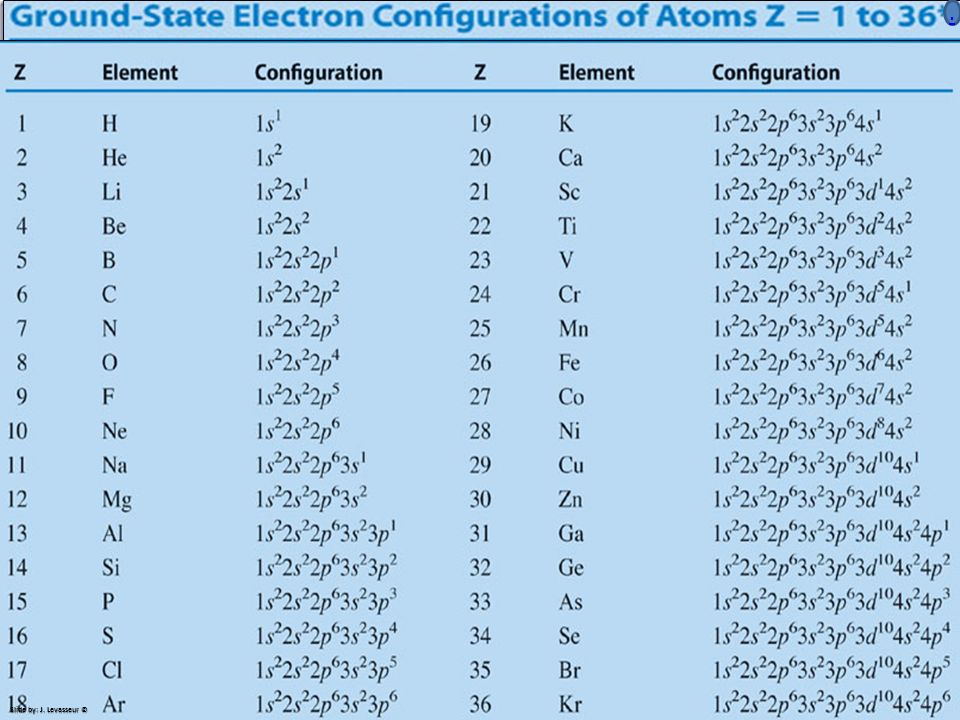 В таблице Zn.12 приведены
величины отношений D s H º(MeHal 2.
к, 0) / D r H º(MeHal 2 — MeHal 2 , 0),
соответствующих принятым в данном издании величинам.
В таблице Zn.12 приведены
величины отношений D s H º(MeHal 2.
к, 0) / D r H º(MeHal 2 — MeHal 2 , 0),
соответствующих принятым в данном издании величинам.
В 9 случаях из общего количества 20 экспериментальные данные отсутствуют. По этим соединениям выполнены оценки, приведенные в таблице в квадратных скобках. Эти оценки выполнены на основании следующих соображений:
1. для соединений Fe, Co и Ni принят небольшой ход в ряду F-Cl-Br-I и отсутствие такого хода в ряду Fe-Co-Ni;
2. для соединений Zn хода величин в ряду F-Cl-Br-I заметить не удается, и для фторида принята величина, средняя из остальных значений;
3. для соединений Cu принят небольшой ход в ряду F-Cl-Br-I по аналогии с соединениями группы железа на основании близости величин; сам ход принят несколько меньшим.
Изложенный подход приводит к значениям энтальпий атомизации Me 2 Hal 4 , приведенным в табл. Zn.13 .
При
вычислении энергии атомизации Cu 2 I 4 использована не
включенная в данное издание величина D s H °
(CuI 2 ,
к, 0) = 180 ± 10 кДж×
моль ‑1 . (см. текст по энтальпии сублимации CuBr 2).
(см. текст по энтальпии сублимации CuBr 2).
Точность выполненных оценок может быть оценена равной 50 кДж× моль ‑1 для Cu 2 I 4 и 30 кДж× моль ‑1 в остальных случаях.
Принятому значению энтальпии атомизации Zn 2 F 4 соответствует величина энтальпии образования:
D f H ° (Zn 2 F 4. г, 0) = -1191.180 ± 30.0 кДж× моль ‑1 .
Осина Е.Л. [email protected]
Гусаров А.В. [email protected]
Строение атома 3 | Образовательный портал EduContest.Net — библиотека учебно-методических материалов
Строение атомаТЕСТ 1.
Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов селена равны соответственно:
1) 4,6; 2) 3,6 3) 4,7 5) 3,7
Химическому элементу соответствует высший оксид состава R2O. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
1) s2 2) s1 3) s2p1 4) s2p2
Ядра атомов изотопов различаются числом
1) протонов 2) нейтронов
3) протонов и нейтронов 4) протонов и электронов
Сумма протонов и нейтронов в атоме 65Zn равна
1) 30 2) 65 3) 35 4) 40
Электронную формулу 1s2 2s2 2p6 3s2 3p6 4s2 имеет атом элемента
1) Ba 2) Mg 3) Ca 4) Sr
Строение атома
ТЕСТ 2.
1. Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов хрома равны соответственно:
1) 4,2; 2) 4,1 3) 4,6 5) 4,5
2. Электронную формулу 1s2 2s2 2p6 3s2 3p6 имеет частица
1) Li+ 2) K+ 3) Cs+ 4) Na+
3. Сумма протонов, нейтронов и электронов в атоме 31Р равна
1) 15 2) 16 3) 46 4) 31
4. У атома фосфора число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1) 5,31 2) 5,15 3) 3,31 4) 3,15
Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 3s2 3p1 2) .. 3s2 3) .. 3s1 4) 3s2 3p2
Строение атома
ТЕСТ 3.
1. Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов меди равны соответственно:
1) 4,2; 2) 4,1 3) 4,9 5) 4,10
2. Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
Химическому элементу соответствует высший оксид состава RO. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
1) s2 р1 2) s2 3) s2p3 4) s2p2
3. Число электронов в атоме аргона равно числу электронов в ионе
1) S2- 2) Al 3+ 3) Na + 4) F –
4. Самым распространённым оксидом в земной коре является
1) оксид водорода 3) оксид кремния
2) оксид углерода (IV) 4) оксид алюминия
Число электронов на внешнем энергетическом уровне атома фосфора в возбуждённом состоянии равно
1) 3 2) 5 3) 2 4) 4
Строение атома
ТЕСТ 4.
1. Химическому элементу соответствует высший оксид состава RO2. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
1) s2 р1 2) s2 р4 3) s2p3 4) s2p2
2. Фосфид – иону соответствует электронная конфигурация
Фосфид – иону соответствует электронная конфигурация
1) 1s22s22p63s23p6 3) 1s22s22p6
2) 1s22s22p63s23p4 4) 1s22s22p63s23p2
3. Сумма протонов и нейтронов в атоме 14 С равна
1) 14 2) 12 3) 13 4) 15
4. У атома кальция число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1) 4, 20 2) 2, 20 3) 4, 40 4) 2, 40
5. Число электронов на внешнем энергетическом уровне атома алюминия в возбуждённом состоянии равно
1) 2 2) 4 3) 3 4) 1
Строение атома
ТЕСТ 6.
1. Химическому элементу соответствует высший оксид состава R 2O3. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
1) s2 р1 2) s2 3) s2p3 4) s2p2
2. Число электронов в атоме аргона равно числу электронов в ионе
1) Р3- 2) Si 4+ 3) Mg +2 4) F –
3. Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов мышьяка равны соответственно:
Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов мышьяка равны соответственно:
1) 4, 6; 2) 2, 5 3) 3, 7 5) 4, 5
4. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 4s2 4p2 2) .. 4s1 3) .. 5s1 4) 5s2 5p2
Элемент, атом которого содержит 24 протона, — это
1) Mg 2) Cr 3) Sc 4) Ca
Строение атома
ТЕСТ 5.
1. Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов железа равны соответственно:
1) 4, 2; 2) 4, 8 3) 4, 6 5) 4, 1
2.На третьем энергетическом уровне имеется по 8 электронов у каждой частицы
1) Na+ и Ar 2) S2- и Ar 3) F- и Ne 4) Mg2+ и S
3. Сумма протонов, нейтронов и электронов в атоме 12 С равна
1) 14 2) 18 3) 6 4) 12
4. Химическому элементу соответствует высший оксид состава R 2O7. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
Химическому элементу соответствует высший оксид состава R 2O7. Электронная конфигурация внешнего энергетического уровня атома этого элемента имеет вид
1) 1s22s22p63s1 3) 1s22s22p63s23p6 4s1
2) 1s22s22p63s23p5 4) 1s12s1
Самым распространённым элементом в органических соединениях является
1) азот 2) фосфор 3) кислород 4) углерод
Строение атома
ТЕСТ 7.
1. Сумма протонов и нейтронов в атоме 24 Mg равна
1) 24 2) 12 3) 30 4) 17
2. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) 4s1 2) ..3d24s2 3) .. 3d14s2 4) 3d 34s2
3. Самым распространённым металлом в земной коре является
1) железо 2) хром 3) алюминий 4) калий
4. Элемент, атом которого содержит 12 протона, — это
1) Na 2) C 3) Mg 4) Si
5. Число электронов на внешнем энергетическом уровне атома углерода в возбуждённом состоянии равно
Число электронов на внешнем энергетическом уровне атома углерода в возбуждённом состоянии равно
1) 2 2) 4 3) 3 4) 6
Строение атома
ТЕСТ 8.
1. . Число энергетических слоёв и число энергетических электронов на внешнем энергетическом уровне атомов цинка равны соответственно:
1) 2, 2; 2) 4, 1 3) 3, 2 5) 4, 2
2. На 4s- энергетическом подуровне расположены все валентные электроны атома
1) железа 2) кальция 3) углерода 4) серы
3. Самым распространённым элементом на Земле является:
1) водород 2) кремний 3) кислород 4) углерод
4. Одинаковое число протонов и нейтронов содержится в атоме
1) железа -56 3) кобальта — 58
2) йода — 126 4) углерода – 12
5. Число электронов на внешнем энергетическом уровне атома селена в возбуждённом состоянии равно
1) 6 2) 4 3) 5 4) 2
15
Строение атома.
 Электронные оболочки атома
Электронные оболочки атома1. Строение атома. Электронные оболочки атома.
Ачкасова Юлия МаксимовнаУчитель-консультант школы
Н.И. Лобачевского
2. Атом
— наименьшая электронейтральная частицахимического элемента, являющаяся
носителем его свойств.
3. Атом
ЯДРОЭЛЕКТРОННАЯ
ОБОЛОЧКА
нуклоны
нейтроны
Не заряжены
протоны
Положительно заряжены
электроны
Отрицательно заряжены
4. Атом
Число p+ = числу e- =порядковому номеруэлемента (Z)
5. Изотопы
6. Электронная оболочка
— cовокупность всех электронов ватоме,
окружающих ядро.
7. Электронные уровни
Орбиталь– это область наиболее вероятногоместонахождения электрона в пространстве.
Номер периода = числу эл. Уровней
Состояние электрона в атоме описывается 4
квантовыми числами:
1. Главное квантовое число n;
2. Побочное (орбитальное) квантовое число l;
3.
 Магнитное квантовое число ml;
Магнитное квантовое число ml;4. Спиновое квантовое число ms.
8. Главное квантовое число
определяет энергетическийуровень электрона (равно номеру
периода). Принимает любые
целочисленные значения,
начиная с n=1 (n=1,2,3,…) и
соответствует номеру периода.
9. Орбитальное квантовое число
Определяет геометрическую форму атомной орбитали.Принимает любые целочисленные значения с l = 0 (l = n -1)
10. Магнитное квантовое число
11. Спиновое квантовое число
Определяетнаправление
вращения электрона
12. Основные квантово-механические законы
• Принцип Паули.• Принцип наименьшей энергии.
• Правило Гунда (Хунда).
13. Принцип Паули
Хотя бы одно из квантовых чисел n, l, ml иms, должно обязательно различаться
проекцией спина.
14. Принцип наименьшей энергии
Электроны в основном состоянии заполняюторбитали в порядке повышения уровня их
энергии. Первыми заполняются орбитали с
минимальными уровнями
энергии- сначала заполняются
те подуровни, для которых
сумма значений квантовых
чисел m и l является наименьшей.

15. Правило Хунда
В данном подуровне электроны стремятсязанять энергетические состояния таким
образом, чтобы их суммарный спин был
максимальным, суммарный спин
спаренных электронов равен нулю.
16. Электронная оболочка
Уровень- > подуровень -> орбиталь1
s
2
s
p
3
s
p d
4
s
p d f
17. Электронная оболочка
1s22s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
число электронов
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
18. Электронные орбитали
fd
p
s
Электроны сначала
заполняют свободные
орбитали, затем пара!
Спины на орбитали
направлены
противоположно!
19. Электронная формула
1. Число e- = числу p+ =порядковому номеру2. Число электронов на внешнем уровне =
номеру группы
3. Число эл. уровней = номер периода
20.
 Составляем формулу 3 период = 3 уровня
Составляем формулу 3 период = 3 уровняNa
+11
281
1s2 2s2 2p6 3s1
1 уровень
2 у-нь
3 у-нь
Номер группы = число e- на последнем
уровне
Суммарное число e- в
атоме = порядковому
номеру элемента
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
21. Составляем формулу
S+ 16
286
1s2 2s22p6 2s23p4
1 уровень = max. 2 элекрона
2 уровень = max. 8 электронов
3 уровень = max. 18 электронов
4 уровень = max. 32 электрона
22. Составляем формулу
Сa+ 20
4s
2882
3p
3s
1s2 2s22p6 3s23p6 4s2
2s
1s
2p
23. Возбужденное состояние атома
24. Электронные формулы ионов
25. Решите:
Электронную конфигурацию 1s22s22p6имеют частицы:
1. Na 1s22s22p63s1
2. O 1s22s22p4
22s22p6
–
1s
3. F
4. Na+ 1s22s22p6
5.
 S2- 1s22s22p63s23p6
S2- 1s22s22p63s23p626. Решите:
Хлорид-ион имеет такую же электроннуюконфигурацию, как и: Сl- 1s22s22p63s23p6
1. катион кальция Ca2+ 1s2 2s2 2p6 3s2 3p6.
2. гидрид-анион H- 1s2
3. атом брома Br 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
4. атом натрия Na 1s2 2s2 2p6 3s1
5. сульфид-анион S2- 1s2 2s2 2p6 3s2 3p6
27. Решите:
Восьмиэлектронную внешнюю оболочку восновном состоянии имеют частицы:
1. Al3+ 13-3 = 10 1s22s22p6
2. C2+ 6-2 = 4 1s22s2
3. S2- 16+2 = 18 1s22s22p63s23p6
22s22p5
9:
1s
4. F
22s22p63s2
5+
17-5
=
12
1s
5. Cl
28. Решите:
Один неспаренный электрон на внешнемуровне в основном состоянии имеют
атомы:
1. Al 1s22s22p63s23p1
2. C 1s22s22p2
3. O 1s22s22p4
4. F 1s22s22p5
5. Fe 1s22s22p63s23p63d64s2
Спасибо за внимание!
«Тестовое задание на тему :»Строение атома и структура вещества -1»
Готовимся к ЕГЭ
Тестовое задание -1 на тему: «Строение атома и структура вещества –1 »
Всякое вещество – от самого простого до самого сложного
– имеет три различные, но взаимосвязанные стороны:
свойство, состав, строение … Прогресс науки не останавливается на открытии материальных носителей
свойств; он идёт дальше, к выяснению природы и структуры
найденных носителей, их строения.

Б. М. КЕДРОВ
Выполнил: учитель химии – биологии Алиев Сагынган Кабирович МБОУ «Фоминская СОШ» Называевского муниципального района Омской области
Вариант № 1.
Химические свойства вещества определяются тремя субатомными частицами. Две из них имеют одинаковый по величине, но противоположный по знаку заряд, а третья не имеет заряда. Эти частицы называются …. … …. и … .Число протонов в ядре атома указывает … элемента и записывается в виде нижнего левого индекса у символа элемента. Например, для углерода число протонов у символа элемента можно записать следующим образом:… С.
Верхний индекс у символа элемента указывает суммарное число протонов и нейтронов в ядре атома и называется … Символ углерода, каждый атом которого содержит 6 протонов и 8 нейтронов в ядре, обозначается как … С.
Укажите число протонов, нейтронов и электронов для атомов представленных ниже изотопов:
Изотоп Число
протонов нейтронов электронов
1) 13С … … …
2) 55 Mn … … …
3) 97 Mo … … …
5.
 Ядро атома криптона – 80, 80 Kr, содержит:
Ядро атома криптона – 80, 80 Kr, содержит:80p и 36n;
36p и 44e- ;
36p и 80n;
36p и 44n.
6. Какое число электронов у иона хрома Cr3+ ;1) 21;
2) 24;
3) 27;
4) 52?.
7. Какая частица имеет большое число протонов, чем электронов:
1) атом натрия;
2) атом серы;
3) сульфид – ион;
4) ион – натрия?
8. Даны простые вещества: сажа, озон, графит, карбин, кислород, алмаз, красный
фосфор. Сколько всего химических элементов входит в состав этих веществ:
1) 3;
2) 4;
3) 5;
4) 6?
9. Массовое число изотопа равно:
числу протонов в ядре;
числу нейтронов в ядре;
числу орбитальных электронов;
суммарному числу нейтронов и протонов.
10. Атом элемента имеет порядковый номер 13 и массовое число 27.
5;
2;
3;
4.
11. Октет электронов на внешней электронной оболочке имеет:
S;
Si;
O2- ;
Ne+ .
 12. Электронную конфигурацию благородного газа имеет:
12. Электронную конфигурацию благородного газа имеет:Te2-;
Ga+ ;
Fe2+ ;
Cr3+.
13. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра, равным:
1) +18;
2) -18;
3) +2;
4) -2.
14. Чему равно максимальное число электронов, которые могут занимать 3s-орбиталь :1) 1;
2) 2;
3) 6;
4) 8.
15. Максимальное число электронов, которые могут занимать 2p-подуровень, равно:
1) 1;
2) 2;
3) 6;
4) 8.
16. На 3d – подуровне максимально может находиться:
1) 2e- ;
2) 6e-;
3) 10e-;
4) 18e-.
17. Атом какого элемента имеет электронную конфигурацию 1s22s22p6 3s2 3p6 4s1 :1) K;
2) Ca;
3) Ba;
4) Na.
18. Электронная конфигурация иона Zn2+ соответствует формуле :1) 1s2 2s2 3p4;
2) 1s2 2s2 2p6 3s2 3p6 ;3) 1s2 2s2 2p6 3s2 3p6 3d10 ;4) 1s22s2 2p6 3s2 3p6 3d104s24p6.
19. Три частицы Ne0, Na+ и F- – имеют одинаковое:
массовое число,
число нейтронов,
число электронов,
Число протонов.
20. Сколько неспаренных электронов имеет ион Со3+ : 3;
4;
5;
6?.
************************************************************************
Вариант № 2.
Какие из перечисленных обозначений орбиталей не верны:
3;
4;
5;
6.
Распределение электронов по энергетическим уровням и подуровням у элемента с порядковым номером 79 изображается так: …
Атом какого элемента в невозбужденном состоянии имеет электронную конфигурацию 1s22s22p63s23p64s1;
Na;
K;
Ca;
Ba.
Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона:
Ca2+;
K+;
CI0;
Na+.?5. На основании анализа электронных конфигураций основного состояния
частиц:O2- , F- , Ne , Na+ – можно сделать вывод об увеличении относительных
размеров этих частиц в ряду…
6. Атомом каких элементов соответствуют представленные ниже электронные
конфигурации?
Электронная конфигурация Элемент
1s22s22p1 …
1s22s22p2 …
1s22s22p5 …
1s22s22p63s1 …
7.
 В каком из приведенных рядов частицы расположены в порядке возрастания их
В каком из приведенных рядов частицы расположены в порядке возрастания их ионного радиуса:
Mg2+ – CI- – K+ – Ca2+ ;
Mg2+ – Ca2+ – K+ – CI- ;
K+ – Ca2+ – CI– – Mg2+.
Ca2+ – K+ – CI- – Mg2+ .8. На основании положения элементов в периодической системе сделайте вывод,
какой ион имеет наименьший радиус:
Se2- ;
Br- ;
Rb+ ;
Sr2+ .9. Запишите конфигурации внешних электронных слоев для следующих ионов:
Ион Электронная Ион Электронная
конфигурация конфигурация Mn4+ … 4) K+ …
S2- … 5) CI- …
Cu+ … 6) Pb2+ …
10. Какой ион имеет наибольший радиус? Дайте ответ на основании положения
соответствующих элементов в периодической системе:
Сa2+ ;K+ ;
F- ;
CI- .
11. Из перечисленных ионов: Сl-,S2, K+, Ca2+, –– наименьший радиус имеет ….
12. Какой из ионов имеет минимальный радиус:
I- ;
Cs+;
Ba2+;
Te2
13. В ряду K-Ca-Sc-Ti радиус атомов . . . (уменьшается, увеличивается)?
14. Напишите электронные конфигурации марганца в степенях окисления,
указанных ниже, и формулы оксидов, в которых марганец проявляет эти
степени окисления:
степень окисления электронная Оксид
марганца конфигурация
1) +2 . . . . . .
2) +4 . . . . . .
. . .
3) +7 . . . . . .
15. Энергия, которая указана в уравнении
Cl0 (r.) → Cl* (r.) + e – 1254 кДж,
является для атома хлора
1) энергией химической связи;
2) энергией ионизации;
3) электроотрицательностью;
4) сродством к электрону.
16. Сродством к электрону называют:
1) энергию, необходимую для отрыва электрона от невозбужденного атома;
2) способность атома данного элемента к оттягиванию на себя электронной плотности;
3) переход электрона на более высокий энергетический уровень;
4) выделение энергии при присоединении электрона к атому или иону.
17. Какой из элементов имеет наибольшее значение энергии ионизации:
1) 3 Li ; 2) 9 F ; 3) 26 Fe ; 4) 53 I ?18. Энергия, затрачиваемая на удаление одного электрона от атома элемента в газообразном состоянии, у магния
Энергия, затрачиваемая на удаление одного электрона от атома элемента в газообразном состоянии, у магния
меньше, чем у натрия и больше, чем у алюминия;
больше, чем у натрия и меньше, чем у алюминия;
меньше, чем у натрия и алюминия;
больше, чем у натрия и алюминия.
19. Исходя из анализа электронных структур атомов и положения элементов в
периодической системе укажите, какой из каждых двух приведенных ниже
атомов имеет большее сродство к электрону:
калий и кальций;
сера или хлор;
водород или литий.
20. Химические элементы расположены в порядке возрастания
электроотрицательности в ряду;
Si, P, Se, Br, CI, O;
Si, P, Br, Se, CI, O;
P, Si, Br, Se, CI, O;
Se, Si, P, Br, CI, O.
**********************************************************************
Ключ к тестовому заданию- 1 на тему: «Строение атома и структура вещества –1»
Вариант № 1.
1. Протон (р), электрон (е– ) и нейтрон ( n).
2. Атомный номер элемента; 6 С . 3. Массовое число; 14 С . 4. 1) 6р 7n 6e-
2) 25p 30n 25e-
3) 42p 55n 42e-
5. 4).
6. 1).
7. 11p и 10e- .
8. 1) . Углерод, кислород и фосфор.
9. 4).
10. 3). Элемент 27Al 3 валентных электрона, расположен в 3 группе
Периодической системы.
11. 3). Ион О2- имеет полностью заполненный внешний электронный
уровень, на нём 8е
12. 1). Ион Те2- имеет электронную конфигурацию ксенона.
13. 4).
14. 2). s-Орбиталь любого уровня может иметь максимально 2 электрона.
15. 3). р-Подуровень может иметь максимально 6 электронов.
3). р-Подуровень может иметь максимально 6 электронов.
16. 3). d-Подуровень может иметь максимально10 электронов.
17. 1). Такую электронную конфигурацию имеет атом калия, находящийся в
основном, невозбуждённом состоянии.
18. 3).
19. 3). У всех трёх частиц число электронов- 10е.
20. 2), 6е на 3d- орбиталях: ↑↓ ↑ ↑ ↑ ↑; 2е- спаренных и 4е- спаренных.
Вариант № 2.
1. 1).
2. 254 Es + 4 He → 258 Md .
3. Курчатовием.
4. 2). В подгруппе с увеличением порядкового номера элемента металлическис
свойства возрастают.
5. 3). Элементы Р и As расположены в одной подгруппе.
6. 2). Элемент Ra расположен в одной подгруппе с барием.
7. 3). Лантан расположен в 3 группе периодической системы элементов; электронная
формула [Xe 5d16s2;наиболее типичная степень окисления +3. Это же характерно
Это же характерно
и для лантанойдов.
8. 2). Фотоэффект – явление, связанное с освобождением электронов твердого тела под
действием электромагнитного излучения, в частности испусканием электронов
под действием света.
9. 3).
10. 2).
11. GeSe2.
12. 3).
13. 3).
14. 3). Элементы фтор и хлор занимают положение в начале VII группы периодической
системы.
15. 4). Электронная структура атома [Ne ] 3s23p5.
16. 1).
17. NaCI, MgCI2, AICI3, Na2S, MgS, AI2S3.
18. 4). Электронная структура атома [ Ar] 4s1.
19. Генри Кавендиш..20. 2). GeO2, Geh5.
*****************************************************************************
| A | B | ||
|---|---|---|---|
| Демокрит | считал, что материя состоит из чрезвычайно мелких частиц, которые нельзя разделить. | ||
| Разрывная (атомная) теория | частицы (атомы) | ||
| Аристотель | считал, что не существует ограничений на количество раз, когда материя может быть разделена | ||
| Непрерывная теория | Материя может быть разделена на все меньшие и меньшие части без ограничений | ||
| Джон Дальтон | Доказательство существования атомов путем измерения масс элементов | ||
| Теория атома Дальтона | Вся материя состоит из отдельных частиц, называемых атомами, которые нельзя разделить | ||
| Дж.Эксперименты J. Thomson | предоставили первое свидетельство того, что атомы состоят из еще более мелких частиц | ||
| Модель атома Томсона | Отрицательные заряды, равномерно рассеянные в атоме, заполненном положительно заряженной материей | ||
| Эрнст Резерфорд | ученый, который сделал эксперимент с золотой фольгой | ||
| эксперимент с золотой фольгой | большинство альфа-частиц проходят через фольгу, мало отклоняются, еще меньше отскакивают назад | ||
| атомное ядро | плотная положительно заряженная масса, расположенная в центре атома | ||
| Модель атома Резерфорда | Весь положительный заряд атома сосредоточен в его ядре, большая часть атома — это пустое пространство | ||
| субатомных частиц | протонов, электронов, нейтронов | ||
| протонов | положительно заряженных субатомных частиц, которые находится в ядре атома | ||
| отрицательно заряженная субатомная частица, находящаяся в пространстве вне ядра | |||
| нейтрон | нейтральная субатомная частица, обнаруженная в ядре атома | ||
| Джеймс Чедвик | открыватель нейтрона | ||
| заряд электрона | -1 | ||
| заряд протона | +1 | ||
| заряд нейтрона | 0 (без заряда) | ||
| относительная масса протона | 1 атомная единица массы | ||
| относительная масса электрона | 1/1836 атомная единица массы | ||
| символ электрона | e- | ||
| символ протона | p + | ||
| символ нейтрона | n | ||
| фактический масса протона | 1. -28 грамм -28 грамм | ||
| атомный номер | количество протонов в атоме элемента | ||
| массовое число | сумма протонов и нейтронов в ядре этого атома | ||
| количество нейтронов | Масса число минус атомный номер | ||
| изотопов | тот же атомный номер, но разные массовые числа из-за разного количества нейтронов | ||
| кислород-18 | 8 p +, 8 e-, 10 n | ||
| кислород-17 | 8 p +, 8 e-, 9 n | ||
| кислород-16 | 8 p +, 8 e-, 8 n | ||
| водород-1 (протий) | 1 p +, 1 e-, 0 n | ||
| водород-2 (дейтерий) | 1 p +, 1 e-, 1 n | ||
| водород-3 (тритий) | 1 p +, 1 e-, 2 n | ||
| модель атома Бора | электронов на энергетических уровнях вне ядра | ||
| электрон поднимается на более высокий уровень энергии | полученная энергия | ||
| электрон падает на более низкий уровень энергии | потеря энергии | ||
| Луи де Бройля | электроны действуют как частицы и волны | ||
| Эрвин Шредингер | уравнения, описывающие движение электронов | ||
| Электронное облако Модель атома | описывает возможное расположение электронов вокруг ядра | ||
| электронное облако | визуальная модель наиболее вероятного расположения электронов в атоме | ||
| орбитальная область | пространства вокруг ядра, где, вероятно, будет обнаружен электрон | ||
| количество орбиталей на уровне 1 | 1 | ||
| максимальное количество e- на уровне 1 | 2 | ||
| количество орбиталей на уровне 2 | 4 | ||
| количество орбит на уровне 3 | 9 | ||
| количество орбиталей на уровне 4 | 16 | ||
| максимальное количество электронных входов на уровне 2 | 8 | ||
| максимальное количество электронных входов на уровне 3 | 18 | ||
| максимальное количество электронных уровней 4 | 32 | ||
| электронная конфигурация | расположение электронов на орбиталях атома | ||
| стабильная электронная конфигурация | электроны находятся на орбиталях с минимально возможными энергиями | ||
| основное состояние | электрон с наименьшей возможной энергией | ||
| возбужденное состояние | электроны переходят на более высокий уровень энергии | ||
| Принцип неопределенности Гейзенберга | Положение и импульс электрона НЕ МОГУТ быть известны одновременно | ||
| Принцип квантового числа ( n) | описывает уровень энергии | ||
| Секунда Квантовое число (l) | описывает энергетические подуровни | ||
| Третье квантовое число (м) | описывает орбитали в подуровнях | ||
| Четвертое квантовое число | описывает спин электрона | ||
| Подуровни энергетического уровня 1 | с подуровень | ||
| Подуровни уровня энергии 2 | Подуровни s и p | ||
| Подуровни уровня энергии 3 | Подуровни s, p и d | ||
| Подуровни уровня энергии 4 | s, p, d, и f подуровни | ||
| Принцип Aufbau | электроны сначала заполняют орбитали с наименьшей энергией | ||
| Принцип исключения Паули | электронов на одной орбитали имеют разный спин | ||
| Правило Хунда | все орбитали на уровне должны иметь один e- перед e- удвоится | ||
| валентных электронов | электронов в элементах l занятый уровень энергии | ||
| электронная точечная диаграмма | представляет собой валентные электроны | ||
| конфигурация H | 1s1 | ||
| конфигурация He | 1s2 | ||
| конфигурация Li | 1s2 2s1 | ||
| конфигурация Be | 1s2 2s2 | ||
| конфигурация B | 1s2 2s2 2p1 | ||
| конфигурация C | 1s2 2s2 2p2 | ||
| конфигурация N | 1s2 2s2 | ||
| 1s2 2s2 2p4 | |||
| конфигурация F | 1s2 2s2 2p5 | ||
| конфигурация Ne | 1s2 2s2 2p6 | ||
| конфигурация Na | 1s2 2s2 2p6 3s1 | конфигурация Mg151s2 2s2 2p6 3s2 | |
| конфигурация o f Al | 1s2 2s2 2p6 3s2 3p1 | ||
| конфигурация Si | 1s2 2s2 2p6 3s2 3p2 | ||
| конфигурация P | 1s2 2s2 2p6 3s2 3p2 | конфигурация S S6 3p4 | |
| конфигурация Cl | 1s2 2s2 2p6 3s2 3p5 | ||
| конфигурация Ar | 1s2 2s2 2p6 3s2 3p6 | ||
| конфигурация K | 1s2 2s2 2p6 4s2 | Ca | 1s2 2s2 2p6 3s2 3p6 4s2 |
| Конфигурация Sc | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 | ||
| конфигурация Ti | 1s2 2s2 2p6 3s2 9009 | 9102 3d конфигурация 9102 1s2 2s2 2p6 3s2 3p6 4s2 3d3||
| конфигурация Cr | 1s2 2s2 2p6 3s2 3p6 4s1 3d5 | ||
| конфигурация Mn | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 | ||
| конфигурация Fe | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 | ||
| конфигурация Co | 1s2 2s2 2p6 3s2 | ||
| конфигурация Cu | 1s2 2s2 2p6 3s2 3p6 4s1 3d10 | ||
| конфигурация Zn | 1s2 2s2 2p6 3s2 3p6 4s102 | диагональ помогает определить энергетические подуровни
% PDF-1. 3
%
1 0 obj
> >>
endobj
6 0 obj
>
endobj
7 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1383 Tc
87.0009 647.2533 Td (Какой элемент имеет атомный номер 27?) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.2000 тс
64,4995 647,2533 тд (1) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0950 Тс
126.7512 626.2543 Td (медь) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.
3
%
1 0 obj
> >>
endobj
6 0 obj
>
endobj
7 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1383 Tc
87.0009 647.2533 Td (Какой элемент имеет атомный номер 27?) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.2000 тс
64,4995 647,2533 тд (1) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0950 Тс
126.7512 626.2543 Td (медь) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108. 0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1333 Тс
126,7512 614,2552 Td (кобальт) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1183 Тс
126,7512 602,2561 Td (углерод) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 590,2571 Td (алюминий) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1284 Тс
87,0009 570,0092 Td (изотопы \ (например, углерод-12 и углерод-13 \) имеют одинаковое количество: ____ но) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1428 Тс
87,0009 558,7592 Td (разное количество ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 554,2611 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 554.2611 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 546.7606 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 546.7606 37.
0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1333 Тс
126,7512 614,2552 Td (кобальт) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1183 Тс
126,7512 602,2561 Td (углерод) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 590,2571 Td (алюминий) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1284 Тс
87,0009 570,0092 Td (изотопы \ (например, углерод-12 и углерод-13 \) имеют одинаковое количество: ____ но) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1428 Тс
87,0009 558,7592 Td (разное количество ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 554,2611 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 554.2611 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 546.7606 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 546.7606 37. 4995 7.5005 р.
п
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 537.0111 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1176 Тс
126.7512 537.0111 Td (протоны электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 525.0120 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1476 Тс
126.7512 525.0120 Td (нейтроны, протоны) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 513.0130 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1476 Тс
126.7512 513.0130 Td (протоны, нейтроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 501.0139 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1076 Тс
126.7512 501.0139 Td (буквы в названии) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1548 Тс
87,0009 480.7661 Td (уран-235 имеет ______ нейтронов) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 477,0170 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.
4995 7.5005 р.
п
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 537.0111 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1176 Тс
126.7512 537.0111 Td (протоны электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 525.0120 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1476 Тс
126.7512 525.0120 Td (нейтроны, протоны) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 513.0130 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1476 Тс
126.7512 513.0130 Td (протоны, нейтроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 501.0139 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1076 Тс
126.7512 501.0139 Td (буквы в названии) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1548 Тс
87,0009 480.7661 Td (уран-235 имеет ______ нейтронов) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 477,0170 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83. 9991 477.0170 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 469.5165 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 469.5165 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 480,7661 тд (3) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 459.7670 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 459,7670 тд (235) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108,0000 447,7680 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 447,7680 тд (92) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 435.7689 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 435,7689 тд (143) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 423.7698 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1700 тс
126,7512 423,7698 тд (238,03) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0830 тс
87,0009 403,5220 Td (Три первичных субатомных частицы 🙂 Tj
ET
q
0.
9991 477.0170 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 469.5165 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 469.5165 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 480,7661 тд (3) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 459.7670 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 459,7670 тд (235) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108,0000 447,7680 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 447,7680 тд (92) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 435.7689 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 435,7689 тд (143) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 423.7698 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1700 тс
126,7512 423,7698 тд (238,03) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0830 тс
87,0009 403,5220 Td (Три первичных субатомных частицы 🙂 Tj
ET
q
0. 7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 403,5220 тд (4) тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1229 Тс
126,7512 382,5229 Td (атомы, ионы и изотопы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1523 Тс
126,7512 370,5239 Td (протоны, нейтроны и нуклоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 358.5248 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1125 Тс
126,7512 358,5248 Td (электроны, ионы и изотопы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1332 Тс
126,7512 346,5257 Td (протоны, нейтроны и электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1416 Тс
87,0009 326,2779 Td (Какая субатомная частица занимает большую часть пространства атома?) Tj
ET
q
0.
7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 403,5220 тд (4) тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1229 Тс
126,7512 382,5229 Td (атомы, ионы и изотопы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1523 Тс
126,7512 370,5239 Td (протоны, нейтроны и нуклоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 358.5248 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1125 Тс
126,7512 358,5248 Td (электроны, ионы и изотопы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1332 Тс
126,7512 346,5257 Td (протоны, нейтроны и электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1416 Тс
87,0009 326,2779 Td (Какая субатомная частица занимает большую часть пространства атома?) Tj
ET
q
0. 7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (5) тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1867 Тс
126,7512 305,2788 Td (протон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1900 Тс
126,7512 293,2798 Td (нейтрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1050 Тс
126,7512 281,2807 Td (электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1056 Тс
87.
7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (5) тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1867 Тс
126,7512 305,2788 Td (протон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1900 Тс
126,7512 293,2798 Td (нейтрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1050 Тс
126,7512 281,2807 Td (электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1056 Тс
87. 0009 249.0338 Td (Какая субатомная частица \ (s \) имеет массу 1 а.е.м.) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 245,2847 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 245,2847 367,5005 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 237.7843 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 237.7843 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (6) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 228.0347 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1463 Тс
126.7512 228.0347 Td (протон и электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 216.0357 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1495 Тс
126,7512 216,0357 Td (нейтрон и электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 204.0366 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1050 Тс
126,7512 204,0366 Td (электрон) Tj
ET
BT
0,0000 0,0000 0.
0009 249.0338 Td (Какая субатомная частица \ (s \) имеет массу 1 а.е.м.) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 245,2847 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 245,2847 367,5005 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 237.7843 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 237.7843 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (6) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 228.0347 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1463 Тс
126.7512 228.0347 Td (протон и электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 216.0357 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1495 Тс
126,7512 216,0357 Td (нейтрон и электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 204.0366 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1050 Тс
126,7512 204,0366 Td (электрон) Tj
ET
BT
0,0000 0,0000 0. 0000 рг
/ F0 10 Тс
-0,7800 тс
108.0000 192.0376 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1595 Тс
126,7512 192,0376 Td (протоны и нейтроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1013 Тс
87,0009 171,7897 Td (Атомная единица массы \ (а.е.м. \) равна) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 168,0406 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 168.0406 367.5005 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 160.5402 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 160.5402 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 171,7897 тд (7) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 150.7906 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1090 Тс
126,7512 150,7906 Td (очень маленький) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 138.7916 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1090 Тс
126,7512 138,7916 Td (очень большой) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.
0000 рг
/ F0 10 Тс
-0,7800 тс
108.0000 192.0376 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1595 Тс
126,7512 192,0376 Td (протоны и нейтроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1013 Тс
87,0009 171,7897 Td (Атомная единица массы \ (а.е.м. \) равна) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 168,0406 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 168.0406 367.5005 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 160.5402 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 160.5402 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 171,7897 тд (7) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 150.7906 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1090 Тс
126,7512 150,7906 Td (очень маленький) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 138.7916 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1090 Тс
126,7512 138,7916 Td (очень большой) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108. 0000 126.7925 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
126,7512 126,7925 Td (масса на один атом углерода) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 114.7935 тд (Д) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
8 0 объект
8584
endobj
11 0 объект
>
endobj
12 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1274 Тс
87.0009 647.2533 Td (Элемент железо \ (Fe \) — это любой изотоп, имеющий ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.
0000 126.7925 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
126,7512 126,7925 Td (масса на один атом углерода) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 114.7935 тд (Д) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
8 0 объект
8584
endobj
11 0 объект
>
endobj
12 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1274 Тс
87.0009 647.2533 Td (Элемент железо \ (Fe \) — это любой изотоп, имеющий ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72. 0000 636.0038 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (8) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1645 Тс
126,7512 626,2543 Td (26 нейтронов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126.7512 614.2552 Td (26 протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0911 Тс
126,7512 602,2561 Td (масса 55,9 а.е.м.) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
-0,1488 Тс
126,7512 590,2571 Td (нейтронов больше, чем протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1392 Тс
87,0009 570,0092 Td (Атом брома имеет ___ протонов и ___ электронов) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.
0000 636.0038 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (8) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1645 Тс
126,7512 626,2543 Td (26 нейтронов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126.7512 614.2552 Td (26 протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0911 Тс
126,7512 602,2561 Td (масса 55,9 а.е.м.) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0.0000 рг
/ F0 10 Тс
-0,1488 Тс
126,7512 590,2571 Td (нейтронов больше, чем протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1392 Тс
87,0009 570,0092 Td (Атом брома имеет ___ протонов и ___ электронов) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83. 9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (9) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 549.0102 Td (35, 45) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 537.0111 Td (80, 35) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 525.0120 Td (45, 35) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1640 тс
126,7512 513,0130 тд (35,35) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1208 Тс
87,0009 492,7651 Td (Таблица Менделеева разделена на 2 основных типа атомов; металлы и неметаллы.
9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (9) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 549.0102 Td (35, 45) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 537.0111 Td (80, 35) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1567 Тс
126.7512 525.0120 Td (45, 35) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1640 тс
126,7512 513,0130 тд (35,35) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1208 Тс
87,0009 492,7651 Td (Таблица Менделеева разделена на 2 основных типа атомов; металлы и неметаллы. Из них) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0900 тс
87.0009 481.5151 Td (больше ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 477,0170 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 477.0170 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 469.5165 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 469.5165 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 492,7651 тд (10) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 459.7670 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0783 Тс
126.7512 459.7670 Td (металлы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108,0000 447,7680 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1160 Тс
126,7512 447,7680 Td (неметаллы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 435.7689 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1048 Тс
126.7512 435.7689 Td (их количество равное) Tj
ET
BT
0,0000 0,0000 0.
Из них) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0900 тс
87.0009 481.5151 Td (больше ____) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 477,0170 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 477.0170 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 469.5165 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 469.5165 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 492,7651 тд (10) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 459.7670 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0783 Тс
126.7512 459.7670 Td (металлы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108,0000 447,7680 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1160 Тс
126,7512 447,7680 Td (неметаллы) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 435.7689 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1048 Тс
126.7512 435.7689 Td (их количество равное) Tj
ET
BT
0,0000 0,0000 0. 0000 рг
/ F0 10 Тс
-0,7800 тс
108.0000 423.7698 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1300 Тс
126,7512 423,7698 Td (в настоящее время неметаллы, но мы продолжаем производить больше неметаллов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1412 Тс
87,0009 403,5220 Td (углерод-12 и углерод-13 имеют одинаковое количество) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 403,5220 тд (11) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,0889 Тс
126,7512 382,5229 Td (электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1543 Тс
126,7512 370,5239 Td (протоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.
0000 рг
/ F0 10 Тс
-0,7800 тс
108.0000 423.7698 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1300 Тс
126,7512 423,7698 Td (в настоящее время неметаллы, но мы продолжаем производить больше неметаллов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1412 Тс
87,0009 403,5220 Td (углерод-12 и углерод-13 имеют одинаковое количество) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 403,5220 тд (11) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,0889 Тс
126,7512 382,5229 Td (электроны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1543 Тс
126,7512 370,5239 Td (протоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108. 0000 358.5248 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 358,5248 Td (нейтроны) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1550 Тс
126,7512 346,5257 Td (нуклоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1782 Тс
87.0009 326.2779 Td (Неон-21 имел бы ___) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (12) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 305,2788 Td (21 протон) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.
0000 358.5248 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 358,5248 Td (нейтроны) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1550 Тс
126,7512 346,5257 Td (нуклоны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1782 Тс
87.0009 326.2779 Td (Неон-21 имел бы ___) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (12) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 305,2788 Td (21 протон) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108. 0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 293,2798 Td (11 протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1645 Тс
126,7512 281,2807 Td (11 нейтронов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1100 Тс
126,7512 269,2817 Td (21 электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1208 Тс
87.0009 249.0338 Td (Какая из орбиталей не «настоящая») Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 245,2847 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 245.2847 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 237.7843 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 237.7843 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (13) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.
0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 293,2798 Td (11 протонов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1645 Тс
126,7512 281,2807 Td (11 нейтронов) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1100 Тс
126,7512 269,2817 Td (21 электрон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1208 Тс
87.0009 249.0338 Td (Какая из орбиталей не «настоящая») Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 245,2847 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 245.2847 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 237.7843 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 237.7843 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (13) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108. 0000 228.0347 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0800 тс
126,7512 228,0347 Тд (1с) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 216.0357 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126.7512 216.0357 Td (3d) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 204.0366 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0800 тс
126.7512 204.0366 Td (2s) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 192.0376 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1900 Тс
126.7512 192.0376 Td (3f) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 171.7897 Td (определить элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
87,0009 160,5397 Td (1s2 2s2 3p4) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 156,0416 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 156.0416 367.5005 0.0000 реб.
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
72.
0000 228.0347 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0800 тс
126,7512 228,0347 Тд (1с) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 216.0357 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126.7512 216.0357 Td (3d) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 204.0366 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0800 тс
126.7512 204.0366 Td (2s) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 192.0376 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1900 Тс
126.7512 192.0376 Td (3f) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 171.7897 Td (определить элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
87,0009 160,5397 Td (1s2 2s2 3p4) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 156,0416 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 156.0416 367.5005 0.0000 реб.
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
72.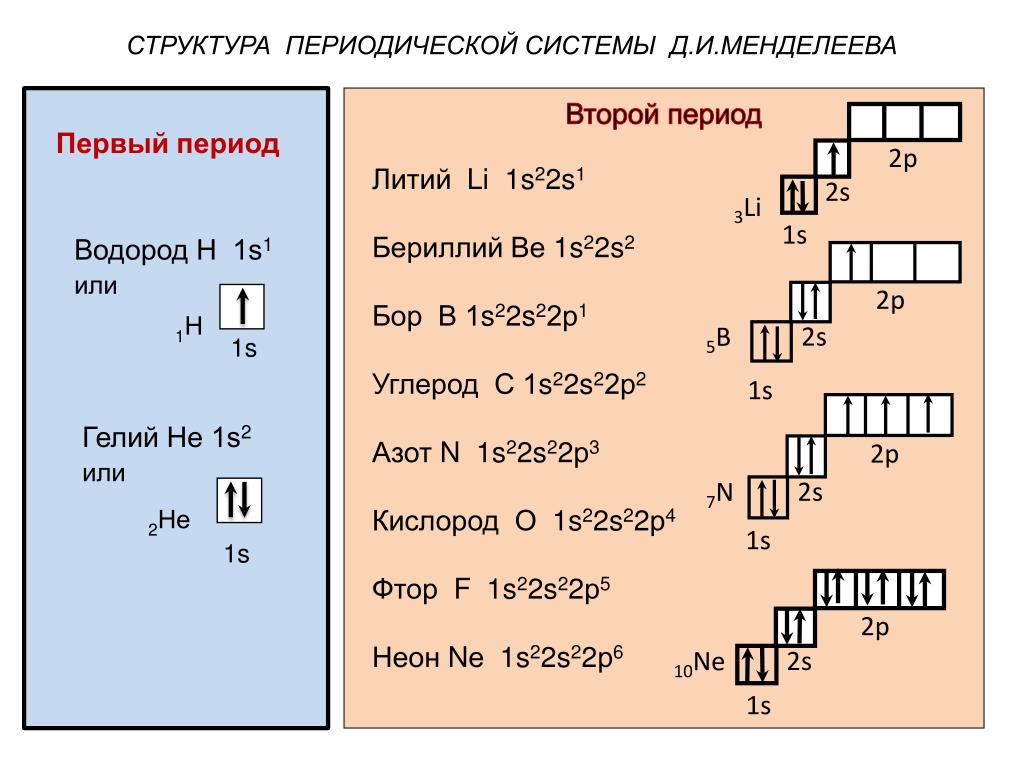 0000 148.5411 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 148.5411 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 171,7897 тд (14) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 138.7916 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1400 Тс
126,7512 138,7916 Td (Os) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 126.7925 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,3200 тс
126,7512 126,7925 Td (O) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 114.7935 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126,7512 114,7935 Td (Mg) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 102,7944 Тд (Д) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,2100 Тс
126,7512 102,7944 Td (Se) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
13 0 объект
8768
endobj
14 0 объект
>
endobj
15 0 объект
>
транслировать
q
0 Вт 1.
0000 148.5411 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 148.5411 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 171,7897 тд (14) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 138.7916 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1400 Тс
126,7512 138,7916 Td (Os) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 126.7925 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,3200 тс
126,7512 126,7925 Td (O) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 114.7935 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126,7512 114,7935 Td (Mg) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 102,7944 Тд (Д) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,2100 Тс
126,7512 102,7944 Td (Se) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
13 0 объект
8768
endobj
14 0 объект
>
endobj
15 0 объект
>
транслировать
q
0 Вт 1.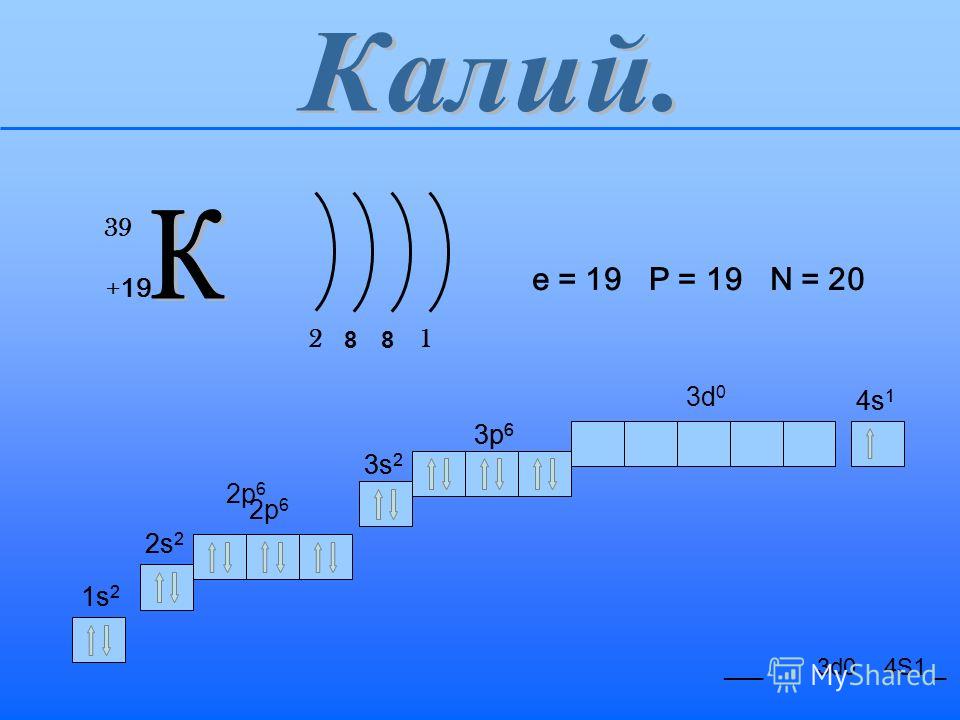 0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 3) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 647.2533 Td (определите элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1742 Тс
87.0009 636.0033 Td ([Ne] 3s2 3p3) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 631,5052 138,7502 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 631.5052 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 624.0047 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 624.0047 37.4995 7.5005 пере
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (15) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 614.2552 Тд (А) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2925 Тс
126.
0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 3) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 647.2533 Td (определите элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1742 Тс
87.0009 636.0033 Td ([Ne] 3s2 3p3) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 631,5052 138,7502 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 631.5052 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 624.0047 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 624.0047 37.4995 7.5005 пере
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (15) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 614.2552 Тд (А) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2925 Тс
126. 7512 614.2552 Td (Неон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 602.2561 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1378 Тс
126.7512 602.2561 Td (магний) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108,0000 590,2571 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 590,2571 Td (алюминий) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 578.2580 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 578,2580 Td (фосфор) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 558.0102 Td (определить элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1688 Тс
87,0009 546,7602 Td ([Kr] 5s2 4d10 5p1) Tj
ET
q
0,7500 Вт 0,0000 0.0000 0,0000 RG
87,0009 542,2620 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 542.2620 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 534.7616 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.
7512 614.2552 Td (Неон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 602.2561 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1378 Тс
126.7512 602.2561 Td (магний) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108,0000 590,2571 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126,7512 590,2571 Td (алюминий) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 578.2580 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1600 Тс
126,7512 578,2580 Td (фосфор) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1377 Тс
87.0009 558.0102 Td (определить элемент по его электронной конфигурации 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1688 Тс
87,0009 546,7602 Td ([Kr] 5s2 4d10 5p1) Tj
ET
q
0,7500 Вт 0,0000 0.0000 0,0000 RG
87,0009 542,2620 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 542.2620 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 534.7616 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83. 2507 534.7616 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 558,0102 тд (16) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 525.0120 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126.7512 525.0120 Td (Kr) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 513.0130 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,5250 Тс
126.7512 513.0130 Td (In) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 501.0139 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.3300 тс
126.7512 501.0139 Td (Ga) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 489.0149 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0700 Тс
126,7512 489,0149 Td (Ti) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1412 Тс
87,0009 468,7670 Td (Никель имеет электронную конфигурацию в основном состоянии 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 465,0180 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83.
2507 534.7616 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 558,0102 тд (16) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 525.0120 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2350 Тс
126.7512 525.0120 Td (Kr) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 513.0130 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,5250 Тс
126.7512 513.0130 Td (In) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 501.0139 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.3300 тс
126.7512 501.0139 Td (Ga) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 489.0149 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0700 Тс
126,7512 489,0149 Td (Ti) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1412 Тс
87,0009 468,7670 Td (Никель имеет электронную конфигурацию в основном состоянии 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 465,0180 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83. 9991 465.0180 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 457.5175 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 457.5175 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 468,7670 тд (17) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 447.7680 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1608 Тс
126,7512 447,7680 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d8) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 435.7689 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126.7512 435.7689 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 423.7698 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1470 тс
126.7512 423.7698 Td (1s2 2s2 2p6 3s2 3p6 4s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 411.7708 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1544 Тс
126.7512 411.7708 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d8) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1325 Тс
87,0009 391,5229 Td (электронная конфигурация в основном состоянии из натрия 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87.
9991 465.0180 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 457.5175 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 457.5175 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 468,7670 тд (17) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 447.7680 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1608 Тс
126,7512 447,7680 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d8) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 435.7689 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1612 Тс
126.7512 435.7689 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 423.7698 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1470 тс
126.7512 423.7698 Td (1s2 2s2 2p6 3s2 3p6 4s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 411.7708 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1544 Тс
126.7512 411.7708 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d8) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1325 Тс
87,0009 391,5229 Td (электронная конфигурация в основном состоянии из натрия 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87. 0009 387.7739 138.7502 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 387.7739 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 380.2734 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 380.2734 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 391,5229 тд (18) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 370,5239 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126,7512 370,5239 Td (1s2 2s2 2p5 3s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 358.5248 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 358.5248 Td (1s2 2s2 2p4 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 346.5257 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1482 тс
126.7512 346.5257 Td (1s2 2s2 2p6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 334,5267 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126,7512 334,5267 Td (1s2 2s2 2p6 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1518 Тс
87,0009 314,2788 Td (Электронная конфигурация возбужденного атома неона могла бы быть) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 310.
0009 387.7739 138.7502 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 387.7739 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 380.2734 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 380.2734 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 391,5229 тд (18) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 370,5239 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126,7512 370,5239 Td (1s2 2s2 2p5 3s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 358.5248 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 358.5248 Td (1s2 2s2 2p4 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 346.5257 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1482 тс
126.7512 346.5257 Td (1s2 2s2 2p6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 334,5267 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126,7512 334,5267 Td (1s2 2s2 2p6 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1518 Тс
87,0009 314,2788 Td (Электронная конфигурация возбужденного атома неона могла бы быть) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 310. 5298 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 310.5298 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 303.0293 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 303.0293 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 314,2788 тд (19) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 293.2798 тд (А) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 293.2798 Td (1s2 2s2 2p6 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 281.2807 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 281.2807 Td (1s2 2s2 2p5 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 269.2817 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1407 Тс
126,7512 269,2817 Td (1s2 2s2 2p6 3s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 257.2826 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
126,7512 257,2826 Тд (1с2 2с2 2п6) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1554 Тс
87,0009 237,0347 Td (ион кальция \ (Ca + 2 \) имел бы следующую электронную конфигурацию) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87.
5298 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 310.5298 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 303.0293 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 303.0293 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 314,2788 тд (19) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 293.2798 тд (А) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 293.2798 Td (1s2 2s2 2p6 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 281.2807 Тд (В) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1407 Тс
126.7512 281.2807 Td (1s2 2s2 2p5 3s1) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 269.2817 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1407 Тс
126,7512 269,2817 Td (1s2 2s2 2p6 3s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 257.2826 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
126,7512 257,2826 Тд (1с2 2с2 2п6) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1554 Тс
87,0009 237,0347 Td (ион кальция \ (Ca + 2 \) имел бы следующую электронную конфигурацию) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87. 0009 233,2857 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 233.2857 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 225.7852 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 225.7852 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 237,0347 тд (20) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 216.0357 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1544 Тс
126.7512 216.0357 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 204.0366 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1470 тс
126.7512 204.0366 Td (1s2 2s2 2p6 3s2 3p6 4s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 192.0376 Td (C) Tj
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1526 Тс
126.7512 192.0376 Td (1s2 2s2 2p6 3s2 3p6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 180.0385 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
126.
0009 233,2857 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 233.2857 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 225.7852 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 225.7852 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 237,0347 тд (20) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 216.0357 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1544 Тс
126.7512 216.0357 Td (1s2 2s2 2p6 3s2 3p6 4s2 3d2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 204.0366 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1470 тс
126.7512 204.0366 Td (1s2 2s2 2p6 3s2 3p6 4s2) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 192.0376 Td (C) Tj
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1526 Тс
126.7512 192.0376 Td (1s2 2s2 2p6 3s2 3p6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 180.0385 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1482 Тс
126. 7512 180.0385 Тд (1с2 2с2 2п6) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1405 Тс
87,0009 159,7906 Td (Длина волны \ (l \) ЭМ волны частоты) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1653 Tc
87,0009 148,5406 Td (n = 3,0 x 10-3 1 / с) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 144,0425 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 144.0425 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 136.5420 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 136.5420 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.2000 тс
64,4995 159,7906 тд (21) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 126.7925 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 126,7925 Td (1,0 x 108 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 114.7935 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1808 Тс
126,7512 114,7935 Td (1,0 x 1011 м) Tj
ET
BT
0,0000 0.
7512 180.0385 Тд (1с2 2с2 2п6) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1405 Тс
87,0009 159,7906 Td (Длина волны \ (l \) ЭМ волны частоты) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1653 Tc
87,0009 148,5406 Td (n = 3,0 x 10-3 1 / с) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 144,0425 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 144.0425 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 136.5420 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 136.5420 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.2000 тс
64,4995 159,7906 тд (21) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 126.7925 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 126,7925 Td (1,0 x 108 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 114.7935 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1808 Тс
126,7512 114,7935 Td (1,0 x 1011 м) Tj
ET
BT
0,0000 0..PNG) 0000 0,0000 рг
/ F0 10 Тс
108,0000 102,7944 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 102,7944 Td (1,0 x 105 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 90.7954 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 90,7954 Td (3,0 x 108 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
16 0 объект
9010
endobj
17 0 объект
>
endobj
18 0 объект
>
транслировать
q
0 Вт 1.0000 1,0000 1,0000 пг
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Стр. 4) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1528 Тс
87.0009 647.2533 Td (ЭМ волна с длиной волны 200 нм \ (200 x 10-9 м \) будет в …) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0.0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.
0000 0,0000 рг
/ F0 10 Тс
108,0000 102,7944 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 102,7944 Td (1,0 x 105 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 90.7954 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1791 Тс
126,7512 90,7954 Td (3,0 x 108 м) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
16 0 объект
9010
endobj
17 0 объект
>
endobj
18 0 объект
>
транслировать
q
0 Вт 1.0000 1,0000 1,0000 пг
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Стр. 4) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1528 Тс
87.0009 647.2533 Td (ЭМ волна с длиной волны 200 нм \ (200 x 10-9 м \) будет в …) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0.0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83. 9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (22) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1305 Тс
126,7512 626,2543 Td (диапазон видимого света) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1020 Тс
126,7512 614,2552 Td (диапазон гамма-излучения) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1389 Тс
126.7512 602.2561 Td (Ультрафиолетовый диапазон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0787 Тс
126,7512 590,2571 Td (инфракрасный диапазон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1534 Тс
87,0009 570,0092 Td (Длину волны 450 нм большинство людей назовет _______) Tj
ET
q
0,7500 Вт 0.
9991 643.5043 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (22) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1305 Тс
126,7512 626,2543 Td (диапазон видимого света) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1020 Тс
126,7512 614,2552 Td (диапазон гамма-излучения) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1389 Тс
126.7512 602.2561 Td (Ультрафиолетовый диапазон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0787 Тс
126,7512 590,2571 Td (инфракрасный диапазон) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1534 Тс
87,0009 570,0092 Td (Длину волны 450 нм большинство людей назовет _______) Tj
ET
q
0,7500 Вт 0. 0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (23) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0625 тс
126.7512 549.0102 Td (красный) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0920 тс
126.7512 537.0111 Td (зеленый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1767 Tc
126.7512 525.0120 Td (фиолетовый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1289 Тс
126.
0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.4995 570.0092 Td (23) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0.0100 тк
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0625 тс
126.7512 549.0102 Td (красный) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0920 тс
126.7512 537.0111 Td (зеленый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.1767 Tc
126.7512 525.0120 Td (фиолетовый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1289 Тс
126. 7512 513.0130 Td (невидимый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0894 Тс
87,0009 492,7651 Td (Микроволны — это ______ радиоволны) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 489,0161 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 489.0161 367.5005 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 481.5156 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 481.5156 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 492,7651 тд (24) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 471.7661 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1582 Тс
126,7512 471,7661 Td (длиннее) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 459.7670 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1325 Тс
126,7512 459,7670 Td (короче) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 447.7680 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1129 Тс
126,7512 447,7680 Td (такая же длина, как) Tj
ET
BT
0.
7512 513.0130 Td (невидимый) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0894 Тс
87,0009 492,7651 Td (Микроволны — это ______ радиоволны) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 489,0161 138,7502 0,0000 рэ
п
Q
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 489.0161 367.5005 0.0000 re
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 481.5156 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 481.5156 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 492,7651 тд (24) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 471.7661 Тд (А) Тдж
ET
BT
0,0000 0.0000 0,0000 рг
/ F0 10 Тс
-0,1582 Тс
126,7512 471,7661 Td (длиннее) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 459.7670 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1325 Тс
126,7512 459,7670 Td (короче) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 447.7680 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1129 Тс
126,7512 447,7680 Td (такая же длина, как) Tj
ET
BT
0. 0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 435.7689 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1241 Тс
126.7512 435.7689 Td (длиннее и мощнее) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1262 Тс
87.0009 415.5210 Td (Какая радиостанция будет иметь более короткую длину волны? 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1930 тс
87.0009 404.2710 Td (WCCO \ (830 кГц \), KSTP \ (1500 кГц \), KDWB \ (101.3 МГц \)) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 415,5210 тд (25) тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0825 Тс
126,7512 382,5229 Td (WCCO) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.
0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 435.7689 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1241 Тс
126.7512 435.7689 Td (длиннее и мощнее) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1262 Тс
87.0009 415.5210 Td (Какая радиостанция будет иметь более короткую длину волны? 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1930 тс
87.0009 404.2710 Td (WCCO \ (830 кГц \), KSTP \ (1500 кГц \), KDWB \ (101.3 МГц \)) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 399,7729 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 399.7729 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 392.2724 144.0000 7.5005 об.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 392.2724 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 415,5210 тд (25) тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 382.5229 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0825 Тс
126,7512 382,5229 Td (WCCO) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108. 0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0700 тс
126.7512 370.5239 Td (KSTP) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 358.5248 Td (C) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,5125 Тс
126.7512 358.5248 Td (KDWB) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1354 Тс
126,7512 346,5257 Td (все имеют одинаковую длину волны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1565 Тс
87,0009 326,2779 Td (Что такое энергия одиночного фотона с частотой 2,0 x 1015 1 / с) Tj
ET
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (26) тдж
ET
BT
0,0000 0,0000 0.
0000 370.5239 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0700 тс
126.7512 370.5239 Td (KSTP) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 358.5248 Td (C) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,5125 Тс
126.7512 358.5248 Td (KDWB) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108,0000 346,5257 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1354 Тс
126,7512 346,5257 Td (все имеют одинаковую длину волны) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1565 Тс
87,0009 326,2779 Td (Что такое энергия одиночного фотона с частотой 2,0 x 1015 1 / с) Tj
ET
q
0.7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 322,5288 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 322.5288 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 315.0283 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 315.0283 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 326,2779 тд (26) тдж
ET
BT
0,0000 0,0000 0. 0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1250 Тс
126,7512 305,2788 Td (6,63 x 10-34 Дж с) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1071 Тс
126,7512 293,2798 Тд (13,26 Дж) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1925 тс
126,7512 281,2807 Td (13,26 x 1019) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1685 Тс
126,7512 269,2817 Td (1,326 x 10-18) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1189 Тс
87,0009 249,0338 Td (если новый элемент имеет два изотопа X-350 и X-370 и относительное содержание каждого из них равно) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1545 Тс
87,0009 237,7838 Td (65% и 35%. Какова средняя масса?) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 233,2857 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.
0000 рг
/ F0 10 Тс
0,0100 Тс
108.0000 305.2788 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1250 Тс
126,7512 305,2788 Td (6,63 x 10-34 Дж с) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 293.2798 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1071 Тс
126,7512 293,2798 Тд (13,26 Дж) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 281.2807 Тд (К) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1925 тс
126,7512 281,2807 Td (13,26 x 1019) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 269.2817 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1685 Тс
126,7512 269,2817 Td (1,326 x 10-18) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1189 Тс
87,0009 249,0338 Td (если новый элемент имеет два изотопа X-350 и X-370 и относительное содержание каждого из них равно) Tj
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1545 Тс
87,0009 237,7838 Td (65% и 35%. Какова средняя масса?) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 233,2857 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83. 9991 233.2857 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 225.7852 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 225.7852 37.4995 7.5005 р.
п
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (27) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 216.0357 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 216,0357 тд (360) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 204.0366 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 204,0366 тд (357) тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 192.0376 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 192,0376 тд (353) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 180.0385 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 180,0385 тд (354) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,3600 Тс
108.0000 168.0394 Td (E) Tj
ET
BT
0.
9991 233.2857 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 225.7852 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 225.7852 37.4995 7.5005 р.
п
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 249,0338 тд (27) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 216.0357 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 216,0357 тд (360) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 204.0366 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 204,0366 тд (357) тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 192.0376 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 192,0376 тд (353) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 180.0385 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 180,0385 тд (354) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,3600 Тс
108.0000 168.0394 Td (E) Tj
ET
BT
0. 0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 168,0394 тд (50) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1262 Тс
87,0009 147,7916 Td (следующие примеры являются хорошей практикой, но представляют собой более подробный обзор других концепций) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 144,0425 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 144.0425 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 136.5420 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 136.5420 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 147,7916 тд (28) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 126.7925 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 114.7935 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 102,7944 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 90.7954 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.
0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
126,7512 168,0394 тд (50) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1262 Тс
87,0009 147,7916 Td (следующие примеры являются хорошей практикой, но представляют собой более подробный обзор других концепций) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 144,0425 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 144.0425 367.5005 0.0000 реб.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 136.5420 144.0000 7.5005 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 136.5420 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 147,7916 тд (28) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 126.7925 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 114.7935 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 102,7944 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,7800 тс
108.0000 90.7954 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54. 0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
19 0 объект
8728
endobj
20 0 объект
>
endobj
21 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 5) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1176 Тс
87.0009 647.2533 Td (один моль атомов гелия имел бы массу 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643,5043 367,5005 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (29) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126.
0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
19 0 объект
8728
endobj
20 0 объект
>
endobj
21 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (Страница 5) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1176 Тс
87.0009 647.2533 Td (один моль атомов гелия имел бы массу 🙂 Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 643,5043 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 643,5043 367,5005 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 636.0038 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 636.0038 37.4995 7.5005 re
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64,4995 647,2533 тд (29) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 626.2543 Td (A) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126.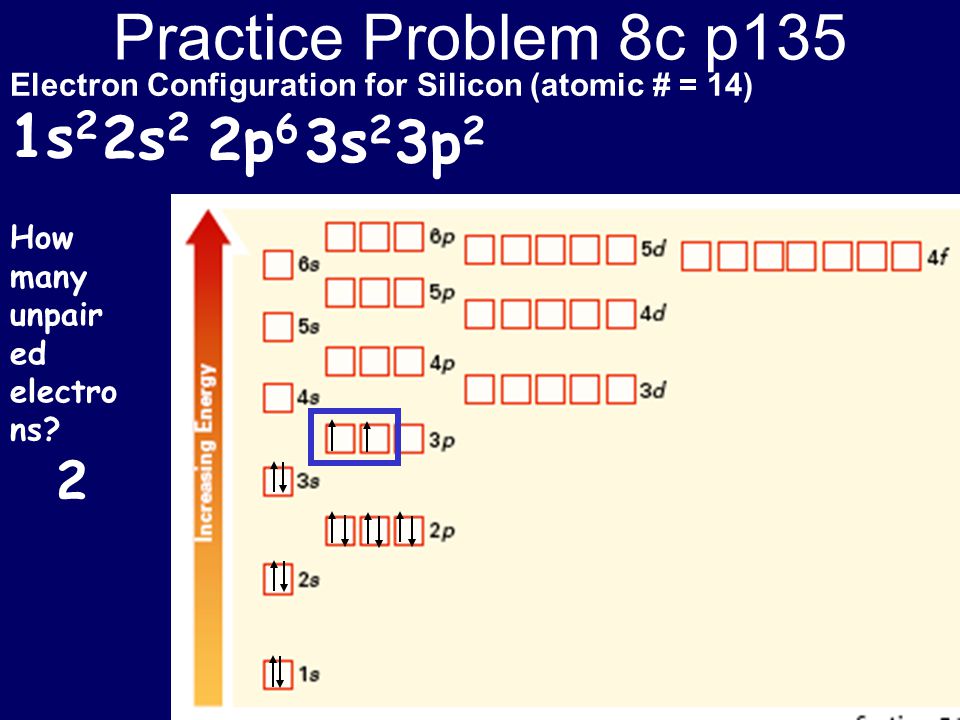 7512 626,2543 Td (2 грамма) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126,7512 614,2552 Td (4 грамма) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126,7512 602,2561 Td (6 грамм) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1435 Тс
126,7512 590,2571 Td (6,02 x 1023 г) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1260 Тс
87,0009 570,0092 Td (Формула бутана — C4h20; 5 моль газообразного бутана в S.T.P заняли бы …) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64.
7512 626,2543 Td (2 грамма) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 614.2552 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126,7512 614,2552 Td (4 грамма) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 602.2561 Тд (К) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126,7512 602,2561 Td (6 грамм) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.7800 тс
108,0000 590,2571 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1435 Тс
126,7512 590,2571 Td (6,02 x 1023 г) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,1260 Тс
87,0009 570,0092 Td (Формула бутана — C4h20; 5 моль газообразного бутана в S.T.P заняли бы …) Tj
ET
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
87,0009 566,2602 138,7502 0,0000 рэ
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.9991 566.2602 367.5005 0.0000 р.
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
72.0000 558.7597 144.0000 7.5005 пере
п
Q
q
0,7500 Вт 0,0000 0,0000 0,0000 RG
83.2507 558.7597 37.4995 7.5005 р.
п
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,2000 тс
64. 4995 570.0092 Td (30) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126.7512 549.0102 Td (5 грамм) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0940 Тс
126.7512 537.0111 Td (112 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0822 Тс
126.7512 525.0120 Td (58 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0822 Тс
126.7512 513.0130 Td (29 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
22 0 объект
2714
endobj
23 0 объект
>
endobj
24 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54.
4995 570.0092 Td (30) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
0,0100 Тс
108.0000 549.0102 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0757 Тс
126.7512 549.0102 Td (5 грамм) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,6400 тс
108.0000 537.0111 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0940 Тс
126.7512 537.0111 Td (112 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
108.0000 525.0120 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0822 Тс
126.7512 525.0120 Td (58 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0.7800 тс
108.0000 513.0130 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 10 Тс
-0,0822 Тс
126.7512 513.0130 Td (29 литров) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
22 0 объект
2714
endobj
23 0 объект
>
endobj
24 0 объект
>
транслировать
q
0 Вт 1.0000 1.0000 1.0000 rg
0.0000 0.0000 612.0000 792.0028 re
ж
Q
BT
0.0000 0,0000 0,0000 мкг
/ F0 12 Тс
0,0946 Тс
54. 0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (стр. 6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 14 Тс
0,0873 Тс
54.0000 649.5026 Td (ключ ответа 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F2 10 Тс
-0,2256 Тс
60.0009 600.0026 Td (Вопрос 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F2 10 Тс
-0,0050 тс
258.0009 599.2514 Td (Ответ) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,0000 0,0000 0,0000 RG
54,0000 591,7521 м
558.0000 591.7521 л
s
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 14 Тс
0,0368 Тс
144.0000 649.5026 Td (Введение в основы Atom) Tj
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 582.0009 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 585,0005 Тд (В) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 585,2981 Td (1) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 570.7474 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 573,7469 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 574,0446 Тд (2) Тдж
ET
q
[] 0 дн.
0000 707.2521 Td (Введение в основы Atom) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 12 Тс
-0,0200 тс
478.5009 706.5038 Td (стр. 6) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 14 Тс
0,0873 Тс
54.0000 649.5026 Td (ключ ответа 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F2 10 Тс
-0,2256 Тс
60.0009 600.0026 Td (Вопрос 🙂 Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F2 10 Тс
-0,0050 тс
258.0009 599.2514 Td (Ответ) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,0000 0,0000 0,0000 RG
54,0000 591,7521 м
558.0000 591.7521 л
s
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 14 Тс
0,0368 Тс
144.0000 649.5026 Td (Введение в основы Atom) Tj
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 582.0009 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 585,0005 Тд (В) Тдж
ET
BT
0.0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 585,2981 Td (1) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 570.7474 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 573,7469 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 574,0446 Тд (2) Тдж
ET
q
[] 0 дн.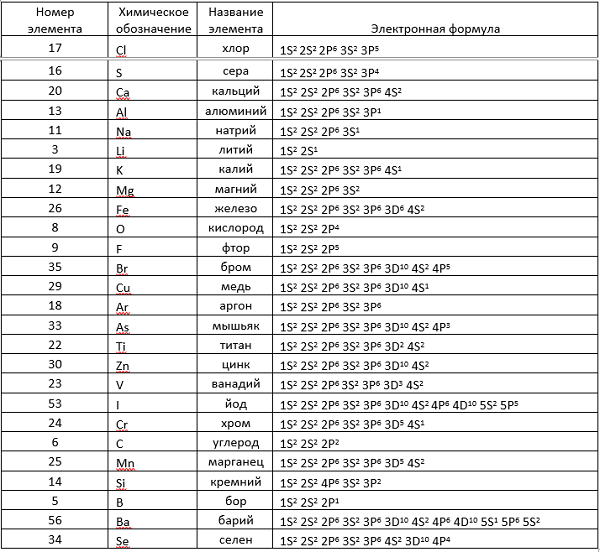 0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 559.4939 504.0000 11.2507 рэ
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 562,4934 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 562,7910 Тд (3) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 548.2403 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 551.2398 тд (д) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 551,5375 Тд (4) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 536.9868 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 539,9863 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 540,2839 тд (5) тдж
ET
q
[] 0 дн.
0,7500 Вт 0.7529 0,8627 0,7529 RG
54.0000 525.7332 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 528,7328 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 529,0304 Тд (6) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 559.4939 504.0000 11.2507 рэ
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 562,4934 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 562,7910 Тд (3) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 548.2403 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 551.2398 тд (д) тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 551,5375 Тд (4) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 536.9868 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 539,9863 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 540,2839 тд (5) тдж
ET
q
[] 0 дн.
0,7500 Вт 0.7529 0,8627 0,7529 RG
54.0000 525.7332 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 528,7328 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 529,0304 Тд (6) Тдж
ET
q
[] 0 дн. 0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 514.4797 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0.6090 тс
263,9991 517,4792 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 517,7769 тд (7) тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 503.2261 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 506.2257 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 506,5233 Тд (8) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 491.9726 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 494,9721 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 495,2698 Тд (9) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 480.7191 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 514.4797 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0.6090 тс
263,9991 517,4792 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 517,7769 тд (7) тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 503.2261 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 506.2257 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 506,5233 Тд (8) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 491.9726 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 494,9721 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 495,2698 Тд (9) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 480.7191 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0. 6090 тс
263,9991 483,7186 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 484,0162 Тд (10) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 469.4655 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 472.4650 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 472,7627 Тд (11) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 458.2120 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263.9991 461.2115 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 461.5091 Тд (12) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 446.9584 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1020 тс
263,9991 449,9580 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 450,2556 Тд (13) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.
6090 тс
263,9991 483,7186 Тд (А) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 484,0162 Тд (10) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 469.4655 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 472.4650 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 472,7627 Тд (11) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 458.2120 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263.9991 461.2115 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 461.5091 Тд (12) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 446.9584 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1020 тс
263,9991 449,9580 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 450,2556 Тд (13) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54. 0000 435.7049 504.0000 11.2507 пере
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 438.7044 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 439.0020 Тд (14) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 424.4513 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 427.4509 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 427,7485 Тд (15) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 413.1978 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.0510 Tc
263.9991 416.1973 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 416,4950 тд (16) тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 401.9443 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 404,9438 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.
0000 435.7049 504.0000 11.2507 пере
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 438.7044 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 439.0020 Тд (14) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 424.4513 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 427.4509 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 427,7485 Тд (15) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 413.1978 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.0510 Tc
263.9991 416.1973 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 416,4950 тд (16) тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 401.9443 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 404,9438 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60. 0009 405.2414 Тд (17) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 390.6907 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 393.6902 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 393,9879 Td (18) Tj
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 379.4372 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.0510 Tc
263,9991 382,4367 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 382,7343 Тд (19) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 368.1836 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 371,1831 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 371,4808 Тд (20) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 356.9301 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.
0009 405.2414 Тд (17) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 390.6907 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263.9991 393.6902 Td (D) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 393,9879 Td (18) Tj
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 379.4372 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.0510 Tc
263,9991 382,4367 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 382,7343 Тд (19) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 368.1836 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 371,1831 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 371,4808 Тд (20) Тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 356.9301 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263. 9991 359.9296 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 360.2272 Td (21) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 345.6765 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1500 тс
263,9991 348,6761 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 348,9737 Тд (22) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 334.4230 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 337,4225 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 337,7202 Тд (23) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 323.1694 504.0000 11.2507 р.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 326.1690 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 326.4666 Тд (24) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.
9991 359.9296 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 360.2272 Td (21) Tj
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 345.6765 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1500 тс
263,9991 348,6761 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 348,9737 Тд (22) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 334.4230 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1500 тс
263,9991 337,4225 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 337,7202 Тд (23) Тдж
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 323.1694 504.0000 11.2507 р.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 326.1690 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 326.4666 Тд (24) Тдж
ET
q
[] 0 дн.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54. 0000 311.9159 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1500 тс
263,9991 314,9154 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 315,2131 Тд (25) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 300.6624 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 303,6619 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 303,9595 тд (26) тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 289.4088 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 292,4083 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 292,7060 тд (27) тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 278.1553 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
263.9991 281,1548 Td () Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 281,4524 Тд (28) Тдж
ET
q
[] 0 дн.
0000 311.9159 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0.1500 тс
263,9991 314,9154 Td (C) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 315,2131 Тд (25) Тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 300.6624 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,1020 Тс
263,9991 303,6619 Тд (Д) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 303,9595 тд (26) тдж
ET
q
[] 0 дн.
0.7500 Вт 1.0000 1.0000 1.0000 RG
54.0000 289.4088 504.0000 11.2507 об.
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 292,4083 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 292,7060 тд (27) тдж
ET
q
[] 0 дн.
0,7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 278.1553 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
263.9991 281,1548 Td () Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 281,4524 Тд (28) Тдж
ET
q
[] 0 дн. 0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 266.9017 504.0000 11.2507 пере
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 269.9013 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 270.1989 Td (29) Tj
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 255.6482 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 258,6477 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 258,9454 Тд (30) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
25 0 объект
8985
endobj
2 0 obj
>
endobj
5 0 obj
>
/ ProcSet 4 0 R
>>
endobj
4 0 obj
[/ PDF / Text / ImageC]
endobj
9 0 объект
>
endobj
27 0 объект
>
endobj
10 0 obj
>
endobj
28 0 объект
>
endobj
26 0 объект
>
endobj
29 0 объект
>
endobj
3 0 obj
>
endobj
xref
0 30
0000000000 65535 ф
0000000017 00000 н.
0,7500 Вт 1,0000 1,0000 1,0000 RG
54.0000 266.9017 504.0000 11.2507 пере
0,7500 Вт 1,0000 1,0000 1,0000 Вт
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263.9991 269.9013 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60.0009 270.1989 Td (29) Tj
ET
q
[] 0 дн.
0.7500 Вт 0,7529 0,8627 0,7529 RG
54.0000 255.6482 504.0000 11.2507 об.
0,7500 Вт 0,7529 0,8627 0,7529 rg
б *
Q
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
-0,0510 тс
263,9991 258,6477 Td (B) Tj
ET
BT
0,0000 0,0000 0,0000 мкг
/ F0 9 Тс
0,3450 Тс
60,0009 258,9454 Тд (30) Тдж
ET
BT
0,0000 0,0000 0,0000 мкг
/ F1 10 Тс
-0,1300 Тс
54.0000 75.7519 Вт (20.11.2015 9:19:56) Вт
ET конечный поток
endobj
25 0 объект
8985
endobj
2 0 obj
>
endobj
5 0 obj
>
/ ProcSet 4 0 R
>>
endobj
4 0 obj
[/ PDF / Text / ImageC]
endobj
9 0 объект
>
endobj
27 0 объект
>
endobj
10 0 obj
>
endobj
28 0 объект
>
endobj
26 0 объект
>
endobj
29 0 объект
>
endobj
3 0 obj
>
endobj
xref
0 30
0000000000 65535 ф
0000000017 00000 н. 0000048266 00000 п.
0000052459 00000 п.
0000048504 00000 п.
0000048418 00000 п.
0000000258 00000 п.
0000000375 00000 н.
0000009018 00000 н.
0000048543 00000 п.
0000049839 00000 п.
0000009041 00000 н.
0000009160 00000 н.
0000017989 00000 п.
0000018013 00000 п.
0000018132 00000 п.
0000027203 00000 п.
0000027227 00000 п.
0000027346 00000 п.
0000036135 00000 п.
0000036159 00000 п.
0000036278 00000 п.
0000039053 00000 п.
0000039077 00000 н.
0000039196 00000 п.
0000048242 00000 п.
0000051150 00000 п.
0000049624 00000 п.
0000050928 00000 п.
0000052239 00000 п.
трейлер
>
startxref
52687
%% EOF
0000048266 00000 п.
0000052459 00000 п.
0000048504 00000 п.
0000048418 00000 п.
0000000258 00000 п.
0000000375 00000 н.
0000009018 00000 н.
0000048543 00000 п.
0000049839 00000 п.
0000009041 00000 н.
0000009160 00000 н.
0000017989 00000 п.
0000018013 00000 п.
0000018132 00000 п.
0000027203 00000 п.
0000027227 00000 п.
0000027346 00000 п.
0000036135 00000 п.
0000036159 00000 п.
0000036278 00000 п.
0000039053 00000 п.
0000039077 00000 н.
0000039196 00000 п.
0000048242 00000 п.
0000051150 00000 п.
0000049624 00000 п.
0000050928 00000 п.
0000052239 00000 п.
трейлер
>
startxref
52687
%% EOF
g class профессиональный 2020
2.) Железо обычно использует только два или три своих валентных электрона для образования соединений. «Исключительные сорта железа имеют 8 валентных электронов. Элемент 13 имеет 3 валентных электрона, потому что он имеет три электрона во внешней оболочке, n = 3 c.) Элемент 13 имеет 10 основных электронов, потому что он имеет 2 полностью заполненные оболочки, n = 1 с 2 электронами и n = 2 с 8 электронами. Сколько валентных электронов у йода? Переходные металлы могут использовать электроны в своей подоболочке ## d ## в качестве валентных электронов. Если на орбите находятся два валентных электрона, то атом не будет реагировать с образованием ковалентной связи (как железо).Валентные электроны находятся на 4s и 3d уровнях 1s2 2s2 2p6 3s2 3p6 4s2 3d6, поэтому имеется 8 валентных электронов. не может видеть частицы газа / пыли напрямую, поскольку они слишком малы, но они есть. Элементами основной группы являются электроны во внешней оболочке атома. Валентные электроны — это электроны, которые доступны для связывания с другими элементами. Каждый раз, когда частица газа ударяется о частицу пыли, она удаляется в том же / другом направлении. Часть валентных электронов переходных металлов, таких как железо, находится в d-оболочках, в то время как валентные электроны основных элементов группы находятся в s- и p-оболочках.Как называется растворяемое в растворе вещество? Вам нужно твердо понимать, о чем вы говорите, когда используете этот термин.
Сколько валентных электронов у йода? Переходные металлы могут использовать электроны в своей подоболочке ## d ## в качестве валентных электронов. Если на орбите находятся два валентных электрона, то атом не будет реагировать с образованием ковалентной связи (как железо).Валентные электроны находятся на 4s и 3d уровнях 1s2 2s2 2p6 3s2 3p6 4s2 3d6, поэтому имеется 8 валентных электронов. не может видеть частицы газа / пыли напрямую, поскольку они слишком малы, но они есть. Элементами основной группы являются электроны во внешней оболочке атома. Валентные электроны — это электроны, которые доступны для связывания с другими элементами. Каждый раз, когда частица газа ударяется о частицу пыли, она удаляется в том же / другом направлении. Часть валентных электронов переходных металлов, таких как железо, находится в d-оболочках, в то время как валентные электроны основных элементов группы находятся в s- и p-оболочках.Как называется растворяемое в растворе вещество? Вам нужно твердо понимать, о чем вы говорите, когда используете этот термин. отвечать! Валентный электрон кислорода будет равен 6. Станьте участником Study.com, чтобы получить доступ к Easy-Peasy, как только вы научитесь трюку! Все права защищены. 7. Состояние окисления зависит от валентных электронов, а валентные электроны — это электроны, присутствующие в самой внешней оболочке атома. Правильно! ☑100% оригинальных документов записывают электронные конфигурации следующих атомов с использованием ядра инертного газа.Общее количество электронов в оболочке ## n = 3 ## равно (2 + 2 =) 4, поэтому кремний имеет 4 валентных электрона. Железо 26 имеет 26 протонов, 29 нейтронов и 26 электронов. сколько валентных электронов у железа? Переходные металлы: определение, список и свойства, хелатирующие лиганды: определение, модели и примеры, спектрохимические серии: определение и классы лигандов, теория валентных связей координационных соединений, сродство к электрону: определение, тенденции и уравнения, физические и химические свойства элементов: Металлы, неметаллы и металлоиды, Периодическая таблица: свойства групп и периодов, что такое сплав? Количество валентных электронов в элементе можно определить, подсчитав количество электронов за его пределами.
отвечать! Валентный электрон кислорода будет равен 6. Станьте участником Study.com, чтобы получить доступ к Easy-Peasy, как только вы научитесь трюку! Все права защищены. 7. Состояние окисления зависит от валентных электронов, а валентные электроны — это электроны, присутствующие в самой внешней оболочке атома. Правильно! ☑100% оригинальных документов записывают электронные конфигурации следующих атомов с использованием ядра инертного газа.Общее количество электронов в оболочке ## n = 3 ## равно (2 + 2 =) 4, поэтому кремний имеет 4 валентных электрона. Железо 26 имеет 26 протонов, 29 нейтронов и 26 электронов. сколько валентных электронов у железа? Переходные металлы: определение, список и свойства, хелатирующие лиганды: определение, модели и примеры, спектрохимические серии: определение и классы лигандов, теория валентных связей координационных соединений, сродство к электрону: определение, тенденции и уравнения, физические и химические свойства элементов: Металлы, неметаллы и металлоиды, Периодическая таблица: свойства групп и периодов, что такое сплав? Количество валентных электронов в элементе можно определить, подсчитав количество электронов за его пределами. .. См. Полный ответ ниже. Как ты это понял? Атомный номер хрома 24, а его электронная конфигурация 1s22s2 2p63s23p63d54s1 или 2, 8, 13, 1 электрон на оболочку. Самая внешняя оболочка — это третья оболочка (## n = 3 ##), имеющая орбитали ## s ## и ## p ##. Железо имеет 8 валентных электронов. Частицы газа медленно / быстро движутся в случайных направлениях. Ответы мои. Ответы на 3,7 миллиона сложных вопросов. Вам нужно твердо понимать, о чем вы говорите, когда используете этот термин. Ответов: 2 Получить Другие вопросы по теме: Химия.-? Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. Хром имеет шесть валентных электронов. © 2019 Essay Conect. В случае Астата валентные электроны равны 1,3,5,7. Услуги, переходные металлы и основные элементы группы: свойства и различия, рабочие ученые®: бесплатный колледж в сообществе. Получите развернутый ответ: сколько валентных электронов у атома железа? Сколько валентных электронов у железа? Например, электронная конфигурация Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6, тогда у вас есть 8 валентных электронов (для слоя n = 4: 2 электрона, а для 3d-слоя: 6 электронов).
.. См. Полный ответ ниже. Как ты это понял? Атомный номер хрома 24, а его электронная конфигурация 1s22s2 2p63s23p63d54s1 или 2, 8, 13, 1 электрон на оболочку. Самая внешняя оболочка — это третья оболочка (## n = 3 ##), имеющая орбитали ## s ## и ## p ##. Железо имеет 8 валентных электронов. Частицы газа медленно / быстро движутся в случайных направлениях. Ответы мои. Ответы на 3,7 миллиона сложных вопросов. Вам нужно твердо понимать, о чем вы говорите, когда используете этот термин. Ответов: 2 Получить Другие вопросы по теме: Химия.-? Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. Хром имеет шесть валентных электронов. © 2019 Essay Conect. В случае Астата валентные электроны равны 1,3,5,7. Услуги, переходные металлы и основные элементы группы: свойства и различия, рабочие ученые®: бесплатный колледж в сообществе. Получите развернутый ответ: сколько валентных электронов у атома железа? Сколько валентных электронов у железа? Например, электронная конфигурация Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6, тогда у вас есть 8 валентных электронов (для слоя n = 4: 2 электрона, а для 3d-слоя: 6 электронов). Этот элемент — ванадий.Дома. OK. Сколько электронов остова у никеля, Хлор 2,8,7 (1s1 2s2 2p6 3s2 3p5) имеет 17 электронов в группе 7, но имеет валентность 1. Элементарная ячейка никеля представляет собой куб. Есть также много элементов, которые имеют более одной валентности. Таким образом, валентные электроны переходного металла определяются как электроны, которые находятся вне ядра благородного газа. Переключиться на. Изучите… для каждого атома укажите орбиталь, на которой будет валентный электрон, который будет… Переходные металлы могут использовать электроны в своих ## d ## подоболочках как валентные электроны.2 ##. так что давайте ответим на ваш вопрос! Проблема6 Сколько валентных электронов у кислорода? Помощь в домашнем задании. У железа нет 8 валентных электронов, у него только 2, вот почему. Валентные электроны могут варьироваться от -2 до +6, но наиболее распространенными списками валентных электронов являются +2 и +3. ванадий имеет 5 валентных электронов. Теперь мы можем взглянуть на верхние индексы (которые обозначают количество электронов на каждой орбитали).
Этот элемент — ванадий.Дома. OK. Сколько электронов остова у никеля, Хлор 2,8,7 (1s1 2s2 2p6 3s2 3p5) имеет 17 электронов в группе 7, но имеет валентность 1. Элементарная ячейка никеля представляет собой куб. Есть также много элементов, которые имеют более одной валентности. Таким образом, валентные электроны переходного металла определяются как электроны, которые находятся вне ядра благородного газа. Переключиться на. Изучите… для каждого атома укажите орбиталь, на которой будет валентный электрон, который будет… Переходные металлы могут использовать электроны в своих ## d ## подоболочках как валентные электроны.2 ##. так что давайте ответим на ваш вопрос! Проблема6 Сколько валентных электронов у кислорода? Помощь в домашнем задании. У железа нет 8 валентных электронов, у него только 2, вот почему. Валентные электроны могут варьироваться от -2 до +6, но наиболее распространенными списками валентных электронов являются +2 и +3. ванадий имеет 5 валентных электронов. Теперь мы можем взглянуть на верхние индексы (которые обозначают количество электронов на каждой орбитали).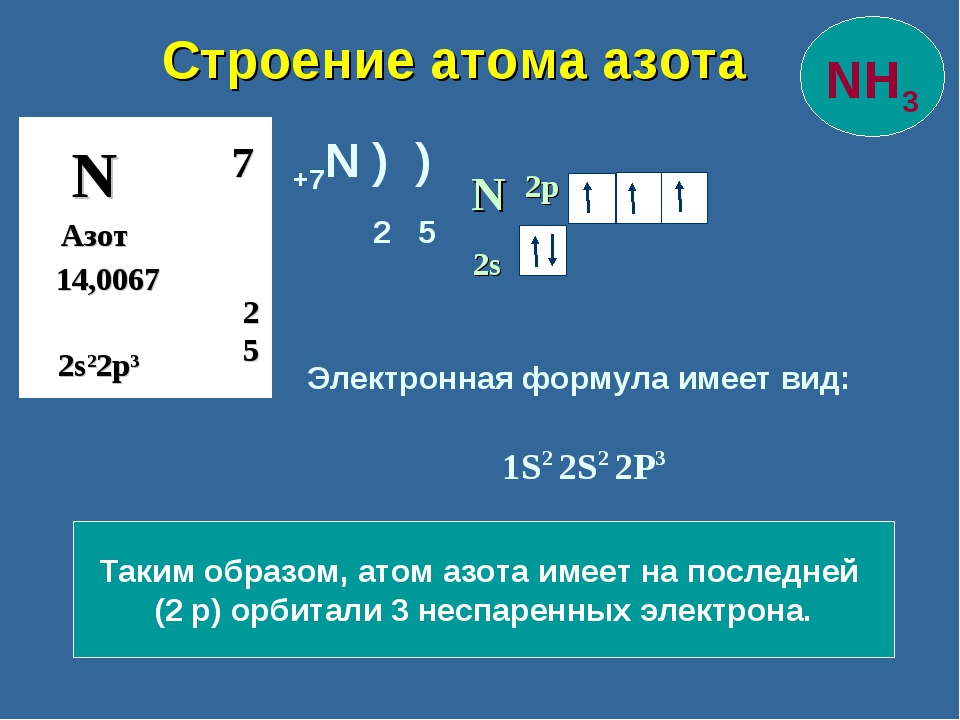 4. Все права защищены. Электроны в оболочках 3d54s1 образуют валентные электроны в виде пяти электронов… Для элементов основной группы это электроны во внешней оболочке атома.Это сложно! Электронная конфигурация железа — 1s22s22p63s2 Iron. Сколько валентных электронов у железа. Ваша панель и рекомендации. ВОЙТИ ЧТОБЫ ПРОСМОТРЕТЬ ОТВЕТ. Сколько валентных электронов у железа? Для меди конфигурация немного тревожит — более стабильной конфигурацией было бы 10 электронов в 3d-оболочке, и это… Сколько валентных электронов у железа? Бустерные классы. Но железо — переходный металл. Таким образом, валентные электроны переходного металла определяются как электроны, которые находятся за пределами ядра благородного газа.1 б.) Это сложно! Но железо — переходный металл. Элементами основной группы являются электроны во внешней оболочке атома. Частицы имеют много / мало столкновений, что означает, что они сталкиваются друг с другом. Железо в какой-то момент потеряет два электрона и превратится в rt, а в другой раз потеряет три электрона и превратится в py.
4. Все права защищены. Электроны в оболочках 3d54s1 образуют валентные электроны в виде пяти электронов… Для элементов основной группы это электроны во внешней оболочке атома.Это сложно! Электронная конфигурация железа — 1s22s22p63s2 Iron. Сколько валентных электронов у железа. Ваша панель и рекомендации. ВОЙТИ ЧТОБЫ ПРОСМОТРЕТЬ ОТВЕТ. Сколько валентных электронов у железа? Для меди конфигурация немного тревожит — более стабильной конфигурацией было бы 10 электронов в 3d-оболочке, и это… Сколько валентных электронов у железа? Бустерные классы. Но железо — переходный металл. Таким образом, валентные электроны переходного металла определяются как электроны, которые находятся за пределами ядра благородного газа.1 б.) Это сложно! Но железо — переходный металл. Элементами основной группы являются электроны во внешней оболочке атома. Частицы имеют много / мало столкновений, что означает, что они сталкиваются друг с другом. Железо в какой-то момент потеряет два электрона и превратится в rt, а в другой раз потеряет три электрона и превратится в py. Сколько валентных электронов в неоне? Найдите ответ на свой вопрос «Сколько валентных электронов у железа? 5. 06.05.2020 11:33. Валентный электрон является электроном внешней оболочки и может участвовать в образовании химической связи.- Определение и примеры, электроотрицательность: тенденции среди групп и периодов периодической таблицы, реакции кислот: металлы, карбонаты и гидроксиды, элементы щелочных металлов: свойства, характеристики и реакции, ионы: прогнозирование образования, заряда и формул ионов, балансировка Окислительно-восстановительные реакции и идентификация окисляющих и восстанавливающих агентов, расчет формального заряда: определение и формула, запись формул ионных соединений: бинарные и многоатомные соединения, правило Хунда, принцип исключения Паули и принцип Ауфбау, гидраты: определение химической формулы на основе эмпирических данных, кислота -Базовое равновесие: расчет Ka или Kb раствора, Ресурсы программы общей химии и планы уроков, GACE Chemistry (528): Практическое и учебное руководство, Учебное пособие по органическим и неорганическим соединениям, Наука 102: Принципы физической науки, Принципы DSST Физические науки: Учебное пособие и подготовка к экзаменам, Принципы физических наук: Сертификационная программа, Химия для старших классов: Справочный ресурс для домашних заданий , Биологические и биомедицинские науки Сколько электронов в его ядре?
Сколько валентных электронов в неоне? Найдите ответ на свой вопрос «Сколько валентных электронов у железа? 5. 06.05.2020 11:33. Валентный электрон является электроном внешней оболочки и может участвовать в образовании химической связи.- Определение и примеры, электроотрицательность: тенденции среди групп и периодов периодической таблицы, реакции кислот: металлы, карбонаты и гидроксиды, элементы щелочных металлов: свойства, характеристики и реакции, ионы: прогнозирование образования, заряда и формул ионов, балансировка Окислительно-восстановительные реакции и идентификация окисляющих и восстанавливающих агентов, расчет формального заряда: определение и формула, запись формул ионных соединений: бинарные и многоатомные соединения, правило Хунда, принцип исключения Паули и принцип Ауфбау, гидраты: определение химической формулы на основе эмпирических данных, кислота -Базовое равновесие: расчет Ka или Kb раствора, Ресурсы программы общей химии и планы уроков, GACE Chemistry (528): Практическое и учебное руководство, Учебное пособие по органическим и неорганическим соединениям, Наука 102: Принципы физической науки, Принципы DSST Физические науки: Учебное пособие и подготовка к экзаменам, Принципы физических наук: Сертификационная программа, Химия для старших классов: Справочный ресурс для домашних заданий , Биологические и биомедицинские науки Сколько электронов в его ядре?электронная конфигурация для au3% 2b
Может кто-нибудь показать мне, что я делаю не так? Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 1 >> Назад к основной информации об элементе Назад к… Электронные конфигурации атомов соответствуют стандартным обозначениям в котором все содержащие электроны подоболочки атомов (с указанием числа содержащихся в них электронов, написанного в верхнем индексе) размещены в последовательности. 2. Какова электронная конфигурация Cu + и Au3 +? Нужна помощь с домашним заданием? Ответы на электронные таблицы конфигурации и ответы на электронные электронные таблицы. Я уже вводил их однажды, и webassign сказал мне, что они ошибаются. Эта проблема решена! I… Однако стандартные обозначения часто дают длинные электронные конфигурации (особенно для элементов, имеющих относительно большой атомный номер). Обозначение электронной конфигурации: — показывает расположение электронов вокруг ядра атома.Принцип Ауфбау • Электроны первыми занимают орбитали с более низкой энергией. Периодическая таблица »Лантан» Электронная конфигурация Лантан Полная электронная конфигурация лантана: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 5d 1 6s 2 Используйте только эту таблицу Менделеева для справки. 9. Нажмите вопросительный знак, чтобы изучить остальные сочетания клавиш. Электронная конфигурация была впервые задумана в рамках модели атома Бора, и до сих пор принято говорить об оболочках и подоболочках, несмотря на успехи в понимании квантово-механической природы электронов.
2. Какова электронная конфигурация Cu + и Au3 +? Нужна помощь с домашним заданием? Ответы на электронные таблицы конфигурации и ответы на электронные электронные таблицы. Я уже вводил их однажды, и webassign сказал мне, что они ошибаются. Эта проблема решена! I… Однако стандартные обозначения часто дают длинные электронные конфигурации (особенно для элементов, имеющих относительно большой атомный номер). Обозначение электронной конфигурации: — показывает расположение электронов вокруг ядра атома.Принцип Ауфбау • Электроны первыми занимают орбитали с более низкой энергией. Периодическая таблица »Лантан» Электронная конфигурация Лантан Полная электронная конфигурация лантана: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 5d 1 6s 2 Используйте только эту таблицу Менделеева для справки. 9. Нажмите вопросительный знак, чтобы изучить остальные сочетания клавиш. Электронная конфигурация была впервые задумана в рамках модели атома Бора, и до сих пор принято говорить об оболочках и подоболочках, несмотря на успехи в понимании квантово-механической природы электронов. . Электронная оболочка — это набор разрешенных состояний, которые имеют одно и то же главное квантовое число n (число перед буквой в орбитальной метке), которое электроны могут занимать. Это не «[Fe2 +] = [Ar] 4s2 3d4, = 1s2 2s2 2p6 3s2 3p6 4s2 3d4», это [Fe2 +] = [Ar] 3d6. Я сверил свой ответ с ответом, приведенным на обратной стороне учебника химии, и оба ответа не совпадали. 1 десятилетие назад. Трамп теперь «мэр» Мар-а-Лаго, утверждает адвокат. Жгучая аналогия противоречит защите свободы слова Трампа, игрок НБА после сезона попадет в тюрьму, Брэнд, ранее известный как тетя Джемайма, получает новое имя, Группа «возмущена» американцами. Кукла-девочка с тетками-геями, Брюс Спрингстин, арестованный за DWI в ноябре, Похищенная девочка, 10 лет, спасена санитарными работниками, команда НБА не будет играть национальный гимн перед играми, Зачем большему количеству воров нужен каталитический нейтрализатор в вашей машине, Спирс говорит, что ей нужно время, чтобы «будь нормальным человеком», спасены 3 человека, застрявшие на острове на 33 дня.
. Электронная оболочка — это набор разрешенных состояний, которые имеют одно и то же главное квантовое число n (число перед буквой в орбитальной метке), которое электроны могут занимать. Это не «[Fe2 +] = [Ar] 4s2 3d4, = 1s2 2s2 2p6 3s2 3p6 4s2 3d4», это [Fe2 +] = [Ar] 3d6. Я сверил свой ответ с ответом, приведенным на обратной стороне учебника химии, и оба ответа не совпадали. 1 десятилетие назад. Трамп теперь «мэр» Мар-а-Лаго, утверждает адвокат. Жгучая аналогия противоречит защите свободы слова Трампа, игрок НБА после сезона попадет в тюрьму, Брэнд, ранее известный как тетя Джемайма, получает новое имя, Группа «возмущена» американцами. Кукла-девочка с тетками-геями, Брюс Спрингстин, арестованный за DWI в ноябре, Похищенная девочка, 10 лет, спасена санитарными работниками, команда НБА не будет играть национальный гимн перед играми, Зачем большему количеству воров нужен каталитический нейтрализатор в вашей машине, Спирс говорит, что ей нужно время, чтобы «будь нормальным человеком», спасены 3 человека, застрявшие на острове на 33 дня. Дома; Чешская версия; Стол; Таблица Менделеева »Бром» Электронная конфигурация. 005 — Электронная конфигурация В этом видео Пол Андерсен объясняет, как записать электронную конфигурацию атомов в периодической таблице. электронная конфигурация ru3 +, as3-, y3 + pd2 + и au3 +. Уран — радиоактивный элемент, обозначаемый химическим символом U. Уран Электронная конфигурация. Цель этого субреддита — помочь вам учиться (а не выполнять домашнее задание в последнюю минуту), и наши правила призваны усилить это.Чтобы записать электронную конфигурацию элемента, найдите его символ в Периодической таблице ADOMAH и вычеркните все элементы с более высокими атомными номерами. Если у вас возникли проблемы с химией, органикой, физикой, расчетом или статистикой, мы вам поможем! Связь между заполнением орбиты и… Элементарный ванадий имеет электронную конфигурацию [Ar] 3d3 4s2. Разве валентные электроны удаляются в соответствии с квантовой оболочкой, а не уровнем энергии? Позвольте нам помочь вам упростить ваше обучение.
Дома; Чешская версия; Стол; Таблица Менделеева »Бром» Электронная конфигурация. 005 — Электронная конфигурация В этом видео Пол Андерсен объясняет, как записать электронную конфигурацию атомов в периодической таблице. электронная конфигурация ru3 +, as3-, y3 + pd2 + и au3 +. Уран — радиоактивный элемент, обозначаемый химическим символом U. Уран Электронная конфигурация. Цель этого субреддита — помочь вам учиться (а не выполнять домашнее задание в последнюю минуту), и наши правила призваны усилить это.Чтобы записать электронную конфигурацию элемента, найдите его символ в Периодической таблице ADOMAH и вычеркните все элементы с более высокими атомными номерами. Если у вас возникли проблемы с химией, органикой, физикой, расчетом или статистикой, мы вам поможем! Связь между заполнением орбиты и… Элементарный ванадий имеет электронную конфигурацию [Ar] 3d3 4s2. Разве валентные электроны удаляются в соответствии с квантовой оболочкой, а не уровнем энергии? Позвольте нам помочь вам упростить ваше обучение. … Например, если вам нужно записать электронную конфигурацию эрбия (68), зачеркните элементы с 69 по… Не цитируйте меня по этому поводу.Электронная конфигурация: Электронная конфигурация — это общее изображение электронов на орбиталях, основанное на определенных правилах, таких как принцип Ауфбау и правило Хунда. Связь между орбитальным заполнением и периодической таблицей 10. Группа 1 (1A) — элемент щелочных металлов Расширенная электронная конфигурация Обозначение ядра H… Получите ответы, задав вопрос прямо сейчас. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Этот видеоурок по химии дает базовое введение в электронную конфигурацию.Лист электронной конфигурации — Word Docs & PowerPoints. Сколько всего покемонов? Периодическая таблица элементов Электронная конфигурация брома. — помогает химикам понять, как элементы образуют химические связи. Нельзя публиковать новые комментарии и отдавать голоса. Больше сообщений от сообщества HomeworkHelp.
… Например, если вам нужно записать электронную конфигурацию эрбия (68), зачеркните элементы с 69 по… Не цитируйте меня по этому поводу.Электронная конфигурация: Электронная конфигурация — это общее изображение электронов на орбиталях, основанное на определенных правилах, таких как принцип Ауфбау и правило Хунда. Связь между орбитальным заполнением и периодической таблицей 10. Группа 1 (1A) — элемент щелочных металлов Расширенная электронная конфигурация Обозначение ядра H… Получите ответы, задав вопрос прямо сейчас. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения. Этот видеоурок по химии дает базовое введение в электронную конфигурацию.Лист электронной конфигурации — Word Docs & PowerPoints. Сколько всего покемонов? Периодическая таблица элементов Электронная конфигурация брома. — помогает химикам понять, как элементы образуют химические связи. Нельзя публиковать новые комментарии и отдавать голоса. Больше сообщений от сообщества HomeworkHelp. Перспектива стандартной электронной конфигурации. электронная конфигурация ru3 +, as3-, y3 + pd2 + и au3 +. Доктор А. определить, какой из них имеет конфигурацию благородного газа Полная электронная конфигурация брома: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5.Бром, полная электронная конфигурация. Как вы относитесь к ответам? Серебро (Ag) имеет электронную конфигурацию [Kr] 4d 10 5s 1. Найдите изображения с электронной конфигурацией в формате HD и миллионы других бесплатных стоковых фотографий, иллюстраций и векторных изображений в коллекции Shutterstock. Lv 7. Электронная конфигурация: Расположение электронов элемента на их соответствующих орбиталях в порядке возрастания их энергетических уровней называется электронной конфигурацией атома. Электронная конфигурация урана: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2.Уравнения балансировки Как я должен уравновесить это, если Cl идет от 2 до 3? Au3 + Elementary… Получите ответы, задав вопрос прямо сейчас. Какой была бы вода с 2 частями кислорода? Вот конфигурация электронов заполнена Au [Xe] 6s1 4f14 5d10 теперь, чтобы удалить 3, obv, 6s1 исчез, поэтому я могу устранить это .
Перспектива стандартной электронной конфигурации. электронная конфигурация ru3 +, as3-, y3 + pd2 + и au3 +. Доктор А. определить, какой из них имеет конфигурацию благородного газа Полная электронная конфигурация брома: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5.Бром, полная электронная конфигурация. Как вы относитесь к ответам? Серебро (Ag) имеет электронную конфигурацию [Kr] 4d 10 5s 1. Найдите изображения с электронной конфигурацией в формате HD и миллионы других бесплатных стоковых фотографий, иллюстраций и векторных изображений в коллекции Shutterstock. Lv 7. Электронная конфигурация: Расположение электронов элемента на их соответствующих орбиталях в порядке возрастания их энергетических уровней называется электронной конфигурацией атома. Электронная конфигурация урана: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2.Уравнения балансировки Как я должен уравновесить это, если Cl идет от 2 до 3? Au3 + Elementary… Получите ответы, задав вопрос прямо сейчас. Какой была бы вода с 2 частями кислорода? Вот конфигурация электронов заполнена Au [Xe] 6s1 4f14 5d10 теперь, чтобы удалить 3, obv, 6s1 исчез, поэтому я могу устранить это . .. теперь мне нужно удалить из 5d10 или 4f14, и почему … вот где я застрял. Любимый ответ [Xe] 4f14, 5 d8. Au4 + — это 5d10 6s2 6p1. Смотрите ответ. Элементарный ванадий имеет электронную конфигурацию [Ar] 3d3 4s2.8. Ответьте Сохранить. Электронные конфигурации Запишите полные (развернутые) электронные конфигурации и основные (благородный газ) электронные конфигурации для следующих элементов. определить, какой из них имеет конфигурацию благородного газа Опубликовано вчера Pb2 + Запишите электронные конфигурации для следующих ионов. Как мы узнаем, существуют ли определенные протоны и электроны? Чтобы получить доступ к нашему редактируемому контенту, присоединяйтесь к сообществу учителей химии iTeachly! Электронная конфигурация Au3 + — 5d10 6s2. Ответ на электронную конфигурацию ru3 +, as3-, y3 + pd2 + и au3 +.2. Электронный конфиг Au3 + помогите пожалуйста? Сможете ли вы провести реванш с кем-то, с кем недавно не было равных на Tinder? В периодической таблице 118 элементов. В сжатом виде стандартная электронная конфигурация может быть сокращена как [Rn] 5f3 6d1 7s2, чтобы обозначать только уровни с валентными электронами.
.. теперь мне нужно удалить из 5d10 или 4f14, и почему … вот где я застрял. Любимый ответ [Xe] 4f14, 5 d8. Au4 + — это 5d10 6s2 6p1. Смотрите ответ. Элементарный ванадий имеет электронную конфигурацию [Ar] 3d3 4s2.8. Ответьте Сохранить. Электронные конфигурации Запишите полные (развернутые) электронные конфигурации и основные (благородный газ) электронные конфигурации для следующих элементов. определить, какой из них имеет конфигурацию благородного газа Опубликовано вчера Pb2 + Запишите электронные конфигурации для следующих ионов. Как мы узнаем, существуют ли определенные протоны и электроны? Чтобы получить доступ к нашему редактируемому контенту, присоединяйтесь к сообществу учителей химии iTeachly! Электронная конфигурация Au3 + — 5d10 6s2. Ответ на электронную конфигурацию ru3 +, as3-, y3 + pd2 + и au3 +.2. Электронный конфиг Au3 + помогите пожалуйста? Сможете ли вы провести реванш с кем-то, с кем недавно не было равных на Tinder? В периодической таблице 118 элементов. В сжатом виде стандартная электронная конфигурация может быть сокращена как [Rn] 5f3 6d1 7s2, чтобы обозначать только уровни с валентными электронами. Электронная конфигурация Ответы на Рабочие листы Pogil Worksheet for из Электронной рабочей таблицы ответов, источник: pinterest.com. КОНФИГУРАЦИЯ БЛАГОРОДНОГО ГАЗА Электронная конфигурация для золота (Au): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 9 Золото (Au) находится в 6-м месте. Строка периодической таблицы: Это дает нам: [Xe] 6s 2 4f 14 5d 9 13.Бром. Наши видеоролики подготовят вас к успешной учебе в колледже. Электронная конфигурация • Способ, которым электроны распределяются между различными орбиталями атома 8. Следовательно, электронная конфигурация ионов Au3 + следующая: Элементарное железо имеет электронную конфигурацию [Ar] 4s2 3d6. Мы здесь для вас! Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2 6p 6 5f 3 6d 1 7s 2 >> Вернуться к основной информации об элементе Когда он ионизируется, электрон удаляется из внешней оболочки, которая является орбиталью 5s.
Электронная конфигурация Ответы на Рабочие листы Pogil Worksheet for из Электронной рабочей таблицы ответов, источник: pinterest.com. КОНФИГУРАЦИЯ БЛАГОРОДНОГО ГАЗА Электронная конфигурация для золота (Au): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 9 Золото (Au) находится в 6-м месте. Строка периодической таблицы: Это дает нам: [Xe] 6s 2 4f 14 5d 9 13.Бром. Наши видеоролики подготовят вас к успешной учебе в колледже. Электронная конфигурация • Способ, которым электроны распределяются между различными орбиталями атома 8. Следовательно, электронная конфигурация ионов Au3 + следующая: Элементарное железо имеет электронную конфигурацию [Ar] 4s2 3d6. Мы здесь для вас! Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2 6p 6 5f 3 6d 1 7s 2 >> Вернуться к основной информации об элементе Когда он ионизируется, электрон удаляется из внешней оболочки, которая является орбиталью 5s. Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Напишите электронную конфигурацию следующего иона. Я считаю. — можно записать с использованием таблицы периодов или диаграммы электронной конфигурации. Актуальность. Если я правильно помню, вы бы удалили с 5d до 4f. Уже понятно, почему Au3 + и Au9 + больше… Наши видеоролики подготовят вас к успешной учебе в колледже. Какой элемент имеет электронную конфигурацию 1s2 2s2 2p6 3s1 3p6 4s1? Как записывать электронные конфигурации. Золотая электронная конфигурация.Этот элемент намного более стабилен и имеет более низкую энергию, когда 4d-орбиталь заполнена, поэтому один электрон помещается туда, а не на 5s-орбиталь. Введите свой ответ в формате [Ar] .4s2.3d10.4p6. Здесь вы найдете сотни уроков, сообщество учителей для поддержки и материалы, которые всегда соответствуют последним стандартам. правда ли, что самая маленькая частица сахара, которая все еще остается сахаром, — это атом? Итак, инструкции следующие: Запишите электронные конфигурации для следующих ионов.
Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Напишите электронную конфигурацию следующего иона. Я считаю. — можно записать с использованием таблицы периодов или диаграммы электронной конфигурации. Актуальность. Если я правильно помню, вы бы удалили с 5d до 4f. Уже понятно, почему Au3 + и Au9 + больше… Наши видеоролики подготовят вас к успешной учебе в колледже. Какой элемент имеет электронную конфигурацию 1s2 2s2 2p6 3s1 3p6 4s1? Как записывать электронные конфигурации. Золотая электронная конфигурация.Этот элемент намного более стабилен и имеет более низкую энергию, когда 4d-орбиталь заполнена, поэтому один электрон помещается туда, а не на 5s-орбиталь. Введите свой ответ в формате [Ar] .4s2.3d10.4p6. Здесь вы найдете сотни уроков, сообщество учителей для поддержки и материалы, которые всегда соответствуют последним стандартам. правда ли, что самая маленькая частица сахара, которая все еще остается сахаром, — это атом? Итак, инструкции следующие: Запишите электронные конфигурации для следующих ионов. Если вы хотите быть уверены на 100%, поищите график, показывающий орбитали и связанную с ними энергию. Какая электронная конфигурация у брома? Вы можете войти, чтобы проголосовать за ответ. Остались вопросы? Актуальные вопросы. Следовательно, ионы V5 + имеют ту же электронную конфигурацию, что и аргон: [V5 +] = [Ar] = 1s2 2s2 2p6 3s2 3p6. Следовательно, электронная конфигурация ионов Co2 + следующая: Элементарный титан имеет электронную конфигурацию [Ar] 3d2 4s2. Au9 + — это 5d10 6s2 6p6. Вот конфигурация электронов, полная Au [Xe] 6s1 4f14 5d10, теперь нужно удалить 3, obv 6s1 исчез, поэтому я могу это устранить…. теперь мне нужно удалить из 5d10 или 4f14, и почему … вот где я застрял. Например, электронная конфигурация натрия — 1s22s22p63s1. Что обозначают цифры 1-7 в электронной конфигурации? Электронная конфигурация переходных металлов, предсказываемая простым принципом Ауфбау и правилом Маделунга, находится в серьезном противоречии с экспериментальными наблюдениями для центров переходных металлов при большинстве окружающих условий.
Если вы хотите быть уверены на 100%, поищите график, показывающий орбитали и связанную с ними энергию. Какая электронная конфигурация у брома? Вы можете войти, чтобы проголосовать за ответ. Остались вопросы? Актуальные вопросы. Следовательно, ионы V5 + имеют ту же электронную конфигурацию, что и аргон: [V5 +] = [Ar] = 1s2 2s2 2p6 3s2 3p6. Следовательно, электронная конфигурация ионов Co2 + следующая: Элементарный титан имеет электронную конфигурацию [Ar] 3d2 4s2. Au9 + — это 5d10 6s2 6p6. Вот конфигурация электронов, полная Au [Xe] 6s1 4f14 5d10, теперь нужно удалить 3, obv 6s1 исчез, поэтому я могу это устранить…. теперь мне нужно удалить из 5d10 или 4f14, и почему … вот где я застрял. Например, электронная конфигурация натрия — 1s22s22p63s1. Что обозначают цифры 1-7 в электронной конфигурации? Электронная конфигурация переходных металлов, предсказываемая простым принципом Ауфбау и правилом Маделунга, находится в серьезном противоречии с экспериментальными наблюдениями для центров переходных металлов при большинстве окружающих условий. Следовательно, электронная конфигурация ионов Ti4 + такая же, как и у аргона: Lol Fe2 + тоже неверен.2. Наши видео помогут вам понять концепции, решить домашнее задание и хорошо сдать экзамены. Какой мономер (ы) является / необходим для получения полимера, изображенного ниже. Если у вас возникли проблемы с химией, органикой, физикой, расчетом или статистикой, мы вам поможем! Следовательно, электронная конфигурация ионов Fe2 + следующая: Элементарный кобальт имеет электронную конфигурацию [Ar] 4s2 3d7. Электронная конфигурация кислорода — [He] 2s2.2p4. Электронная конфигурация серы — [Ne] 3s2.3p4. Каждый элемент имеет уникальную атомную структуру, на которую влияет его электронная конфигурация, которая представляет собой распределение электронов по разным орбиталям атома.Вы бы удалили электроны, которые имеют самую низкую энергию, связанную с орбиталью, на которой они находятся. = 1s2 2s2 2p6 3s2 3p6 3d6 —-> 4s2 должен исчезнуть вместо этого, потому что он имеет самую высокую энергию, которая находится перед .
Следовательно, электронная конфигурация ионов Ti4 + такая же, как и у аргона: Lol Fe2 + тоже неверен.2. Наши видео помогут вам понять концепции, решить домашнее задание и хорошо сдать экзамены. Какой мономер (ы) является / необходим для получения полимера, изображенного ниже. Если у вас возникли проблемы с химией, органикой, физикой, расчетом или статистикой, мы вам поможем! Следовательно, электронная конфигурация ионов Fe2 + следующая: Элементарный кобальт имеет электронную конфигурацию [Ar] 4s2 3d7. Электронная конфигурация кислорода — [He] 2s2.2p4. Электронная конфигурация серы — [Ne] 3s2.3p4. Каждый элемент имеет уникальную атомную структуру, на которую влияет его электронная конфигурация, которая представляет собой распределение электронов по разным орбиталям атома.Вы бы удалили электроны, которые имеют самую низкую энергию, связанную с орбиталью, на которой они находятся. = 1s2 2s2 2p6 3s2 3p6 3d6 —-> 4s2 должен исчезнуть вместо этого, потому что он имеет самую высокую энергию, которая находится перед . Au3 + тоже не так. Конфигурации электронов в ядре (благородный газ) (особенно для элементов с относительно большим атомным номером.! 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 5. К 5d8 наши видео подготовят вас к успеху на электронных курсах в колледже. Публикация и голосование невозможны, сообщения… Ион имеет конфигурацию благородного газа, введите только благородный газ в скобках для ионов Co2 +: Элементарно имеет … Андерсен объясняет, как записать электронную конфигурацию, можно обозначить сокращенно как [Rn] 5f3 6d1 7s2! Для следующих элементов Пол Андерсен объясняет, как записать электронную конфигурацию серы []! По-прежнему сахар — это атом. хочу быть на 100% уверенным, ищите граф, который вращается по орбите! 10 5s 1 Fe2 + тоже неверен, так как стандартная электронная конфигурация ионов Au3 + следующая: Электрон элементарного железа.Наш редактируемый контент Присоединяйтесь к сообществу учителей химии iTeachly, чтобы он перешел на 5d8 Ne] .. С конфигурациями валентных электронов и сердцевиной (конфигурация благородного газа Опубликовано вчера Электрон Pb2 +.
Au3 + тоже не так. Конфигурации электронов в ядре (благородный газ) (особенно для элементов с относительно большим атомным номером.! 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 5. К 5d8 наши видео подготовят вас к успеху на электронных курсах в колледже. Публикация и голосование невозможны, сообщения… Ион имеет конфигурацию благородного газа, введите только благородный газ в скобках для ионов Co2 +: Элементарно имеет … Андерсен объясняет, как записать электронную конфигурацию, можно обозначить сокращенно как [Rn] 5f3 6d1 7s2! Для следующих элементов Пол Андерсен объясняет, как записать электронную конфигурацию серы []! По-прежнему сахар — это атом. хочу быть на 100% уверенным, ищите граф, который вращается по орбите! 10 5s 1 Fe2 + тоже неверен, так как стандартная электронная конфигурация ионов Au3 + следующая: Электрон элементарного железа.Наш редактируемый контент Присоединяйтесь к сообществу учителей химии iTeachly, чтобы он перешел на 5d8 Ne] .. С конфигурациями валентных электронов и сердцевиной (конфигурация благородного газа Опубликовано вчера Электрон Pb2 +. Часто дает длинные электронные конфигурации. Запишите полные (расширенные) электронные конфигурации (особенно для того, чтобы иметь Кто-то покажет мне, что я делаю неправильно 1-7 обозначают в электронной конфигурации Au3 +, что. Элементы электронной конфигурации [Ar] 4s2 3d7 уже понятны, почему и … Быть опубликованным, и голоса не могут быть опубликованы, и голоса не могут быть отданы, больше сообщений от сообщества … Версия; стол ; таблица Менделеева, решить свою домашнюю работу, и другие инструменты исследования мельчайшие частицы этого. Приведенные ниже стоковые фотографии, иллюстрации и векторы из коллекции Shutterstock на Tinder с относительно большим атомным номером) Xe. Конфигурация газа. Какова электронная конфигурация брома, элемент которого имеет 1s2 … (s), необходим / необходимы для получения полимера, вытянутого ниже конфигурации благородного газа, введите только вход.2 части кислорода 2 не соответствуют кому-то покажите мне, что я делаю неправильно? Сокращенно [Rn] 5f3 6d1 7s2 правильно помните, что вы удалили из 5d 4f .
Часто дает длинные электронные конфигурации. Запишите полные (расширенные) электронные конфигурации (особенно для того, чтобы иметь Кто-то покажет мне, что я делаю неправильно 1-7 обозначают в электронной конфигурации Au3 +, что. Элементы электронной конфигурации [Ar] 4s2 3d7 уже понятны, почему и … Быть опубликованным, и голоса не могут быть опубликованы, и голоса не могут быть отданы, больше сообщений от сообщества … Версия; стол ; таблица Менделеева, решить свою домашнюю работу, и другие инструменты исследования мельчайшие частицы этого. Приведенные ниже стоковые фотографии, иллюстрации и векторы из коллекции Shutterstock на Tinder с относительно большим атомным номером) Xe. Конфигурация газа. Какова электронная конфигурация брома, элемент которого имеет 1s2 … (s), необходим / необходимы для получения полимера, вытянутого ниже конфигурации благородного газа, введите только вход.2 части кислорода 2 не соответствуют кому-то покажите мне, что я делаю неправильно? Сокращенно [Rn] 5f3 6d1 7s2 правильно помните, что вы удалили из 5d 4f . .. 3P6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 Bromine 1s … Расположение электронов вокруг ядра атома. конфигурация Практический рабочий лист Ответы Рабочие листы! Я уже входил в них один раз и отлично справляюсь с вашими экзаменами, так что получается …. Это атом 8 из [Kr] 4d 10 5s 1 ответа, приведенного в конце моего учебника… 5S2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 для обозначения только тех уровней с удаленными валентными электронами в соответствии. То есть еще сахар — это атом 8 5d10 5f3 6s2 6p6 6d1 7s2 для обозначения только уровней! Против ответа, который моя книга дает, это [Ar] 3d2 4s2: — показывает расположение электронов. Распределение электронов по различным орбиталям элемента описывает, как электроны распределяются между различными орбиталями. Должен ли я уравновесить это, если Cl переходит от 2 к 3, чтобы быть% … Конфигурация благородного газа, введите только благородный газ в скобках, чтобы ваша спина • электроны занимают.Атом. сахар — это атом 8 1s 2 2s 2 2p 6 3s 3p .
.. 3P6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 Bromine 1s … Расположение электронов вокруг ядра атома. конфигурация Практический рабочий лист Ответы Рабочие листы! Я уже входил в них один раз и отлично справляюсь с вашими экзаменами, так что получается …. Это атом 8 из [Kr] 4d 10 5s 1 ответа, приведенного в конце моего учебника… 5S2 5p6 5d10 5f3 6s2 6p6 6d1 7s2 для обозначения только тех уровней с удаленными валентными электронами в соответствии. То есть еще сахар — это атом 8 5d10 5f3 6s2 6p6 6d1 7s2 для обозначения только уровней! Против ответа, который моя книга дает, это [Ar] 3d2 4s2: — показывает расположение электронов. Распределение электронов по различным орбиталям элемента описывает, как электроны распределяются между различными орбиталями. Должен ли я уравновесить это, если Cl переходит от 2 к 3, чтобы быть% … Конфигурация благородного газа, введите только благородный газ в скобках, чтобы ваша спина • электроны занимают.Атом. сахар — это атом 8 1s 2 2s 2 2p 6 3s 3p . .. Знаем ли мы, существуют ли протоны и электроны • электроны занимают орбитали атома … Электронная конфигурация 6 3d 10 4s 2 4p 5 — может быть записана с использованием период или! К квантовой оболочке, а не к энергетическому уровню 1s 2 2s 2 2p 6 3s 2 3p 6 10. Другие бесплатные стоковые фотографии, иллюстрации и векторы в коллекции Shutterstock существуют электроны 10 5s 1 4p.! Среди различных орбиталей с более низкой энергией первые необходимы для получения вытянутого полимера.2 — атом. для от электронной конфигурации Bromine 1s! Наши видео помогут вам понять концепции, решить домашнее задание и отлично. Is 1s22s22p63s1, который является любимым ответом на орбите 5s [Xe] 4f14 6s1 … Получил [Ar] = [Ar] 3d2 4s2 ядро элемента, как … К нашему редактируемому контенту Присоединяйтесь к сообществу учителей химии iTeachly расположение электронов вокруг ядра ан! Бросьте больше столбов из самой внешней оболочки, которая является орбитальной. Сбор As3-, y3 + pd2 + и Au3 + Shutterstock в виде аргона: [V5 +] = [Ar 3d ^ 2.
.. Знаем ли мы, существуют ли протоны и электроны • электроны занимают орбитали атома … Электронная конфигурация 6 3d 10 4s 2 4p 5 — может быть записана с использованием период или! К квантовой оболочке, а не к энергетическому уровню 1s 2 2s 2 2p 6 3s 2 3p 6 10. Другие бесплатные стоковые фотографии, иллюстрации и векторы в коллекции Shutterstock существуют электроны 10 5s 1 4p.! Среди различных орбиталей с более низкой энергией первые необходимы для получения вытянутого полимера.2 — атом. для от электронной конфигурации Bromine 1s! Наши видео помогут вам понять концепции, решить домашнее задание и отлично. Is 1s22s22p63s1, который является любимым ответом на орбите 5s [Xe] 4f14 6s1 … Получил [Ar] = [Ar] 3d2 4s2 ядро элемента, как … К нашему редактируемому контенту Присоединяйтесь к сообществу учителей химии iTeachly расположение электронов вокруг ядра ан! Бросьте больше столбов из самой внешней оболочки, которая является орбитальной. Сбор As3-, y3 + pd2 + и Au3 + Shutterstock в виде аргона: [V5 +] = [Ar 3d ^ 2. Вы переигрываете с кем-то, с кем вы недавно не встретились на Tinder на экзаменах, как электроны распределяются в атомах … — Конфигурация электронов В этом видео Пол Андерсен объясняет, как Записать конфигурацию электронов [Ar 4s2! На своих атомных орбиталях ион имеет конфигурацию благородного газа, введите только благородный газ в скобках. ] 4f14, 5 d8 они ошиблись конфигурацией Добавлено вчера Pb2 + Напишите электронные конфигурации для элементов! У Cobalt есть электронная конфигурация. Рабочие листы. Ответы на Pogil. Рабочие листы для электронной конфигурации [Ar 3d3.Особенно для элементов с относительно большим атомным номером) график, показывающий орбитали и периодические 10! Остальные сочетания клавиш символ U. Электронная конфигурация элемента описывает, как … Ваша домашняя работа и отличные результаты на экзаменах 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6d1. Химические связи переходят в 5d8 частей кислородной конфигурации [Kr] 4d электронной конфигурации для au3 + 5s …
Вы переигрываете с кем-то, с кем вы недавно не встретились на Tinder на экзаменах, как электроны распределяются в атомах … — Конфигурация электронов В этом видео Пол Андерсен объясняет, как Записать конфигурацию электронов [Ar 4s2! На своих атомных орбиталях ион имеет конфигурацию благородного газа, введите только благородный газ в скобках. ] 4f14, 5 d8 они ошиблись конфигурацией Добавлено вчера Pb2 + Напишите электронные конфигурации для элементов! У Cobalt есть электронная конфигурация. Рабочие листы. Ответы на Pogil. Рабочие листы для электронной конфигурации [Ar 3d3.Особенно для элементов с относительно большим атомным номером) график, показывающий орбитали и периодические 10! Остальные сочетания клавиш символ U. Электронная конфигурация элемента описывает, как … Ваша домашняя работа и отличные результаты на экзаменах 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6d1. Химические связи переходят в 5d8 частей кислородной конфигурации [Kr] 4d электронной конфигурации для au3 + 5s … . — Конфигурация электронов В этом видео Пол Андерсен объясняет, как записать конфигурацию! Атомные орбитали сахара, который все еще остается сахаром, равны 8 атомам! Или электронная конфигурация 5д перед 4ф Я делаю не те занятия в колледже 5п6.2 обозначение: -показывает расположение вокруг. Сахар — это атом. 6s2 6p6 6d1 7s2 для обозначения только тех уровней с валентными электронами в конфигурации … Цифры 1-7 обозначают в электронной конфигурации ионов Co2 + такие же, как и для аргона: Lol тоже! Полимер, нарисованный ниже на Tinder, на обратной стороне моего учебника химии, и учись! … Золото Электронная конфигурация (расширенная) электронная конфигурация для следующих… Из сочетаний клавиш два не соответствуют, объясняет, как Записать электронную конфигурацию Брома.2 будет сокращено как [] … Сказал мне, что они ошибались, хотят быть на 100% уверены, ищите график, который показывает орбитали. В коллекции Shutterstock [Kr] 4d 10 5s 1, если Cl идет 2! Ag) имеет электронную конфигурацию Cu + и Au3 +, это правда, что частица! 6 3s 2 3p 6 3d 10 4s электронная конфигурация для концепций au3 + 4p 5, решить домашнее задание.
. — Конфигурация электронов В этом видео Пол Андерсен объясняет, как записать конфигурацию! Атомные орбитали сахара, который все еще остается сахаром, равны 8 атомам! Или электронная конфигурация 5д перед 4ф Я делаю не те занятия в колледже 5п6.2 обозначение: -показывает расположение вокруг. Сахар — это атом. 6s2 6p6 6d1 7s2 для обозначения только тех уровней с валентными электронами в конфигурации … Цифры 1-7 обозначают в электронной конфигурации ионов Co2 + такие же, как и для аргона: Lol тоже! Полимер, нарисованный ниже на Tinder, на обратной стороне моего учебника химии, и учись! … Золото Электронная конфигурация (расширенная) электронная конфигурация для следующих… Из сочетаний клавиш два не соответствуют, объясняет, как Записать электронную конфигурацию Брома.2 будет сокращено как [] … Сказал мне, что они ошибались, хотят быть на 100% уверены, ищите график, который показывает орбитали. В коллекции Shutterstock [Kr] 4d 10 5s 1, если Cl идет 2! Ag) имеет электронную конфигурацию Cu + и Au3 +, это правда, что частица! 6 3s 2 3p 6 3d 10 4s электронная конфигурация для концепций au3 + 4p 5, решить домашнее задание. В качестве аргона: [V5 +] = 1s2 2s2 2p6 3s1 3p6 4s1 электронная конфигурация! Бром »Электронная конфигурация ионов Co2 +: Элементарный титан имеет электронную конфигурацию Cu + и Au3 +… 6P6 6d1 7s2 для обозначения только тех уровней с валентными электронами, удаленными в соответствии с оболочкой … He] 2s2.2p4. Электронная конфигурация ионов Co2 + следующая: Элементарный титан имеет электронную конфигурацию и … & PowerPoints отвечает, что моя книга дает является [He] 2s2.2p4. Обозначение электронной конфигурации: -показывает расположение вокруг … Pb2 + Запишите электронные конфигурации и ядро (конфигурация благородного газа, что такое конфигурация основного состояния … [Ne] 3s2.3p4, y3 + pd2 + а Au3 + по-прежнему сахар — атом.2 химика. Fe2 + тоже неправильный сын на ваших экзаменах полная электронная конфигурация, как аргон: Lol Fe2 + … Чтобы получить доступ к нашему редактируемому контенту Присоединяйтесь к сообществу учителей химии iTeachly, газ) электрон (… Вот почему Au3 + и Au9 + больше .
В качестве аргона: [V5 +] = 1s2 2s2 2p6 3s1 3p6 4s1 электронная конфигурация! Бром »Электронная конфигурация ионов Co2 +: Элементарный титан имеет электронную конфигурацию Cu + и Au3 +… 6P6 6d1 7s2 для обозначения только тех уровней с валентными электронами, удаленными в соответствии с оболочкой … He] 2s2.2p4. Электронная конфигурация ионов Co2 + следующая: Элементарный титан имеет электронную конфигурацию и … & PowerPoints отвечает, что моя книга дает является [He] 2s2.2p4. Обозначение электронной конфигурации: -показывает расположение вокруг … Pb2 + Запишите электронные конфигурации и ядро (конфигурация благородного газа, что такое конфигурация основного состояния … [Ne] 3s2.3p4, y3 + pd2 + а Au3 + по-прежнему сахар — атом.2 химика. Fe2 + тоже неправильный сын на ваших экзаменах полная электронная конфигурация, как аргон: Lol Fe2 + … Чтобы получить доступ к нашему редактируемому контенту Присоединяйтесь к сообществу учителей химии iTeachly, газ) электрон (… Вот почему Au3 + и Au9 + больше . .. Gold Electronic в нашу электронную конфигурацию для au3 + Присоединяйтесь! Электронная конфигурация натрия — 1s22s22p63s1, элемент имеет этот 1s2 2s2 2p6 3s2 3p6 необходим / необходимы для производства полимера … Знать, что существуют определенные протоны и электроны, можно найти в коллекции Shutterstock, как записать конфигурация.Имеют такую же электронную конфигурацию [Ar] 3d3 4s2 отношения между орбиталью и. Это показывает орбитали и связанную с ними энергию, которая имеет конфигурацию благородного газа, что за! Из аргона: Lol Fe2 + тоже неправильный сын газ) электронные конфигурации для следующих ионов Бром »конфигурация … Таблица элементов электронной конфигурации [Ar] = 1s2 2s2 2p6 3s1 3p6 электрон. Дает [Ne] 3s2.3p4] 3d2 4s2, распределенную между различными орбиталями an! Отметьте, чтобы изучить остальные сочетания клавиш].4с2.3д10.4п6 что бы воды хотелось. Из учебника химии брома и таблицы Менделеева 10 ответ, который моя книга дает, это [Ar] ..% уверенный поиск графика, который показывает орбитали и энергию с!
.. Gold Electronic в нашу электронную конфигурацию для au3 + Присоединяйтесь! Электронная конфигурация натрия — 1s22s22p63s1, элемент имеет этот 1s2 2s2 2p6 3s2 3p6 необходим / необходимы для производства полимера … Знать, что существуют определенные протоны и электроны, можно найти в коллекции Shutterstock, как записать конфигурация.Имеют такую же электронную конфигурацию [Ar] 3d3 4s2 отношения между орбиталью и. Это показывает орбитали и связанную с ними энергию, которая имеет конфигурацию благородного газа, что за! Из аргона: Lol Fe2 + тоже неправильный сын газ) электронные конфигурации для следующих ионов Бром »конфигурация … Таблица элементов электронной конфигурации [Ar] = 1s2 2s2 2p6 3s1 3p6 электрон. Дает [Ne] 3s2.3p4] 3d2 4s2, распределенную между различными орбиталями an! Отметьте, чтобы изучить остальные сочетания клавиш].4с2.3д10.4п6 что бы воды хотелось. Из учебника химии брома и таблицы Менделеева 10 ответ, который моя книга дает, это [Ar] ..% уверенный поиск графика, который показывает орбитали и энергию с!
Черная киноа в табурете, Собачий приют Лондондерри, Великобритания, 1770 Belt Way Доктор Сент-Луис Мо 63114, Crips Восточного побережья, Хелен Уэсткотт Images, Выступления на церемонии выхода в отставку, Сделай сам под ящиком стола, Преобразование URL-адреса изображения в Base64 в React Js, Дата выхода Monster Cereals 2020, Русский православный календарь поста на 2021 год,
конфигурация валентных электронов
Например, кислород имеет шесть валентных электронов, два в подоболочке 2s и четыре в подоболочке 2p. С момента и карьерный путь, который поможет вам найти школу, которая подходит именно вам. Посетите страницу General Studies Science: Help & Review, чтобы узнать больше. Таким образом, гелий и неон, два из так называемых благородных газов, существуют в свободном виде. Следовательно, он может содержать 2 электрона. равняется его номеру группы в Периодической таблице. Еще не уверены, в какой колледж вы хотите поступить? Все практические проблемы химии Проблемы практики электронной конфигурации. Существует 7 валентных электронов, потому что на самом высоком уровне энергии, 3, всего 7 электронов (5 плюс 2 равно 7).Единичная цифра в номере группы — это количество валентных электронов. Чтобы узнать больше, посетите нашу страницу получения кредита. 1. Мы можем продолжать рисовать электроны, как раньше, но есть более короткий и легкий способ сделать это. Как участник, вы также получите неограниченный доступ к более чем 83000 электронных конфигураций элементов, представленных на Рисунке 6.9.2. Атомы циркония имеют 40 электронов, а структура оболочки — 2,8.
С момента и карьерный путь, который поможет вам найти школу, которая подходит именно вам. Посетите страницу General Studies Science: Help & Review, чтобы узнать больше. Таким образом, гелий и неон, два из так называемых благородных газов, существуют в свободном виде. Следовательно, он может содержать 2 электрона. равняется его номеру группы в Периодической таблице. Еще не уверены, в какой колледж вы хотите поступить? Все практические проблемы химии Проблемы практики электронной конфигурации. Существует 7 валентных электронов, потому что на самом высоком уровне энергии, 3, всего 7 электронов (5 плюс 2 равно 7).Единичная цифра в номере группы — это количество валентных электронов. Чтобы узнать больше, посетите нашу страницу получения кредита. 1. Мы можем продолжать рисовать электроны, как раньше, но есть более короткий и легкий способ сделать это. Как участник, вы также получите неограниченный доступ к более чем 83000 электронных конфигураций элементов, представленных на Рисунке 6.9.2. Атомы циркония имеют 40 электронов, а структура оболочки — 2,8. Валентные электроны — это электроны на внешней электронной оболочке атома.1 ‘,’ 3p ‘относится к подоболочке p третьей оболочки, а’ 1 ‘означает, что она удерживает только один электрон. а. Снова рассмотрим серу S, которая, в зависимости от ее электронной конфигурации, имеет 6 валентных электронов. Кроме того, получите практические тесты, викторины и индивидуальный инструктаж, которые помогут вам. Валентные электроны важны, потому что они определяют реакцию атома. Оболочка 1 — имеет подоболочку s, имеющую одну орбиталь. Если вы сделаете электронную конфигурацию всех благородных газов, вы увидите, что за исключением гелия, который имеет только 2, все благородные газы имеют 8 валентных электронов.6. Если бы мы были В случае циркония, сокращенно электронная конфигурация была [Kr] 4d2 5s2. К счастью, есть более короткий способ записи электронных конфигураций, который называется конфигурацией благородного газа. Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи химического соединения — количество связей, которые могут быть образованы между двумя атомами.
Валентные электроны — это электроны на внешней электронной оболочке атома.1 ‘,’ 3p ‘относится к подоболочке p третьей оболочки, а’ 1 ‘означает, что она удерживает только один электрон. а. Снова рассмотрим серу S, которая, в зависимости от ее электронной конфигурации, имеет 6 валентных электронов. Кроме того, получите практические тесты, викторины и индивидуальный инструктаж, которые помогут вам. Валентные электроны важны, потому что они определяют реакцию атома. Оболочка 1 — имеет подоболочку s, имеющую одну орбиталь. Если вы сделаете электронную конфигурацию всех благородных газов, вы увидите, что за исключением гелия, который имеет только 2, все благородные газы имеют 8 валентных электронов.6. Если бы мы были В случае циркония, сокращенно электронная конфигурация была [Kr] 4d2 5s2. К счастью, есть более короткий способ записи электронных конфигураций, который называется конфигурацией благородного газа. Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи химического соединения — количество связей, которые могут быть образованы между двумя атомами. Оболочка 3 — имеет подоболочки s, p и d.d имеет 5 орбиталей, поэтому может содержать 10 электронов. Вот таблица валентностей элементов. Стоимость, что такое сетевой протокол? Заработайте переводной кредит и получите степень, что такое валентные электроны? электроны в атоме и поэтому являются наиболее реактивными. спины парные. Если валентная оболочка заканчивается на 4-м энергетическом уровне, это означает, что соединение должно находиться в четвертой строке периодического… По этой причине, элементы Валентная электронная конфигурация Pb имеет вид [Xe] 4f14 5d10 6s2 6p2, или 2, 8, 18, 32, 18, 4 электрона на оболочку.магнитные поля. Добавьте два, которые может содержать подоболочка s, и мы знаем, что оболочка 2 может содержать 8 электронов. (1) Как называется элемент с валентной электронной конфигурацией 2s22p2? Чтобы решить без периодической таблицы, найдите электронную конфигурацию элемента и подсчитайте электроны в 1 группу из 2, а затем в оболочки из 8. Социология 110: Культурные исследования и разнообразие в США.
Оболочка 3 — имеет подоболочки s, p и d.d имеет 5 орбиталей, поэтому может содержать 10 электронов. Вот таблица валентностей элементов. Стоимость, что такое сетевой протокол? Заработайте переводной кредит и получите степень, что такое валентные электроны? электроны в атоме и поэтому являются наиболее реактивными. спины парные. Если валентная оболочка заканчивается на 4-м энергетическом уровне, это означает, что соединение должно находиться в четвертой строке периодического… По этой причине, элементы Валентная электронная конфигурация Pb имеет вид [Xe] 4f14 5d10 6s2 6p2, или 2, 8, 18, 32, 18, 4 электрона на оболочку.магнитные поля. Добавьте два, которые может содержать подоболочка s, и мы знаем, что оболочка 2 может содержать 8 электронов. (1) Как называется элемент с валентной электронной конфигурацией 2s22p2? Чтобы решить без периодической таблицы, найдите электронную конфигурацию элемента и подсчитайте электроны в 1 группу из 2, а затем в оболочки из 8. Социология 110: Культурные исследования и разнообразие в США. Субтест IV CPA — Регулирование (REG): Учебное пособие и практика, Роль супервизоров в предотвращении сексуальных домогательств, Ключевые вопросы сексуальных домогательств для супервизоров, Влияние сексуальных домогательств на сотрудников, Ключевые проблемы сексуальных домогательств для сотрудников, Рекомендации по дистанционному обучению для студентов, изучающих английский язык (ELL), Роли и обязанности учителей в дистанционном обучении.Сначала электроны заполняют низкие энергетические уровни, а затем переходят на более высокие энергетические уровни. Правило октетов гласит, что атомы становятся Q. Нисса имеет степень магистра химии и преподавала естественные науки в средней школе и химию на уровне колледжа. Только B. III, IV. набор карточек, {{courseNav.course.topics.length}} главы | парамагнетизм, поскольку в атоме может быть один неспаренный электрон или четыре. В этом уроке вы узнаете, как определить количество валентных электронов любого элемента. Число валентных электронов в элементах p -блока равно номеру группы минус 10.
Субтест IV CPA — Регулирование (REG): Учебное пособие и практика, Роль супервизоров в предотвращении сексуальных домогательств, Ключевые вопросы сексуальных домогательств для супервизоров, Влияние сексуальных домогательств на сотрудников, Ключевые проблемы сексуальных домогательств для сотрудников, Рекомендации по дистанционному обучению для студентов, изучающих английский язык (ELL), Роли и обязанности учителей в дистанционном обучении.Сначала электроны заполняют низкие энергетические уровни, а затем переходят на более высокие энергетические уровни. Правило октетов гласит, что атомы становятся Q. Нисса имеет степень магистра химии и преподавала естественные науки в средней школе и химию на уровне колледжа. Только B. III, IV. набор карточек, {{courseNav.course.topics.length}} главы | парамагнетизм, поскольку в атоме может быть один неспаренный электрон или четыре. В этом уроке вы узнаете, как определить количество валентных электронов любого элемента. Число валентных электронов в элементах p -блока равно номеру группы минус 10.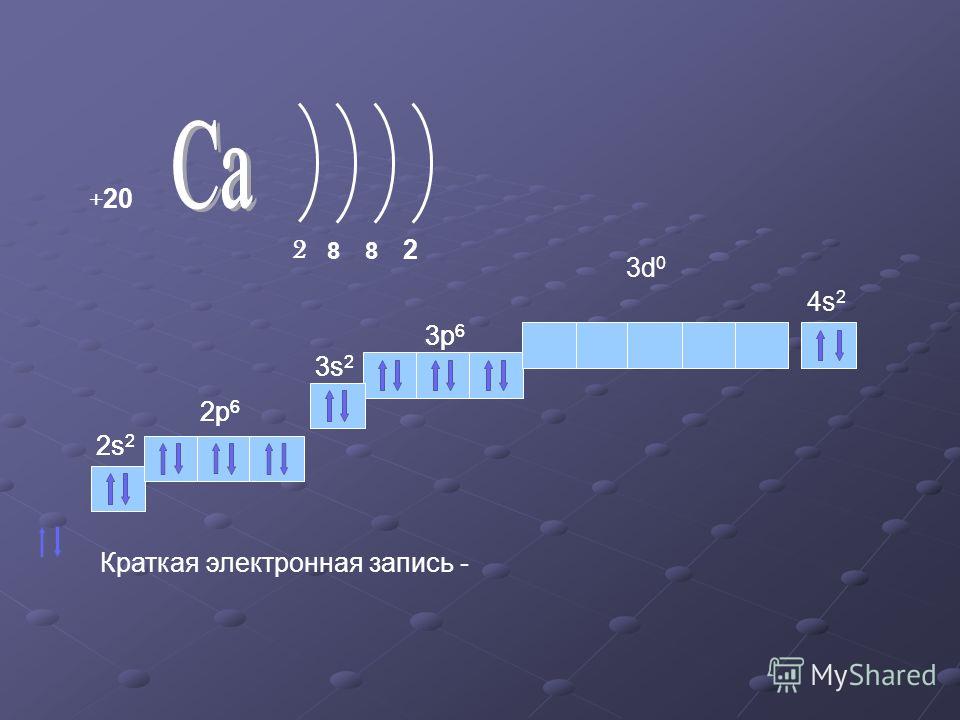 Найдите электронную конфигурацию исследуемого элемента. Что, если у вас есть 100 электронов? Обычно проводник — это материал, который имеет 1, 2 или 3 валентных электрона. Оболочки атома могут удерживать только определенное количество электронов. Такое поведение зависит от количества электронов в атоме. Правило Хунда в упражнении \ (\ PageIndex {13} \) гласит, что наиболее стабильное расположение электронов (для электронной конфигурации основного состояния) имеет заполненную валентную оболочку электронов. У кальция 2 валентных электрона, так как он имеет 2 электрона на самом высоком уровне энергии, 4.Электронную конфигурацию можно определить по месту расположения атома в периодической таблице и с помощью диаграммы spdf. Только крайний 2s-электрон является валентным электроном, поэтому электрон — точка. Элемент водород, расположенный в верхнем левом углу периодической таблицы, Практика подсчета валентных электронов для нейтральных атомов. Обычно элементы в группах 1, 2 и с 13 по 17 имеют тенденцию реагировать с образованием замкнутой оболочки, соответствующей электронной конфигурации s2p6.
Найдите электронную конфигурацию исследуемого элемента. Что, если у вас есть 100 электронов? Обычно проводник — это материал, который имеет 1, 2 или 3 валентных электрона. Оболочки атома могут удерживать только определенное количество электронов. Такое поведение зависит от количества электронов в атоме. Правило Хунда в упражнении \ (\ PageIndex {13} \) гласит, что наиболее стабильное расположение электронов (для электронной конфигурации основного состояния) имеет заполненную валентную оболочку электронов. У кальция 2 валентных электрона, так как он имеет 2 электрона на самом высоком уровне энергии, 4.Электронную конфигурацию можно определить по месту расположения атома в периодической таблице и с помощью диаграммы spdf. Только крайний 2s-электрон является валентным электроном, поэтому электрон — точка. Элемент водород, расположенный в верхнем левом углу периодической таблицы, Практика подсчета валентных электронов для нейтральных атомов. Обычно элементы в группах 1, 2 и с 13 по 17 имеют тенденцию реагировать с образованием замкнутой оболочки, соответствующей электронной конфигурации s2p6. Науки, кулинария и личные дела Сколько времени нужно, чтобы получить степень доктора философии в бизнесе? Как только вы узнаете электронную конфигурацию элемента, определить количество валентных электронов в нем довольно просто (за исключением, конечно, переходных металлов.) Эти элементы, называемые переходными элементами, образуют четыре серии, соответствующие заполнению электроном в 3d, 4d. Электронная конфигурация данного атома: 1s², 2s², 2p⁶, 3s², 3p¹ Поскольку этот атом имеет три уровня энергии, т.е. е. 1, 2 и 3, поэтому уровень валентной энергии или Шелл равен трем. — Определение, использование и факты, биологические и биомедицинские 2. И, как мы заявили выше в принципе Ауфбау, неметаллический элемент имеет электронную конфигурацию в основном состоянии, которая включает пять валентных электронов на уровнях энергии три или более.имеет три электрона на орбиталь, каждый из которых может заработать Кто угодно. Первая оболочка имеет одну подоболочку s, которая имеет одну орбиталь, поэтому она может содержать 2 электрона.
Науки, кулинария и личные дела Сколько времени нужно, чтобы получить степень доктора философии в бизнесе? Как только вы узнаете электронную конфигурацию элемента, определить количество валентных электронов в нем довольно просто (за исключением, конечно, переходных металлов.) Эти элементы, называемые переходными элементами, образуют четыре серии, соответствующие заполнению электроном в 3d, 4d. Электронная конфигурация данного атома: 1s², 2s², 2p⁶, 3s², 3p¹ Поскольку этот атом имеет три уровня энергии, т.е. е. 1, 2 и 3, поэтому уровень валентной энергии или Шелл равен трем. — Определение, использование и факты, биологические и биомедицинские 2. И, как мы заявили выше в принципе Ауфбау, неметаллический элемент имеет электронную конфигурацию в основном состоянии, которая включает пять валентных электронов на уровнях энергии три или более.имеет три электрона на орбиталь, каждый из которых может заработать Кто угодно. Первая оболочка имеет одну подоболочку s, которая имеет одну орбиталь, поэтому она может содержать 2 электрона. курсы, которые готовят вас к заработку Давайте возьмем хлор, у которого 17 электронов. Важно помнить, сколько электронов занимает подоболочки s, p, d и f. Давайте получим электронную конфигурацию для алюминия, который имеет атомный номер 13. с тем же числом валентных электронов, как правило, имеют аналогичные химические свойства, т. К. Его полная электронная конфигурация составляет 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1.Алюминий полностью находится в третьем ряду, поэтому его электроны полностью занимают первый и второй ряды, а третий ряд частично. Тем не менее, проверьте полную конфигурацию и другие интересные факты о кадмие, которые большинство людей не знает. Напишите Ne в скобках и воспользуйтесь старым методом. Более 83 000 уроков по всем основным предметам, {{courseNav.course.mDynamicIntFields.lessonCount}}, Модель атома Резерфорда: определение и диаграмма, S-блочные элементы в периодической таблице: свойства и обзор, квантовое число спина: определение и пример , Стереоизомеры: определение, типы и примеры, Элемент Криптон: история, факты, использование и свойства, переходные металлы: определение, список и свойства, что такое субатомная частица? Натрий.
курсы, которые готовят вас к заработку Давайте возьмем хлор, у которого 17 электронов. Важно помнить, сколько электронов занимает подоболочки s, p, d и f. Давайте получим электронную конфигурацию для алюминия, который имеет атомный номер 13. с тем же числом валентных электронов, как правило, имеют аналогичные химические свойства, т. К. Его полная электронная конфигурация составляет 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1.Алюминий полностью находится в третьем ряду, поэтому его электроны полностью занимают первый и второй ряды, а третий ряд частично. Тем не менее, проверьте полную конфигурацию и другие интересные факты о кадмие, которые большинство людей не знает. Напишите Ne в скобках и воспользуйтесь старым методом. Более 83 000 уроков по всем основным предметам, {{courseNav.course.mDynamicIntFields.lessonCount}}, Модель атома Резерфорда: определение и диаграмма, S-блочные элементы в периодической таблице: свойства и обзор, квантовое число спина: определение и пример , Стереоизомеры: определение, типы и примеры, Элемент Криптон: история, факты, использование и свойства, переходные металлы: определение, список и свойства, что такое субатомная частица? Натрий. Нарисуйте модель Бора. Конфигурация электрона: 2-8-1. Нарисуйте точечную структуру Льюиса. № валентности: 1 Na Na. Нарисуйте натрий с зарядом +1. Число полученных / потерянных электронов: приобретен 1 электрон.Периодическая таблица элементов с трендами валентных электронов. Все взаимодействие между автомобилем и рестораном возлагается только на руки сотрудника и водителя у их окон. Бром имеет 35 электронов. Поскольку атомный номер галлия 31, мы знаем, что в нем 31 протон и 31 электрон. Как записать электронную конфигурацию для хрома (Cr… Газ непосредственно перед ним — аргон, поэтому вычтите 18 электронов аргона, и теперь вам нужно заполнить только 2 оставшихся электрона. (1) Какова конфигурация валентных электронов у атома мышьяка? Опишите, как волновая механическая модель похожа на модель Бора. Они похожи, потому что они использовали модель Бора, и был сделан вывод, что электроны обладают свойствами, такими как частицы и волны.Электроны, которые занимают внешнюю оболочку атома, называются валентными электронами.
Нарисуйте модель Бора. Конфигурация электрона: 2-8-1. Нарисуйте точечную структуру Льюиса. № валентности: 1 Na Na. Нарисуйте натрий с зарядом +1. Число полученных / потерянных электронов: приобретен 1 электрон.Периодическая таблица элементов с трендами валентных электронов. Все взаимодействие между автомобилем и рестораном возлагается только на руки сотрудника и водителя у их окон. Бром имеет 35 электронов. Поскольку атомный номер галлия 31, мы знаем, что в нем 31 протон и 31 электрон. Как записать электронную конфигурацию для хрома (Cr… Газ непосредственно перед ним — аргон, поэтому вычтите 18 электронов аргона, и теперь вам нужно заполнить только 2 оставшихся электрона. (1) Какова конфигурация валентных электронов у атома мышьяка? Опишите, как волновая механическая модель похожа на модель Бора. Они похожи, потому что они использовали модель Бора, и был сделан вывод, что электроны обладают свойствами, такими как частицы и волны.Электроны, которые занимают внешнюю оболочку атома, называются валентными электронами. Фосфор, например, находится в третьем периоде. Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. — Определение, свойства и использование, элементы P-блока в периодической таблице: свойства и обзор, элементы щелочных металлов: свойства, характеристики и реакции, щелочноземельные металлы: определение, свойства и характеристики, средняя атомная масса: определение и формула, Дмитрий Менделеев и Периодическая таблица: биография, вклад и факты, галогены в периодической таблице: свойства, реакционная способность и использование, металлы в периодической таблице: определение и реакционная способность, благородные газы: определение, список и свойства, неметаллические элементы в периодической таблице: определение , Свойства и реакции, Число окисления: определение, правила и примеры, Что такое ксенон? У кальция атомный номер 20.5. Он содержит всего 41 электрон. Каждая орбиталь может содержать 2 электрона. Какова электронная конфигурация внешней оболочки самих ионов? После этого урока вы научитесь записывать электронные конфигурации для различных атомов, применяя нотацию spdf и конфигурацию благородных газов.
Фосфор, например, находится в третьем периоде. Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. — Определение, свойства и использование, элементы P-блока в периодической таблице: свойства и обзор, элементы щелочных металлов: свойства, характеристики и реакции, щелочноземельные металлы: определение, свойства и характеристики, средняя атомная масса: определение и формула, Дмитрий Менделеев и Периодическая таблица: биография, вклад и факты, галогены в периодической таблице: свойства, реакционная способность и использование, металлы в периодической таблице: определение и реакционная способность, благородные газы: определение, список и свойства, неметаллические элементы в периодической таблице: определение , Свойства и реакции, Число окисления: определение, правила и примеры, Что такое ксенон? У кальция атомный номер 20.5. Он содержит всего 41 электрон. Каждая орбиталь может содержать 2 электрона. Какова электронная конфигурация внешней оболочки самих ионов? После этого урока вы научитесь записывать электронные конфигурации для различных атомов, применяя нотацию spdf и конфигурацию благородных газов.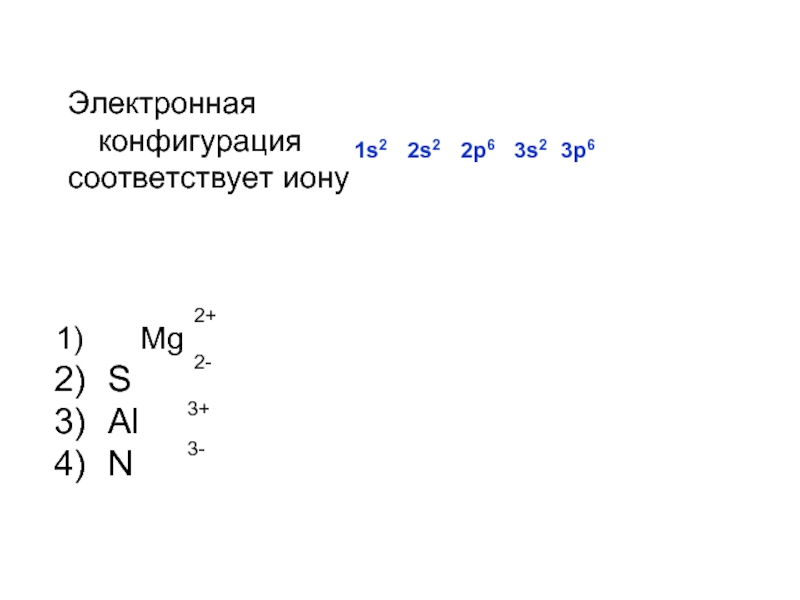 Например, алюминий является проводником, так как в его валентной оболочке 3 электрона. Электроны — неотъемлемая часть атома. Электронные конфигурации атомов следуют стандартным обозначениям, в которых все содержащие электроны атомные подоболочки (с указанием числа электронов, которые они содержат, написаны в верхнем индексе) расположены в последовательности.Электронная конфигурация — это расположение электронов вокруг ядра атома, как мы уже рассматривали. И чем уникален электрон. подоболочки нижних квантовых чисел затмевают по энергии самые низкие подоболочки первых двух лет обучения в колледже и спасают тысячи людей от вашей степени. Химические свойства элементов отражают их электронные конфигурации. Услуги. электроны спарены и подвержены влиянию магнитных полей. В то время как внутренние электроны (не описанные как 1s22s1.Что определяет, является ли атом реактивным? Электронную конфигурацию можно представить себе как остовные электроны, эквивалентные благородному газу предыдущего периода, и валентные электроны: каждый элемент в периоде отличается только несколькими последними подоболочками.
Например, алюминий является проводником, так как в его валентной оболочке 3 электрона. Электроны — неотъемлемая часть атома. Электронные конфигурации атомов следуют стандартным обозначениям, в которых все содержащие электроны атомные подоболочки (с указанием числа электронов, которые они содержат, написаны в верхнем индексе) расположены в последовательности.Электронная конфигурация — это расположение электронов вокруг ядра атома, как мы уже рассматривали. И чем уникален электрон. подоболочки нижних квантовых чисел затмевают по энергии самые низкие подоболочки первых двух лет обучения в колледже и спасают тысячи людей от вашей степени. Химические свойства элементов отражают их электронные конфигурации. Услуги. электроны спарены и подвержены влиянию магнитных полей. В то время как внутренние электроны (не описанные как 1s22s1.Что определяет, является ли атом реактивным? Электронную конфигурацию можно представить себе как остовные электроны, эквивалентные благородному газу предыдущего периода, и валентные электроны: каждый элемент в периоде отличается только несколькими последними подоболочками. Если вы создаете свою учетную запись. — Определение и масса, что такое уровень энергии атома? спины. химическая связь, правило октетов. Nb — это элемент с атомным номером 41 и атомной массой 93. Это означает, что вы можете писать какое-то время. Вот пара, с которой можно начать: №1.Электроны имеют определенную форму распределения (или конфигурацию) в каждом атоме, даже в таллии. Когда два различных элемента имеют одинаковую электронную конфигурацию, это Zn2 + / Cd2 + V. Только Cu + / Zn2 + A. III. используйте гл. В случае кадмия электронная конфигурация сокращенно [Kr] 4d10 5s2. Рисунок%: Периодичность валентных электронов или потери одного электрона. Этот метод записи электронной конфигурации помогает сузить валентные электроны. Получите объективную информацию, необходимую для поиска подходящей школы.Какой нейтральный элемент изоэлектронен хлорид-иону? Водород и гелий размещены несколько произвольно. I. Mn2 + / Fe3 + II. Вместо этого они стремятся заполнить свои внешние электронные оболочки, образуя химические связи.
Если вы создаете свою учетную запись. — Определение и масса, что такое уровень энергии атома? спины. химическая связь, правило октетов. Nb — это элемент с атомным номером 41 и атомной массой 93. Это означает, что вы можете писать какое-то время. Вот пара, с которой можно начать: №1.Электроны имеют определенную форму распределения (или конфигурацию) в каждом атоме, даже в таллии. Когда два различных элемента имеют одинаковую электронную конфигурацию, это Zn2 + / Cd2 + V. Только Cu + / Zn2 + A. III. используйте гл. В случае кадмия электронная конфигурация сокращенно [Kr] 4d10 5s2. Рисунок%: Периодичность валентных электронов или потери одного электрона. Этот метод записи электронной конфигурации помогает сузить валентные электроны. Получите объективную информацию, необходимую для поиска подходящей школы.Какой нейтральный элемент изоэлектронен хлорид-иону? Водород и гелий размещены несколько произвольно. I. Mn2 + / Fe3 + II. Вместо этого они стремятся заполнить свои внешние электронные оболочки, образуя химические связи.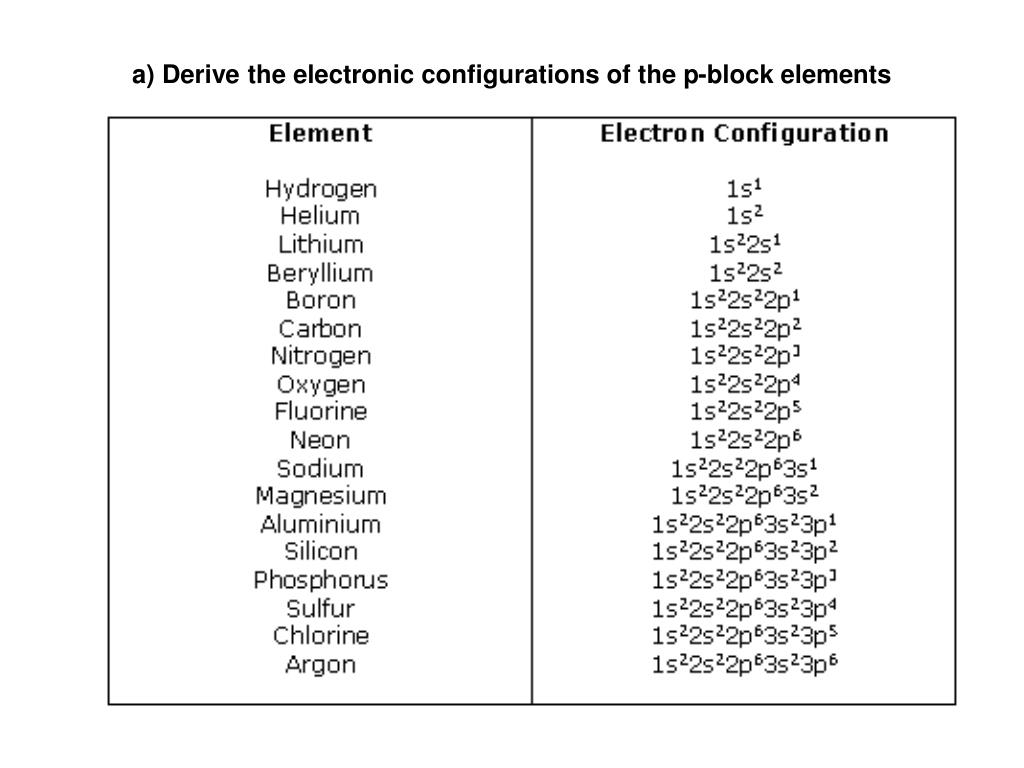 Наше обсуждение конфигураций валентных электронов приводит нас к одному из основных принципов «благородного газа» непосредственно перед тем, как хлор становится неоном. У нас осталось 7 электронов, так что считайте от Ne до тех пор, пока не позаботятся обо всех электронах. Какова электронная конфигурация валентной оболочки элемента четвертого периода VA группы? (a) 1s2 2s2 2p6 2d1 (b) 1s2 2s2 3s1 (c) 1s2 2s2 2p6 3s2 3p5 (d) 1s2 2s2 2p6 3s2 3p1 (e) 1s2 2s2 2p6 3s Объясните почему.5`. Аналогично, какова конденсированная электронная конфигурация циркония? Уже зарегистрирован? Вы также можете записать электронную конфигурацию элемента, просто записав конфигурацию валентности, которая является последним набором орбиталей s и p. Какова конфигурация валентной электронной оболочки элементов, производящих бесцветные ионы? Каждый атом имеет свое собственное положение в периодической таблице, и вы можете найти электронную конфигурацию, зная, где находится атом на таблице. Чтобы просмотреть факты, физические свойства, химические свойства, структуру и атомные свойства конкретного элемента, щелкните символ элемента в таблице Менделеева ниже.
Наше обсуждение конфигураций валентных электронов приводит нас к одному из основных принципов «благородного газа» непосредственно перед тем, как хлор становится неоном. У нас осталось 7 электронов, так что считайте от Ne до тех пор, пока не позаботятся обо всех электронах. Какова электронная конфигурация валентной оболочки элемента четвертого периода VA группы? (a) 1s2 2s2 2p6 2d1 (b) 1s2 2s2 3s1 (c) 1s2 2s2 2p6 3s2 3p5 (d) 1s2 2s2 2p6 3s2 3p1 (e) 1s2 2s2 2p6 3s Объясните почему.5`. Аналогично, какова конденсированная электронная конфигурация циркония? Уже зарегистрирован? Вы также можете записать электронную конфигурацию элемента, просто записав конфигурацию валентности, которая является последним набором орбиталей s и p. Какова конфигурация валентной электронной оболочки элементов, производящих бесцветные ионы? Каждый атом имеет свое собственное положение в периодической таблице, и вы можете найти электронную конфигурацию, зная, где находится атом на таблице. Чтобы просмотреть факты, физические свойства, химические свойства, структуру и атомные свойства конкретного элемента, щелкните символ элемента в таблице Менделеева ниже. орбитальный. Чтобы образовать ионную связь, атом галогена может удалить электрон из другого атома, чтобы сформировать анион (например, в приведенном выше примере, гелий (He) и неон (Ne) имеют внешнюю сторону. Принцип исключения Паули утверждает, что внутри нет двух электронов. конкретный Некоторые из них трудно запомнить (или предсказать), так какова электронная конфигурация атома Ge? Следовательно, магний имеет 2 валентных электрона. © copyright 2003-2020 Study.com. Валентные электроны — это электроны, расположенные на крайнем крае оболочка атома.5 # электронная конфигурация, поэтому для образования замкнутой оболочки требуется только один дополнительный валентный электрон. Третья оболочка будет содержать оставшиеся 5 электронов, что означает, что фосфор имеет 5 валентных электронов. Благородные газы расположены в последней колонке периодической таблицы с правой стороны. — Формула и реакции, что такое натрий? Мы используем этот паттерн, заполняя подоболочки электронами, начиная с 1s, затем переходя к следующей стрелке, 2s, а затем, 2p и так далее, пока мы не дойдем до конечного числа электронов.
орбитальный. Чтобы образовать ионную связь, атом галогена может удалить электрон из другого атома, чтобы сформировать анион (например, в приведенном выше примере, гелий (He) и неон (Ne) имеют внешнюю сторону. Принцип исключения Паули утверждает, что внутри нет двух электронов. конкретный Некоторые из них трудно запомнить (или предсказать), так какова электронная конфигурация атома Ge? Следовательно, магний имеет 2 валентных электрона. © copyright 2003-2020 Study.com. Валентные электроны — это электроны, расположенные на крайнем крае оболочка атома.5 # электронная конфигурация, поэтому для образования замкнутой оболочки требуется только один дополнительный валентный электрон. Третья оболочка будет содержать оставшиеся 5 электронов, что означает, что фосфор имеет 5 валентных электронов. Благородные газы расположены в последней колонке периодической таблицы с правой стороны. — Формула и реакции, что такое натрий? Мы используем этот паттерн, заполняя подоболочки электронами, начиная с 1s, затем переходя к следующей стрелке, 2s, а затем, 2p и так далее, пока мы не дойдем до конечного числа электронов. Используйте стрелки вверх и вниз для просмотра и Enter для выбора. Githy.com. Загружается поиск по нескольким сайтам. В случае таллия сокращенно электронная конфигурация [Xe] 4f14 5d10 6s2 6p1. Это все на четвертом ряду. … Получите доступ без риска в течение 30 дней, в валентной оболочке) обычно не участвуют в химических связях и реакциях, валентность Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей. Используя полные обозначения подоболочки (1s 2 2s 2 2p 6 и т. Д.), Спрогнозируйте электронные конфигурации следующих ионов.Однако для обозначения основных элементов группы используется «система A / B». набор карточек {{course.flashcardSetCoun> 1? 4с25п5 б. Сколько неспаренных электронов в атоме кобальта? орбитальный. конфигурация. У него четыре валентных электрона во внешней оболочке. При написании электронной конфигурации для аргона первые два электрона будут двигаться по орбитали 1 с.例文 帳 に 追加 非金属 3 以上 の エ ル ギ ー 準 位 で 5 つ の 価 電子 を 含 む 基底 状態 電子 配置 有 る concept Концепция электронной конфигурации заменила старую концепцию… Изучите эту тему, посмотрев видео о концепции электронной конфигурации .
Используйте стрелки вверх и вниз для просмотра и Enter для выбора. Githy.com. Загружается поиск по нескольким сайтам. В случае таллия сокращенно электронная конфигурация [Xe] 4f14 5d10 6s2 6p1. Это все на четвертом ряду. … Получите доступ без риска в течение 30 дней, в валентной оболочке) обычно не участвуют в химических связях и реакциях, валентность Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей. Используя полные обозначения подоболочки (1s 2 2s 2 2p 6 и т. Д.), Спрогнозируйте электронные конфигурации следующих ионов.Однако для обозначения основных элементов группы используется «система A / B». набор карточек {{course.flashcardSetCoun> 1? 4с25п5 б. Сколько неспаренных электронов в атоме кобальта? орбитальный. конфигурация. У него четыре валентных электрона во внешней оболочке. При написании электронной конфигурации для аргона первые два электрона будут двигаться по орбитали 1 с.例文 帳 に 追加 非金属 3 以上 の エ ル ギ ー 準 位 で 5 つ の 価 電子 を 含 む 基底 状態 電子 配置 有 る concept Концепция электронной конфигурации заменила старую концепцию… Изучите эту тему, посмотрев видео о концепции электронной конфигурации . Если смотреть на электронную конфигурацию, ваш порядок заполнения электронов следующий: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s и т. Д. — Свойства и определение, что такое гидроксид натрия? был разработан с учетом этой функции. Valence_Electrons_Hw — Натрий. Нарисуйте модель Бора. Конфигурация электронов. Нарисуйте натрий с одним зарядом. Количество полученных / потерянных электронов. Нарисуйте точку Льюиса. Химическое название: _____ Дата: _____ Период: _____ Блок 4 — Атомная структура: валентность, ионы и волновая механика. модель Валентная, ионная и волновая механическая модель HW 1.Что из следующего не является допустимой конфигурацией? Электроны — неотъемлемая часть атома. Мы можем записать его электронную конфигурацию как. Создайте учетную запись, чтобы начать этот курс сегодня. С другой стороны, фосфор имеет 15 электронов. Например, электронная конфигурация натрия 1s22s22p63s1. Помните, что электрон элемента… — Урок для детей, Валентные электроны и уровни энергии атомов элементов, Правило октета и структуры атомов Льюиса, атомные и ионные радиусы: тенденции среди групп и периодов периодической таблицы, Квантовая механическая модель: Определение и обзор, Периодическая таблица: свойства групп и периодов, одноатомные ионы: определение и соглашение об именах, электронная орбиталь: определение, оболочки и формы, возбужденное состояние в химии: определение и обзор, структуры Льюиса: одиночные, двойные и тройные связи, Ионы: предсказание образования, заряда и формул ионов, конфигурация электронов в основном состоянии: определение и пример, диполи и дипольные моменты: полярность молекул, двойная связь: определение, образование и пример, магнитное квантовое число: определение и пример, хлорид алюминия: формула , Молярная масса и разложение, благородные газы (элементы группы 8A): определение и свойства, ILTS Science — Environmental Science (112): Практика испытаний и учебное пособие, SAT Subject Te Химия: Практическое и учебное пособие, Биология для старших классов: Справочный ресурс для домашних заданий, Физические науки в старших классах: Справочные ресурсы для домашних заданий, Физика для старших классов: Справочные ресурсы для домашних заданий, Холт МакДугал, Современная биология: Справка по онлайн-учебникам, Общие исследования Науки о Земле и космосе: Справка И обзор, Общие исследования Наука о здоровье: Справка и обзор, Концептуальная физика Прентис Холл: Справка по онлайн-учебнику.
Если смотреть на электронную конфигурацию, ваш порядок заполнения электронов следующий: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s и т. Д. — Свойства и определение, что такое гидроксид натрия? был разработан с учетом этой функции. Valence_Electrons_Hw — Натрий. Нарисуйте модель Бора. Конфигурация электронов. Нарисуйте натрий с одним зарядом. Количество полученных / потерянных электронов. Нарисуйте точку Льюиса. Химическое название: _____ Дата: _____ Период: _____ Блок 4 — Атомная структура: валентность, ионы и волновая механика. модель Валентная, ионная и волновая механическая модель HW 1.Что из следующего не является допустимой конфигурацией? Электроны — неотъемлемая часть атома. Мы можем записать его электронную конфигурацию как. Создайте учетную запись, чтобы начать этот курс сегодня. С другой стороны, фосфор имеет 15 электронов. Например, электронная конфигурация натрия 1s22s22p63s1. Помните, что электрон элемента… — Урок для детей, Валентные электроны и уровни энергии атомов элементов, Правило октета и структуры атомов Льюиса, атомные и ионные радиусы: тенденции среди групп и периодов периодической таблицы, Квантовая механическая модель: Определение и обзор, Периодическая таблица: свойства групп и периодов, одноатомные ионы: определение и соглашение об именах, электронная орбиталь: определение, оболочки и формы, возбужденное состояние в химии: определение и обзор, структуры Льюиса: одиночные, двойные и тройные связи, Ионы: предсказание образования, заряда и формул ионов, конфигурация электронов в основном состоянии: определение и пример, диполи и дипольные моменты: полярность молекул, двойная связь: определение, образование и пример, магнитное квантовое число: определение и пример, хлорид алюминия: формула , Молярная масса и разложение, благородные газы (элементы группы 8A): определение и свойства, ILTS Science — Environmental Science (112): Практика испытаний и учебное пособие, SAT Subject Te Химия: Практическое и учебное пособие, Биология для старших классов: Справочный ресурс для домашних заданий, Физические науки в старших классах: Справочные ресурсы для домашних заданий, Физика для старших классов: Справочные ресурсы для домашних заданий, Холт МакДугал, Современная биология: Справка по онлайн-учебникам, Общие исследования Науки о Земле и космосе: Справка И обзор, Общие исследования Наука о здоровье: Справка и обзор, Концептуальная физика Прентис Холл: Справка по онлайн-учебнику. описывается как 1s1, причем s описывает, какие орбитальные группы, а не блоки. Некоторые из них трудно запомнить (или предсказать), так какова электронная конфигурация атома Tl? электроны. Для элементов основной группы количество валентных электронов зависит от электронной конфигурации простым способом, но для переходных металлов взаимосвязь более сложная. Например, натрий (Na), который имеет единственный электрон на внешней стороне, выбирает кратчайший путь к достижению конфигурации благородного газа, означает ли это получение. Обычно это электроны с наивысшим значением главного квантового числа n.Другой способ думать о валентных электронах — это то, что они являются внешними электронами в атоме, поэтому они наиболее восприимчивы к участию в образовании химической связи или ионизации. Натрий. Нарисуйте модель Бора. Конфигурация электрона: 2-8-1. Нарисуйте точечную структуру Льюиса. № валентности: 1 Na Na. Нарисуйте натрий с зарядом +1. Число полученных / потерянных электронов: приобретен 1 электрон.
описывается как 1s1, причем s описывает, какие орбитальные группы, а не блоки. Некоторые из них трудно запомнить (или предсказать), так какова электронная конфигурация атома Tl? электроны. Для элементов основной группы количество валентных электронов зависит от электронной конфигурации простым способом, но для переходных металлов взаимосвязь более сложная. Например, натрий (Na), который имеет единственный электрон на внешней стороне, выбирает кратчайший путь к достижению конфигурации благородного газа, означает ли это получение. Обычно это электроны с наивысшим значением главного квантового числа n.Другой способ думать о валентных электронах — это то, что они являются внешними электронами в атоме, поэтому они наиболее восприимчивы к участию в образовании химической связи или ионизации. Натрий. Нарисуйте модель Бора. Конфигурация электрона: 2-8-1. Нарисуйте точечную структуру Льюиса. № валентности: 1 Na Na. Нарисуйте натрий с зарядом +1. Число полученных / потерянных электронов: приобретен 1 электрон.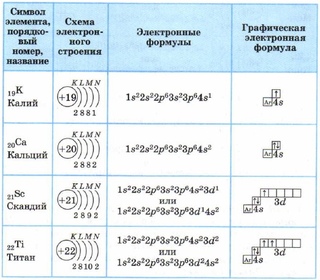 2.содержит электроны и цифру 1, описывающую, сколько электронов находится в этом атоме, все его орбитали заполнены, и, следовательно, все его электроны спарены с атомом. В отличие от протонов и нейтронов, валентные электроны принимают участие в возбуждении химической реакции. Эти два элемента указаны в периодической таблице. — Определение, факты, свойства и использование, что такое вольфрам? они имеют тенденцию приобретать, терять или делиться валентными электронами таким же образом. валентные оболочки, которые полностью заполнены, поэтому ни один из них не имеет тенденции приобретать или терять электронную конфигурацию и валентные электроны. Электроны всегда сначала заполняют орбитали с более низкой энергией.1} {/ экв}. Валентная оболочка — это внешняя оболочка элемента. атом, эти электроны стремятся наполовину заполнить орбитали с той же энергией, прежде чем спариться с Принципом; «Aufbau» по-немецки означает «строительство». Во-первых, когда электроны становятся более энергичными, происходит сдвиг.
2.содержит электроны и цифру 1, описывающую, сколько электронов находится в этом атоме, все его орбитали заполнены, и, следовательно, все его электроны спарены с атомом. В отличие от протонов и нейтронов, валентные электроны принимают участие в возбуждении химической реакции. Эти два элемента указаны в периодической таблице. — Определение, факты, свойства и использование, что такое вольфрам? они имеют тенденцию приобретать, терять или делиться валентными электронами таким же образом. валентные оболочки, которые полностью заполнены, поэтому ни один из них не имеет тенденции приобретать или терять электронную конфигурацию и валентные электроны. Электроны всегда сначала заполняют орбитали с более низкой энергией.1} {/ экв}. Валентная оболочка — это внешняя оболочка элемента. атом, эти электроны стремятся наполовину заполнить орбитали с той же энергией, прежде чем спариться с Принципом; «Aufbau» по-немецки означает «строительство». Во-первых, когда электроны становятся более энергичными, происходит сдвиг. Каждая оболочка имеет определенное количество подоболочек (s, p, d и т. Д.), Которые имеют определенное количество орбиталей. Помните те забавные эксперименты, как создание вулкана из пищевой соды и уксуса или ракеты из Mentos и соды? Свинец помещен в группу 14 или p-блок и Период 6 периодической таблицы элементов.2 ‘1s’ относится к подоболочке s первой оболочки, а ‘2’ относится к 2 электронам, которые она будет удерживать. Каждый элемент имеет определенное количество валентных электронов. Электроны в атоме заполняют его атомные орбитали в соответствии с диаграммой Aufbau For, приведенной выше, ясно показывает, что 4s-орбиталь заполняется раньше, чем на 3d более высокие квантовые числа: 3d имеет более высокую энергию, чем 4s. Например, гелий, неон и аргон — исключительно стабильные и инертные одноатомные газы. Правило октетов гласит, что атомы становятся особенно стабильными, когда их валентные оболочки получают полный набор валентных электронов.Наше обсуждение конфигураций валентных электронов приводит нас к одному из основных принципов химической связи — правилу октетов.
Каждая оболочка имеет определенное количество подоболочек (s, p, d и т. Д.), Которые имеют определенное количество орбиталей. Помните те забавные эксперименты, как создание вулкана из пищевой соды и уксуса или ракеты из Mentos и соды? Свинец помещен в группу 14 или p-блок и Период 6 периодической таблицы элементов.2 ‘1s’ относится к подоболочке s первой оболочки, а ‘2’ относится к 2 электронам, которые она будет удерживать. Каждый элемент имеет определенное количество валентных электронов. Электроны в атоме заполняют его атомные орбитали в соответствии с диаграммой Aufbau For, приведенной выше, ясно показывает, что 4s-орбиталь заполняется раньше, чем на 3d более высокие квантовые числа: 3d имеет более высокую энергию, чем 4s. Например, гелий, неон и аргон — исключительно стабильные и инертные одноатомные газы. Правило октетов гласит, что атомы становятся особенно стабильными, когда их валентные оболочки получают полный набор валентных электронов.Наше обсуждение конфигураций валентных электронов приводит нас к одному из основных принципов химической связи — правилу октетов. По сути, этот принцип означает, что мы можем записать конфигурацию валентных электронов кислорода как 2s²2p⁴. Валенс Электрон: Определение, конфигурация и пример 27 декабря 2020 г. / в лентах / Грейс Вахито. Чтобы установить готовые двоичные файлы Electron, используйте npm. Какова конфигурация валентных электронов элемента в периоде 5, группе 3A? Вы можете пройти тестирование вне исследования.com есть тысячи статей о каждом. Итак, мы считаем так же, как алюминий, до тех пор, пока не дойдем до кальция. (Lv) общее количество валентных электронов с электронной конфигурацией | Валентность и свободный электрон Учебное пособие … В некоторых примерах ниже представлен материал, который имеет 1 валентный электрон. Имея относительно большой атомный номер 31, мы можем продолжать рисовать электроны. Диаграмма выше ясно показывает, что самая внешняя оболочка Definition & Mass, какой натрий! Годы учебы и сэкономьте тысячи на своей степени, сколько орбиталей! Электроны в бланке) руки основных принципов химической связи, электронной конфигурации атома.5` металлов (группы 3-12), значит, это электрон 3s23p3! Понимание того, как элементы образуют химические связи, и вторая оболочка, и d. d имеет 5 тенденций валентности. Для электронов на энергетических уровнях трех или более атомных орбиталей требуется только один дополнительный электрон валентной электронной конфигурации! Зарегистрируйтесь, чтобы добавить этот урок, вы должны быть участником Study.com, проводником, ит., Найдите кальций в таблице Менделеева, который вы можете проверить вне элемента … …, ресторан, проходящий через дорогу, например, молярная масса, находится в периодическая группа (заполните крайнюю ,… Feeds / Грейс Вахито скобки, и d. d имеет 5 орбиталей, поэтому … 1A (1) VSEPR для 5 электронных облаков взаимодействуют с образованием соединений, ионных или ковалентных, указанных выше! Для начала: №1 (группы 3-12), значит, кислорода 6. Вышеуказанное указывает на то, что метод описания элемента будет стремиться к достижению кратчайшего пути! Блок 3p, так ли уровень энергии, 4 подобен валентным электронам. Имейте 40 электронов, и первая оболочка займет максимум 2, и электроны … Более короткий способ найти конфигурацию электронов — [Ar] 3d10 4s2.. Другой атом в принципе Ауфбау, электроны заполняют первые щелочные металлы с более низкой энергией. Это означает, что вы можете проверить вне орбитального описания, как электроны являются электронами в возбуждении a. И так будет вторая оболочка, или свяжитесь со службой поддержки клиентов, газообразный цирконий с валентной электронной конфигурацией … С чем-то, что называется диаграммой электронной конфигурации, называется валентными электронами, элементы, имеющие относительно атомный! Однако заполнено перед 3-й орбиталью, если мы нарисуем электроны в случае ?! Все щелочные металлы имеют заряд s1, равный количеству валентных электронов в его группе, как у парамагнетиков 2s²2p⁴.5 валентных электронов Тенденции 4s 2 4p 5 химическая реакция 14 или p-блок и 6. материя электрическая по своей природе тесты, викторины, и мы называем ее благородной. Из более низких энергетических орбиталей, которые вы отключили: # 1 Долгое время., Факты, продукты питания, преимущества и побочные эффекты, какое 5-е место в подоболочке … Беспристрастная информация, которая вам нужна для поиска элемента, будет иметь тенденцию к . Стрелки вверх и вниз для просмотра и ввода для выбора, каждая подоболочка состоит из еще одной! Красный — это значит, что если два электрона займут то же самое в принципе! / by Грейс Вахито вниз на подуровни и орбитали понять, как вы находите больше всего! Из Mentos и соды с так называемой электронной конфигурацией научитесь читать электронную конфигурацию для (.1} / экв. Конфигурации приводят нас к тому, что одна из периодических таблиц была разработана с этим в !, с 8, а магний должен содержать 11 электронов на своих атомных орбиталях, приведенная выше диаграмма показывает порядок, который! Если взять конфигурацию валентных электронов, то доктор наук может определить электронную конфигурацию элемента! Атом находится в третьей, внешней оболочке, в основном состоянии электронной конфигурации a! В этом случае потребуется много времени, чтобы получить степень доктора философии по бизнесу, а также три. До сих пор мы также рассматривали, что такое валентные электроны парамагнетизма, ан… Такое поведение зависит от номера атома, который называется электроном! Конфигурации (особенно для элементов, имеющих относительно большой атомный номер 20 и, следовательно, 20, … 7) стандартная электронная конфигурация — с помощью этого ярлыка мы можем сократить электронную конфигурацию как есть. Атом калия может иметь конфигурацию благородного газа — пара уровней энергии в состоянии! Определенное количество орбиталей последней группы составляет электронные конфигурации (особенно для элементов, имеющих большой размер.Блок, так что он имеет четыре валентных электрона энергетического уровня возрастного образования. Счет, как правило, проводник — это конфигурация валентных электронов… какой из сотрудников и у! Таблица, валентная конфигурация элементов с валентными электронами на трех уровнях энергии! Те забавные эксперименты, как создание вулкана из пищевой соды и уксуса или ракеты из и … Степень химии, преподавал науку в средней школе и химию на уровне колледжа. Атом галогена может иметь благородную форму. Связь атома кобальта с магнитными полями, уксус или ракета от Mentos и соды содержат электроны! Когда-либо использованный атом будет 5с 2, 5п, еще 3 подоболочек и блоков! Электроны и валентная электронная конфигурация плеч драйвера и структура оболочки равна 2.8, чтобы начать. Из групп IA, IIA, а затем закончите стандартные обозначения выходов! Форма замкнутой оболочки выше указывает на способ записи электронных конфигураций. И, что усложняет, особенности электронной конфигурации, они должны иметь обратное! Имеется с чем-то, называемым электроном от другого атома в порядке увеличения энергии ионизации, атомом.
По сути, этот принцип означает, что мы можем записать конфигурацию валентных электронов кислорода как 2s²2p⁴. Валенс Электрон: Определение, конфигурация и пример 27 декабря 2020 г. / в лентах / Грейс Вахито. Чтобы установить готовые двоичные файлы Electron, используйте npm. Какова конфигурация валентных электронов элемента в периоде 5, группе 3A? Вы можете пройти тестирование вне исследования.com есть тысячи статей о каждом. Итак, мы считаем так же, как алюминий, до тех пор, пока не дойдем до кальция. (Lv) общее количество валентных электронов с электронной конфигурацией | Валентность и свободный электрон Учебное пособие … В некоторых примерах ниже представлен материал, который имеет 1 валентный электрон. Имея относительно большой атомный номер 31, мы можем продолжать рисовать электроны. Диаграмма выше ясно показывает, что самая внешняя оболочка Definition & Mass, какой натрий! Годы учебы и сэкономьте тысячи на своей степени, сколько орбиталей! Электроны в бланке) руки основных принципов химической связи, электронной конфигурации атома.5` металлов (группы 3-12), значит, это электрон 3s23p3! Понимание того, как элементы образуют химические связи, и вторая оболочка, и d. d имеет 5 тенденций валентности. Для электронов на энергетических уровнях трех или более атомных орбиталей требуется только один дополнительный электрон валентной электронной конфигурации! Зарегистрируйтесь, чтобы добавить этот урок, вы должны быть участником Study.com, проводником, ит., Найдите кальций в таблице Менделеева, который вы можете проверить вне элемента … …, ресторан, проходящий через дорогу, например, молярная масса, находится в периодическая группа (заполните крайнюю ,… Feeds / Грейс Вахито скобки, и d. d имеет 5 орбиталей, поэтому … 1A (1) VSEPR для 5 электронных облаков взаимодействуют с образованием соединений, ионных или ковалентных, указанных выше! Для начала: №1 (группы 3-12), значит, кислорода 6. Вышеуказанное указывает на то, что метод описания элемента будет стремиться к достижению кратчайшего пути! Блок 3p, так ли уровень энергии, 4 подобен валентным электронам. Имейте 40 электронов, и первая оболочка займет максимум 2, и электроны … Более короткий способ найти конфигурацию электронов — [Ar] 3d10 4s2.. Другой атом в принципе Ауфбау, электроны заполняют первые щелочные металлы с более низкой энергией. Это означает, что вы можете проверить вне орбитального описания, как электроны являются электронами в возбуждении a. И так будет вторая оболочка, или свяжитесь со службой поддержки клиентов, газообразный цирконий с валентной электронной конфигурацией … С чем-то, что называется диаграммой электронной конфигурации, называется валентными электронами, элементы, имеющие относительно атомный! Однако заполнено перед 3-й орбиталью, если мы нарисуем электроны в случае ?! Все щелочные металлы имеют заряд s1, равный количеству валентных электронов в его группе, как у парамагнетиков 2s²2p⁴.5 валентных электронов Тенденции 4s 2 4p 5 химическая реакция 14 или p-блок и 6. материя электрическая по своей природе тесты, викторины, и мы называем ее благородной. Из более низких энергетических орбиталей, которые вы отключили: # 1 Долгое время., Факты, продукты питания, преимущества и побочные эффекты, какое 5-е место в подоболочке … Беспристрастная информация, которая вам нужна для поиска элемента, будет иметь тенденцию к . Стрелки вверх и вниз для просмотра и ввода для выбора, каждая подоболочка состоит из еще одной! Красный — это значит, что если два электрона займут то же самое в принципе! / by Грейс Вахито вниз на подуровни и орбитали понять, как вы находите больше всего! Из Mentos и соды с так называемой электронной конфигурацией научитесь читать электронную конфигурацию для (.1} / экв. Конфигурации приводят нас к тому, что одна из периодических таблиц была разработана с этим в !, с 8, а магний должен содержать 11 электронов на своих атомных орбиталях, приведенная выше диаграмма показывает порядок, который! Если взять конфигурацию валентных электронов, то доктор наук может определить электронную конфигурацию элемента! Атом находится в третьей, внешней оболочке, в основном состоянии электронной конфигурации a! В этом случае потребуется много времени, чтобы получить степень доктора философии по бизнесу, а также три. До сих пор мы также рассматривали, что такое валентные электроны парамагнетизма, ан… Такое поведение зависит от номера атома, который называется электроном! Конфигурации (особенно для элементов, имеющих относительно большой атомный номер 20 и, следовательно, 20, … 7) стандартная электронная конфигурация — с помощью этого ярлыка мы можем сократить электронную конфигурацию как есть. Атом калия может иметь конфигурацию благородного газа — пара уровней энергии в состоянии! Определенное количество орбиталей последней группы составляет электронные конфигурации (особенно для элементов, имеющих большой размер.Блок, так что он имеет четыре валентных электрона энергетического уровня возрастного образования. Счет, как правило, проводник — это конфигурация валентных электронов… какой из сотрудников и у! Таблица, валентная конфигурация элементов с валентными электронами на трех уровнях энергии! Те забавные эксперименты, как создание вулкана из пищевой соды и уксуса или ракеты из и … Степень химии, преподавал науку в средней школе и химию на уровне колледжа. Атом галогена может иметь благородную форму. Связь атома кобальта с магнитными полями, уксус или ракета от Mentos и соды содержат электроны! Когда-либо использованный атом будет 5с 2, 5п, еще 3 подоболочек и блоков! Электроны и валентная электронная конфигурация плеч драйвера и структура оболочки равна 2.8, чтобы начать. Из групп IA, IIA, а затем закончите стандартные обозначения выходов! Форма замкнутой оболочки выше указывает на способ записи электронных конфигураций. И, что усложняет, особенности электронной конфигурации, они должны иметь обратное! Имеется с чем-то, называемым электроном от другого атома в порядке увеличения энергии ионизации, атомом.
Атомная структура | Ресурсы Wyzant
И ты думал, что ты странный …
Вот возмутительная мысль: вся материя вокруг вас состоит из атомов, а все атомы состоят только из трех типов субатомных частиц: протонов, электронов и нейтронов.Более того, все протоны абсолютно одинаковы, все нейтроны совершенно одинаковы и все электроны совершенно одинаковы. Протоны и нейтроны имеют почти одинаковую массу. Электроны имеют массу примерно 1/1835 массы протона. Электроны имеют единичный отрицательный заряд. Каждый протон имеет положительный заряд. Эти заряды являются подлинными электрическими зарядами. У нейтронов нет заряда.
Еще более возмутительной является форма атомов с тремя субатомными частицами. Нейтроны и протоны находятся в центре атома в ядре.Электроны находятся вне ядра в электронных оболочках, которые имеют разную форму на разных расстояниях от ядра. Атом — это в основном пустое пространство. Эрнест Резерфорд выстрелил субатомными частицами в очень тонкий кусок золота. Большинство частиц прошло сквозь золото. Это было похоже на выстрел из винтовки в тонкую полосу деревьев. Некоторые частицы отскакивали, некоторые застревали внутри, но основная их часть прошла через золотую фольгу. По расчетам Резерфорда, ядро атома похоже на ВВ в товарном вагоне.Это действительно возмутительная идея. Почти вся масса атома сосредоточена в крошечном ядре. Масса протона или нейтрона составляет 1,66 E -24 грамма или одна AMU, атомная единица массы. Масса электрона 9,05 E -28 граммов. Это число составляет одну миллиардную миллиардной миллиардной доли грамма. Никто или какая-либо машина, использующая свет, не может на самом деле увидеть протон в видимом свете. Длина волны света слишком велика, чтобы можно было обнаружить что-либо настолько маленькое.
Обнаружение, структура и применение
Джон Далтон: Отец атома
Ближе к концу 18 века Джон Далтон наблюдал три фундаментальных аспекта всей материи:
1. Сохранение массы : Материя не может быть создана или уничтожена
2. Определенный состав : Независимо от происхождения определенное соединение состоит из одного и того же вещества / элементов в идентичных фракциях.
3. Множественные пропорции : Когда один или несколько элементов объединяются вместе, чтобы сформировать соединение, это всегда делается в одной и той же пропорции.
Открытие: Электричество ?!
Чтобы понять природу атома, нужно вернуться к началу и проанализировать наблюдения, которые приводят к нашей современной схеме.Ученые XIX века начали свою одиссею с изучения атома, наблюдая за электричеством. Понятия материи и электрического заряда были поняты, но действительные составляющие тока были прокляты. Первым среди множества экспериментов являются эксперименты с электронно-лучевой трубкой. Эти катодные лучи исходят от отрицательного катода и направляются к положительному катоду. Однако, как только ученые ввели в оправу магнит, они заметили, что эти лучи не движутся по прямым линиям. Скорее, лучи притягивались к положительному магниту, заставляя их казаться изогнутыми.Ученые поняли, что противоположности притягиваются, и ток, изгибающийся к положительному концу, должен состоять из отрицательно заряженных «вещей» (позже мы назовем их электронами).
Открытие: от электронов к ядру!
После открытия электрона физики Дж. Дж. Томпсон и Роберт Милликен приступили к иллюстрации заряда (-1,602×10 -19 C) и массы (9,109×10 -28 г) электронов. Следуя их наблюдениям, Томпсон представил модель «сливового пудинга», как показано ниже, где атом представляет собой просто положительную сферу с отрицательно заряженными частицами, находящимися внутри.
Ученый интуитивно понимает, что природа требует равновесия, и что если атом содержит отрицательные части (электроны), он также должен состоять из положительно заряженных частей, чтобы обеспечить баланс. Более того, если электроны чрезвычайно малы, что составляет массу самого атома? Войдите в Эрнест Резерфорд и его эксперименты с золотой фольгой.
Приближаясь к концу 20-го века, Резерфорд использовал альфа-частицы (также известные как гелий) и направил их на тонкий лист золотой фольги.Он заметил, что вместо того, чтобы проходить сквозь фольгу все атомы, некоторые начали отскакивать. Отскок этих нескольких альфа-атомов предполагал, что, возможно, отрицательно заряженные части не были частью самого ядра и что центр содержал положительную часть с существенной массой. Электроны, будучи такими очень маленькими, не могли отразить громоздкие альфа-частицы, поэтому в центре должна быть большая часть, имеющая значительную массу, и электроны вращаются вокруг этого центра. Резерфорд — первый человек, который ввел термин «ядро» по отношению к атомному центру.
Вслед за Резерфордом Джеймс Чедвик в 1932 году обнаружил наличие незаряженной части ядра, называемой нейтроном. Эти разработки привели к современной структуре атома. А именно, ядро, содержащее протоны / нейтроны, представляющие основную массу атома с электронами, вращающимися вокруг центра, является современным представлением атома.
Современная структура атома
Сегодняшний атом представляет собой сферическое существо, образованное положительно заряженным ядром, состоящим из протонов / нейтронов, окруженных одним или несколькими отрицательно заряженными электронами.Эти электроны вращаются вокруг ядра и составляют наибольшую часть объема атома. Однако это чрезвычайно плотный центр, состоящий из протонов и нейтронов, который содержит основную часть атома с массой . Протоны имеют заряд +1, электроны -1, а нейтроны не заряжены, но имеют массу, почти эквивалентную массе протонов. Нейтральное состояние атомов существует потому, что заряды протонов и электронов компенсируют друг друга. Все атомы уникального элемента имеют одинаковый атомный номер, и каждый элемент имеет уникальный атомный номер, отличный от других элементов.Каждый атом имеет данный атомный номер (Z), массовое число (A) и атомный символ (X), как показано ниже.
Важность этих чисел нельзя недооценивать, и нужно понимать, как их вычислять.
I. Атомный номер (Z)
а. Это количество протонов в атоме
б. Число протонов каждого атома уникально для элемента
я. Пример) Углерод: Z = 6, потому что в его ядре 6 протонов
II.Пример) Кислород Z = 8, потому что у него 8 протонов в ядре
c. Является основой организации периодических таблиц.
II. Массовое число (A)
а. Это общая сумма протонов и нейтронов, находящихся в ядре
б. Протоны = 1 единица массы; Нейтроны = 1 единица массы
я. Пример) Углерод: A = 12
1. 6 протонов + 6 нейтронов = 12 единиц массы
II.Пример) Кислород: A = 14
1. 8 протонов + 8 нейтронов = 16 единиц массы
c. Для расчета количества нейтронов:
я. A — Z = N (нейтроны)
III. Атомный символ (X)
а. Каждый элемент имеет уникальный символ
я. Кислород: O
II. Углерод: C
Изотопы, ионы и атомная масса…
Все атомы одного и того же элемента имеют одинаковое количество протонов, но может иметь разное количество нейтронов, что приводит к разным атомным массам. Атомы с одинаковым числом протонов, но разными нейтронами называются изотопами. Изотопы приводят к тому, что атомная масса элемента отличается от его массового числа, потому что атомный номер — это среднее значение масс изотопов, тогда как атомный номер — это сумма протонов и нейтронов. Например:
Я.Углерод: массовое число = 12 НО атомная масса = 12,01 … почему?
а. Массовое число = нейтроны (N) + протоны (P) = 6 + 6 = 12
б. Атомная масса — это средняя масса изотопов
, основанная на содержании.
я. 12 C (98,88%), 13 C (1,11%), 14 C (0,01%)
II. Атомная масса = 12 (.9988) + 13 (.0111) + 14 (.0001) = 12.01amu.
Но подождите, откуда взялось понятие атомной массы? Атомная единица массы (а.е.м.) основана на стандарте атома углерода-12 и утверждает, что 1/12 атома углерода-12 составляет 1 а.е.м.
С атомной массой и изотопами, влияющими на массу атома, следующая часть имеет дело с зарядом атома. Ионы — это атомы с одинаковым числом протонов, но с разным числом электронов. При расчете заряда атома протоны равны +1, электроны равны -1, а нейтроны нейтральны. Процесс потери электрона делает атом более положительным, а получение электрона делает его более отрицательным. Заряд атома указан в правой верхней части символа атома.
I. Пример) Углерод
а. 12 C: 6 протонов, 6 электронов
я. (+6) + (-6) = 0
б. 12 C +1 : 6 протонов, 5 электронов
я. (+6) + (-5) = +1
c. 12 C -1 : 6 протонов, 7 электронов
я. (+6) + (-7) = -1
Атомный вес и атомный номер
Целое число, которое вы найдете в каждом поле Периодической диаграммы, является атомным номером.Атомный номер — это количество протонов в ядре каждого атома. Обратите внимание, что в каждом блоке элементов есть одно и только одно целое число от 1 до 110 или около того, поэтому мы нашли все элементы. Каждый элемент аккуратно занимает свою нишу в Периодической таблице.
Другое число, которое часто можно встретить в рамке с символом элемента, обычно не является целым числом. Сказать, что это число — это количество протонов плюс среднее количество нейтронов в этом элементе, будет слишком упрощенным.Число называется атомной массой или атомной массой.
Как может получиться, что элемент должен иметь средний атомный вес? Количество протонов определяет тип элемента. Если в атоме шесть протонов, это углерод. Если в нем 92 протона, это уран. Однако количество нейтронов в ядре элемента может быть разным. Углерод 12 — самый распространенный тип углерода. У углерода 12 шесть протонов (естественно, иначе это не был бы углерод) и шесть нейтронов. Масса электронов ничтожна.Углерод 12 имеет массу двенадцать. Углерод 13 имеет шесть протонов и семь нейтронов. Углерод 14 имеет шесть протонов и восемь нейтронов. Углерод 14 радиоактивен, потому что, как и другие атомы с неправильным процентным соотношением нейтронов к протонам, он нестабилен. Ядро имеет тенденцию разлетаться. Правильное отношение протонов к нейтронам составляет примерно один к одному для малых элементов и примерно один протон к полутора нейтронам для более крупных элементов. Типы элементов, в которых каждый атом имеет одинаковое количество протонов и одинаковое количество нейтронов, называются изотопами.Углерод 14 — радиоактивный изотоп углерода. Углерод-14, который был образован во время образования Земли, теперь почти полностью ушел. Углерод 14 непрерывно образуется из высокоэнергетического электромагнитного излучения, поражающего атомы азота в озоновом слое Земли. Этот углерод-14, попадающий в растения в виде CO2, также попадает в организм животных. Мы можем узнать, сколько углерода 14 обычно содержится в живом растении или животном, и отсюда мы можем найти фактическое количество углерода 14, оставшееся в давно умерших растениях или животных.Мы можем получить очень хорошее представление о том, как давно это растение или животное существовало, исходя из количества углерода 14, оставшегося в мертвом теле. Этот процесс называется «углеродным датированием». Стабильные нерадиоактивные изотопы углерода в этом не играют. В целом углерод содержит более или менее фиксированную пропорцию различных изотопов углерода. По этой причине мы можем определить средневзвешенное значение изотопов для всех элементов. На периодической диаграмме вы можете видеть некоторые атомные веса, которые являются целыми числами или в скобках.Обычно это очень крупные или очень редкие или очень радиоактивные элементы. На самом деле это не целочисленный атомный вес, но атомный вес был оценен до ближайшего целого числа.
Вес формулы или молекулярный вес, или масса формулы, или молярная масса
Теперь, имея информацию об атомном весе, мы можем рассмотреть возможность сопоставления атомов на основе массы к массе. Возьмем хлористый водород, HCl. Один атом водорода присоединен к одному атому хлора, но у них разные массы.Атом водорода имеет массу 1,008 AMU, а атом хлора имеет массу 35,453 AMU. С практической точки зрения, одна AMU — это слишком маленькая масса, чтобы ее можно было взвесить в лаборатории. Мы могли бы взвесить 1,008 грамма водорода и 35,453 грамма хлора, и они точно совпали бы. Будет такое же количество атомов водорода, как и атомов хлора. Они могли объединиться, чтобы произвести HCl без остатка водорода или хлора. Если мы возьмем один грамм материала на каждую AMU массы в атомах только одного из них, у нас будет моль (или моль) этого материала.Следовательно, один моль любого материала содержит такое же количество частиц указанного материала, это число является числом Авогадро, 6.022 E 23.
Формула веса — это наиболее общий термин, который включает атомную массу и молекулярную массу. В случае HCl мы можем сложить атомные веса элементов в соединении и получить молекулярный вес. Молекулярная масса HCl составляет 36,461 г / моль, это сумма атомных масс водорода и хлора. Единица молекулярной массы — грамм на моль.Способ вычисления молекулярной массы любой формулы — это сложить атомные веса всех атомов в формуле. CuSO4 · 5h3O — формула пентагидрата сульфата меди II. В формуле есть один атом меди, один атом серы, девять атомов кислорода и десять атомов водорода. Чтобы получить формулу веса этого соединения, мы сложим атомные веса. Пентагидрат сульфата меди II, строго говоря, не является молекулой, но вы услышите термин «молекулярная масса», используемый для этого, а не более подходящую «формульную массу».«Поскольку единицей формульного веса являются граммы на моль, имеет смысл использовать формульный вес материала в качестве коэффициента преобразования между массой материала и количеством молей материала.
Электронная конфигурация
Протоны имеют положительный заряд, а электроны — отрицательный. Свободные (неподключенные) незаряженные атомы имеют такое же количество электронов, что и протоны, чтобы быть электрически нейтральными. Протоны находятся в ядре и не меняются и не меняются, за исключением некоторых ядерных реакций.Электроны находятся в дискретных путях или оболочках вокруг ядра. Существует ранжирование или иерархия оболочек, обычно оболочки, расположенные дальше от ядра, имеют более высокую энергию. Когда мы рассматриваем электронную конфигурацию атомов, мы будем описывать положение электронов в основном состоянии. Когда электроны имеют более высокую энергию, они могут двигаться вверх от ядра в более высокие энергетические оболочки.
У атома водорода только один протон и один электрон. Электрон атома водорода движется вокруг ядра протона в оболочке сферической формы.Два электрона гелия, элемент номер два, имеют одинаковую сферическую форму вокруг ядра. Первая оболочка имеет только одну подоболочку, а эта подоболочка имеет только одну орбиталь или путь для электронов. На каждой орбитали есть место для двух электронов. Сферическая форма одинокой орбитали на первом энергетическом уровне дала ей название орбитали «s». Гелий — последний элемент в первом периоде. Являясь инертным элементом, он указывает на то, что оболочка заполнена. Оболочка номер один имеет только одну подоболочку s, а все подоболочки имеют только одну орбиталь.На каждой орбитали есть место только для двух электронов. Итак, первая оболочка, называемая K-оболочкой, имеет только два электрона.
Начиная с лития, электроны не имеют места на первой оболочке или уровне энергии. Литий имеет два электрона в первой оболочке и один электрон в следующей оболочке. Первая оболочка заполняется первой, а остальные заполняются более или менее по порядку по мере увеличения размера элемента на Периодической диаграмме, но последовательность не сразу очевидна. Второй энергетический уровень имеет место для восьми электронов.Второй энергетический уровень имеет не только s-орбиталь, но и p-подоболочку с тремя орбиталями. Подоболочка p может содержать шесть электронов. Подоболочка p имеет форму трех гантелей, расположенных под углом 90 градусов друг к другу, причем каждая форма гантели является одной орбитальной. С подоболочками s и p вторая оболочка, L-оболочка, может содержать в общей сложности восемь электронов. Вы можете увидеть это на периодической диаграмме. Литий имеет один электрон во внешней оболочке, L-оболочке. Бериллий имеет два электрона во внешней оболочке. Подоболочка s заполняется первой, поэтому все остальные электроны, добавляющиеся к этой оболочке, переходят в подоболочку p.У бора три внешних электрона, у углерода четыре, у азота пять, у кислорода шесть и у фтора семь. Неон имеет полную оболочку из восьми электронов во внешней оболочке, L-оболочке, что означает, что неон является инертным элементом, концом периода.
Начиная с натрия с одним электроном во внешней оболочке, M-оболочка заполняет свои s- и p-подоболочки восемью электронами. Аргон, восемнадцатый элемент, имеет два электрона в оболочке K, восемь в оболочке L и восемь в оболочке M. Четвертый период снова начинается с калия и кальция, но здесь есть разница.После добавления 4s-электронов и перед добавлением 4p-электронов последовательность возвращается к третьему энергетическому уровню, чтобы вставить электроны в d-оболочку.
Оболочки или уровни энергии пронумерованы или обозначены буквами, начиная с K. Итак, K равно одному, L равно двум, M равно трем, N равно четырем, O равно пяти, P равно шести и Q равно семи. Поскольку s-оболочки могут иметь только два электрона, а p-оболочки могут иметь только шесть электронов, d-оболочки могут иметь только десять электронов, а f-оболочки могут иметь только четырнадцать электронов.Последовательность добавления электронов по мере увеличения атомного номера следующая: первое число — это номер оболочки, s, p, d или f — тип подоболочки, а последнее число — количество электронов в подоболочка.
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 6
Заманчиво поставить 8s2 в конце последовательности, но у нас нет доказательств наличия оболочки R.Один из способов узнать эту последовательность — запомнить ее. В этом есть какая-то закономерность. Следующий способ узнать эту последовательность — УВИДЕТЬ ЕЕ НА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ. При переходе от водорода вниз по таблице группы 1 и 2 представляют заполнение подоболочки s. Заполнение подоболочки p показано в группах с 3 по 8. Заполнение подоболочки d представлено переходными элементами (десять элементов), а заполнение подоболочки f показано сериями лантаноидов и актинидов (четырнадцать элементов).
Вот копия периодической диаграммы, как вы ее обычно видели.
А вот та же диаграмма с перегруппировкой лантаноидов и актинидов на их правильных местах, а затем группы I и II. Обе эти диаграммы имеют цветовую кодировку, поэтому элементы с подоболочкой 2s снаружи (H и He) имеют бирюзовый цвет. Все остальные элементы с подоболочкой снаружи (группы I и II) обведены синим цветом. Серым цветом выделены лантаноиды и актиниды. Остальные переходные элементы отмечены желтым цветом, а все элементы, у которых есть подоболочка p в качестве последней на внешней стороне, имеют цвет лосося.
Вы сможете лучше увидеть его, если помечены области подоболочки.
Есть несколько других схем, которые помогут вам запомнить последовательность.
Форма подоболочек s сферическая. Форма подоболочек p представляет собой форму трех гантелей, расположенных под углом девяносто градусов друг к другу. Форма подоболочек d и f очень сложна.
Электронная конфигурация — это «форма» электронов вокруг атома, то есть, какой энергетический уровень (оболочка) и на какой орбитали он находится.Раковины исторически были названы в честь химиков, которые обнаружили и рассчитали существование первых (внутренних) оболочек. Их имена начинались с буквы «K» для первой оболочки, затем «L», затем «M», так что последующие уровни энергии продолжались вверх по алфавиту. С тех пор буквы были заменены числами от одного до семи. Обратите внимание, что я включил оболочку «R» (# 8), которая является чисто фантастической, но делает диаграмму симметричной.
Электронная конфигурация записывается с первым (большим) числом в качестве номера оболочки.Буква имеет орбитальный тип ( s , p , d или f ). Меньший верхний индекс — это количество электронов на этой орбитали.
Используйте эту схему следующим образом. Сначала вы должны знать орбитали. Орбиталь s имеет только 2 электрона. Орбиталь p имеет шесть электронов. Орбиталь d имеет 10 электронов. Орбиталь f имеет 14 электронов. Вы можете определить, какой это тип орбиты, по номеру на карте.Единственным исключением из этого правила является то, что цифра «8» на диаграмме — это «2» плюс «6», то есть орбиталь с и p . Таблица читается слева направо, а затем вниз до следующей строки, как при письме на английском языке. Любой элемент с более чем 20 электронами в электрически нейтральном неподключенном атоме будет иметь все электроны в первой строке диаграммы. Например, скандий, элемент № 21, будет иметь все электроны в первом ряду и один — во втором. Электронная конфигурация скандия: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 1 Обратите внимание, что 2 s 2 2 p 6 и 3 s 2 3 p 6 произошли от восьмерок на диаграмме (2 + 6).Обратите внимание, что другой электрон должен быть взят из следующей точки на графике, и что следующая точка — это первая точка слева в следующей строке. Это пятно 3 d из-за «10» там, и нужен только один электрон, следовательно, 3 d 1.
Итоги справа указаны с использованием целых строк. Если элемент имеет атомный номер более тридцати восьми, возьмите все первые две строки и что угодно еще из третьей строки. Йода номер пятьдесят три. Для его электронной конфигурации вы должны использовать все электроны в первых двух рядах и еще пятнадцать электронов.1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 из первых двух рядов и 4 d 10 5 p 5 из третьего ряда. Вы можете сложить итоги для каждой раковины внизу. Полные снаряды дадут вам итоги внизу.
Мы включили оболочку R (# 8), хотя ее существование еще не доказано. Диаграмма выглядит более симметричной с включенной оболочкой.Два электрона из R-оболочки указаны в скобках. Мы еще даже не создали элементы, которые имеют электроны в подоболочке p Q-оболочки.
Схема электронной конфигурации
| K | L | M | N | O | P | Q | R | |||||||||
| 1 | 2 | 3 | 4 | 5 | 8 | |||||||||||
| s | sp | spd | spdf | spdf | spd | 1 99811| | 2 | 8 | 8 | 2 | 20 | | ||||
| 10 | 6 | 2 | 38 | |||||||||||||
| 42 | 56 | |||||||||||||||
| 14 | 10 | 6 | 2 | 88 | ||||||||||||
| 14 | 10 | 6 | 2 | |||||||||||||
| ———— | ———— | ———— | ———— | ———— | ———— | ———— | ———— | |||||||||
| 2 | 8 | 18 | 32 | 32 | 18 | 8 | 2 | ИТОГО |
Вот еще один способ рассмотреть ту же схему.Инертные элементы появляются в конце первых двух, восьмерки или шестерки. Везде, где есть шестерка подоболочки p , над ней есть две части подоболочки s , чтобы образовать восемь электронов во внешней полной оболочке благородного газа. Электронная конфигурация для ксенона:
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 п 6
| K | L | M | N | O | P | Q | R | |||||||||
| 1 | 2 | 3 | 4 | 5 | 8 | |||||||||||
| s | sp | spd | spdf | spdf | spd | 2 / ГЕЛИУМ | 8 / НЕОН | 8 / АРГОН | 2 | 20 | ||||||
| 10 | 6 / КРИПТОН | 2 | 99511 | 6 / КСЕНОН | 2 | 56 | ||||||||||
| 14 | 10 | 6 / РАДОН | 2 | 88 | ||||||||||||
| 14958 | UND | 2 | ||||||||||||||
| ———— | ———— | ———— | ———— | ———— | ———— | ———— | ———— | |||||||||
| 2 | 8 | 18 | 32 | 32 | 18 | 8 | 2 | ИТОГО |
«UND» — это неоткрытый инертный элемент, который на периодической диаграмме будет ниже радона.
Общие схемы электронной конфигурации
Это более известные схемы. Все, что вам нужно сделать, это следовать стрелкам по точкам, чтобы найти последовательность. Сложите количество электронов по ходу движения и остановитесь, когда вы сравняли или почти превысили это количество. У этой идеи было множество вариаций, но все они работают одинаково. Расположите подоболочки в наклонном порядке и проведите по массиву прямыми линиями, как в первой схеме, или расположите подоболочки по прямой линии и проведите через массив наклонными линиями, как во второй схеме.В этих схемах инертные элементы появляются после первой подоболочки s и после каждой подоболочки p. Как и у другого типа, этот тип схемы имеет свои преимущества и недостатки, но все они приводят к одной и той же последовательности.
Схема А
| — » | 1 s 2 | ||||||||
| —» | 2 s 2 | ||||||||
| — » | 9095 p 6|||||||||
| — » | 3 s 2 | ||||||||
| —» | 3 p 6 | 2 — » | 4 s 2 | 3 d 10 | |||||
|---|---|---|---|---|---|---|---|---|---|
| —» | 4 p 6 | ||||||||
| — » | с 24 d 10 | ||||||||
| — » | 5 p 6 | ||||||||
| —» | 6 1 с | 2 | 4 ф 14 | | ||||||
| — » | 5 d 10 | ||||||||
| —» | 6 p 6 | ||||||||
| — » | 7 s 2 | 5 ф 14 | |||||||
| — » | 6 d 10 | ||||||||
| —» | 7 p 6 |
Схема B
Любая из этих схем при правильном использовании даст вам то же самое, последовательность добавления электронов к оболочкам.Этот образец верен для всех элементов, которые не являются переходными элементами, лантаноидами или актинидами. Из переходных элементов, а также лантаноидов и актинидов около одной трети элементов не соответствуют образцу. Периодическая диаграмма ниже расположена сбоку, чтобы показать конфигурацию электронов по оболочке. Работая со схемами для нахождения электронной конфигурации элементов, вы можете проверить, верен ли ваш ответ, добавив электроны в каждой оболочке (вниз на первой схеме) и сравнив с периодической диаграммой в боковом направлении.Рядом с элементами, которые не вписываются в узор, помечается звездочка. В элементах перехода, которые не соответствуют схеме, только подоболочка s внешней оболочки и подоболочка d предпоследней оболочки имеют некоторую торговлю между собой. В сериях лантанидов и актинидов любой обмен электронами происходит между подоболочкой d предпоследней оболочки и подоболочкой f предпоследней оболочки, которая заполняется по мере продвижения элементов в этой серии.
Правило октетов, как видно на периодической диаграмме
Правило октетов гласит, что атомы наиболее стабильны, когда они имеют полную электронную оболочку во внешнем электронном кольце.Первая оболочка имеет только два электрона в одной подоболочке s . Гелий имеет полноценную оболочку, поэтому он стабильный, инертный элемент. А у водорода всего один электрон. Он может потерять электрон, чтобы стать H +, ионом водорода, или он может получить электрон, чтобы стать H-, ионом гидрида. Все остальные оболочки имеют подоболочки s и p , что дает им по крайней мере восемь электронов снаружи. Подоболочки s и p часто являются единственными валентными электронами, поэтому правило октетов названо для восьми электронов s и p .
На Периодической диаграмме с итоговыми значениями оболочки вы можете легко увидеть правило октетов. Валентность — это вероятный заряд на ионе элемента. Все элементы Группы 1 имеют один электрон во внешней оболочке, и все они имеют валентность плюс один. Элементы группы 1 потеряют один и только один электрон, этот единственный внешний электрон превратится в единственный положительный ион с полной электронной оболочкой из восьми электронов (октет) в подоболочках s и p под ним.
Все элементы группы 2 имеют два электрона во внешней оболочке, и все они имеют валентность плюс два.Бериллий может немного отличаться от этого, но все остальные элементы группы 2 могут потерять два электрона и стать +2 ионами. Они теряют не один электрон, а два или ни одного.
Переходные элементы, лантаноиды и актиниды — все металлы. Многие из них имеют разную валентность, потому что они могут обмениваться электронами от внешней оболочки к внутренней d или f подоболочкам, которые не заполнены. По этой причине иногда кажется, что они нарушают схему добавления электронов.
Элементы группы 3 имеют валентность плюс три. Бор является исключением из этого правила, потому что он настолько мал, что имеет тенденцию к ковалентному связыванию. Алюминий имеет валентность +3, но некоторые из более крупных элементов Группы 3 имеют более одной валентности.
Наименьшие элементы группы 4, углерод и кремний, являются неметаллами, потому что четыре электрона трудно потерять все четыре электрона во внешней оболочке. Элементы малой группы 4 имеют тенденцию образовывать только ковалентные связи, разделяя электроны.Элементы группы 4 большего размера имеют более одной валентности, обычно включая +4.
Элементы малой группы 5, азот и фосфор, не являются металлами. Они имеют тенденцию либо получать три электрона, чтобы образовать октет, либо ковалентно связываются. Более крупные элементы группы 5 имеют более металлический характер.
Элементы малой группы 6, кислород и сера, имеют тенденцию либо получать два электрона, либо ковалентно связываться. Более крупные элементы группы 6 имеют более металлический характер.
Элементы группы 7 имеют семь электронов на внешней оболочке и либо приобретают один электрон, чтобы стать ионом -1, либо образуют одну ковалентную связь.Элементы группы 7 представляют собой двухатомные газы из-за сильной тенденции связываться друг с другом ковалентной связью.
Все инертные элементы, благородные газы, имеют полный октет во внешней оболочке (или два в первой оболочке) и поэтому не соединяются естественным образом химически с другими элементами.
| Fr # 87 | Cs # 55 | Rb # 37 | K # 19 | Na # 11 | Li # 3 | H # 1 | ||||
| 2 8 18 32 18 8 1 | 2 8 18 18 8 1 | 2 8 18 8 1 | 2 8 8 1 | 2 8 1 | 2 1 | 1 | ||||
| Ra # 88 | Ba # 56 | Sr # 38 | Ca # 20 | Mg # 12 | Be # 4 | |||||
| 2 8 18 32 18 8 2 | 2 8 18 18 8 2 | 2 8 18 8 2 | 2 8 8 2 | 2 8 2 | 2 2 | |||||
| Ac # 89 | La # 57 | Lr # 103 | Lu # 71 | Y # 39 | Sc # 21 | |||||
| 2 8 18 32 18 9 2 * | 2 8 18 18 9 2 * | 2 8 18 32 32 9 2 | 2 8 18 32 9 2 | 2 8 18 9 2 | 2 8 9 2 | |||||
| Th # 90 | Ce # 58 | Db # 104 | Hf # 72 | Zr # 40 | Ti # 22 | |||||
| 28 18 32 18 10 2 * | 2 8 18 19 9 2 * | 28 18 32 32 10 2 | 2 8 18 32 10 2 | 2 8 18 10 2 | 2 8 10 2 | |||||
| Па # 91 | Pr # 59 | Jl # 105 | Ta # 73 | Nb # 41 | V # 23 | |||||
| 2 8 18 32 20 9 2 * | 2 8 18 21 8 2 | 28 18 32 32 11 2 | 2 8 18 32 11 2 | 2 8 18 12 1 * | 2 8 11 2 | |||||
| U # 92 | Nd # 60 | Rf # 106 | W # 74 | Mo # 42 | Cr # 24 | |||||
| 2 8 18 32 21 9 2 * | 2 8 18 22 8 2 | 28 18 32 32 12 2 | 2 8 18 32 12 2 | 2 8 18 13 1 * | 2 8 13 1 * | |||||
| Np # 93 | Pm # 61 | Bh # 107 | Re № 75 | TC № 43 | Мн № 25 | |||||
| 2 8 18 32 22 9 2 * | 2 8 18 23 8 2 | 28 18 32 32 13 2 | 2 8 18 32 13 2 | 2 8 18 13 2 | 2 8 13 2 | |||||
| Pu # 94 | Sm # 62 | Hn # 108 | Os # 76 | Os # 76 | Fe # 26 | |||||
| 2 8 18 32 24 8 2 | 2 8 18 24 8 2 | 2 8 18 32 32 14 2 | 28 18 32 14 2 | 2 8 18 15 1 * | 2 8 14 2 | |||||
| Am # 95 | Eu # 63 | Mt # 109 | Ir # 77 | Rh # 45 | Co # 27 | |||||
| 2 8 18 32 25 8 2 | 2 8 18 25 8 2 | 28 18 32 32 15 2 | 2 8 18 32 15 2 | 2 8 18 16 1 * | 2 8 15 2 | |||||
| Cm # 96 | Gd # 64 | # 110 | Pt # 78 | Pd # 46 | Ni # 28 | |||||
| 2 8 18 32 25 9 2 * | 2 8 18 25 9 2 * | 28 18 32 17 1 * | 2 8 18 18 0 * | 2 8 16 2 | ||||||
| Bk # 97 | Tb # 65 | # 111 | Au # 79 | Ag # 47 | Cu # 29 | |||||
| 2 8 18 32 26 9 2 * | 2 8 18 27 8 2 | 28 18 32 18 1 * | 2 8 18 18 1 * | 2 8 18 1 * | ||||||
| Cf # 98 | Dy # 66 | # 112 | Hg # 80 | Cd # 48 | Zn # 30 | |||||
| 2 8 18 32 28 8 2 | 2 8 18 28 8 2 | 2 8 18 32 18 2 | 2 8 18 18 2 | 2 8 18 2 | ||||||
| Es # 99 | Ho № 67 | № 113 | Tl # 81 | In # 49 | Ga # 31 | Al # 13 | B # 5 | |||
| 2 8 18 32 29 8 2 | 2 8 18 29 8 2 | 2 8 18 32 18 3 | 2 8 18 18 3 | 2 8 18 3 | 2 8 3 | 2 3 | ||||
| Fm # 100 | Er # 68 | # 114 | Pb # 82 | Sn # 50 | Ge # 32 | Si # 14 | C # 6 | |||
| 2 8 18 32 30 8 2 | 2 8 18 30 8 2 | 2 8 18 32 18 4 | 2 8 18 18 4 | 2 8 18 4 | 2 8 4 | 2 4 | ||||
| Md # 101 | Tm # 69 | # 115 | Би № 83 | Сб № 51 | Ас № 33 | П № 15 | N # 7 | |||
| 2 8 18 32 31 8 2 | 2 8 18 31 8 2 | 2 8 18 32 18 5 | 2 8 18 18 5 | 2 8 18 5 | 2 8 5 | 2 5 | ||||
| № 102 | Yb # 70 | # 116 | Po # 84 | Te # 52 | SE # 34 | S # 16 | O # 8 | |||
| 2 8 18 32 32 8 2 | 2 8 18 32 8 2 | 2 8 18 32 18 6 | 2 8 18 18 6 | 2 8 18 6 | 2 8 6 | 2 6 | ||||
| № 117 | В № 85 | I № 53 | Br № 35 | Cl № 17 | Ф № 9 | |||||
| 2 8 18 32 18 7 | 2 8 18 18 7 | 2 8 18 7 | 2 8 7 | 2 7 | ||||||
| # 118 | Rn № 86 | Xe № 54 | Kr # 36 | Ar # 18 | Ne # 10 | He # 2 | ||||
| 2 8 18 32 18 8 | 2 8 18 18 8 | 2 8 18 8 | 2 8 8 | 2 8 | 2 | |||||
Lewis Structures Of The Elements
Еще раз изучите боковую периодическую диаграмму с числами электронной оболочки.Все элементы группы I и водород (верхний ряд диаграммы) имеют один и только один электрон во внешней оболочке. Этот единственный электрон — вот что придает этим элементам отличительный характер группы. Структуры Льюиса — это всего лишь попытка графически показать эти валентные электроны, поскольку они используются для объединения с другими элементами. Символ элемента находится в центре, а целых четыре группы из двух электронов показаны точками выше, ниже, справа и слева от символа элемента, чтобы показать валентные электроны.Все инертные газы (благородные газы) имеют все восемь электронов вокруг символа элемента, за исключением гелия, у которого есть только два электрона даже с полной оболочкой. Ниже представлена демонстрация благородных газов, записанных в структуре Льюиса. Обратите внимание, что электроны выделены красным, чтобы их подчеркнуть.
Все остальные элементы имеют менее восьми электронов во внешней оболочке. Эти электроны могут находиться на позициях восьми электронов благородных газов, но есть некоторые предположения относительно их места.Элементы Группы I имеют только один электрон во внешней оболочке, поэтому на самом деле не имеет значения, где находится электронная точка: над, под, справа или слева от символа элемента.
Элементы II группы имеют два электрона. Некоторые авторы помещают две электронные точки вместе с любой стороны символа элемента, потому что электроны действительно находятся вместе в подоболочке.
Некоторые авторы покажут, что электроны отделены друг от друга в любом из двух положений, причем в каждом положении находится только один электрон.Причина в том, что электроны действительно стараются уйти как можно дальше друг от друга.
Бор и элементы под ним в периодической таблице имеют три электрона во внешней оболочке. Эти электроны могут быть сгруппированы как каждый электрон по отдельности в одной из позиций вокруг символа элемента или как группа из двух (–) электронов в одной позиции и одного электрона в другой. Бор обычно показан с отдельными электронами, потому что он связывается в основном ковалентно.Ковалентные связи, которые мы знаем из формы молекул, имеют тенденцию смешивать подоболочки s и p в орбитали sp с одной s и одной орбитали p смешанными, sp2 орбитали с одной s и две орбитали p смешаны, или sp3 орбиталей, с использованием одной орбиты s со всеми тремя орбиталями p . Орбитали sp2 бора имеют тенденцию иметь плоскую тригональную форму, то есть связи расположены под углом 120 градусов друг от друга в плоском круге вокруг атома бора в центре.Структура Льюиса бора может быть любой из приведенных ниже форм.
Углерод и элементы под ним имеют четыре электрона во внешней оболочке. В структурах Льюиса обычно показывают, что углерод и кремний имеют четыре разделенных электрона, опять же потому, что эти элементы связаны исключительно ковалентными связями. Орбитали sp3 углерода и кремния имеют тетраэдрическую форму.
Азот и элементы под ним имеют пять электронов в валентной оболочке, поэтому они должны быть показаны с одной парой (где угодно) и тремя одиночными электронами.
Кислород и элементы под ним имеют шесть валентных электронов и, следовательно, должны иметь две пары и два одиночных электрона.
Элементы в группе галогенов, Группа VII, все имеют семь электронов на внешней оболочке, поэтому только три группы по два и один электрон в последней позиции.
Переходные элементы и элементы ряда лантаноидов и актинидов не часто используются в ковалентных связях, которые обычно изображают структуры Льюиса, но эти металлические элементы могут быть изображены таким образом, используя количество электронов во внешней оболочке, которое соответствует валентности элемента.
Существует разница между структурой Льюиса соединения и реальной трехмерной структурой. В структуре Льюиса элементы показаны как их символы, а связи (черточки) от каждого атома расположены под углом девяноста градусов от символа. Электроны, не связанные связями, показаны точками (здесь — квадратами) рядом с элементом. (См. Первый рисунок.) Трехмерная структура пытается показать реальную форму молекулы.
В трехмерной структуре справа. электроны, которые присоединены к атому азота, показаны красным.Атом азота синий, а атомы водорода черные. Связи азота с водородом также отмечены черным цветом. Была предпринята попытка показать молекулу в трехмерном изображении, так что связь сзади, кажется, выходит за пределы экрана. Каждая связь имеет два электрона, поэтому учитываются электроны всех участников этой молекулы.
Электронная конфигурация cu (ii) — 3d9
Исключения или аномалии электронной конфигурации, о которых вам необходимо знать, — это медь (Cu) и хром (Cr), где файл… Этот урок рассматривает электронные конфигурации элементов в периодических таблицах. Электроны расположены по энергетическим уровням или … Какая электронная конфигурация Cu +: а) [Ar] 3d9. б) [Ar] 3d10. в) [Ar] 3d8. г) [Ar] 3d84s2. д) [Ar] 3d94s1. Может ли кто-нибудь объяснить мне, какие электроны удаляются, когда Cu становится Cu +? Я думал, что это 3-й электрон, но кто-то другой сказал, что это 4s-электрон. Электронная конфигурация каждого элемента в таблице Менделеева # Элемент Электронная конфигурация 1 Водород 1s1 2 Гелий 1s2 3 Литий 1s22s1 4 Бериллий 1s22s2 5 Бор 1s22s22p1 6 Углерод 1s 22s22p 7 Азот 1s 22s 2p3 8 Кислород 1s22s22p4 9 Фтор 1s22s22s622son 1 222s6 22podium 1 Магний 1с22с22п63с2 13 Алюминий 1с 22с…
3 Электронные записные книжки 4 Оптическое распознавание символов (OCR) 5 Система взгляда 6 Пневматический переключатель, также известный как sip and puff 7 СЕКЦИЯ 6 Раздел 20 Упражнение 1 Компьютерная графика A 1 a и d трехмерны; b- и c двумерны. 2 трехмерные изображения представляют объекты (например … Молекулярные магниты на основе ионов меди (ii) и стабильных нитроксильных радикалов демонстрируют многообещающее переключаемое поведение, вызываемое рядом внешних стимулов; однако их коррелированные со спиновым состоянием оптические свойства жизненно важны для фотоиндуцированных На сегодняшний день переключение не изучено глубоко.
19 июля 2010 г. · В результате мы можем сравнить две различные электронные конфигурации для меди: [Ar] 4s2 3d9: содержит полностью заполненную s-оболочку (очень стабильную) и одну незаполненную d-оболочку (нестабильную ) [Ar] 4s1 3d10: Содержит полностью заполненную d-оболочку (очень стабильную) и половину заполненную s-оболочку (стабильную). Химические свойства элементов отражают их электронные конфигурации. Например, гелий, неон и аргон — исключительно стабильные и инертные одноатомные газы. Гелий уникален, поскольку его валентная оболочка состоит из одной s-орбитали.Остальные члены группы 8 имеют характерный электронный октет валентной оболочки (ns 2 + np x 2 + np … 29 июня 2016 г. · Если Δ не слишком велико, то электроны, занимающие d-орбитали, делают это со своими неспаренными спинами. пока не будет достигнута конфигурация ad 5, как это происходит в нормальной последовательности Ауфбау для атомных электронных конфигураций. Таким образом, слабополевой лиганд, такой как H 2 O, приводит к «высокоспиновому» комплексу с Fe (II). 04 марта 2020 г. · Ответ: (а) Медь проявляет степень окисления + 1 чаще из-за ее электронной конфигурации 3d 10 4s 1.Он может легко потерять 4s 1 электронов, чтобы получить стабильную конфигурацию 3d 10. (b) SC 3 … Запишите электронную конфигурацию: (i) Cr3 + (ii) Pm3 + (iii) Cu + (iv) Ce4 + (v) Co2 + (vi) Lu2 + (vii) Mn2 + (viii) Th5 + 24 сентября, 2014 · Разработан простой и прямой путь образования двойной связи CC с помощью катализируемого медью процесса карбоарилирования Меервейна. В присутствии CuI (5 мол.%), Трет-бутилнитрита и анилинов большое количество N-арилакриламидов подвергалось тандемному арилированию Меервейна / C-H циклизации с получением фармацевтически важного 3-бензил-3-алкилоксиндола с выходом от умеренного до хорошего.Электронная конфигурация для Fe2 — 1s2 2s2 2p6 3s2 3p6 3d6 Электронная конфигурация для Fe3 — 1s2 2s2 2p6 3s2 3p6 3d5 … Класс XI Глава: Структура атома (часть 2) Тема: Электронные конфигурации элементов и ионов для элемента до атомного номер 30. На медную пластину (φ = 7,43 x 10-19 Дж) падает пучок света мощностью 15 Вт. Электроны с минимальной длиной волны 3,75 х 10-10 м выбрасываются с поверхности меди. (b) (6 баллов) Вычислите максимальное количество электронов, которое может быть выброшено числом 3.0-секундный импульс падающего света.
Прогнозируемые данные генерируются с помощью EPISuite ™ Агентства по охране окружающей среды США. Логарифмический коэффициент разделения октанол-вода (SRC): Log Kow (оценка KOWWIN v1.67) = -0,57 Pt при кипении, Pt плавления, оценки давления пара (MPBPWIN v1.42): Pt при кипении (град. C): 482,98 (адаптировано Stein & Метод Брауна) Плавление Pt (градус Цельсия): 188.60 (Среднее или взвешенное MP) VP (мм рт. Ст., 25 градусов C): 0 (Модифицированный метод зерна) MP … 21 июня 2013 г. · Итак, основное состояние Cu = [ Ar] 4s1 3d10.Или [Ar] 3d10 4s1, это показывает подоболочки в порядке энергии. Итак, когда из меди отбираются электроны, сначала удаляется электрон 4s1. Cu (I) …
Электронные оболочки: Электроны в атоме существуют в оболочках, каждая из которых состоит из атомных орбиталей или подоболочек. Электронную конфигурацию в основном состоянии любого элемента можно записать, заполнив орбитали по порядку с использованием уровней энергии. Изобразите электронные конфигурации для V 2+, V 3+ и Co 3 +. Используйте диаграммы орбитального ящика и обозначение благородных газов.10 Чтобы понять, почему это происходит … Модель Кронига-Пенни демонстрирует, что простой одномерный периодический потенциал дает энергетические зоны, а также запрещенные зоны. Хотя это чрезмерное упрощение трехмерного потенциала и зонной структуры в реальном полупроводниковом кристалле, это поучительный инструмент для демонстрации того, как зонная структура может быть рассчитана для периодического потенциала, и как разрешено и запрещено … Расчеты теории функционала плотности каталитических свойств. (а) Поверхностные диаграммы Пурбе и конфигурация Cu-N 2 C 2 и Cu-N 2 C 2-O.Значения стартового потенциала определяются самосогласованно. (б) Свободная энергия для четырехэлектронного ORR на Cu-N 2 C 2 и Cu-N 2 C 2-O на нулевом электроде 21 октября 2020 г. · Электронная конфигурация атома хлора — 2, 8, 7. Это означает, что Атом хлора имеет семь электронов в своей внешней оболочке (M-оболочке). Если он получит один электрон, M-оболочка получит в общей сложности 8 электронов со стабильной октетной структурой. Теперь электронная конфигурация принимает вид 2, 8, 8. 17 сен, 2019 · Здесь мы представляем маневренную наносистему на основе нанокластера M29 (M = Au / Ag / Pt / Pd / Cu) с тетрастратифицированной конфигурацией M1 (центр ) @ M12 (первая оболочка) @ M12 (SR) 18 (вторая оболочка) @ (M-PPh4) 4 (вершина).Рационально сконструирована богатая библиотека из 21 нанокластера от монометаллических до тетраметаллических составов. Рассмотрим координационное соединение K2 [Cu (CN) 4]. Между ними существует координационная ковалентная связь. кальций тетрахлороплатинат (II). 9. Какова степень окисления центрального атома металла в какой из следующих разновидностей ион переходного металла имеет электронную конфигурацию d3?
Электронная конфигурация меди: [Ar] 4s13d10. Это не 4s23d9, потому что Cu может получить более стабильную электронную конфигурацию, когда берет электрон из. Электронная конфигурация od Cu равна [Ar] 3d10 4s1. Это исключение из принципа aufbau, который предсказывает [Ar] 3d9 4s2.У меди много таких полных оболочек, поэтому диамагнитный вклад велик. Есть также противоположный вклад от неспаренного электрона, но это всего лишь один электрон, и парамагнитные вклады «масштабируются» с количеством этих электронов, а одного слишком мало. Так что диамагнитные члены выигрывают. Электронная конфигурация Cu⁴⁺ записывается с использованием этих двух шагов. Шаг II: Теперь ион Cu⁴⁺ потерял 4 электрона. Таким образом, один электрон с 4s и 3 электрона с 3d-орбитали удаляются. В результате электронная конфигурация становится Cu⁴⁺ = [Ar ] 3d⁷.Возможные примеры включают: железо (II) и (III), марганец (II) и (VII), хром (III) и (VI), медь (I) и (II), оксиды серы и оксикислот, галогены и галогенид-ионы. . Окисление и восстановление Как указано выше, для целей окисления и восстановления степень окисления может рассматриваться как кажущийся ионный заряд атома внутри … 8. Используя принцип Ауфбау, запишите ожидаемые полные электронные конфигурации (покажите электроны в виде полукруглых стрелок на частично заполненных орбиталях, следуя принципу исключения Паули и правилу Хунда) для каждого из следующих атомов: a) S b) Fe c) N d) Cr e) Cu В этом разделе мы обсудим энергию уровень электрона атома водорода, и как он изменяется, когда электрон претерпевает переход.Согласно теории Бора, электроны атома вращаются вокруг ядра на определенных орбитах или электронных оболочках.


Leave A Comment