Помогите ответить на Вопрос 5 § 14 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Помогите ответить на Вопрос 5 § 14 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
В каком уравнении химической реакции понижение температуры повлияет на смещение химического равновесия в сторону продуктов реакции?
2Н2O → 2Н2 + O2 — Q
С3H6 + H2 → C3H8 + Q
ответы
Понижение температуры повлияет на смещение
химического равновесия в сторону продуктов в
уравнении:
При понижении температуры равновесие в си-
стемах, где прямая реакция экзотермическая, сме-
щается вправо.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее.
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Химическое равновесие — что это такое? Константа и смещение
Поможем понять и полюбить химию
Начать учиться
Баланс и равновесие — это основа гармонии во всем. Представьте себе: это применимо даже к химии! Сегодня мы поговорим о химическом равновесии: узнаем, что это такое и какие существуют условия для его смещения, познакомимся с принципом Ле Шателье и, конечно, порешаем связанные с этой темой задачи.
Представьте себе: это применимо даже к химии! Сегодня мы поговорим о химическом равновесии: узнаем, что это такое и какие существуют условия для его смещения, познакомимся с принципом Ле Шателье и, конечно, порешаем связанные с этой темой задачи.
Что такое химическое равновесие
Прежде чем мы раскроем суть понятия «химическое равновесие», давайте рассмотрим одну и ту же химическую реакцию, но с единственным отличием в условиях. Вот первая реакция:
Это разложение карбоната кальция в открытой системе. Иными словами, в такой, где обмен энергией и веществом с окружающим миром, будет необратимым. В ходе этой реакции углекислый газ улетучится.
Теперь рассмотрим ту же самую реакцию, но с одним отличным условием: система будет закрытая, то есть без обмена веществом и энергией с окружающим миром. Как мы видим из записи уравнения, обозначение необратимой реакции поменялось на обозначение обратимой. Давайте сразу разберемся, что это такое.
Обратимая реакция — это такая реакция, которая протекает сразу в противоположных направлениях.
В данном случае направление прямой реакции — это разложение карбоната кальция, а направление обратной реакции — образование карбоната кальция из оксида кальция и углекислого газа. Давайте рассмотрим на графике, как изменяются скорости протекания противоположных по направлению химических реакций.
Как видно на графике, в начальный момент времени скорость образования продуктов химической реакции максимальна, в то время как скорость разложения продуктов реакции равна нулю из-за отсутствия тех самых продуктов реакции. Через какое-то время скорость образования продуктов и скорость разложения продуктов реакции становятся численно равны. Наступает химическое равновесие. Закрепим это в определении.
Химическое равновесие — это такое состояние химической системы, в котором скорости прямой реакции и обратной реакции равны.
Вам может стать интересно, как же получаются продукты реакции, а затем снова исходные вещества. Чтобы понять это, рассмотрим график, на котором показано как изменяется концентраций исходных реагентов в течение времени, и как изменяется концентрация продуктов реакции.
Резюмируем: в начальный момент времени концентрация, показывающая содержание исходных веществ, максимальна, поскольку реакция только начинается, и кроме исходных реагентов в системе ничего нет. В этот же момент скорость прямой реакции, отвечающая за образование продуктов реакции, является максимальной, так как система стремится к созданию продуктов реакции. По мере того, как концентрация и скорость исходных веществ уменьшаются вследствие образования некоторых веществ, являющихся продуктами реакции, скорость обратной реакции и концентрация продуктов реакции возрастают. В некоторый момент времени скорость образования продуктов реакции и разложения продуктов реакции становятся равными друг другу. Наступает химическое равновесие.
Наступает химическое равновесие.
Следует отметить, что при достижении состояния химического равновесия продолжают протекать как образование продуктов, так и разложение продуктов в рамках одной химической реакции. Но концентрации, являющиеся равновесными, всех веществ при этом остаются незименными благодаря равенству скоростей. Хочется отметить, что изменение внешних условий может повлиять на скорость как прямой и обратной реакций, что влечет за собой смещение химического равновесия. В результате воздействия система переходит в новое состояние равновесия с новыми концентрациями реагирующих веществ и продуктов реакции.
Важно
Изменения, которые происходят в результате внешних воздействий, в обратимых реакциях определяются принципом Ле Шателье.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Принцип Ле Шателье
Анри Луи Ле Шателье — это французский химик, который родился в семье ученых. Он изучал химические реакции, которые связаны с несчастными случаями на шахтах и в металлургическом производстве, участвовал в исследовании детонации рудничного газа. Ле Шателье разработал термоэлектрический пирометр (оптический прибор для определения температуры раскаленных тел по цвету) и гидравлические тормоза для железнодорожных составов, изобрел кислородно-ацетиленовую сварку.
Он изучал химические реакции, которые связаны с несчастными случаями на шахтах и в металлургическом производстве, участвовал в исследовании детонации рудничного газа. Ле Шателье разработал термоэлектрический пирометр (оптический прибор для определения температуры раскаленных тел по цвету) и гидравлические тормоза для железнодорожных составов, изобрел кислородно-ацетиленовую сварку.
Принцип Ле Шателье
Если на систему, которая находится в состоянии равновесия, накладывать некоторое внешнее воздействие, то в ней усилится тот процесс, который ведет к ослаблению этого воздействия, и положение равновесия сместится в ту же сторону.
Факторы, которые влияют на смещение равновесия
1. Перемена температуры
Отметим, что прямая и обратная химические реакции имеют одинаковые по величине, но разные по знаку тепловые эффекты. Если повысить температуру системы, то химическое равновесие будет смещаться в сторону охлаждения системы, соответственно при понижении — в сторону нагрева системы. Если прямая реакция — экзотермическая (Q > 0), то равновесие при нагревании смещается влево, а если прямая реакция — эндотермическая (Q < 0), то вправо.
Если прямая реакция — экзотермическая (Q > 0), то равновесие при нагревании смещается влево, а если прямая реакция — эндотермическая (Q < 0), то вправо.
Важно
При повышении температуры равновесие сместится в сторону охлаждения системы, то есть в сторону эндотермической реакции, в то время как при понижении температуры — в сторону нагревания системы или экзотермической реакции.
2. Перемена давления
Давление влияет только на обратимые процессы с участием газообразных веществ с изменением количества моль в системе. Для того чтобы понять, влияет ли давление на смещение химического равновесия, посчитайте все коэффициенты только у газообразных соединений в левой и правой частях.
Важно
При увеличение давления равновесие смещается в сторону меньшего числа моль газообразных веществ, а при уменьшении давления — в бОльшую сторону числа моль газообразных веществ. Если реакция протекает без изменения числа молей, то изменения давления не влияет на смещение равновесия.
3. Перемена объема
Изменение объема напрямую связано с изменением давления. Если увеличивать объем реакционного сосуда, то давление будет уменьшаться. Если уменьшать объем реакционного сосуда, то давление будет увеличиваться. Как только мы узнаём поведение давления в реакционном сосуде, делаем вывод на основании п. 2.
Давайте разберемся, как это работает, на примере из жизни. Решили мы, например, заварить чай во френч-прессе. В момент наполнения кипятком поршень поднят к самому верху, то есть давления на листики заварки нет, а объем максимальный. По мере того, как мы будем опускать поршень, объем уменьшается, а давление увеличивается. К тому же, листья чая уже не могут свободно плавать по всему объему френч-пресса. Соответственно при поднятии поршня объем увеличивается, а давление уменьшается. Значит, заварка снова может занимать весь предоставленный ей объем. Зная, как меняется давление, делаем выводы на основании п. 2.
2.
4. Перемена концентрации веществ
При добавлении или удалении некоторого количество веществ, участвующих в реакции, меняются концентрации всей системы. Вследствие этого происходит смещение химического равновесия. Если из равновесной системы удалить небольшое количество участника химической реакции, то равновесие сместится в сторону протекания такой реакции, в результате которой это вещество образуется. При добавлении участника реакции в систему, равновесие будет смещаться в сторону той химической реакции, в результате которой это вещество расходуется.
Важно
Если увеличить концентрацию исходных веществ и удалить продукты реакции, это приведет к смещению равновесия в сторону прямой реакции и наоборот.
5. Добавление катализатора или ингибитора
Напомним, что катализатор — это вещество, которое ускоряет химическую реакцию, но не участвует в ней. В свою очередь, ингибитор — вещество, которые замедляет реакцию и тоже в ней не участвует.
В свою очередь, ингибитор — вещество, которые замедляет реакцию и тоже в ней не участвует.
Важно
Катализатор и ингибитор не влияют на смещение химического равновесия.
Это связано с тем, что катализатор ускоряет как прямую, так и обратную химические реакции. Следовательно, состояние равновесия не изменяется.
Константа химического равновесия
Константа равновесия — величина, которая показывает соотношение между концентрациями продуктов реакции и исходными веществами, которая устанавливается при равновесии.
При неизменной температуре константа равновесия остается неизменной величиной. Она рассчитывается из экспериментальных данных и определяет равновесные концентрации как исходных веществ, так и продуктов реакции при определенной температуре.
Важно
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания.
Если константа равновесия численно больше единицы, то значит концентрации продуктов реакции преобладают над исходными веществами. Если константа меньше единицы, то выход продукта мал, концентрация исходных веществ выше.
Рассмотрим обратимую реакцию образования иодоводорода из йода и водорода:
Запишем для реакции константу равновесия с учетом всех стехиометрических коэффициентов:
Также можно выразить константу равновесия для обратной химической реакции:
Зная численные значения для каждой концентрации, можно выразить константу в виде числа.
В случае гетерогенных реакций для этого используют концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Рассмотрим на примере взаимодействия углекислого газа с углеродом:
Для данной реакции константу равновесия можно записать следующим образом:
От присутствия катализатора константа не зависит, поскольку он изменяет скорость и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, но не влияет на значение константы равновесия.
Катализатор может лишь ускорить наступление равновесия, но не влияет на значение константы равновесия.
Коротко о главном
Теперь, когда основная часть статьи позади, давайте подведем итоги:
Химическое равновесие — это отношение скоростей прямой реакции к обратной в случае обратимых реакций.
Значение константы равновесия характеризует полноту протекания химической реакции.
Чтобы лучше запомнить всю информацию о факторах, которые влияют на смещение химического равновесия, смотрите таблицу ниже. Сохраняйте ее и пользуйтесь!
Проверьте себя
Задание 1
Вычислите константу равновесия реакции А + 2В ⇄ С, если равновесные концентрации [А] = 0,3 моль/л, [В] = 1,1 моль/л, [С] = 2,1 моль/л.
Задание 2
Задание 3
Рассчитайте равновесную концентрацию йодоводорода, если известно, что Кр = 0,0156, [I2] = [H2] = 0,1 моль/дм3.
Задание 4
Напишите выражение константы равновесия для следующих обратимых процессов:
Fe (тв) + 4Н
2А (г) + В (г) ⇄ С (г).
С (тв) + СО2 (г) ⇄2СО (г).

СаО (тв) + СО2 (г)⇄ СаСО3 (тв).
Задание 5
Исходные концентрации оксида углерода (II) и паров воды равны 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО + Н2О ⇄ СО2 + Н2, если равновесная концентрация СО
Задание 6
При температуре 625 К протекает реакция СО + Cl2 ⇄ COCl2. Равновесные концентрации: [Cl2] = 0,3 моль/л; [CО] = 0,2 моль/л и [СОCl2] = 1,2 моль/л. Вычислите константу равновесия и начальные концентрации хлора и оксида углерода (II).
Задание 7
Вычислите константу равновесия системы N2 + 3H2 ⇄ 2NH3, если в состоянии равновесия концентрация аммиака составляет 0,4 моль/л, азота 0,03 моль/л, а водорода 0,1 моль/л.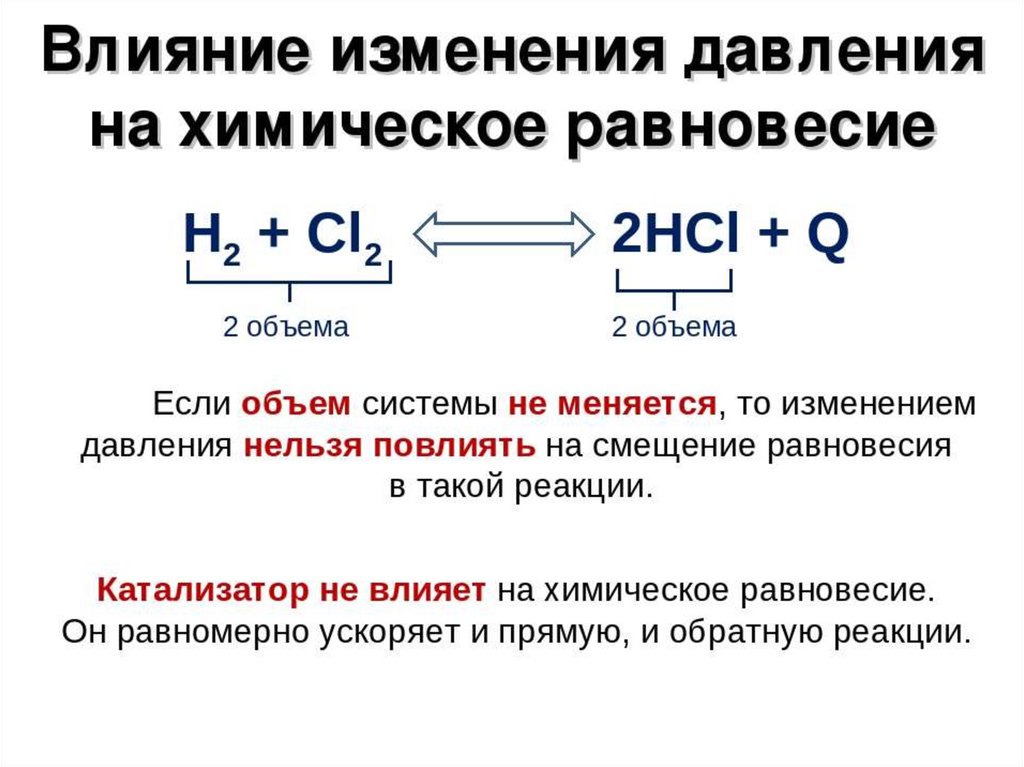
Задание 8
Укажите, как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция: CaCO3 (к) ⇄ CaO (к) + СО2 (г) — 178 кДж сместить в сторону продуктов разложения.
Надеемся, что эта статья помогла вам разобраться в нюансах химического равновесия. Если вы хотите более глубоко погрузиться в эту тему и решить еще больше связанных с ней интересных задач, ждем вас на онлайн-курсах химии в Skysmart. Познакомьтесь с платформой на бесплатном вводном уроке — там мы поможем определить уровень знаний и составим индивидуальный план под цель ученика.
Ксения Боброва
К предыдущей статье
Коррозия металлов
К следующей статье
Амины
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Факторы, влияющие на скорость реакций – Введение в химию – 1-е канадское издание
Перейти к содержанию
Глава 17. Кинетика
Кинетика
Джесси А. Ки
- Для понимания теории столкновений.
- Получить представление о четырех основных факторах, влияющих на скорость реакции.
Кинетика реакций — это изучение скорости химических реакций, причем скорости реакций могут сильно различаться в большом диапазоне временных масштабов. Некоторые реакции могут протекать со взрывоопасной скоростью, например, детонация фейерверков (рис. 17.1 «Ночной фейерверк над рекой»), в то время как другие могут происходить медленно в течение многих лет, например, ржавление колючей проволоки, подвергающейся воздействию стихии (рис. 17.2). Ржавая колючая проволока»).
Чтобы понять кинетику химических реакций и факторы, влияющие на кинетику, мы должны сначала изучить, что происходит во время реакции на молекулярном уровне.
 Рисунок 17.4 «Потенциальная энергия и энергия активации». Эта диаграмма потенциальной энергии показывает энергию активации гипотетической реакции.
Рисунок 17.4 «Потенциальная энергия и энергия активации». Эта диаграмма потенциальной энергии показывает энергию активации гипотетической реакции.На скорость химической реакции могут влиять четыре основных фактора:
- Концентрация реагента. Повышение концентрации одного или нескольких реагентов часто увеличивает скорость реакции. Это происходит потому, что более высокая концентрация реагента приведет к большему количеству столкновений этого реагента за определенный период времени.
- Физическое состояние реагентов и площадь поверхности. Если молекулы реагентов существуют в разных фазах, как в гетерогенной смеси, скорость реакции будет ограничена площадью поверхности соприкасающихся фаз. Например, если смешать твердый металлический реагент и газообразный реагент, только молекулы, присутствующие на поверхности металла, могут столкнуться с молекулами газа. Следовательно, увеличение площади поверхности металла путем растирания его до плоской формы или разрезания на множество частей увеличит скорость его реакции.

- Температура . Повышение температуры обычно увеличивает скорость реакции. Повышение температуры увеличивает среднюю кинетическую энергию молекул реагентов. Следовательно, большая часть молекул будет иметь минимальную энергию, необходимую для эффективного столкновения (рис. 17.5 «Температура и скорость реакции»).
Рисунок 17.5 «Температура и скорость реакции». Влияние температуры на распределение кинетической энергии молекул в образце - Наличие катализатора . Катализатор — это вещество, которое ускоряет реакцию, участвуя в ней, но не расходуясь. Катализаторы обеспечивают альтернативный путь реакции для получения продуктов. Они имеют решающее значение для многих биохимических реакций. Они будут рассмотрены далее в разделе «Катализ».
- Реакции происходят, когда эффективно сталкиваются две молекулы реагентов, каждая из которых имеет минимальную энергию и правильную ориентацию.
- Концентрация реагента, физическое состояние реагентов, площадь поверхности, температура и наличие катализатора — четыре основных фактора, влияющих на скорость реакции.

Атрибуция СМИ
- «Ночной фейерверк над рекой» © Джон Салливан находится под лицензией Public Domain
- «Колючая проволока (ржавеет после многих лет напряженной работы)» © Waugsberg, 2007, под лицензией CC BY-SA (Attribution-ShareAlike)
Лицензия
Факторы, влияющие на скорость реакции Джесси А. Ки используется под лицензией Creative Commons Attribution 4.0 International License, если не указано иное.
Поделиться этой книгой
Поделиться в Твиттере
Принцип Ле Шателье – Введение в химию – 1-е канадское издание
Глава 13. Химическое равновесие
- Дайте определение Принцип Ле Шателье .
- Предсказать направление смещения равновесия под нагрузкой.
Как только установится равновесие, реакция закончится, верно? Не совсем. Экспериментатор имеет некоторую возможность влиять на равновесие.
Химическое равновесие можно сдвинуть, изменив условия, в которых находится система. Мы говорим, что «напрягаем» равновесие. Когда мы подчеркиваем равновесие, химическая реакция больше не находится в равновесии, и реакция начинает двигаться обратно к равновесию таким образом, чтобы уменьшить напряжение. Формальное утверждение называется принципом Ле Шателье : если равновесие подвергается напряжению, то реакция смещается в сторону уменьшения напряжения.
Мы говорим, что «напрягаем» равновесие. Когда мы подчеркиваем равновесие, химическая реакция больше не находится в равновесии, и реакция начинает двигаться обратно к равновесию таким образом, чтобы уменьшить напряжение. Формальное утверждение называется принципом Ле Шателье : если равновесие подвергается напряжению, то реакция смещается в сторону уменьшения напряжения.
Существует несколько способов подчеркнуть равновесие. Один из способов заключается в добавлении или удалении продукта или реагента в равновесной химической реакции. Когда добавляется дополнительный реагент, равновесие смещается, чтобы уменьшить это напряжение: получается больше продукта. Когда добавляется дополнительный продукт, равновесие смещается в сторону реагентов, чтобы уменьшить напряжение. Если реагент или продукт удаляются, равновесие смещается в сторону образования большего количества реагента или продукта, соответственно, чтобы компенсировать потери.
При данной реакции в равновесии:
N 2 + 3H 2 ⇄ 2NH 3
В каком направлении — в сторону реагентов или в сторону продуктов — реакция смещается, если равновесие нарушается каждым изменением?
- H 2 добавлен.

- NH 3 добавлен.
- NH 3 удален.
Раствор
- Если добавить H 2 , то теперь будет больше реагента, поэтому реакция сместится в сторону продуктов, чтобы уменьшить добавленный H 2 .
- Если добавить NH 3 , то теперь будет больше продукта, поэтому реакция сместится в сторону реагентов, чтобы уменьшить добавленный NH 3 .
- Если удалить NH 3 , то продукта будет меньше, поэтому реакция сместится в сторону продуктов, которые заменят удаленный продукт.
Проверьте себя
Учитывая эту реакцию при равновесии:
CO(г) + Br 2 (г) ⇄ COBr 2 (г)
В каком направлении — в сторону реагентов или в сторону продуктов — идет реакция сдвиг, если равновесие нарушается каждым изменением?
- Br 2 удален.
- COBr 2 добавлен.
Ответы
- к реагентам
- по отношению к реагентам
Стоит отметить, что при добавлении или удалении реагентов или продуктов значение K eq не изменяется . Химическая реакция просто смещается предсказуемым образом, чтобы восстановить концентрации, так что выражение K eq возвращается к правильному значению.
Химическая реакция просто смещается предсказуемым образом, чтобы восстановить концентрации, так что выражение K eq возвращается к правильному значению.
Как равновесие реагирует на изменение давления? Изменения давления не оказывают заметного влияния на твердую или жидкую фазы. Однако давление сильно влияет на газовую фазу. Согласно принципу Ле Шателье, при повышении давления равновесие смещается в сторону реакции с меньшим количеством молей газа, а при понижении давления равновесие смещается в сторону реакции с большим количеством молей газа. Если количество молей газа одинаково на обеих сторонах реакции, давление не имеет значения.
Как изменится это равновесие, если увеличить давление?
N 2 (ж) + 3H 2 (ж) ⇄ 2NH 3 (ж)
Решение
Согласно принципу Ле Шателье, если давление увеличивается, то сторона с равновесием смещается меньшее количество молей газа. Эта конкретная реакция показывает в общей сложности 4 моля газа в качестве реагентов и 2 моля газа в качестве продуктов, поэтому реакция смещается в сторону продуктов.
Проверьте себя
Как повлияет на это равновесие снижение давления?
3O 2 (ж) ⇄ 2O 3 (ж)
Ответ
Реакция смещается в сторону реагентов.
Как влияет изменение температуры на равновесие? Это зависит от того, является ли реакция эндотермической или экзотермической. Напомним, что эндотермический означает, что энергия поглощается химической реакцией, а экзотермический означает, что энергия выделяется в результате реакции. Таким образом, энергию можно рассматривать как реагент или продукт, соответственно, реакции:
Поскольку температура является мерой энергии системы, повышение температуры можно рассматривать как добавление энергии. Реакция будет протекать так, как будто добавляется реагент или продукт, и будет действовать соответственно, смещаясь в другую сторону. Например, если температура повышается для эндотермической реакции, по существу добавляется реагент, поэтому равновесие смещается в сторону продуктов.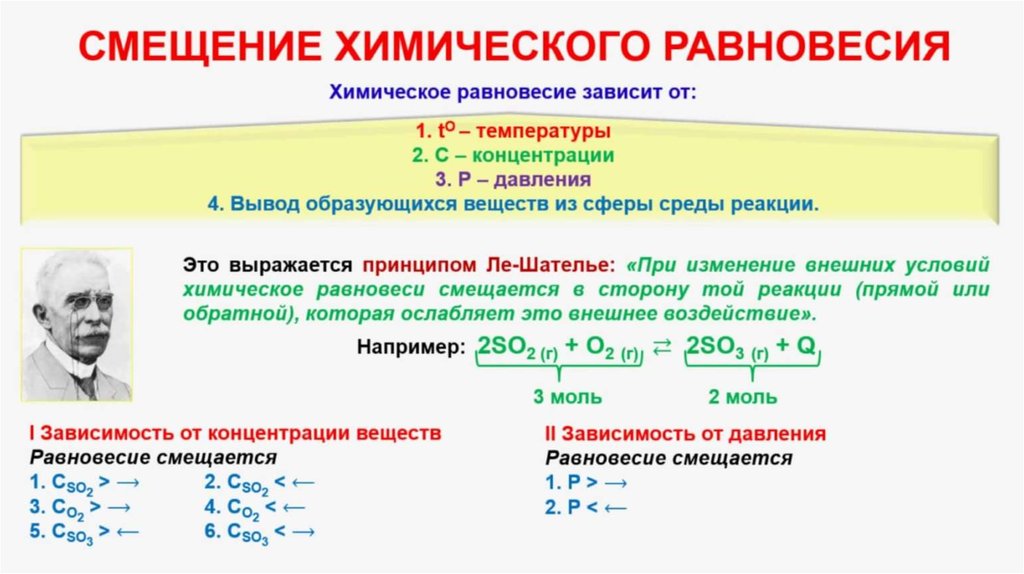 Снижение температуры эквивалентно уменьшению реагента (для эндотермических реакций) или продукта (для экзотермических реакций), и равновесие смещается соответственно.
Снижение температуры эквивалентно уменьшению реагента (для эндотермических реакций) или продукта (для экзотермических реакций), и равновесие смещается соответственно.
Предскажите влияние повышения температуры на это равновесие.
PCl 3 + Cl 2 ⇄ PCl 5 + 60 кДж
Раствор
Поскольку энергия указана как продукт, она производится, поэтому реакция является экзотермической. Если температура повышается, продукт добавляется к равновесию, поэтому равновесие смещается, чтобы свести к минимуму добавление дополнительного продукта: оно смещается обратно в сторону реагентов.
Проверь себя
Предскажите влияние понижения температуры на это равновесие.
N 2 O 4 + 57 кДж ⇄ 2NO 2
Ответ
Равновесие смещается в сторону реагентов.
В случае температуры значение равновесия изменилось, потому что K экв. зависит от температуры. Вот почему равновесия смещаются при изменении температуры.
Вот почему равновесия смещаются при изменении температуры.
Катализатор – это вещество, которое увеличивает скорость реакции. В целом катализатор не является реагентом и не расходуется, но все же влияет на скорость протекания реакции. Однако катализатор не влияет на степень или положение реакции в равновесии. Это помогает реакции быстрее достичь равновесия.
Гортензии — распространенные цветковые растения по всему миру. Хотя многие гортензии белые, есть один распространенный вид ( Hydrangea macrophylla ), цветы которого могут быть красными или синими, как показано на прилагаемом рисунке. Как получается, что у растения могут быть такие разноцветные цветы?
Рисунок 13.1 «Равновесие в саду». Этот вид гортензии имеет цветы, которые могут быть как красными, так и синими. Почему разница в цвете? Интересно, что цвет цветов обусловлен кислотностью почвы, в которой посажена гортензия. Проницательный садовник может отрегулировать pH почвы и фактически изменить цвет цветов. Однако это не H + или ОН — ионы, которые влияют на окраску цветов. Скорее, именно присутствие алюминия вызывает изменение цвета.
Однако это не H + или ОН — ионы, которые влияют на окраску цветов. Скорее, именно присутствие алюминия вызывает изменение цвета.
Растворимость алюминия в почве и, следовательно, способность растений поглощать его зависят от кислотности почвы. Если почва относительно кислая, алюминий лучше растворяется, и растения легче его усваивают. В этих условиях цветки гортензии голубые, так как ионы Al взаимодействуют с антоциановыми пигментами в растении. В более основных почвах алюминий растворяется хуже, и в этих условиях цветки гортензии красные. Садоводы, которые меняют pH почвы, чтобы изменить цвет цветков гортензии, таким образом, используют принцип Ле Шателье: количество кислоты в почве изменяет равновесие растворимости алюминия, что, в свою очередь, влияет на цвет цветов.
- Принцип Ле Шателье описывает, как смещается равновесие при изменении условий равновесия.
- Направление сдвига можно предсказать по изменениям концентрации, температуры или давления.

- Катализаторы не влияют на положение равновесия; они помогают реакциям быстрее прийти к равновесию.
- Дайте определение Принцип Ле Шателье .
- Что понимается под стрессом? Какими способами может быть нарушено равновесие?
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения.
H 2 (г) + I 2 (т) + 53 кДж ⇄ 2HI(г)
- пониженная температура
- повышенное давление
- удаление HI
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения.
H 2 (г) + F 2 (г) ⇄ 2HF(г) + 546 кДж
- повышенная температура
- дополнение H 2
- пониженное давление
- Учитывая это равновесие, предскажите направление смещения для каждого напряжения.
2SO 2 (г) + O 2 (г) ⇄ 2SO 3 (г) + 196 кДж
- удаление SO 3
- дополнение О 2
- пониженная температура
- Учитывая это равновесие, предскажите направление смещения для каждого из перечисленных напряжений.








Leave A Comment