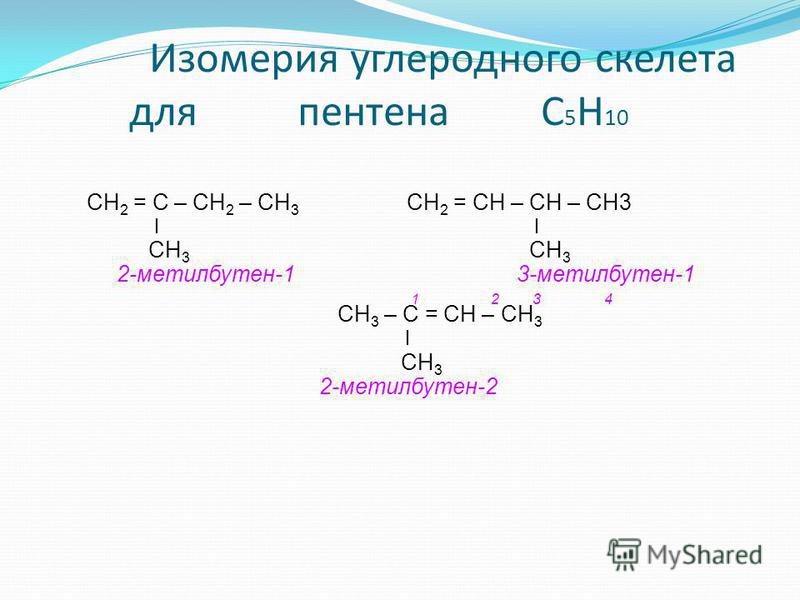
2-метилбутен-1, химические свойства, изомеры, Ch3=C(Ch4)-Ch3-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задание 12
Задание 12.1
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
1) бутан
2) циклобутан
3) бутин-3
4) бутадиен-1,3
5) метилпропен
Запишите в поле ответа номера выбранных веществ.
Источник — Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Решение
Напомним, что к структурной изомерии алкенов, к которым относится бутен-1, относится изомерия углеродной цепи, изомерия положения двойной связи и межклассовая изомерия. Среди перечисленных соединений изомерами бутена-1 являются циклобутан (межклассовая изомерия; алкенам изомерны циклоалканы) и метилпропен (изомерия углеродной цепи).
Приведем структурные формулы данных соединений:
| Бутен-1 | |
| Циклобутан | |
| Метилпропен |
Ответ: 25
Задание 12. 2
2
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентена-2.
1) пентадиен-1,4
2) циклопентан
3) пентин-1
4) 2-метилбутен-2
5) 2-метилбутан
Запишите в поле ответа номера выбранных веществ.
Решение
Напомним, что к структурной изомерии алкенов, к которым относится пентен-2, относится изомерия углеродной цепи, изомерия положения двойной связи и межклассовая изомерия. Среди перечисленных соединений изомерами пентена-2 являются циклопентан (межклассовая изомерия; алкенам изомерны циклоалканы) и 2-метилбутен-2 (изомерия углеродной цепи).
Приведем структурные формулы данных соединений:
| Пентен-2 | |
| Циклопентан | |
| 2-метилбутен-2 |
Ответ: 24
Задание 12.3
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентина-1.
1) 3-метилбутин-1
2) 3-этилбутин-1
3) пентен-2
4) пентин-2
5) метилциклобутан
Запишите в поле ответа номера выбранных веществ.
Решение
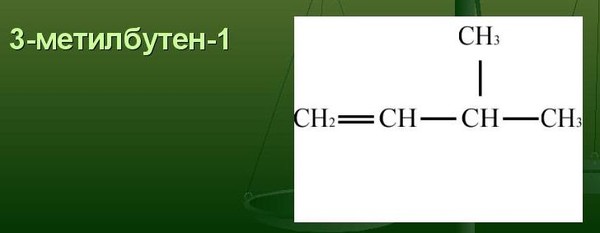
Напомним, что к структурной изомерии алкинов, к которым относится пентин-1, относится изомерия углеродной цепи, изомерия положения тройной связи и межклассовая изомерия. Среди перечисленных соединений изомерами пентина-1 являются 3-метилбутин-1 (изомерия углеродной цепи) и пентин-2 (изомерия положения тройной связи).
Приведем структурные формулы данных соединений:
| Пентин-1 | |
| 3-метилбутин-1 | |
| Пентин-2 |
Ответ: 14
Задание 12.4
Из предложенного перечня выберите два вещества, которые являются структурными изомерами пентина-2.
1) пентен-1
2) циклопентан
3) циклопентен
4) 2-метилбутадиен-1,3
5) 2-метилбутен-1
Запишите в поле ответа номера выбранных веществ.
Решение
Напомним, что к структурной изомерии алкинов, к которым относится пентин-2, относится изомерия углеродной цепи, изомерия положения тройной связи и межклассовая изомерия. Среди перечисленных соединений изомерами пентина-2 являются циклопентен (межклассовая изомерия; алкины изомерны циклоалкенам) и 2-метилбутадиен-1,3 (межклассовая изомерия; алкины изомерны алкадиенам).
Приведем структурные формулы данных соединений:
| Пентин-2 | |
| Циклопентен | |
| 2-метилбутадиен-1,3 |
Ответ: 34
Задание 12.5
Из предложенного перечня выберите два вещества, которые являются структурными изомерами этилацетата.
1) бутановая кислота
2) пентановая кислота
3) метилпропионат
4) бутаналь
5) диэтиловый эфир
Запишите в поле ответа номера выбранных веществ.
Решение
Напомним, что к структурной изомерии сложных эфиров, к которым относится этилацетат, относится изомерия углеродной цепи,
изомерия положения сложноэфирной группы и межклассовая изомерия.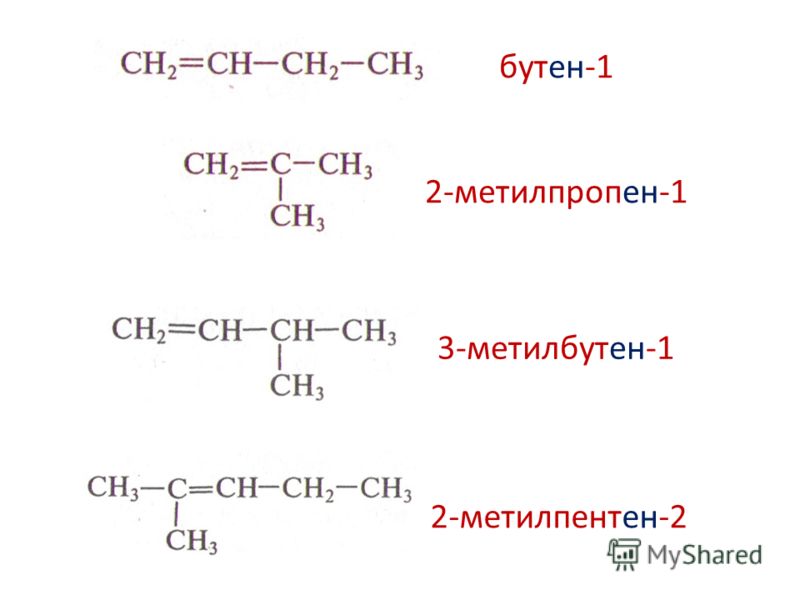 Среди перечисленных соединений изомерами этилацетата являются
бутановая кислота (межклассовая изомерия; сложные эфиры изомерны карбоновым кислотам) и метилпропионат
(изомерия положения сложноэфирной группы).
Среди перечисленных соединений изомерами этилацетата являются
бутановая кислота (межклассовая изомерия; сложные эфиры изомерны карбоновым кислотам) и метилпропионат
(изомерия положения сложноэфирной группы).
Приведем структурные формулы данных соединений:
| Этилацетат | |
| Бутановая кислота | |
| Метилпропионат |
Ответ: 13
Задание 12.6
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутанола-1.
1) бутаналь
2) диэтиловый эфир
3) масляная кислота
4) метилпропионат
5) 2-метилпропанол-2
Запишите в поле ответа номера выбранных веществ.
Решение
Напомним, что к структурной изомерии спиртов, к которым относится бутанол-1, относится изомерия углеродной цепи,
изомерия положения гидроксильной группы и межклассовая изомерия. Среди перечисленных соединений изомерами бутанола-1 являются
диэтиловый эфир (межклассовая изомерия; спирты изомерны простым эфирам) и 2-метилпропанол-2 (изомерия углеродной цепи).
Приведем структурные формулы данных соединений:
| Бутанол-1 | |
| Диэтиловый эфир | |
| 2-метилпропанол-2 |
Ответ: 25
Задание 12.7
Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами.
1) гексан
2) метилциклопентан
3) гексадиен-1,5
4) гексен-1
5) циклогептан
Запишите в поле ответа номера выбранных веществ.
Решение
Среди представленных углеводородов с одинаковым числом атомов углерода межклассовая изомерия характерна для циклоалканов (метилциклопентан) и алкенов (гексен-1).
Ответ: 24
Задание 12.8
Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами.
1) 2-метилпентан
2) 2-метилгексен-1
3) циклогексен
4) 2-метилпентадиен-1,4
5) метилциклопентан
Запишите в поле ответа номера выбранных веществ.
Решение
Среди представленных углеводородов с одинаковым числом атомов углерода межклассовая изомерия характерна для циклоалкенов (циклогексен) и алкадиенов (2-метилпентадиен-1,4).
Ответ: 34
Задание 12.9
Из предложенного перечня выберите два вещества, в которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) пропилен
2) стирол
3) ацетилен
4) изопрен
5) бутадиен-1,3
Запишите в поле ответа номера выбранных веществ.
Решение
Состояние sp2-гибридизации характерно для атомов углерода, образующих двойную связь. Все атомы углерода находятся в состоянии sp2-гибридизации в молекуле стирола C6H5-CH=CH2 и бутадиена-1,3 CH2=CH-CH=CH2.
Ответ: 25
Задание 12.10
Из предложенного перечня выберите два вещества, в молекулах которых присутствуют атомы углерода в состоянии sp2-гибридизации.
1) 2-метилбутен-1
2) циклопентан
3) пентин-2
4) пентен-1
5) 2-метилбутан
Запишите в поле ответа номера выбранных веществ.
Решение
Состояние sp2-гибридизации характерно для атомов углерода, образующих двойную связь. Атомы углерода в состоянии sp2-гибридизации присутствуют в молекулах 2-метилбутена-1 CH2=С(CH3)-CH2-CH3 и пентена-1 CH2=CH-CH2-CH2-CH3.
Ответ: 14
Задание 12.11
Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
1) 2-метилбутан
2) гексен-2
3) пентин-2
4) циклогексан
5) 3-метилпентен-2
Запишите в поле ответа номера выбранных веществ.
Решение
Цис-транс-изомерия характерна для углеводородов, содержащих двойные связи.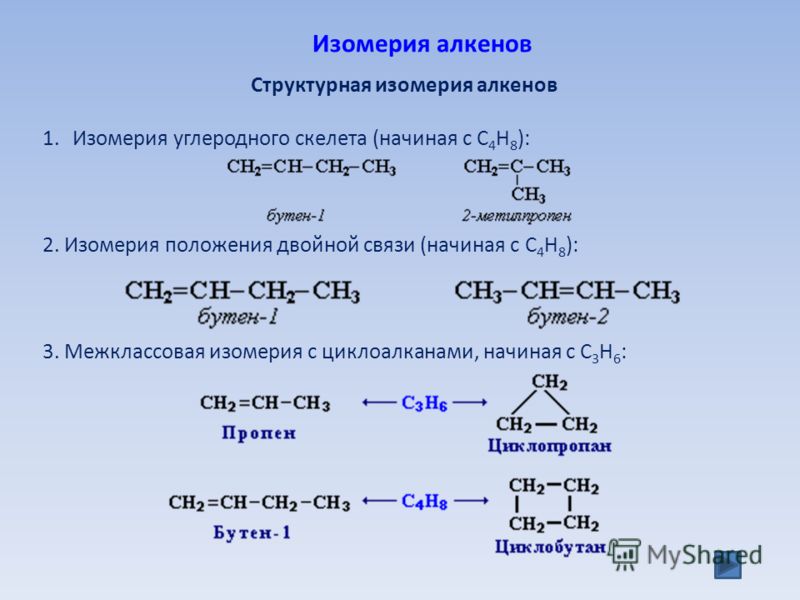 Среди представленных соединений в виде цис-транс-изомеров существуют молекулы гексена-2 и 3-метилпентена-2.
Среди представленных соединений в виде цис-транс-изомеров существуют молекулы гексена-2 и 3-метилпентена-2.
Ответ: 25
6.6: Сводная диаграмма изомерии — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 136882
Цель обучения
- различать и различать структурные и химические связи между изомерными соединениями
Различные типы изомеров были представлены и исследованы в нескольких главах. Может быть полезно просмотреть, сравнить и противопоставить все формы изомерии, чтобы развить наши навыки различения. Краткий обзор каждого типа изомерии следует за сводной диаграммой. Полное объяснение см. в соответствующей главе.
Полное объяснение см. в соответствующей главе.
Конформационные изомеры
Вращение одинарных связей C–C в обеих углеродных цепях создает конформеры (одно и то же соединение показано с разным вращением). Следовательно, возможно множество различных расположений атомов, каждое из которых соответствует разным степеням вращения. Различия в трехмерной структуре, возникающие в результате вращения вокруг σ-связи, называются различиями в конформации, а каждое различное расположение называется конформационным изомером (или конформером). В то время как полное вращение одинарных связей С-С в кольцах невозможно. Свобода движения связи действительно позволяет кольцам принимать различные конформации, такие как стул и лодка для 6-членных колец.
Структурные (конституционные) изомеры
В отличие от конформационных изомеров, структурные изомеры различаются связностью, как показано ниже для 1-пропанола и 2-пропанола. Хотя эти два спирта имеют одинаковую молекулярную формулу C 3 H 8 O, положение группы –OH отличается, создавая уникальные соединения с разными физическими и химическими свойствами.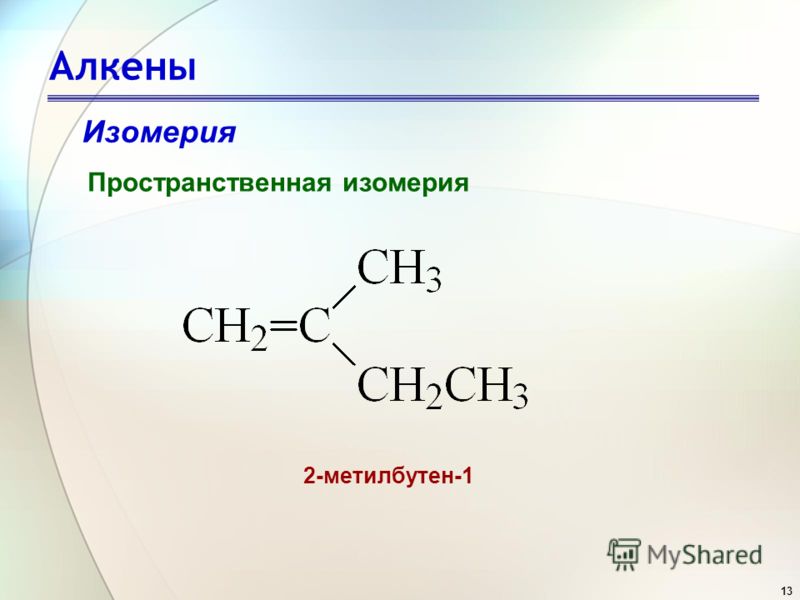
Рассмотрим, например, следующие пять структур, представленных формулой C 5 Н 12 . При превращении одного структурного изомера в другой по крайней мере одна связь должна быть разорвана и восстановлена в другом положении в молекуле.
Структуры (a) и (d) выше представляют собой одно и то же соединение, н-пентан. Структуры (b) и (c) представляют собой одно и то же соединение, 2-метилбутан. Нет необходимости разрывать и реформировать облигации, чтобы конвертировать между (a) и (d) или между (b) и (c). Молекулы просто поворачиваются на 180° вокруг вертикальной оси. Структура (e) называется 2,2-диметилпропан. Возможны только три структурных изомера с химической формулой C 5 H 12 : н-пентан, 2-метилбутан и 2,2-диметилпропан. Структурные изомеры обладают различными физическими и химическими свойствами.
Стереоизомеры
Энантиомеры представляют собой пары соединений, которые не накладываются друг на друга. Когда в соединении есть два или более хиральных центра, могут существовать диатереомеры. Диастереомеры — это стереоизомеры, которые НЕ являются энантиомерами. Энантиомеры обладают всеми физическими свойствами, за исключением их взаимодействия с плоскополяризованным светом. Диастереомеры имеют разные физические свойства (температуры плавления, температуры кипения и плотности).
Диастереомеры — это стереоизомеры, которые НЕ являются энантиомерами. Энантиомеры обладают всеми физическими свойствами, за исключением их взаимодействия с плоскополяризованным светом. Диастереомеры имеют разные физические свойства (температуры плавления, температуры кипения и плотности).
Упражнение
1. Какими изомерами являются следующие пары? Примечание: может быть трудно ответить на этот вопрос непосредственно по именам. Может быть полезно нарисовать структуры.
- (R)-5-хлоргексен и 6-хлоргексен
- (2R,3R)-дибромгексан и (2R,3S)-дибромгексан
- Ответить
1.
а. Структурные изомеры
б. Диастереомеры
Авторы и ссылки
Д-р Дитмар Кеннеполь FCIC (профессор химии, Университет Атабаски)
Проф. Стивен Фармер (Государственный университет Сономы)
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), виртуальный учебник органической химии
6. 6: Сводная диаграмма изомерии распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
6: Сводная диаграмма изомерии распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги

Определение изомера в биологии, химии.
(существительное)
Любое из двух или более соединений с одинаковой молекулярной формулой, но с разной структурой.
(существительное)
Любое из двух или более соединений с одинаковой молекулярной формулой, но с разной структурой.
(существительное)
Молекулы с одинаковым числом атомов в различном геометрическом расположении.
Общее резюме изомерии и молекулярных дескрипторов, включая взаимосвязь конституциональных и стереоизомеров и взаимосвязь стереоизомеров
- Все изомеры 1,2-дихлора являются конституциональными изомеров изомеров 1,3-дихлора .
- В каждой категории (1,2- и 1,3-) (R,R)-транс изомер и (S,S)-транс изомер являются энантиомерами.
- Цис-изомер является диастереомером транс-изомеров .
- Этот изомер также является мезосоединением.

- Эти изомеров являются диастереоизомерами друг друга и входят в состав изомеров 1,2- и 1,3- изомеры .
Стереоизомеры
- Когда группа атомов, составляющих молекулы различных изомеров , связана друг с другом принципиально разными способами, мы называем такие соединения конституционными изомерами .
- Например, в случае углеводородов C4H8 большинство из изомеров являются конституциональными.
- Сокращенные структуры для четырех из этих изомеров показаны ниже с их названиями IUPAC.
- Пятым возможным изомером формулы C4H8 является Ch4CH=CHCh4.
- В цис-изомере метильные группы находятся на одной стороне; тогда как они находятся на противоположных сторонах транс изомера .
Изомеры в координационных соединениях
- Как и в случае других соединений, существует несколько видов координационных комплексов изомеров .

- Пример цис- и транс- изомеров можно увидеть для платины.
- Когда три идентичных лиганда занимают одну грань октаэдра, -изомер называется гранным, или fac.
- В fac изомер любые два идентичных лиганда являются соседними или цис-по отношению друг к другу.
- Если эти три лиганда и ион металла находятся в одной плоскости, то говорят, что изомер является меридиональным, или мером.
- Как и в случае других соединений, существует несколько видов координационных комплексов изомеров .
Органические изомеры
- Молекулы, имеющие одинаковую химическую формулу, но отличающиеся расположением (структурой) своих атомов и/или химических связей, известны как изомеры .
- Структурные изомеры (такие как бутан и изобутан) отличаются расположением ковалентных связей.
- Молекулы с одинаковым числом и типом атомов, расположенных по-разному, называются изомерами .
- (a) Структурные изомеры имеют различное ковалентное расположение атомов.

- (b) Геометрические изомеры имеют различное расположение атомов вокруг двойной связи.
Энантиомеры и стереоизомерия в органических соединениях
- Стереоизомеры — это изомеров , в которых связность связей одинакова, но пространственное расположение связей отличается.
- Стереоизомеры или пространственные изомеры являются специфическими типами изомеров .
- Стереоизомеры соединения имеют не только одинаковую химическую формулу (как и все изомеров ), но и одинаковую связность связей.
- (R, R) и (S, S) изомеров являются энантиомерами.
Органические энантиомеры
- Стереоизомеры представляют собой тип изомера , в котором порядок атомов в двух молекулах одинаков, но их расположение в пространстве различно.
- Оптические изомеры представляют собой стереоизомеры, образующиеся при наличии асимметричных центров; например, углерод с четырьмя связанными с ним различными группами.

- Энантиомеры представляют собой два оптических изомера (т.е. изомеров , являющихся отражением друг друга).
- Каждый стереоцентр в одном изомере имеет противоположную конфигурацию в другом.
- Соединения, являющиеся энантиомерами друг друга, обладают одинаковыми физическими свойствами, за исключением направления, в котором они вращают поляризованный свет, и того, как они взаимодействуют с различными оптическими изомерами других соединений.
Номенклатура стереоизомеров алкенов
- До сих пор префиксы цис- и транс- служили для различения стереоизомеров; однако не всегда ясно, какой изомер следует называть цис, а какой транс.
- Присвоение цис- или транс-префикса любому из этих изомеров может быть выполнено только произвольным образом, поэтому необходим более строгий метод.
- В изомерах , проиллюстрированных в разделе «Конфигурационные стереоизомеры алкенов», для которых подходило обозначение цис-транс, Z эквивалентен цис, а Е эквивалентен транс.

- Применяя эти правила к изомерам соединений A и B, показанным выше, мы определяем конфигурацию 1-бром-1-хлорпропена изомер как E (Br имеет более высокий приоритет, чем Cl, а Ch4 более высокий приоритет, чем H).
- Конфигурация изомера 1-циклобутил-2-этил-3-метил-1-бутена определена как Z (C4H7 имеет более высокий приоритет, чем H, а изопропильная группа имеет более высокий приоритет, чем этильная группа).
Изомеризация алкенов
- Молярная абсорбционная способность цис-изомера меньше, чем у транс-изомера , потому что стерическая скученность орто-позиций приводит к тому, что фенильные группы немного скручиваются из компланарности.
- Небольшая доля (6%) транс-S1 состояния флуоресцирует обратно в транс- изомер , но менее 0,1% флуоресценции из цис-S1 состояния.
- Некоторые из их результатов представлены в таблице ниже, причем такое же фотостационарное соотношение цис: транс наблюдается как для изомера , так и для изомера в качестве отправной точки.






Leave A Comment