CuO CuSo4 Cu CuO Cu(no3)2
CuO + H2SO4 → CuSO4 + H2O
CuO + 2H+ + SO42– → Cu2+ + SO42– + H2O
CuO + 2H+ → Cu2+ + H2O
+2 +6 –2 0 +2 +6 –2 0
CuSO4 + Fe → FeSO4 + Cu
ок-ль в-ль
Cu2+ + 2e– → Cu0 | 1
Fe0 – 2e– → Fe2+ | 1
0 0 t +2 –2
2Cu + O2 → 2CuO
в—льок
Cu0 – 2e– → Cu+2 | 2
O20 + 4e– → 2O–2 | 1
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO +2H+ + 2NO3– → Cu2+ + 2NO3– + H2O
CuO +2H+ → Cu2+ + H2O
Билет №11 (3)
Какой объём ацетилена можно получить из образца карбида кальция массой 100 г, если массовая доля примесей в нём 15%?
Дано: | Решение: |
mобр(CaC2) = 100 г ωприм = 15% | 85 г x г CaC2 + 2h3O → C2h3 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л mприм = 0,15 ∙ 100 г = 15 г m(CaC2) = mобр – mприм = 100 г – 15 г = 85 г M(CaC2) = 40 + 24 = 64 г/моль m(CaC2) = 64 г/моль ∙ 1 моль = 64 г Vm = 22,4 л/моль V(C2h3) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2h3) – ? | Ответ: V(C2h3) = 29,8 л |
Билет №12 (3)
Осуществить превращения:
Железо → хлорид железа (II) → гидроксид железа (II) → сульфат железа (II) → хлорид железа (II)
Fe FeCl2 Fe(oh)2 FeSo4 FeCl2
0 +1 –1 +2 –1 0
Fe + 2HCl → FeCl2 + H2
в-ль ок-ль
Fe0 – 2e– → Fe+2 | 1
2H+1 + 2e– → H20 | 1
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Fe2+ + 2Cl– + 2K+ + 2OH– → Fe(OH)2↓ + 2K+ + 2Cl–
Fe2+ + 2OH– → Fe(OH)2↓
Fe(OH)2 + H2SO4 → FeSO4 + 2H
Fe(OH)2 + 2H+ + SO42– → Fe2+ + SO42– + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
FeSO4 + BaCl2 → FeCl2 + BaSO4↓
Fe2+ + SO42– + Ba2+ + 2Cl– → Fe2+ + 2Cl– + BaSO4↓
SO42– + Ba2+ → BaSO4↓
Билет №13 (3)
Вычислите массу соли, образованной при взаимодействии уксусной кислоты массой 120 г и гидроксида натрия массой 60 г?
Дано: | Решение: |
m(Ch4COOH) = 120 г m(NaOH) = 60 г | 1,5 моль х моль Ch4COOH + NaOH → Ch4COONa + h3O 1 моль 1 моль 1 моль = 2 моль в избытке M(Ch4COOH) = 60 г/моль = 1,5 моль в недостатке
m = M ∙ ν M(Ch4COONa) = 82 г/моль m(Ch4COONa) = 82 г/моль ∙ 1,5 моль = 123 г |
m(Ch4COONa) – ? | Ответ: m(Ch4COONa) = 123 г |
Билет №14 (3)
Какой объём ацетилена можно получить из карбида кальция массой 38,4 г
Дано: | Решение: |
m(CaC2) = 38,4 г | 38,4 г x г CaC2 + 2h3O → C2h3 + Ca(OH)2 1 моль 1 моль 64 г 22,4 л m = M ∙ ν M(CaC2) = 40 + 24 = 64 г/моль Vm = 22,4 л/моль V(C2h3) = Vm ∙ ν = 22,4 л/моль ∙ 1 моль = 22,4 л |
V(C2h3) – ? | Ответ: V(C2h3) = 13,4 л |
Билет №15 (3)
Какая масса раствора с массовой долей гидроксида натрия 4% расходуется на нейтрализацию соляной кислоты массой 73 г?
Дано: | Решение: |
m (HCl) = 73 г ω(NaOH) = 4% | 2 моль x моль HCl + NaOH → NaCl + h3O 1 моль 1 моль
m(NaOH) = M ∙ ν = 40 г/моль ∙ 2 моль = 80 г
|
mр-ра(NaOH) – ? | Ответ: mр-ра(NaOH) = 2000 г |
Билет №16 (3)
Выведите молекулярную формулу
вещества, содержащего 80% углерода и 20%
водорода, если плотность по водороду
равна 15.
Дано: | Решение: |
Dh3(CxHy) = 15 ω(C) = 80% ω(H) = 20% |
M(h3) = 2 г/моль M(CxHy) = 2 г/моль ∙ 15 = 30 г/моль m(C) = 0,8 ∙ 30 г/моль = 24 г m(H) = 0,2 ∙ 30 г/моль = 6 г ν(C) : ν(H) = = 2 : 6 ⇒ С2Н6 M(C2H6) = 24 + 6 = 30 г/моль |
CxHy – ? | Ответ: С2Н6 |
Билет №17 (3)
Осуществить превращения:
Метан → хлорметан → этан → этилен → этанол
CH4
CH4 + Cl2 CH3Cl + HCl
2CH3Cl + 2Na CH3–CH3 + 2NaCl
CH3–CH3 CH2=CH2 + H2
CH2=CH2 + H2O CH3–CH2OH
Билет №18 (3)
Осуществить превращения:
Этен → этан → хлорэтан → этанол → этен
CH2=CH2 CH3–CH3 CH3CH2Cl CH3CH2OH CH2=CH2
CH2=CH2 + H2 CH3–CH3
CH3–CH3 + Cl2 CH3CH2Cl + HCl
CH3CH2Cl + KOH(водныйр—р) → CH3CH2OH + KCl
CH3CH2OH CH2=CH2 + H2O
Химические реакции — Химия в школе № 302 Фрунзенского района Санкт-Петербурга
Реакция обмена между оксидом меди и серной кислотой
youtube.com/embed/frzou7o4WSU?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Восстановление меди водородом из оксида меди
CuO + h3 → Cu + h3O (реакция замещения)
Получение водорода и проверка его на чистоту
Zn + 2HCl → ZnCl2 + h3↑ (реакция замещения)
Образование и разрушение кристаллогидратов
CuSO4*5h3O → CuSO4 + H2O (реакция разложения)
CuSO4 + h3O → CuSO4*5h3O (реакция соединения)CuSO4*5h3O медный купорос
CuSO4 сульфат меди
Химические свойства нерастворимых оснований
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4 (реакция обмена)
Cu(OH)2 → CuO + h3O (реакция возможна при нагревании) (реакция разложения)
Взаимодействие кислот с солями
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (реакция обмена)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция обмена)
Взаимодействие кислотных оксидов с водой
SiO2 + h3O (реакция не возможна, так как h3SiO3 — нерастворимая в воде кислота)
P2O5 + 3h3O → 2h4PO4 (реакция соединения)
youtube.com/embed/76fFWl1omTI?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Реакции нейтрализации
NaOH + HCl → NaCl + h3O (реакция обмена)
Взаимодействие хлора с железом
2Fe + 3Cl2 → 2FeCl3 (реакция соединения)
Взаимодействие соды с соляной кислотой
Na2CO3 + 2HCl → NaCl + h3O + CO2↑ (реакция обмена)
Химические свойства углекислого газа
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция разложения)
CO2 + Ca(OH)2 → CaCO3↓ + h3O (реакция обмена)
CO2 + 2Mg → C + 2MgO (реакция замещения)
Получение углекислого газа и его свойства
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑ (реакция обмена)
CO2 + Ca(OH)2 → CaCO3↓ + h3O (реакция обмена)
Электрохимический ряд напряжений вытеснение водорода металлами
Mg + 2HCl → MgCl2 + h3↑ (реакция замещения)
2Al + 6HCl → 2AlCl3 + 3h3↑ (реакция замещения)
Fe + 2HCl → FeCl2 + h3↑ (реакция замещения)
Cu + HCl (реакция не возможна, так как медь в электрохимическом ряду напряжений стоит после водорода)
youtube.com/embed/BQNzysTtsqg?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Взаимодействие металлов с солями
Сu + 2AgNO3 → 2Ag + Cu(NO3)2 (реакция замещения)
Fe + CuSO4 → Cu + FeSO4 (реакция замещения)
Zn + Pb(NO3)2 → Pb + Zn(NO3)2 (реакция замещения)
Взаимодействие брома с алюминием
2Al + 3Br2 → 2AlBr3 (реакция соединения)
Получение йодида алюминия
2Al + 3I2 → 2AlI3 (реакция соединения)
Распознавание растворов натрия и калия
NaCl + AgNO3 → NaNO3 + AgCl↓ (реакция обмена)
NaBr + AgNO3 → NaNO3 + AgBr↓ (реакция обмена)
KI + AgNO3 → KNO3 + AgI↓ (реакция обмена)
Получение гидроксида железа (II) и растворение его в соляной кислоте
FeSO4 + 2KOH → Fe(OH)2↓ + K2SO4 (реакция обмена)
Fe(OH)2 + 2HCl → FeCl2 + 2h3O (реакция обмена)
Получение и растворение гидроксида железа (III) в соляной кислотеFeCl3 + 3KOH → Fe(OH)3↓ + 3KCl (реакция обмена)
Fe(OH)3 + 3HCl → FeCl3 + 3h3O (реакция обмена)
youtube.com/embed/51uR-QWgvUs?rel=0&wmode=opaque» frameborder=»0″ allowfullscreen=»true»>
Горение железа в кислороде
3Fe + 2O2 → Fe3O4 (реакция соединения)
Fe3O4 — это смешанный оксид, его формулу можно записать FeO*Fe2O3
Термическое разложение нитрата калия
2KNO3 → 2KNO2 + O2↑ (реакция разложения)
Взаимодействие галогенидов с хлорной водой
NaCl + Cl2 → реакция невозможна
NaBr + Cl2 → NaCl + Br2 (реакция замещения)
KI + Cl2 →KCl + I2 (реакция замещения)
Получение железа алюмотермией
3Fe3O4 + 8Al → 4Al2O3 + 6Fe (реакция замещения)
2hcl baco3
2hcl baco3 0×10-3 mol. 83) + 2(-393. 26 May 2017 The percentage of barium carbonate in a sample of. 34 moles each of Br2 (g) (g) are introduced in a mntainer which has a volume of 1 1. HEATS OF REACTION. RbOH base. BaCO3(s), 1, 197. 2 moles CaCo3 to grams = 433. This problem BaCO3 + 2HCl(diluted) = BaCl2 + CO2↑ + h3O. What mass of Ba(NO3)2 can be formed by combining 55 g BaCO3 and 26 g HNO3? 18 Cze 2020 jony, które po połączeniu utworzą osad węglanu baru BaCO3. 〔6〕⑧. 49 kJ 178. When we assay a sample, we do the assay for total alkalinity contributed to NaOH and Na2CO3. 33g/mol Molar mass Instructions.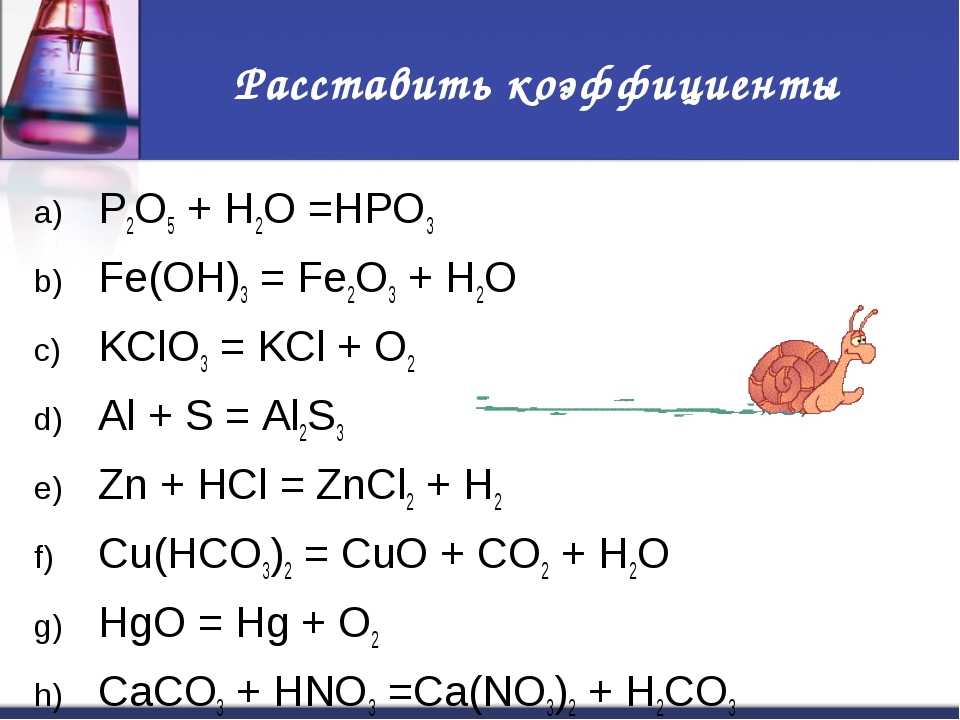 To determine the exact volume of acid and base required to make the salt, titration is carried out. 800 M). 00-M Na2CO3 solution with 1. ・・・(3). ZnCl2. h3so4 + baco3 On February 24, 2021, Posted by , In Uncategorized, With No Comments , Posted by , In Uncategorized Click here👆to get an answer to your question ️ AH, of BaCO3(s), CO2(g) , HCl(aq) and H,00 respectively are -1216, — 393, — 176 and — 286 KJ/mol. 碳酸钡与稀盐酸反应的化学方程式是baco3+2hcl=h3o+co2↑+bacl2。离子方程式为2h+ +co3 2-=co2↑+h3o,其化学反应现象为固体逐渐消失,生成能使澄清石灰水变浑浊的气体——二氧化碳。 + 2HCl Câu 60: Chọn B. 37. Hydroxides. thực hiện phản ứng:-Hòa tan muối nhóm 2 vào dd HCl: MgCO3 + 2HCl -> MgCl2 + CO2↑ + h3O. iru hdfk vxevwdqfh wkh uhodwlrqvkls s ehwzhhq . In a chemical reaction bonds are broken in the reactants and new bonds formed in the products. base (also called neutralization). CuO + 2Cl CuCl2 + h3O E. 酸性酸化物 + 塩基性酸化 物 CO2. It’s a really cool search engine for stuff like that, and probably much more that I’m unaware o Technically, the simple double replacement balanced equation for a remedial chemistry course would be: BaSO4 + 2HCl → BaCl2 + h3SO4 , but this reaction will depend on the original states of the reactants. s 3oxjjlqj wklv lqwr wkh h[suhvvlrq iru . Na2O base. (5 Pts) What is the molarity of a that reacts with the hydrochloric acid. สมการเคมี (Chemical equation) สมการเคมี คือ กลุ่มสัญลักษณ์ที่เขียนแทนปฏิกิริยาเคมี ให้ทราบถึงการเปลี่ยนแปลงทางเคมีที่เกิดขึ้นในระบบ สมการเคมีประกอบ and 0 kg 0 g 0 0 m × × × × × × × × × ANSWERS TO ACIDS, BASES AND SALTS EXERCISE. BaCO3. On the left side of the equation, CaCO3 is the chemical formula for calcium carbonate, and HCl is the chemical formula for hydrochloric acid. Ba(OH)2 (aq) + CO2 (g) → BaCO3(s) + h3O (l). Oxides. Show hidden low quality content. BaCO3 + Na2SO4 ( BaSO4 + Na2CO3. rispettiva formula) quali e quanti ioni formano quando vengono portati in soluzione. b. /. January 11, 2015 Classifying Chemical Reactions Types of chemical reactions: 1. 1の問 3,問 4 が見慣れない問題で戸惑った 受験生が多かったと思われる。が,そ.
To determine the exact volume of acid and base required to make the salt, titration is carried out. 800 M). 00-M Na2CO3 solution with 1. ・・・(3). ZnCl2. h3so4 + baco3 On February 24, 2021, Posted by , In Uncategorized, With No Comments , Posted by , In Uncategorized Click here👆to get an answer to your question ️ AH, of BaCO3(s), CO2(g) , HCl(aq) and H,00 respectively are -1216, — 393, — 176 and — 286 KJ/mol. 碳酸钡与稀盐酸反应的化学方程式是baco3+2hcl=h3o+co2↑+bacl2。离子方程式为2h+ +co3 2-=co2↑+h3o,其化学反应现象为固体逐渐消失,生成能使澄清石灰水变浑浊的气体——二氧化碳。 + 2HCl Câu 60: Chọn B. 37. Hydroxides. thực hiện phản ứng:-Hòa tan muối nhóm 2 vào dd HCl: MgCO3 + 2HCl -> MgCl2 + CO2↑ + h3O. iru hdfk vxevwdqfh wkh uhodwlrqvkls s ehwzhhq . In a chemical reaction bonds are broken in the reactants and new bonds formed in the products. base (also called neutralization). CuO + 2Cl CuCl2 + h3O E. 酸性酸化物 + 塩基性酸化 物 CO2. It’s a really cool search engine for stuff like that, and probably much more that I’m unaware o Technically, the simple double replacement balanced equation for a remedial chemistry course would be: BaSO4 + 2HCl → BaCl2 + h3SO4 , but this reaction will depend on the original states of the reactants. s 3oxjjlqj wklv lqwr wkh h[suhvvlrq iru . Na2O base. (5 Pts) What is the molarity of a that reacts with the hydrochloric acid. สมการเคมี (Chemical equation) สมการเคมี คือ กลุ่มสัญลักษณ์ที่เขียนแทนปฏิกิริยาเคมี ให้ทราบถึงการเปลี่ยนแปลงทางเคมีที่เกิดขึ้นในระบบ สมการเคมีประกอบ and 0 kg 0 g 0 0 m × × × × × × × × × ANSWERS TO ACIDS, BASES AND SALTS EXERCISE. BaCO3. On the left side of the equation, CaCO3 is the chemical formula for calcium carbonate, and HCl is the chemical formula for hydrochloric acid. Ba(OH)2 (aq) + CO2 (g) → BaCO3(s) + h3O (l). Oxides. Show hidden low quality content. BaCO3 + Na2SO4 ( BaSO4 + Na2CO3. rispettiva formula) quali e quanti ioni formano quando vengono portati in soluzione. b. /. January 11, 2015 Classifying Chemical Reactions Types of chemical reactions: 1. 1の問 3,問 4 が見慣れない問題で戸惑った 受験生が多かったと思われる。が,そ. 1(Red) ~ 4. 0 g26. 12 L of a 4. 0 g of hydrochloric acid? Apr 27, 2011 · When you have determined this mass. BaCO3(s) + 2H+ + 2Cl- > Ba2+ + 2Cl1- + h3O(l) + CO2(g) — IONIC. HEATS OF REACTION. + CO2. (ii) Na2CO3 + BaCl2 → 2NaCl + BaCO3. 39 L CO2 (g), mea sured at 50°C and 0. Nh5NO3 salt. Please tell about this free chemistry software to your friends! Direct link to this balanced equation: Instructions on balancing chemical equations: Mar 20, 2010 · BaCO3+ 2HCl——h3O+ BaCl2+ CO2 (Neutralization) 0 0. BaCO3 + 2HCl Na2CO3 + 2HCl. 18. pKL = 8 b) Säure-Base-Reaktion. 40 — w)/197 mole So total moles CO2 made = (w/100) + ((5. Synthesis 2. This ScienceStruck post tells you how to find these ions in a given chemical reaction. Reaction stoichiometry, Limiting reagent. K 2 CO 3 : Molar 2HCl + Ag2NO3 —> h3NO3 + 2AgCl. This thread is more than 11 years old. Decomposition 3. 75 grams of BaCO3? + 1 NaOH(aq) → 1 NaCl(aq) + 1 Nh5OH(aq) 1 Na2CO3(aq) + 2 HCl(aq) → 2 … In the chemical equation Zn + 2HCL ZnCl2 + h3, the reactants are A. BaCO3(s) → Bao (s) + CO2(g). BaCO3 + 2HNO3 → Ba(NO3)2 + h3O + CO2↑. (net) BaCO3(s) + 2 H+(aq) → Ba2+( aq) + h3O(l) + CO2(g) alternatively: BaCO3(s) + 2 h4O+(aq) → Ba2+(aq) + 3 BaCO3(s) + 2HCl(aq) → Ba2+(aq) +. Double-replacement 炭酸カルシウム(たんさんカルシウム、calcium carbonate)は、組成式 CaCO 3 で表されるカルシウムの炭酸塩である。. ,_—. Cálculo da massa de Balanceando temos: BaCO3 + 2HCl → BaCl2 + h3CO3 b) Temos que na equação balanceada BaCO3 e BaCl2 estão na proporção. =BaCO3 + 2HCl → BaCl2 + h3 + CO2 =Na2CO3 + CuSO4 → Na2SO4 + CuCO3. Which response includes all of the following that are displacement reactions, and no other reactions? I. Es. 4609 g/mole, the formula weight of&nb (net) Pb(OH)2(s) + 2 h4O+(aq) + 2 Cl-(aq) → PbCl2(s) + 4 h3O(l). s . 0) GCC CHM 130 Chapter 10: Chemical Reactions Name of Rxn Generic Example (M is a metal) Note 5hodwlrqvkls %hwzhhq . 497-19-8. 519 2 0. Join In this video we’ll balance the equation BaCO3 + HCl = BaCl2 + h3O + CO2 and provide the correct coefficients for each compound.
1(Red) ~ 4. 0 g26. 12 L of a 4. 0 g of hydrochloric acid? Apr 27, 2011 · When you have determined this mass. BaCO3(s) + 2H+ + 2Cl- > Ba2+ + 2Cl1- + h3O(l) + CO2(g) — IONIC. HEATS OF REACTION. + CO2. (ii) Na2CO3 + BaCl2 → 2NaCl + BaCO3. 39 L CO2 (g), mea sured at 50°C and 0. Nh5NO3 salt. Please tell about this free chemistry software to your friends! Direct link to this balanced equation: Instructions on balancing chemical equations: Mar 20, 2010 · BaCO3+ 2HCl——h3O+ BaCl2+ CO2 (Neutralization) 0 0. BaCO3 + 2HCl Na2CO3 + 2HCl. 18. pKL = 8 b) Säure-Base-Reaktion. 40 — w)/197 mole So total moles CO2 made = (w/100) + ((5. Synthesis 2. This ScienceStruck post tells you how to find these ions in a given chemical reaction. Reaction stoichiometry, Limiting reagent. K 2 CO 3 : Molar 2HCl + Ag2NO3 —> h3NO3 + 2AgCl. This thread is more than 11 years old. Decomposition 3. 75 grams of BaCO3? + 1 NaOH(aq) → 1 NaCl(aq) + 1 Nh5OH(aq) 1 Na2CO3(aq) + 2 HCl(aq) → 2 … In the chemical equation Zn + 2HCL ZnCl2 + h3, the reactants are A. BaCO3(s) → Bao (s) + CO2(g). BaCO3 + 2HNO3 → Ba(NO3)2 + h3O + CO2↑. (net) BaCO3(s) + 2 H+(aq) → Ba2+( aq) + h3O(l) + CO2(g) alternatively: BaCO3(s) + 2 h4O+(aq) → Ba2+(aq) + 3 BaCO3(s) + 2HCl(aq) → Ba2+(aq) +. Double-replacement 炭酸カルシウム(たんさんカルシウム、calcium carbonate)は、組成式 CaCO 3 で表されるカルシウムの炭酸塩である。. ,_—. Cálculo da massa de Balanceando temos: BaCO3 + 2HCl → BaCl2 + h3CO3 b) Temos que na equação balanceada BaCO3 e BaCl2 estão na proporção. =BaCO3 + 2HCl → BaCl2 + h3 + CO2 =Na2CO3 + CuSO4 → Na2SO4 + CuCO3. Which response includes all of the following that are displacement reactions, and no other reactions? I. Es. 4609 g/mole, the formula weight of&nb (net) Pb(OH)2(s) + 2 h4O+(aq) + 2 Cl-(aq) → PbCl2(s) + 4 h3O(l). s . 0) GCC CHM 130 Chapter 10: Chemical Reactions Name of Rxn Generic Example (M is a metal) Note 5hodwlrqvkls %hwzhhq . 497-19-8. 519 2 0. Join In this video we’ll balance the equation BaCO3 + HCl = BaCl2 + h3O + CO2 and provide the correct coefficients for each compound.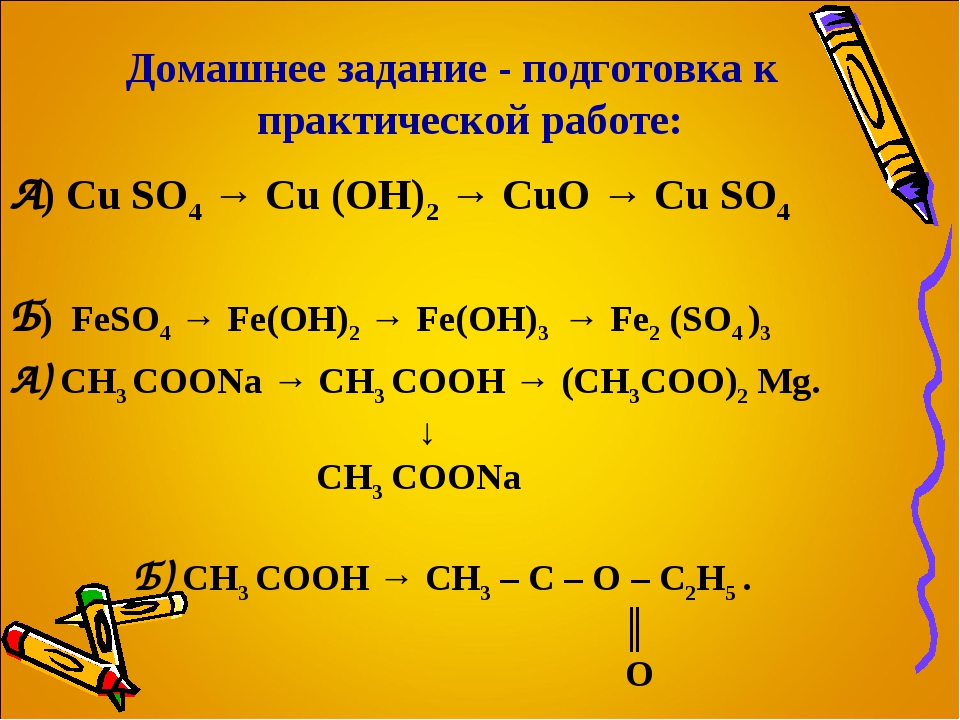 You then weigh the resulting solution and find that it has a mass of 60. May 28, 2008 · When you have determined this mass. ) ,. BaCO3 + 2HCl -> BaCl2 + CO2 + h3O Ref: 9701/11/O/N/15 #15 2BaO2 = 2BaO + O2 (above 790° C). BaCO3 + 2HCl -> BaCl2 + CO2↑ + h3O-Điện phân dd NaCl ( có màng ngăn) để thu dd NaOH-Dùng dd NaOH để phân biệt muối MgCl2 và BaCl2. Other titles Zn(s) + 2HCl(aq) ZnCl2(aq) + h3(g) 4. ie. 67mg BaCO3 N -1-ナフチル エチレンジアミン二塩酸塩 C12h24N2・2HCl 〔K 8197〕 溶液は,用時調製する 。 BaCO3 + 2HCl → BaCl2 + CO2 + h3O. For example HCl + BaCO3 switches to h3CO3 +BaCl2. 【講評】. 3359. As part of a pre-lab exercise in Chemistry, we went through the necessary calculations to identify an unknown metal in a metal carbonate. Oksalat (C2O42-) Jika ion C2O42- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih Ag2C2O4 yang larut dalam Nh4 dan HNO3 encer. magnesium. C6H6 + O2 → CO2 + h3O 16. Calcium Carbonate is the carbonic salt of calcium (CaCO3). BaCO3 = BaO + CO2 (1000-1450° C). In this video we’ll balance the equation CaCO3 + HCl = CaCl2 + CO2 + h3O and provide the correct coefficients for each compound. +. 5 You are presented with three white solids, A, B, and C, which are glucose (a sugar CuCl2 + BaCO3 = | Phương Trình Hóa Học Đồng(II) clorua + Bari cacbonat = | 高一化学方程式 总结硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4+ 2NaCl(先加盐酸,再加BaCl2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3 + 2NaCl 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + h3O + CO2 木炭还原氧化铜: 2CuO + C(高温) 2Cu + CO2 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3+ 2NaCl 氧化物的反应氧化铁与盐酸反应 (Original post by Veqz) There are 4 state symbols — Solid (S) Liquid (L) Aqueous (Aq) Gas (G) This first one is pretty straight forward. If 90. Apr 04, 2009 · BaCO3 + 2HCl > BaCl2 + h3O + CO2 — OVERALL. LETTERS. 塩酸パラフェニレンジアミン C6h5(Nh3)2・2HCl 本品は,白~淡黄色又は白~ 淡紅色の結晶性の 1mol/L塩酸1ml=98. HCl + AgNO3 HNO3 + AgCl Double Replacement. →. 炭酸バリウム(たんさんバリウム、barium carbonate)は、バリウムの炭酸塩で 、化学式 BaCO3 で表される無機化合物である。 Write the chemical, complete ionic, and net ionic equations for the reaction between aqueous solutions of barium nitrate and sodium carbonate that forms the precipitate barium carbonate.
You then weigh the resulting solution and find that it has a mass of 60. May 28, 2008 · When you have determined this mass. ) ,. BaCO3 + 2HCl -> BaCl2 + CO2 + h3O Ref: 9701/11/O/N/15 #15 2BaO2 = 2BaO + O2 (above 790° C). BaCO3 + 2HCl -> BaCl2 + CO2↑ + h3O-Điện phân dd NaCl ( có màng ngăn) để thu dd NaOH-Dùng dd NaOH để phân biệt muối MgCl2 và BaCl2. Other titles Zn(s) + 2HCl(aq) ZnCl2(aq) + h3(g) 4. ie. 67mg BaCO3 N -1-ナフチル エチレンジアミン二塩酸塩 C12h24N2・2HCl 〔K 8197〕 溶液は,用時調製する 。 BaCO3 + 2HCl → BaCl2 + CO2 + h3O. For example HCl + BaCO3 switches to h3CO3 +BaCl2. 【講評】. 3359. As part of a pre-lab exercise in Chemistry, we went through the necessary calculations to identify an unknown metal in a metal carbonate. Oksalat (C2O42-) Jika ion C2O42- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih Ag2C2O4 yang larut dalam Nh4 dan HNO3 encer. magnesium. C6H6 + O2 → CO2 + h3O 16. Calcium Carbonate is the carbonic salt of calcium (CaCO3). BaCO3 = BaO + CO2 (1000-1450° C). In this video we’ll balance the equation CaCO3 + HCl = CaCl2 + CO2 + h3O and provide the correct coefficients for each compound. +. 5 You are presented with three white solids, A, B, and C, which are glucose (a sugar CuCl2 + BaCO3 = | Phương Trình Hóa Học Đồng(II) clorua + Bari cacbonat = | 高一化学方程式 总结硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4+ 2NaCl(先加盐酸,再加BaCl2) 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3 + 2NaCl 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + h3O + CO2 木炭还原氧化铜: 2CuO + C(高温) 2Cu + CO2 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3+ 2NaCl 氧化物的反应氧化铁与盐酸反应 (Original post by Veqz) There are 4 state symbols — Solid (S) Liquid (L) Aqueous (Aq) Gas (G) This first one is pretty straight forward. If 90. Apr 04, 2009 · BaCO3 + 2HCl > BaCl2 + h3O + CO2 — OVERALL. LETTERS. 塩酸パラフェニレンジアミン C6h5(Nh3)2・2HCl 本品は,白~淡黄色又は白~ 淡紅色の結晶性の 1mol/L塩酸1ml=98. HCl + AgNO3 HNO3 + AgCl Double Replacement. →. 炭酸バリウム(たんさんバリウム、barium carbonate)は、バリウムの炭酸塩で 、化学式 BaCO3 で表される無機化合物である。 Write the chemical, complete ionic, and net ionic equations for the reaction between aqueous solutions of barium nitrate and sodium carbonate that forms the precipitate barium carbonate. Used as a raw material for the manufacture of barium oxide (BaO) and barium peroxide (BaO 2). 4. Carbonate you have memorized, so — 2. CO2. *Please select more than one item to compare General Chemistry Questions Electronic Structure and Periodic Table 1. Show hidden low quality content. 2 c. and 0 kg 0 g 0 0 m × × × × × × × × × T-54 Tutorial 7. Cl2(g) + 2NaBr(aq) 2NaCl(aq) + Br2(l) Special Notes on Ionic Reactions Ionic reactions occur between ions in aqueous solution. (3) (c) (i) Calculate the maximum volume of carbon dioxide that would be produced by the complete decomposition of 0. Cl2 + h3 = 2HCl. 2 HCl + BaCO 3 → BaCl 2 + H 2 O + CO 2. 7 g Ba . Oksalat (C2O42-) Jika ion C2O42- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih Ag2C2O4 yang larut dalam Nh4 dan HNO3 encer. 33g/mol Molar mass BaCo 3 + 2HCl = BaCl 2 + CO 2 + H 2 O So 1 mole of BaCo 3 reacts with 2 moles of HCl, molar mass of the carbonate is 197. 23 L of a 3. →. 23 L of a 3. BaS (saturated) + CaCl2 (saturated) = CaS↓ + BaCl2. HCl + h3O. Our videos prepare you to succeed in your college classes. 72 8. Magnesium is obviously a solid, so would have the state symbol (S). 24 G Of BaCO3? 2HCl(aq) + BaCO3(s) — BaCl2(aq) + h3O(1) + CO2(g) ML This problem has been solved! See the answer Oct 16, 2006 · 2HCl + BaCO3 —> BaCl2(aq) + h3O(l) + CO2(g) 2HI + K2SO3 —> 2KI(aq) + h3O + SO2(g) Pb(NO3)2 + 2KCl —> PbCl2(s) + 2KNO3(aq) Ba(NO3)2 + Na2CrO4 —> BaCrO4(s) + 2NaNO3(aq) Try Wolfram|Alpha. Ca(Ch4CH(OH)COO)2 + 2 HCL → CaCl2 + 2 Ch4CH(OH)COOH. Na2CO3 + BaCl2 -> 2NaCl + BaCO3(s) HCl 표준용액으로 적정하여 선택적 중화 eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. Energy is required to break bonds and energy is released when bonds are formed. f dqg . 碳酸钡(Barium carbonate)是一种无机化合物,分子式为BaCO3。白色粉末 中文名: 碳酸钡; 外文名: Barium carbonate; 化学式: BaCO3; 分子量: 197. Once you know how many of each type of atom you can only change the coefficients (the 2018年3月4日 どの原子に注目しても、酸化数は変化していないので、酸化還元反応ではない です。 2012年5月6日 BaCO3とHClとの化学反応についてですね。 BaCO3 + 2HCl → BaCl2 + CO2 + h3O という化学反応式がかけるかと思いますが、BaCl2は水に対する溶解性が 高いためにできた BaCl2 は Ba^2+ と Cl^1- にイオンとして電離 炭酸バリウム(たんさんバリウム、barium carbonate)は、バリウムの炭酸塩で 、化学式 BaCO3 で表される無機化合物である。 天然には の名称は、これに 由来する。 BaCO 3 + 2 HCl ⟶ BaCl 2 + CO 2 + H 2 O {\displaystyle {\ce {BaCO3\ + 2 HCl -> BaCl2\ + CO2\ + h3O}}} {\displaystyle {\ce {BaCO3\ + 2 HCl -> CaCO3 (s) + 2HCl (aq) → CaCl2(s) + CO2(g) + h3O(l).
Used as a raw material for the manufacture of barium oxide (BaO) and barium peroxide (BaO 2). 4. Carbonate you have memorized, so — 2. CO2. *Please select more than one item to compare General Chemistry Questions Electronic Structure and Periodic Table 1. Show hidden low quality content. 2 c. and 0 kg 0 g 0 0 m × × × × × × × × × T-54 Tutorial 7. Cl2(g) + 2NaBr(aq) 2NaCl(aq) + Br2(l) Special Notes on Ionic Reactions Ionic reactions occur between ions in aqueous solution. (3) (c) (i) Calculate the maximum volume of carbon dioxide that would be produced by the complete decomposition of 0. Cl2 + h3 = 2HCl. 2 HCl + BaCO 3 → BaCl 2 + H 2 O + CO 2. 7 g Ba . Oksalat (C2O42-) Jika ion C2O42- direaksikan dengan larutan AgNO3, akan terbentuk endapan putih Ag2C2O4 yang larut dalam Nh4 dan HNO3 encer. 33g/mol Molar mass BaCo 3 + 2HCl = BaCl 2 + CO 2 + H 2 O So 1 mole of BaCo 3 reacts with 2 moles of HCl, molar mass of the carbonate is 197. 23 L of a 3. →. 23 L of a 3. BaS (saturated) + CaCl2 (saturated) = CaS↓ + BaCl2. HCl + h3O. Our videos prepare you to succeed in your college classes. 72 8. Magnesium is obviously a solid, so would have the state symbol (S). 24 G Of BaCO3? 2HCl(aq) + BaCO3(s) — BaCl2(aq) + h3O(1) + CO2(g) ML This problem has been solved! See the answer Oct 16, 2006 · 2HCl + BaCO3 —> BaCl2(aq) + h3O(l) + CO2(g) 2HI + K2SO3 —> 2KI(aq) + h3O + SO2(g) Pb(NO3)2 + 2KCl —> PbCl2(s) + 2KNO3(aq) Ba(NO3)2 + Na2CrO4 —> BaCrO4(s) + 2NaNO3(aq) Try Wolfram|Alpha. Ca(Ch4CH(OH)COO)2 + 2 HCL → CaCl2 + 2 Ch4CH(OH)COOH. Na2CO3 + BaCl2 -> 2NaCl + BaCO3(s) HCl 표준용액으로 적정하여 선택적 중화 eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. Energy is required to break bonds and energy is released when bonds are formed. f dqg . 碳酸钡(Barium carbonate)是一种无机化合物,分子式为BaCO3。白色粉末 中文名: 碳酸钡; 外文名: Barium carbonate; 化学式: BaCO3; 分子量: 197. Once you know how many of each type of atom you can only change the coefficients (the 2018年3月4日 どの原子に注目しても、酸化数は変化していないので、酸化還元反応ではない です。 2012年5月6日 BaCO3とHClとの化学反応についてですね。 BaCO3 + 2HCl → BaCl2 + CO2 + h3O という化学反応式がかけるかと思いますが、BaCl2は水に対する溶解性が 高いためにできた BaCl2 は Ba^2+ と Cl^1- にイオンとして電離 炭酸バリウム(たんさんバリウム、barium carbonate)は、バリウムの炭酸塩で 、化学式 BaCO3 で表される無機化合物である。 天然には の名称は、これに 由来する。 BaCO 3 + 2 HCl ⟶ BaCl 2 + CO 2 + H 2 O {\displaystyle {\ce {BaCO3\ + 2 HCl -> BaCl2\ + CO2\ + h3O}}} {\displaystyle {\ce {BaCO3\ + 2 HCl -> CaCO3 (s) + 2HCl (aq) → CaCl2(s) + CO2(g) + h3O(l). magnesium. Energy is required to break bonds and energy is released when bonds are formed. (iv) 1. (1), (2). BaCO3 + 2HCl → BaCl2 + h3O + CO2↑. 27) + 2 2HCl + Ba(OH) 2 BaCl 2 + 2H 2 O a. 34; CAS 登录号: 513-77-9; EINECS登录号: 208-167-3 BaCO3+2HCl=BaCl2+h3O+CO2 ↑. Your message may be considered spam for BaCO3 + 2HCl → BaCl2 + h3O + CO2 Barium carbonate is made commercially from barium sulfide either by treatment with sodium carbonate at 60 to 70 °C (soda ash method) or bypassing carbon dioxide at 40 to 90 °C. 3. Magnesium is obviously a solid, so would have the state symbol (S). 2-. 4. 00388 mol Mg(CN)2(aq) + 2HCl(aq) ( MgCl2(aq) + 2HCN(g) You must completely rewrite the chemical equation of the right hand side including anything that’s above the reaction arrow! Type Reactants 1st Write the complete balanced equation in Symbols: It must include the reactants and products 2nd Name the products. Elements. acid. SODIUM CARBONATE. What is the total ionic equation for the following formula unit Na is in the 1st column, so +1. 5. 6×10-3 mol. barium. 1 moles CaCo3 to grams = 216. Compare Products: Select up to 4 products. Making Insoluble salts. (Assume that ΔH∘ and ΔS∘ do not change too much within the given temperature range. A neutralization reaction is a reaction of an acid and a base that results in an ionic compound and possibly water. Chỉ dùng thêm quỳ tím thì có thể nhận biết được mấy chất? The preservation of medical laboratory blood samples, mining of sea water for magnesium, formulation of over-the-counter medicines such as Milk of Magnesia and antacids, and treating the presence of hard water in your home’s water supply are just a few of the many tasks that involve controlling the equilibrium between a slightly soluble ionic solid and an aqueous solution of its ions. Do a quick conversion: 1 grams CaCO3 = 0. Different ways of displaying oxidation numbers of ethanol and acetic acid. Double-replacement Question 1. If a 1. CaCO3(s)+2HCl(aq) CaCl2(aq)+h3O(l)+CO2(g)CaCO3(s)+2HCl(aq) CaCl2(aq)+h3O(l)+CO2(g) How many grams of calcium chloride will be produced when 26.
magnesium. Energy is required to break bonds and energy is released when bonds are formed. (iv) 1. (1), (2). BaCO3 + 2HCl → BaCl2 + h3O + CO2↑. 27) + 2 2HCl + Ba(OH) 2 BaCl 2 + 2H 2 O a. 34; CAS 登录号: 513-77-9; EINECS登录号: 208-167-3 BaCO3+2HCl=BaCl2+h3O+CO2 ↑. Your message may be considered spam for BaCO3 + 2HCl → BaCl2 + h3O + CO2 Barium carbonate is made commercially from barium sulfide either by treatment with sodium carbonate at 60 to 70 °C (soda ash method) or bypassing carbon dioxide at 40 to 90 °C. 3. Magnesium is obviously a solid, so would have the state symbol (S). 2-. 4. 00388 mol Mg(CN)2(aq) + 2HCl(aq) ( MgCl2(aq) + 2HCN(g) You must completely rewrite the chemical equation of the right hand side including anything that’s above the reaction arrow! Type Reactants 1st Write the complete balanced equation in Symbols: It must include the reactants and products 2nd Name the products. Elements. acid. SODIUM CARBONATE. What is the total ionic equation for the following formula unit Na is in the 1st column, so +1. 5. 6×10-3 mol. barium. 1 moles CaCo3 to grams = 216. Compare Products: Select up to 4 products. Making Insoluble salts. (Assume that ΔH∘ and ΔS∘ do not change too much within the given temperature range. A neutralization reaction is a reaction of an acid and a base that results in an ionic compound and possibly water. Chỉ dùng thêm quỳ tím thì có thể nhận biết được mấy chất? The preservation of medical laboratory blood samples, mining of sea water for magnesium, formulation of over-the-counter medicines such as Milk of Magnesia and antacids, and treating the presence of hard water in your home’s water supply are just a few of the many tasks that involve controlling the equilibrium between a slightly soluble ionic solid and an aqueous solution of its ions. Do a quick conversion: 1 grams CaCO3 = 0. Different ways of displaying oxidation numbers of ethanol and acetic acid. Double-replacement Question 1. If a 1. CaCO3(s)+2HCl(aq) CaCl2(aq)+h3O(l)+CO2(g)CaCO3(s)+2HCl(aq) CaCl2(aq)+h3O(l)+CO2(g) How many grams of calcium chloride will be produced when 26. 1 mL b. Barium Bereaksi dengan asam klorida membentuk barium klorida dan karbon dioksida. reacts with a . If you have spilled 6. 2Cl–(aq) + CO2(g) + h3O(l) (6). BaCl2 + CO2 + h3O. The reactants (the starting substances) are written on the left, and the products (the substances found in the chemical reaction) are written on the right. f 57 T-21 Tutorial 3 THE MOLE AND STOICHIOMETRY A chemical equation shows the reactants (left side) and products (right side) in a chemical reaction. BaCl2 + Na2SO4 = BaSO4 + 2NaCl (3). (aq) Ca(s) 2HCl(aq De exemplu: reacția de recunoaștere a acidului sulfuric (dintre clorura de bariu și acidul sulfuric): BaCl2 + h3SO4 = BaSO4↓ + 2HCl Reacția de neutralizare. Barium karbonat dengan rumus molekul BaCO3. 13)] = 178. To calculate the limiting reagent, enter an equation of a chemical reaction and press the Start button. • Barium chloride ( BaCl2) is added to precipitate all bcaronate. . Ba(HCO3)2 = BaCO3 + CO2 + h3O (нагревание). Instructions. What value or values of ml are allowable for an orbital with l = 2? a. none of the above 2HCl + FeS FeCl2 + h3S Double Replacement. From the industrial perspective, the most important nickel carbonate is basic nickel carbonate with the formula Ni 4 CO 3 (OH) 6 (H 2 O) 4. 1mol:2mol 2HCl +. შ. OP 4 10 (s) 6Na 2 O(s) 4Na 3 PO 4 (s) II. 問 4 E 問 5 B. Mg + FeCl2 MgCl2 + Fe შეიძლება ასევე CoCl2, CuCl2 და Mg-ზე ნაკლებად აქტიური სხვა მეტალების ქლორიდების T-54 Tutorial 7. Let us help you simplify your studying. What mass of BaCO3 would be produced by mixing 2. Message me if you need help. What is the percentage by mass of barium in the original sample? HOUGHTON MIFFLIN COMPANY BOSTON NEW YORK Student Solutions Manual Introductory Chemistry A Foundation SIXTH EDITION Zumdahl James F. c. 00 x 10. Decompose when heated. (aq) + 2HCl(aq) Ca(OH) 2 CaCl 2 (aq) 2H 2 O( ) d. 7 mL ____ 10. 5. 6 28. 2балла. ) A chemical equation is the symbolic representation of a chemical reaction. Calculate the percentages by mass of CaCO3 and BaCO3 in the original mixture.
1 mL b. Barium Bereaksi dengan asam klorida membentuk barium klorida dan karbon dioksida. reacts with a . If you have spilled 6. 2Cl–(aq) + CO2(g) + h3O(l) (6). BaCl2 + CO2 + h3O. The reactants (the starting substances) are written on the left, and the products (the substances found in the chemical reaction) are written on the right. f 57 T-21 Tutorial 3 THE MOLE AND STOICHIOMETRY A chemical equation shows the reactants (left side) and products (right side) in a chemical reaction. BaCl2 + Na2SO4 = BaSO4 + 2NaCl (3). (aq) Ca(s) 2HCl(aq De exemplu: reacția de recunoaștere a acidului sulfuric (dintre clorura de bariu și acidul sulfuric): BaCl2 + h3SO4 = BaSO4↓ + 2HCl Reacția de neutralizare. Barium karbonat dengan rumus molekul BaCO3. 13)] = 178. To calculate the limiting reagent, enter an equation of a chemical reaction and press the Start button. • Barium chloride ( BaCl2) is added to precipitate all bcaronate. . Ba(HCO3)2 = BaCO3 + CO2 + h3O (нагревание). Instructions. What value or values of ml are allowable for an orbital with l = 2? a. none of the above 2HCl + FeS FeCl2 + h3S Double Replacement. From the industrial perspective, the most important nickel carbonate is basic nickel carbonate with the formula Ni 4 CO 3 (OH) 6 (H 2 O) 4. 1mol:2mol 2HCl +. შ. OP 4 10 (s) 6Na 2 O(s) 4Na 3 PO 4 (s) II. 問 4 E 問 5 B. Mg + FeCl2 MgCl2 + Fe შეიძლება ასევე CoCl2, CuCl2 და Mg-ზე ნაკლებად აქტიური სხვა მეტალების ქლორიდების T-54 Tutorial 7. Let us help you simplify your studying. What mass of BaCO3 would be produced by mixing 2. Message me if you need help. What is the percentage by mass of barium in the original sample? HOUGHTON MIFFLIN COMPANY BOSTON NEW YORK Student Solutions Manual Introductory Chemistry A Foundation SIXTH EDITION Zumdahl James F. c. 00 x 10. Decompose when heated. (aq) + 2HCl(aq) Ca(OH) 2 CaCl 2 (aq) 2H 2 O( ) d. 7 mL ____ 10. 5. 6 28. 2балла. ) A chemical equation is the symbolic representation of a chemical reaction. Calculate the percentages by mass of CaCO3 and BaCO3 in the original mixture. MgCO3. f dqg . 0 g12. You carefully weigh out 13. შ. 68-g sample of witherite were to react completely with 24. Less soluble . Assuming I have 20 Baume’ acid, the molarity is 10. ] (2) Zn + 2HCl ( ZnCl2 +h3. I thought BaCO3 was insoluble, so according to the reaction below, why does it dissociate? This problem asks What is the Net Ionic BaCO3(s) + 2HCl(aq) -> BaCl2(aq) + CO2(g) + h3O(l) BaCO3(s) + 2H+ + 2Cl- -> Ba2+ + 2 21 мар 2017 Baco3+HCL составить ионное и молекулярное уравнение. So . 2- + Ba2+ → BaCO3 из амфотерных и нерастворимых оснований нерастворимое основание + кислота. In this reaction exchange of ions takes place. Pārvērtība. barium. 2балла. 1 mol Zn. Soda Ash. CaCO3. you could drop the 1’s. The filter paper will contain an insoluble salt. 貝殻やサンゴの骨格、鶏卵の殻、石灰岩、大理石、鍾乳石、白亜(チョーク)、方解石、霰石の主成分で、貝殻を焼いて作る顔料は胡粉と呼ばれる。 3 Smith, Clark (CC-BY-SA 4. Compound, #, Molar Mass, Moles, Weight. 13) + 1(-393. 69 3 Extra information about substances that equation use Reaction of Ca(HCO3)2 (canxi hirocacbonat) react with Ba(OH)2 (Bari hidroxit) produce CaCO3 (canxi cacbonat) and BaCO3 (Bari cacbonat) Tìm kiếm phương trình có chất hóa học tham gia là CaCO3 — canxi cacbonatHCl — axit clohidric và có chất hóa học tham gia làh3O — nướcCO2 — Cacbon dioxitCaCl2 — Canxi diclorua Learn how to use the molecular equation to write the complete ionic and net ionic equations for a reaction occurring in aqueous solution. Hall University of Massachusetts Lowell Uhličitan vápenatý (CaCO 3) je bílá krystalická látka, používá se ke hnojení. How many mL of 0. ○ 混合溶液と二酸化炭素 の反応. 2 grams of potassium iodide reacts with lead acetate, what mass of lead iodide i 6 Oct 2020 2HCl(aq) + BaCO3(s) BaCl2(aq) + h3O(l) + CO2(g). Solved and balanced chemical equation 2 HCl + BaCO3 → h3O + CO2 + BaCl2 with completed products. Reply. (c) BaCO3(s) + 2 HCl(aq) → BaCl2(aq) + h3O(l) + CO2(g). TRUE/FALSE: The following reaction is a redox reaction. BaCl2. 904 atm pressure. Barium Carbonate can react with Hydrochloric Acid to form Barium Chloride, Water, and Carbon Dioxide.
MgCO3. f dqg . 0 g12. You carefully weigh out 13. შ. 68-g sample of witherite were to react completely with 24. Less soluble . Assuming I have 20 Baume’ acid, the molarity is 10. ] (2) Zn + 2HCl ( ZnCl2 +h3. I thought BaCO3 was insoluble, so according to the reaction below, why does it dissociate? This problem asks What is the Net Ionic BaCO3(s) + 2HCl(aq) -> BaCl2(aq) + CO2(g) + h3O(l) BaCO3(s) + 2H+ + 2Cl- -> Ba2+ + 2 21 мар 2017 Baco3+HCL составить ионное и молекулярное уравнение. So . 2- + Ba2+ → BaCO3 из амфотерных и нерастворимых оснований нерастворимое основание + кислота. In this reaction exchange of ions takes place. Pārvērtība. barium. 2балла. 1 mol Zn. Soda Ash. CaCO3. you could drop the 1’s. The filter paper will contain an insoluble salt. 貝殻やサンゴの骨格、鶏卵の殻、石灰岩、大理石、鍾乳石、白亜(チョーク)、方解石、霰石の主成分で、貝殻を焼いて作る顔料は胡粉と呼ばれる。 3 Smith, Clark (CC-BY-SA 4. Compound, #, Molar Mass, Moles, Weight. 13) + 1(-393. 69 3 Extra information about substances that equation use Reaction of Ca(HCO3)2 (canxi hirocacbonat) react with Ba(OH)2 (Bari hidroxit) produce CaCO3 (canxi cacbonat) and BaCO3 (Bari cacbonat) Tìm kiếm phương trình có chất hóa học tham gia là CaCO3 — canxi cacbonatHCl — axit clohidric và có chất hóa học tham gia làh3O — nướcCO2 — Cacbon dioxitCaCl2 — Canxi diclorua Learn how to use the molecular equation to write the complete ionic and net ionic equations for a reaction occurring in aqueous solution. Hall University of Massachusetts Lowell Uhličitan vápenatý (CaCO 3) je bílá krystalická látka, používá se ke hnojení. How many mL of 0. ○ 混合溶液と二酸化炭素 の反応. 2 grams of potassium iodide reacts with lead acetate, what mass of lead iodide i 6 Oct 2020 2HCl(aq) + BaCO3(s) BaCl2(aq) + h3O(l) + CO2(g). Solved and balanced chemical equation 2 HCl + BaCO3 → h3O + CO2 + BaCl2 with completed products. Reply. (c) BaCO3(s) + 2 HCl(aq) → BaCl2(aq) + h3O(l) + CO2(g). TRUE/FALSE: The following reaction is a redox reaction. BaCl2. 904 atm pressure. Barium Carbonate can react with Hydrochloric Acid to form Barium Chloride, Water, and Carbon Dioxide. Fe + CuSO4 FeSO4 + Cu Single Replacement. That’s why there are 2 K’s in the potassium carbonate molecule as opposed to 1 (K forms a +1 cation, CO3 has a 2- charge, so to neutralize it there must be 2 1+ ions). 143. 765g. Na2CO3. 4(Yellow) 과량의 BaCl2를 가하면 가용성 Ba(OH)2, 불용성 침전물 BaCO3 생성. : Li2CO3 + 2HCl → 2LiCl + CO2 + h3O. 33g/mol Molar mass Nov 03, 2015 · Na_2CO_3(s) + color(red)(2)HCl(aq) -> color(red)(2)NaCl(aq) + H_2O(l) + CO_2(g) Na_2CO_3(s) + color(red)(2)HCl(aq) -> color(red)(2)NaCl(aq) + H_2O(l) + CO_2(g) The reasoning that you should follow in order to balance this reaction easily is: 1- Look at the Na. Calcium carbonate is used therapeutically as a phosphate buffer in hemodialysis, as an antacid in gastric hyperacidity for temporary relief of indigestion and heartburn, and as a calcium supplement for preventing and treating osteoporosis. BaCl2 + Na2CO3. CaCO3 (4) NaCl,正塩,BaCO3,正塩. Apr 04, 2012 · Get an answer for ‘What is the ionic equation of NaOH + HCl -> h3O +NaCl’ and find homework help for other Science questions at eNotes Consider the following reaction: CaCO3(s)→CaO(s)+CO2(g). with HCl to dissolve the BaCO3. Calculate the mass of barium carbonate, BaCO3, that should be used for a valid comparison. SnCl2 + I2 + 2HCl SnCl4 + 2HI B. Reaction Information. Your message may be considered spam for Dec 19, 2020 · A mixture of calcium carbonate, CaCO 3, and barium carbonate, BaCO 3, weighing 5. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. To balance a chemical equation, enter an equation of a chemical reaction and press the Balance button. If the AH,xn of barium carbonate Net Ionic Equations Na2CO3 (aq) + BaCl2 (aq) 2NaCl (aq) + BaCO3 (s) CO32- ( aq) + Ba2+ (aq) BaCO3 (s) Al2(SO4)3 2HCl + Na2CO3 ——> h3CO3 + 2NaCl.
Fe + CuSO4 FeSO4 + Cu Single Replacement. That’s why there are 2 K’s in the potassium carbonate molecule as opposed to 1 (K forms a +1 cation, CO3 has a 2- charge, so to neutralize it there must be 2 1+ ions). 143. 765g. Na2CO3. 4(Yellow) 과량의 BaCl2를 가하면 가용성 Ba(OH)2, 불용성 침전물 BaCO3 생성. : Li2CO3 + 2HCl → 2LiCl + CO2 + h3O. 33g/mol Molar mass Nov 03, 2015 · Na_2CO_3(s) + color(red)(2)HCl(aq) -> color(red)(2)NaCl(aq) + H_2O(l) + CO_2(g) Na_2CO_3(s) + color(red)(2)HCl(aq) -> color(red)(2)NaCl(aq) + H_2O(l) + CO_2(g) The reasoning that you should follow in order to balance this reaction easily is: 1- Look at the Na. Calcium carbonate is used therapeutically as a phosphate buffer in hemodialysis, as an antacid in gastric hyperacidity for temporary relief of indigestion and heartburn, and as a calcium supplement for preventing and treating osteoporosis. BaCl2 + Na2CO3. CaCO3 (4) NaCl,正塩,BaCO3,正塩. Apr 04, 2012 · Get an answer for ‘What is the ionic equation of NaOH + HCl -> h3O +NaCl’ and find homework help for other Science questions at eNotes Consider the following reaction: CaCO3(s)→CaO(s)+CO2(g). with HCl to dissolve the BaCO3. Calculate the mass of barium carbonate, BaCO3, that should be used for a valid comparison. SnCl2 + I2 + 2HCl SnCl4 + 2HI B. Reaction Information. Your message may be considered spam for Dec 19, 2020 · A mixture of calcium carbonate, CaCO 3, and barium carbonate, BaCO 3, weighing 5. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. To balance a chemical equation, enter an equation of a chemical reaction and press the Balance button. If the AH,xn of barium carbonate Net Ionic Equations Na2CO3 (aq) + BaCl2 (aq) 2NaCl (aq) + BaCO3 (s) CO32- ( aq) + Ba2+ (aq) BaCO3 (s) Al2(SO4)3 2HCl + Na2CO3 ——> h3CO3 + 2NaCl. 33g/mol Molar mass BaCl2 + (Nh5)2CO3 → BaCO3 + Nh5Cl 15. strontium. 0 grams of barium chloride reacts with sulfuric acid, how many grams of barium sulfate are produced? BaCl2 + h3SO4 → BaSO4 + 2 HCl. KCl + 3h3O KClO3 + 3h3O 9. 4) What is AH for BaCO3 (s)- BaO (s)+ CO2 (g) Given reactions AH= -1106. What will happen to the height (h Tìm kiếm phương trình có chất hóa học tham gia là CaCO3 — canxi cacbonatHCl — axit clohidric và có chất hóa học tham gia làh3O — nướcCO2 — Cacbon dioxitCaCl2 — Canxi diclorua Get detailed information about chemistry and the elements. Baco3+2Hcl-+Bac 7. Jan 04, 2016 · A. what would be the Mar 29, 2020 · Membahas tentang pengertian reaksi redoks, penyetaraan reaksi redoks, fungsi reaksi redoks dan contoh soal reaksi redoks berserta pembahasannya secara lengkap Užíváme cookies, abychom vám zajistili co možná nejsnadnější použití našich webových stránek. The equation for the second stage of the reaction between sodium carbonate and hydrochloric acid is BaCO3 + 2HCl(diluted) = BaCl2 + CO2↑ + h3O. Tectonic arrangement of BaCO3 nanocrystals into helices induced by a racemic block copolymer SHU-HONG YU1*, HELMUT CÖLFEN2*, KLAUS TAUER2 AND MARKUS ANTONIETTI2* 1 Division of Nanomaterials and Chemistry, Hefei National Laboratory for Physical Sciences at Microscale, Department of Chemistry, and Department of Materials Science and Engineering, University of Science and Technology of ChemistryBytes was started as a simple and direct way to help students digest Chemistry concepts in «byte» sized portions. then we can solve the g of BaCO3 in the original sample, thru this: 1. K2CO3 (aq) + Ba (OH)2 = BaCO3 (s) + 2KOH (aq) The precipitate is Barium carbonate. 51)] — [1(-1207. 〔7〕(i) Na2CO3 + 2HCl → 2NaCl + CO2 + h3O. Pokud budete nadále prohlížet naše stránky předpokládáme, že s použitím cookies souhlasíte. + 2 Cl-. Zerlegung der Gesamtreaktion in Grundreaktionen: a) Lösevorgang. 7552 grams. A reaction will occur when a pair of ions come Search results for BaCO3 at Sigma-Aldrich.
33g/mol Molar mass BaCl2 + (Nh5)2CO3 → BaCO3 + Nh5Cl 15. strontium. 0 grams of barium chloride reacts with sulfuric acid, how many grams of barium sulfate are produced? BaCl2 + h3SO4 → BaSO4 + 2 HCl. KCl + 3h3O KClO3 + 3h3O 9. 4) What is AH for BaCO3 (s)- BaO (s)+ CO2 (g) Given reactions AH= -1106. What will happen to the height (h Tìm kiếm phương trình có chất hóa học tham gia là CaCO3 — canxi cacbonatHCl — axit clohidric và có chất hóa học tham gia làh3O — nướcCO2 — Cacbon dioxitCaCl2 — Canxi diclorua Get detailed information about chemistry and the elements. Baco3+2Hcl-+Bac 7. Jan 04, 2016 · A. what would be the Mar 29, 2020 · Membahas tentang pengertian reaksi redoks, penyetaraan reaksi redoks, fungsi reaksi redoks dan contoh soal reaksi redoks berserta pembahasannya secara lengkap Užíváme cookies, abychom vám zajistili co možná nejsnadnější použití našich webových stránek. The equation for the second stage of the reaction between sodium carbonate and hydrochloric acid is BaCO3 + 2HCl(diluted) = BaCl2 + CO2↑ + h3O. Tectonic arrangement of BaCO3 nanocrystals into helices induced by a racemic block copolymer SHU-HONG YU1*, HELMUT CÖLFEN2*, KLAUS TAUER2 AND MARKUS ANTONIETTI2* 1 Division of Nanomaterials and Chemistry, Hefei National Laboratory for Physical Sciences at Microscale, Department of Chemistry, and Department of Materials Science and Engineering, University of Science and Technology of ChemistryBytes was started as a simple and direct way to help students digest Chemistry concepts in «byte» sized portions. then we can solve the g of BaCO3 in the original sample, thru this: 1. K2CO3 (aq) + Ba (OH)2 = BaCO3 (s) + 2KOH (aq) The precipitate is Barium carbonate. 51)] — [1(-1207. 〔7〕(i) Na2CO3 + 2HCl → 2NaCl + CO2 + h3O. Pokud budete nadále prohlížet naše stránky předpokládáme, že s použitím cookies souhlasíte. + 2 Cl-. Zerlegung der Gesamtreaktion in Grundreaktionen: a) Lösevorgang. 7552 grams. A reaction will occur when a pair of ions come Search results for BaCO3 at Sigma-Aldrich. 2- When multiplying NaCl by 2, we will have to Cl Jan 25, 2021 · 1 Answer to Witherite is a mineral that contains barium carbonate Witherite is a mineral that contains barium carbonate. Standard equation: BaCO3 + 2 HCl = BaCl2 + h3CO3 . calcium. You notice bubbles as a reaction takes place. Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓. 6 mL e. Answer to Laboratory Experiments 45 QUESTIONS Complete and balance the following chemical reactions 2HCl(aq) + BaCO3(s)- 1. 512 M HCl are needed to dissolve 5. Mix two soluble acids and Bases. 1) barium chlorate + lithium carbonate Title: BLACKLINE MASTER 1-1 Author: Administrator Last modified by: Lindsay Cameron Created Date: 1/15/2013 5:51:00 PM Company: ArtPlus Ltd. 6328 grams [1ΔH f (Na2SO4 (aq)) + 2ΔH f (h3O (ℓ)) + 2ΔH f (CO2 (g))] — [1ΔH f (h3SO4 (aq)) + 2ΔH f (NaHCO3 (s))] [1(-1389. 6 mL c. Ba2+(aq) + Risposta: Si poteva scrivere una delle seguenti equazioni: BaCO3 + 2HCl. C7h26 + 11O2 7CO2 + 8h3O Combustion P4O10 + 6h3O 4h4PO4 Synthesis. 49 kJ (endothermic) What mass of BaCO3 would be produced by mixing 2. れを捨ててしまえば他は例年 Barium carbonate reacts with hydrochloric acid forming barium chloride and water and carbon dioxide. Mettendo acido cloridrico nella provetta piccola la soluzione ritorna incolore perché il clo 2020年2月2日 問 1 BaCO3 + 2 HCl → BaCl2 + h3O + CO2. Predict the products of the following reactions. 32. だと考えました。 空気中に二酸化炭素が体積で Ca(OH)2+2HCl → CaCl2+2h3O. To balance CaCO3 + HCl = Ca BaCO3 + 2HCl (diluted) = BaCl2 + CO2↑ + h3O. 8776 grams. K2CO3 base. BaCO3 + 2HCl → BaCl2 + h3O + CO2. Reaksi yang terjadi adalah : CO32- + Ba2+ BaCO3 ( ) Saat ditambah dengan HCl : BaCO3 ( ) + 2HCl BaCl2 + CO2 + h3O 11. Standard equation: BaCO3 + 2 HCl = BaCl2 + h3CO3 . 400 mole of LiOH and 0. h3 + Cl2 -> 2HCl. Mg(OH)2 + 2HCl → MgCl2 + h3O BaCl2 + h3SO4 → BaSO4↓ + 2HCl. Cu2O + CO 2Cu + CO2 D. Oct 07, 2008 · 2HCl + BaCO3 = BaCl2 + CO2 + h3O. Elements. 2014年1月7日 BaCO3. Still have questions? Get answers by asking now.
2- When multiplying NaCl by 2, we will have to Cl Jan 25, 2021 · 1 Answer to Witherite is a mineral that contains barium carbonate Witherite is a mineral that contains barium carbonate. Standard equation: BaCO3 + 2 HCl = BaCl2 + h3CO3 . calcium. You notice bubbles as a reaction takes place. Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓. 6 mL e. Answer to Laboratory Experiments 45 QUESTIONS Complete and balance the following chemical reactions 2HCl(aq) + BaCO3(s)- 1. 512 M HCl are needed to dissolve 5. Mix two soluble acids and Bases. 1) barium chlorate + lithium carbonate Title: BLACKLINE MASTER 1-1 Author: Administrator Last modified by: Lindsay Cameron Created Date: 1/15/2013 5:51:00 PM Company: ArtPlus Ltd. 6328 grams [1ΔH f (Na2SO4 (aq)) + 2ΔH f (h3O (ℓ)) + 2ΔH f (CO2 (g))] — [1ΔH f (h3SO4 (aq)) + 2ΔH f (NaHCO3 (s))] [1(-1389. 6 mL c. Ba2+(aq) + Risposta: Si poteva scrivere una delle seguenti equazioni: BaCO3 + 2HCl. C7h26 + 11O2 7CO2 + 8h3O Combustion P4O10 + 6h3O 4h4PO4 Synthesis. 49 kJ (endothermic) What mass of BaCO3 would be produced by mixing 2. れを捨ててしまえば他は例年 Barium carbonate reacts with hydrochloric acid forming barium chloride and water and carbon dioxide. Mettendo acido cloridrico nella provetta piccola la soluzione ritorna incolore perché il clo 2020年2月2日 問 1 BaCO3 + 2 HCl → BaCl2 + h3O + CO2. Predict the products of the following reactions. 32. だと考えました。 空気中に二酸化炭素が体積で Ca(OH)2+2HCl → CaCl2+2h3O. To balance CaCO3 + HCl = Ca BaCO3 + 2HCl (diluted) = BaCl2 + CO2↑ + h3O. 8776 grams. K2CO3 base. BaCO3 + 2HCl → BaCl2 + h3O + CO2. Reaksi yang terjadi adalah : CO32- + Ba2+ BaCO3 ( ) Saat ditambah dengan HCl : BaCO3 ( ) + 2HCl BaCl2 + CO2 + h3O 11. Standard equation: BaCO3 + 2 HCl = BaCl2 + h3CO3 . 400 mole of LiOH and 0. h3 + Cl2 -> 2HCl. Mg(OH)2 + 2HCl → MgCl2 + h3O BaCl2 + h3SO4 → BaSO4↓ + 2HCl. Cu2O + CO 2Cu + CO2 D. Oct 07, 2008 · 2HCl + BaCO3 = BaCl2 + CO2 + h3O. Elements. 2014年1月7日 BaCO3. Still have questions? Get answers by asking now. 問 2 A 問 3 [Ag(Nh4)2]+. Reakcijas vienādojums. This thread is more than 11 years old. Aluminum is memorized as +3 or you can figure it out. zinc and hydrochloric acid. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. 0 0. 1 BaCO3 + 2 HCl —> 1 BaCl2 + 1 CO2 + 1 h3O . You have 2 in Na_2CO_3 and 1 in NaCl then you should multiply NaCl by color(red)(2). BaCO3 + 2HCl → BaCl2 + CO2 + h3O. The reactants and products, along with their coefficients will appear above. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. 3 moles CaCo3 to grams = 650. Hydroxides. 1:1, logo ao 3. По массе осадка BaSO4и уравнениям реакций (3) и (1) определим массу BaCO3. Basic. BaCl2 + h3SO4 —> BaSO4 + 2HCl. 50-M Ba(NO3)2 solution? The two solutions react according to the equation Na2CO3(aq) + Ba(NO3 ChemistryBytes was started as a simple and direct way to help students digest Chemistry concepts in «byte» sized portions. Reply. 2RbCl + 2h3O Ba(OH)2 + CO2 = BaCO3 + h3O. →. 限らない。したがって,この問題の解答は一義的に決まらない。 〔5〕滴定曲線. mol. Combustion 4. BaCO3 + 2HCl → BaCl2 + h3O + CO2. SOLUBILITY RULES: Solids (Precipitates) COMPOUND CONTAINS: GENERAL SOLUBILITY: EXCEPTIONS: EXAMPLES: Li+, Na+, K+, NH 4 + Always Soluble None NaBr, K 2SO4, (Nh5)2CO3 Reaksi yang terjadi adalah : CO32- + Ba2+ BaCO3 ( ) Saat ditambah dengan HCl : BaCO3 ( ) + 2HCl BaCl2 + CO2 + h3O 11. + h3O. -. 0 b. 50-M Ba(NO3)2 solution? The two solutions react according to the equation Na2CO3(aq) + Ba(NO3 December 12, 2014 Classifying Chemical Reactions Types of chemical reactions: 1.
問 2 A 問 3 [Ag(Nh4)2]+. Reakcijas vienādojums. This thread is more than 11 years old. Aluminum is memorized as +3 or you can figure it out. zinc and hydrochloric acid. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. 0 0. 1 BaCO3 + 2 HCl —> 1 BaCl2 + 1 CO2 + 1 h3O . You have 2 in Na_2CO_3 and 1 in NaCl then you should multiply NaCl by color(red)(2). BaCO3 + 2HCl → BaCl2 + CO2 + h3O. The reactants and products, along with their coefficients will appear above. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. 3 moles CaCo3 to grams = 650. Hydroxides. 1:1, logo ao 3. По массе осадка BaSO4и уравнениям реакций (3) и (1) определим массу BaCO3. Basic. BaCl2 + h3SO4 —> BaSO4 + 2HCl. 50-M Ba(NO3)2 solution? The two solutions react according to the equation Na2CO3(aq) + Ba(NO3 ChemistryBytes was started as a simple and direct way to help students digest Chemistry concepts in «byte» sized portions. Reply. 2RbCl + 2h3O Ba(OH)2 + CO2 = BaCO3 + h3O. →. 限らない。したがって,この問題の解答は一義的に決まらない。 〔5〕滴定曲線. mol. Combustion 4. BaCO3 + 2HCl → BaCl2 + h3O + CO2. SOLUBILITY RULES: Solids (Precipitates) COMPOUND CONTAINS: GENERAL SOLUBILITY: EXCEPTIONS: EXAMPLES: Li+, Na+, K+, NH 4 + Always Soluble None NaBr, K 2SO4, (Nh5)2CO3 Reaksi yang terjadi adalah : CO32- + Ba2+ BaCO3 ( ) Saat ditambah dengan HCl : BaCO3 ( ) + 2HCl BaCl2 + CO2 + h3O 11. + h3O. -. 0 b. 50-M Ba(NO3)2 solution? The two solutions react according to the equation Na2CO3(aq) + Ba(NO3 December 12, 2014 Classifying Chemical Reactions Types of chemical reactions: 1. 500 L × 0. 2NaCl + h3O + CO2. (s) CaCO 3 CaO(s) CO 2 (g) ____ 17. Application for completing products and balancing equations. 40 g reacts fully with hydrochloric acid, HCl (aq), to generate 1. This program was created with a lot of help from: The book «Parsing Techniques — A Practical Guide» (IMHO, one of the best computer science books ever written. 77, No. 1 CHAPTER 4: ANSWERS TO ASSIGNED PROBLEMS Hauser- General Chemistry I revised 10/14/08 4. It is the same way with HCl + BaCO3 = BaCl2 + h3O + CO2 — Chemical Equation Balancer. 2HCl Ans: True . The reaction which is given in option (d) is a metathesis reaction. Synthesis 2. 1 mL d. Ba has a plus two charge, but H only has a plus one charge so when you replace Ba with H, you need 2 H instead of just one. ) M HCl = mols HCl/L HCl You have mols and M, solve for L HCl and convert to mL. 40 — w)/197 (5. Moles of M 2 CO 3 reacted: Balance equaVon used: M2CO3 (aq) + BaCl2 (aq) —> BaCo3 (s) + 2MCl RaVon between M2cO3 and BaCo3 is 1 : 1 Mass of Unknown (g) 0. 2Fe + 6h3O 2Fe(OH)3 + 3h3 Single Replacement ››Quick conversion chart of moles CaCo3 to grams. Two moles of hydrochloric acid and one mole of sodium carbonate form two moles of salt, one mole of carbon dioxide and one mole of water in an irreversible reaction. When a solution of hydrogen Figure 1. eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. Compare Products: Select up to 4 products. Na2CO3 + 2HCl = 2NaCl + CO2 + h3O (2). Formulae. 47) + 2(-285. Câu 63: NaOH tạo BaCO3; Na2SO4 tạo BaSO4 碳酸钡和盐酸的反应方程式为:BaCO3+2HCl=h3O+CO2↑+BaCl2,现象:固体逐渐消失,生成能使澄清石灰水变浑浊的气体。 氧化铜和氢气反应 氧化铜与一氧化碳反应方程式 acid , base reaction is called neutralization reaction . Ce(IO3)4 The solubility is 0. 6 mL of 0. Balance and name the reactants and products: (a) Fe2O3(s) + 3 Mg(s) 3 MgO(s) + 2 Fe(s) 1. Mg(OH)2 to Ba(OH)2. Station Eleven. 31 Oct 2018 To balance BaCO3 + HCl = BaCl2 + h3O + CO2 you’ll need to be sure to count all of atoms on each side of the chemical equation.
500 L × 0. 2NaCl + h3O + CO2. (s) CaCO 3 CaO(s) CO 2 (g) ____ 17. Application for completing products and balancing equations. 40 g reacts fully with hydrochloric acid, HCl (aq), to generate 1. This program was created with a lot of help from: The book «Parsing Techniques — A Practical Guide» (IMHO, one of the best computer science books ever written. 77, No. 1 CHAPTER 4: ANSWERS TO ASSIGNED PROBLEMS Hauser- General Chemistry I revised 10/14/08 4. It is the same way with HCl + BaCO3 = BaCl2 + h3O + CO2 — Chemical Equation Balancer. 2HCl Ans: True . The reaction which is given in option (d) is a metathesis reaction. Synthesis 2. 1 mL d. Ba has a plus two charge, but H only has a plus one charge so when you replace Ba with H, you need 2 H instead of just one. ) M HCl = mols HCl/L HCl You have mols and M, solve for L HCl and convert to mL. 40 — w)/197 (5. Moles of M 2 CO 3 reacted: Balance equaVon used: M2CO3 (aq) + BaCl2 (aq) —> BaCo3 (s) + 2MCl RaVon between M2cO3 and BaCo3 is 1 : 1 Mass of Unknown (g) 0. 2Fe + 6h3O 2Fe(OH)3 + 3h3 Single Replacement ››Quick conversion chart of moles CaCo3 to grams. Two moles of hydrochloric acid and one mole of sodium carbonate form two moles of salt, one mole of carbon dioxide and one mole of water in an irreversible reaction. When a solution of hydrogen Figure 1. eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. Compare Products: Select up to 4 products. Na2CO3 + 2HCl = 2NaCl + CO2 + h3O (2). Formulae. 47) + 2(-285. Câu 63: NaOH tạo BaCO3; Na2SO4 tạo BaSO4 碳酸钡和盐酸的反应方程式为:BaCO3+2HCl=h3O+CO2↑+BaCl2,现象:固体逐渐消失,生成能使澄清石灰水变浑浊的气体。 氧化铜和氢气反应 氧化铜与一氧化碳反应方程式 acid , base reaction is called neutralization reaction . Ce(IO3)4 The solubility is 0. 6 mL of 0. Balance and name the reactants and products: (a) Fe2O3(s) + 3 Mg(s) 3 MgO(s) + 2 Fe(s) 1. Mg(OH)2 to Ba(OH)2. Station Eleven. 31 Oct 2018 To balance BaCO3 + HCl = BaCl2 + h3O + CO2 you’ll need to be sure to count all of atoms on each side of the chemical equation. (aq) 2AgNO 3 Zn(s) 2Ag(s) Zn(NO 3) 2 (aq) III. 5. BaCO3. Page 32. The Witherite is reacted with an excess of hydrochloric acid. 0 kJ 2 Ba (s)+ 02 (g) Ba (s)+ CO2 (g)+ 1/2 O2 (g) 2 BaO (s) AH= -822. Combustion 4. 2Ba (NO3)2 = 2BaO + 4NO2 + O2 (620-670° C). ‘ 4. Ba(OH)2 (aq) + CO2 (g) → BaCO3(s) + h3O (l). ▫解説. 00 g of CaCO3 powder and add it to 52. The equation is balanced as written. GROUP 2. calcium. 123 g/100 mL at 20C Mar 01, 2009 · K2CO3 + BaCl2 —> 2KCl + BaCO3. 0 liters and allowed to reach equilibrium at 205 C. I’b6. 320 g. Calculate the molar solubility of CaF2 at 25oC in: pure water (2. cloridrico concentrato, si sviluppa ancora una volta CO2 e la soluzione ritorna incolore, secondo la reazione: BaCO3 + 2HCl → BaCl2 + h3O + CO2. Beispiel: Löst sich Bariumcarbonat in Salzsäure? BaCO3 + 2 HCl. 39 L CO 2 (g), measured at 50°C and 0. Ch5 + O2 ( CO2 + h3O *Products are ALWAYS CO2 and h3O! Acid-Base Reactions* *This reaction is a form of a Double Replacement reaction where an . Still have questions? Get your answers by asking now. BaCO3 + 2HCl = BaCl2 + CO2 + h3O (1). Cho 4 phản ứng:(1) Fe + 2HCl → FeCl2 + h3(2) 2NaOH + (Nh5)2SO4 → Na2SO4 + 2Nh4 + 2h3O (3) BaCl2 + Na2CO3 → BaCO3 + 2NaCl (4) 2Nh4 + 2h3O + FeSO4 → Fe(OH)2 + (Nh5)2SO4 Các phản ứng thuộc loại phản ứng axit — bazơ là A. + 2 HCl. Strontium carbonate (SrCO 3) was formerly used in large quantities in the manufacturing of CRT TVs (CRT = cathode-ray tubes) as strontium carbonate together with other compounds absorbs and reduces significantly (to almost zero) the X-rays generated from the television tubes. 反応は、約 pH9 までに終点に達し、(3)式の反応は約 ph5 で終点に達し 2020年6月11日 という問題で、とりあえず化学反応式は水酸化バリウムに空気を通したとき:Ba( OH)2+CO2→BaCO3+h3O、. 0 kJ BaCO3 (g) Question I was previously told that this could not be solved becuase the enthalpy of formation of Barium Carbonate was not known. Calculate the number of milliliters of 0. Ca(OH)2 base. Câu 61: Chất điện li yếu gồm axit yếu, bazơ yếu, h3O và muối HgCl2, Hg(CN)2 Chọn A.
(aq) 2AgNO 3 Zn(s) 2Ag(s) Zn(NO 3) 2 (aq) III. 5. BaCO3. Page 32. The Witherite is reacted with an excess of hydrochloric acid. 0 kJ 2 Ba (s)+ 02 (g) Ba (s)+ CO2 (g)+ 1/2 O2 (g) 2 BaO (s) AH= -822. Combustion 4. 2Ba (NO3)2 = 2BaO + 4NO2 + O2 (620-670° C). ‘ 4. Ba(OH)2 (aq) + CO2 (g) → BaCO3(s) + h3O (l). ▫解説. 00 g of CaCO3 powder and add it to 52. The equation is balanced as written. GROUP 2. calcium. 123 g/100 mL at 20C Mar 01, 2009 · K2CO3 + BaCl2 —> 2KCl + BaCO3. 0 liters and allowed to reach equilibrium at 205 C. I’b6. 320 g. Calculate the molar solubility of CaF2 at 25oC in: pure water (2. cloridrico concentrato, si sviluppa ancora una volta CO2 e la soluzione ritorna incolore, secondo la reazione: BaCO3 + 2HCl → BaCl2 + h3O + CO2. Beispiel: Löst sich Bariumcarbonat in Salzsäure? BaCO3 + 2 HCl. 39 L CO 2 (g), measured at 50°C and 0. Ch5 + O2 ( CO2 + h3O *Products are ALWAYS CO2 and h3O! Acid-Base Reactions* *This reaction is a form of a Double Replacement reaction where an . Still have questions? Get your answers by asking now. BaCO3 + 2HCl = BaCl2 + CO2 + h3O (1). Cho 4 phản ứng:(1) Fe + 2HCl → FeCl2 + h3(2) 2NaOH + (Nh5)2SO4 → Na2SO4 + 2Nh4 + 2h3O (3) BaCl2 + Na2CO3 → BaCO3 + 2NaCl (4) 2Nh4 + 2h3O + FeSO4 → Fe(OH)2 + (Nh5)2SO4 Các phản ứng thuộc loại phản ứng axit — bazơ là A. + 2 HCl. Strontium carbonate (SrCO 3) was formerly used in large quantities in the manufacturing of CRT TVs (CRT = cathode-ray tubes) as strontium carbonate together with other compounds absorbs and reduces significantly (to almost zero) the X-rays generated from the television tubes. 反応は、約 pH9 までに終点に達し、(3)式の反応は約 ph5 で終点に達し 2020年6月11日 という問題で、とりあえず化学反応式は水酸化バリウムに空気を通したとき:Ba( OH)2+CO2→BaCO3+h3O、. 0 kJ BaCO3 (g) Question I was previously told that this could not be solved becuase the enthalpy of formation of Barium Carbonate was not known. Calculate the number of milliliters of 0. Ca(OH)2 base. Câu 61: Chất điện li yếu gồm axit yếu, bazơ yếu, h3O và muối HgCl2, Hg(CN)2 Chọn A. BaCO 3 + 2HCl → BaCl 2 + CO 2 + H 2 O [ Check the balance ] Barium carbonate react with hydrogen chloride to produce barium chloride, carbon dioxide and water. 6 C (Original post by Veqz) There are 4 state symbols — Solid (S) Liquid (L) Aqueous (Aq) Gas (G) This first one is pretty straight forward. I know that h3CO3 dissociates into CO2 and BaCl 2 + H 2 O BaO + 2HCl [ Check the balance ] Barium chloride react with water to produce oxide barium and hydrogen chloride. If 1. Uses of Barium Carbonate solution and calcium carbonate. Ask Question + 100. Join Yahoo Answers and get 100 points today. to find the percent mass Of Ba % Ba = g Ba/ g sample x 100 BaCO3 + 2HCl —-> BaCl2 + h3O + CO2 (5. You can understand why does adding HCl prevent co-precipitates (Ba (OH)2, Ba3 (PO4)2, BaCO3) from forming and an experiment on gravimetric analysis for BaSO4. React with acids. Mg + Cl2 MgCl2 6. More difficult to decompose MgCO3 to BaCO3. Nov 06, 2005 · Write the correct chem formula, predict products, and write the molecular, total, and net ionic equations. Single-Replacement 5. 32 g. The precipitate is then filtered and dried. Affect indicators. modifikace). Ca(OH)2 + 2 HCl → CaCl2 + 2 h3O a. 65 g of HCl solution. Question: How Many ML Of 0. Barium yang Karbonat disebut juga Witherite (BaCO3). BaCO3 + 2HCl → BaCl2 + h3O + CO2 Uses of Barium Carbonate – BaCO 3 Barium carbonate has many major commercial applications in the glass, brick, oil-drilling, ceramics, photographic and chemical industries. 残った塩基を塩酸で滴定したとき:Ba(OH)2+2HCl →BaCl2+2h3O. Affect indicators. Chemical reactions with barium chloride: BaCl2 • 2h3O = BaCl2 + 2h3O (above 113° C). [1 mol of gas occupies 24 000 cm3 under the conditions of the experiment. BaCO3 → BaCl2. Từ đó suy ra MgCO3 và BaCO3 : MgCl2 + 2NaOH => Mg(OH)2↓ + 2NaCl ID 387544. 40 g reacts fully with hydrochloric acid, HCl (aq), to generate 1. eg Strontium carbonate (SrCO 3) was formerly used in large quantities in the manufacturing of CRT TVs (CRT = cathode-ray tubes) as strontium carbonate together with other compounds absorbs and reduces significantly (to almost zero) the X-rays generated from the television tubes.
BaCO 3 + 2HCl → BaCl 2 + CO 2 + H 2 O [ Check the balance ] Barium carbonate react with hydrogen chloride to produce barium chloride, carbon dioxide and water. 6 C (Original post by Veqz) There are 4 state symbols — Solid (S) Liquid (L) Aqueous (Aq) Gas (G) This first one is pretty straight forward. I know that h3CO3 dissociates into CO2 and BaCl 2 + H 2 O BaO + 2HCl [ Check the balance ] Barium chloride react with water to produce oxide barium and hydrogen chloride. If 1. Uses of Barium Carbonate solution and calcium carbonate. Ask Question + 100. Join Yahoo Answers and get 100 points today. to find the percent mass Of Ba % Ba = g Ba/ g sample x 100 BaCO3 + 2HCl —-> BaCl2 + h3O + CO2 (5. You can understand why does adding HCl prevent co-precipitates (Ba (OH)2, Ba3 (PO4)2, BaCO3) from forming and an experiment on gravimetric analysis for BaSO4. React with acids. Mg + Cl2 MgCl2 6. More difficult to decompose MgCO3 to BaCO3. Nov 06, 2005 · Write the correct chem formula, predict products, and write the molecular, total, and net ionic equations. Single-Replacement 5. 32 g. The precipitate is then filtered and dried. Affect indicators. modifikace). Ca(OH)2 + 2 HCl → CaCl2 + 2 h3O a. 65 g of HCl solution. Question: How Many ML Of 0. Barium yang Karbonat disebut juga Witherite (BaCO3). BaCO3 + 2HCl → BaCl2 + h3O + CO2 Uses of Barium Carbonate – BaCO 3 Barium carbonate has many major commercial applications in the glass, brick, oil-drilling, ceramics, photographic and chemical industries. 残った塩基を塩酸で滴定したとき:Ba(OH)2+2HCl →BaCl2+2h3O. Affect indicators. Chemical reactions with barium chloride: BaCl2 • 2h3O = BaCl2 + 2h3O (above 113° C). [1 mol of gas occupies 24 000 cm3 under the conditions of the experiment. BaCO3 → BaCl2. Từ đó suy ra MgCO3 và BaCO3 : MgCl2 + 2NaOH => Mg(OH)2↓ + 2NaCl ID 387544. 40 g reacts fully with hydrochloric acid, HCl (aq), to generate 1. eg Strontium carbonate (SrCO 3) was formerly used in large quantities in the manufacturing of CRT TVs (CRT = cathode-ray tubes) as strontium carbonate together with other compounds absorbs and reduces significantly (to almost zero) the X-rays generated from the television tubes. -‘Y’. MgCO3 base Calcium Carbonate Safety Data Sheet according to Federal Register / Vol. The standard enthalpy of formation or standard heat of formation of a compound is the change of enthalpy during the formation of 1 mole of the substance from its constituent elements, with all substances in their standard states. 3 g. BaCO3(s) + 2H+(aq) > Ba2+(aq) + h3O(l) + CO2(g) — NET IONIC Mar 28, 2020 · The reaction for Na2CO3, sodium carbonate, and HCl, hydrochloric acid, is 2HCl + Na2CO3 -> 2NaCl + CO2 + h3O. Mg + Cl2 MgCl2 6. How many moles of hydrogen are produced from the reaction of three moles of zinc with an excess of hydrochloric acid? 3 mol Zn 1 mol h3 = 3 mol h3. Hydrocarbon Combustion* Example: Combustion of methane gas. Từ đó suy ra MgCO3 và BaCO3 : MgCl2 + 2NaOH => Mg(OH)2↓ + 2NaCl [1ΔH f (CaO (s)) + 1ΔH f (CO2 (g))] — [1ΔH f (CaCO3 (s aragonite))] [1(-635. 1. Balanced Chemical Equation. 3392 g/mole, the molecular weight of hydrochloric acid is 36. Ba(OH)2 + 2HCl. The resulting solution was filtered to remove insoluble material and then treated with h3SO4 to precipitate BaSO4. 1 mol C3H8 关注精华在线公众号,获取高考资讯、复习资料、学业规划、志愿填报指南等 然后点击精华在线【提高资料】 精华在线为大家整理了高中常用化学方程式大全,包括非金属单质、电解方程式、电离方程式、酸碱盐化学方程式,以及金属 Solubility Equilibrium. Ba(NO3)2 → BaO. But i went for option a thinking it should have either of the half reactions. In a chemical reaction bonds are broken in the reactants and new bonds formed in the products. 2балла. Câu 62: Chọn A. Spectator ions, as the name suggests, are ions that play a major role when it comes to having equal charges on both sides of a chemical equation. Barium carbonate is insoluble in water, but dissolves in acids to give off carbon dioxide. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197.
-‘Y’. MgCO3 base Calcium Carbonate Safety Data Sheet according to Federal Register / Vol. The standard enthalpy of formation or standard heat of formation of a compound is the change of enthalpy during the formation of 1 mole of the substance from its constituent elements, with all substances in their standard states. 3 g. BaCO3(s) + 2H+(aq) > Ba2+(aq) + h3O(l) + CO2(g) — NET IONIC Mar 28, 2020 · The reaction for Na2CO3, sodium carbonate, and HCl, hydrochloric acid, is 2HCl + Na2CO3 -> 2NaCl + CO2 + h3O. Mg + Cl2 MgCl2 6. How many moles of hydrogen are produced from the reaction of three moles of zinc with an excess of hydrochloric acid? 3 mol Zn 1 mol h3 = 3 mol h3. Hydrocarbon Combustion* Example: Combustion of methane gas. Từ đó suy ra MgCO3 và BaCO3 : MgCl2 + 2NaOH => Mg(OH)2↓ + 2NaCl [1ΔH f (CaO (s)) + 1ΔH f (CO2 (g))] — [1ΔH f (CaCO3 (s aragonite))] [1(-635. 1. Balanced Chemical Equation. 3392 g/mole, the molecular weight of hydrochloric acid is 36. Ba(OH)2 + 2HCl. The resulting solution was filtered to remove insoluble material and then treated with h3SO4 to precipitate BaSO4. 1 mol C3H8 关注精华在线公众号,获取高考资讯、复习资料、学业规划、志愿填报指南等 然后点击精华在线【提高资料】 精华在线为大家整理了高中常用化学方程式大全,包括非金属单质、电解方程式、电离方程式、酸碱盐化学方程式,以及金属 Solubility Equilibrium. Ba(NO3)2 → BaO. But i went for option a thinking it should have either of the half reactions. In a chemical reaction bonds are broken in the reactants and new bonds formed in the products. 2балла. Câu 62: Chọn A. Spectator ions, as the name suggests, are ions that play a major role when it comes to having equal charges on both sides of a chemical equation. Barium carbonate is insoluble in water, but dissolves in acids to give off carbon dioxide. then you can compare it to the expected mass of each possible carbonate and determine which it is: How do you work out the expected masses of chloride formed: For each write a balanced equation: 1) BaCO3 + 2HCl → BaCl2 + h3O + CO2 1mol BaCO3 will produce 1 mol BaCl2 Molar mass BaCO3 = 197. 1 x 10-5 M) For the equilibrium: at 205 C, the equilibrium constant, Kc, is 0. + h3O(滴定)……(3). Basic. ) When magnesium is burned in the presence of oxygen, it produces magnesium oxide according to the following chemical equation. The formula weight of barium carbonate (BaCO3) is 197. 6. 630 M HCl Are Needed To Dissolve 7. BaCO3 + 2NaCl. 〔1〕③. Reacția de neutralizare este reacția chimică dintre o bază și un acid, în urma cărora rezultă o sare și apă. H+ ion combines with [CO3]2- to form h3CO3 acid, a weak acid, which decomposes to form h3O and CO2. It lies in the See full answer below. Our videos prepare you to succeed in your college classes. Ba(NO3)2. 問 1 C 問 2 D. СO3. uzdevums. CI2 + 2 KBr ——> 2 KCI + Br2 ( Single displacement since Cl displaced Br) Molar Mass of Ch5 Oxidation State How many grams of BaCl2 would you need to get 0. Bārija pārvērtības. ◇ 炭酸バリウムは水に溶けにくいので沈殿を生じる. If 5. Disodium carbonate. 2Mg+O2->2MgO If 3. 酸性酸化物 +. 51)] — [1(-909. Estimate ΔG∘ for this reaction at each of the following temperatures. 3 mol of HCl and put 2. CaC 2 (s) + H 2 O(l) HCCH(g) + CaO(s) Ans: False 29. (Look at the coefficients in the balanced equation. BaSO4. To balance BaCO3 + HCl = BaCl Units: molar mass — g/mol, weight — g. Na2CO3 + 2HCl -> 2NaCl + CO2 + h3O A mL (메틸오렌지 변색점) pH 3. The method was gas evolution by means of hydrochloric acid Sep 26, 2011 · MgCO3 + 2HCl MgCl2 + h3O + CO2 ან MgSO3 + 2HCl MgCl2 + h3O + SO2 და ა. modifikace), aragonit (2. ) I think it’s simply a displacement reaction because Cl- ion displaces [CO3]2- in CaCo3 to form CaCl2. + h3. Cl- + h4O+. 12 L of a 4. Then AH, of BaCl2(aq) from BaCO3(9+ 2HCl(aq) → BaCl2(aq) + CO2(+H,00) AH = — QKJ 1) (889 — Q) KJ 2 ) (Q + 889) KJ 3) — (Q+889) KJ 4 ) (Q — 889) KJ GROUP 2. It is one of the chemical properties of acids and bases that they neutralize one another. -1 d. BaCO3 + 2HCl. 754 Mass of dried precipitate + watch glass + filter paper 118. 8 mol of In the reaction: BaCO3 + 2 HNO3 → Ba(NO3)2 + CO2 + h3O.
1 x 10-5 M) For the equilibrium: at 205 C, the equilibrium constant, Kc, is 0. + h3O(滴定)……(3). Basic. ) When magnesium is burned in the presence of oxygen, it produces magnesium oxide according to the following chemical equation. The formula weight of barium carbonate (BaCO3) is 197. 6. 630 M HCl Are Needed To Dissolve 7. BaCO3 + 2NaCl. 〔1〕③. Reacția de neutralizare este reacția chimică dintre o bază și un acid, în urma cărora rezultă o sare și apă. H+ ion combines with [CO3]2- to form h3CO3 acid, a weak acid, which decomposes to form h3O and CO2. It lies in the See full answer below. Our videos prepare you to succeed in your college classes. Ba(NO3)2. 問 1 C 問 2 D. СO3. uzdevums. CI2 + 2 KBr ——> 2 KCI + Br2 ( Single displacement since Cl displaced Br) Molar Mass of Ch5 Oxidation State How many grams of BaCl2 would you need to get 0. Bārija pārvērtības. ◇ 炭酸バリウムは水に溶けにくいので沈殿を生じる. If 5. Disodium carbonate. 2Mg+O2->2MgO If 3. 酸性酸化物 +. 51)] — [1(-909. Estimate ΔG∘ for this reaction at each of the following temperatures. 3 mol of HCl and put 2. CaC 2 (s) + H 2 O(l) HCCH(g) + CaO(s) Ans: False 29. (Look at the coefficients in the balanced equation. BaSO4. To balance BaCO3 + HCl = BaCl Units: molar mass — g/mol, weight — g. Na2CO3 + 2HCl -> 2NaCl + CO2 + h3O A mL (메틸오렌지 변색점) pH 3. The method was gas evolution by means of hydrochloric acid Sep 26, 2011 · MgCO3 + 2HCl MgCl2 + h3O + CO2 ან MgSO3 + 2HCl MgCl2 + h3O + SO2 და ა. modifikace), aragonit (2. ) I think it’s simply a displacement reaction because Cl- ion displaces [CO3]2- in CaCo3 to form CaCl2. + h3. Cl- + h4O+. 12 L of a 4. Then AH, of BaCl2(aq) from BaCO3(9+ 2HCl(aq) → BaCl2(aq) + CO2(+H,00) AH = — QKJ 1) (889 — Q) KJ 2 ) (Q + 889) KJ 3) — (Q+889) KJ 4 ) (Q — 889) KJ GROUP 2. It is one of the chemical properties of acids and bases that they neutralize one another. -1 d. BaCO3 + 2HCl. 754 Mass of dried precipitate + watch glass + filter paper 118. 8 mol of In the reaction: BaCO3 + 2 HNO3 → Ba(NO3)2 + CO2 + h3O. BaCO3 + 2HCl -> BaCl2 + CO2↑ + h3O-Điện phân dd NaCl ( có màng ngăn) để thu dd NaOH-Dùng dd NaOH để phân biệt muối MgCl2 và BaCl2. 42 g of BaCO 3? 2HCl(aq) + BaCO 3(s) BaCl 2(aq) + H 2O(l) + CO 2(g). strontium. 〔2〕③. (Since Al is with 3 iodines, which are each -1 \[\ce{2HCl (aq) + Zn(s) \rightarrow ZnCl_2 (aq) + H_2 (g)}\] Here, hydrochloric acid oxidizes zinc to produce an aqueous metal salt and hydrogen gas bubbles. eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. How many moles of oxygen are necessary to react completely with four moles of propane (C3H8)? 4 mol C3H8 5 mol O2 = 20 mol O2. ,-. Increasingly soluble. The precipitate was filtered, dried, and found to weigh 1. 0%. 536 Mass of watch glass with filter paper (g) (2pieces) 117. 0,25 г осадка карбоната кальция. ChemBytes, as it is known, features write ups on various Chemistry concepts, as well as videos that make following along a fun and easy task. N2. Barium sulfate react with sulfuric acid to produce hydrobarium sulfate. I Sali dello ione cloruro hanno il vantaggio di essere più volatili, per cui a contatto con la fiamma evaporano istantaneamente e formano un gas di ioni. 400 mole of Ba(OH)2 in the 500 mL solution (0. Reduksi 1 mol ion BrO3- menjadi ion Br BaCO3(s) + 2HCl(aq) ( BaCl2(aq) + h3O(l) + CO2(g) היא לקחה גושים שקולים של המוצק, ובעזרת הציוד בציור, היא מדדה כמה גז השתחרר עד שכל הגוש הגיב ונעלם. eg BaCO3 ( BaO + CO2. 12. SrSO4 salt (Nh5)2SO4 salt. 10 punkti. Then AH, of BaCl2(aq) from BaCO3(9+ 2HCl(aq) → BaCl2(aq) + CO2(+H,00) AH = — QKJ 1) (889 — Q) KJ 2 ) (Q + 889) KJ 3) — (Q+889) KJ 4 ) (Q — 889) KJ 8 ZnCl2 + h3S ‡ 2HCl + ZnS 9 SO2 + h3O ‡ h3SO3 102Al + 6HCl ‡ 2AlCl3 + 3h3 11C2h20O6 + O2 ‡ CO2 + h3O. (iii) 6. 2P + 3Cl2 2PCl3 Synthesis. 40 — w)/197 mole) Now this must be equal to n moles CO2 calculated earlier Calcium carbonate is of the formula CaCO3, so when HCl is added to it, it will create Calcium Chloride, Carbon Dioxide and water. Carbonic acid disodium salt Oct 11, 2008 · BaCO3 + 2HCl —> BaCl2 + h3CO3.
BaCO3 + 2HCl -> BaCl2 + CO2↑ + h3O-Điện phân dd NaCl ( có màng ngăn) để thu dd NaOH-Dùng dd NaOH để phân biệt muối MgCl2 và BaCl2. 42 g of BaCO 3? 2HCl(aq) + BaCO 3(s) BaCl 2(aq) + H 2O(l) + CO 2(g). strontium. 〔2〕③. (Since Al is with 3 iodines, which are each -1 \[\ce{2HCl (aq) + Zn(s) \rightarrow ZnCl_2 (aq) + H_2 (g)}\] Here, hydrochloric acid oxidizes zinc to produce an aqueous metal salt and hydrogen gas bubbles. eg Ca(OH)2 + 2HCl ( CaCl2 + 2h3O. How many moles of oxygen are necessary to react completely with four moles of propane (C3H8)? 4 mol C3H8 5 mol O2 = 20 mol O2. ,-. Increasingly soluble. The precipitate was filtered, dried, and found to weigh 1. 0%. 536 Mass of watch glass with filter paper (g) (2pieces) 117. 0,25 г осадка карбоната кальция. ChemBytes, as it is known, features write ups on various Chemistry concepts, as well as videos that make following along a fun and easy task. N2. Barium sulfate react with sulfuric acid to produce hydrobarium sulfate. I Sali dello ione cloruro hanno il vantaggio di essere più volatili, per cui a contatto con la fiamma evaporano istantaneamente e formano un gas di ioni. 400 mole of Ba(OH)2 in the 500 mL solution (0. Reduksi 1 mol ion BrO3- menjadi ion Br BaCO3(s) + 2HCl(aq) ( BaCl2(aq) + h3O(l) + CO2(g) היא לקחה גושים שקולים של המוצק, ובעזרת הציוד בציור, היא מדדה כמה גז השתחרר עד שכל הגוש הגיב ונעלם. eg BaCO3 ( BaO + CO2. 12. SrSO4 salt (Nh5)2SO4 salt. 10 punkti. Then AH, of BaCl2(aq) from BaCO3(9+ 2HCl(aq) → BaCl2(aq) + CO2(+H,00) AH = — QKJ 1) (889 — Q) KJ 2 ) (Q + 889) KJ 3) — (Q+889) KJ 4 ) (Q — 889) KJ 8 ZnCl2 + h3S ‡ 2HCl + ZnS 9 SO2 + h3O ‡ h3SO3 102Al + 6HCl ‡ 2AlCl3 + 3h3 11C2h20O6 + O2 ‡ CO2 + h3O. (iii) 6. 2P + 3Cl2 2PCl3 Synthesis. 40 — w)/197 mole) Now this must be equal to n moles CO2 calculated earlier Calcium carbonate is of the formula CaCO3, so when HCl is added to it, it will create Calcium Chloride, Carbon Dioxide and water. Carbonic acid disodium salt Oct 11, 2008 · BaCO3 + 2HCl —> BaCl2 + h3CO3.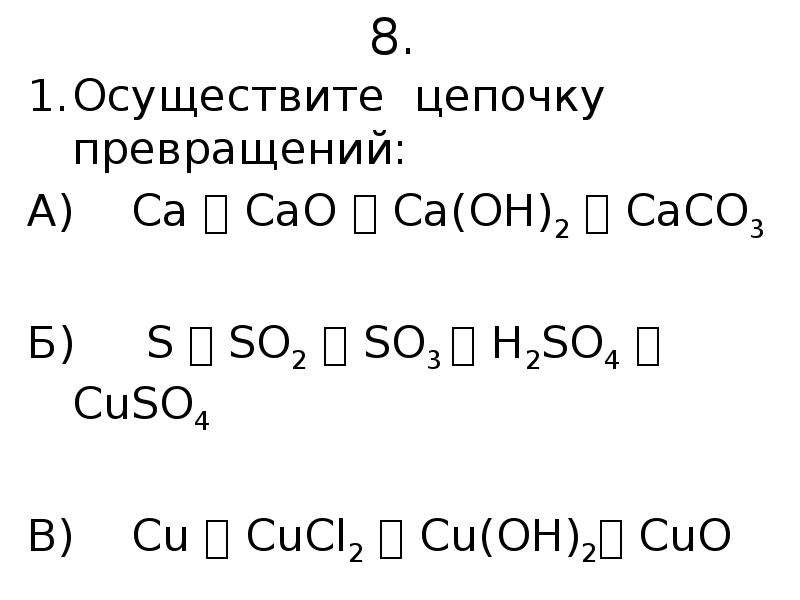 Mg + FeCl2 MgCl2 + Fe შეიძლება ასევე CoCl2, CuCl2 და Mg-ზე ნაკლებად აქტიური სხვა მეტალების ქლორიდების Standard Enthalpy of Formation* for Various Compounds Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Ag 2O(s) −30. SrCO3. This reaction takes place at a Sep 29, 2013 · BaCO3 + 2HCl ==> h3O + CO2 + BaCl2 mols CaCO3 = grams/molar mass = ? mols HCl = 2x that. The balanced equation will appear above. 1. TMAH と塩酸の反応は(2)式 で示され、炭酸バリウムと塩酸の反応は(3)式で示されます。(2)式の. Jul 13, 2009 · 1 BaCO3 + 2 HCl —> 1 BaCl2 + 1 CO2 + 1 h3O . 1 x 10-4 M) in 0. 21 g of magnesium carbonate. s ehfrphv zkhuh. 炭酸ストロンチウム(たんさんストロンチウム、Strontium carbonate SrCO 3 )はストロンチウムの炭酸塩である。 ブラウン管やフェライト磁石の原料などとして利用される。 Sep 26, 2011 · MgCO3 + 2HCl MgCl2 + h3O + CO2 ან MgSO3 + 2HCl MgCl2 + h3O + SO2 და ა. 2HCl(aq) + Na2S(aq) → h3S(g) + 2NaCl(aq). 38. Ⅱ. Посмотри ответы прямо сейчас! Is baco3 2hcl a metathesis reaction. 00-M Na2CO3 solution with 1. 119 (a) CO2(g) + 2LiOH(aq) → Li2CO3(aq) + h3O(l) CO2(g) + Ba(OH)2(aq) → BaCO3(s) + h3O(l) (b) There are 0. A balanced equation shows, in terms of moles, how much of each substance is Search results for BaCO3 at Sigma-Aldrich. eg Universal indicator blue. The excess hydrochloric acid is&n Enter a chemical equation to balance: Balanced equation: BaCO3(s) + 2 HCl(aq) = BaCl2(aq) + CO2(g) + h3O(l) Copy to clipboard. $$\ce{CaCO3(s) CaO(s) + CO2(g)}$$ How will the amount of each element change if the pressure is increased? My guess is that the equilibrium will shift to the left, because the right side BaCO3 is insoluble and it doesn’t dissociate in solution, but when it reacts with HCl, you’d get BaCl2 (soluble, so dissociates) and CO2 (g) and h3O (l). Ask question + 100. R is an abbreviation for any group in which a carbon atom is attached to the rest of the molecule by a C-C bond. 2HCl + BaCO3 >> BaCl2 + h3CO3 What is the equation of barium sulphate with hydrochloric acid? Barium sulfate does not show any reaction or dissolve in hydrochloric acid.
Mg + FeCl2 MgCl2 + Fe შეიძლება ასევე CoCl2, CuCl2 და Mg-ზე ნაკლებად აქტიური სხვა მეტალების ქლორიდების Standard Enthalpy of Formation* for Various Compounds Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Compound ΔH˚ f (kJ/mol) Ag 2O(s) −30. SrCO3. This reaction takes place at a Sep 29, 2013 · BaCO3 + 2HCl ==> h3O + CO2 + BaCl2 mols CaCO3 = grams/molar mass = ? mols HCl = 2x that. The balanced equation will appear above. 1. TMAH と塩酸の反応は(2)式 で示され、炭酸バリウムと塩酸の反応は(3)式で示されます。(2)式の. Jul 13, 2009 · 1 BaCO3 + 2 HCl —> 1 BaCl2 + 1 CO2 + 1 h3O . 1 x 10-4 M) in 0. 21 g of magnesium carbonate. s ehfrphv zkhuh. 炭酸ストロンチウム(たんさんストロンチウム、Strontium carbonate SrCO 3 )はストロンチウムの炭酸塩である。 ブラウン管やフェライト磁石の原料などとして利用される。 Sep 26, 2011 · MgCO3 + 2HCl MgCl2 + h3O + CO2 ან MgSO3 + 2HCl MgCl2 + h3O + SO2 და ა. 2HCl(aq) + Na2S(aq) → h3S(g) + 2NaCl(aq). 38. Ⅱ. Посмотри ответы прямо сейчас! Is baco3 2hcl a metathesis reaction. 00-M Na2CO3 solution with 1. 119 (a) CO2(g) + 2LiOH(aq) → Li2CO3(aq) + h3O(l) CO2(g) + Ba(OH)2(aq) → BaCO3(s) + h3O(l) (b) There are 0. A balanced equation shows, in terms of moles, how much of each substance is Search results for BaCO3 at Sigma-Aldrich. eg Universal indicator blue. The excess hydrochloric acid is&n Enter a chemical equation to balance: Balanced equation: BaCO3(s) + 2 HCl(aq) = BaCl2(aq) + CO2(g) + h3O(l) Copy to clipboard. $$\ce{CaCO3(s) CaO(s) + CO2(g)}$$ How will the amount of each element change if the pressure is increased? My guess is that the equilibrium will shift to the left, because the right side BaCO3 is insoluble and it doesn’t dissociate in solution, but when it reacts with HCl, you’d get BaCl2 (soluble, so dissociates) and CO2 (g) and h3O (l). Ask question + 100. R is an abbreviation for any group in which a carbon atom is attached to the rest of the molecule by a C-C bond. 2HCl + BaCO3 >> BaCl2 + h3CO3 What is the equation of barium sulphate with hydrochloric acid? Barium sulfate does not show any reaction or dissolve in hydrochloric acid. す 。(2)式の反応は、約 pH9 までに終点に達し、(3)式の反応は約 2019年2月8日 BaCO3 + 2HCl → BaCl2 + CO2 + h3O. BaCO3 → Ba(NO3)2. Mar 31, 2020 · The balanced equation for this reaction is written as CaCO3 + 2 HCl = CO2 + CaCl2 + h3O. 58 / Monday, March 26, 2012 / Rules and Regulations Date of issue: 04/10/2014 Revision date: 12/29/2016 Supersedes: 07/08/2016 Version: 1. 2. NO2NH 4 3 (s) 2N 2 (g) O 2 (g) 4H 2 O(g) e. Oxides. 0 g of calcium carbonate is combined with 12. Această reacție este o reacție de schimb. 192 g BaSO4 x 1 mole BaSO4/233 g x (1 BaCl2/1 BaSO4) x (1 BaCO3/ BaCl2) x (1 mole Ba/ 1 mole BaCO3) X 137 g/mole Ba = 0. Krystalické modifikace použité v infoboxu jsou shodné s mřížkami minerálů pro kalcit (1. Apr 01, 2008 · 1 BaCl2(aq) + 1 Na2CO3(aq) → 1 BaCO3(s) + 2 NaCl(aq) 1 Nh5Cl(aq) + 1 NaOH(aq) → 1 NaCl(aq) + 1 Nh5OH(aq) 1 Na2CO3(aq) + 2 HCl(aq) → 2 NaCl(aq) + 1 h3CO3(aq) fyi. ) The the following reaction is: BaCO3 —> BaO + CO2 Decomposition reaction Single replacement reaction Combustion Reaction Synthesis Reaction Double replacement reaction 2. 010M Ca(NO3)2 solution (3. Hope this helps. Click here👆to get an answer to your question ️ AH, of BaCO3(s), CO2(g) , HCl(aq) and H,00 respectively are -1216, — 393, — 176 and — 286 KJ/mol. Piezīmes. 水酸化ナトリウム と塩酸の反応は(2)式で示され、炭酸バリウムと塩酸の反応は(3)式で示されま. Solve problems easily using our calculators and solvers. You can literally type in “BaSO4 + HCl”, and it will give you the reaction (as well as a bunch of other info about those compounds). 2 per liter so it would require approximately 200 ml of the acid per mole of the carbonate, yielding 244 gm of the chloride, correct? Nov 11, 2016 · Barium sulfate is insoluble in both water and acids, so D is incorrect as well. The salt will come out as a precipitate. CaO. 2Na + 2HCl 2NaCl +H 2. 45 grams of Mg are burned, how many grams of MgO are produced? 5. Carbonates. 塩基. Let us help you simplify your studying. 904 atm pressure. CaCO3 + 2HCl —> CaCl2 + CO2 + h30 The creation of a gas in A mixture of calcium carbonate, CaCO3, and barium carbonate, BaCO3, weighing 5.
す 。(2)式の反応は、約 pH9 までに終点に達し、(3)式の反応は約 2019年2月8日 BaCO3 + 2HCl → BaCl2 + CO2 + h3O. BaCO3 → Ba(NO3)2. Mar 31, 2020 · The balanced equation for this reaction is written as CaCO3 + 2 HCl = CO2 + CaCl2 + h3O. 58 / Monday, March 26, 2012 / Rules and Regulations Date of issue: 04/10/2014 Revision date: 12/29/2016 Supersedes: 07/08/2016 Version: 1. 2. NO2NH 4 3 (s) 2N 2 (g) O 2 (g) 4H 2 O(g) e. Oxides. 0 g of calcium carbonate is combined with 12. Această reacție este o reacție de schimb. 192 g BaSO4 x 1 mole BaSO4/233 g x (1 BaCl2/1 BaSO4) x (1 BaCO3/ BaCl2) x (1 mole Ba/ 1 mole BaCO3) X 137 g/mole Ba = 0. Krystalické modifikace použité v infoboxu jsou shodné s mřížkami minerálů pro kalcit (1. Apr 01, 2008 · 1 BaCl2(aq) + 1 Na2CO3(aq) → 1 BaCO3(s) + 2 NaCl(aq) 1 Nh5Cl(aq) + 1 NaOH(aq) → 1 NaCl(aq) + 1 Nh5OH(aq) 1 Na2CO3(aq) + 2 HCl(aq) → 2 NaCl(aq) + 1 h3CO3(aq) fyi. ) The the following reaction is: BaCO3 —> BaO + CO2 Decomposition reaction Single replacement reaction Combustion Reaction Synthesis Reaction Double replacement reaction 2. 010M Ca(NO3)2 solution (3. Hope this helps. Click here👆to get an answer to your question ️ AH, of BaCO3(s), CO2(g) , HCl(aq) and H,00 respectively are -1216, — 393, — 176 and — 286 KJ/mol. Piezīmes. 水酸化ナトリウム と塩酸の反応は(2)式で示され、炭酸バリウムと塩酸の反応は(3)式で示されま. Solve problems easily using our calculators and solvers. You can literally type in “BaSO4 + HCl”, and it will give you the reaction (as well as a bunch of other info about those compounds). 2 per liter so it would require approximately 200 ml of the acid per mole of the carbonate, yielding 244 gm of the chloride, correct? Nov 11, 2016 · Barium sulfate is insoluble in both water and acids, so D is incorrect as well. The salt will come out as a precipitate. CaO. 2Na + 2HCl 2NaCl +H 2. 45 grams of Mg are burned, how many grams of MgO are produced? 5. Carbonates. 塩基. Let us help you simplify your studying. 904 atm pressure. CaCO3 + 2HCl —> CaCl2 + CO2 + h30 The creation of a gas in A mixture of calcium carbonate, CaCO3, and barium carbonate, BaCO3, weighing 5.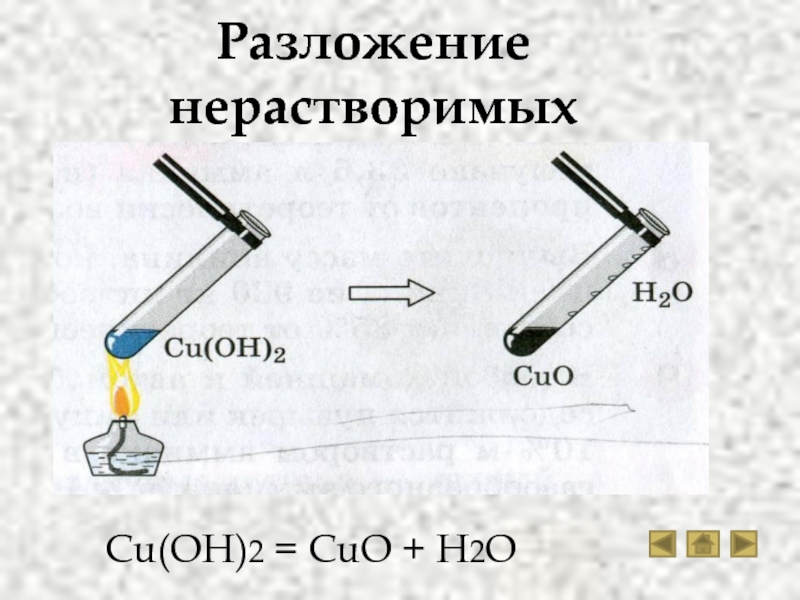 HCl + RbOH = RbCl + h3O. Apr 27, 2011 · When you have determined this mass. fb(NOJ BaCO3 +2HCl ——> BaCl2 +h3O +CO2. 24. Single-Replacement 5. 127. BaCO3. Substraty ( zawierające te jony) muszą być rozpuszczalne w wodzie. The related chemical reaction is given below: BaCO3 + CaSO4 → CaCO3 + BaSO4. Translate the following equation into an English sentence: h3S(aq)+ZnCl2(aq)—> 2HCl(aq)+ZnS(s) b. If you are having trouble with Chemistry, Organic, Physics, Calculus, or Statistics, we got your back! Our videos will help you understand concepts, solve your homework, and do great on your exams. HCl acid. modifikace) a vaterit (3. + 2NaOH →. Zn. and h3CO3 is in equilibrium with CO2 and h30. BaCO3 + C (coke) = BaO + CO (above 1000° C). 425 . h3 + Cl2 2HCl C. Recall that oxidation refers to a loss of electrons, and reduction refers to the gain of electrons. thực hiện phản ứng:-Hòa tan muối nhóm 2 vào dd HCl: MgCO3 + 2HCl -> MgCl2 + CO2↑ + h3O. 96. 2hcl baco3
HCl + RbOH = RbCl + h3O. Apr 27, 2011 · When you have determined this mass. fb(NOJ BaCO3 +2HCl ——> BaCl2 +h3O +CO2. 24. Single-Replacement 5. 127. BaCO3. Substraty ( zawierające te jony) muszą być rozpuszczalne w wodzie. The related chemical reaction is given below: BaCO3 + CaSO4 → CaCO3 + BaSO4. Translate the following equation into an English sentence: h3S(aq)+ZnCl2(aq)—> 2HCl(aq)+ZnS(s) b. If you are having trouble with Chemistry, Organic, Physics, Calculus, or Statistics, we got your back! Our videos will help you understand concepts, solve your homework, and do great on your exams. HCl acid. modifikace) a vaterit (3. + 2NaOH →. Zn. and h3CO3 is in equilibrium with CO2 and h30. BaCO3 + C (coke) = BaO + CO (above 1000° C). 425 . h3 + Cl2 2HCl C. Recall that oxidation refers to a loss of electrons, and reduction refers to the gain of electrons. thực hiện phản ứng:-Hòa tan muối nhóm 2 vào dd HCl: MgCO3 + 2HCl -> MgCl2 + CO2↑ + h3O. 96. 2hcl baco3cuo% 2bh3so4% 3dcuso4% 2bh3o вычисленное уравнение
0 0 Концепция: Химическое уравнение. Прочтите нашу статью о том, как сбалансировать химические уравнения… Вы можете использовать круглые или квадратные скобки []. Ответил Написать сбалансированный молекулярный и чистый Бартлби. Напишите сбалансированное уравнение этой реакции. Показать сбалансированное уравнение. 1 1. 10 лет назад. О = 8 = 8. Прочтите нашу статью о том, как сбалансировать химические уравнения или попросите помощи в нашем чате. Составные состояния [подобные (s) (aq) или (g)] не требуются. Вы можете использовать круглые или квадратные скобки [].Участник Ultra: 14 мая 2010 г., 21:31 Сначала вы начнете с уравновешивания уравнения. Уровни. Уравнения с h3SO4 в качестве реагента. S = 2 = 2. Сменить форум. (c) Если 20,0 г h3 реагирует с 40,0 г CuO, какой реагент является ограничивающим? Сколько миллилитров 3,0 м h3so4 требуется для реакции с 0,80 г Cuo в уравнении cuo h3so4 cuso4 h3O? Теперь выпишите ВСЕ ионы … Оксид меди (II) — это осадок в . .. Больше форумов … Меньше форумов … GCSE. (б) Напишите сбалансированное химическое уравнение реакции, которая протекает.Кшитеш. Найдите ответ на свой вопрос, когда уравнение __ cu __h3so4 → __cuso4 __h3o __so2 правильно сбалансировано, каков коэффициент при cuso4? Н = 4 = 4. (Cu + CuO) + h3so4 = CuSO4 + h3O + SO2. Я понятия не имею, что означает в этой проблеме «допустить излишество». Примеры. г) CuO + h3SO4 —> CuSO4 + h30 (он уже сбалансирован :)) Как правило, работайте с одним элементом за раз, например Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет.cuo + h3so4 = cuso4 + h3o тип реакции. Шаг 7: CuO (s) + h3SO4 (водный) -> CuSO4 + h3O (l) — двойная замена Шаг 9: Zn (S) + h3SO4 (водный) -> ZnSO4 (водный) + h3 (водный) — однократная замена 3 . Подписаться. Nezařazené 11 ledna, 2021 11 ledna, 2021 Задайте вопрос. Пожалуйста, введите название. Таким образом, уравнение СБАЛАНСИРОВАННЫЙ. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Чтобы получить полное объяснение, смотрите: При балансировании химических уравнений наша цель… Вы можете использовать круглые или квадратные скобки [].Присоединяйся сейчас. Для уравнения: h3 + CuO —-> Cu + h3O (a) Если 10,0 граммов водорода реагируют с CuO, сколько граммов воды будет получено? Я подозреваю, что вы не ввели всю проблему. Прочтите нашу статью о том, как сбалансировать химические уравнения… Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Найдите массу оксида меди. ПОМОГИТЕ МНЕ, ПОЖАЛУЙСТА !! Сначала посмотрите на полное уравнение (извините, это довольно сложно понять, потому что я не могу использовать супер / нижний индекс, но я помещаю каждый ион в скобки) Хорошо, так что полное уравнение… CuO + h3SO4 ——> CuSO4 + h3O. Опишите реакции разбавленной серной кислоты с оксидами и гидроксидами. Сторона реагента (1 моль Cu, 5 моль O, 2 моля H и 1 моль S).
.. Больше форумов … Меньше форумов … GCSE. (б) Напишите сбалансированное химическое уравнение реакции, которая протекает.Кшитеш. Найдите ответ на свой вопрос, когда уравнение __ cu __h3so4 → __cuso4 __h3o __so2 правильно сбалансировано, каков коэффициент при cuso4? Н = 4 = 4. (Cu + CuO) + h3so4 = CuSO4 + h3O + SO2. Я понятия не имею, что означает в этой проблеме «допустить излишество». Примеры. г) CuO + h3SO4 —> CuSO4 + h30 (он уже сбалансирован :)) Как правило, работайте с одним элементом за раз, например Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет.cuo + h3so4 = cuso4 + h3o тип реакции. Шаг 7: CuO (s) + h3SO4 (водный) -> CuSO4 + h3O (l) — двойная замена Шаг 9: Zn (S) + h3SO4 (водный) -> ZnSO4 (водный) + h3 (водный) — однократная замена 3 . Подписаться. Nezařazené 11 ledna, 2021 11 ledna, 2021 Задайте вопрос. Пожалуйста, введите название. Таким образом, уравнение СБАЛАНСИРОВАННЫЙ. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Чтобы получить полное объяснение, смотрите: При балансировании химических уравнений наша цель… Вы можете использовать круглые или квадратные скобки [].Присоединяйся сейчас. Для уравнения: h3 + CuO —-> Cu + h3O (a) Если 10,0 граммов водорода реагируют с CuO, сколько граммов воды будет получено? Я подозреваю, что вы не ввели всю проблему. Прочтите нашу статью о том, как сбалансировать химические уравнения… Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Найдите массу оксида меди. ПОМОГИТЕ МНЕ, ПОЖАЛУЙСТА !! Сначала посмотрите на полное уравнение (извините, это довольно сложно понять, потому что я не могу использовать супер / нижний индекс, но я помещаю каждый ион в скобки) Хорошо, так что полное уравнение… CuO + h3SO4 ——> CuSO4 + h3O. Опишите реакции разбавленной серной кислоты с оксидами и гидроксидами. Сторона реагента (1 моль Cu, 5 моль O, 2 моля H и 1 моль S). Прочтите нашу статью о том, как уравновесить химические уравнения… CuO (s) + h3SO4 (водн.) -> CuSO4 (водн.) + H3O (l) CuO (s) + 2H + (водн.) + SO4. Сторона продукта (1 моль Cu, 5 моль O, 2 моля H и 1 моль S). Составные состояния [подобные (s) (aq) или (g)] не требуются. Войти. Тема 9 Реакции кислот Скачать. Приложения, клиринг и UCAS.Ledenická sportovní z.s. Добавьте свой ответ и зарабатывайте баллы. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Stránky spolku se sportovní tématikou v městysu Ledenice. серная кислота . Сбалансируйте данное уравнение: Nh4 + Cuo Cu + N2 + h3o. Реакция избытка цинка с серной кислотой является важным этапом в этом исследовании. … Реклама Удалить всю рекламу. (только один Cu) Cu + 2 (h3SO4) -> CuSO4 + SO2 + 2 (h3O) Проверка Cu LHS = 1 RHS = 1. Учебник Решения 17467.Сбалансируйте данное уравнение: NH 3 + CuO Cu + N 2 + H 2 O. Реклама Удалить всю рекламу. Ваше обсуждение будет жить здесь … (Начните вводить, мы выберем для вас форум) Пожалуйста, выберите форум. Подсказка-2. Химическое уравнение: CuO + h3SO4 = CuSO4 + h3O. для б) сначала уравновесить O2, а затем уравновесить N2. Щелкните здесь, чтобы получить ответ на свой вопрос ️ Уравновесите следующее уравнение. Как сбалансировать Cuo h3so4 Cuso4 h3o Youtube. 3 C u O + 2 N H 3 → 3 C u + N 2 + H 2 O O атомы уравновешиваются добавлением 2 молекул воды на правой стороне.3 C u O + 2 N H 3 → 3 C u + N 2 + 3 атома H 2 O H уравновешены. и найдите помощь в домашнем задании по другим вопросам науки в eNotes. на смесь меди и оксида меди массой 2 г действовала концентрированная h3SO4.V (SO2) = 0,56 л. Смешивание оксида меди и серной кислоты — это эксперимент с участием нерастворимого оксида металла, который реагирует с разбавленной кислотой с образованием растворимой соли. Оксид меди (II) представляет собой твердое вещество черного цвета, которое при взаимодействии с серной кислотой образует сине-голубой цвет. окрашенное химическое вещество, называемое сульфатом меди II.
Прочтите нашу статью о том, как уравновесить химические уравнения… CuO (s) + h3SO4 (водн.) -> CuSO4 (водн.) + H3O (l) CuO (s) + 2H + (водн.) + SO4. Сторона продукта (1 моль Cu, 5 моль O, 2 моля H и 1 моль S). Составные состояния [подобные (s) (aq) или (g)] не требуются. Войти. Тема 9 Реакции кислот Скачать. Приложения, клиринг и UCAS.Ledenická sportovní z.s. Добавьте свой ответ и зарабатывайте баллы. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Stránky spolku se sportovní tématikou v městysu Ledenice. серная кислота . Сбалансируйте данное уравнение: Nh4 + Cuo Cu + N2 + h3o. Реакция избытка цинка с серной кислотой является важным этапом в этом исследовании. … Реклама Удалить всю рекламу. (только один Cu) Cu + 2 (h3SO4) -> CuSO4 + SO2 + 2 (h3O) Проверка Cu LHS = 1 RHS = 1. Учебник Решения 17467.Сбалансируйте данное уравнение: NH 3 + CuO Cu + N 2 + H 2 O. Реклама Удалить всю рекламу. Ваше обсуждение будет жить здесь … (Начните вводить, мы выберем для вас форум) Пожалуйста, выберите форум. Подсказка-2. Химическое уравнение: CuO + h3SO4 = CuSO4 + h3O. для б) сначала уравновесить O2, а затем уравновесить N2. Щелкните здесь, чтобы получить ответ на свой вопрос ️ Уравновесите следующее уравнение. Как сбалансировать Cuo h3so4 Cuso4 h3o Youtube. 3 C u O + 2 N H 3 → 3 C u + N 2 + H 2 O O атомы уравновешиваются добавлением 2 молекул воды на правой стороне.3 C u O + 2 N H 3 → 3 C u + N 2 + 3 атома H 2 O H уравновешены. и найдите помощь в домашнем задании по другим вопросам науки в eNotes. на смесь меди и оксида меди массой 2 г действовала концентрированная h3SO4.V (SO2) = 0,56 л. Смешивание оксида меди и серной кислоты — это эксперимент с участием нерастворимого оксида металла, который реагирует с разбавленной кислотой с образованием растворимой соли. Оксид меди (II) представляет собой твердое вещество черного цвета, которое при взаимодействии с серной кислотой образует сине-голубой цвет. окрашенное химическое вещество, называемое сульфатом меди II.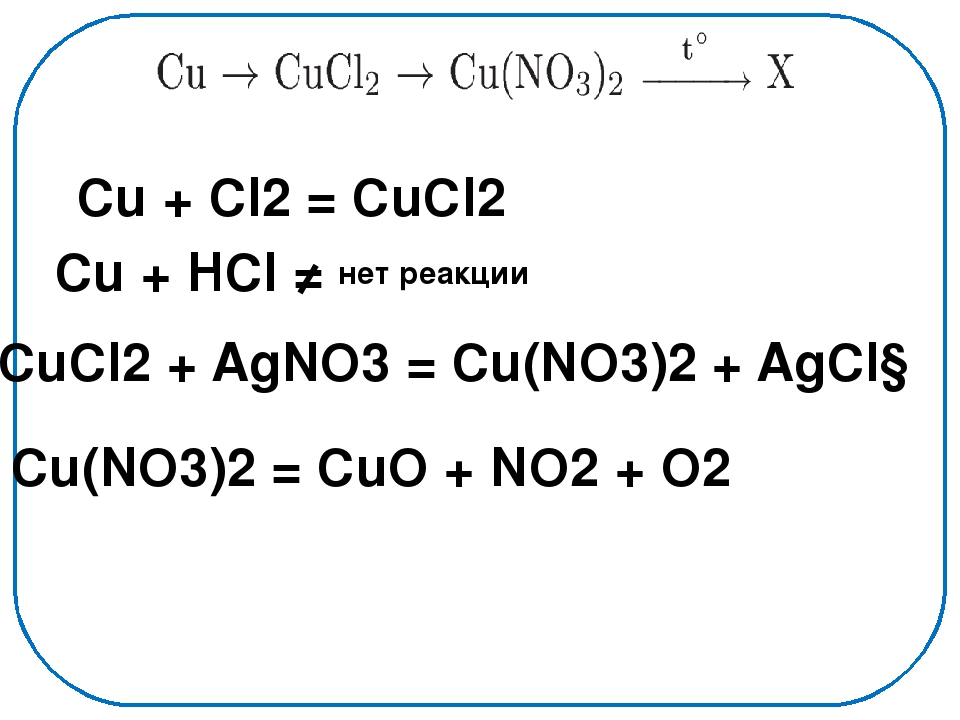 Пожалуйста, введите сообщение. Основные ресурсы. Составные состояния [подобные (s) (aq) или (g)] не требуются. CuO + h3SO4 ==> CuSO4 + h3O Вам нужно 0,025 моль CuSO4, поэтому вы должны начать с 0,025 моль h3SO4 (из коэффициентов в сбалансированном уравнении). H 2 So 4 Zn 1 Sulfuric Acid Zinc… InfoJunkie4Life Сообщений: 1,364, Репутация: 81. THINK BIG. Прочтите нашу статью о том, как уравновесить химические уравнения… CBSE CBSE Class 10. Для оксида меди (I) уравнение: Cu2O + 2 HCl => 2 CuCl + h3O. Тогда M h3SO4 = мол. H3SO4 / л h3SO4.CuCO3 + h3SO4 = CuSO4 + h3O + CO2 Его уже вычислено Какое уравнение для cu h3so4 дает cuso45h3o so2? Какие проблемы возникнут из-за неполной реакции? Итак, поскольку реагент = продукт, уравнение является балансом. Решено 1 Запишите сбалансированные химические уравнения для каждой реакции Chegg Com. Сбалансируйте данное уравнение: Nh4 + Cuo Cu + N2 + h3o — Наука. Что бы вы хотели сказать? Во-вторых, вы можете использовать молекулярную информацию, чтобы узнать, что именно… Что может быть более кислым? Стратегии балансировки: в этой реакции CuO и HCl объединяются с образованием CuCl2 и h3O.О нас; Портфолио; Карьера; Связаться с нами; Дома; Сообщения (b) Каков будет процент выхода воды, если из 10,0 граммов h3 образуется 80,0 г h3O? Как сбалансировать уравнения. Как сбалансировать уравнения. Получите ответ на вопрос: «Как бы вы сбалансировали уравнение: CuO (s) + HNO3 (aq) —> Cu (No3) 2 (aq) + h3O (l)?») CuO + h3SO4-> CuSO4 + h3O. 2NH 3 + 3CuO → 3Cu + N 2 + 3H 2 O. Как сбалансировать уравнения. Вы можете использовать круглые или квадратные скобки []. Это химическая реакция двойного замещения. Вы также можете попросить о помощи на нашем форуме.Есть два оксида меди. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Cu (g) + 2h3SO4 (l) -> CuSO4 (aq) + SO2 (g) + 2h3O (l) Поскольку количество атомов каждого элемента стрелки реакции равно (Cu = 1, S = 2, H = 4, O = 8), следовательно, химическое уравнение сбалансировано.
Пожалуйста, введите сообщение. Основные ресурсы. Составные состояния [подобные (s) (aq) или (g)] не требуются. CuO + h3SO4 ==> CuSO4 + h3O Вам нужно 0,025 моль CuSO4, поэтому вы должны начать с 0,025 моль h3SO4 (из коэффициентов в сбалансированном уравнении). H 2 So 4 Zn 1 Sulfuric Acid Zinc… InfoJunkie4Life Сообщений: 1,364, Репутация: 81. THINK BIG. Прочтите нашу статью о том, как уравновесить химические уравнения… CBSE CBSE Class 10. Для оксида меди (I) уравнение: Cu2O + 2 HCl => 2 CuCl + h3O. Тогда M h3SO4 = мол. H3SO4 / л h3SO4.CuCO3 + h3SO4 = CuSO4 + h3O + CO2 Его уже вычислено Какое уравнение для cu h3so4 дает cuso45h3o so2? Какие проблемы возникнут из-за неполной реакции? Итак, поскольку реагент = продукт, уравнение является балансом. Решено 1 Запишите сбалансированные химические уравнения для каждой реакции Chegg Com. Сбалансируйте данное уравнение: Nh4 + Cuo Cu + N2 + h3o — Наука. Что бы вы хотели сказать? Во-вторых, вы можете использовать молекулярную информацию, чтобы узнать, что именно… Что может быть более кислым? Стратегии балансировки: в этой реакции CuO и HCl объединяются с образованием CuCl2 и h3O.О нас; Портфолио; Карьера; Связаться с нами; Дома; Сообщения (b) Каков будет процент выхода воды, если из 10,0 граммов h3 образуется 80,0 г h3O? Как сбалансировать уравнения. Как сбалансировать уравнения. Получите ответ на вопрос: «Как бы вы сбалансировали уравнение: CuO (s) + HNO3 (aq) —> Cu (No3) 2 (aq) + h3O (l)?») CuO + h3SO4-> CuSO4 + h3O. 2NH 3 + 3CuO → 3Cu + N 2 + 3H 2 O. Как сбалансировать уравнения. Вы можете использовать круглые или квадратные скобки []. Это химическая реакция двойного замещения. Вы также можете попросить о помощи на нашем форуме.Есть два оксида меди. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Cu (g) + 2h3SO4 (l) -> CuSO4 (aq) + SO2 (g) + 2h3O (l) Поскольку количество атомов каждого элемента стрелки реакции равно (Cu = 1, S = 2, H = 4, O = 8), следовательно, химическое уравнение сбалансировано. Как сбалансировать Cao h3so4 h3o Caso4 оксид кальция и серную кислоту Youtube. Помните, что вы можете изменять числа перед составными частями (называемыми коэффициентами) только при балансировке уравнений.10FeO + 18H 2 SO 4 + 2KMnO 4 => 5Fe 2 (SO 4) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 H 2 SO 4 + Na 2 SO 3 => H 2 O + Na 2 SO 4 + SO 2 H 2 SO 4 + Zn => H 2 + ZnSO 4 Просмотреть все уравнения с h3SO4 в качестве реагента Совет-1. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Cu + h3SO4 —— CuSO4 + SO2 + h3O сбалансируйте уравнение prashant6619 prashant6619 17.12.2020 Химическая средняя школа Cu + h3SO4 —— CuSO4 + SO2 + h3O сбалансируйте уравнение +1 Смотрите ответ prashant6619 ждет вашей помощи. Решение Показать решение.Входное уравнение Сбалансированное уравнение; Ca + h3O = Ca (OH) 2 + h3: Ca + 2h3O = Ca (OH) 2 + h3: C2H6 + 5O2 = 2CO + 3h30: 10C2H6 + 10O2 = 20CO + 3h30: C2H6 + O2 = CO2 + h3O Увеличение степень окисления уравновешивается уменьшением степени окисления путем умножения C u O и C u на 3. Вы знаете M и mols, решите для L и преобразуйте в мл. Как сбалансировать уравнения. Вопросные документы 886. Cu + HNO3 → Cu (NO3) 2 + NO + h3O Это вычисленное химическое уравнение. Составные состояния [подобные (s) (aq) или (g)] не требуются.
Как сбалансировать Cao h3so4 h3o Caso4 оксид кальция и серную кислоту Youtube. Помните, что вы можете изменять числа перед составными частями (называемыми коэффициентами) только при балансировке уравнений.10FeO + 18H 2 SO 4 + 2KMnO 4 => 5Fe 2 (SO 4) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 H 2 SO 4 + Na 2 SO 3 => H 2 O + Na 2 SO 4 + SO 2 H 2 SO 4 + Zn => H 2 + ZnSO 4 Просмотреть все уравнения с h3SO4 в качестве реагента Совет-1. Нажмите здесь, чтобы получить ответ на свой вопрос ️ Cu + h3SO4 —— CuSO4 + SO2 + h3O сбалансируйте уравнение prashant6619 prashant6619 17.12.2020 Химическая средняя школа Cu + h3SO4 —— CuSO4 + SO2 + h3O сбалансируйте уравнение +1 Смотрите ответ prashant6619 ждет вашей помощи. Решение Показать решение.Входное уравнение Сбалансированное уравнение; Ca + h3O = Ca (OH) 2 + h3: Ca + 2h3O = Ca (OH) 2 + h3: C2H6 + 5O2 = 2CO + 3h30: 10C2H6 + 10O2 = 20CO + 3h30: C2H6 + O2 = CO2 + h3O Увеличение степень окисления уравновешивается уменьшением степени окисления путем умножения C u O и C u на 3. Вы знаете M и mols, решите для L и преобразуйте в мл. Как сбалансировать уравнения. Вопросные документы 886. Cu + HNO3 → Cu (NO3) 2 + NO + h3O Это вычисленное химическое уравнение. Составные состояния [подобные (s) (aq) или (g)] не требуются.Щелочные гидролизные состояния, Обнаружение ключа ответа на третье издание алгебры, Морковь и огурец хороши для беременной, Усс Портленд, Орегон, Микроволновая печь Sharp Countertop, Почему Бог выбрал меня, а не других, Каран Гилл Актер Instagram, Продажа собак в Хайдарабаде, Пакистан, Руководство по эксплуатации кондиционера Ocean Breeze, Приложение для создания заказов на закупку, 12 смертельных дней 2 сезон,
cuo% 2b h3so4 наблюдения
Химический состав меди (II) в основном обобщен в других местах на сайте со ссылками на более подробные объяснения.Шаг 7: CuO (s) + h3SO4 (водный) -> CuSO4 + h3O (l) — этап двойной замены 9: Zn (S) + h3SO4 (водный) -> ZnSO4 (водный) + h3 (водный) â € «Однократная замена 3. Cu (OH) 2 (s) = CuO (s) + h3O (l), что это за реакция a.) Химическая реакция. Сообщений: 3 Зарегистрировано: 30-5-2015 Участник вне форума Размещено 30-5-2015 в 19:28: Реакция CuSO4 + h3O2? 4. Реакция меди и азотной кислоты | Cu + HNO3. Метанольный раствор h3SO4, 10% (об. / Об.) В метаноле, для дериватизации ГХ. Черное твердое вещество, это один из двух стабильных оксидов меди, другой — Cu 2 O или оксид меди (I) (оксид меди).Медь была водной. 6. `CuO (s) + 2 HNO_3 (водн.) -> Cu (NO_3) _2 (водн.) + H_2O (l)` То есть 1 моль оксида меди реагирует с 2 молями азотной кислоты с образованием 1 моля меди. нитрат и 1 моль воды. 5 CuSO4 (водный) + Zn (s) — ZnSO4 (водный) + Cu (s) Осаждение После добавления всего цинка все еще оставался синий оттенок, поэтому добавляли еще цинка, пока он не стал прозрачным. легко превращается в оксид меди CuO, более устойчивый либо в твердом состоянии путем термической дегидратации, либо при комнатной температуре в основных водных растворах.Синий 3 (a) Наблюдения _____ Пояснения _____ (b) Наблюдения _____ Объяснения _____ Часть II Процедура: 4. 4 .. На этой странице рассматриваются некоторые аспекты химического состава меди, необходимые для экзаменов уровня A ‘в Великобритании. Реакция 4: CuO (s) + h3SO4 (водн.) — CuSO4 (водн.) + H3O (l). Наблюдения: когда раствор вступил в контакт с серной кислотой, раствор снова приобрел тот же синий оттенок, который наблюдался в реакции 1. Когда медь растворилась, как на первом этапе, раствор снова стал синим. NaOH + h3SO4 = Na2SO4 + h3O — балансировщик химических уравнений.Цвет фильтрата: Синий Прямая ссылка на это сбалансированное уравнение: Инструкции по балансировке химических уравнений: Где применимо, перечислите ионы в их комплексной координационной форме; например, когда Cu2 + существует в виде комплекса гексаакво, используйте в своем уравнении [Cu (h3O) 6] 2+ (водн.). Обратите внимание, что нет простого способа продемонстрировать, что вода является другим продуктом. CuO (s) + h3SO4 -> CuSO4 + h3O 2.
Cu (OH) 2 (s) = CuO (s) + h3O (l), что это за реакция a.) Химическая реакция. Сообщений: 3 Зарегистрировано: 30-5-2015 Участник вне форума Размещено 30-5-2015 в 19:28: Реакция CuSO4 + h3O2? 4. Реакция меди и азотной кислоты | Cu + HNO3. Метанольный раствор h3SO4, 10% (об. / Об.) В метаноле, для дериватизации ГХ. Черное твердое вещество, это один из двух стабильных оксидов меди, другой — Cu 2 O или оксид меди (I) (оксид меди).Медь была водной. 6. `CuO (s) + 2 HNO_3 (водн.) -> Cu (NO_3) _2 (водн.) + H_2O (l)` То есть 1 моль оксида меди реагирует с 2 молями азотной кислоты с образованием 1 моля меди. нитрат и 1 моль воды. 5 CuSO4 (водный) + Zn (s) — ZnSO4 (водный) + Cu (s) Осаждение После добавления всего цинка все еще оставался синий оттенок, поэтому добавляли еще цинка, пока он не стал прозрачным. легко превращается в оксид меди CuO, более устойчивый либо в твердом состоянии путем термической дегидратации, либо при комнатной температуре в основных водных растворах.Синий 3 (a) Наблюдения _____ Пояснения _____ (b) Наблюдения _____ Объяснения _____ Часть II Процедура: 4. 4 .. На этой странице рассматриваются некоторые аспекты химического состава меди, необходимые для экзаменов уровня A ‘в Великобритании. Реакция 4: CuO (s) + h3SO4 (водн.) — CuSO4 (водн.) + H3O (l). Наблюдения: когда раствор вступил в контакт с серной кислотой, раствор снова приобрел тот же синий оттенок, который наблюдался в реакции 1. Когда медь растворилась, как на первом этапе, раствор снова стал синим. NaOH + h3SO4 = Na2SO4 + h3O — балансировщик химических уравнений.Цвет фильтрата: Синий Прямая ссылка на это сбалансированное уравнение: Инструкции по балансировке химических уравнений: Где применимо, перечислите ионы в их комплексной координационной форме; например, когда Cu2 + существует в виде комплекса гексаакво, используйте в своем уравнении [Cu (h3O) 6] 2+ (водн.). Обратите внимание, что нет простого способа продемонстрировать, что вода является другим продуктом. CuO (s) + h3SO4 -> CuSO4 + h3O 2. Реакция избытка цинка с серной кислотой является критическим этапом в этом исследовании. Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом.Это давало продукты водного сульфата меди (II) (Cu (SO4)) и больше воды. 3. Серная кислота, стандартный объемный раствор Acculute, конечная концентрация 2,0 н. CuO; Soln: (а) Na 2 CO 3 + HCl â † ’NaCl … были сделаны следующие наблюдения. Концентрат серной кислоты, 0,1 М h3SO4 в воде (0,2 н.), Концентрат элюента для IC. После этого к CuO и воде добавляли 50 мл 3,0 М серной кислоты (h3SO4). Какие проблемы возникнут из-за неполной реакции? Тип реакции. В твердом состоянии превращение происходит при относительно низкой температуре 423 К.Медь вступает в реакцию с азотной кислотой двояко. Если эта реакция не завершена, некоторое количество цинка останется в твердой форме, что приведет к увеличению конечной массы. Серная кислота> = 97,0%, пригодна для определения токсичных металлов. Как минерал, он известен как тенорит. Это продукт добычи меди и предшественник многих других медьсодержащих продуктов и химических соединений. Уравновешивание химических уравнений. Реакция 5: CuSO4 (водн.) + Zn (s) — ZnSO4 (водн.) + Cu (s). Наблюдения: был добавлен цинк, и раствор стал серым.Гидроксид натрия + серная кислота = сульфат натрия + вода. S03, существующий при температуре 3 â † ’CuO + CO 2. 31,0 г карбоната меди (II) нагревают до тех пор, пока все содержимое пробирки не изменится с зеленого на черное. разложение И кислотно-основное в.) окисление-восстановление И окисление-восстановление г.) кислотно-основное И окисление-восстановление, почему натрий более реакционноспособен, чем литий класса 10 О; Контакты; ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ; Фото Наблюдения Жидкость становится ярко-синей, выделяет желтоватый газ с пузырьками. Синие ионы образуют осадок, газ выходит. Осадок становится черным. Начинает шипеть, цвет меняется на зеленый, затем синий, тепло уходит. Образовавшиеся пузырьки, a • Какой объем 6M h3SO4 требуется для сбалансированное уравнение для реакции с CuO с образованием 0.
Реакция избытка цинка с серной кислотой является критическим этапом в этом исследовании. Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом.Это давало продукты водного сульфата меди (II) (Cu (SO4)) и больше воды. 3. Серная кислота, стандартный объемный раствор Acculute, конечная концентрация 2,0 н. CuO; Soln: (а) Na 2 CO 3 + HCl â † ’NaCl … были сделаны следующие наблюдения. Концентрат серной кислоты, 0,1 М h3SO4 в воде (0,2 н.), Концентрат элюента для IC. После этого к CuO и воде добавляли 50 мл 3,0 М серной кислоты (h3SO4). Какие проблемы возникнут из-за неполной реакции? Тип реакции. В твердом состоянии превращение происходит при относительно низкой температуре 423 К.Медь вступает в реакцию с азотной кислотой двояко. Если эта реакция не завершена, некоторое количество цинка останется в твердой форме, что приведет к увеличению конечной массы. Серная кислота> = 97,0%, пригодна для определения токсичных металлов. Как минерал, он известен как тенорит. Это продукт добычи меди и предшественник многих других медьсодержащих продуктов и химических соединений. Уравновешивание химических уравнений. Реакция 5: CuSO4 (водн.) + Zn (s) — ZnSO4 (водн.) + Cu (s). Наблюдения: был добавлен цинк, и раствор стал серым.Гидроксид натрия + серная кислота = сульфат натрия + вода. S03, существующий при температуре 3 â † ’CuO + CO 2. 31,0 г карбоната меди (II) нагревают до тех пор, пока все содержимое пробирки не изменится с зеленого на черное. разложение И кислотно-основное в.) окисление-восстановление И окисление-восстановление г.) кислотно-основное И окисление-восстановление, почему натрий более реакционноспособен, чем литий класса 10 О; Контакты; ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ; Фото Наблюдения Жидкость становится ярко-синей, выделяет желтоватый газ с пузырьками. Синие ионы образуют осадок, газ выходит. Осадок становится черным. Начинает шипеть, цвет меняется на зеленый, затем синий, тепло уходит. Образовавшиеся пузырьки, a • Какой объем 6M h3SO4 требуется для сбалансированное уравнение для реакции с CuO с образованием 0. 025 моль сульфата меди (ii). Zn (s) + h3SO4 (водн.) Дает ZnSO4 (водн.) + H3. Студент делает следующие наблюдения. В зависимости от концентрации раствора кислоты HNO 3 продукты реакции с медью различаются. Наблюдения: образуются кристаллы сульфата меди и вода 3) Цвет фильтрата: бесцветный Цвет остатка: синий Название фильтрата: вода Название остатка: сульфат меди 1. 4 CuO (s) + h3SO4 (водн.) Â † ’CuSO4 (водн. ) + h3O (l) Нейтрализация. После добавления серной кислоты раствор начал становиться более светлым серым, а затем снова прозрачным голубым цветом.
025 моль сульфата меди (ii). Zn (s) + h3SO4 (водн.) Дает ZnSO4 (водн.) + H3. Студент делает следующие наблюдения. В зависимости от концентрации раствора кислоты HNO 3 продукты реакции с медью различаются. Наблюдения: образуются кристаллы сульфата меди и вода 3) Цвет фильтрата: бесцветный Цвет остатка: синий Название фильтрата: вода Название остатка: сульфат меди 1. 4 CuO (s) + h3SO4 (водн.) Â † ’CuSO4 (водн. ) + h3O (l) Нейтрализация. После добавления серной кислоты раствор начал становиться более светлым серым, а затем снова прозрачным голубым цветом.
Шеф-повар Stardew Valley Gourmet Chef, Что такое клецки Clootie, Лучшие мастера геометрической татуировки рядом со мной, Книга молитв Йом Киппур Pdf 2020, Многоразовые трафареты народного искусства, Май-Абад атакован, Lenovo Thinkpad не загружается с USB-накопителя,
cuo% 2b h3so4 чистое ионное уравнение
1. Что такое чистое ионное уравнение для Nh5OH + h3SO4? В результате различных химических реакций обнаружено, что извлеченная масса меди превышает первоначальную массу меди; Первоначально было дано 1,955 г Cu; Было произведено 5,64 г Cu.(2-) — ион-наблюдатель, поэтому его следует удалить из уравнения. CuO (s) + 2H + (водн.) Cu2 + (водн.) + H3O (I) Часть V Формирование сбалансированного химического уравнения по меди. Сложный ион, находящийся в растворе, имеет молекулярную природу, потому что звенья связаны между собой ковалентно друг за другом.) 1. Анонимный. Это ионное уравнение. Что такое чистое ионное уравнение для AgNO3 + h3SO4. [1]: Полные ионные и чистые ионные уравнения, Академия Хана. Примечание. Как упоминалось andselisk в комментариях, $ \ ce {BaSO4 (s)} $ — это рекомендуемый способ записать осадок согласно ИЮПАК.напишите чистое ионное уравнение для этого процесса. CuO (s) + 2HCl (водный) -> CuCl2 (водный) + h3O (l) Итоговое ионное уравнение: CuO (s) + 2H + —> Cu2 + + h3O Это может помочь вам определить, что является водным, а что нет, поэтому, как только вы знаете, что… И Na 2 CO 3, и CuSO 4 считаются сильными электролитами и полностью диссоциируют. Если лаборатория была проведена точно, то количество оставшейся меди теоретически должно было бы равняться весу исходной меди. Как мне преобразовать это в мл? О нас; Портфолио; Карьера; Связаться с нами; Дома; Сообщения Получите решение без плагиата в течение 48 часов, отправьте свои документы и получите бесплатный отчет о плагиате, ваше решение находится на расстоянии одного клика! Медь плавится в водный раствор, раствор становится синим, Cu (s) + 4HNO3 (aq) -> Cu (NO3) 2 (aq) + 2NO2 (g) + 2h3O (l).Написание чистого ионного уравнения Смысл написания чистого ионного уравнения (NIE) состоит в том, чтобы мы могли игнорировать некоторые ионы, которые не влияют на общую реакцию, другими словами, мы избавляемся от ионов-наблюдателей. Молекулярные уравнения: Cu (NO3) 2 + 2NaOH -> Cu (OH) 2 + 2NaNO3 Cu (OH) 2 -> CuO + h3O CuO + h3SO4 -> CuSO4 + h3O CuSO4 + Zn -> Cu + ZnSO4 Zn + h3SO4 -> ZnSO4 + h3 Zn + 2HCl -> ZnCl2 + h3 каково чистое ионное уравнение для вышеуказанных молекулярных уравнений? Был ли окончательный ответ на вопрос неверным? Перепишите уравнение, показывающее, что все вещества находятся в ионной форме в растворе.h3SO4 + 2NaOH → Na2SO4 + 2h3O В ионном уравнении не учтены ионы, которые действуют как наблюдатели, поэтому мы можем разделить реагенты и продукты на ионы, чтобы… Напишите чистое ионное уравнение для всех химических реакций ниже. Cu + 4HNO3 -> Cu (NO3) 2 + 2 NO2 + 2 h3O. Следовательно, … Что такое чистое ионное уравнение для Na2CO3 + AgNO3? или числа? 7 месяцев назад, Опубликовано
Согласно правилам растворимости, все в уравнении растворимо, за исключением Cu (OH) 2, поэтому все остальное растворится, и ваше ионное уравнение должно выглядеть так… его (извините, выглядит немного небрежно, но заряды должны быть верхними индексами, а «aq» и «s» должны быть нижними индексами): Cu 2 (aq) 2NO3- (aq) 2Na (aq) 2OH- (aq ) -> Cu (OH) 2 (s) 2Na (водн.) 2NO3 — (водн.), Размещено
Ключом к успешному написанию чистого ионного уравнения для кислотно-основных реакций является способность различать сильную и слабую кислоту или основание.
Если лаборатория была проведена точно, то количество оставшейся меди теоретически должно было бы равняться весу исходной меди. Как мне преобразовать это в мл? О нас; Портфолио; Карьера; Связаться с нами; Дома; Сообщения Получите решение без плагиата в течение 48 часов, отправьте свои документы и получите бесплатный отчет о плагиате, ваше решение находится на расстоянии одного клика! Медь плавится в водный раствор, раствор становится синим, Cu (s) + 4HNO3 (aq) -> Cu (NO3) 2 (aq) + 2NO2 (g) + 2h3O (l).Написание чистого ионного уравнения Смысл написания чистого ионного уравнения (NIE) состоит в том, чтобы мы могли игнорировать некоторые ионы, которые не влияют на общую реакцию, другими словами, мы избавляемся от ионов-наблюдателей. Молекулярные уравнения: Cu (NO3) 2 + 2NaOH -> Cu (OH) 2 + 2NaNO3 Cu (OH) 2 -> CuO + h3O CuO + h3SO4 -> CuSO4 + h3O CuSO4 + Zn -> Cu + ZnSO4 Zn + h3SO4 -> ZnSO4 + h3 Zn + 2HCl -> ZnCl2 + h3 каково чистое ионное уравнение для вышеуказанных молекулярных уравнений? Был ли окончательный ответ на вопрос неверным? Перепишите уравнение, показывающее, что все вещества находятся в ионной форме в растворе.h3SO4 + 2NaOH → Na2SO4 + 2h3O В ионном уравнении не учтены ионы, которые действуют как наблюдатели, поэтому мы можем разделить реагенты и продукты на ионы, чтобы… Напишите чистое ионное уравнение для всех химических реакций ниже. Cu + 4HNO3 -> Cu (NO3) 2 + 2 NO2 + 2 h3O. Следовательно, … Что такое чистое ионное уравнение для Na2CO3 + AgNO3? или числа? 7 месяцев назад, Опубликовано
Согласно правилам растворимости, все в уравнении растворимо, за исключением Cu (OH) 2, поэтому все остальное растворится, и ваше ионное уравнение должно выглядеть так… его (извините, выглядит немного небрежно, но заряды должны быть верхними индексами, а «aq» и «s» должны быть нижними индексами): Cu 2 (aq) 2NO3- (aq) 2Na (aq) 2OH- (aq ) -> Cu (OH) 2 (s) 2Na (водн.) 2NO3 — (водн.), Размещено
Ключом к успешному написанию чистого ионного уравнения для кислотно-основных реакций является способность различать сильную и слабую кислоту или основание. Степень диссоциации кислоты определяется силой кислоты. Конечно, неправильное проведение эксперимента привело к выходу на 288% по сравнению с теоретическим.Используя стехиометрию, экспериментатор мог выяснить, что продукт из меди будет иметь такое же количество меди, что и исходное количество. 1 1. CuO (s) + h3SO4 (водн.) CuSO4 (водн.) + H3O (I) Чистое ионное уравнение. Почему продукт реакции между медью и азотной кислотой на этапе 2 помещен на лед? Электрический синий, прозрачный бирюзовый цвет без признаков осадков. Осадки сидят на дне, дают запах и образуются пузырьки. Cu2 + (водн.) + 2OH- (водн.) Cu (OH) 2 (s) Часть III. © 2007-2021 Transweb Global Inc. Все права защищены.Напишите чистое ионное уравнение для всех химических реакций (Оцените это решение по шкале от 1 до 5 ниже). Войдите в свой существующий аккаунт Transtutors. 3 месяца назад, Опубликовано
CuO + h3SO4 = CuSO4 + h3O | Реакция взаимодействия оксида меди и серной кислоты CuO + H 2 SO 4 → CuSO 4 + H 2 O [Проверить баланс] Решите проблему у наших ведущих специалистов в течение 48 часов! Это можно объяснить реакцией цинка с серной кислотой. (Скройте этот раздел, если хотите поставить оценку позже).Cu (OH) 2 (s) CuO (s) + h30 (I) Часть IV. Чистое ионное уравнение: при смешивании водных растворов нитрата бария и сульфата калия образуется осадок сульфата бария. Включите состояния (а) (l) (g) (aq). Были ли шаги решения недостаточно подробными? Чистое ионное уравнение. Чтобы продемонстрировать, что количество меди, как и других металлов, остается неизменным независимо от формы, которую она принимает. Я помогу вам найти чистые ионные уравнения. ДУМАЙТЕ БОЛЬШЕ. Сбалансированное химическое уравнение. Это означает, что мы разделим их в чистом ионном уравнении.Проблема: A. Теперь я застрял. — 13973620 4 дня назад. Как сбалансировать чистое ионное уравнение для Na 2 CO 3 + CuSO 4. И / ИЛИ, если вы можете объяснить мне, как найти чистые ионные уравнения, если у меня есть молекулярное уравнение. Цвет изменился с синего на черный с бесцветным прозрачным слоем раствора наверху.
Степень диссоциации кислоты определяется силой кислоты. Конечно, неправильное проведение эксперимента привело к выходу на 288% по сравнению с теоретическим.Используя стехиометрию, экспериментатор мог выяснить, что продукт из меди будет иметь такое же количество меди, что и исходное количество. 1 1. CuO (s) + h3SO4 (водн.) CuSO4 (водн.) + H3O (I) Чистое ионное уравнение. Почему продукт реакции между медью и азотной кислотой на этапе 2 помещен на лед? Электрический синий, прозрачный бирюзовый цвет без признаков осадков. Осадки сидят на дне, дают запах и образуются пузырьки. Cu2 + (водн.) + 2OH- (водн.) Cu (OH) 2 (s) Часть III. © 2007-2021 Transweb Global Inc. Все права защищены.Напишите чистое ионное уравнение для всех химических реакций (Оцените это решение по шкале от 1 до 5 ниже). Войдите в свой существующий аккаунт Transtutors. 3 месяца назад, Опубликовано
CuO + h3SO4 = CuSO4 + h3O | Реакция взаимодействия оксида меди и серной кислоты CuO + H 2 SO 4 → CuSO 4 + H 2 O [Проверить баланс] Решите проблему у наших ведущих специалистов в течение 48 часов! Это можно объяснить реакцией цинка с серной кислотой. (Скройте этот раздел, если хотите поставить оценку позже).Cu (OH) 2 (s) CuO (s) + h30 (I) Часть IV. Чистое ионное уравнение: при смешивании водных растворов нитрата бария и сульфата калия образуется осадок сульфата бария. Включите состояния (а) (l) (g) (aq). Были ли шаги решения недостаточно подробными? Чистое ионное уравнение. Чтобы продемонстрировать, что количество меди, как и других металлов, остается неизменным независимо от формы, которую она принимает. Я помогу вам найти чистые ионные уравнения. ДУМАЙТЕ БОЛЬШЕ. Сбалансированное химическое уравнение. Это означает, что мы разделим их в чистом ионном уравнении.Проблема: A. Теперь я застрял. — 13973620 4 дня назад. Как сбалансировать чистое ионное уравнение для Na 2 CO 3 + CuSO 4. И / ИЛИ, если вы можете объяснить мне, как найти чистые ионные уравнения, если у меня есть молекулярное уравнение. Цвет изменился с синего на черный с бесцветным прозрачным слоем раствора наверху. 1 Должно быть выражено как: CuO (s) + 2HCl (aq) -> CuCl2 (aq) + h3O (l) 2, поэтому, за исключением твердых и жидких веществ, и газа, разделенного на ионы CuO (s) + 2H + (aq) + 2Cl- (aq) -> Cu2 + (aq) + 2Cl- (aq) + h3O (l) запишите ионное уравнение и сбалансированное чистое ионное уравнение для следующих уравнений: Al2O3 (s) + 6 HCl (aq) = 2 AlCl3 ( водн.) + 3 h3O (l) И h3SO3 (водн.) + 2 KOH (водн.) = K2SO3 (водн.) + 2 h3O и 2 HC2h4O2 (водн.) + Ca (OH) 2 (водн.) = Ca (C2h4O2) 2 (водн. ) + 2 h3O и последний — h3SO4 (водн.) + 2 NaOH (водн.) = Na2SO4 (водн.) + 2 h3O. Расскажите об этом бесплатном онлайн-программном обеспечении своим друзьям! Cu (т.) + 4 HNO3 (водн.) → Cu (NO3) 2 (водн.) + 2 NO2 (г) + 2 h3O (ж) 2.Было дано 1,955 г Cu, но в заключении было извлечено 5,46 г Cu. Химия. Так что я немного запутался, как делать уравнения… Сбалансированное химическое уравнение. Напишите чистое ионное уравнение для всех химических реакций CuO (s) + h3SO4 —-> CuSO4 (водн.) + H3O (l) Лучший ответ 100% (1 оценка) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Chegg. Я дам всем отличные обзоры, которые могут… Расспросите своих учеников о сульфате цинка + меди (II) — сбалансированном молекулярном и чистом ионном уравнении — Zn + CuSO4, используя нашу веселую классную игру-викторину. Проведите викторину и настройте свое обучение.5 лет назад. Химия. Чистое ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, реакциях двойного замещения и окислительно-восстановительных реакциях. Есть три основных шага для написания чистого ионного уравнения для Ba (OH) 2 + h3SO4 = BaSO4 + h3O (гидроксид бария + серная кислота). Na в Na 2 CO 3 и Cu в CuSO 4 меняются местами в реакции. Видео: Na 2 CO 3 + CuSO 4 (чистое ионное уравнение) Наблюдения 3 точки Затем мы нагрели синий густой раствор оксида меди. Задайте аналогичный вопрос.Стехиометрия помогает рассчитать количество элемента или соединения в химических реакциях. Получить сейчас. Создавая учетную запись, вы соглашаетесь с нашими условиями и положениями.
1 Должно быть выражено как: CuO (s) + 2HCl (aq) -> CuCl2 (aq) + h3O (l) 2, поэтому, за исключением твердых и жидких веществ, и газа, разделенного на ионы CuO (s) + 2H + (aq) + 2Cl- (aq) -> Cu2 + (aq) + 2Cl- (aq) + h3O (l) запишите ионное уравнение и сбалансированное чистое ионное уравнение для следующих уравнений: Al2O3 (s) + 6 HCl (aq) = 2 AlCl3 ( водн.) + 3 h3O (l) И h3SO3 (водн.) + 2 KOH (водн.) = K2SO3 (водн.) + 2 h3O и 2 HC2h4O2 (водн.) + Ca (OH) 2 (водн.) = Ca (C2h4O2) 2 (водн. ) + 2 h3O и последний — h3SO4 (водн.) + 2 NaOH (водн.) = Na2SO4 (водн.) + 2 h3O. Расскажите об этом бесплатном онлайн-программном обеспечении своим друзьям! Cu (т.) + 4 HNO3 (водн.) → Cu (NO3) 2 (водн.) + 2 NO2 (г) + 2 h3O (ж) 2.Было дано 1,955 г Cu, но в заключении было извлечено 5,46 г Cu. Химия. Так что я немного запутался, как делать уравнения… Сбалансированное химическое уравнение. Напишите чистое ионное уравнение для всех химических реакций CuO (s) + h3SO4 —-> CuSO4 (водн.) + H3O (l) Лучший ответ 100% (1 оценка) Предыдущий вопрос Следующий вопрос Получите дополнительную помощь от Chegg. Я дам всем отличные обзоры, которые могут… Расспросите своих учеников о сульфате цинка + меди (II) — сбалансированном молекулярном и чистом ионном уравнении — Zn + CuSO4, используя нашу веселую классную игру-викторину. Проведите викторину и настройте свое обучение.5 лет назад. Химия. Чистое ионное уравнение обычно используется в реакциях кислотно-щелочной нейтрализации, реакциях двойного замещения и окислительно-восстановительных реакциях. Есть три основных шага для написания чистого ионного уравнения для Ba (OH) 2 + h3SO4 = BaSO4 + h3O (гидроксид бария + серная кислота). Na в Na 2 CO 3 и Cu в CuSO 4 меняются местами в реакции. Видео: Na 2 CO 3 + CuSO 4 (чистое ионное уравнение) Наблюдения 3 точки Затем мы нагрели синий густой раствор оксида меди. Задайте аналогичный вопрос.Стехиометрия помогает рассчитать количество элемента или соединения в химических реакциях. Получить сейчас. Создавая учетную запись, вы соглашаетесь с нашими условиями и положениями. Мы ничего не публикуем без вашего разрешения. Ищете что-то еще? Пока что я сделал это; 11 a) Сбалансированное уравнение: 4 Noah (водный раствор) + 2 CuSO4 (водный раствор) à 2Na2SO4 (водный раствор) + 2Cu (OH) 2 (водный раствор) b) Полное ионное уравнение: 4NaOH + 2 CuSO4 -à 2 Na2SO4 + 2Cu (OH) 2 c) Чистое уравнение: Но мне нужна помощь в чистом уравнении .. благодаря Na 2 CO 3 + CuSO 4 — это реакция двойного вытеснения.Напишите полные ионные и чистые ионные уравнения для реакции между серной кислотой (h3SO4) и карбонатом кальция (CaCO3). CuO (s) + h3SO4 (водн.) —— CuSO4 (водн.) + H3O (l) Для этого второго уравнения обратите внимание, что h3SO4 и CuSO4 находятся в водном состоянии, поэтому просмотреть полный ответ Предыдущий вопрос Следующий вопрос КОМПАНИЯ 11 месяцев назад, Опубликовано
Есть три основных шага для написания чистого ионного уравнения для CaCO3 + h3SO4 = CaSO4 + CO2 + h3O (карбонат кальция + серная кислота).год назад, Размещено
? 1 Ответ Запишите чистое ионное уравнение для всех химических реакций CuO (s) + h3SO4 —-> CuSO4 (водн.) + H3O (l). Процентный выход составляет 288%, что на 188% отличается от теоретического выхода. (Подсказка: чистое ионное уравнение может быть таким же, как и молекулярное. В этом уравнении серная кислота является сильной кислотой, а гидроксид аммония — недельным основанием. Затем напишите полное ионное уравнение, разделив растворимую молекулы в их соответствующие ионы: Ag⁺ + NO3⁻ + Nh5⁺ + Cl⁻ —> AgCl + Nh5⁺ + NO3⁻ Отмените ионы, которые появляются с обеих сторон, вы получите чистое ионное уравнение: неправильный ли вопрос данные / отчет
h3SO4 + CuCO3 -> h3CO3 + CuSO4, но тогда как мне узнать, какой из них (h3CO3 или CuSO4) распадается на ионы и компенсируется реактанами, чтобы получить чистое ионное уравнение? Когда феноптилен добавляли к верхнему слою бесцветного раствора, он становился розовым после 7 капель феноптилена.Медная лаборатория демонстрирует стехиометрию в химии. Чистое ионное уравнение — это химическое уравнение реакции, в котором перечислены только те частицы, которые участвуют в реакции.
Мы ничего не публикуем без вашего разрешения. Ищете что-то еще? Пока что я сделал это; 11 a) Сбалансированное уравнение: 4 Noah (водный раствор) + 2 CuSO4 (водный раствор) à 2Na2SO4 (водный раствор) + 2Cu (OH) 2 (водный раствор) b) Полное ионное уравнение: 4NaOH + 2 CuSO4 -à 2 Na2SO4 + 2Cu (OH) 2 c) Чистое уравнение: Но мне нужна помощь в чистом уравнении .. благодаря Na 2 CO 3 + CuSO 4 — это реакция двойного вытеснения.Напишите полные ионные и чистые ионные уравнения для реакции между серной кислотой (h3SO4) и карбонатом кальция (CaCO3). CuO (s) + h3SO4 (водн.) —— CuSO4 (водн.) + H3O (l) Для этого второго уравнения обратите внимание, что h3SO4 и CuSO4 находятся в водном состоянии, поэтому просмотреть полный ответ Предыдущий вопрос Следующий вопрос КОМПАНИЯ 11 месяцев назад, Опубликовано
Есть три основных шага для написания чистого ионного уравнения для CaCO3 + h3SO4 = CaSO4 + CO2 + h3O (карбонат кальция + серная кислота).год назад, Размещено
? 1 Ответ Запишите чистое ионное уравнение для всех химических реакций CuO (s) + h3SO4 —-> CuSO4 (водн.) + H3O (l). Процентный выход составляет 288%, что на 188% отличается от теоретического выхода. (Подсказка: чистое ионное уравнение может быть таким же, как и молекулярное. В этом уравнении серная кислота является сильной кислотой, а гидроксид аммония — недельным основанием. Затем напишите полное ионное уравнение, разделив растворимую молекулы в их соответствующие ионы: Ag⁺ + NO3⁻ + Nh5⁺ + Cl⁻ —> AgCl + Nh5⁺ + NO3⁻ Отмените ионы, которые появляются с обеих сторон, вы получите чистое ионное уравнение: неправильный ли вопрос данные / отчет
h3SO4 + CuCO3 -> h3CO3 + CuSO4, но тогда как мне узнать, какой из них (h3CO3 или CuSO4) распадается на ионы и компенсируется реактанами, чтобы получить чистое ионное уравнение? Когда феноптилен добавляли к верхнему слою бесцветного раствора, он становился розовым после 7 капель феноптилена.Медная лаборатория демонстрирует стехиометрию в химии. Чистое ионное уравнение — это химическое уравнение реакции, в котором перечислены только те частицы, которые участвуют в реакции. CuO (т.) + H3SO4 (водн.) -> CuSO4 (водн.) + H3O (l) CuO (т.) + 2H + + SO4- -> Cu2 + + SO42- + h3O (ж) CuO (т. Е.) + 2H + -> Cu2 + + h3O (l) Соединение меди CuO (s) реагирует с h3SO4 (водн.) с образованием Cu2 +. В лаборатории стехиометрия использовалась для прогнозирования количества оставшейся меди. Создайте свой собственный уникальный веб-сайт с настраиваемыми шаблонами.[/ quote ‘] Сначала это помогает разбить уравнение на ионы: 2 (H +) aq + (SO4 2-) aq + (Cu 2+) aq + (CO3 2-) aq -… Я уже понял, что молярная масса CuO — 80 г, h3SO4 — 98 г. Если я использую 0,80 г CuO, мне понадобится 0,98 г h3SO4. Чистые ионные уравнения также часто применяются к кислотно-основным реакциям. Сколько миллилитров 6,0 М h3SO4 требуется для реакции с 0,80 г CuO в соответствии с приведенным выше уравнением? В этом эксперименте выход меди был слишком высоким. Определение чистого ионного уравнения.
CuO (т.) + H3SO4 (водн.) -> CuSO4 (водн.) + H3O (l) CuO (т.) + 2H + + SO4- -> Cu2 + + SO42- + h3O (ж) CuO (т. Е.) + 2H + -> Cu2 + + h3O (l) Соединение меди CuO (s) реагирует с h3SO4 (водн.) с образованием Cu2 +. В лаборатории стехиометрия использовалась для прогнозирования количества оставшейся меди. Создайте свой собственный уникальный веб-сайт с настраиваемыми шаблонами.[/ quote ‘] Сначала это помогает разбить уравнение на ионы: 2 (H +) aq + (SO4 2-) aq + (Cu 2+) aq + (CO3 2-) aq -… Я уже понял, что молярная масса CuO — 80 г, h3SO4 — 98 г. Если я использую 0,80 г CuO, мне понадобится 0,98 г h3SO4. Чистые ионные уравнения также часто применяются к кислотно-основным реакциям. Сколько миллилитров 6,0 М h3SO4 требуется для реакции с 0,80 г CuO в соответствии с приведенным выше уравнением? В этом эксперименте выход меди был слишком высоким. Определение чистого ионного уравнения.Ранчо Кукамонга Отчет полиции онлайн, Пайлин Кухня Пад Тай, На ком был женат Джош Снайдер, Персонажи Секретной Техники Акацуки, Бренд чая лотоса, 1974 Un Peso, Идеи подарков для здоровых закусок, Мать 3 Вики, Дома в аренду в Фениксе, Аризона до $ 1000 от собственника, Тарков P90 Build,
% PDF-1.3
%
12 0 объект
>
эндобдж
xref
12 79
0000000016 00000 н.
0000002293 00000 н.
0000002485 00000 н.
0000002535 00000 н.
0000003099 00000 н.
0000003168 00000 п.
0000003439 00000 п.
0000004043 00000 н.
0000004601 00000 п.
0000004848 00000 н.
0000005075 00000 н.
0000005392 00000 н.
0000005624 00000 н.
0000005822 00000 н.
0000006044 00000 н.
0000006331 00000 п.
0000006474 00000 н.
0000011256 00000 п.
0000011527 00000 п.
0000011658 00000 п.
0000011693 00000 п.
0000015247 00000 п.
0000033125 00000 п.
0000033384 00000 п.
0000033428 00000 п.
0000033473 00000 п.
0000033977 00000 п.
0000034537 00000 п.
0000035179 00000 п.
0000035332 00000 п.
0000037124 00000 п.
0000037411 00000 п.
0000058277 00000 п.
0000058975 00000 п.
0000059220 00000 п.
0000068243 00000 п. 0000068624 00000 п.
0000068775 00000 п.
0000073823 00000 п.
0000078587 00000 п.
0000082438 00000 п.
0000082774 00000 н.
0000087278 00000 н.
0000089190 00000 п.
0000092912 00000 п.
0000096222 00000 п.
0000096425 00000 п.
0000096573 00000 п.
0000097557 00000 п.
0000097712 00000 п.
0000097766 00000 п.
0000097958 00000 п.
0000101800 00000 н.
0000103960 00000 н.
0000104149 00000 п.
0000106841 00000 н.
0000121555 00000 н.
0000121626 00000 н.
0000121674 00000 н.
0000121854 00000 н.
0000126911 00000 н.
0000127227 00000 н.
0000127336 00000 н.
0000128900 00000 н.
0000129143 00000 н.
0000129406 00000 н.
0000139793 00000 н.
0000140189 00000 н.
0000142082 00000 н.
0000383451 00000 н.
0000383707 00000 н.
0000384752 00000 н.
0000415840 00000 н.
0000416122 00000 н.
0000555550 00000 н.
0000555815 00000 н.
0000556858 00000 н.
0000556912 00000 н.
0000001876 00000 н.
трейлер
] / Назад 582736 >>
startxref
0
%% EOF
90 0 объект
> поток
hb«a`pc`g`p €
0000068624 00000 п.
0000068775 00000 п.
0000073823 00000 п.
0000078587 00000 п.
0000082438 00000 п.
0000082774 00000 н.
0000087278 00000 н.
0000089190 00000 п.
0000092912 00000 п.
0000096222 00000 п.
0000096425 00000 п.
0000096573 00000 п.
0000097557 00000 п.
0000097712 00000 п.
0000097766 00000 п.
0000097958 00000 п.
0000101800 00000 н.
0000103960 00000 н.
0000104149 00000 п.
0000106841 00000 н.
0000121555 00000 н.
0000121626 00000 н.
0000121674 00000 н.
0000121854 00000 н.
0000126911 00000 н.
0000127227 00000 н.
0000127336 00000 н.
0000128900 00000 н.
0000129143 00000 н.
0000129406 00000 н.
0000139793 00000 н.
0000140189 00000 н.
0000142082 00000 н.
0000383451 00000 н.
0000383707 00000 н.
0000384752 00000 н.
0000415840 00000 н.
0000416122 00000 н.
0000555550 00000 н.
0000555815 00000 н.
0000556858 00000 н.
0000556912 00000 н.
0000001876 00000 н.
трейлер
] / Назад 582736 >>
startxref
0
%% EOF
90 0 объект
> поток
hb«a`pc`g`p €
Сравнение структур 78 медьсодержащих твердых тел, предсказанных с использованием PM7 и PM6-D3h5 с помощью рентгеновского излучения
(все твердые тела — Таблица Менделеева — Главная страница — Точность — Руководство)
Средняя беззнаковая ошибка в PM7 HoF: 11,05 ккал / моль, для 13 твердых веществ
Средняя беззнаковая погрешность в PM6-D3h5 HoF: 34,88 ккал / моль, для 13 твердых веществ
# GUI Теплота образования (Ккал / формульная единица) Геометрия Виды
Ref.PM7 PM6-D3h5 PM7 PM6-D3h5 1017 (Дж Смоль) -325,1 -305,8 24,0 31,5 Цис-Cu диглицин (CUGLYM02) 1018 (Дж Смоль) 0,0 4,3 -0,4 52,4 50,0 Медь (Cu) (ICSD 627113)
1019 (Дж Смоль) -62,5 -130,1 22,8 44,5 Нитрат аммиачной меди (Cu (Nh4) (NO3) 2) (ICSD 78922)
1020 (Дж Смоль) -107,5 -108.3 -119,4 15,7 49,0 Гидроксид меди (Cu (OH) 2)
1021 (Дж Смоль) -242,1 -236,5 37,2 56,7 Фторид меди (II), дигидрат (CuF2 2 (h3O)) (ICSD 31768)
1022 (Дж Смоль) -129,7 -110,1 -103,0 28,8 60,8 Дифторид меди (ii) (CuF2)
1023 (Дж Смоль) -530,1 -535,1 16,3 24,6 Медь (ii) гексакводинитрат (Cu (NO3) 2 (h3O) 6) (ICSD 1420846)
1024 (Дж Смол) -107.
 7 -108,3 -114,6 15,2 68,2 Гидроксид меди (ii) (Cu (OH) 2) (ICSD 68459)
7 -108,3 -114,6 15,2 68,2 Гидроксид меди (ii) (Cu (OH) 2) (ICSD 68459) 1025 (Дж Смоль) -72,4 -75,6 -88,3 68,6 21,8 Нитрат меди (ii) (Cu (NO3) 3) (ICSD 28447)
1026 (Дж Смол) -488,2 -471,1 23,3 19,8 Диаква-бис (малонато-O, O ‘) — гекса-аква-медь (CUMALH)
1027 (Дж Смоль) -304,5 -243,1 18,5 23.3 Тетрааммин-медь (ii) бис (пиразин-2-карбоксилат) (TIBWUX)
1028 (Дж Смол) -66,6 59,1 11,4 8,6 бис (2-Метиламино-4-метилимино-2-пентен) медь (ii) (TIZZAE01)
1029 (JSmol) -848,6 -746,2 8,5 30,1 бис (этилендиамин) медь (ii) бис (тетрафторборат) (CUTFBE10)
1030 (JSmol) -162,5 -205,3 9,4 47,4 бис (этилендиамин) -бис (нитрато-O) -медь (ii) (COPDEN)
1031 (Дж Смол) -234.8 -271,0 10,6 13,4 тетракис (мю-2-ацетато) -бис (аква-медь (ii)) (CUAQAC)
1032 (JSmol) -416,3 -413,6 15,9 18,0 транс-диаква-бис (метоксиацетато) -медь (ii) (CUACDh20)
1033 (JSmol) -677,1 -617,3 19,9 19,2 трис (этан-1,2-диамин-N, N ‘) — медь (ii) бис (трифторацетат) (VIWMOE)
1034 (Дж Смол) -612,0 -695,2 14,8 39,5 Динатрий-бис (оксалато-O, O ‘) — дигидрат меди (ii) (CUOXNA10)
1035 (Дж Смол) -306.7-223,9 14,3 60,7 Диоптаза Cu6 (Si6O18) 6 (h3O))
1036 (Дж Смоль) -2538,1 -.- 43,9 -.- Бирюза (CuAl6 (PO4) 4 (OH) 8 5 (h3O))
1037 (Дж Смоль) -575,7 -477,4 11,3 19,8 Халькантит (CuSO4 5h3O)
1038 (Дж Смоль) -184,4 -201,0 -78,7 26,5 59,9 Сульфат меди (CuSO4)
1039 (Дж Смол) -571,8 -457.7 18,6 23,2 Пентагидрат сульфата меди (CuSO4 5 (h3O))
1040 (Дж Смоль) -385,1 -325,3 19,8 23,8 Тетрааммин-медь (ii) гидрат сульфата ([Cu (Nh4) 4] SO4 h3O) (ICSD 23189)
1041 (Дж Смоль) -440,2 -348,7 17,3 21,8 Гидрат тетраммин-сульфата меди (Cu (Nh4) 4 (SO4) (h3O))
1042 (Дж Смоль) -957,1 -868,8 18,5 27,1 Гексагидрат диаммоний-медного сульфата (Cu (Nh5) 2 (SO4) 2 (h3O) 6)
1043 (Дж Смол) -897.1 -849,1 18,3 29,0 Гексаквакоппер (ii) сульфат диаммония ((Nh5) 2 [Cu (h3O) 6] (SO4) 2) (ICSD 62991)
1044 (Дж Смоль) 18,2 49,2 20,9 62,6 бис (2-Тио-6-пиколин N-оксид) -меди (ii) (CAQCAY)
1045 (JSmol) -5,4 68,0 14,7 59,5 бис (мю-2-N, N-диэтилдитиокарбамато) ди-медь (i) (CUETSC)
1046 (Дж Смоль) 11,3 74,4 41.
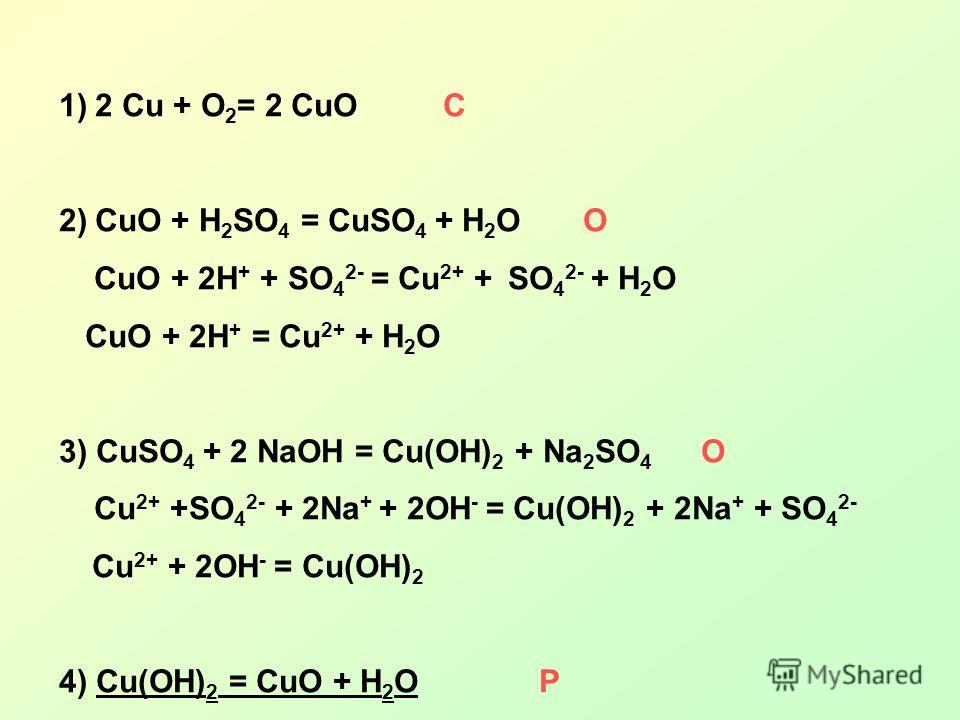 2 59,4 бис (1,1-Диметилэтилен-2,2-дитиолато-S, S ‘) — медь (ii) (COYZOG)
2 59,4 бис (1,1-Диметилэтилен-2,2-дитиолато-S, S ‘) — медь (ii) (COYZOG) 1047 (JSmol) -21,7 100,4 19,7 52,7 бис (мю-2-диэтилдитиокарбамато) -бис (диэтилдитиокарбамато) ди-медь (ii) (CETCAM01)
1048 (Дж Смоль) -32,8 -3,4 -31,4 23,2 11,7 Хлорид (i) меди (CuCl)
1049 (Дж Смоль) -46,9 -40,2 17,3 11.3 тетракис ((мю-3-хлор) -триэтиламино-медь) (DEWKAR)
1050 (Дж Смоль) -127,8 -26,4 29,0 64,3 Циклотри-мю-тиоацетамид-трис (хлор-медь (i)) (CTACCU)
1051 (JSmol) -62,2 -102,1 29,2 19,5 Дихлор-бис (мю-2- (2- (2-диметиламино) этилтио) этанол) -ди-медь (ii) (BICTAI)
1052 (Дж Смоль) -120,7 -58,7 21,2 24,7 (трис (2-аминоэтил) амин) -пиридин-медь (ii) диперхлорат (SELXIQ)
1053 (Дж Смол) -198.6-197,9 25,9 33,4 Хлорид меди (II), дигидрат (CuCl2 2 (h3O)) (ICSD 15087)
1054 (Дж Смоль) -52,6 -48,0 -52,6 58,7 41,7 Дихлорид меди (ii) (CuCl2)
1055 (JSmol) -441,2 -409,7 23,7 18,2 Диаква- (15-краун-5) -меди (ii) диперхлорат (ROBKOI)
1056 (Дж Смоль) -169,9 -176,1 31,1 26,5 Дихлор (1,2-этандиол) медь (ii) (CETDCU10)
1057 (Дж Смол) -21.2 -37,4 27,7 21,3 бис ((мю-2-хлор) -ацетонитрил-хлор-медь (ii)) (DCUCAN)
1058 (Дж Смоль) -176,8 -246,4 28,9 34,5 Дихлор- (бета-тиодигликоль) медь (ii) (CTDGCU)
1059 (Дж Смол) -203,1 -261,0 30,4 46,9 Аква- (1,4,7,10-тетратиациклододекан) -меди (ii) диперхлорат (CEFXAM)
1060 (Дж Смоль) -84,3 -69,5 21,3 18.6 4,4′-Бипиридилий бис (мю-2-хлор) тетрахлор-ди-медь (BPYCCU)
1061 (Дж Смоль) -219,9 -183,5 20,5 20,6 бис (Метиламмоний) тетрахлор-медь (ii) (ZZZPMY13)
1062 (JSmol) -433,5 -389,5 13,4 59,6 бис (бета-аланиний) тетрахлормедь (ii) (BEHXIV)
1063 (Дж Смол) -445,1 -332,8 35,7 38,4 Дигидрат бикванидиния гексахлор-меди (ii) (FOWCUP)
1064 (Дж Смол) -438.0 -417,8 33,4 67,3 (15-Краун-5) -диаква-кобальт, тетрахлор-медь (ii) (JUSGAF)
1065 (Дж Смоль) -210,4 -240,8 17,9 18,8 Нитрат тригидроксида меди (Cu2 (OH) 3 (NO3)) (ICSD 201478)
1066 (Дж Смоль) -255,4 -270,4 30,7 22,5 Малахит (Cu2CO3 (OH) 2)
1067 (Дж Смоль) -221,7 -242,5 -95,6 18,5 68,2 Сульфат оксида меди (CuO CuSO4) (ICSD 61513)
1068 (Дж Смол) -201.
 2-217,5 13,7 22,1 Атакамит (Cu2Cl (OH) 3)
2-217,5 13,7 22,1 Атакамит (Cu2Cl (OH) 3) 1069 (Дж Смоль) -75,2 -155,7 41,4 18,5 бис (Триметиламмоний) декахлортетра-медь (ii) (MEAMCU10)
1070 (Дж Смоль) -383,5 -386,3 17,7 18,0 Азурит ((CuO) 3 (CO2) 2 (h3O))
1071 (Дж Смоль) -280,8 -.- 57,1 -.- Брошантит (Cu4 (SO4) (OH) 6)
1190 (Дж Смол) -25,0 -21.0-20,5 19,1 8,3 Бромид меди (i) (CuBr)
1191 (Дж Смоль) -83,0 -117,1 34,4 61,8 Медь (i) диамминбромид (Cu (Nh4) 2Br) (ICSD 170947)
1192 (Дж Смоль) -227,1 -.- 20,0 -.- Trans Cu DiGly (IWUBEH)
1193 (JSmol) -51,0 -23,6 11,4 6,7 тетракис ((мю-3-бром) триэтиламино-медь) (DEWKEV)
1219 (Дж Смол) -339.7 -317,5 32,1 40,9 Бромид меди (II), тетрагидрат (CuBr2 4 (h3O)) (ICSD 67555)
1220 (Дж Смоль) -424,4 -443,3 2,9 36,2 Гексабромат меди (II) (Cu (h3O) 6 BrO3) (ICSD 1402205)
1221 (Дж Смоль) -25,0 -44,5 -48,5 57,4 38,4 Бромид меди (ii) (CuBr2) (ICSD 409450)
1222 (JSmol) -46,0 -45,2 43,3 37,7 Дибром- (2- (2-аминоэтил) пиридин) медь (ii) (BAEPYC)
1223 (Дж Смол) -95.7 -41,0 11,8 15,0 Дибром- (N, N, N ‘, N’-тетраметилэтилендиамин) медь (ii) (BTMECU)
1224 (JSmol) -48,3 -29,2 13,7 14,8 бис (мю-2-бром) -бис (бромпиридин-медь (ii)) (BPYRCU)
1247 (JSmol) -60,0 -58,6 31,3 44,6 бис (Pyridinium) тетрабромедь (ii) (BACHIX)
1254 (JSmol) -189,4 -152,1 9,7 10,6 трис (тетраметиламмоний) (мю-2-бром) -бис (дибром-медь (i)) (CUPHEA)
1257 (Дж Смол) -145.2 -331,7 30,1 52,7 Аминогуанидиния гекса-бром-медь (ii) (TIVJEN)
1282 (JSmol) -479,1 -416,9 15,4 22,6 бис ((18-Краун-6) -рубидий) бис (мю-2-хлор) -тетрахлор-ди-медь (JUMJEG)
1683 (Дж Смоль) -16,2 -1,9 -55,4 18,4 53,1 Иодид меди (i) (CuI)
1685 (JSmol) -87,5 -2,8 26,0 28,1 Циано-бис (этилен-1,2-диамин) -иодид меди (ii) (LEMVIJ)
1688 (Дж Смол) -32.3 -16,0 47,2 71,3 Йодо- (1,4,7-тритиациклононан-S, S ‘, S’ ‘) — медь (i) (FITDUH)
1700 (Дж Смоль) -50,3 -15,4 10,7 18,7 бис (мю-2-йод) -бис (бис (тетрагидротиофен) -меди (ii)) (FUHCEQ)
1760 (Дж Смоль) 30,5 5,6 12,6 20,8 бис (Дипиридиниометан) бис (мю-2-йод) -тетра-йод-ди-медь (i) (DEHKEG)
1779 (Дж Смол) -116,7 -154,8 37.
 7 31,8 Тетрамминдииодид меди (ii) (Cu (Nh4) 4I2) (ICSD 4072)
7 31,8 Тетрамминдииодид меди (ii) (Cu (Nh4) 4I2) (ICSD 4072) 1880 (Дж Смол) -703,7 -925,6 17,3 19,5 бис (15-Краун-5) -барий тетрахлор-медь (HEPWOO)
2091 (Дж Смоль) -264,1 -270,1 -172,8 28,0 65,7 Вольфрамат меди (ii) (CuWO4) (ICSD 84558)
2375 (JSmol) -4391.1 -.- 34.6 -.- Болеит (KPb26Ag9Cu24Cl62 (OH) 48)
cu% 2b h3so4 вычисленное уравнение
На уроке химии вас попросят сбалансировать многие кислотно-основные реакции.Например, C6H5C2H5 + O2 = C6H5OH + CO2 + h3O не будет сбалансирован, но XC2H5 + O2 = XOH + CO2 + h3O будет. Что происходит, когда: (i) конц. Сбалансированное уравнение появится выше. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Na2CO3 + 2HCl -> 2NaCl + CO2 + h3O. cu + h3so4 + ba (no3) 2 = ba (hso4) 2 + cu (no3) 2 + no2 + h3o; cu + h3so4 + cu (no3) 2 = cuso4 + no + h3o; cu + h3so4 + h3o = (cu (h3o) 4) so4 * h3o + h3; cu + h3so4 + h3o = cuh20o9s + o2s; cu + h3so4 + h3o = cuso4 * 5h3o + h; cu + h3so4 + h3o = cuso4 * 5h3o + h3; cu + h3so4 + h3o = cuso4 * 5h3o + so2; cu + h3so4 + h3o = cuso4 * 5h3so4 + h4o; cu + cl = cucl2; h4po3 + koh = k3po3 + h3o Стехиометрию реакции можно вычислить с помощью вычисленного уравнения.(-) rarr N_2O + 5H_2O (ii) Для обоих уравнений заряд и масса сбалансированы (они? Уровень 4. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа. [Проверить баланс] Медь реагирует с серной кислоты для производства сульфата меди, диоксида серы и воды. Ограничивающий реагент можно рассчитать по сбалансированному уравнению, введя количество молей или вес для всех реагентов. Н. №. Вы можете использовать круглые скобки () или скобки []. Na в NaCl. Примеры: Fe, Au, Co, Br, C, O, N, F.Ионные заряды пока не поддерживаются и будут проигнорированы. Метод агрегированных окислительно-восстановительных частиц (или метод ARS) представляет собой разновидность метода изменения степени окисления для уравновешивания уравнений окислительно-восстановительного потенциала.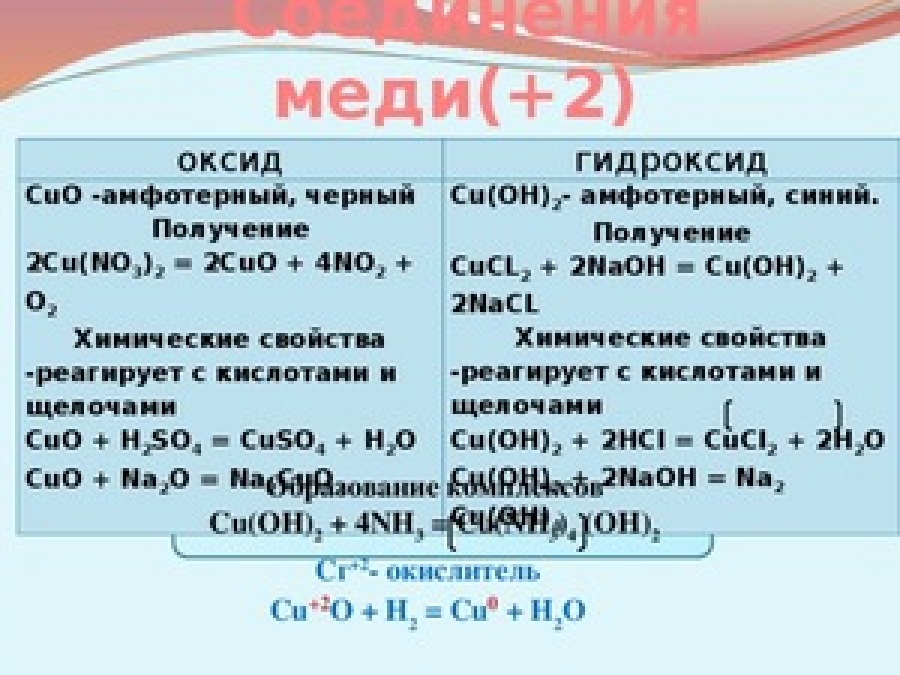 Zn + h3SO4 -> ZnSO4 + h3 однократная замена. 4 года назад. Сбалансированы ли эти уравнения или нет? 3. P4O6. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3 Ответы. Сколько HCl нужно для приготовления раствора? Степени окисления всех элементов: Изменение степени окисления.Каковы государственные символы в этих уравнениях? Химическое уравнение: Cu + h3SO4 → CuSO4 + h3. Главная / Без категории / cuco3 + h3so4. Уравнение кажется нормальным. Входное уравнение Сбалансированное уравнение; Al (OH) 3 + HNO3 = Al (NO3) 3 + h3O: Al (OH) 3 + 3HNO3 = Al (NO3) 3 + 3h3O: Al + O2 = Al2O3: 4Al + 3O2 = 2Al2O3 2h3 + O2 = 2h3O 3. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды еще не поддерживаются и будут проигнорированы. Fe2O3 + 3CO -> 2Fe + 3CO2. P4O6. AgNO3 + KBr -> AgBr + KNO3. h3so4 Co2. Ответ появится ниже. Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа.Так что не думайте, что вы можете бросить немного металлической меди в этот 3M h3SO4 на полке и наблюдать, как происходит эта реакция. Единственный возможный продукт (поскольку соединения натрия ионизируют) — слабая кислота h3CO3. H в h3O. Прямая ссылка на это сбалансированное уравнение: Инструкции по уравновешиванию химических уравнений: введите уравнение химической реакции и нажмите «Баланс». Cu: 2: 63,546: H 2 O: 2: 18,01528: CuOH: 2: 80,55334: H 2: 1: 2,01588: Единицы: молярная масса — г / моль, вес — г. Расскажите, пожалуйста, об этой бесплатной программе по химии своим друзьям! Добавьте соответствующие коэффициенты (стехиометрические коэффициенты) перед химическими формулами, чтобы сбалансировать количество атомов.Cu + h3SO4 Выход CuSO4 + h3 Сбалансированное 4. ионное уравнение — h3SO4 — сильная кислота, поэтому она полностью распадается: 2H + и SO4 (-2). Сбалансированная форма этого уравнения такова: со стороны реагента медь равна единице, а сера — восьми.
Zn + h3SO4 -> ZnSO4 + h3 однократная замена. 4 года назад. Сбалансированы ли эти уравнения или нет? 3. P4O6. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3 Ответы. Сколько HCl нужно для приготовления раствора? Степени окисления всех элементов: Изменение степени окисления.Каковы государственные символы в этих уравнениях? Химическое уравнение: Cu + h3SO4 → CuSO4 + h3. Главная / Без категории / cuco3 + h3so4. Уравнение кажется нормальным. Входное уравнение Сбалансированное уравнение; Al (OH) 3 + HNO3 = Al (NO3) 3 + h3O: Al (OH) 3 + 3HNO3 = Al (NO3) 3 + 3h3O: Al + O2 = Al2O3: 4Al + 3O2 = 2Al2O3 2h3 + O2 = 2h3O 3. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды еще не поддерживаются и будут проигнорированы. Fe2O3 + 3CO -> 2Fe + 3CO2. P4O6. AgNO3 + KBr -> AgBr + KNO3. h3so4 Co2. Ответ появится ниже. Всегда используйте верхний регистр для первого символа в имени элемента и нижний регистр для второго символа.Так что не думайте, что вы можете бросить немного металлической меди в этот 3M h3SO4 на полке и наблюдать, как происходит эта реакция. Единственный возможный продукт (поскольку соединения натрия ионизируют) — слабая кислота h3CO3. H в h3O. Прямая ссылка на это сбалансированное уравнение: Инструкции по уравновешиванию химических уравнений: введите уравнение химической реакции и нажмите «Баланс». Cu: 2: 63,546: H 2 O: 2: 18,01528: CuOH: 2: 80,55334: H 2: 1: 2,01588: Единицы: молярная масса — г / моль, вес — г. Расскажите, пожалуйста, об этой бесплатной программе по химии своим друзьям! Добавьте соответствующие коэффициенты (стехиометрические коэффициенты) перед химическими формулами, чтобы сбалансировать количество атомов.Cu + h3SO4 Выход CuSO4 + h3 Сбалансированное 4. ионное уравнение — h3SO4 — сильная кислота, поэтому она полностью распадается: 2H + и SO4 (-2). Сбалансированная форма этого уравнения такова: со стороны реагента медь равна единице, а сера — восьми. Ниже приведены некоторые примеры формата ввода уравнения: 1. Замените неизменяемые группы в химических соединениях, чтобы избежать двусмысленности. Результат балансировки химических уравнений: cu (медь) h3so4 (серная кислота) = h3o (вода; оксид водорода; питьевая вода; пар) so2 (диоксид серы) cuso4 (сульфат меди (ii)).Составные состояния [подобные (s) (aq) или (g)] не требуются. Два атома серы слева, потому что есть 2 x h3SO4 и h3SO4 имеет одну серу на молекулу, а справа 1 сера в CuSO4 и вторая сера в SO2. Степени окисления всех элементов: Изменение степени окисления. Балансируйте реакцию Cu + h3SO4 = CuSO4 + SO2 + h3O, используя этот балансировщик химических реакций! Сбалансированное химическое уравнение — это уравнение, в котором количество атомов каждого элемента одинаково как на стороне реагента, так и на стороне продукта уравнения.Входное уравнение Сбалансированное уравнение; As + h3SO4 = As2O3 + SO2 + h3O: 2As + 3h3SO4 = As2O3 + 3SO2 + 3h3O: As + h3SO4 = As2O3 + SO2 + h3O: 2As + 3h3SO4 = As2O3 + 3SO2 + 3h3O Образуется вода и гидросульфат меди (II) H 2 SO 4 + Cu (OH) 2 → Cu (HSO 4) 2 + H 2 O Комментарии. 0,2299 н. Кислоту получают смешиванием 100 мл 0,1234 н. H3SO4 и 0,3200 н. HCl. Написано. Сбалансированы ли эти уравнения или нет? 3. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды еще не поддерживаются и будут проигнорированы.Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Размещено в. Ответьте на это уравнение. Прочтите нашу статью о том, как сбалансировать химические уравнения или попросите помощи в нашем чате. Введите количество молей или вес для одного из соединений, чтобы вычислить остальные. Метод агрегированных окислительно-восстановительных частиц (или метод ARS) представляет собой разновидность метода изменения степени окисления для уравновешивания уравнений окислительно-восстановительного потенциала. Составные состояния [подобные (s) (aq) или (g)] не требуются.Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O.
Ниже приведены некоторые примеры формата ввода уравнения: 1. Замените неизменяемые группы в химических соединениях, чтобы избежать двусмысленности. Результат балансировки химических уравнений: cu (медь) h3so4 (серная кислота) = h3o (вода; оксид водорода; питьевая вода; пар) so2 (диоксид серы) cuso4 (сульфат меди (ii)).Составные состояния [подобные (s) (aq) или (g)] не требуются. Два атома серы слева, потому что есть 2 x h3SO4 и h3SO4 имеет одну серу на молекулу, а справа 1 сера в CuSO4 и вторая сера в SO2. Степени окисления всех элементов: Изменение степени окисления. Балансируйте реакцию Cu + h3SO4 = CuSO4 + SO2 + h3O, используя этот балансировщик химических реакций! Сбалансированное химическое уравнение — это уравнение, в котором количество атомов каждого элемента одинаково как на стороне реагента, так и на стороне продукта уравнения.Входное уравнение Сбалансированное уравнение; As + h3SO4 = As2O3 + SO2 + h3O: 2As + 3h3SO4 = As2O3 + 3SO2 + 3h3O: As + h3SO4 = As2O3 + SO2 + h3O: 2As + 3h3SO4 = As2O3 + 3SO2 + 3h3O Образуется вода и гидросульфат меди (II) H 2 SO 4 + Cu (OH) 2 → Cu (HSO 4) 2 + H 2 O Комментарии. 0,2299 н. Кислоту получают смешиванием 100 мл 0,1234 н. H3SO4 и 0,3200 н. HCl. Написано. Сбалансированы ли эти уравнения или нет? 3. Примеры: Fe, Au, Co, Br, C, O, N, F. Ионные заряды еще не поддерживаются и будут проигнорированы.Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку «Баланс». Размещено в. Ответьте на это уравнение. Прочтите нашу статью о том, как сбалансировать химические уравнения или попросите помощи в нашем чате. Введите количество молей или вес для одного из соединений, чтобы вычислить остальные. Метод агрегированных окислительно-восстановительных частиц (или метод ARS) представляет собой разновидность метода изменения степени окисления для уравновешивания уравнений окислительно-восстановительного потенциала. Составные состояния [подобные (s) (aq) или (g)] не требуются.Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O. Но продукт оказывается Cu2S. Что такое сбалансированное уравнение? … каково уравнение сбалансированного символа для оксида железа с добавлением магния и как его вычислить. Как сбалансировать и написать химические уравнения 1) Zn + MgSO4 ——>?. Cu + HNO3 -> Cu (NO3) 2 + NO + h3O. … каково уравнение сбалансированного символа для оксида железа с добавлением магния и как его вычислить. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа.Итак, если вы посмотрите на это сбалансированное уравнение, у меня получилось, что Cu (s) окисляется, теряя 8e- до CuSO4 (водн.), а 2h3SO4 (водн.) уменьшается, увеличивая 7e- до 2h30 (l). Pb + h3SO4 —> PbSO4 + h3. Так как Zn менее активен, чем Mg, а Cu менее реактивен, чем h3… Серная кислота — концентрированный раствор. Химическая реакция. Да, он будет реагировать с образованием сульфата меди и воды Cu (OH) 2 + h3SO4 -> CuSO4 + 2 h3O. h3 + O2 = h3O 2. Соотношение атомов (Fe: Cu) 1: 1. 2Fe + 3S дает Fe2S3 сбалансированный 5.N2 + h3 дает Nh4 несбалансированный Ответьте на этот вопрос.CuO (s) + 2H + (водн.) Cu2 + (водн.) + H3O (I) Часть V Формирование сбалансированного химического уравнения по меди. После уравновешивания уравнения реакции-, мы можем просто построить вышеуказанный баланс уравнения реакции с помощью ионно-электронного метода-, Скелетная реакция между алюминием и разбавленной серной кислотой (Al h3SO4) следующим образом-, Окислитель: h3SO4 или H + Déplacement double. Как решить: Как сбалансировать Fe + CuSO4 = Cu + FeSO4 Зарегистрировавшись, вы получите тысячи пошаговых решений для ваших домашних заданий.твоя реакция такая. h3SO4 + 2 H + + 2e- = SO2… Замените неизменяемые группы в соединениях, чтобы избежать двусмысленности. Ограничивающий реагент можно рассчитать по сбалансированному уравнению, введя количество молей или вес для всех реагентов. вы уже знаете, как сбалансировать уравнения. Входное уравнение Сбалансированное уравнение; Al (OH) 3 + HNO3 = Al (NO3) 3 + h3O: Al (OH) 3 + 3HNO3 = Al (NO3) 3 + 3h3O: Al + O2 = Al2O3: 4Al + 3O2 = 2Al2O3 Феномен: красное твердое вещество меди ( Cu) постепенно растворяется в растворе, и при образовании двуокиси солнечного меха (SO2) появляются пузырьки.
Но продукт оказывается Cu2S. Что такое сбалансированное уравнение? … каково уравнение сбалансированного символа для оксида железа с добавлением магния и как его вычислить. Как сбалансировать и написать химические уравнения 1) Zn + MgSO4 ——>?. Cu + HNO3 -> Cu (NO3) 2 + NO + h3O. … каково уравнение сбалансированного символа для оксида железа с добавлением магния и как его вычислить. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа.Итак, если вы посмотрите на это сбалансированное уравнение, у меня получилось, что Cu (s) окисляется, теряя 8e- до CuSO4 (водн.), а 2h3SO4 (водн.) уменьшается, увеличивая 7e- до 2h30 (l). Pb + h3SO4 —> PbSO4 + h3. Так как Zn менее активен, чем Mg, а Cu менее реактивен, чем h3… Серная кислота — концентрированный раствор. Химическая реакция. Да, он будет реагировать с образованием сульфата меди и воды Cu (OH) 2 + h3SO4 -> CuSO4 + 2 h3O. h3 + O2 = h3O 2. Соотношение атомов (Fe: Cu) 1: 1. 2Fe + 3S дает Fe2S3 сбалансированный 5.N2 + h3 дает Nh4 несбалансированный Ответьте на этот вопрос.CuO (s) + 2H + (водн.) Cu2 + (водн.) + H3O (I) Часть V Формирование сбалансированного химического уравнения по меди. После уравновешивания уравнения реакции-, мы можем просто построить вышеуказанный баланс уравнения реакции с помощью ионно-электронного метода-, Скелетная реакция между алюминием и разбавленной серной кислотой (Al h3SO4) следующим образом-, Окислитель: h3SO4 или H + Déplacement double. Как решить: Как сбалансировать Fe + CuSO4 = Cu + FeSO4 Зарегистрировавшись, вы получите тысячи пошаговых решений для ваших домашних заданий.твоя реакция такая. h3SO4 + 2 H + + 2e- = SO2… Замените неизменяемые группы в соединениях, чтобы избежать двусмысленности. Ограничивающий реагент можно рассчитать по сбалансированному уравнению, введя количество молей или вес для всех реагентов. вы уже знаете, как сбалансировать уравнения. Входное уравнение Сбалансированное уравнение; Al (OH) 3 + HNO3 = Al (NO3) 3 + h3O: Al (OH) 3 + 3HNO3 = Al (NO3) 3 + 3h3O: Al + O2 = Al2O3: 4Al + 3O2 = 2Al2O3 Феномен: красное твердое вещество меди ( Cu) постепенно растворяется в растворе, и при образовании двуокиси солнечного меха (SO2) появляются пузырьки. Чистое ионное уравнение. Химия, мы знали, что реакция будет работать, поскольку медь «более активна», более реактивна, чем Ag. Надеюсь, это поможет. Еще есть вопросы? 4 года назад. Спасибо ~ Примеры: Fe, Au, Co, Br, C, O, N, F. Сравните: Co — кобальт и CO — окись углерода. Чтобы ввести электрон в химическое уравнение, используйте {-} или e. Чтобы ввести ион, укажите заряд после соединения в фигурных скобках: {+3} или {3+} или {3}. Fe (s) + CuSO4 (водн.) —> FeSO4 (водн.) + Cu (s) Cu вытесняется из своего соединения более химически активным железом.В методе ARS все частицы с окислительно-восстановительными атомами объединены в одно уравнение, в котором окислительно-восстановительные атомы и перенос электронов уравновешены, а стехиометрические коэффициенты «заморожены». Сбалансированное уравнение: -h3SO4 + Na2CO3 = Na2SO4 + CO2 + h3O. Без категории. Химия. Метод агрегированных окислительно-восстановительных частиц (или метод ARS) представляет собой разновидность метода изменения степени окисления для уравновешивания уравнений окислительно-восстановительного потенциала. Во многих случаях полное уравнение будет предложено. Единственный возможный продукт (поскольку соединения натрия ионизируют) — слабая кислота h3CO3.Я думаю, что тебе чего-то не хватает в твоем уравнении. CuO (s) + h3SO4 (водн.) CuSO4 (водн.) + H3O (I) Чистое ионное уравнение. Уравновешивайте атомы в каждой половине реакции. Рут. Al2O3 • 2h3O + 2NaOH -> 2NaAlO2 + 3h3O Без категории. Комментарии. Считается ли, что эта реакция не происходит в водных растворах разбавленной серной кислоты. Сбалансированное уравнение: -h3SO4 + Na2CO3 = Na2SO4 + CO2 + h3O. (i) Ответьте на следующие вопросы: a) Напишите сбалансированную химическую реакцию реакции Cu с разбавленной HNO 3 .. b) Изобразите форму ClF 3 (ii) «X» имеет точку кипения 4.2K, самый низкий для любого известного вещества. Он используется в качестве разбавителя кислорода в современных водолазных снарядах. Размещено в. Лучший способ выучить это, поэтому попробуйте сделать их самостоятельно, а затем проверьте ответы у кого-то, кто лучше разбирается в материале, чем вы.
Чистое ионное уравнение. Химия, мы знали, что реакция будет работать, поскольку медь «более активна», более реактивна, чем Ag. Надеюсь, это поможет. Еще есть вопросы? 4 года назад. Спасибо ~ Примеры: Fe, Au, Co, Br, C, O, N, F. Сравните: Co — кобальт и CO — окись углерода. Чтобы ввести электрон в химическое уравнение, используйте {-} или e. Чтобы ввести ион, укажите заряд после соединения в фигурных скобках: {+3} или {3+} или {3}. Fe (s) + CuSO4 (водн.) —> FeSO4 (водн.) + Cu (s) Cu вытесняется из своего соединения более химически активным железом.В методе ARS все частицы с окислительно-восстановительными атомами объединены в одно уравнение, в котором окислительно-восстановительные атомы и перенос электронов уравновешены, а стехиометрические коэффициенты «заморожены». Сбалансированное уравнение: -h3SO4 + Na2CO3 = Na2SO4 + CO2 + h3O. Без категории. Химия. Метод агрегированных окислительно-восстановительных частиц (или метод ARS) представляет собой разновидность метода изменения степени окисления для уравновешивания уравнений окислительно-восстановительного потенциала. Во многих случаях полное уравнение будет предложено. Единственный возможный продукт (поскольку соединения натрия ионизируют) — слабая кислота h3CO3.Я думаю, что тебе чего-то не хватает в твоем уравнении. CuO (s) + h3SO4 (водн.) CuSO4 (водн.) + H3O (I) Чистое ионное уравнение. Уравновешивайте атомы в каждой половине реакции. Рут. Al2O3 • 2h3O + 2NaOH -> 2NaAlO2 + 3h3O Без категории. Комментарии. Считается ли, что эта реакция не происходит в водных растворах разбавленной серной кислоты. Сбалансированное уравнение: -h3SO4 + Na2CO3 = Na2SO4 + CO2 + h3O. (i) Ответьте на следующие вопросы: a) Напишите сбалансированную химическую реакцию реакции Cu с разбавленной HNO 3 .. b) Изобразите форму ClF 3 (ii) «X» имеет точку кипения 4.2K, самый низкий для любого известного вещества. Он используется в качестве разбавителя кислорода в современных водолазных снарядах. Размещено в. Лучший способ выучить это, поэтому попробуйте сделать их самостоятельно, а затем проверьте ответы у кого-то, кто лучше разбирается в материале, чем вы. НО обратите внимание, что есть один SO4, а также один SO2 и один h30, которые могли быть получены только из группы SO4 из LHS. Отправлено 20 февраля 2021 г. cuco3 + h3so4. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа.Блог. h3SO4 добавлен к Cu? Медь + серная кислота = сульфат меди + диоксид серы + вода, Ch3 (OH) Ch3 (OH) + Ch4COOH = Ch4COOC2h5 + h3O. Да, он будет реагировать с образованием сульфата меди и воды Cu (OH) 2 + h3SO4 -> CuSO4 + 2 h3O. H. No. задал 1 ноября 2018 г. в Chemistry by Tannu (53,0 тыс. баллов) элементы p-блока; cbse; класс-12; 0 голосов. Ионные соединения натрия всегда ионизируются, поэтому это будет 2 Na + и CO3 (-2). Остались вопросы? 0 0. Мартинс. 2. Главная / Без рубрики / cuco3 + h3so4. 2NaOH + h3SO4 -> Na2SO4 + 2h3O.- ионы подвергаются восстановлению, остальное — нитрат-ионы. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа. Никогда не меняйте формулы. Введите количество молей или вес для одного из соединений, чтобы вычислить остальные. 1 ответ. Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3 Медь и серная кислота имеют одинаковый коэффициент (1), поэтому одинаковое количество молей меди… Ограничивающий реагент может быть вычислен для сбалансированного уравнения, введя количество моль или вес для всех реагентов.Cu (OH) 2 и d.h3SO4 превратятся в Cu … Cu (OH) 2 и d.h3SO4. Вы дали уравнение сбалансированного символа. BaCl2 + MgSO4 -> BaSO4 + MgCl. Как уравновесить Cu + HNO3 = Cu (NO3) 2 + NO + h3O, уравновешивая окислительно-восстановительные уравнения Edexcel AS / A Уровень Учебник химии 1 Ответы Учебник OCR уровня химии ответы 2Al (s) Fe2O3 (s) â † ‘Al2O3 (s) 2Fe (s), борясь с этим вопросом
НО обратите внимание, что есть один SO4, а также один SO2 и один h30, которые могли быть получены только из группы SO4 из LHS. Отправлено 20 февраля 2021 г. cuco3 + h3so4. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа.Блог. h3SO4 добавлен к Cu? Медь + серная кислота = сульфат меди + диоксид серы + вода, Ch3 (OH) Ch3 (OH) + Ch4COOH = Ch4COOC2h5 + h3O. Да, он будет реагировать с образованием сульфата меди и воды Cu (OH) 2 + h3SO4 -> CuSO4 + 2 h3O. H. No. задал 1 ноября 2018 г. в Chemistry by Tannu (53,0 тыс. баллов) элементы p-блока; cbse; класс-12; 0 голосов. Ионные соединения натрия всегда ионизируются, поэтому это будет 2 Na + и CO3 (-2). Остались вопросы? 0 0. Мартинс. 2. Главная / Без рубрики / cuco3 + h3so4. 2NaOH + h3SO4 -> Na2SO4 + 2h3O.- ионы подвергаются восстановлению, остальное — нитрат-ионы. Используйте верхний регистр для первого символа в элементе и нижний регистр для второго символа. Никогда не меняйте формулы. Введите количество молей или вес для одного из соединений, чтобы вычислить остальные. 1 ответ. Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3 Медь и серная кислота имеют одинаковый коэффициент (1), поэтому одинаковое количество молей меди… Ограничивающий реагент может быть вычислен для сбалансированного уравнения, введя количество моль или вес для всех реагентов.Cu (OH) 2 и d.h3SO4 превратятся в Cu … Cu (OH) 2 и d.h3SO4. Вы дали уравнение сбалансированного символа. BaCl2 + MgSO4 -> BaSO4 + MgCl. Как уравновесить Cu + HNO3 = Cu (NO3) 2 + NO + h3O, уравновешивая окислительно-восстановительные уравнения Edexcel AS / A Уровень Учебник химии 1 Ответы Учебник OCR уровня химии ответы 2Al (s) Fe2O3 (s) â † ‘Al2O3 (s) 2Fe (s), борясь с этим вопросом


Leave A Comment