Физики получили самый тяжелый изотоп кальция
Физики впервые синтезировали самый тяжелый на сегодняшний день изотоп кальция 60Ca, ядро которого содержит 20 протонов и 40 нейтронов. Также впервые были получены самые тяжелые изотопы для других элементов: фосфора, серы, хлора, аргона, калия и скандия. Полученные результаты подтвердили теоретические модели, которые существуют для границы стабильности атомных ядер. Это означает, что, вероятнее всего, для кальция возможно образование и более тяжелых ядер, вплоть до 70Ca, пишут ученые в Physical Review Letters.
Максимальное количество нейтронов в ядре каждого элемента, при котором это ядро будет жить хоть какое-то время, определяется силами, связывающими нуклоны между собой. Для описания устойчивых конфигураций атомных ядер существует несколько теоретических моделей, ни одна из которых на сегодняшний день не может однозначно определить границу нуклонной устойчивости. Самые устойчивые нуклонные конфигурации часто описываются с использованием магических чисел, которые соответствуют полностью заполненным оболочкам нейтронов или протонов.
Например, ядро кальция интересно тем, что число протонов в нем всегда магическое — 20, а при определенных числах нейтронов ядро кальция становится «дважды магическим». Для этого в ядре должно быть 20, 28, 32 или 34 нейтрона. Так, в природе чаще всего встречается изотоп кальция, который имеет массовое число 40 — с 20 протонами и 20 нейтронами, самый тяжелый из устойчивых изотопов кальция содержит 28 нейтронов. У радиоактивных изотопов кальция с коротким периодом полураспада, число нейтронов в ядре может быть и больше: например, существование устойчивых ядер предполагалось для ядер с 40 и 50 нейтронами, однако получить их экспериментально не удавалось.
Каждое открытие самых легких и самых тяжелых изотопов для отдельных элементов позволяет сместить границу нуклонной стабильности и подтвердить или опровергнуть существующие теоретические модели. Группа физиков из России, США, и Японии под руководством Олега Тарасова (O. B. Tarasov) из Университета штата Мичиган предложили новый метод синтеза тяжелых изотопов с большим количеством нейтронов.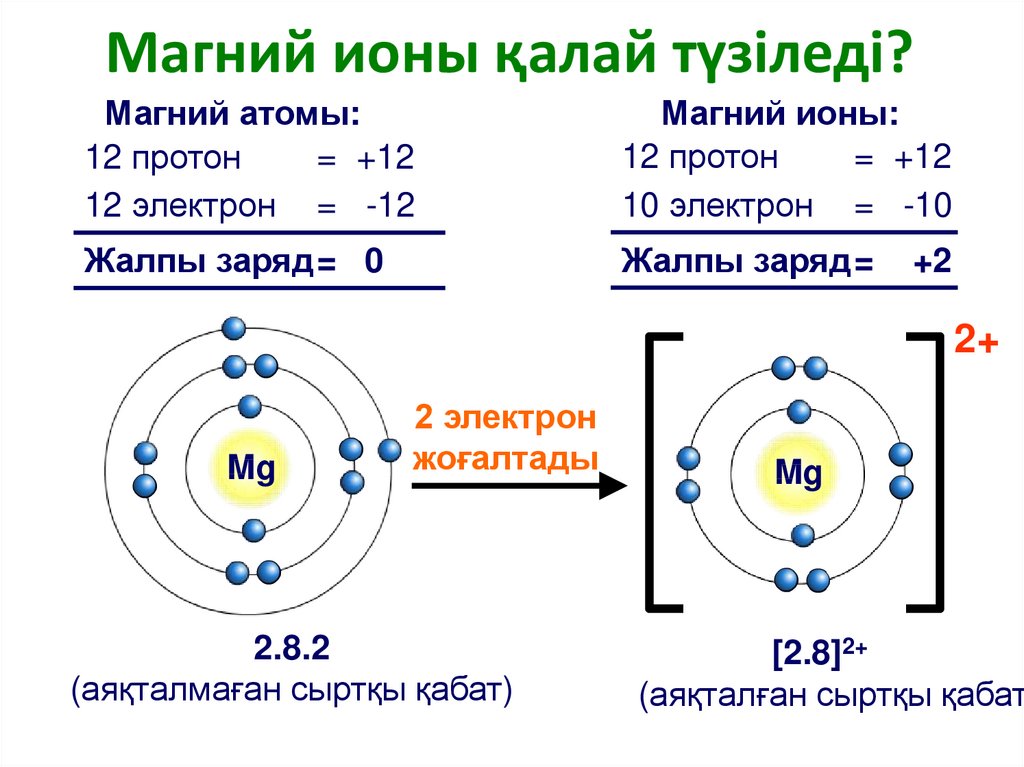 Для этого ученые облучали вращающуюся мишень из бериллия 9Be пучком ядер цинка 70Zn с энергией 345 электронвольт. Образующиеся при этом частицы фиксировались с помощью спектрометра для идентификации частиц.
Для этого ученые облучали вращающуюся мишень из бериллия 9Be пучком ядер цинка 70Zn с энергией 345 электронвольт. Образующиеся при этом частицы фиксировались с помощью спектрометра для идентификации частиц.
В результате ученым зарегистрировали восемь новых изотопов, которые не удавалось получить ранее. Все эти изотопы (фосфор 47P, сера 49S, хлор 52Cl, аргон 54Ar, калий 57K, кальций 59,60Ca и скандий 62Sc) оказались самыми тяжелыми из известных на сегодняшний день для своих элементов. Также было зарегистрировано одно ядро 59K, однако эти данные пока нельзя считать статистически значимыми. Самым важным из синтезированных ядер ученые называют именно изотоп кальция 60Ca, устойчивость которого косвенно подтверждает «магичность» числа нейтронов 40. Время жизни такого изотопа составляет несколько тысячных секунды.
По словам авторов работы, полученные результаты позволили подтвердить некоторые из теоретических моделей, которые предполагают, что для кальция возможно образование и более тяжелых ядер, вплоть до 70Ca.
Стоит отметить, что интерес вызывают не только изотопы с большим количеством нейтронов, но нейтрон-дефицитные ядра. Так, в 2015 году физикам удалось синтезировать сразу несколько изотопов, которые, наоборот, были самыми легкими из известных для урана, нептуния, берклия и америция. Эти ядерные структуры, которые находятся на границе нуклонной стабильности могут помочь в развитии теоретических моделей ядра атома.
Александр Дубов
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Ядерные реакции — что это, определение и ответ
Планетарная модель атома была разработана Резерфордом после проведения серии экспериментов. До Резерфорда считалось, что в атоме равномерно распределены “плюсы” и “минусы”, и атом представляет собой некий электронейтральный “пудинг”, состоящий из равномерно перемешенных положительных и отрицательных зарядов (модель атома Томпсона).
Постановка эксперимента
Резерфорд направлял сфокусированный пучок альфа-частиц (тяжелые положительно заряженные частицы) на тонкую пластинку фольги. {4}} = \frac{m_{0}}{16}\) (кг) и т. д.
{4}} = \frac{m_{0}}{16}\) (кг) и т. д.
Наиболее распространенные типы радиоактивного распада ― α-распад, электронный β-распад, электронный β-захват и γ-распад. Эти распады происходят по следующим схемам:
α-распад:
\(\begin{matrix} A \\ Z \\ \end{matrix}X \rightarrow \begin{matrix} A — 4 \\ Z — 2 \\ \end{matrix}Y + \begin{matrix} 4 \\ 2 \\ \end{matrix}\text{He}\)
При α-распаде заряд ядра атома уменьшается на 2, а массовое число уменьшается на 4, и излучается α-частица ― ядро гелия.
β-распад:
\(\begin{matrix} A \\ Z \\ \end{matrix}X \rightarrow \begin{matrix} \text{\ \ \ \ \ \ \ }A \\ Z + 1 \\ \end{matrix}Y + \begin{matrix} \text{\ \ \ }0 \\ — 1 \\ \end{matrix}e\)
При электронном β-распаде один из нейтронов в ядре превращается в протон, ядро испускает один электрон: \(\begin{matrix} \text{\ \ \ }0 \\ — 1 \\ \end{matrix}e\).
Из-за превращения нейтрона в протон, зарядовое число увеличивается на 1, а масса не изменяется.
β-захват:
\(\begin{matrix} A \\ Z \\ \end{matrix}X\ + \begin{matrix} \text{\ \ \ }0 \\ — 1 \\ \end{matrix}e \rightarrow \begin{matrix} A \\ Z — 1 \\ \end{matrix}Y\)
При электронном β-захвате (еще можно встретить название: позитронный β-распад) один из электронов \(\begin{matrix} \text{\ \ \ }0 \\ — 1 \\ \end{matrix}e\) со внешних орбиталей захватывается протоном в ядре и превращается в нейтрон. Из-за превращения протона в нейтрон, зарядовое число уменьшается на 1, а масса не изменяется.
γ-распад ― это испускание ядром гамма-излучения (электромагнитной волны высокой частоты).
\(\begin{matrix} A \\ Z \\ \end{matrix}X \rightarrow \begin{matrix} A \\ Z \\ \end{matrix}Y + \gamma\)
При γ-распаде заряд и масса ядра не изменяются.
При протекании ядерной реакции сохраняется суммарное массовое число и суммарный заряд элементов:
\(\begin{matrix} A_{1} \\ Z_{1} \\ \end{matrix}X + \begin{matrix} A_{2} \\ Z_{2} \\ \end{matrix}Y = \begin{matrix} A_{3} \\ Z_{3} \\ \end{matrix}Z + \begin{matrix} A_{4} \\ Z_{4} \\ \end{matrix}\Omega\)
Сумма масс элементов слева, до ядерной реакции, равна сумме масс справа, после ядерной реакции: \(A_{1} + A_{2} = A_{3} + A_{4}\).
Сумма зарядов элементов слева, до ядерной реакции, равна сумме зарядов справа, после ядерной реакции: \(Z_{1} + Z_{2} = Z_{3} + Z_{4}\).
Сколько протонов, нейтронов и электронов в кальции?
Подсказка: Атомный номер Ca равен 20.
Массовое число или атомная масса Ca равна 40.
Полный ответ:
Итак, в вопросе предлагается написать количество протонов, электронов и число нейтронов, присутствующих в атоме Са. В младших классах мы изучали три основных субатомных вида: протоны, электроны и нейтроны. Давайте освежим нашу память об этих субатомных частицах и проследим связь между атомным номером и атомной массой с количеством протонов, нейтронов и электронов. 9{-27}}кг$.
Давайте освежим нашу память об этих субатомных частицах и проследим связь между атомным номером и атомной массой с количеством протонов, нейтронов и электронов. 9{-27}}кг$.
Атомный номер является уникальным номером или может быть назван идентификатором элемента. Каждый элемент имеет уникальный атомный номер. Атомный номер — это количество электронов или количество протонов, присутствующих в атоме.
Атомный номер представляет собой сумму количества протонов и нейтронов, присутствующих в атомном ядре.
Теперь давайте перейдем к решению:
Поскольку мы знаем, что атомный номер Ca равен 20, он дает количество протонов и электронов, присутствующих в атоме.
$Число\,из\,протонов\,=20$ 9{\text{0}}}\text{=40-20=20}$
Количество нейтронов равно 20.
Следовательно, количество протонов, нейтронов и электронов в атоме Ca равно 20.
$Number\,of \,протонов\,=20$
$Количество\,оф\,электронов\,=20$
$Количество\,оф\,нейтронов=20$
Примечание:
Всегда есть шанс запутаться с расчет атомной массы и атомного номера, многие добавляют количество протонов и электронов для атомной массы.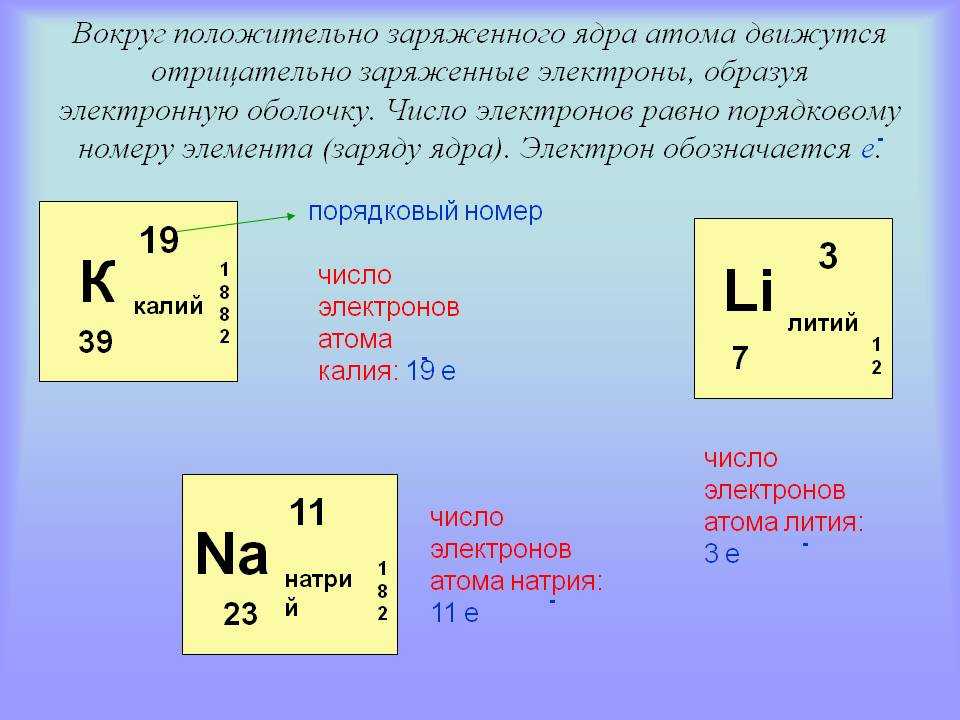 Атомное ядро определяет массу элемента.
Атомное ядро определяет массу элемента.
$\text{Atomic}\,\text{number=No}\text{.}\,\text{of}\,\text{protons=No}\text{.}\,\text{of}\ ,\text{электроны}$
Количество протонов и электронов в атоме будет одинаковым.


Leave A Comment