Фенол — это… Что такое Фенол?
Игольчатые кристаллы фенолаФено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производств фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Получение
На 2006 год производство фенола в промышленном масштабе осуществляется тремя способами:
- Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
- Около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
- Весь остальной фенол выделяют из каменноугольной смолы.
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Химические свойства
- Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия — C
- C6H5OH + NaOH = C6H5ONa + H2O
- Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
- Реакция Кольбе-Шмидта.
- Взаимодействие с металлическим натрием:
2C6H5OH + 2Na = 2C6H5ONa + H2↑
- Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол
- Взаимодействие с концентрированной азотной кислотой:
C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол
- Взаимодействие с хлоридом железа (III)(качественная реакция на фенол):
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает энзим тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
- 44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол;
- 30 % фенола расходуется на производство фенолформальдегидных смол;
- 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
- остальные 14 % расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство.
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт».
Токсические свойства
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Эта отметка установлена 12 мая 2011. |
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.
Предельно допустимые концентрации (ПДК) фенола:[1][2][3]
- ПДКр.з. = 1 мг/м³
- ПДКр.с. = 0,3 мг/м³
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,003 мг/м³
- ПДКв. = 0,001 мг/л
Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
Примечания
Фенол (гидроксибензол, карболовая кислота)
Фенол (гидроксибензол, карболовая кислота) – это органическое соединение ароматического ряда с формулой C6
В свою очередь, Фено́лы — это класс органических соединений ароматического ряда, в молекулах которых гидроксильные группы OH− связаны с атомами углерода ароматического кольца.
По числу гидроксильных групп различают :
- одноатомные фенолы (аренолы): фенол и его гомологи;
- двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон;
- трёхатомные фенолы (арентриолы): пирогаллол, гидроксигидрохинон, флороглюцин;
- многоатомные фенолы.
Соответственно, собственно фенол, как вещество, представляет собой простейший представитель группы фенолов и имеет одно ароматическое ядро и одну гидроксильную группу
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше 60 °С), хорошо растворим в эфире, хлороформе, глицерине, сероуглероде.
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
- Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa):
C6H5OH + NaOH -> C6H5ONa + H2O
- В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
2C6H5OH + 2Na -> 2C6H5ONa + H2
- Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
C6H5OH + CH3COOH -> C6H5OCOCH3 + NaCl
- При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
C6H5OH + Zn -> C6H6 + ZnO
Реакции фенола по ароматическому кольцу:
- Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в
- Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
C6H5OH + CO2 –NaOH-> C6H4OH(COONa)
C6H4OH(COONa) –h3SO4-> C6H4OH(COOH)
Качественные реакции на фенол:
- В результате взаимодействия с бромной водой:
C6H5OH + 3Br2 -> C6H2Br3OH +3HBr
- образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
- С концентрированной азотной кислотой:
C6H5OH + 3HNO3 -> C6H2(NO2)3OH + 3H2O
- С хлоридом железа(III) (качественная реакция на фенол):
C6H5OH + FeCl3 -> ⌈Fe(C6H5OH)6⌉Cl3
Реакция присоединения
- Гидрированием фенола в присутствии металлических катализаторов Pt/Pd, Pd/Ni, получают циклогексиловый спирт:
C6H5OH -> C6H11OH
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
- Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C6H5OH + 2H2O2 – Fe> C6H4(OH)2
- При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Получение фенола
Получают фенол из каменноугольной смолы (продукта коксования) и синтетическим путем.
В каменноугольной смоле коксохимического производства содержится от 0,01 до 0,1% фенолов, в продуктах полукоксования от 0,5 до 0,7%; в масле, образующемся при гидрогенизации, и в сточной воде, вместе взятых,— от 0,8 до 3,7%. В смоле бурого угля и сточных водах полукоксования содержится от 0,1 до 0,4% фенолов. Каменноугольную смолу перегоняют, отбирая фенольную фракцию, выкипающую при 160—250 °С. В состав фенольной фракции входят фенол и его гомологи (25—40%), нафталин (25—40%) и органические основания (пиридин, хинолин). Нафталин отделяют фильтрованием, а оставшуюся часть фракции обрабатывают 10—14%-ным раствором едкого натра.
Образовавшиеся феноляты отделяют от нейтральных масел и пиридиновых оснований путем продувки острым паром, а затем обрабатывают диоксидом углерода. Выделенные сырые фенолы подвергают ректификации, отбирая последовательно фенол, крезолы и ксиленолы.
Большая часть фенола, производимого в настоящее время в промышленном масштабе, получается различными синтетическими методами
Синтетические методы получения фенола
- По бензолсульфонатному методу бензол смешивают с купоросным маслом. Полученный продукт обрабатывают содой и получают натриевую соль бензолсульфокислоты, после чего раствор упаривают, отделяют выпавший сульфат натрия, а натриевую соль бензолсульфокислоты сплавляют со щелочью. Образовавшийся фенолят натрия либо насыщайте диоксидом углерода, либо добавляют серную кислоту до начала выделения диоксида серы и отгоняют фенол.
- Хлорбензольный метод заключается в прямом хлорировании бензола газообразным хлором в присутствии железа или его солей и омылении образующегося хлорбензола раствором едкого натра или при гидролизе в присутствии катализатора.
- Модифицированный метод Рашига основан на окислительном хлорировании бензола хлористым водородом и воздухом с последующим гидролизом хлорбензола и выделением фенола перегонкой.
- Кумольный метод заключается в алкилировании бензола, окислении полученного изопропилбензола в гидропероксид кумола и последующем разложении его на фенол и ацетон: Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Промышленный кумольный метод, разработанный в СССР, является экономически наиболее выгодным по сравнению с другими методами получения фенола. Получение фенола через бензолсульфокислоту связано с расходованием больших количеств хлора и щелочи. Окислительное хлорирование бензола связано с большим расходом пара—в 3—6 раз большим, чем при применении других методов; кроме того, при хлорировании происходит сильная коррозия аппаратуры, что требует применения специальных материалов. Кумольный метод прост по аппаратурному оформлению и позволяет получать одновременно два технически ценных продукта: фенол и ацетон.
- При окислительном декарбоксилировании бензойной кислоты сначала проводят жидкофазное каталитическое окисление толуола в бензойную кислоту, которая в присутствии Сu2+ превращается в бензолсалициловую кислоту. Этот процесс может быть описан следующей схемой: Бензоилсалициловая кислота разлагается водяным паром на салициловую и бензойные кислоты. Фенол образуется в результате быстрого декарбоксилирования салициловой кислоты.
Применение фенола
Фенол используют как сырье для производства полимеров: поликарбоната и эпоксидных смол (сначала синтезируют бисфенол А, а затем – эти полимеры), фенолфольмальдегидных смол, циклогексанола (с последующим получением нейлона и капрона).
В процессе нефтепереработки при помощи фенола проводят очистку масел от смолистых веществ, серосодержащих соединений и полициклических ароматических углеводородов.
Кроме того, фенол служит сырьем для производства ионола, неонолов (ПАВ), креозолов, аспирина, антисептиков и пестицидов.
Фенол хороший консервант и антисептик. Его используют для дезинфекции в животноводстве, в медицине, в косметологии.
Токсические свойства фенола
Фенол токсичен (класс опасности II). При вдыхании фенола нарушаются функций нервной системы. Пыль, пары и раствор фенола при попадании на слизистые оболочки глаз, дыхательных путей, кожу, вызывают химические ожоги. При попадании на кожу фенол всасывается в течение нескольких минут и начинает воздействовать на ЦНС. В больших дозах может вызывать паралич дыхательного центра.Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г.
Фенол: общая и структурная формулы, химические свойства, применение
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Антибиотики
- Антисептики
- Биологически активные добавки
- Витамины
- Гинекологические
- Гормональные
- Дерматологические
- Диабетические
- Для глаз
- Для крови
- Для нервной системы
- Для печени
- Для повышения потенции
- Для полости рта
- Для похудения
- Для суставов
- Для ушей
- Желудочно-кишечные
- Кардиологические
- Контрацептивы
- Мочегонные
- Обезболивающие
- От аллергии
- От кашля
- От насморка
- Повышение иммунитета
- Противовирусные
- Противогрибковые
- Противомикробные
- Противоопухолевые
- Противопаразитарные
- Противопростудные
- Сердечно-сосудистые
- Урологические
- Другие лекарства
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексология
- Стоматология
- Травы и продукты
- Трихология
- Другие статьи
- Словарь терминов
- [А] Абазия .. Ацидоз
- [Б] Базофилы .. Богатая тромбоцитами плазма
- [В] Вазопрессин .. Выкидыш
- [Г] Галлюциногены .. Грязи лечебные
- [Д] Деацетилазы гистонов .. Дофамин
- [Ж] Железы .. Жиры
- [И] Иммунитет .. Искусственная кома
- [К] Каверна .. Кумарин
- [Л] Лапароскоп .. Лучевая терапия
- [М] Макрофаги .. Мутация
- [Н]
Фенол, свойства и все характеристики
Характеристики и физические свойства фенола
Фенол – твердое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок (рис. 1), а при длительном хранении темнеют и становятся более красными. Он малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60 – 70oС. Фенол легкоплавок, его температура плавления 43oС. Ядовит.
Рис. 1. Фенол. Внешний вид.
Получение фенола
В промышленных масштабах фенол получают из каменноугольной смолы. Среди лабораторных методов наиболее часто использую следующие:
— гидролиз хлорбензола
C6H5Cl + NaOH→C6H5OH + NaCl (kat = Cu, t0).
— щелочное плавление солей аренсульфоновых кислот
C6H5SO3Na + 2NaOH→C6H5OH + Na2SO3 + H2O (t0).
— кумольный метод (окисление изопропилбензола)
C6H5-C(CH3)H-CH3 + O2→C6H5OH + CH3-C(O)-CH3 (H+, t0).
Химические свойства фенола
Химические превращения фенола протекают в основном с расщеплением:
1) связи О-Н
— взаимодействие с металлами
2C6H5OH + 2Na→ 2C6H5ONa + H2↑.
— взаимодействие с щелочами
C6H5OH + NaOH→C6H5ONa + H2O.
— взаимодействие с ангидридами карбоновых кислот
C6H5-OH + Cl-C(O)-O-C(O)-CH3→ C6H5-O-C(O)-CH3 + CH3COOH (t0).
— взаимодействие с галогенангидридами карбоновых кислот
C6H5-OH + Cl-C(O)-CH3→ C6H5-O-C(O)-CH3 + HCl (t0).
— взаимодействие с FeCl3 (качественная реакция на фенол – появление фиолетовой окраски, исчезающей при добавлении кислоты)
6C6H5OH + FeCl3→ (C6H5OH)3 + 3Cl—.
2) связей Csp2-H преимущественно в о— и n-положениях
— бромирование
C6H5-OH + 3Br2 (aq)→Br3-C6H2-OH↓ + 3HBr.
— нитрование (образование пикриновой кислоты)
C6H5-OH + 3HONO2 (conc)→ (NO2)3-C6H2-OH + 3H2O (H+).
3) единого 6π-электронного облака бензольного кольца
— гидрирование
C6H5OH + 3H2→ C6H11-OH (kat = Ni, t0 = 130 – 150, p = 5 – 20 атм).
Применение фенола
Фенол в больших количествах используется для производства красителей, фенолформальдегидных пластмасс, лекарственных веществ.
Из двухатомных фенолов в медицине применяют резорцин как антисептик и вещество для некоторых клинических анализов, а гидрохинон и другие двухатомные фенолы используют при обработке фотоматериалов в качестве проявителей.
В медицине для дезинфекции помещений и мебели применяют лизол, в состав которого входят разные фенолы.
Некоторые фенолы используют как антиоксиданты – вещества, предотвращающие порчу пищевых продуктов при их долгом хранении (жиров, масел, пищевых концентратов).
Примеры решения задач
Спирты и фенолы
Спирты и фенолы
Спирты – органические вещества, содержащие одну или более гидроксильных групп (−OH), напрямую связанных с атомом углерода в состоянии sp3-гибридизации).
Фенолы – соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
Номенклатура и классификация
При использовании номенклатуры ИЮПАК названия спиртов характеризуются суффиксом —ол. В зависимости от числа гидроксильных групп спирты бывают одно-, двух-, трехатомные. В зависимости от того, при каком атоме углерода находится гидроксильная группа, спирты классифицируют на первичные, вторичные и третичные.
Строение и физические свойства
Строение спиртов отчасти схоже со строением воды. Как и в воде, между молекулами спирта образуются водородные связи, поэтому спирты имеют более высокие температуры плавления и кипения, чем можно было бы ожидать. Влияние гидроксильной группы на свойства вещества особенно велико в соединениях с короткой углеводородной цепочкой. Например, метанол и этанол неограниченно смешиваются с водой, имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, а высшие спирты являются гидрофобными и мало отличаются по свойствам от аналогичных углеводородов без гидроксильной группы [9].
При рассмотрении фенолов необходимо выделить влияние гидроксильной группы –OH на ароматическое кольцо, которое повышает в бензольном кольце электронную плотность (особенно в орто- и пара-положениях) благодаря одной из неподелённых пар электронов кислорода, учавствующей в сопряжении с π-системой бензольного кольца. Смещение неподелённой электронной пары атома О в сторону бензольного кольца приводит к усилению полярности связи O–H. В итоге молекулы фенола распадаются в водных растворах с элиминированием протона, а значит фенол проявляет себя как слабая кислота. Это является основным отличием фенолов от спиртов, являющихся неэлектролитами. Основная часть одноатомных фенолов при нормальных условиях – бесцветные кристаллические вещества с низкой температурой плавления и специфическим запахом. Фенолы плохо растворяются в воде, но с легкостью – в органических растворителях. Они токсичны, а при хранении на воздухе постепенно окисляются и темнеют.
Химические свойства
Кислотно-основные реакции спиртов. Спирты способны проявлять как кислотные, так и основные свойства. Как кислоты, спирты с щелочными и щелочноземельными металлами, а также сильными основаниями (например, амидами или гидридами) реагируют с образованием алкоголятов:
2C2H5OH + 2Na → 2C2H5ONa + H2.
Спирты также проявляют основные свойства – образуют соли с сильными кислотами (соли алкоксония) и дают донорно-акцепторные комплексы с кислотами Льюиса:
R–OH + AlCl3 ⇄ R–OH+AlCl–3.
По связи О–Н → фенолы в большинстве реакциий активнее спиртов, так как эта связь полярнее из-за смещения электронной плотности от кислорода к бензольному кольцу (участие неподеленной электронной пары атома кислорода в системе π-сопряжения). Фенол с растворами щелочей дает соли – феноляты (например, фенолят калия – C6H5OК):
C6H5OH + NaOH = C6H5ONa + H2O.
Превращение спиртов в галогеналканы. Одной из наиболее важных реакций с участием связи C–O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена:
Превращение спиртов в эфиры неорганических кислот. При действии концентрированной азотной кислоты могут быть получены органические нитраты:
C2H5OH + HNO3 → C2H5O–NO2 +H2O.
Превращение спиртов в простые эфиры. Медленно нагревая спирты в присутствии серной кислоты обеспечивается межмолекулярная дегидратация спиртов с образованием простых эфиров:
| 2ROH | ROR + H2O. |
Превращение спиртов в сложные эфиры. Сложные эфиры получаются из спиртов в реакциях с органическими кислотами при нагревании с участием кислотного катализатора (чаще всего, концентрированной серной кислоты). Этот процесс имеет название кислотно-каталитической реакции этерификации:
Реакции окисления спиртов. Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот:
| CH2═CH–CH2OH | CH2═CH–CHO. |
Вторичные – до соответствующих кетонов и кислот:
| R–CHOH–R´ | R–CO–R´. |
Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции восстановления спиртов. Неактивированные гидроксильные группы довольно устойчивы к гидрогенолизу и могут быть восстановлены в довольно жёстких условиях. Реакции гидрирования протекают при высоких температурах и давлении, в качестве катализаторов используются: никель, смешанные оксиды хрома-меди и т. д.
| RCH2OH + H2 | RCH3 + H2O. |
Методы получения
Реакции окисления. Для получения первичных спиртов применяют окисление металлорганических соединений:
R–MgBr + CH2O + H2O → R–CH2OH + Mg(OH)Br.
При окислении алкенов происходит образование двухатомных спиртов:
Реакции восстановления. При мягком восстановлении карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров также образуются спирты:
R–CHO + 2[H] → R–CH2OH;
R–COOR´ + 4[H] → R–CH2OH + R´OH.
Реакции присоединения – активно используется в промышленности при синтезе метанола:
CO + 2H2 CH3OH.
Реакции замещения (гидролиза):
RCH2Cl + OH– → RCH2OH + Cl–,
CH3–Br + NaOH (водн.) CH3–OH + NaBr,
ClCH2–CH2Cl + 2NaOH (водн.) HOCH2–CH2OH + 2NaCl,
C6H5Cl + NaOH (p, 340°С) C6H5OH + NaCl.
Биохимические методы производства. Известный с давних времён способ получения этанола – спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Схематично реакцию можно выразить уравнением [10]:
C6H12O6 → 2C2H5OH + 2CO2.
Кумольный способ получения фенола: (1949 г., Р. Ю. Удрис, П. Г. Сергеев, Б. Д. Кружалов). Получают сразу два продукта – куол и ацетон из кумола. Технология считается практически безотходной (выход полезных продуктов более 99 %) и экономичной. Сейчас кумольный способ используют как основной в мировом производстве фенола:
Применение
Одноатомные насыщенные спирты C3–C9, из которых главным компонентом является изоамиловый спирт, представляют основной компонент сивушного масла – побочного продукта спиртового брожения. Амиловый спирт используется для получения сложных эфиров, для целей парфюмерии и в производстве бездымного пороха. Пирокатехин и гидрохинон (парадигидроксибензол, бензол-1,4-диол) используют в фотографии как проявитель, в производстве красителей, лекарственных веществ. Фенол активно используется для производства фенолформальдегидных смол, поликарбона и эпоксидных смол, нейлона и капрона. Фенол и его производные также обуславливают консервирующие свойства коптильного дыма. Бутанол – компонент в топливных элементах и сырье для производства водорода. В 2007 г. в Великобритании начались продажи биобутанола в качестве добавки к бензину. Метанол используется для выпуска формальдегида, который используется для производства фенолформальдегидных смол и формалина, уксусной кислоты. Метанол используется для заправки гоночных мотоциклов и автомобилей. Этанол широко применяется как растворитель и антисептик: в пищевой промышленности; в качестве автомобильного топлива. Смесь этанола с бензином обозначается буквой Е. Цифрой и буквой Е обозначается процентное содержание этанола. Е85 – означает смесь из 85 % этанола и 15 % бензина. Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующим сгоранием выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Глицерин фармацевтическая и парфюмерная промышленность, смягчитель кожи и тканей, производство взрывчатых веществ.
Урок 7. фенолы и ароматические спирты — Химия — 10 класс
Химия, 10 класс
Урок № 7. Фенолы и ароматические спирты
Перечень вопросов, рассматриваемых в теме: урок посвящён ароматическим спиртам. Рассматривается взаимное влияние атомов в молекуле фенола и как это отражается на химических свойствах.
Глоссарий
Антисептик – противогнилостные средства, предназначенные для предупреждения процессов разложения на поверхности открытых ран, например, в ранах, образующихся после больших операций или ушибов, или для задержания уже начавшихся изменений в крови
Гидрохинон (1,4- дигидроксобензол) – двухатомный ароматический спирт, изомер пирокатехина и резорцина.
Крезол (С6H4(CH3)OH метилфенол, гидрокситолуол) существует в виде трёх изомеров: о-крезол(2-метилфенол), м-крезол (3-метилфенол), п-крезол (4-метилфенол).
Карболовая кислота (фенол) (C6H5OH,гидроксибензол) –ароматический спирт
Кумол (изопропилбензол) – ароматическое соединение, промежуточное соединение при получении фенола.
Пикриновая кислота (C6H2(NO2)3OH 2,4,6-тринитрофенол) – продукт взаимодействия концентрированной азотной кислоты с фенолом.
Пирокатехин (1,2-дигидроксибензол) – двухатомный ароматический спирт, изомер гидрохинона и резорцина.
Резорцин (1,3-дигидроксибензол) – двухатомный ароматический спирт, изомер пирокатехина и гидрохинона.
Фенол (C6H5OH,гидроксибензол) – ароматический спирт. Тривиальное название – карболовая кислота.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Ароматическими спиртами называются соединения, содержащие гидроксильную группу, связанную с атомом углерода ароматического кольца. Простейший представитель – фенол или карболовая кислота — бесцветное кристаллическое вещество с характерным запахом, которое на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворяется в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол ядовит. Широкое распространение фенола в качестве антисептика последовало после публикации работы Джозефа Листера «Антисептические принципы в хирургической практике» в 1867 году, вдохновлённой «Микробной теорией гниения» Луи Пастера. В настоящее время фенол в качестве антисептика в медицине не используется из-за высокой токсичности.
В молекуле фенола две функциональные группы, которые оказывают взаимное влияние. Бензольное кольцо влияет на связь между атомами водорода и кислорода в гидроксогруппе, что облегчает способность водорода замещаться в химических реакциях. Кислотные свойства фенолов выше, чем спиртов. Гидроксильная группа снижает прочность связи в бензольном кольце и облегчает замещение атома водорода в положениях орто- и пара. Для фенолов характерны реакции, протекающие по гидроксогруппе и по бензольному кольцу. Определить его среди других веществ можно по качественной реакции с хлоридом железа. В большом количестве фенол получают двумя способами: из каменноугольной смолы и синтетическим путем (из бензола и пропилена). Этот способ получил название «кумольный», его изобрёл в 1949 году Петр Гаврилович Сергеев. Сущность реакции в окислении кумола кислородом воздуха с последующим разложением промежуточных продуктов серной кислотой. Кроме фенола в этой реакции получают и ацетон.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1.При взаимодействии фенола с натрием выделилось 3,36 л (н.у.) водорода. Определите массу образовавшегося фенолята натрия 2C6H5OH+2Na=2C6H5ONa+H2.
Решение:
- Определение количества вещества водорода: n(H2)=3,36л/22,4л/моль=0,15 моль
- Определение количество вещеста фенолята натрия: n(C6H5ONa)=0,15×2=0,3 моль
- Определение массы фенолята натрия: m(C6H5ONa)=0,3моль х 116 г/моль=34,8 г
Ответ: 34,8 г.
2. Определите вещество B в цепочке превращений: C2H6 → A → C6H14 → C6H6 → C6H5Cl → B → C6H2Br3OH
Решение:
1) Определяем вещество А: C2H6 + Br2 = C2H5Br + HBr, C2H5Br + 2Na+ CH3Br= C3H8+ 2NaBr, C3H8+Br2= C3H7Br +HBr
A- C3H7Br
2) Определяем вещество В: C6H2Br3OH- трибромфенол, значит В- С6H5OH( и его мажно получить из C6H5Cl)
Ответ: С6H5OH
Фенолы, подготовка к ЕГЭ по химии
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».

Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
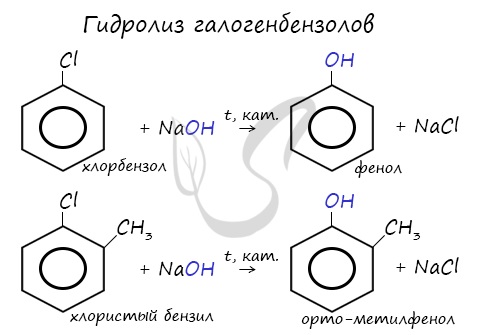
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.

Химические свойства фенолов
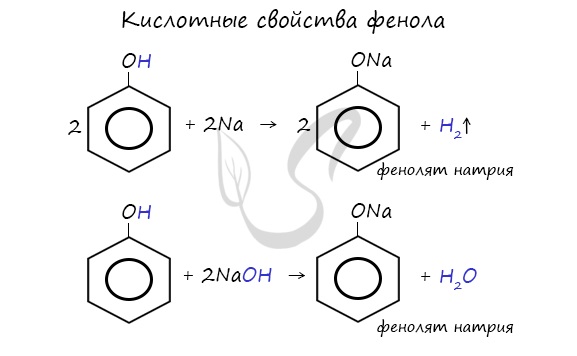
- Кислотные свойства
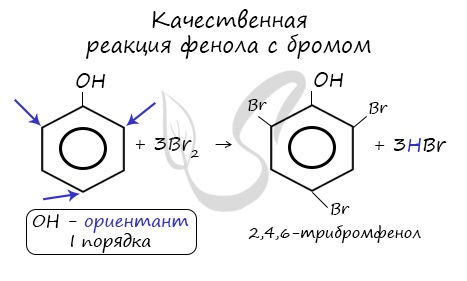
- Галогенирование
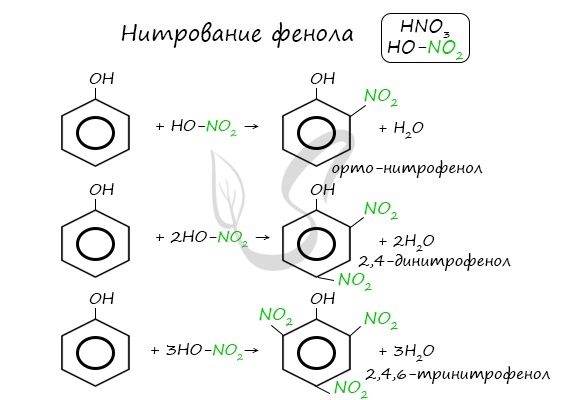
- Реакции с кислотами
- Гидрирование
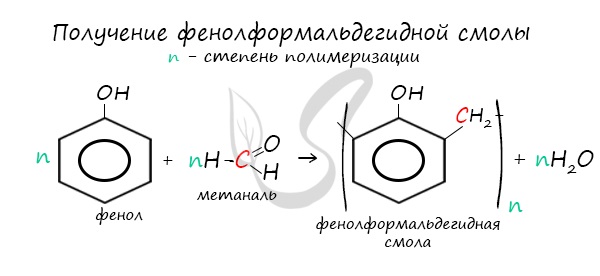
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
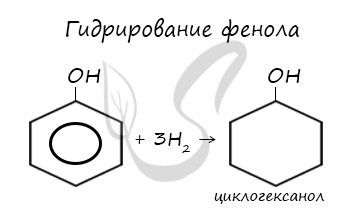
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
фенол | Определение, структура, использование и факты
Фенол , любое из семейства органических соединений, характеризующихся гидроксильной (OH) группой, присоединенной к атому углерода, который является частью ароматического кольца. Помимо общего названия всей семьи, термин фенол также является специфическим названием для своего простейшего члена, моногидроксибензола (C 6 H 5 OH), также известного как бензолол или карболовая кислота.
Фенолформальдегидные смолы термостойкие и водонепроницаемые, хотя и несколько хрупкие.Они образуются в результате реакции фенола с формальдегидом с последующим сшиванием полимерных цепей. Encyclopdia Britannica, Inc.Подробнее по теме
химический состав: спирты и фенолы
Атом кислорода обычно образует две σ-связи с другими атомами; молекула воды h3O — самый простой и распространенный пример ….
Фенолы похожи на спирты, но образуют более прочные водородные связи.Таким образом, они более растворимы в воде, чем спирты, и имеют более высокие температуры кипения. Фенолы встречаются при комнатной температуре в виде бесцветных жидкостей или белых твердых веществ и могут быть высокотоксичными и едкими.
Фенолы широко используются в бытовых продуктах и в качестве промежуточных продуктов для промышленного синтеза. Например, сам фенол используется (в низких концентрациях) в качестве дезинфицирующего средства в бытовых чистящих средствах и в жидкости для полоскания рта. Фенол, возможно, был первым хирургическим антисептиком. В 1865 году британский хирург Джозеф Листер использовал фенол в качестве антисептика для стерилизации своего операционного поля.При таком применении фенола смертность от хирургических ампутаций в палате Листера снизилась с 45 до 15 процентов. Однако фенол довольно токсичен, а концентрированные растворы вызывают тяжелые, но безболезненные ожоги кожи и слизистых оболочек. Менее токсичные фенолы, такие как n -гексилрезорцин, вытеснили сам фенол в леденцах от кашля и других антисептических средствах. Бутилированный гидрокситолуол (BHT) имеет гораздо более низкую токсичность и является распространенным антиоксидантом в пищевых продуктах.
В промышленности фенол используется в качестве исходного материала для производства пластмасс, взрывчатых веществ, таких как пикриновая кислота, и лекарств, таких как аспирин.Обычный фенол гидрохинон является компонентом фотографического проявителя, который восстанавливает открытые кристаллы бромида серебра до черного металлического серебра. Другие замещенные фенолы используются в красильной промышленности для получения интенсивно окрашенных азокрасителей. Смеси фенолов (особенно крезолов) используются в качестве компонентов в консервантах для древесины, таких как креозот.
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняПриродные источники фенолов
Фенолы широко распространены в природе; примеры включают тирозин, одну из стандартных аминокислот, содержащихся в большинстве белков; адреналин (адреналин), гормон-стимулятор, вырабатываемый мозговым веществом надпочечников; серотонин, нейромедиатор головного мозга; и урушиол, раздражитель, выделяемый ядовитым плющом, чтобы животные не поедали его листья.Многие из более сложных фенолов, используемых в качестве ароматизаторов и ароматизаторов, получают из эфирных масел растений. Например, ванилин, основной ароматизатор ванили, выделяют из бобов ванили, а метилсалицилат, который имеет характерный мятный вкус и запах, выделяют из грушанки. Другие фенолы, полученные из растений, включают тимол, выделенный из тимьяна, и эвгенол, выделенный из гвоздики.
Ядовитый плющ ( Toxicodendron radicans ) является естественным источником фенола урушиола — раздражителя, вызывающего сильное воспаление кожи. Уолтер ЧандохаФенол, крезолы (метилфенолы) и другие простые алкилированные фенолы могут быть получены перегонкой каменноугольной смолы или сырой нефти.
Номенклатура фенолов
Многие фенольные соединения были открыты и использовались задолго до того, как химики смогли определить их структуру. Поэтому тривиальные названия (например, ванилин, салициловая кислота, пирокатехол, резорцин, крезол, гидрохинон и эвгенол) часто используются для наиболее распространенных фенольных соединений.
Систематические имена более полезны, потому что систематическое имя определяет фактическую структуру соединения. Если гидроксильная группа является основной функциональной группой фенола, соединение можно назвать замещенным фенолом с атомом углерода 1, несущим гидроксильную группу. Например, систематическое название тимола — 5-метил-2-изопропилфенол. Фенолы с одним другим заместителем могут быть названы с использованием соответствующих номеров или системы орто (1,2), мета (1,3) и пара (1,4).Соединения с другими основными функциональными группами могут быть названы гидроксильной группой в качестве гидроксизаместителя. Например, систематическое название ванилина — 4-гидрокси-3-метоксибензальдегид.
Физические свойства фенолов
Подобно спиртам, фенолы имеют гидроксильные группы, которые могут участвовать в межмолекулярных водородных связях; фактически, фенолы имеют тенденцию к образованию более прочных водородных связей, чем спирты. ( См. химическая связь: Межмолекулярные силы для получения дополнительной информации о водородной связи.) Водородная связь приводит к более высоким температурам плавления и гораздо более высоким температурам кипения для фенолов, чем для углеводородов с аналогичной молекулярной массой. Например, фенол (молекулярная масса [MW] 94, точка кипения [bp] 182 ° C [359,6 ° F]) имеет температуру кипения более чем на 70 градусов выше, чем у толуола (C 6 H 5 CH 3 ; MW 92, т.кип. 111 ° C [231,8 ° F]).
Способность фенолов образовывать прочные водородные связи также увеличивает их растворимость в воде. Фенол растворяется до 9.3-процентный раствор в воде по сравнению с 3,6-процентным раствором циклогексанола в воде. Связь между водой и фенолом необычайно сильна; когда кристаллический фенол не используется во влажной среде, он забирает из воздуха достаточно воды для образования капель жидкости.
Синтез фенолов
Большая часть используемого сегодня фенола производится из бензола либо путем гидролиза хлорбензола, либо путем окисления изопропилбензола (кумола).
Гидролиз хлорбензола (процесс Доу)
Бензол легко превращается в хлорбензол различными способами, одним из которых является процесс Доу.Хлорбензол гидролизуется сильным основанием при высоких температурах с образованием феноксидной соли, которая подкисляется до фенола.
Окисление изопропилбензола
Бензол превращается в изопропилбензол (кумол) обработкой пропиленом и кислотным катализатором. Окисление дает гидропероксид (гидропероксид кумола), который подвергается катализируемой кислотой перегруппировке в фенол и ацетон. Хотя этот процесс кажется более сложным, чем процесс Доу, он выгоден тем, что дает два ценных промышленных продукта: фенол и ацетон.
Общий синтез фенолов
Для получения более сложных фенольных соединений необходим более общий синтез. Реакция гидропероксида кумола довольно специфична для самого фенола. Процесс Доу является несколько более общим, но требуемые жесткие условия часто приводят к низким выходам, и они могут разрушить любые другие функциональные группы в молекуле. Более мягкая и более общая реакция — это диазотирование ариламина (производное анилина, C 6 H 5 NH 2 ) с образованием соли диазония, которая гидролизуется до фенола.Большинство функциональных групп могут выжить при этой методике, если они стабильны в присутствии разбавленной кислоты.
Реакции фенолов
По своему химическому составу фенолы во многом сходны с химическим составом спиртов. Например, фенолы реагируют с кислотами с образованием сложных эфиров, а ионы феноксида (ArO — ) могут быть хорошими нуклеофилами в синтезе эфира Вильямсона.
Хотя фенолы часто рассматриваются просто как ароматические спирты, они обладают несколько другими свойствами.Наиболее очевидное отличие — повышенная кислотность фенолов. Фенолы не такие кислые, как карбоновые кислоты, но они гораздо более кислые, чем алифатические спирты, и они более кислые, чем вода. В отличие от простых спиртов, большинство фенолов полностью депротонируется гидроксидом натрия (NaOH).
Подобно другим спиртам, фенолы подвергаются окислению, но они дают продукты, отличные от тех, которые наблюдаются с алифатическими спиртами. Например, хромовая кислота окисляет большинство фенолов до конъюгированных 1,4-дикетонов, называемых хинонами.В присутствии кислорода в воздухе многие фенолы медленно окисляются с образованием темных смесей, содержащих хиноны.
Гидрохинон (1,4-бензолдиол) представляет собой соединение, которое особенно легко окисляется, потому что у него есть две гидроксильные группы в правильном соотношении, чтобы отдавать атомы водорода с образованием хинона. Гидрохинон используется в проявке фотопленки путем восстановления активированного (подвергнутого воздействию света) бромида серебра (AgBr) до черного металлического серебра (Ag ↓). Необработанные зерна бромистого серебра реагируют медленнее, чем открытые зерна.
Фенолы обладают высокой реакционной способностью по отношению к электрофильному ароматическому замещению, поскольку несвязывающие электроны на кислороде стабилизируют промежуточный катион. Эта стабилизация наиболее эффективна для атаки в позиции кольца ortho или para ; следовательно, гидроксильная группа фенола считается активирующей (т.е. ее присутствие заставляет ароматическое кольцо быть более реакционноспособным, чем бензол) и направлять орто- или пара .
Пикриновая кислота (2,4,6-тринитрофенол) — важное взрывчатое вещество, которое использовалось во время Первой мировой войны. Эффективное взрывчатое вещество требует высокой доли окисляющих групп, таких как нитрогруппы. Однако нитрогруппы сильно дезактивируют (то есть делают ароматическое кольцо менее реактивным), и часто бывает трудно добавить вторую или третью нитрогруппу к ароматическому соединению. Три нитрогруппы легче замещаются на фенол, поскольку сильная активация гидроксильной группы помогает противодействовать дезактивации первой и второй нитрогрупп.
Ионы феноксида, образующиеся при обработке фенола гидроксидом натрия, настолько сильно активируются, что подвергаются электрофильному ароматическому замещению даже с очень слабыми электрофилами, такими как диоксид углерода (CO 2 ). Эта реакция используется в коммерческих целях для получения салициловой кислоты для преобразования в аспирин и метилсалицилат.
Образование фенолформальдегидных смол
Фенольные смолы составляют большую часть производства фенола.Фенолформальдегидная смола под торговым названием бакелит была одним из первых пластиков, изобретенных американским промышленным химиком Лео Бэкеландом и запатентованных в 1909 году. Фенолформальдегидные смолы недорогие, термостойкие и водонепроницаемые, хотя и несколько хрупкие. Полимеризация фенола с формальдегидом включает электрофильное ароматическое замещение в положениях орто и пара фенола (вероятно, несколько случайно) с последующим поперечным сшиванием полимерных цепей.
Лерой Г. УэйдУзнайте больше в этих связанных статьях Britannica:
,C6H5OH
Вылейте омонимы статей, voir Phénol.| Фенол | |||
|---|---|---|---|
| Структура феноля | |||
| Général | |||
| Номинал IUPAC | Фенол | ||
| Синонимы | Acide phénique Acide carbolique | ||
| N или CAS | 108-95-2 | ||
| N или EINECS | 203-632-7 | ||
| Лекарственный банк | DB03255 | ||
| FEMA | 3223 | ||
| УЛЫБКИ | |||
| ИНЧИ | InChI = 1 / C6H6O / c7-6-4-2-1-3-5-6 / h2-5,7H | ||
| Внешний вид | cristaux incolores à jaunes or rose clair, d’odeur caractéristique. [1] | ||
| Propriétés chimiques | |||
| Formule brute | C 6 H 6 O [Изомеры] | ||
| Masse molaire | 94,1112 г ∙ моль -1 C 76,57%, H 6,43%, O 17%, | ||
| пКа | (pKa PhOH 2 + / PhOH ) — 6,4 (pKa PhOH / PhO — ) 9.95 | ||
| Собственное телосложение | |||
| T ° fusion | 43 ° C [1] | ||
| T ° ébullition | 182 ° C [1] | ||
| Solubilité | 9,8 г / 100 мл воды | ||
| Объемная масса | 1,06 г / см³ [1] | ||
| Авто-воспаление | 715 ° C [1] | ||
| Point d’éclair | 79 ° C (ок.е.) [1] | ||
| Limites d’explosivité dans l’air | en volume% dans l’air: 1.36-10 [1] | ||
| Pression de vapeur saturante | à 20 ° C: 47 Па [1] | ||
| Меры предосторожности | |||
| Директива 67/548 / EEC | |||
| |||
| Числовой индекс : 604-001-00-2 Классификация : Символы : Фразы R : Фразы S : | |||
| Фразы R: 23/24/25, 34, 48/20/21/22, 68, | |||
| Фразы S: (1/2), 24/25, 26, 28, 36/37/39, 45, | |||
| Транспорт [3] | |||
| Код Kemler: 60 : токсичный или токсичный материал Номер ONU: 1671 : PHÉNOL33 SOLIDE Класс .1 Этикет: 6.1 : Matières toxiques Emballage: Groupe d’emballage II: matières moyennement dangereuses; Код Kemler: 60 : токсичный или токсичный материал Номер ONU: 2312 : PHÉNOL FONDU Класс 1 Этикет: 6.1 : Matières toxiques Emballage: Groupe d’emballage II: matières moyennement dangereuses; Код Kemler: 60 : токсичный материал или уровень токсичности Номер ONU: 2821 : PHÉNOL EN SOLUTION Класс 9033 : 6.1 : Matières toxiques Emballage: Groupe d’emballage II / III: matières moyennement / faiblement dangereuses. | |||
| NFPA 704 | |||
| SIMDUT [4] | |||
| D1A, E, D1A : Matière très toxique ayant des effets immédiats graves Transport des marchandises dangereuses: classe 6.1 groupe II E : Matière corrosive nécrose de la peau chez l’animal Divulgation à de% Des Ingrédients | |||
| SGH [5] | |||
| Опасно h401, h411, h414, h431, h441, h473, h401 : Toxique en cas d’ingestion | |||
| Классификация du CIRC | |||
| Groupe 3: Inclassable quancérogénicité pour l’Homme [2] | |||
| Écotoxicologie | |||
| ЛогП | 1.46 [1] | ||
| Unités du SI & CNTP, обратная индикация sauf. | |||
Le phénol , appelé aussi hydroxybenzène , acide phénique , ou encore acide carbolique , est composé d’un cycle aromatique бензо-ароматический углеводород. C’est la plus simple molécule de la famille des phénols.
Репрезентации
Модные петлицы и батоны |
Origine
Découvert à l’état impur par Johann Rudolf Glauber en 1650 à partir de la distillation du goudron de houille.Il le décrit Com « une huile vive et rouge de sang qui assèche et guérit tous les ulcères humides «. En 1834, Фридрих Фердинанд Рунге parvient à l’isoler et le nomme alors acide carbolique . Синтезатор и производство в 1889 году на фирме BASF.
Énol
Le phénol est aussi un énol (dérivé alcoolique Possédant un fonction alcène). Il est la forme tautomère de la cyclohexa-2,4-diènone. Mais contrairement à la major des enols, il est la forme la plus стабильное сравнение a sa cétone tautomère, стабильное, должное en major à la présence d’un cycle aromatique, non présent dans la cétone Соответствующий.
Собственное телосложение
Le phénol — это постоянная криоскопическая криоскопия при 6,84 ° C ∙ кг / моль и постоянная молекулярная ébullioscopique de 3,54 ° C ∙ кг / мол. De couleur blanche à l’état pur, il atendance à s’oxyder legèrement au contact de l’air pour donner des traces de quinones qui le colorent en rose, puis en rouge
Производство
- En 2005, le phénol a été produit à huteur de 8 800 000 тонн в мире 26% в США и 2% во Франции. Основным производителем является INEOS Phenol [6] (Royaume Uni) с производственной мощностью 1 600 000 т [7] .
- Le phénol est produit aujourd’hui à plus de 85% partir du cumène. Ce procédé mis aux point en 1944 par Hock et Lang est utilisé depuis les années 1950. Son avantage réside dans sa simplicité de mise en oeuvre, son bon rendement (90%) и le fait d’obtenir phénol et acétone à partir du cumène disponible en grande Quantité par pétrochimie. Il consiste en une oxydation du cumène par l’air fournissant l’hyperoxyde de cumyle en tant qu’intermédiaire qui en midieu acide aqueux fournit le phénol et l’acétone.
Использование
Sécurité
Le phénol est fortement corrosif pour les organismes vivants. Même une solution aqueuse à 1% génèrera des sevères раздражения.
Les brûlures au phénol sont très douloureuses et longues à guérir. De plus, elles peuvent être suivies de осложнения, graves pouvant mener à la mort de par laxicité de ce composé et sa capacity à pénétrer dans l’organisme en traversant la peau.
Voir aussi
Примечания и ссылки
- ↑ a, b, c, d, e, f, g, h et i PHENOL, fiche de sécurité du Program International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Рабочая группа МАИР по оценке канцерогенных рисков для людей, «Глобальные оценки канцерогенности для человека, Группа 3: Inclassables Quant à leur cancérogénicité pour l’Homme» для http: // монографии.iarc.fr , 16 января 2009 г., CIRC. Консультации по 22 августа 2009 г.
- ↑ Entrée de «Phenol» в базе данных химикатов GESTIS de la BGIA (Organisme Allmand De la sécurité et de la santé au travail) (allemand, anglais), accès le 25 aoét 2009 (JavaScript )
- ↑ «Phénol» на базе химикатов Reptox от CSST (канадская организация, ответственная за безопасность и безопасность на работе), обратитесь к 25 апреля 2009 г.
- ↑ Числовой индекс 604-001-00-2 в таблице 3.1 приложения VI Регламента CE N ° 1272/2008 (16 декабря 2008 г.)
- ↑ (en) Сайт организации
- ↑ Données sur la production industrialelle de phénol
- Portail de la chimie
- Портэйл-де-ла-Аптека
Категории: Химические токсичные продукты | Продукт химического коррозионного | Фенол | Антисептик
,
Leave A Comment