Контрольная работа № 1 по теме «Строение и классификация органических соединений». 10 класс
Контрольная работа № 1 по теме «Строение и классификация органических соединений». 10 класс
Вариант 1
1. Функциональная группа –ОН соответствует классу соединений:
А. Альдегидов. Б. Аминов. В. Карбоновых кислот. Г. Спиртов.
2. Термин «органическая химия» ввел: А. Й. Берцелиус. Б. А. Бутлеров. В. А. Кекуле. Г. Д. Менделеев.
3. Тип химической связи между атомами углерода в молекуле вещества, формула которого С2Н4:
А. Одинарная. Б. Двойная. В. Тройная.
4. Общая формула СnН2n соответствует: А. Алканам. Б. Алкенам. В. Алкинам. Г. Аренам.
5. Молекулярная формула углеводорода с относительной молекулярной массой 56:
А. С4Н10. Б. С4Н8. В. С4Н6. Г. С3Н8.
6. Следующие признаки: sp2-гибридизация, длина углерод-углеродной связи 0,134 нм, угол связи 1200 характерны для молекулы: А. Бензола. Б. Этана. В. Этина. Г. Этена.
7. Вещества, формулы которых СН2 = СН2 и СН2 = СН – СН2 – СН3, являются:
А. Веществами разных классов. Б. Гомологами. В. Изомерами. Г. Одним и тем же веществом.
8. Установите соответствие.
Формула соединения | Класс соединения |
А. С17Н35СООН | 1. Алканы |
Б. С6Н6 | 2. Алкены |
В. НСНО | 3. Алкины. |
Г. С2Н5ОН | 4. Арены |
5. Альдегиды | |
6. Карбоновые кислоты | |
7. Спирты |
9. Массовая доля углерода в пропане С3Н8 равна: А. 18,8%. Б. 40%. В. 60%. Г. 81,82%.
10. Углеводород имеет плотность по воздуху 1,034, массовая доля углерода в нем 80%. Определите формулу углеводорода и назовите его.
11. Выведите истинную формулу органического соединения, содержащего 40,03% С, 6,67% Н, и 53,30% О. Молярная масса данного соединения равна 180 г/моль. Назовите вещество.
Молярная масса данного соединения равна 180 г/моль. Назовите вещество.
12. Назовите по систематической номенклатуре следующие вещества:
а) СН3 – СН – СН – СН3 б) СН2 = СН – СН2 – СН3
׀ ׀ ׀ ׀
СН3 СН3 СН3 С2Н5
13. Напишите структурные формулы: а) 2-метилпропана; б) 3,3-диметилгексана; в) 3-метилпентана.
14. Для вещества (а) из задания 12 составьте формулу гомолога (с более длинной углеродной цепью) и назовите его.
15. Укажите формулу 2,2,3-триметилбутана:
А) CH3-CH(CH3)-CH(CH3)2; Б) (CH3)2CH-CH2-CH(CH3)2; В) CH3-CH(CH3)-C(CH3)3; Г) CH3-CH(CH3)-CH2-CH3
16. Изомером 3,4-диметилгексана является:
Изомером 3,4-диметилгексана является:
а) 4,4,5-триметилгексан;
б) 4,4-диметилгептан;
в) 2,2,3-триметилпентан;
г) 2-метил-3-этилгексан.
Контрольная работа № 1 по теме «Строение и классификация органических соединений». 10 класс
Вариант 2
1. Функциональная группа –NН2 соответствует классу соединений:
А. Альдегидов. Б. Аминов. В. Карбоновых кислот. Г. Спиртов.
2. Автором теории химического строения органических соединений является:
А. А. Бутлеров. Б. А. Лавуазье. В. М. Ломоносов. Г. Д. Менделеев.
3. Тип химической связи между атомами углерода в молекуле вещества, формула которого С2Н6:
А. Одинарная. Б. Двойная. В. Тройная.
4. Общая формула СnН2n–2 соответствует: А. Алканам. Б. Алкенам. В. Алкинам. Г. Аренам.
5. Молекулярная формула углеводорода с относительной молекулярной массой 30:
А. С2Н6. Б. С3Н8. В. С4Н8. Г. С5Н12.
6. Следующие признаки: sp-гибридизация, длина углерод-углеродной связи 0,120 нм, угол связи 1800 характерны для молекулы: А. Бензола. Б. Этана. В. Этина. Г. Этена.
Бензола. Б. Этана. В. Этина. Г. Этена.
7. Вещества, формулы которых СН3 – СН2ОН и СН3 – СНО, являются:
А. Веществами разных классов. Б. Гомологами. В. Изомерами. Г. Одним и тем же веществом.
8. Установите соответствие.
Формула соединения | Класс соединения |
А. С2Н2 | 1. Алканы |
Б. СН3СН2СООН | 2. Алкены |
В. СН3ОН | 3. Алкины. |
Г. С3Н8 | 4. Арены |
5. Альдегиды | |
6. Карбоновые кислоты | |
7. Спирты |
9. Массовая доля углерода в ацетилене С2Н2 равна:
А. 77,7%. Б. 83,3%. В. 92,3%. Г. 93,2%.
10. Выведите молекулярную формулу вещества по следующим данным: массовые доли углерода, кислорода и водорода соответственно равны 38,7%, 51,6% и 9,7%. Относительная плотность паров этого вещества по водороду равна 31. Назовите вещество.
Назовите вещество.
11. Выведите формулу соединения, содержащего 25% водорода и 75% углерода. Назовите вещество.
12. Назовите по систематической номенклатуре следующие вещества:
а) СН3 – СН – СН – СН2 – СН — СН3 б) СН2 = С – СН3
ǀ ǀ ǀ ǀ
СН3 СН3 СН3 СН2— СН3
13. Напишите структурные формулы: а) 2,3-диметилбутана; б) 3-этилгептана; в) 2,2-диметилпропана.
14. Для вещества (а) из задания 12 составьте формулу гомолога (с более короткой углеродной цепью) и назовите его.
15. Отметьте формулы гомологов вещества CH3CH(C2H5)CH2CH3:
а) 3-метилпентан;
б) 2-этилгексан;
в) 2,2-диметилгексан;
г) 3-метилгептан.
16. Укажите формулу 2,3,3-триметилпентана:
а) СН3-СН2-С(СН3)2-СН3; б) СН3-СН(СН3)- С(СН3)2-СН2-СН3; в) СН3-С(СН3)2-С(СН3)-СН2-СН3.
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/350548-kontrolnaja-rabota1-po-teme-stroenie-i-klass
Сайт преподавателя биологии и химии Дмитрия Андреевича Соловкова
Обновлены задания 3, 6, 11, 27 и 28 по биологии — добавлены новые номера из ЕГЭ-2020.
Рубрика: АбитуриентуОбновил задания 1, 2, 20 и 21 в первой части — добавил около 30 новых номеров.
Рубрика: АбитуриентуЗа последний месяц обновлены все задания второй части экзамена (№№30-35) — добавлены задания образца 2020 года. Согласно проекту ЕГЭ-2021, изменений во второй части по химии не планируется.
Рубрика: АбитуриентуОбновлено задание 33 — добавлено около 15 новых цепочек.
Рубрика: Без рубрики |В задания 34 добавлен новый раздел — задачи на атомистику и молярные соотношения.
Обновлены задания 32 и 35 — добавлены задачи 2020 года
Рубрика: Абитуриенту |Обновлены задания 30 и 31 — добавлены номера образца 2020 года. Посмотреть их можно здесь.
Рубрика: АбитуриентуЗадания 19 и 20 первой части обновлены в соответствии со спецификатором ЕГЭ-2021 года. В задание 24 добавлено около 10 номеров.
Выложены последние 2 презентации по цитологии — репликация ДНК и биосинтез белка. Таким образом, полностью закончен целый раздел общей биологии. Всем рекомендую для подготовки к ЕГЭ.
Всем рекомендую для подготовки к ЕГЭ.
Добавлены очередные презентации по цитологии: по диссимиляции и автотрофному питанию
Составьте и решите задачу используя следующие физические величины относительная молекулярная масса масса молярная масса количество вещества
1,2 моль х л
Zn+2HCl=ZnCl2+h3
1 22,4
х=1,2*22,4=26,88 л
х г 1,4 л
2NaOH + CO2 = Na2CO3 + h3O
2 моль 1 моль
М=40 г/моль Vm=22,4 л/моль
По уравнению реакции гидроксида натрия расходуется в 2 раза больше, т.
 е. 0,0625*2=0,125 моль
е. 0,0625*2=0,125 мольm(NaOH) = M*n = 40*0,125=5 г
W(NaOH)% = m(вещества)*100%/m(раствора) = 5*100/40 = 12,5%
C2h5oh+ch4cooh=ch4cooch3h5o+h3o m c2h5oh=200;100×96=192 n c2h5oh=192:2240=0,09моль M 200:100×60=120гр 120:0,8=150 мл:2240=0,07 Ищем по сн3соон 0.07-0,05=0,02 0.02х88=1,76 грамм
M(C)=12 г/моль
ню(С) = 6/12 = 0.5 моль
ню(О2) = 0.5 моль
V(O2) = 22.4 *0.5 = 11.2 л — это мы нашли объем кислорода
сейчас найдем объем воздуха, если он содержит 21 % кислорода
составим пропорцию
11.
 2 л — 21%
2 л — 21%х — 100%
х = 53.3 л воздуха
M(CaCO3) = 100 г/моль
n = 10/100 = 0.1 моль
M(CO2) = 44г/моль
m(CO2) = 44*0.1 = 4.4 г
Ответ : 4.4г
Контрольная работа по теме «Предельные углеводороды»
Контрольная работа по теме «Предельные углеводороды»
Задачи на нахождение молекулярной формулы углеводорода.
Задача 1 (3 балла)
При сжигании углеводорода массой 87г образовалось 134,4л углекислого газа и 135г воды. Относительная плотность вещества по воздуху равна 2. Найдите молекулярную формулу углеводорода.
Найдите молекулярную формулу углеводорода.
___________________________________________________________
Задача 2 (3 балла)
При сжигании углеводорода объёмом 4,48л образовалось 26,4г
углекислого газа и 14,4г воды. Относительная плотность вещества по метану равна 2,75. Найдите молекулярную формулу углеводорода.
____________________________________________________________
Задача 3 (3 балла)
При сжигании углеводорода массой 6,4г образовалось 19,8г углекислого газа и 9г воды. Относительная плотность вещества по кислороду равна 4. Найдите молекулярную формулу углеводорода.
______________________________________________________________
Задача 4 (3 балла)
При сжигании углеводорода массой 7,2г образовалось 11,2л (н.у.) углекислого газа и 10,8г воды. Относительная плотность паров этого вещества по водороду равна 36.
______________________________________________________________
Задача 5 (3 балла)
При сжигании углеводорода массой 0,56г образовалось 0,896л (н.у.)
углекислого газа и 0,72г воды. Относительная плотность вещества по азоту равна 2. Определите молекулярную формулу углеводорода.
______________________________________________________________
Задача 6 (3 балла)
При сжигании углеводорода массой 8г образовалось 11,2л (н.у.) углекислого газа и 18г воды. Относительная плотность вещества по водороду равна 8. Определите молекулярную формулу углеводорода.
______________________________________________________________
Задача 7 (3 балла)
При сжигании углеводорода массой 1,44г образовалось 2,24л (н.у.) углекислого газа и 2,16г воды. Относительная плотность вещества по
кислороду равна 2,25. Определите молекулярную формулу углеводорода.
Определите молекулярную формулу углеводорода.
______________________________________________________________
Задача 8 (3 балла)
Сожгли 12,8г углеводорода , при этом получили 39,6г углекислого газа и 18г воды. Относительная плотность этого вещества по кислороду равна 4. Определите молекулярную формулу углеводорода.
Задача 9 (3 балла)
При сжигании 21г углеводорода получили 33,6л (н.у.) углекислого газа и 27г воды. Относительная плотность вещества по азоту равна 3. Определите молекулярную формулу углеводорода.
_____________________________________________________________
Задача 10 (3 балла)
При горении углеводорода массой 3,36г получили 10,56г углекислого газа и 4,32г воды. Относительная плотность вещества по метану равна 3,5. Установите молекулярную формулу углеводорода.
______________________________________________________________
Задача 11 (3 балла)
При сжигании 25,2г углеводорода образовалось 79,2г углекислого газа и 32,4г воды. Относительная плотность углеводорода по азоту равна 1,5. Определите молекулярную формулу углеводорода.
Относительная плотность углеводорода по азоту равна 1,5. Определите молекулярную формулу углеводорода.
______________________________________________________________
Задача 12 (3 балла)
При сжигании углеводорода массой 14,5г получили 22,4л (н.у.)
углекислого газа и 22,5г воды. Относительная плотность углеводорода
по водороду равна 29. Определите молекулярную формулу углеводорода. _____________________________________________________________
Задача 13 (3 балла)
При сжигании 58г углеводорода образовалось 176г углекислого газа и 90г воды. Относительная плотность вещества по воздуху равна 2.
Определите молекулярную формулу углеводорода.
_____________________________________________________________
Задача 14 (3 балла)
После сжигания углеводорода массой 1,14г получили 1,792л (н.у.) углекислого газа и 1,62г воды. Относительная плотность вещества по водороду равна 57. Установите молекулярную формулу углеводорода.
Относительная плотность вещества по водороду равна 57. Установите молекулярную формулу углеводорода.
_____________________________________________________________
Задача 15 (3 балла)
После сжигания 5,6л (н.у.) углеводорода образовалось 22г углекислого газа и 13,5г воды. Определите молекулярную формулу углеводорода, если его относительная плотность по водороду равна 15.
______________________________________________________________
Задача 16 (3 балла)
При сжигании углеводорода массой 40г получили 62,72л (н.у.)
углекислого газа и 57,6г воды. Относительная плотность углеводорода по водороду равна 50. Определите молекулярную формулу углеводорода.
Контрольная работа по теме «Предельные углеводороды»
Задача 1 (2 балла)
Рассчитайте объём кислорода, который потребуется для сжигания бутана
объёмом 4,48л.
______________________________________________________________
Задача 2 (2 балла)
Рассчитайте объём кислорода, который потребуется для сжигания пропана
объёмом 8,96л.
______________________________________________________________
Задача 3 (2 балла)
Рассчитайте объём кислорода, который потребуется для сгорания метана объёмом 5,6л.
______________________________________________________________
Задача 4 (2 балла)
Рассчитайте объём кислорода, который потребуется для сжигания смеси метана объёмом 2,24л.
______________________________________________________________
Задача 5 (2 балла)
Какой объём (н.у.) углекислого газа образуется при горении пропана массой 100г.
______________________________________________________________
Задача 6 (2 балла)
Какой объём этана (н. у.) можно получить при взаимодействии йодметана массой 284г с натрием массой 50г?
у.) можно получить при взаимодействии йодметана массой 284г с натрием массой 50г?
______________________________________________________________
Задача 7 (2 балла)
Какой объем кислорода необходим для сжигания 150 грамм пентана?
______________________________________________________________
Контрольная работа по теме «Предельные углеводороды»
Вариант 1.
Решите тест, ценность одного задания 0,2 балла.
1. Какова общая формула углеводородов ряда алканов:
1) CnH2n 2) CnHn 3) CnH2n-2 4) CnH2n+2
2. Какая химическая связь в алканах:
1) двойная 2) одинарная 3) σ-связь 4) π-связь
3. Какую геометрическую форму имеют молекулы предельных углеводородов:
1) тетраэдрическую 2) линейную 3) объемную 4) плоскую
4. Какая длина связи С-С и валентный угол в молекулах алканов:
Какая длина связи С-С и валентный угол в молекулах алканов:
1) 0,120 нм, 120̊ 2) 0,154 нм, 109̊28̍ 3) 0,140 нм, 120̊ 4) 0,134 нм, 109̊28̍
5. Какой тип реакции характерен для свойств алканов, обусловленных σ-связью С-Н:
1) замещения 2) соединения 3) обмена 4) разложения
6. Назвать углеводород разветвленного (изомерного) строения:
С2Н5-CH-СН2-СН-СН2-СН3
|
СН3
1) дихлоризогептан 2) 2-метилгептан 3) 3-метилгептан 4) 5-метилгептан
7. Чем по отношению друг к другу являются вещества пропан и н-декан
1) изомерами 2) гомологами 3) хлорпроизводными 4) углеводородами нормального строения
8. Чем различаются изомеры:
1) химическими свойствами 2) химической активностью
3) физическими свойствами 4) химическим строением
9. Чем отличается одновалентный радикал метана от молекулы метана:
1) имеет неспаренный электрон 2) является нейтральной частицей
3) нереакционноспособный 4) реакционноспособный
10.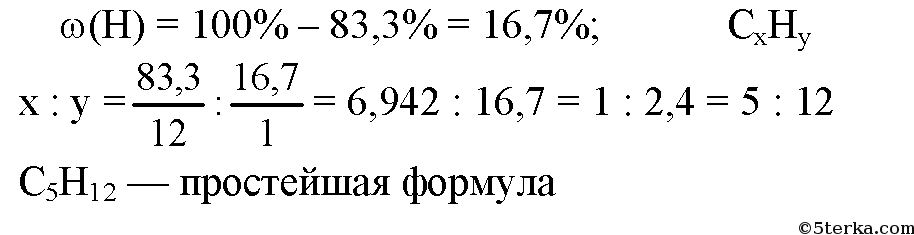 Сколько изомеров характерно для октана:
Сколько изомеров характерно для октана:
1) 3 2) 5 3) 9 4) 18
11. Реакция взаимодействия хлоралканов в присутствии металлического натрия называется реакцией:
1) Кучерова 2) Вюрца 3) Зинина 4) Фиттинга
12. Укажите ряд, в котором прослеживаются только формулы типичных алканов:
1) CH4, C2H4, C5H12 2) C2H6O, C2H6, C10H22
3) C40H82, C15H32, C8H18 4) CH3Cl, CH2Cl2, CHCl3
13. Сколько разных веществ изображено на рисунке:
1) 7 2) 4 3) 3 4) 2
14. Веществом «Х» в цепочке превращений CH4→CH3Cl→CH2Cl2→CHCl3Х является
1) хлороформ 2) четыреххлорметан 3) трихлорметан 4) двахлорметан
15. Автор теории строения органических веществ:
Автор теории строения органических веществ:
1) Д.И. Менделеев 2) А.М. Бутлеров
3) Ф. Кекуле 4) Й. Берцелиус
Контрольная работа по теме «Предельные углеводороды»
Вариант 2.
Решите тест, ценность одного задания 0,2 балла.
1. Автор теории строения органических веществ:
1) Д.И. Менделеев 2) А.М. Бутлеров
3) Ф. Кекуле 4) Й. Берцелиус
2. Сколько разных веществ изображено на рисунке:
1) 7 2) 4 3) 3 4) 2
3. Реакция взаимодействия хлоралканов в присутствии металлического натрия называется реакцией:
1) Кучерова 2) Вюрца 3) Зинина 4) Фиттинга
4. Веществом «Х» в цепочке превращений CH4→CH3Cl→CH2Cl2→CHCl3Х является
1) хлороформ 2) четыреххлорметан 3) трихлорметан 4) двахлорметан
5. Какова общая формула углеводородов ряда алканов:
Какова общая формула углеводородов ряда алканов:
1) CnH2n 2) CnHn 3) CnH2n-2 4) CnH2n+2
6. Какую геометрическую форму имеют молекулы предельных углеводородов:
1) тетраэдрическую 2) линейную 3) объемную 4) плоскую
7. Сколько изомеров характерно для октана:
1) 3 2) 5 3) 9 4) 18
8. Укажите ряд, в котором прослеживаются только формулы типичных алканов:
1) CH4, C2H4, C5H12 2) C2H6O, C2H6, C10H22
3) C40H82, C15H32, C8H18 4) CH3Cl, CH2Cl2, CHCl3
9. Чем отличается одновалентный радикал метана от молекулы метана:
1) имеет неспаренный электрон 2) является нейтральной частицей
3) нереакционноспособный 4) реакционноспособный
10. Чем по отношению друг к другу являются вещества пропан и н-декан
Чем по отношению друг к другу являются вещества пропан и н-декан
1) изомерами 2) гомологами 3) хлорпроизводными 4) углеводородами нормального строения
11. Назвать углеводород разветвленного (изомерного) строения:
С2Н5-CH-СН2-СН-СН2-СН3
|
СН3
1) дихлоризогептан 2) 2-метилгептан 3) 3-метилгептан 4) 5-метилгептан
12. Какая химическая связь в алканах:
1) двойная 2) одинарная 3) σ-связь 4) π-связь
13. Какая длина связи С-С и валентный угол в молекулах алканов:
1) 0,120 нм, 120̊ 2) 0,154 нм, 109̊28̍ 3) 0,140 нм, 120̊ 4) 0,134 нм, 109̊28̍
14. Чем различаются изомеры:
1) химическими свойствами 2) химической активностью
3) физическими свойствами 4) химическим строением
15. Какой тип реакции характерен для свойств алканов, обусловленных σ-связью С-Н:
1) замещения 2) соединения 3) обмена 4) разложения
Контрольная работа по теме «Предельные углеводороды»
Вариант 1
1. Изобразите структурные формулы изомеров алкана С8Н18 (4-5 изомера), назовите их. К октану напишите также 2 гомолога, назовите их. (1 балл)
Изобразите структурные формулы изомеров алкана С8Н18 (4-5 изомера), назовите их. К октану напишите также 2 гомолога, назовите их. (1 балл)
2. Напишите структурные формулы соединений по их названиям (1 балл):
А) 3-метилбутан;
Б) 3-бутилгептан;
В) 2-этил-3-пропилнонан;
Г) 2,2-диметилоктан;
Д) этан
3. Какие из перечисленных ниже соединений являются изомерами (1 балл):
А) 2-метилгексан; Б) 3-метилгептан; В) 3-этилгексан;
Г) 2,2-диметилгептан; Д) 2,4-диметилгексан; Е) 2-метилоктан?
Напишите структурные формулы изомеров.
______________________________________________________________
Вариант 2
1. Изобразите структурные формулы изомеров алкана С5Н12 (4-5 изомера), назовите их. К пентану напишите также 2 гомолога, назовите их (1 балл).
2. Напишите структурные формулы соединений по их названиям (1 балл):
А) 2-метилоктан;
Б) 2,5,6 – триметилнонан;
В) 3,3 – диэтилгексан;
Г) 2-метилбутан;
Д) метан
3. Какие из перечисленных ниже соединений являются изомерами (1 балл):
А) 2-метилбутан; Б) 2,3 – диметилбутан; Г) н-гексан;
Д) 2,2-диметилбутан; Е) н-бутан?
Напишите структурные формулы изомеров.
______________________________________________________________
Вариант 3
1. Изобразите структурные формулы изомеров алкана С9Н20 (4-5 изомера), назовите их. К нонану — напишите 2 гомолога, назовите их (1 балл).
2. Напишите структурные формулы соединений по их названиям(1 балл):
А) 3-метил-4-этилгексан;
Б) 2,3-диметилбутан;
В) 2,2-диметилгептан;
Г) 3-этилгексан;
Д) пентан
3. Какие из перечисленных ниже соединений являются изомерами (1 балл):
Какие из перечисленных ниже соединений являются изомерами (1 балл):
А) 2-метилбутан; Б) 2,3 – диметилбутан; Г) н-гексан;
Д) 2,2-диметилбутан; Е) н-бутан?
Напишите структурные формулы изомеров.
______________________________________________________________
Вариант 4
1. Изобразите структурные формулы изомеров бутана, назовите их.
Напишите 3 гомолога бутана, назовите их.
2. Напишите структурные формулы соединений по их названиям:
А) 2,2-диметилпропан;
Б) н-пентан;
В) 3-метил-4-этилгексан;
Г) 2,4 – диметил-3,4-диэтилоктан;
Д) 2,3-диметилгексан
3. Какие из перечисленных ниже соединений являются изомерами (1 балл):
А) 2-метилгексан; Б) 3-метилгептан; В) 3-этилгексан;
Г) 2,2-диметилгептан; Д) 2,4-диметилгексан; Е) 2-метилоктан?
Напишите структурные формулы изомеров.
Напишите формулу 2-метилбутана.
Дайте название следующим веществам:
б) СН3 – СН – СН2 – СН – СН3
СН3 СН3
Напишите формулу 3-метилпентана.
Дайте название следующим веществам:
Напишите формулу 2,2-диметилгексана.
Дайте название следующим веществам:
Напишите формулу 3-метил-4-этилгептана.
Дайте название следующим веществам:
Информио
×Неверный логин или пароль
×Все поля являются обязательными для заполнения
×Сервис «Комментарии» — это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения — заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.

- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
×Информация доступна только для зарегистрированных пользователей.
×Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
В случае неверно указанных данных организация ответственности не несёт.
Поиск молекулярной массы
Примечание: Этот поиск ведется по молекулярной массе на основе атомных масс одного (наиболее распространенного) изотопа. Эти веса могут значительно отличаться от молекулярных. веса основаны на средних атомных массах. Молекулярный веса, указанные в других местах на этом сайте, основаны на средние атомные массы.
Пожалуйста, следуйте инструкциям ниже, чтобы проведите поиск (Помощь):
Справка по поиску молекулярной массы
Параметры поиска (шаг 1)
(Вернуться к поиску)Вы можете искать виды на основе молекулярной массы значения двумя способами:
- Задайте одно значение; система будет искать значения в пределах 0.5 единиц этой стоимости.
- Укажите диапазон. Пределы диапазона должны быть разделенными запятой.
Правила ограничения формулы (шаг 2)
(Вернуться к поиску) Можно ввести химическую формулу, чтобы ограничить поиск
виды, соответствующие формуле. Способ, которым
формула интерпретируется контролируется двумя флажками ниже
поле ввода формулы:
Способ, которым
формула интерпретируется контролируется двумя флажками ниже
поле ввода формулы:
- Разрешить элементы, не указанные в формуле
- Если отмечено, эта опция указывает, что вид содержащие элементы, не указанные в формуле также будут сопоставлены.Например, поиск C2 будет соответствовать всем видам, которые содержат ровно два атома углерода и любое количество другие атомы.
- Этот параметр указывает на то, что виды, содержащие больше атомов, чем указано для данного элемента, будут сопоставлены. Например, поиск HC только с эта опция будет соответствовать только углеводородам.
Правила для типов данных (шаг 4)
(Вернуться к поиску)- Если один или несколько типов данных проверены, поиск будет ограничен видами, которые содержат хотя бы один из указанных типов данных.
- Если ни один из типов данных не проверен, там
не будет ограничений на поиск.

Определение эмпирических и молекулярных формул
Когда новое химическое соединение, такое как потенциально новое лекарственное средство, синтезируется в лаборатории или выделяется из природного источника, химики определяют его элементный состав, его эмпирическую формулу и структуру, чтобы понять его характеристики. В этом разделе мы сосредоточимся на том, как определить эмпирическую формулу соединения, а затем использовать ее для определения молекулярной формулы, если молярная масса соединения известна.
Расчет массовых процентов
Закон определенных пропорций гласит, что химическое соединение всегда содержит одинаковую пропорцию элементов по массе; то есть процентный состав — процентное содержание каждого элемента, присутствующего в чистом веществе. За некоторыми исключениями, процентный состав химического соединения постоянен (см. Закон определенных пропорций). Процент каждого элемента, присутствующего в чистом веществе, постоянен (хотя теперь мы знаем, что есть исключения из этого закона). Например, сахароза (тростниковый сахар) состоит из 42,11% углерода, 6,48% водорода и 51,41% кислорода по массе. Это означает, что 100,00 г сахарозы всегда содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода. Сначала мы воспользуемся молекулярной формулой сахарозы (C 12 H 22 O 11 ) для расчета массового процента составляющих элементов; затем мы покажем, как массовые проценты могут использоваться для определения эмпирической формулы.
Например, сахароза (тростниковый сахар) состоит из 42,11% углерода, 6,48% водорода и 51,41% кислорода по массе. Это означает, что 100,00 г сахарозы всегда содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода. Сначала мы воспользуемся молекулярной формулой сахарозы (C 12 H 22 O 11 ) для расчета массового процента составляющих элементов; затем мы покажем, как массовые проценты могут использоваться для определения эмпирической формулы.
Согласно молекулярной формуле каждая молекула сахарозы содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Следовательно, моль молекул сахарозы содержит 12 моль атомов углерода, 22 моль атомов водорода и 11 моль атомов кислорода. Мы можем использовать эту информацию для расчета массы каждого элемента в 1 моль сахарозы, что даст нам молярную массу сахарозы. Затем мы можем использовать эти массы для расчета процентного состава сахарозы. С точностью до трех десятичных знаков вычисления следующие:
Уравнение 3. 3
3
Таким образом, 1 моль сахарозы имеет массу 342,297 г; Обратите внимание, что более половины массы (175,989 г) составляет кислород, а почти половина массы (144,132 г) — углерод.
Массовый процент каждого элемента в сахарозе — это масса элемента, присутствующего в 1 моль сахарозы, деленная на молярную массу сахарозы, умноженную на 100, чтобы получить процентное значение.Результат отображается с двумя десятичными знаками:
% масс C в сахарозе = масса C / моль сахарозы молярная масса сахарозы × 100 = 144,132 г C342,297 г / моль × 100 = 42,12% масс.% H в сахарозе = масса H / моль сахарозы молярная масса сахарозы × 100 = 22,176 г ч 442,297 г / моль × 100 = 6,48% масс.% O в сахарозе = масса O / моль сахарозы Молярная масса сахарозы × 100 = 175,989 г O 342,297 г / моль × 100 = 51,41%Вы можете проверить свою работу, убедившись, что сумма процентов всех элементов в соединении равна 100%:
42. 12% + 6,48% + 51,41% = 100,01%
12% + 6,48% + 51,41% = 100,01%Если сумма не 100%, вы допустили ошибку в расчетах. (Однако округление до правильного числа десятичных знаков может привести к тому, что общая сумма будет немного отличаться от 100%.) Таким образом, 100,00 г сахарозы содержат 42,12 г углерода, 6,48 г водорода и 51,41 г кислорода; с точностью до двух знаков после запятой процентный состав сахарозы действительно составляет 42,12% углерода, 6,48% водорода и 51,41% кислорода.
Мы также можем рассчитать массовые проценты, используя атомные массы и молекулярные массы с атомными единицами массы.Поскольку ответ, который мы ищем, представляет собой соотношение, выраженное в процентах, единицы массы отменяют, являются ли они граммами (с использованием молярных масс) или атомными единицами массы (с использованием атомных и молекулярных масс).
Пример 5
Аспартам — искусственный подсластитель, продаваемый как NutraSweet and Equal. Его молекулярная формула: C 14 H 18 N 2 O 5 .
Его молекулярная формула: C 14 H 18 N 2 O 5 .
- Рассчитайте массовый процент каждого элемента в аспартаме.
- Рассчитайте массу углерода в пакете Equal по 1,00 г, предполагая, что это чистый аспартам.
Дано: молекулярная формула и масса образца
Запрошено: массовый процент всех элементов и масса одного элемента в образце
Стратегия:
A Используйте атомные массы из периодической таблицы, чтобы вычислить молярную массу аспартама.
B Разделите массу каждого элемента на молярную массу аспартама; затем умножьте на 100, чтобы получить проценты.
C Чтобы найти массу элемента, содержащегося в заданной массе аспартама, умножьте массу аспартама на массовый процент этого элемента, выраженный в десятичной дроби.
Решение:
A Мы вычисляем массу каждого элемента в 1 моль аспартама и молярную массу аспартама с точностью до трех знаков после запятой:
14C (14 моль C) (12.011 г / моль C) = 168,154 г 18H (18 моль H) (1,008 г / моль H) = 18,114 г2N (2 моль N) (14,007 г / моль N) = 28,014 г + 5O (5 моль O) (15,999 г / моль O) = 79,995 г C14h28N2O5 молярная масса аспартама = 294,277 г / моль.Таким образом, более половины массы 1 моля аспартама (294,277 г) составляет углерод (168,154 г).
B Чтобы вычислить массовый процент каждого элемента, мы разделим массу каждого элемента в соединении на молярную массу аспартама, а затем умножим на 100, чтобы получить проценты, которые здесь указаны с двумя десятичными знаками:
мас. % C = 168.154 г C294,277 г аспартама × 100 = 57,14% Cmass% H = 18,114 г h394,277 г аспартама × 100 = 6,16% Hmass% N = 28,014 г N294,277 г аспартама × 100 = 9,52% Nmass% O = 79,995 г O 294,277 г аспартама × 100 = 27,18% O
% C = 168.154 г C294,277 г аспартама × 100 = 57,14% Cmass% H = 18,114 г h394,277 г аспартама × 100 = 6,16% Hmass% N = 28,014 г N294,277 г аспартама × 100 = 9,52% Nmass% O = 79,995 г O 294,277 г аспартама × 100 = 27,18% OВ качестве проверки мы можем сложить проценты:
57,14% + 6,16% + 9,52% + 27,18% = 100,00%Если вы получили общую сумму, которая отличается от 100% более чем примерно на ± 1%, значит, в вычислении должна быть ошибка.
C Масса углерода в 1,00 г аспартама рассчитывается следующим образом:
масса C = 1,00 г аспартама × 57,14 г C 100 г аспартама = 0,571 г C
Упражнение
Рассчитайте массовый процент каждого элемента в оксиде алюминия (Al 2 O 3 ). Затем рассчитайте массу алюминия в 3 раза.62 г образца чистого оксида алюминия.
Затем рассчитайте массу алюминия в 3 раза.62 г образца чистого оксида алюминия.
Ответ: 52,93% алюминия; 47,08% кислорода; 1,92 г Al
Определение эмпирической формулы пенициллина
Так же, как мы можем использовать эмпирическую формулу вещества для определения его процентного состава, мы можем использовать процентный состав образца для определения его эмпирической формулы, которая затем может быть использована для определения его молекулярной формулы. Такая процедура фактически использовалась для определения эмпирической и молекулярной формулы первого открытого антибиотика: пенициллина.
Антибиотики — это химические соединения, которые избирательно убивают микроорганизмы, многие из которых вызывают заболевания. Хотя сегодня мы можем принимать антибиотики как должное, пенициллин был открыт всего около 80 лет назад. Последующая разработка широкого спектра других антибиотиков для лечения многих распространенных заболеваний в значительной степени способствовала значительному увеличению продолжительности жизни за последние 50 лет. Открытие пенициллина — это исторический детектив, в котором ключевую роль сыграло использование массовых процентов для определения эмпирических формул.
Открытие пенициллина — это исторический детектив, в котором ключевую роль сыграло использование массовых процентов для определения эмпирических формул.
В 1928 году молодой микробиолог из Лондонского университета Александр Флеминг работал с обычной бактерией, вызывающей фурункулы и другие инфекции, такие как заражение крови. Для лабораторных исследований бактерии обычно выращивают на поверхности геля, содержащего питательные вещества, в небольших плоских чашках для культивирования. Однажды Флеминг заметил, что одна из его культур была заражена голубовато-зеленой плесенью, похожей на плесень, обнаруженную на испорченном хлебе или фруктах. Такие несчастные случаи довольно часты, и большинство лабораторных работников просто выбросили бы культуры.Однако Флеминг заметил, что бактерии росли повсюду на геле , за исключением рядом с заражающей плесенью (часть (а) на рис. 3.3 «)
«), и он предположил, что плесень должна производить вещество, которое либо убивает бактерии, либо предотвращает их рост. Чтобы проверить эту гипотезу, он вырастил плесень в жидкости, а затем отфильтровал жидкость и добавил ее к различным культурам бактерий. жидкость убила не только бактерии, которые первоначально изучал Флеминг, но и целый ряд других болезнетворных бактерий.Потому что форма была членом семейства Penicillium (названного в честь их карандашных ветвей под микроскопом) (часть (b) на рис. 3.3 «)
«), Флеминг назвал действующее вещество в бульоне пенициллин .
Чтобы проверить эту гипотезу, он вырастил плесень в жидкости, а затем отфильтровал жидкость и добавил ее к различным культурам бактерий. жидкость убила не только бактерии, которые первоначально изучал Флеминг, но и целый ряд других болезнетворных бактерий.Потому что форма была членом семейства Penicillium (названного в честь их карандашных ветвей под микроскопом) (часть (b) на рис. 3.3 «)
«), Флеминг назвал действующее вещество в бульоне пенициллин .
Рисунок 3.3 Penicillium
(a) Плесень Penicillium растет в культуральной чашке; на фото показано его влияние на рост бактерий.(b) На этой микрофотографии Penicillium видны его стержневые и карандашные ветви. Название происходит от латинского penicillus , что означает «кисть».
Хотя Флемингу не удалось выделить пенициллин в чистом виде, медицинское значение его открытия стимулировало исследователей в других лабораториях. Наконец, в 1940 году два химика из Оксфордского университета, Ховард Флори (1898–1968) и Эрнст Чейн (1906–1979), смогли выделить активный продукт, который они назвали пенициллин G.В течение трех лет пенициллин G широко использовался для лечения пневмонии, гангрены, гонореи и других заболеваний, и его использование значительно увеличило выживаемость раненых солдат во время Второй мировой войны. В результате своей работы Флеминг, Флори и Чейн разделили Нобелевскую премию по медицине в 1945 году.
Наконец, в 1940 году два химика из Оксфордского университета, Ховард Флори (1898–1968) и Эрнст Чейн (1906–1979), смогли выделить активный продукт, который они назвали пенициллин G.В течение трех лет пенициллин G широко использовался для лечения пневмонии, гангрены, гонореи и других заболеваний, и его использование значительно увеличило выживаемость раненых солдат во время Второй мировой войны. В результате своей работы Флеминг, Флори и Чейн разделили Нобелевскую премию по медицине в 1945 году.
Как только им удалось выделить чистый пенициллин G, Флори и Чейн подвергли это соединение процедуре, называемой анализом горения (описанной далее в этом разделе), чтобы определить, какие элементы присутствовали и в каких количествах.Результаты таких анализов обычно выражаются в массовых процентах. Они обнаружили, что типичный образец пенициллина G содержит 53,9% углерода, 4,8% водорода, 7,9% азота, 9,0% серы и 6,5% натрия по массе. Сумма этих чисел составляет всего 82,1%, а не 100,0%, что означает, что должен быть один или несколько дополнительных элементов. Разумным кандидатом является кислород, который является обычным компонентом соединений, содержащих углерод и водород; однако по техническим причинам непосредственный анализ кислорода затруднен.Если предположить, что вся недостающая масса обусловлена кислородом, то пенициллин G содержит (100,0% — 82,1%) = 17,9% кислорода. Исходя из этих массовых процентов, можно определить эмпирическую формулу и, в конечном итоге, молекулярную формулу соединения.
Разумным кандидатом является кислород, который является обычным компонентом соединений, содержащих углерод и водород; однако по техническим причинам непосредственный анализ кислорода затруднен.Если предположить, что вся недостающая масса обусловлена кислородом, то пенициллин G содержит (100,0% — 82,1%) = 17,9% кислорода. Исходя из этих массовых процентов, можно определить эмпирическую формулу и, в конечном итоге, молекулярную формулу соединения.
Чтобы определить эмпирическую формулу из массовых процентов элементов в таком соединении, как пенициллин G, нам нужно преобразовать массовые проценты в относительное количество атомов. Для удобства предположим, что мы имеем дело со 100.0 г образца соединения, хотя размеры образцов, используемых для анализа, обычно намного меньше, обычно в миллиграммах. Это предположение упрощает арифметику, поскольку массовый процент углерода 53,9% соответствует 53,9 г углерода в 100,0 г образца пенициллина G; аналогично 4,8% водорода соответствует 4,8 г водорода в 100,0 г пенициллина G; и так далее для других элементов. Затем мы можем разделить каждую массу на молярную массу элемента, чтобы определить, сколько молей каждого элемента присутствует в 100.Образец 0 г:
Затем мы можем разделить каждую массу на молярную массу элемента, чтобы определить, сколько молей каждого элемента присутствует в 100.Образец 0 г:
Уравнение 3.4
масса (г) молярная масса (г / моль) = (г) (мольг) = моль 53,9 г C (1 моль C12,011 г C) = 4,49 моль C 4,8 г H (1 моль ч 2,008 г H) = 4,8 моль H7,9 г N (1 моль N14,007 г N) = 0,56 моль N9,0 г S (1 моль S32,065 г S) = 0,28 моль S6,5 г Na (1 моль Na22,990 г Na ) = 0,28 моль Na 17,9 г O (1 моль O 15,999 г O) = 1,12 моль OТаким образом, 100,0 г пенициллина G содержит 4,49 моль углерода, 4,8 моль водорода, 0,56 моль азота, 0,28 моль серы, 0.28 моль натрия и 1,12 моль кислорода (при условии, что вся недостающая масса составляла кислород). Число значащих цифр в количестве молей элементов варьируется от двух до трех, потому что некоторые аналитические данные были представлены только двумя значащими цифрами.
Эти результаты говорят нам о соотношении молей различных элементов в образце (4,49 моль углерода к 4,8 моль водорода и 0,56 моль азота и т. Д.), Но они не являются целочисленными отношениями, которые нам нужны для эмпирическая формула — эмпирическая формула выражает относительных числа атомов в наименьших возможных целых числах .Чтобы получить целые числа, мы делим количество молей всех элементов в образце на количество молей элемента, присутствующего в наименьшем относительном количестве, которым в данном примере является сера или натрий. Результатом будут индексы элементов в эмпирической формуле. С двумя значащими цифрами получается
Д.), Но они не являются целочисленными отношениями, которые нам нужны для эмпирическая формула — эмпирическая формула выражает относительных числа атомов в наименьших возможных целых числах .Чтобы получить целые числа, мы делим количество молей всех элементов в образце на количество молей элемента, присутствующего в наименьшем относительном количестве, которым в данном примере является сера или натрий. Результатом будут индексы элементов в эмпирической формуле. С двумя значащими цифрами получается
Уравнение 3.5
C: 4,490,28 = 16H: 4,80,28 = 17N: 0,560,28 = 2,0S: 0,280,28 = 1,0Na: 0,280,28 = 1,0O: 1.120,28 = 4,0 Таким образом, эмпирическая формула пенициллина G: C 16 H 17 N 2 NaO 4 S. Другие эксперименты показали, что пенициллин G на самом деле является ионным соединением, содержащим катионы Na + и [C 16 H 17 N 2 O 4 S] — анионов в соотношении 1: 1. Сложная структура пенициллина G (рис. 3.4 «Структурная формула и шариковая модель аниона пенициллина G») не была определена до 1948 года.
Сложная структура пенициллина G (рис. 3.4 «Структурная формула и шариковая модель аниона пенициллина G») не была определена до 1948 года.
Рисунок 3.4 Структурная формула и шариковая модель аниона пенициллина G
В некоторых случаях один или несколько индексов в формуле, вычисляемой с помощью этой процедуры, могут не быть целыми числами. Означает ли это, что интересующее нас соединение содержит нецелое число атомов? Нет; Ошибки округления в расчетах, а также экспериментальные ошибки в данных могут привести к нецелым отношениям. Когда это происходит, вы должны проявить определенное суждение при интерпретации результатов, как показано в Примере 6.В частности, отношения 1,50, 1,33 или 1,25 предполагают, что вы должны умножить всех нижних индекса в формуле на 2, 3 или 4 соответственно. Округление до ближайшего целого числа следует рассматривать только в том случае, если соотношение находится в пределах 5% от целого значения.
Пример 6
Рассчитайте эмпирическую формулу ионного соединения фосфата кальция, основного компонента удобрений и полирующего агента в зубных пастах. Элементный анализ показывает, что он содержит 38.77% кальция, 19,97% фосфора и 41,27% кислорода.
Дано: -процентный состав
Запрошено: эмпирическая формула
Стратегия:
A Возьмем образец весом 100 г и вычислим количество молей каждого элемента в этом образце.
B Получите относительное количество атомов каждого элемента в соединении, разделив количество молей каждого элемента в 100-граммовой пробе на количество молей элемента, присутствующего в наименьшем количестве.
C Если отношения не целые, умножьте все нижние индексы на одно и то же число, чтобы получить целые значения.
D Поскольку это ионное соединение, определите анион и катион и запишите формулу, чтобы заряды были сбалансированы.
Решение:
A Образец 100 г фосфата кальция содержит 38,77 г кальция, 19.97 г фосфора и 41,27 г кислорода. Разделив массу каждого элемента в образце 100 г на его молярную массу, получится количество молей каждого элемента в образце:
моль Ca = 38,77 г Ca × 1 моль Ca40,078 г Ca = 0,9674 моль Camoles P = 19,97 г P × 1 моль P30,9738 г P = 0,6447 г Pмоль O = 41,27 г O × 1 моль O15,9994 г O = 2,5800 моль OB Чтобы получить относительных числа атомов каждого элемента в соединении, разделите количество молей каждого элемента в 100-граммовой пробе на количество молей элемента в наименьшем количестве, в данном случае фосфор:
П: 0. 6447 моль P0,6447 моль P = 1.000Ca: 0,,6447 = 1,501O: 2,58000,6447 = 4,002
6447 моль P0,6447 моль P = 1.000Ca: 0,,6447 = 1,501O: 2,58000,6447 = 4,002C Мы могли бы записать эмпирическую формулу фосфата кальция как Ca 1,501 P 1.000 O 4,002 , но эмпирическая формула должна показывать отношения элементов в виде небольших целых чисел. Чтобы преобразовать результат в целую форму, умножьте все индексы на 2, чтобы получить Ca 3,002 P 2,000 O 8,004 . Отклонение от интегральных атомных отношений невелико и может быть объяснено незначительными экспериментальными ошибками; следовательно, эмпирическая формула Ca 3 P 2 O 8 .
D Ион кальция (Ca 2+ ) является катионом, поэтому для поддержания электрической нейтральности фосфор и кислород должны образовывать многоатомный анион. Из главы 2 «Молекулы, ионы и химические формулы» мы знаем, что фосфор и кислород образуют фосфат-ион (PO 4 3-; см. Таблицу 2.4 «Общие многоатомные ионы и их названия»). Поскольку в эмпирической формуле присутствуют два атома фосфора, должны присутствовать два иона фосфата. Итак, запишем формулу фосфата кальция как Ca 3 (PO 4 ) 2 .
Таблицу 2.4 «Общие многоатомные ионы и их названия»). Поскольку в эмпирической формуле присутствуют два атома фосфора, должны присутствовать два иона фосфата. Итак, запишем формулу фосфата кальция как Ca 3 (PO 4 ) 2 .
Упражнение
Рассчитайте эмпирическую формулу нитрата аммония, ионного соединения, которое содержит 35,00% азота, 5,04% водорода и 59,96% кислорода по массе; при необходимости см. Таблицу 2.4 «Общие многоатомные ионы и их названия». Хотя нитрат аммония широко используется в качестве удобрения, он может быть взрывоопасным. Например, он был основным компонентом взрывчатки, использованной во время взрыва в Оклахома-Сити в 1995 году.
Ответ: N 2 H 4 O 3 — это NH 4 + NO 3 — , записывается как NH 4 NO 3
Анализ горения
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализ горения . Небольшой, тщательно взвешенный образец неизвестного соединения, которое может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода, и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 соответственно) определяются одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке 3.5 «Этапы получения эмпирической формулы из анализа горения», а типичный анализ горения проиллюстрирован в примере 7.
Небольшой, тщательно взвешенный образец неизвестного соединения, которое может содержать углерод, водород, азот и / или серу, сжигается в атмосфере кислорода, и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 соответственно) определяются одним из нескольких возможных методов. Одна процедура, используемая при анализе горения, схематически представлена на рисунке 3.5 «Этапы получения эмпирической формулы из анализа горения», а типичный анализ горения проиллюстрирован в примере 7.
Рис. 3.5. Этапы получения эмпирической формулы из анализа горения
Пример 7
Нафталин, активный ингредиент одной разновидности нафталина, представляет собой органическое соединение, содержащее только углерод и водород. Полное сгорание 20,10 мг образца нафталина в кислороде дает 69,00 мг CO 2 и 11,30 мг H 2 O. Определите эмпирическую формулу нафталина.
Дано: масса пробы и масса продуктов сгорания
Запрошено: эмпирическая формула
Стратегия:
A Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходном образце нафталина.
B Используйте эти массы и молярные массы элементов, чтобы вычислить эмпирическую формулу нафталина.
Решение:
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль CO 2 . Точно так же 1 моль H 2 O образуется на каждые 2 моля атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны на основе этих соотношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицы молярной массы — граммы на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
Поскольку единицы молярной массы — граммы на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
B Чтобы получить относительных числа атомов обоих присутствующих элементов, нам нужно вычислить количество молей каждого из них и разделить на количество молей элемента, присутствующего в наименьшем количестве:
моль C = 1.883 × 10–2 г C × 1 моль C12.011 г C = 1.568 × 10–3 моль Смоль H = 1.264 × 10–3 г H × 1 моль h2.0079 г H = 1.254 × 10–3 моль HРазделив каждое число на количество молей элемента, присутствующего в меньшем количестве, получим
H: 1,254 × 10−31,254 × 10−3 = 1. 000C: 1,568 × 10−31,254 × 10−3 = 1,250
000C: 1,568 × 10−31,254 × 10−3 = 1,250Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25: 1: C 1,25 H 1,0 . Поскольку соотношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что дает C 5 H 4 как эмпирическую формулу нафталина.Фактически, молекулярная формула нафталина C 10 H 8 , что согласуется с нашими результатами.
Упражнение
- Ксилол, органическое соединение, которое является основным компонентом многих бензиновых смесей, содержит только углерод и водород. Полное сгорание 17,12 мг образца ксилола в кислороде дает 56,77 мг CO 2 и 14,53 мг H 2 O. Определите эмпирическую формулу ксилола.
- Эмпирическая формула бензола — CH (его молекулярная формула: C 6 H 6 ).
 Если 10,00 мг бензола подвергнуть анализу сгорания, какая масса CO 2 и H 2 O будет произведена?
Если 10,00 мг бензола подвергнуть анализу сгорания, какая масса CO 2 и H 2 O будет произведена?
Ответ:
- Эмпирическая формула: C 4 H 5 . (Молекулярная формула ксилола на самом деле C 8 H 10 .)
- 33,81 мг CO 2 ; 6,92 мг H 2 O
От эмпирической формулы к молекулярной формуле
Эмпирическая формула дает только относительных числа атомов в веществе в минимально возможном соотношении.Для ковалентного вещества нас обычно больше интересует молекулярная формула, которая дает фактическое количество атомов каждого типа, присутствующих в молекуле. Однако без дополнительной информации невозможно узнать, является ли формула пенициллина G, например, C 16 H 17 N 2 NaO 4 S или целым кратным, например C 32 H 34 N 4 Na 2 O 8 S 2 , C 48 H 51 N 6 Na 3 O 12 S 3 , или (C 16 H 17 N 2 NaO 4 S) n , где n — целое число. (Фактическая структура пенициллина G показана на Рисунке 3.4 «Структурная формула и шариковая модель аниона пенициллина G».)
(Фактическая структура пенициллина G показана на Рисунке 3.4 «Структурная формула и шариковая модель аниона пенициллина G».)
Рассмотрим глюкозу, сахар, который циркулирует в нашей крови, чтобы обеспечить топливо для нашего тела и особенно для нашего мозга. Результаты анализа горения глюкозы показывают, что глюкоза содержит 39,68% углерода и 6,58% водорода. Поскольку горение происходит в присутствии кислорода, невозможно напрямую определить процентное содержание кислорода в соединении с помощью анализа горения; необходимы другие более сложные методы.Если предположить, что оставшийся процент приходится на кислород, то глюкоза будет содержать 53,79% кислорода. Таким образом, образец глюкозы весом 100,0 г будет содержать 39,68 г углерода, 6,58 г водорода и 53,79 г кислорода. Чтобы рассчитать количество молей каждого элемента в образце 100,0 г, мы разделим массу каждого элемента на его молярную массу:
Уравнение 3.6
моль C = 39,68 г C × 1 моль C12,011 г C = 3,304 моль C моль H = 6,58 г H × 1 моль h2. 0079 г H = 6,53 моль Hмолей O = 53,79 г O × 1 моль O 15,9994 г O = 3,362 моль O
0079 г H = 6,53 моль Hмолей O = 53,79 г O × 1 моль O 15,9994 г O = 3,362 моль OЕще раз, мы находим индексы элементов в эмпирической формуле, разделив количество молей каждого элемента на количество молей элемента, присутствующего в наименьшем количестве:
C: 3.3043.304 = 1.000H: 6.533.304 = 1.98O: 3.3623.304 = 1.018Соотношение кислород: углерод составляет 1,018, или приблизительно 1, а соотношение водород: углерод составляет примерно 2. Таким образом, эмпирическая формула глюкозы — CH 2 O, но какова ее молекулярная формула?
Многие известные соединения имеют эмпирическую формулу CH 2 O, включая формальдегид, который используется для сохранения биологических образцов и имеет свойства, которые сильно отличаются от сахара, циркулирующего в нашей крови.На данный момент мы не можем знать, является ли глюкоза CH 2 O, C 2 H 4 O 2 или любой другой (CH 2 O) n . Однако мы можем использовать экспериментально определенную молярную массу глюкозы (180 г / моль), чтобы решить эту дилемму.
Однако мы можем использовать экспериментально определенную молярную массу глюкозы (180 г / моль), чтобы решить эту дилемму.
Сначала мы вычисляем массу по формуле , молярную массу формульной единицы, которая представляет собой сумму атомных масс элементов в эмпирической формуле, умноженную на их соответствующие индексы.Для глюкозы
Уравнение 3,7
формульная масса Ch3O = [1 моль C (12,011 г1 моль C)] + [2 моль H (1,0079 г1 моль H)] + [1 моль O (15,9994 г1 моль O)] = 30,026 гЭто намного меньше наблюдаемой молярной массы 180 г / моль.
Во-вторых, мы определяем количество формульных единиц на моль. Для глюкозы мы можем рассчитать количество единиц (CH 2 O), то есть n в (CH 2 O) n , — разделив молярную массу глюкозы на формулу массы из CH 2 O:
Уравнение 3. 8
8
Каждая глюкоза содержит шесть формульных единиц CH 2 O, что дает молекулярную формулу глюкозы (CH 2 O) 6 , которую чаще записывают как C 6 H 12 O 6 . Молекулярные структуры формальдегида и глюкозы, оба из которых имеют эмпирическую формулу CH 2 O, показаны на Рисунке 3.6 «Структурные формулы и шарообразные модели (а) формальдегида и (б) глюкозы».
Рисунок 3.6 Структурные формулы и шариковые модели для (а) формальдегида и (б) глюкозы
Пример 8
Рассчитайте молекулярную формулу кофеина, соединения, содержащегося в кофе, чае и напитках колы, которое оказывает заметное стимулирующее действие на млекопитающих. Химический анализ кофеина показывает, что он содержит 49,18% углерода, 5,39% водорода, 28,65% азота и 16,68% кислорода по массе, а его экспериментально определенная молярная масса составляет 196 г / моль.
Дано: % состава и молярная масса
Запрошено: молекулярная формула
Стратегия:
A Допустим, 100 г кофеина. Из приведенных процентных соотношений используйте процедуру, приведенную в примере 6, для расчета эмпирической формулы кофеина.
B Рассчитайте массу по формуле, а затем разделите полученную экспериментально молярную массу на массу по формуле.Это дает количество присутствующих формульных единиц.
C Умножьте каждый нижний индекс в эмпирической формуле на количество формульных единиц, чтобы получить молекулярную формулу.
Решение:
A Начнем с деления массы каждого элемента в 100,0 г кофеина (49,18 г углерода, 5,39 г водорода, 28,65 г азота, 16,68 г кислорода) на его молярную массу. Это дает количество молей каждого элемента в 100 г кофеина.
Это дает количество молей каждого элемента в 100 г кофеина.
Чтобы получить относительное количество атомов каждого присутствующего элемента, разделите количество молей каждого элемента на количество молей элемента, присутствующего в наименьшем количестве:
О: 1.0431.043 = 1.000C: 4.0951.043 = 3.926H: 5.351.043 = 5.13N: 2.0451.043 = 1.960 Эти результаты достаточно типичны для реальных экспериментальных данных. Ни одно из атомных отношений не является точно целым, но все они находятся в пределах 5% от целых значений. Как и в примере 6, разумно предположить, что такие небольшие отклонения от целых значений вызваны небольшими экспериментальными ошибками, поэтому округлите их до ближайшего целого числа. Таким образом, эмпирическая формула кофеина: C 4 H 5 N 2 O.
Таким образом, эмпирическая формула кофеина: C 4 H 5 N 2 O.
B Молекулярная формула кофеина может иметь вид C 4 H 5 N 2 O, но это также может быть любое целое кратное этого числа. Чтобы определить действительную молекулярную формулу, мы должны разделить экспериментально определенную молярную массу на формульную массу. Формула массы рассчитывается следующим образом:
4C (4 атома C) (12,011 г / атом C) = 48,044 г 5H (5 атомов H) (1,0079 г / атом H) = 5,0395 г 2N (2 атома N) (14.0067 г / атом N) = 28,0134 г + 1O (1 атом O) (15,9994 г / атом O) = 15,9994 г C4H5N2O Формульная масса кофеина = 97,096 гРазделив измеренную молярную массу кофеина (196 г / моль) на расчетную массу по формуле, получим
196 г / моль 97,096 г / C4H5N2O = 2,02≈2 C4H5N2O эмпирическая формула единиц C В кофеине две формулы C 4 H 5 N 2 O, поэтому молекулярная формула должна быть (C 4 H 5 N 2 O) 2 = C 8 H 10 N 4 O 2 . Состав кофеина следующий:
Состав кофеина следующий:
Упражнение
Рассчитайте молекулярную формулу фреона-114, который содержит 13,85% углерода, 41,89% хлора и 44,06% фтора. Экспериментально измеренная молярная масса этого соединения составляет 171 г / моль. Как и фреон-11, фреон-114 является широко используемым хладагентом, который участвует в разрушении озонового слоя.
Ответ: C 2 Cl 2 F 4
Сводка
Эмпирическая формула вещества может быть рассчитана на основе экспериментально определенных процентов состава , массового процента каждого элемента, присутствующего в чистом веществе.Во многих случаях эти проценты можно определить с помощью анализа горения . Если молярная масса соединения известна, молекулярная формула может быть определена по эмпирической формуле.
Ключевые вынос
- Эмпирическая формула вещества может быть рассчитана на основе его процентного состава, а молекулярная формула может быть определена на основе эмпирической формулы и молярной массы соединения.

Концептуальные проблемы
Какая связь между эмпирической формулой и молекулярной формулой?
Постройте блок-схему, показывающую, как определить эмпирическую формулу соединения по процентному составу.
Числовые задачи
Каков массовый процент воды в каждом гидрате?
- H 3 AsO 4 · 0 · 5H 2 O
- NH 4 NiCl 3 · 6H 2 O
- Al (НЕТ 3 ) 3 · 9H 2 O
Каков массовый процент воды в каждом гидрате?
- CaSO 4 · 2H 2 O
- Fe (НЕТ 3 ) 3 · 9H 2 O
- (NH 4 ) 3 ZrOH (CO 3 ) 3 · 2H 2 O
Что из следующего имеет наибольший массовый процент кислорода — KMnO 4 , K 2 Cr 2 O 7 или Fe 2 O 3 ?
Что из следующего имеет наибольший массовый процент кислорода — ThOCl 2 , MgCO 3 или NO 2 Cl?
Рассчитайте процентное содержание элемента, выделенного жирным шрифтом, в каждом соединении.

- Сб Белл 3
- Как 2 I 4
- Al P O 4
- С 6 В 10 О
Рассчитайте процентное содержание элемента, выделенного жирным шрифтом, в каждом соединении.
- H Br O 3
- CS ReO 4
- С 3 В 8 О
- Fe S O 4
Образец соединения хрома имеет молярную массу 151.
 99 г / моль. Элементный анализ соединения показывает, что оно содержит 68,43% хрома и 31,57% кислорода. Какова идентичность соединения?
99 г / моль. Элементный анализ соединения показывает, что оно содержит 68,43% хрома и 31,57% кислорода. Какова идентичность соединения?Процентное содержание железа и кислорода в трех наиболее распространенных бинарных соединениях железа и кислорода представлено в следующей таблице. Напишите эмпирические формулы этих трех соединений.
Соединение % Железо % кислорода Эмпирическая формула 1 69.  9
930,1 2 77,7 22,3 3 72,4 27.6 Каков массовый процент воды в каждом гидрате?
- LiCl · H 2 O
- MgSO 4 · 7H 2 O
- Sr (НЕТ 3 ) 2 · 4H 2 O
Каков массовый процент воды в каждом гидрате?
- CaHPO 4 · 2H 2 O
- FeCl 2 · 4H 2 O
- мг (NO 3 ) 2 · 4H 2 O
Два гидрата взвешивали, нагревали, чтобы отогнать гидратные воды, а затем охлаждали.
 Затем остатки повторно взвешивали. На основании следующих результатов, каковы формулы гидратов?
Затем остатки повторно взвешивали. На основании следующих результатов, каковы формулы гидратов?Соединение Начальная масса (г) Масса после охлаждения (г) NiSO 4 · x H 2 O 2.08 1,22 CoCl 2 · x H 2 O 1,62 0,88 Что содержит наибольший массовый процент серы — FeS 2 , Na 2 S 2 O 4 или Na 2 S?
При равных массах каждого из них, который содержит наибольший массовый процент серы — NaHSO 4 или K 2 SO 4 ?
Рассчитайте массовую долю кислорода в каждом многоатомном ионе.

- бикарбонат
- хромат
- ацетат
- сульфит
Рассчитайте массовую долю кислорода в каждом многоатомном ионе.
- оксалат
- нитрит
- дигидрофосфат
- тиоцианат
Эмпирическая формула граната, драгоценного камня, такова: Fe 3 Al 2 Si 3 O 12 .Анализ образца граната дал значение 13,8% для массового процента кремния. Соответствует ли это эмпирической формуле?
Соединение имеет эмпирическую формулу C 2 H 4 O, а его формульная масса составляет 88 г.
 Какова его молекулярная формула?
Какова его молекулярная формула?Мирекс — инсектицид, содержащий 22.01% углерода и 77,99% хлора. Он имеет молекулярную массу 545,59 г. Какова его эмпирическая формула? Какова его молекулярная формула?
Сколько молей CO 2 и H 2 O будет произведено анализом сжигания 0,010 моль стирола?
Сколько молей CO 2 , H 2 O и N 2 будет произведено при анализе сгорания 0.0080 моль анилина?
Сколько молей CO 2 , H 2 O и N 2 будет произведено анализом сжигания 0,0074 моля аспартама?
Сколько молей CO 2 , H 2 O, N 2 и SO 2 будет произведено при анализе сгорания 0.
 0060 моль пенициллина G?
0060 моль пенициллина G?При сжигании 34,8 мг образца бензальдегида, который содержит только углерод, водород и кислород, было получено 101 мг CO 2 и 17,7 мг H 2 O.
- Какова масса углерода и водорода в образце?
- Если предположить, что исходный образец содержал только углерод, водород и кислород, какова была масса кислорода в образце?
- Каков был массовый процент кислорода в образце?
- Какова эмпирическая формула бензальдегида?
- Молярная масса бензальдегида 106.12 г / моль. Какова его молекулярная формула?
Салициловая кислота используется для производства аспирина.
 Он содержит только углерод, кислород и водород. При сжигании 43,5 мг образца этого соединения было получено 97,1 мг CO 2 и 17,0 мг H 2 O.
Он содержит только углерод, кислород и водород. При сжигании 43,5 мг образца этого соединения было получено 97,1 мг CO 2 и 17,0 мг H 2 O.- Какова масса кислорода в образце?
- Каков массовый процент кислорода в образце?
- Какова эмпирическая формула салициловой кислоты?
- Молярная масса салициловой кислоты 138.12 г / моль. Какова его молекулярная формула?
При равных массах следующих кислот, которая содержит наибольшее количество водорода, который может диссоциировать с образованием H + — азотной кислоты, йодистоводородной кислоты, синильной кислоты или хлорноватой кислоты?
Рассчитайте формульную массу или молекулярную массу каждого соединения.

- гептановая кислота (семиуглеродная карбоновая кислота)
- 2-пропанол (трехуглеродный спирт)
- КМнО 4
- тетраэтилсвинец
- сернистая кислота
- этилбензол (восьмиуглеродный ароматический углеводород)
Рассчитайте формульную массу или молекулярную массу каждого соединения.
- MoCl 5
- B 2 O 3
- бромбензол
- циклогексен
- фосфорная кислота
- этиламин
При равных массах бутана, циклобутана и пропена, который содержит наибольшую массу углерода?
При равных массах мочевины [(NH 2 ) 2 CO] и сульфата аммония, который содержит больше всего азота для использования в качестве удобрения?
Пожалуйста, убедитесь, что вы знакомы с темами, обсуждаемыми в разделе «Основные навыки 2» (раздел 3.7 «Основные навыки 2»), прежде чем переходить к числовым задачам.
ответы
Процент с точностью до двух десятичных знаков составляет:
- 5.
 97%
97% - 37,12%
- 43,22%
- 5.
% кислорода: KMnO 4 , 40,50%; K 2 Cr 2 O 7 , 38,07%; Fe 2 O 3 , 30,06%
Процент с точностью до двух десятичных знаков составляет:
- 66.32% Br
- 22,79% как
- 25,40% P
- 73,43% С
Процент с точностью до двух десятичных знаков составляет:
- 29.
 82%
82% - 51,16%
- 25,40%
- 29.
NiSO 4 · 6H 2 O и CoCl 2 · 6H 2 O
- 27.
 6 мг C и 1,98 мг H
6 мг C и 1,98 мг H - 5,2 мг O
- 15%
- C 7 H 6 O
- C 7 H 6 O
- 27.
Значения с точностью до двух десятичных знаков:
- 273.23 а.е.м.
- 69,62 а.е.м.
- 157,01 а.е.м.
- 82,14 а.е.м.
- 98,00 а.е.м.
- 45,08 а.
 е.м.
е.м.
Определение молекулярной формулы углеводородов с использованием данных о сжигании
Ранее мы обсуждали стратегию определения молекулярной формулы соединений с использованием состава по массе.
Сегодня мы обсудим Определение молекулярной формулы углеводородов с использованием данных горения . Это новая концепция для тех, кто совершает переход с GCE O-Levels на GCE A-Levels и, таким образом, будет одним из ключевых вопросов, которые нужно будет задать в GCE A-Level h2 и h3 Chemistry Examination .
Давайте посмотрим на используемый метод.
Углеводороды сгорают в избытке кислорода согласно следующему уравнению:
C x H y (g) + (x + y / 4) O 2 (g) -> xCO 2 (g) + y / 2 H 2 O (l)
При комнатной температуре или с. t.pm водный продукт фактически является жидкостью. Таким образом, объем незначителен по сравнению с объемами C x H y (г), O 2 (г) и CO 2 (г).
t.pm водный продукт фактически является жидкостью. Таким образом, объем незначителен по сравнению с объемами C x H y (г), O 2 (г) и CO 2 (г).
Использование соотношения объемов;
Следовательно, если 1 см 3 полностью сгорает в кислороде,
Объем использованного кислорода = (x + y / 4) см 3
Объем произведенного диоксида углерода = x см 3
Объем произведенной воды (в виде жидкости) = 0 см 3
Давайте рассмотрим вопрос на экзамене, чтобы увидеть, как мы можем использовать вышеперечисленное для решения вопроса.
Пример:
10 см 3 газообразного углеводорода требуется 20 см 3 кислорода для полного сгорания. 10 см 3 диоксида углерода. Рассчитайте молекулярную формулу углеводорода.
и
Предлагаемое решение:
Используя общее уравнение и применяя объемный коэффициент, получаем
C x H y (g) + (x + y / 4) O 2 (g) -> xCO 2 (g) + y / 2 H 2 O (l)
10 см 3 …… 20 см 3 ……………….
10 см 3
1 моль 2 моль 1 моль
Исходя из приведенного выше сравнения, имеем
x = 1 и (x + y / 4) = 2
Решение дает y = 4
Следовательно, молекулярная формула углеводорода CH 4 .
Надеюсь, что приведенное выше объяснение будет вам полезно. Обратите внимание, что это очень важная концепция, когда вы находитесь в JC1, и все равно будет проверяться, когда вы находитесь в JC2. Я понял, что многие из моих учеников на моих классах по химии GCE A-Level h3 не имеют должной подготовки в своих младших колледжах, когда дело доходит до этой базовой концепции.
PS: Сообщите мне, как вы его нашли. Напишите мне комментарий. Я хотел бы получить известие от вас. 😀
Статьи по теме:
Многие знают меня как автора книги «Десятилетняя серия» по JC A-Level h3 Chemistry и O-Level Pure Chemistry. Мой более чем 19-летний опыт коучинга (с 1999 года) с более чем 1500 учениками из 180+ JC и средних школ позволил мне понять истинные причины, по которым ученики не могут хорошо учиться по химии. Самое главное, что моя сила заключается в использовании повседневных аналогий (даже бабушки могут понять!) Для упрощения абстрактных понятий.Кроме того, моя методика преподавания была разработана таким образом, чтобы приносить удовольствие моим ученикам, приносить удовольствие и быть эффективной.
Самое главное, что моя сила заключается в использовании повседневных аналогий (даже бабушки могут понять!) Для упрощения абстрактных понятий.Кроме того, моя методика преподавания была разработана таким образом, чтобы приносить удовольствие моим ученикам, приносить удовольствие и быть эффективной.Если вы хотите весело провести время, изучая химию и иметь мотивацию к преуспеванию в химии, свяжитесь со мной сегодня по телефону 9828 7357
Углеводороды — физические данные
Ниже таблицы приведены примеры молекулярных структур для различных классов углеводородов, а также определений различных классов углеводородов.
Цифры, показывающие тенденции для различных классов с увеличением длины цепи, а также молекулярные структуры, см. Также
Для полной таблицы с молекулярной массой, температурой плавления и кипения, плотностью, температурой вспышки и температурой воспламенения — поверните экран!
| Класс углеводородов | Название IUPAC | Общее название | #C | #H | Молярная масса Температура плавления 9000 ° C | Точка кипения ° C | Плотность при 20 ° C * г / мл | Температура вспышки ° C | Температура самовоспламенения ° C 90809 N-алкан | Метан | 1 | 4 | 16. |  04 04-183 | -162 | — | -135 | 595 | N-алкан | Этан | 2 | 6 | 26 30100600 | 009 | -135 | 515 | N-алкан | Пропан | 3 | 8 | 44.09 | -188 | -42 | 2 0.498100-42 | 2 0,49810099999 -алкан Н-бутан | Бутан | 4 | 10 | 58.12 | -138 | -1 | 0,577 | -60 | 365 | N-алкан | N-пентан | Пентан | 5 | 22-1906222 | 0,630 | -49 | 260 | Н-алкан | Н-гексан | Гексан | 6 | 14 | 86,17 | -95 | 69.664 | <-20 | 230 | Н-алкан | Н-гептан | Гептан | 7 | 16 | 100. |  20 20-91 | 2 986100 906 220912
N-алкан | N-октан | Октан | 8 | 18 | 114,22 | -57 | 126 | 0,702 | 12 | 06 205 909 Alkane -нонан Нонан | 9 | 20 | 128.25 | -53 | 151 | 0,719 | 31 | 205 | N-алкан | N-декан | Decane | 10 | 22 | 1002222 142 0,730 | 46 | 200 | N-алкан | N-ундекан | 11 | 24 | 156,30 | -26 | 196 | 21006 -26 196 | N-додекан | 12 | 26 | 170.33 | -10 | 216 | 0,750 | 80 | 200 | N-алкан | N-тридекан | 13 | 28 | 2626262262929 909 | N-алкан | N-тетрадекан | 14 | 30 | 198,38 | 6 | 254 | 0,760 | 12 | 0,760 | 12 N609-алкан 9 -1009 9 -98 алкан 9 -98 9 -98 | 32 | 212. |  41 41 15 | 270 | 0,769 | N-алкан | N-гексадекан | 16 | 34 | 226,43 | 26 286 226,43 | 26 286 907 909 909 909 909 -алкан N-гептадекан | 17 | 36 | 240,46 | 22 | 303 | 0,778 | N-алкан | 251006 N-алкан | .48 | 28 | 316 | 0,777 28 | N-алкан | N-нонадекан | 19 | 40 | 268.51 | 222 268,51 | 2 909 N-алкан | N-эйкозан | 20 | 42 | 282,54 | 37 | 344 | 0,789 | 187 | N-алкен N-Alkne 9 | 44 | 296.56 | 40 | 359 | 0,792 | N-алкан | N-докозан | 22 | 46 | 310,59 | 2 446909 310,59 | 2 449099 N-алкан | N-трикозан | 23 | 48 | 324,61 | 47 | 381 | 0,779 48 | N-алкос 91 609 | 0100 | N-алк9 9 | 50 | 338. |  64 64 50 | 391 | 0,799 | N-алкан | N-пентакозан | 25 | 52 | 352,67 | 006 402 | -алкан | N-гексакозан | 26 | 54 | 366,69 | 56 | 415 | 0,778 60 | 909 909 909 909 909 | 380.72 | 59 | 422 | 0,780 60 | 269 | N-алкан | N-октакозан | 28 | 58 | 2 90922 394,79 | N-алкан | N-нонакозан | 29 | 60 | 408,77 | 64 | 443 | 0,808 | 9012 307 | 9012 307 | 62 | 422.80 | 66 | 451 | 0,810 | N-алкан | N-гентриаконтан | Унтриаконтан | 31 | 64 | 6810012 64 | 262 9012 909 N-алкан | N-дотриаконтан | 32 | 66 | 450,85 | 70 | 470 | 0,812 | 2 | | 68 | 464. |  87 87 71 | N-алкан | -N-пентатриаконтан | 35 | 72 | 492,93 | 74 | 21006 486 74 | 26 486 74 | 2100 486 9 N-тетраконтан 40 | 82 | 563,06 | 81 | 522 | 0,817 25 | N-алкан | 232 102609 | 2 10260 | 10260 932 | 92 | 575 | N-алкан | N-гексаконтан | 60 | 122 | 843,58 | 100 | 843,58 | 100 | 909 | 625 909 909 N-гептаконтан | 70 | 142 | 983,84 | 106 | 647 | N-алкан | N-октаконтан | 80100 11609 2491 | 112 | 672 | N-алкан | N-нонаконтан | 90 | 182 | 1264,4 | ~ 700100 | ~ 700100 909 909 | алкан -гектан | 100 | 202 | 1404,6 | 115 | ~ 720 | метила | 9 метила -бутан | 4 | 10 | 58. |  12 12-160 | -12 | 0,555 | -83 | 460 | 2-метилалкан | 2-метилбутан | Изо-пентан | 5 | -1 121006 72912 | 28 | 0,620 | -51 | 420 | 2-метилалкан | 2-метилпентан | изогексан, изо-капроилгидрид | 6 | 14 | 86.17 | -154 | 60 | 0,653 | <-7 | 300 | 2-метилалкан | 2-метилгексан | 7 | 16 | 16 | -10 | 280 | 2-метилалкан | 2-метилгептан | 8 | 18 | 114,22 | -110 | 117 | 0.698 | 6 | 2-метилалкан | 2-метилоктан | изононан, диметилгептан | 9 | 20 | 128,25 | 21003 906 -метилалкан | 2-метилнонан | изо-декан | 10 | 22 | 142,28 | -75 | 167 | 0,728 | 46 | 24 | 156. |  30 30-49 | 189 | 0,737 | 50 | 2-метилалкан | 2-метилундекан | 12 | 26 | 170.33100476 | 170.33100476 | 0,737 3-метилалкан | 3-метилпентан | Диэтилметилметан | 006 14006 6 917 -118 | 63 | 0,660 | <-20 | 300 | 3-метилалкан | 3-метилгексан | 7 | 16 | 16 | 100,20 0,687 | -11 | 280 | 3-метилалкан | 3-метилгептан | 8 | 18 | 114,22 | -121 | 120 | 0.705 | 6 | 410 | 3-метилалкан | 3-метилоктан | 9 | 20 | 128,25 | -108 | 14412 | 144 | 144 | 3-метилнонан | 10 | 22 | 142,28 | -85 | 168 | 0,735 | 3-метилалкан | 3-метилдекан | 1130 | -80 | 192 | 0,742 | 3-метилалкан | 3-метилундекан | 12 | 26 | 170,33 | 28 -58909 902 | 28 -58 902 2,2-диметилалкан | 2,2-диметилпропан | Неопентан, триметилэтан | 5 | 12 | 12 | 5 | 12 | 15 | -17 | 10 | 0,590 | -19 | 450 | 2,2-диметилбутан | 2,2-диметилбутан | Неогексан | 100 6 | 50 | 0,649 | -48 | 435 | 2,2-диметилалкан | 2,2-диметилпентан | 7 | 16 | 100. |  20100129 20100129-21 | 320 | 2,2-диметилалкан | 2,2-диметилгексан | 8 | 18 | 114.22 | -121 | 106 | -121 | 2,2-диметилалкан | 2,2-диметилгептан | 9 | 20 | 128,25 | -113 | 133 | 0,711 | 6 | 10 | 22 | 142.28 | 154 | 0,724 | Триметилалкан | 2,21006 | -107 | 99 | 0,690 | 396 | 1-алкен 6 90122 | 909 .05 | -169 | -104 | — | 440 | 1-алкен | Пропен | Пропилен | 3 | 6 | 00122 | 6 | 006 42. 08 08-108 | 485 | 1-алкен | Бут-1-ен | 1-бутен, 1-бутилен, этилэтилен | 4 | 8 | 56,10 | 26 -185-185 909 0.593-80 | 360 | 1-алкен | 1-пентен | н-амилен, пропилэтилен | 5 | 10 | 70,13 | -165 306100 | 29 0,6100 | 9100 280 | 1-алкен | 1-гексен | 6 | 12 | 84,16 | -140 | 64 | 0,673 | -26 | 06 25512 06 255 1-гептен | 1-гептен | 7 | 14 | 98.18 | -119 | 94 | 0,697 | -8 | 250 | 1-алкен | 1-октен | 1-каприлен | 8 | 0062100621006 112909,21 121 0,715 | 10 | 240 | 1-алкен | 1-нонен | 9 | 18 | 126,23 | -81 | 147100 | 6 1-децен | 10 | 20 | 140. |  26 26-66 | 172 | 0,741 | 44 | 230 | 1-алкен | 1-ундецен | 11 | 22 | 21541006 194969 0,741 63 | 1-алкен | 1-додецен | 12 | 24 | 168,31 | -35 | 213 | 0,758 | 006 769006 76 9алкен 9-1009 1-тридецен | 13 | 26 | 182.34 | -23 | 233 | 0,766 | 1-алкен | 1-тетрадецен | 14 | 28 | 196,36 | 29 196,36 | 29 -13909 | 1-алкен | 1-пентадецен | 15 | 30 | 210,39 | -4 | 268 | 0,776 | 1-алкен 100 | 2 9 гексан | 224.42 | 4 | 285 | 0,781 | 1-алкен | 1-гептадецен | 17 | 34 | 238,44 | 0 | 0 | 306 | 91 238,44 | 0060 9 | 91 -алкен 1-октадецен | 18 | 36 | 252,47 | 18 | 316 | 0,789 | 1-алкен | 006 1912 19129 261009 261009 261009 . |  49 49 23 | 331 | 0,789 25 | 1-алкен | 1-докосен | 22 | 44 | 30810010012 | 44 | 30810010012 386 | 30810010012 | 2-метилалкен | 2-метил-1-пропен | Изобутен, Изобутилен 8 | 5691210 | -140 | -7 | 0,594 | -80 | 465 | 2-метилалкен | 2-метил-1-бутен | 5 | 2 1022 | 31 | 0,650 | -37 | 2-метилалкен | 2-метил-1-пентен | 1-метил-1-пропилэтилен | 6 | 12 | 29 84,16 -909 62 0.680 | -26 | 300 | 2-метилалкен | 2-метил-1-гексен | 7 | 14 | 98,18 | -103 | 2 92 91292 0,7100 | 2-метилалкен | 2-метил-1-гептен | 8 | 16 | 112,21 | -90 | 118 | 0,722 | 14 | 9 | 18 | 126. |  23 23-78 | 145 | 0,734 | 31 | 2-метилалкен | 2-метил-1-нонен | 10 | 20 | 140.21006 | 140.21006 | 9 0,744 2-метилалкен | 2-метил-1-децен | 11 | 22 | 154,29 | -51 | 1-алкин | Этин | Ацетилен | 2 | 2 | 26.04 | -81 | Sub -84 | — | 305 | 1-алкин | Пропин | 3 | 4 | 40.06 91229 | -103 | 340 | 1-алкин | 1-бутин | Этилацетилен | 4 | 6 | 54,09 | -126 | 8 | 0,683 29 | 0,683 0 9128 -алкин | 1-пентин | Пропилацетилен | 5 | 8 | 68. |  11 11 -106 | 40 | 0,690 | <-20 | 1-алкин | 1-гексин | 6 | 10 | 82,14-1006 |
82,14-1006 | -20 | 263 | 1-алкин | 1-гептин | 7 | 12 | 96,17 | -81 | 100 | 0,7333-2 | 100 | 0,7336 -2 | 22 -алкин 1-октин | Гексилацетилен | 8 | 14 | 110.19 | -79 | 126 | 0,746 | 1-алкин | 1-нонин | Гептилацетилен | 9 | 6 16 | 21241006 96 16 | 21241006 96 16 | 21241006 9 1-алкин | 1-децин | Октилацетилен | 10 | 18 | 138,24 | -44 | 174 | 0,765 | 2 | 0,765 | 21 ундеацетилен2 9-1009-ундеацетилен29-1908 | 11 | 20 | 152. |  27 27-25 | 196 | 0,773 | 1-алкин | 1-додецин | Децилацетилен | 12 | 22 | 26 16100129292929 1-алкин | 1-тридецин | 13 | 24 | 180,32 | 1 | 234 | 0,784 | 9 | 9 | 26 | 194.35 | 252 | 0,790 | 1-алкин | 1-пентадецин | 15 | 28 | 208,37 | 91 гексадецин | 16 | 30 | 222,40 | 15 | 284 | 0,796 | 9 10012 9 9 10012 9 9 10012 9 9 10012 9 | 4 | 6 | 54. |  09 09-32 | 27 | 0,691 | -25 | 2-алкин | 2-пентин | Этилметилацетилен | 5 | 2 822 8 | 2-алкин | 2-гексин | 6 | 10 | 82,14 | 9160clo9 9160clo9 | 9160clo9 | 9160 | Триметилен | 3 | 6 | 42.08 | -129 | -33 | — | 495 | Циклоалкан | Циклобутан | 4 | 8 | 56.1012322 | -90 10 | Циклоалкан | Циклопентан | 5 | 10 | 70,13 | -94 | 49 | 0,746 | -51 | 06 320 -51 | 06 320 -51 | 06 320-51 | 06 320 909 Гексан 6 | 12 | 84. |  16 16 7 | 81 | 0,777 | -18 | 260 | Циклоалкан | Циклогептан | 7 | 14 | 2 98,181006 14 | 2 98,181006 Циклоалкан | Циклооктан | 8 | 16 | 112,21 | 15 | 151 | 0,831 | 28 | 250 | 28 | 250 | | 22 | | .23 | 11 | 173 | 0,849 | Циклоалкан | Циклодекан | 10 | 20 | 140,26 | 2 201006 140,26 | 2 2010060 | Циклопропен | 3 | 4 | 40.06 | — | -36 | — | Циклоалкен | Циклобутен | 6 909 549 | 4 | — | 2 | 0,717 0 | Циклоалкен | Циклопентен | 5 | 8 | 68,11 | 1001222229 68,11 | 1001222229-1392 Циклоалкен | Циклогексен | 6 | 10 | 82,14 | -104 | 83 | 0,811 | -17 | 2 267 -17 | 2 267 96. |  17 17-55 | 115 | 0,823 | Циклоалкен | Циклооктен | цис-циклооктен | 8 | 14 | 209 | 14 | 2 9136 909 | Алкилциклопентан | Метилциклопентан | 6 | 12 | 84.16 | -142 | 72 | 0,749 | <-10 | 315 | Алкилциклопентан | Этилциклопентан | 7 | 2410429 7 | 26 14929 Алкилциклопентан | пропилциклопентан | 8 | 16 | 112,21 | -117 | 131 | 0.776 | Alkylcyclopentane butylcyclopentane | 9 18 | 126,23 | -108 156 | 0,785 | Alkylcyclopentane pentylcyclopentane | 10 | 20 | 140,26 | -83 | 180 | 0,791 | Алкилциклопентан | гексилциклопентан | 11 | 22 | 154. |  29 29 -73 206 | 0,797 | Alkylcyclopentane heptylcyclopentane | 12 | 24 | 168,31 -61 | 224 | 0,801 | Alkylcyclopentane октилциклопентан | 13 | 26 | 182,34 | -45 | 242 | 0,805 | Алкилциклопентан | 222222092 | 0936 | -29 | 262 | 0.808 | Алкилциклопентан | децилциклопентан | 15 | 30 | 2 210.36 -9 Алкилциклогексан | Метилциклогексан | Гептанафтен | 7 | 14 | 98.18 | -127 | 101 | 0,770 | -4 | 260 | Алкилциклогексан | Этилциклогексан | 8 | 2 16 Алкилциклогексан | Пропилциклогексан | 9 | 18 | 126,23 | -95 | 156 | 0. |  794 794 35 | 248 | алкилциклогексана butylcyclohexane | 10 | 20 | 140,26 -75 | 181 | 0,790 41 | 0 | алкилциклогексана пентилциклогексан | 11 | 22 | 154,29 | -58 | 204 | 0,804 | 0 | Алкилциклогексан | гексилциклогексан | 12 909 909 12 | гексилциклогексан | 12 | 31 | -48 225 | 0,808 | алкилциклогексана heptylcyclohexane | 13 | 26 | 182,34 -40 244 | 0,811 | алкилциклогексана октилциклогексан | 14 | 28 | 196,36 | -20 | 263 | 0,814 | Алкилциклогексан | 22циклогексан | 2циклогекс39 | -10 | 281 | 0,816 | Алкилциклогексан | децилциклогексан | 16 | 32 | 2241006-2 | 32 | 2241006-2 | 22410012 | 2 2241002 | додецилциклогексан 18 | 36 | 252,47 | 13 | 331 | 0,822 | Алкилциклогексан | 21006 20901222 2250 | 24 | 358 | 0,825 | алкилциклогексана | pentadecylcyclohexane | 21 | 42 | 294,55 | 25 | 371 | 0,827 | алкилциклогексана | octadecylcyclohexane | 24 | 48 | 336,62 | 42 | 409 | 0,830 | 10 | 18 | 138. |  25 25-30 | 187 | 0,866 | 250 | Дициклоалкан | цис-декагидронафталин | цис-декалин | 10 | 100122 138 | 10 | 100122 138 | 250 | Алкилбензол | Бензол | Бензол | 6 | 6 909.11 | 6 | 80 | 0,880 | -11 | 555 | Алкилбензол | Метилбензол | Толуол, толуол | 210062 922222222 9 6 | 535 | Алкилбензол | Этилбензол | Фенилэтан | 8 | 10 | 106,16 | -95 | 136 | 0.866 | Алкилбензол | 1,2-Диметилбензол | орто-ксилол | 8 | 10 | 106,16 | -24 | 2 1441006-24 | 2144 -24 Алкилбензол | 1,3-Диметилбензол | мета-ксилол | 8 | 10 | 106,16 | -48 | 139 | 0,86 | 27 | 527 | 27 | 527 | 527 9090 | пара-ксилол | 8 | 10 | 106. |  16 16 13 | 138 | 0,861 | 27 | 528 | Алкилбензол | Пропилбензол | 9 | 12 | 21006 1201009 9 | 12 | 21006 1201009 Алкилбензол | Бутилбензол | 10 | 14 | 134,21 | -88 | 183 | 0,860 | 58 | 2бензол 0,860 | 58 | 006 41022бензол2бензол21009 16 | 148.24 | -75 | 205 | 0,859 | 66 | Алкилбензол | Гексилбензол | Mellitene | 12 | 26 186 12 | 26 18626 18 | 09 | Алкилбензол | Гептилбензол | 13 | 20 | 176,29 | -48 | 242 | 0,857 | -36 | 263 | 0,856 | Алкилбензол | Нонилбензол | 15 | 24 | 204,34 | 9 -24 | 204,34 | -24 909 Децилбензол | 16 | 26 | 218,37 | -14 | 298 | 0,855 | Алкилбензол | Додецилбензол 6 9012 | | 42 | 3 | 329 | 0,855 | алкилбензол | Tetradecylbenzene | 20 | 34 | 274,47 | 16 | 347 | 0,855 | алкилбензол | Pentadecylbenzene | 21 | 36 | 288,50 | 22 | 373 | 0,855 | Алкилбензол | Гексадецилбензол | 27 | 385 | 0,855 | алкилбензол | Heptadecylbenzene | 23 | 40 | 316,55 | 32 | 395 | 0,855 | алкилбензол | октадецилбензолсульфокислоту | 24 | 42 | 330,58 | 35 | 400 | 0,85 36 | Алкилбензол | Нонадецилбензол | 60 | 40 | 419 | 0,855 | Тетрагидро-наффталин 9,31006 9,3100 Тетрагидро-нафтален | 12 | 132,20 | -35 | 207 | 0,973 | 384 | Тетрагидро-нафталин | 1,2,3,4-тетрагидро-1-метил-нафталин 1126 14 909 909 | 146. |  23 23 221 | 0,9583 | Тетрагидро-нафталин | 1,2,3,4-тетрагидро-5-метил-нафталин | 11 | 26 14 0,9720 | Тетрагидро-нафталин | 1,2,3,4-тетрагидро-6-метил-нафталин | 11 | 14 | 146,23100 -6 | 9129 0 9129 146,23 100 | 9100 .9537 Тетрагидро-нафталин | 1-гексил-1,2,3,4-тетрагидронафталин | 16 | 24 | 216,36 | 141292 | 216,36 | 2 | Диароматика | Нафталин | 10 | 8 | 128,16 | 006 806.025 80 | 540 | Диароматика | 1-метилнафталин | 11 | 10 | 142,19 | -31 | 240 | 2 | 240 | 1-этилнафталин | 12 | 12 | 156,22 | -14 | 258 | 1. |  008 008 Диароматика | 22212 | 24 | -9 | 273 | 0,990 | Диароматика | 1-бутилнафталин | 14 | 16 | 184.27100 | 184.27100 | 184.27100 | 1-пентилнафталин | 15 | 18 | 198,29 | -25 | 305 | 0,966 | Гексаген 0012 | t609.32 | -18 | 322 | 0,957 | Диароматика | 1-нонилнафталин | 19 | 26 | 254.40100 | 254.40100 | 254.40100 | 909 | 1-децилнафталин | 20 | 28 | 268,42 | 15 | 379 | 0,932 | Диароматика | 2 | 2 9012 | 2 | 919 | 35 | 241 | 1,006 | 98 | 488 | Диароматика | 2-этилнафталин | 12 | 12 001229 | 12 | 12 00122929 156 | Диароматика | 1,2-диметилнафталин | 12 | 12 | 156,22 | -3 | 267 | 1. |  018 0182 0986 diar diar | 9 12 | 156.22 | -6 | 265 | 1.014 | Диароматика | 1,4-диметилнафталин | 12 | 12 | 15612100 8 | 15612100 9 | 15612100 9 Диароматика | 1,5-диметилнафталин | 12 | 12 | 156,22 | 82 | 267 | — | 26 12-девятилетний2222222 | 156.22 | -16 | 263 | 1.002 | Диароматика | 1,7-диметилнафталин | 12 | 12 | 15612100,22 | 12 | 15612100,22 | 9 1561260,22 | 9 1,09 Диароматика | 1,8-диметилнафталин | 12 | 12 | 156,22 | 63 | 276 | 1,003 |  3-диметилнафталин 3-диметилнафталин 12 | 12 | 156,22 | 104 | 267 | 1.003 | Диароматика | 2100 121006 00 253 | 1,003 | Диароматика | 2,7-диметилнафталин | 12 | 12 | 156.22 | 96 | 262 | 1.003 | Triaromatics | 262 909 1,18 | 171 | > 450 | Triaromatics | Антрацен | 14 | 10 | 178.22 | 216 | 341 | 1,28 25 | Триароматические углеводороды | 1-метилантрацен | 15 | 12 | 00479 12 | 00609 902 | Triaromatics | 2-метилантрацен | 15 | 12 | 192,25 | 209 | 340 | 1. |  8 0 8 0 Triaromatics | 9-метилантрацен | 15 | 12 | 192,25 | 82 | ~ 340 | 1.02609 | Tetraaromatics | Бензофенантрен | 18 | 12 | 228,28 | 256 | 448 | 1.274 | Тетраароматикс | Хризен | 1,2-Бензофенантрен | 18 | 12 | 228,28 | 255 | 448 |
255 | 448 |
2 | Тетрааромат 6 фенан (12 100122 | 2 | 9 | 228. |  28 28 156 | 404 | 1,21 | 200 | * Обратите внимание, что некоторые из веществ имеют температуру плавления выше 20 ° C, и что данные плотности даны для твердого состояния. Надстрочные обозначения указывают температуру измерения (в ° C), отличную от 20 ° C. | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Определение органических соединений
Углеводород: органическое соединение, полностью состоящее из водорода и углерода.
Основные группы углеводородов:
Алкан: Ациклический насыщенный углеводород с общей формулой Cnh3n + 2. Также называется парафином .
Алкен : ненасыщенный углеводород, содержащий по крайней мере одну углерод-углеродную двойную связь, с общей формулой Cnh3n. Также называется олефином .
Алкин : ненасыщенный углеводород, содержащий по крайней мере одну тройную связь углерод-углерод, с общей формулой Cnh3n-2. Также называется ацетилены .
Также называется ацетилены .
Циклоалкан : Однокольцевый (моноциклический) насыщенный углеводород с общей формулой Cnh3n. Также называется нафтен .
Циклоалкен: Алкеновый углеводород, который содержит замкнутое кольцо атомов углерода, но не имеет ароматических свойств, с общей формулой Cnh3n-2. Также называется циклоолефин .
Ароматический углеводород : Циклическая (кольцевая) плоская (плоская) молекула с кольцом резонансных связей, которая демонстрирует большую стабильность, чем другие геометрические или соединительные структуры с тем же набором атомов.Самый простой из ароматических углеводородов имеет 6 атомов углерода и содержит 3 двойные связи. Однокольцевое ароматическое соединение без каких-либо заместителей называется бензолом с формулой C6H6.
Полициклические ароматические углеводороды: углеводородов, которые состоят из нескольких ароматических колец. Ароматический компонент с двумя кольцами без каких-либо заместителей называется нафталином с формулой C10H8.
Ароматический компонент с двумя кольцами без каких-либо заместителей называется нафталином с формулой C10H8.
Некоторые подчиненные группы углеводородов, приведенные в этом документе:
Алкил: Алкильная группа представляет собой алкановый заместитель, в котором отсутствует один водород, с общей формулой Cnh3n + 1
Фенил : фенильная группа является отсутствующим бензольным заместителем один водород с общей формулой C6H5.
2-Метилалкан: Разветвленный алкан с метильной группой, соединенной со вторым атомом углерода в основной углеродной цепи.
3-Метилалкан: Разветвленный алкан с метильной группой, соединенной с третьим атомом углерода в основной углеродной цепи.
2-Метилалкен: Разветвленный алкен с метильной группой, соединенной со вторым атомом углерода в основной углеродной цепи.
Алкилциклогексан : Монозамещенный циклогексан с одним разветвлением через присоединение одной алкильной группы к одному атому углерода циклогексанового кольца с общей формулой CnH (2n + 1) C6h21.
Алкилциклопентан: Монозамещенный циклопентан с одним разветвлением через присоединение одной алкильной группы к одному атому углерода циклогексанового кольца с общей формулой CnH (2n + 1) C5H9.
Алкилбензол: Монозамещенный бензол с одним разветвлением через присоединение одной алкильной группы к одному атому углерода бензольного кольца с общей формулой CnH (2n + 1) C6H5.
1-Алкилнафталин: Монозамещенный нафталин с одним разветвлением через присоединение одной алкильной группы к одному атому углерода одного из ароматических колец с общей формулой CnH (2n + 1) C10H7.
Рост молекулярной массы за счет расширения кольца в полициклических ароматических углеводородах за счет радикально-радикальных реакций
Руве, Л., Мошаммер, К., Хансен, Н. и Козе-Хойнгхаус, К. Влияние структуры молекулярного топлива на реакции горения по отношению к предшественникам сажи в отдельных пламенах алканов и алкенов. Phys. Chem. Chem. Phys. 20 , 10780–10795 (2018).
Phys. Chem. Chem. Phys. 20 , 10780–10795 (2018).
CAS Статья Google ученый
Тиленс А.Г.М. Молекулярная вселенная. Ред. Мод. Phys. 85 , 1021–1081 (2013).
ADS CAS Статья Google ученый
Хансен, Н., Шенк, М., Мошаммер, К. и Козе-Хоингхаус, К. Исследование путей повторяющихся реакций для образования полициклических ароматических углеводородов в процессах горения. Сжигание. Пламя 180 , 250–261 (2017).
CAS Статья Google ученый
Mulas, G., Falvo, C., Cassam-Chenai, P. & Joblin, C. Ангармоническая колебательная спектроскопия полициклических ароматических углеводородов (ПАУ). J. Chem. Phys. 149 , 144102 (2018).
& Joblin, C. Ангармоническая колебательная спектроскопия полициклических ароматических углеводородов (ПАУ). J. Chem. Phys. 149 , 144102 (2018).
ADS Статья Google ученый
Kohse-Hoeinghaus, K. Новая эра в исследованиях горения. Pure Appl. Chem. 91 , 271–288 (2019).
CAS Статья Google ученый
Йоханссон, К. О., Хед-Гордон, М. П., Шредер, П. Э., Уилсон, К. Р. и Мичельсен, Х. А. Резонансно-стабилизированные цепные углеводородно-радикальные цепные реакции могут объяснить образование и рост сажи. Наука 361 , 997–1000 (2018).
ADS MathSciNet CAS Статья Google ученый
Князев В.Д., Попов К.В. Кинетика самореакции циклопентадиенильных радикалов. J. Phys.Chem. А 119 , 7418–7429 (2015).
CAS Статья Google ученый
Тиленс А. и Алламандола Л. Дж. В Физика и химия при низких температурах Ch. 2, 341–380 (Pan Stanford Publishing, New York, 2011).
Jones, A. P. et al. Цикл углерода в пыли и из пыли. Фарадей Обсудить. 168 , 313–326 (2014).
ADS CAS Статья Google ученый
МакЭналли, К.С., Пфефферле, Л.Д., Атакан, Б. и Козе-Хёингхаус, К. Исследования механизмов образования ароматических углеводородов в пламени: прогресс в направлении закрытия топливного разрыва. Прог. Энергия сгорания. Sci. 32 , 247–294 (2006).
Прог. Энергия сгорания. Sci. 32 , 247–294 (2006).
CAS Статья Google ученый
Ри, Ю. М., Ли, Т. Дж., Гудипати, М. С., Алламандола, Л. Дж. И Хед-Гордон, М. Заряженные кластеры полициклических ароматических углеводородов и галактическое протяженное красное излучение. Proc. Natl Acad. Sci. США 104 , 5274–5278 (2007).
ADS CAS Статья Google ученый
Гилмор И. и Пиллинджер К. Т. Изотопные составы индивидуальных полициклических ароматических углеводородов из метеорита Мерчисон. Пн. Нет. R. Astron. Soc. 269 , 235–240 (1994).
ADS CAS Статья Google ученый
Нараока, Х., Симояма, А. и Харада, К. Изотопные данные антарктического углеродистого хондрита для двух реакционных путей образования внеземных ПАУ. Планета Земля. Sci. Lett. 184 , 1–7 (2000).
ADS CAS Статья Google ученый
Ван Х. и Френклах М. Расчет коэффициентов скорости химически активированных реакций ацетилена с виниловыми и ароматическими радикалами. J. Phys. Chem. 98 , 11465–11489 (1994).
ADS CAS Статья Google ученый
Wang, H. & Frenklach, M. Детальное исследование кинетического моделирования образования ароматических углеводородов в ламинарном пламени предварительно смешанного ацетилена и этилена. Сжигание. Пламя 110 , 173–221 (1997).
Сжигание. Пламя 110 , 173–221 (1997).
CAS Статья Google ученый
Schenk, M. et al. Образование ПАУ и морфология сажи в пламени топлива C4. Proc. Гореть. Inst. 35 , 1761–1769 (2015).
CAS Статья Google ученый
Zhao, L. et al. Синтез пирена в околозвездных оболочках и его роль в формировании 2D наноструктур. Нат. Astron. 2 , 413–419 (2018).
ADS Статья Google ученый
Мицелотта, Э., Джонс, А. и Тиленс, А. Переработка полициклических ароматических углеводородов в межзвездных толчках. А А 510 , А36 (2010).
А А 510 , А36 (2010).
Артикул Google ученый
Загидуллин М.В. и др. Функциональные зависимости между кинетическими, проточными и геометрическими параметрами в высокотемпературном химическом микрореакторе. J. Phys. Chem. А 122 , 8819–8827 (2018).
CAS Статья Google ученый
Mebel, AM & Kislov, VV Can the C 5 H 5 + C 5 H 5 -> C 10 H 10 -> C 10 H 9 + H / C 10 H 8 + H 2 реакция дает нафталин? Исследование Ab Initio / RRKM. J. Phys. Chem. А 113 , 9825–9833 (2009).
CAS Статья Google ученый
Каваллотти, К.И Полино Д. О кинетике реакции C 5 H 5 + C 5 H 5 . Proc. Гореть. Inst. 34 , 557–564 (2013).
CAS Статья Google ученый
Джаспер, А. В. и Хансен, Н. Изомеризация фульвена в бензол с участием водорода и более крупных циклических ароматических углеводородов. Proc. Гореть. Inst. 34 , 279–287 (2013).
CAS Статья Google ученый
Мебель, А. М., Георгиевский, Ю., Джаспер, А. В., Клиппенштейн, С. Дж. Константы скорости роста ПАУ, зависящие от давления: образование индена и его превращение в нафталин. Фарадей Обсудить. 195 , 637–670 (2016).
ADS CAS Статья Google ученый
Москалева, Л., Mebel, A. & Lin, M. Реакция CH 3 + C 5 H 5 : потенциальный источник бенола при высоких температурах. Proc. Гореть. Inst. 26 , 521–526 (1996).
Артикул Google ученый
Шарма, С. и Грин, У. Х. Рассчитанные коэффициенты скорости и выход продукта для c-C 5 H 5 + CH 3 → продукты. J. Phys. Chem. А 113 , 8871–8882 (2009).
CAS Статья Google ученый
Красноухов В. С., Порфирьев Д.П., Завершинский И.П., Азязов В.Н., Мебель А.М. Кинетика реакции CH 3 + C 5 H 5 : теоретическое исследование. J. Phys. Chem. А 121 , 9191–9200 (2017).
С., Порфирьев Д.П., Завершинский И.П., Азязов В.Н., Мебель А.М. Кинетика реакции CH 3 + C 5 H 5 : теоретическое исследование. J. Phys. Chem. А 121 , 9191–9200 (2017).
CAS Статья Google ученый
Фар, А., Халперн, Дж. Б. и Тарди, Д. С. Расчетные и экспериментальные исследования влияния давления на реакции кросс-сочетания радикалов: C 2 H 5 + C 2 H 3 . J. Phys. Chem. А 111 , 6600–6609 (2007).
CAS Статья Google ученый
Пан, Х., Лю, К., Караччиоло, А. и Касавеккья, П. Динамика многоатомных реакций с перекрещенными лучами: последние достижения и новые идеи. Chem. Soc. Ред. 46 , 7517–7547 (2017).
Chem. Soc. Ред. 46 , 7517–7547 (2017).
CAS Статья Google ученый
Пиллинг М. Радикально-радикальные реакции. Annu. Rev. Phys. Chem. 47 , 81–108 (1996).
ADS CAS Статья Google ученый
Jochims, H. W., Rasekh, H., Ruehl, E., Baumgaertel, H. & Leach, S. Фотофрагментация монокатионов нафталина и азулена в диапазоне энергий 7–22 эВ. Chem. Phys. 168 , 159–184 (1992).
CAS Статья Google ученый
Zhao, L. et al. ВУФ фотоионизационное исследование образования простейшего полициклического ароматического углеводорода: нафталина (C 10 H 8 ). J. Phys. Chem. Lett. 9 , 2620–2626 (2018).
J. Phys. Chem. Lett. 9 , 2620–2626 (2018).
CAS Статья Google ученый
Zhang, F. et al. VUV фотоионизационное исследование образования молекулы индена и его изомеров. J. Phys. Chem. Lett. 2 , 1731–1735 (2011).
CAS Статья Google ученый
Yang, T. et al. Обнаружен забор водорода / добавление ацетилена. Angew. Chem. Int. Эд. 55 , 14983–14987 (2016).
CAS Статья Google ученый
Zhao, L. et al. Низкотемпературное образование полициклических ароматических углеводородов в атмосфере Титана. Нат. Astron. 2 , 973 (2018).
Нат. Astron. 2 , 973 (2018).
ADS Статья Google ученый
Hansen, N. et al. Комбинированное неэмпирическое и фотоионизационное масс-спектрометрическое исследование полиинов в пламени с высоким содержанием топлива. Phys. Chem. Chem. Phys. 10 , 366–374 (2008).
CAS Статья Google ученый
Mostefaoui, S., Hoppe, P. & El Goresy, A. Обнаружение на месте графита с межзвездными изотопными сигнатурами в класте без хондр в хондрите L3. Наука 280 , 1418–1420 (1998).
ADS CAS Статья Google ученый
Зиннер, Э., Амари, С., Вопенка, Б. и Льюис, Р.С. Межзвездный графит в метеоритах: изотопный состав и структурные свойства отдельных зерен графита из Мерчисона. Метеоритика 30 , 209–226 (1995).
ADS CAS Статья Google ученый
Messenger, S. et al. Аборигенные полициклические ароматические углеводороды в околозвездных зернах графита примитивных метеоритов. Astrophys. J. 502 , 284–295 (1998).
ADS CAS Статья Google ученый
Смит П.П. К. и Бузек, П. Р. Углерод в метеорите Альенде: свидетельство того, что углерод скорее плохо графитизирован, чем карбин. Геохим. Cosmochim. Acta, Suppl. 16 , 1167–1175 (1982).
CAS Google ученый
Duley, W. W. Химическая эволюция углеродистого материала в межзвездных облаках. Astrophys. J. 528 , 841–848 (2000).
ADS CAS Статья Google ученый
Паркер Д. С., Кайзер Р. И., Трой Т. П. и Ахмед М. Обнаружен отбор водорода / добавление ацетилена. Angew. Chem. Int. Эд. 53 , 7740–7744 (2014).
CAS Статья Google ученый
Parker, D. S. N. et al. Неожиданная химия из реакции нафтила и ацетилена при температурах, подобных горению. Angew. Chem. Int. Эд. 54 , 5421–5424 (2015).
54 , 5421–5424 (2015).
CAS Статья Google ученый
Qi, F. Исследование химии горения с помощью синхротронной фотоионизационной масс-спектрометрии VUV. Proc. Гореть. Inst. 34 , 33–63 (2013).
CAS Статья Google ученый
Ли, К., Янг, В. и Парр, Р. Г. Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности. Phys. Ред. B 37 , 785 (1988).
ADS CAS Статья Google ученый
Беке, А. Д. Плотностно-функциональная термохимия. III. Роль точного обмена. J. Chem. Phys. 98 , 5648–5652 (1993).
ADS CAS Статья Google ученый
Knizia, G., Adler, T. B. & Werner, H.-J. Упрощенные методы CCSD (T) -F12: теория и тесты. J. Chem. Phys. 130 , 054104 (2009).
ADS Статья Google ученый
Adler, T. B., Knizia, G. & Werner, H.-J. Простое и эффективное приближение CCSD (T) -F12. J. Chem. Phys. 127 , 221106 (2007).
ADS Статья Google ученый
Frisch, M. J. et al. Gaussian 09, редакция A.01 (Gaussian Inc., Wallingford, 2009).
Вернер, Х.-Дж., Ноулз, П. Дж., Книция, Г., Манби, Ф. Р. и Шуэц, М. Молпро: универсальный программный пакет по квантовой химии. Wiley Interdiscip. Реверс: Comput. Мол. Sci. 2 , 242–253 (2012).
CAS Google ученый
Маркус, Р. А. Мономолекулярные диссоциации и реакции свободнорадикальной рекомбинации. J. Chem. Phys. 20 , 359–364 (1952).
ADS CAS Статья Google ученый
Георгиевский Ю., Миллер Дж. А.& Klippenstein, SJ. Константы скорости реакции между резонансно-стабилизированными радикалами: C 3 H 3 + C 3 H 3 , C 3 H 3 + C 3 H 5 и C 3 H 5 + C 3 H 5 . Phys. Chem. Chem. Phys. 9 , 4259–4268 (2007).
CAS Статья Google ученый
Celani, P. & Werner, H.-J. Теория возмущений с множеством опорных точек для больших ограниченных и выбранных опорных волновых функций активного пространства. J. Chem. Phys. 112 , 5546–5557 (2000).
ADS CAS Статья Google ученый
Шиодзаки, Т., Дьерфи, В., Целани, П. и Вернер, Х.-Дж. Коммуникация: расширенная многомерная теория возмущений второго порядка полного активного пространства: энергетические и ядерные градиенты. J. Chem. Phys. 135 , 081106 (2011).
ADS Статья Google ученый
Siegbahn, E.M., Almloef, J., Heiberg, A. & Roos, B.O. Метод SCF полного активного пространства (CASSCF) в рецептуре Ньютона-Рафсона с применением к молекуле нитрозилгидрида. J. Chem. Phys. 74 , 2384–2396 (1981).
ADS CAS Статья Google ученый
Мартин, Дж. М. Л. и Узан, О. Сходимость по базисному множеству в соединениях второго ряда. Импорт. ядро Polariz. Функц. Chem. Phys. Lett. 282 , 16–24 (1998).
ADS CAS Google ученый
Георгиевский Ю., Миллер, Дж. А., Берк, М. П., Клиппенштейн, С. Дж. Переформулировка и решение основного уравнения для химических реакций с несколькими лунками. J. Phys. Chem. А 117 , 12146–12154 (2013).
CAS Статья Google ученый
Георгиевский Ю. и Клиппенштейн С. Дж. Пакет программ MESS , http://tcg.cse.anl.gov/papr. (2015).
Трое Дж. Теория термических мономолекулярных реакций при низких давлениях. I. Решения главного уравнения. J. Chem. Phys. 66 , 4745–4757 (1977).
ADS CAS Статья Google ученый
Аналитические методы определения распределения общего количества углеводородов нефти в воде и отложениях водных систем: обзор
Рассмотрены несколько методов экстракции и аналитического определения общего количества углеводородов нефти (TPHC) в водных и твердых пробах.Инфракрасная спектроскопия — один из эффективных методов, которые сегодня заменяются в связи с избавлением от некоторых галогенированных растворителей, классифицируемых как озоноразрушающие вещества. Гравиметрический метод, который использует н-гексан в качестве экстракционного растворителя для определения масла и жира, а также неполярных материалов, стал предпочтительным выбором, несмотря на то, что он не подходит для летучих веществ из-за обязательной стадии испарения. Другие часто используемые методы включают газовую хроматографию с пламенно-ионизационным детектором (FID) или масс-спектрометрическим детектором (MSD), который может определять тип присутствующих углеводородов и применим как к летучим, так и к полулетучим образцам.Ультрафиолетовая флуоресценция — это еще один метод, который доступен как в портативном полевом устройстве, так и в качестве лабораторного оборудования за пределами площадки. У каждого из методов есть свои преимущества и недостатки; следовательно, выбор метода зависит от типа необходимых данных, как подробно обсуждается в этом обзоре. Также были рассмотрены распределение TPHC в воде и отложениях по всему миру и факторы, влияющие на распределение.
1. Введение
Нефтяные углеводороды (PHC) занимают важное место среди органических загрязнителей, которые часто сбрасываются в морскую среду в более низких концентрациях в виде городских стоков, автомобильных и ливневых стоков, промышленных или бытовых отходов [1–3 ] и иногда в более высоких концентрациях, как крупный разлив нефти [4, 5].Основными составляющими этих ПГС являются деградированная сырая нефть, сжигаемое ископаемое топливо и нормальные алканы [6, 7]. Как правило, они менее растворимы в воде, но легко адсорбируются на твердых частицах и впоследствии переносятся в донные отложения, которые стали резервуаром для нескольких гидрофобных загрязнителей. Опасность осаждения этих органических загрязнителей заключается в их тенденции к накоплению и биоконцентрации со временем в водных организмах [8–10].
Общее количество нефтяных углеводородов (TPHC) — это термин, обычно используемый для описания количества углеводородов на нефтяной основе, извлеченных и количественно определенных определенным методом в матрице окружающей среды [11, 12].Аналитические методы TPHC сильно различаются по объему, каждый из которых дает результаты в пределах определенного диапазона, а некоторые из них неспецифичны. Следовательно, понимание того, как проводился анализ, очень важно для правильной интерпретации полученных результатов. Методы с разной эффективностью экстракции могут давать разные концентрации TPHC для одного и того же образца [13, 14]. Следовательно, результаты, полученные с использованием разных процедур, всегда трудно сравнивать, поскольку используются разные калибровочные стандарты и экстрагирующие растворители [6].
Нефтяные углеводороды состоят в основном из трех групп соединений, а именно алканов, алкенов и ароматических соединений [15]. Алканы являются ключевыми компонентами многих нефтепродуктов (например, бензина, дизельного топлива, керосина, реактивного топлива и топочного мазута) и подразделяются на несколько классов, которые включают следующие: линейные алканы (н-алканы), разветвленные алканы, изопреноиды. , циклоалканы (например, стераны и тритерпаны) и нерастворенные сложные смеси (UCM), которые трудно разделить с помощью газовой хроматографии на капиллярной колонке [6, 16].Присутствие UCM на хроматограммах обычно свидетельствует о разложении нефти. Они обычно находятся в высокомолекулярном диапазоне н-алканов, но иногда также присутствуют в низкомолекулярном диапазоне [17, 18].
TPHC иногда определяется как сумма концентраций н-алканов и UCM [19] или как общая концентрация всех углеводородов, элюируемых от н-нонана (C9) до н-гексатриаконтана (C36), за исключением приоритетных полициклических ароматических углеводородов [ 20]. В основном они обнаруживаются в диапазоне более высоких молекулярных масс углеводородов, а иногда также в диапазоне низких молекулярных масс [21].TPHC можно также измерить как сумму алифатических и ароматических углеводородов, особенно в следующих группах: от C9 до C18 (алифатические), от C19 до C36 (алифатические) и от C11 до C22 (ароматические) [22–24].
Суммарные нефтяные углеводороды (TPHC) сами по себе не могут быть прямым указателем опасности для человека или окружающей среды [13, 25], но их присутствие указывает на состояние здоровья водного объекта, а также используется для отслеживания источников загрязнения в прибрежные воды и отложения [26, 27].В этой статье мы рассматриваем существующие методы извлечения нефтяных углеводородов из воды и твердых образцов, сравниваем методы окончательного определения и оцениваем уровни нефтяных углеводородов в водной среде по всему миру, а также доступные инструменты для отслеживания источников с использованием н- алканы в качестве эталонных соединений.
2. Физико-химические свойства
2.1. Точки кипения
Обычно температура кипения углеводородов (УВ) увеличивается с увеличением количества атомов углерода.Для н-алканов увеличение примерно на 20 ° C наблюдается при каждом добавлении нового атома углерода в цепь. PAHC характеризуются более высокими температурами плавления и кипения, чем их соответствующие н-алканы, и поэтому они являются твердыми по своей природе [28].
2.2. Растворимость, летучесть и стойкость
Степень взаимодействия углеводородных структур с водой зависит от степени их полярности. Алифатические углеводороды обычно менее полярны и поэтому менее растворимы в воде по сравнению с их соответствующими ароматическими аналогами.Например, растворимость алифатических углеводородов в диапазоне C5-C6 составляет 36 мг / л, в то время как ароматические углеводороды в том же диапазоне имеют растворимость до 220 мг / л. Наиболее растворимыми компонентами ароматических углеводородов являются низкомолекулярные соединения. Следовательно, растворимость снижается с увеличением числа ароматических колец и молекулярной массы. С другой стороны, алифатические углеводороды относительно более летучие, чем ароматические углеводороды с аналогичным числом атомов углерода [29].Почти все нормальные алканы с числом атомов углерода менее 15 теряются в результате улетучивания в первые дни разлива, тогда как алканы с числом атомов углерода более 20 теряются через несколько недель [13, 30]. Углеводороды с более низким весом менее устойчивы в окружающей среде, в отличие от углеводородов с высоким молекулярным весом. Следовательно, стойкость нефтяных углеводородов возрастает с увеличением температуры кипения соединения [28].
2.3. Токсичность и микробное разложение
Ароматические углеводороды считаются относительно более токсичными и более устойчивыми к микробной деградации, чем соответствующие нормальные алканы, изоалканы, циклоалканы и ненасыщенные алифатические углеводороды [5, 31].Степень токсичности загрязняющих веществ в воде в значительной степени зависит от уровня их растворимости [28]. Микробное разложение углеводородов является функцией многих факторов, включая уровень растворенного кислорода, pH и микробную популяцию в окружающей среде. Популяция бактерий-разлагателей может быть ниже в незагрязненной среде, но может резко увеличиваться при контакте с разлитыми нефтяными веществами [32–36].
Степень восприимчивости углеводородов к микробной деградации отличается от одного класса к другому [37, 38], и бактерии могут разлагать алифатические, алициклические и ароматические углеводороды от низкого до среднего веса с большей скоростью, когда условия окружающей среды очень идеальны.Однако скорость биодеградации снижается по мере увеличения сопротивления из-за увеличения молекулярной массы соединений [39]. Типичный порядок убывания биоразложения представлен следующим образом: н-алканы> разветвленные алканы> ароматические соединения с низким молекулярным весом> циклические алканы> ароматические соединения с высоким молекулярным весом. Ароматические углеводороды, как правило, менее подвержены биологическому разложению, чем соответствующие алифатические углеводороды [5, 37, 38].
Оксигеназы могут превращать алканы в спирт в процессе разложения.Спирт может быть окислен до альдегида, а затем до жирных кислот, которые впоследствии могут быть использованы в β -окислении алифатической цепи. Аналогичным образом циклоалканы могут быть разложены оксидазами до циклического спирта, а затем дегидрированы до кетона. Точно так же ароматические углеводороды могут быть преобразованы в эпоксид под действием оксигеназ. Затем продукт может быть гидратирован до транс--дигидродиолов, которые позже окисляются до катехолов. Позже катехол может быть дополнительно окислен до муконовой кислоты или 2-гидроксимуконовой полуальдегида [40], которые в конечном итоге могут быть разложены с образованием органических кислот, которые используются микроорганизмами для синтеза клеток и производства энергии [41].
3. Источники нефтяных углеводородов в морской среде
Нефтяные углеводороды в морской среде происходят из естественных (биогенных или диагенетических) и антропогенных (петрогенных или пирогенных) источников [42]. Под углеводородами из биогенных источников понимаются углеводороды, производимые живыми организмами (например, планктонами, водорослями и бактериями) или в результате биологических процессов с участием наземных растений. Примеры включают алифатические углеводороды C23 – C33, которые в основном образуются из детрита наземных растений, и н-алканы с нечетными номерами (C15, C17 и C19) из биогенных морских источников, которые обычно доступны в небольших количествах [43].Углеводороды из диагенетических источников — это углеводороды, образующиеся в результате физических и геохимических изменений, которые претерпевают отложения после их первоначального отложения, когда они превращаются в горные породы. В морские воды они попадают в основном за счет естественной фильтрации [44].
Антропогенные углеводороды обычно больше находятся в окружающей среде, чем природные. Обычно они образуются в результате различных видов деятельности человека, таких как индустриализация, урбанизация, транспортировка, утилизация нефти, операции и хранение, судоходство и рыболовство [45, 46].Обилие C16, C18 и C20 в большинстве случаев предполагает разлив нефти [18] из резервуаров и нефтепроводов, построенных для перекачки сырой нефти из одного места в другое [44]. Для углеводородов антропогенного происхождения уровень алканов с нечетными номерами почти равен уровню алканов с четными номерами, обычно в соотношении 1: 1 [43]. В начале 1980-х годов был сделан вывод, что примерно 10% сырой нефти в морской среде поступает из естественных нефтяных просачиваний, а еще 27% приходится на добычу, переработку и транспортировку нефти, а оставшаяся часть 63% поступает из городских и речной сток, атмосферные выбросы, коммунальные и промышленные стоки, среди прочего [44].
4. Сбор и сохранение проб
Стратегии сбора и подготовки проб очень важны при анализе нефтяных углеводородов в окружающей среде [47]. Проба должна быть собрана без загрязнения и полностью репрезентативна для окружающей среды, в которой она была взята [11, 13]. Аналитик должен убедиться, что во время и после сбора образцов не было допущено систематической ошибки или систематической ошибки. Оборудование для отбора проб необходимо тщательно очищать между точками отбора проб, чтобы избежать перекрестного загрязнения, а проба должна быть однородной.В соответствии с надлежащей практикой для водных проб требуется минимум один дубликат полевой пробы, и над пробой следует оставить пространство для воздуха, чтобы предотвратить переполнение [47, 48].
Для отбора водных проб рекомендуется использовать 1-литровые бутыли из желтого стекла с завинчивающейся крышкой с тефлоновым покрытием. Во время сбора образцы должны храниться в концентрированной HCl или H 2 SO 4 до pH <2 и выдерживаться при 4 ° C сразу после сбора до экстракции в течение 14 дней после сбора.Однако неконсервированные образцы необходимо извлечь в течение 7 дней [23, 48, 49]. Образцы почвы или донных отложений следует собирать с помощью грейферного или кернового пробоотборника или любого другого оборудования, которое будет сочтено подходящим в стеклянном сосуде с широким горлышком на 120 мл или сосуде любых других размеров, в зависимости от количества образцов, необходимых для анализа [47]. Образцы необходимо охладить до 4 ° C и экстрагировать в течение 14 дней после сбора. Как водные экстракты, так и экстракты почвы / донных отложений необходимо проанализировать в течение 40 дней после экстракции [11, 49].Объем 400 мл - это наименьший размер водной пробы, разрешенный для этого анализа, при условии соблюдения соотношения растворитель / проба [23].
Образцы почвы или донных отложений могут быть сохранены при температуре 4 ± 2 ° C во время сбора и затем заморожены при –10 ° C в течение 48 часов. Образец должен быть извлечен не позднее 14 дней после размораживания и проанализирован в течение следующих 40 дней. Замороженные образцы могут храниться до года перед анализом, если это необходимо, но должны быть извлечены в течение 24 часов после размораживания [48].
5. Методы экстракции и очистки TPHC в воде и отложениях
Ниже рассматриваются наиболее часто используемые методы экстракции для выделения полулетучих соединений из проб воды, почвы и донных отложений перед аналитическим определением.
5.1. Образцы воды
Наиболее часто используемым методом экстракции TPHC в водных образцах является жидкостно-жидкостная экстракция EPA 3510 [5, 50, 51]. Другие доступные методы включают непрерывную жидкостно-жидкостную экстракцию [11], твердофазную экстракцию [51], вихревую экстракцию [52] и микроэкстракцию [53].
Метод жидкостно-жидкостной экстракции (LLE) включает использование делительной воронки для многократной экстракции образца органическим растворителем по выбору с целью достижения хорошего извлечения требуемых аналитов. Методика требует сильного встряхивания жидкой пробы с органическим растворителем в стеклянной посуде в форме воронки в течение нескольких минут с последующим отделением органического слоя (экстракта) от водной фазы. Затем экстракт фильтруют через осушитель для удаления влаги до конечной концентрации перед аналитической процедурой.Однако этот метод трудоемок и требует больших затрат растворителей [11, 54]. Другой метод — это EPA 3520, непрерывная жидкостно-жидкостная экстракция (CLLE), которая включает непрерывную рециркуляцию свежего органического растворителя в форме капель, которые проходят через пробу воды. Он очень эффективен, требует меньше внимания оператора и потребляет очень мало растворителя. CLLE очень хорошо подходит для образцов, содержащих твердые вещества, образующие эмульсию, но имеет несколько недостатков. Он потребляет больше времени (18–24 часов), чем обычный LLE (EPA 3510), и имеет тенденцию разлагать термически нестабильные соединения, а также терять некоторые летучие соединения в процессе [11] (http: // www.chemistry.sc.chula.ac.th/course_info/2302548/Wk3.pdf).
Твердофазная экстракция (SPE, EPA Method 3535) включает пропускание пробы воды через картридж, содержащий адсорбент, такой как диоксид кремния или оксид алюминия, в котором удерживаются аналиты, а затем элюируется небольшой порцией органического растворителя [11, 55]. Он имеет лучшую эффективность экстракции и использует меньше растворителей и стеклянной посуды по сравнению с LLE и CLLE. Перенос образцов в SPE очень минимален, что гарантирует незначительное перекрестное загрязнение или его отсутствие [56].Многие лаборатории до сих пор используют LLE и SPE, хотя они требуют много времени, потому что они относительно недороги, просты и высокоэффективны [57].
5.2. Выбор растворителя
Выбор растворителя, используемого для экстракции органических веществ, в зависимости от типа извлекаемого материала в очень большой степени определяет эффективность такого процесса экстракции. Хороший экстрагирующий растворитель должен иметь низкую температуру кипения, низкую смешиваемость с водой и высокую растворимость для желаемых аналитов [58].Другие критерии, которые следует учитывать при выборе растворителей, включают стоимость, токсичность, спектральные качества, доступность, правила метода и эффективность экстракции [11]. Ранее органические загрязнители экстрагировались галогенированными растворителями, такими как фреон 113 (трихлортрифторэтан), которые были менее токсичны для человека и обладают хорошими спектральными характеристиками в инфракрасном диапазоне. Однако в настоящее время они постепенно сокращаются во всем мире из-за их причастности к истощению озонового слоя. Возможные замены для этих растворителей включают дихлорметан, пентан, н-гексан, тетрахлорэтен и четыреххлористый углерод [11, 13, 59].
Эффективность экстракции органических аналитов из водных проб часто контролируется добавлением суррогатного стандартного раствора (например, 1-хлороктадекана для н-алканов; 2-фторбифенила для ПАУ) в матрицу пробы перед экстракцией. Многие лаборатории также проводят анализ матриц с целью определить, удерживаются ли интересующие соединения в матрице воды, почвы или донных отложений [60].
5.3. Твердые образцы
Наиболее часто используемые методы экстракции образцов почвы и донных отложений перед их аналитическим определением включают традиционную экстракцию Сокслета [27, 61], обработку ультразвуком [52, 62], вихревую обработку / механическое встряхивание [63], ускоренную экстракцию растворителем. [5, 64], и сверхкритическая флюидная экстракция.Эффективность экстракции для всех этих методов зависит исключительно от образца и матрицы растворителя [11].
Механическое встряхивание довольно просто и подходит для извлечения углеводородов нефти из различных проб окружающей среды [65, 66]. Он включает встряхивание образца с растворителем. Десикант (например, Na 2 SO 4 ) иногда добавляют для удаления влаги и облегчения разрушения образца, тем самым увеличивая его площадь поверхности для превосходного контакта с экстрагирующим растворителем.Однако это не утвержденный стандартный метод Агентства по охране окружающей среды США, поскольку его эффективность зависит от типа образца [11]. Экстракция Сокслета (метод EPA SW-846 3540) является наиболее часто используемым и весьма эффективным для экстракции полулетучих веществ. Он включает нагревание и кипячение образца с обратным холодильником с растворителем непрерывно в течение длительного периода времени (16–48 часов или более), но при этом образуется большой объем экстракта для концентрирования, и он менее подходит для летучих веществ [67, 68].
Метод ультразвуковой экстракции (метод EPA SW-846 3550) также очень подходит для полулетучих веществ.Он использует звуковые волны (ультразвуковые колебания) для улучшения передачи желаемых соединений от образца к растворителю. Это более быстрый метод, чем экстракция Сокслета, и для него требуется относительно меньшее количество растворителя [11]. Однако это трудоемко, так как требует многократных экстракций, декантации и фильтрации для каждой обработанной пробы. Ускоренная экстракция растворителем (ASE) — еще один метод экстракции полулетучих органических соединений. Его иначе называют субкритической жидкостной экстракцией и, как сообщается, он соответствует требованиям EPA Method 3545 (жидкостная экстракция под давлением) в том смысле, что он имеет более широкий охват в своем применении и хорошую эффективность экстракции, эквивалентную методу экстракции Сокслета [67].
ASE использует для своей работы органические растворители, такие как дихлорметан. Растворитель нагревают и сжимают перед пропусканием через образец для быстрого и эффективного удаления желаемых соединений из матрицы образца [11, 67]. Метод требует более короткого периода экстракции и меньшего объема растворителя по сравнению с традиционными методами и, таким образом, является хорошей альтернативой как экстракции Сокслета, так и ультразвуковой экстракции [23, 68]. Однако это дорогостоящий метод, который позволяет устранить множество помех вместе с желаемыми аналитами из-за высокой температуры, которую он использует для своей работы.Следовательно, очистка колонки может потребоваться после процесса экстракции перед аналитическим определением. Более того, процесс экстракции хотя и короче по сравнению с методом экстракции Сокслета, но время подготовки ячеек для экстракции велико, а для промывки требуется много растворителя [68, 69].
Сверхкритическая флюидная экстракция (SFE) — это стандартный метод EPA для общих извлекаемых нефтяных углеводородов (3540) и полициклических ароматических углеводородов (3561). Он включает нагревание и сжатие подвижной фазы (например,g., CO 2 ) до сверхкритических уровней, благодаря чему он обладает свойствами как газа, так и жидкости (сверхкритическая жидкость). Затем жидкость пропускают через образец для концентрации аналитов на конкретном сорбенте, после чего они элюируются растворителем и анализируются обычным способом [11].
5.4. Очистка и разделение колонки
Очистка колонки — это процесс, используемый для отделения органических аналитов от мешающих им соединений различной полярности, которые, возможно, были совместно экстрагированы вместе с аналитами [70].Это очень важный аспект инфракрасных и гравиметрических методов, поскольку они очень чувствительны к помехам, не связанным с нефтью. Однако он обычно не используется в методах, основанных на газовой хроматографии, потому что опытным аналитикам нетрудно определить присутствие мешающих соединений [11].
Такие помехи включают следующее: (i) Природные органические вещества, не связанные с нефтью, например углеводороды животного и растительного происхождения. (Ii) Кислородные метаболиты биоразлагаемого нефтяного происхождения, например, органические кислоты, спирты, кетоны, альдегиды , и фенолы.(iii) Артефакты от лабораторного оборудования или оборудования для отбора проб, например фталаты. (iv) Химические вещества, не связанные с нефтью, например, пестициды и хлорированные растворители [70].
В инфракрасной и гравиметрической категории небольшое количество силикагеля добавляется во флакон с экстрактом и встряхивается для удаления полярных соединений перед анализом, тогда как в методах ГХ адсорбент (например, силикагель) набивается в стеклянную колонку. Затем экстракт пробы пропускают через колонку, которая удерживает полярные вещества, в то время как интересующие соединения элюируются подходящим растворителем.Затем следует повторное концентрирование элюатов и анализ [70]. Помимо очистки экстракта, колонка с силикагелем также фракционирует нефтяной углеводородный экстракт на алифатические и ароматические фракции для раздельного определения [13, 48].
6. Аналитические процедуры для TPHC в воде и отложениях
Существует множество традиционных аналитических методов, доступных для измерения концентраций TPHC в различных пробах окружающей среды. Некоторые из них больше подходят для полевого скрининга, а другие подходят для лабораторных целей [11, 13, 71].Чаще всего используются инфракрасная (ИК) спектроскопия (метод EPA 418.1), гравиметрия (метод EPA 1664A), газовая хроматография с пламенно-ионизационным детектированием (GC / FID) (EPA Method 8015), газовая хроматография с масс-спектрометрическим детектированием (GC / MSD). ) (Методы EPA 8270 и 625), ультрафиолетовая спектрофотометрия, иммуноанализ (IMA) (методы EPA 4030 и 4035), рамановская спектроскопия и флуоресцентная спектроскопия [8, 52, 72, 73]. Жидкие образцы в основном готовятся для аналитического определения методом жидкостно-жидкостной экстракции (LLE) или твердофазной экстракции (SPE), в то время как твердые образцы обычно готовятся методом экстракции Сокслета [74].Поэтому в этом разделе будут представлены сильные и слабые стороны некоторых методов.
6.1. Гравиметрический метод
В основном существует два гравиметрических метода EPA. К ним относятся EPA 413.1 для масел и смазок и EPA 1664A для экстрагируемого н-гексаном силикагеля материала (также рассматриваемого как общее количество нефтяных углеводородов). Оба метода включают экстракцию растворителем, выпаривание и взвешивание до постоянного веса [52], но метод масла и смазки не позволяет отличить полярное органическое вещество от углеводородной части нефти [74].EPA 1664A был разработан для замены EPA 413.1, в котором в качестве экстрагирующего растворителя используется фреон 113 (озоноразрушающее вещество класса I). Новый метод выполняет экстракцию н-гексаном, который является более экологически чистым, но легковоспламеняющимся и может определять общую концентрацию углеводородов нефти в той же процедуре, что и при анализе масел и жиров [75].
EPA 1664A Процедура начинается с доведения pH водной пробы до значения менее 2 с помощью H 2 SO 4 или HCl.Затем образец экстрагируют н-гексаном, используя метод LLE (или SPE), и органическую часть фильтруют через воронку, содержащую безводный Na 2 SO 4 , после чего растворитель отгоняют из колбы при 85 ° C. на водяной бане. Затем колбу сушат и взвешивают до постоянного веса для оценки концентрации масла и смазки [75]. Для определения TPHC масло и жир в колбе растворяют в свежей порции н-гексана. Для удаления полярных веществ добавляют подходящее количество силикагеля (например,жиры, красители, масла, воски и некоторые более тяжелые органические молекулы животного и растительного происхождения) в экстракте, и смесь перемешивают с помощью магнитной мешалки, фильтруют и гравиметрически определяют как неполярный материал (NPM), также известный как экстрагируемый н-гексаном материал, обработанный силикагелем (SGT-HEM) [74, 76].
Твердые образцы (ил, почва и отложения) обрабатываются в соответствии с методом испытаний EPA SW-846 9071B, в котором влажный образец подкисляется концентрированной HCl. Образец подкисленного ила сушат либо безводным сульфатом натрия, либо сульфатом магния, а образец почвы или осадка — сульфатом натрия перед экстракцией по Сокслету н-гексаном.После этого NPM и SGT-HEM в образце определяют гравиметрически, как описано ранее в процедурах EPA 1664 [77]. Другие гравиметрические методы, описанные для твердых образцов, включали добавление 3 г КОН (для увеличения экстракции гуминовых веществ) и 100 см 3 метанола примерно к 100 г высушенных на воздухе образцов перед процессом экстракции Сокслета. Последующие шаги, включающие гравиметрическое измерение полярных и неполярных соединений, описаны выше [78–80].
Гравиметрическое определение TPHC в пробах окружающей среды довольно просто и доступно и, таким образом, за долгие годы приобрело огромную популярность, поскольку не требует специального оборудования.Однако он более применим к образцам с высокой концентрацией аналитов из-за его низкой чувствительности. Это требует много времени, особенно на стадии испарения растворителя, и имеет большую тенденцию к потере низкомолекулярных соединений, что приводит к ошибкам в измерениях [58, 73]. Эффективность экстракции растворителем относительно низка для соединений с более высокой молекулярной массой, но ее можно разумно повысить за счет добавления соли (хлорида натрия). Соэкстракции некоторых органических веществ с множеством полярных функциональных групп также способствует низкая полярность растворителя [81, 82].
6.2. Инфракрасная спектрофотометрия
Аналогичным образом, два инфракрасных (ИК) метода используются для измерений, связанных с нефтяными углеводородами. Они включают EPA 413.2 для общего количества извлекаемых масел и смазок (TOG) и EPA 418.1 для общего количества извлекаемых углеводородов нефти (TRPHC) [13]. Применение масла и смазки ограничено, в отличие от EPA 418.1 или модифицированного EPA 801.5, который был широко принят в качестве стандартного метода для оценки уровней углеводородов на участках, загрязненных нефтью [13, 46].Метод позволяет определять различные классы углеводородов, такие как масла и смазки (OG), органические соединения бензинового ряда (GRO) или общие углеводороды нефти (TPHC) [46]. Он использует светопоглощение связки CH 2 на 2930 см -1 , что характерно для масла и смазки для его измерения [58].
EPA 418.1 включает подкисление пробы воды до pH <2, экстракцию аналитов из матрицы пробы с использованием 1,1,2-трихлор-1,2,2-трифторэтана (фреон 113) или тетрахлорметана (CCl 4 ), и фильтрация экстракта через безводный сульфат натрия для удаления влаги.Затем отфильтрованный экстракт доводят до 100 мл экстракционным растворителем и затем перемешивают с достаточным количеством силикагеля для удаления жирного вещества перед измерением оптической плотности от 3200 см -1 до 2700 см -1 . Окончательное значение затем сравнивается с оптической плотностью эталонного стандарта масла [13, 75]. К преимуществам метода относится отсутствие стадии испарения растворителя, что делает его более подходящим для летучих компонентов нефти [58, 79].Измерения очень воспроизводимы и точны, экономят время и относительно проще [82]. Обычно ИК-методы дают более высокие результаты, чем гравиметрические, возможно, из-за потери летучих компонентов из-за стадии испарения в последнем [58].
Однако ИК-показания иногда могут не указывать на загрязнение нефтью в воде или образце донных отложений, потому что некоторые соединения не нефтяного происхождения (например, гуминовая или фульвокислота) могут генерировать сильное поглощение в инфракрасном диапазоне, давая ложноположительный результат, особенно на этапе очистки опускается [52, 59].Он также ограничен в своем применении, поскольку не предоставлена адекватная информация о типе присутствующего углеводорода. Галогенированные растворители (фреон, CCl 4 ), используемые для экстракции в этом методе, хотя и относительно нетоксичны и негорючие, но являются основными источниками разрушающих озоновый слой веществ, от которых требовалось отказаться в соответствии с поправками к Закону о чистом воздухе 1990 года [ 46]. Поэтому EPA 418.1 постепенно заменяется EPA гравиметрическим (EPA 1664) и / или газохроматографическим (например.g., ISO 9377-2 или 8015D) [52, 76, 82].
6.3. Газовая хроматография
Пересмотренный EPA 8015D под названием «Негалогенированные органические вещества с использованием ГХ / ПИД» был специально разработан для обработки летучих и полулетучих органических веществ отдельно, как органические соединения бензинового ряда (GRO) в диапазоне температур кипения 60 ° C – 170 ° C (C6 – C10) и органические соединения дизельного топлива (DRO) в диапазоне от 170 до 430 ° C (от C10 до C28). В отличие от гравиметрических и инфракрасных методов, этот метод может предоставить некоторую необходимую информацию о типе продукта [13].Летучие образцы обычно вводят в газовый хроматограф (ГХ) методом продувки и улавливания (EPA 5030 для водных образцов или EPA 5035 для твердых образцов) [52, 83].
Водно-летучие пробы в основном готовятся методом жидкостно-жидкостной экстракции (EPA 3510), хотя также может использоваться твердофазная экстракция (EPA 3535). Твердые образцы обычно извлекают с помощью устройства Сокслета (EPA 3540). Экстракты подвергаются очистке на колонке с оксидом алюминия (EPA 3611) или силикагелем (EPA 3630), с помощью которой жирные вещества удаляются на основе полярности, а углеводороды нефти фракционируются на алифатические и ароматические фракции.Затем каждую фракцию вводят непосредственно в газовый хроматограф, оборудованный неполярной капиллярной колонкой для аналитического определения [11, 83]. Идентификация аналитов выполняется путем сравнения времени удерживания отдельного соединения со временем удерживания эталонного стандарта. Калибровочные стандарты используются для построения калибровочных кривых, с помощью которых количественно определяют интересующие соединения [11].
Алифатические и ароматические фракции анализируются отдельно на газовом хроматографе с использованием пламенно-ионизационного детектора (GC-FID), который наиболее предпочтителен из-за его относительной чувствительности и селективности по углеводородам.Эти две фракции обычно делят на диапазоны числа атомов углерода (GRO и DRO) на основе маркеров ПАУ и н-алкана соответственно [52, 84]. Площади, покрытые разрешенными и неразрешенными (UCM) компонентами, обычно оцениваются для определения общего уровня нефтяных углеводородов (TPHC) в образце [84–86]. Нефракционированный экстракт можно также количественно определить как масло и жир, что дает концентрацию, превышающую сумму алифатической и ароматической фракций [84].
Общее количество углеводородов иногда измеряется FID, в то время как ароматическая фракция определяется с помощью фотоионизационного детектора (PID).Поэтому алифатическая фракция оценивается путем вычитания ароматических углеводородов из общего количества углеводородов. Однако ФИД не совсем селективен для ароматических соединений и поэтому может быть завышен [13]. В качестве альтернативы, ГХ в сочетании с масс-спектрометрическим детектором (МСД), особенно в режиме выбранного ионного мониторинга (SIM), может дать лучший результат при анализе ароматических соединений. Это связано с тем, что он способен обнаруживать соединение, присутствующее в чрезвычайно низкой концентрации в сложной матрице, при условии, что желаемое соединение имеет заметный ион-фрагмент с массой, которая отличает его от других углеводородных соединений, а также может предложить более полную информацию о идентичность соединения [52, 72].
С помощью методов ГХ идентичность свежей и умеренно деградированной нефти может быть раскрыта в образцах окружающей среды для распознавания образов [86]. Профиль нерастворенных сложных смесей (НСМ) в загрязненных образцах может быть адекватно охарактеризован и разрешен [87]. Но стоимость анализа, необходимое рабочее время и эффекты матрицы образца могут быть выше [88]. Перекрытие диапазонов углеродного числа может быть еще одной проблемой, потому что часть GRO может быть представлена как DRO и наоборот [13, 52].
6.4. Ультрафиолетовая флуоресцентная спектрофотометрия
Ультрафиолетовая флуоресцентная спектрофотометрия (УФФ) — это быстрый и ценный метод скрининга для анализа TPHC в пробах окружающей среды. Он включает экстракцию растворителем и оптическое измерение молекул углеводородов с помощью спектрометра ультрафиолетовой флуоресценции. Он всегда используется в полевых условиях для водных образцов без экстракции растворителем [58, 74, 89]. Ароматические углеводороды флуоресцируют, когда их π -связи возбуждаются ультрафиолетовым светом, а концентрация углеводородов в экстрактах проб измеряется с помощью флуорометра [74].Этот метод имеет больший потенциал для отличия низкомолекулярных ароматических углеводородов с 2–3 кольцами от высокомолекулярных соединений [11, 58]. Северная Каролина в США недавно одобрила метод мониторинга утечек из негерметичных подземных резервуаров в качестве замены метода GC / FID (EPA 8015D) [90]. Однако алифатические алканы не реагируют на ультрафиолетовое излучение, потому что они не имеют π -связей. Следовательно, образцы, содержащие парафиновое масло, не могут быть обнаружены этим методом [74].
Для получения надежных аналитических результатов калибровочная кривая должна быть построена с использованием определенных углеводородных примесей. Сообщается, что аналитическое извлечение УФФ было хорошим с н-гексаном (132%) в качестве экстракционного растворителя по сравнению с метанолом (40%) [74], но точность и воспроизводимость в диапазоне низких концентраций оказались относительно низкими [82]. Это не подходящий метод для анализа отпечатков пальцев, потому что неуглеводородные соединения могут также излучать на той же длине волны, что и аналиты, что вызывает интерференцию [89].
7. Уровни общего содержания нефтяных углеводородов в окружающей среде
Результаты общего содержания нефтяных углеводородов, опубликованные в разных странах мира, представлены в таблицах 1 и 2. Уровни, указанные в водной матрице, варьировались от «не обнаружено» (ND) до 260,000 мк г / л. Самые высокие значения (60 000–260 000 μ г / л) были зарегистрированы в Deepwater Horizon, Мексиканский залив [91], а самые низкие значения (0,05–4,13 μ г / л) были обнаружены в Сиамском заливе. и восточное побережье полуострова Малайзия [6].Первый в мире огромный аварийный выброс произошел в июне 1979 года на самой продуктивной нефтяной скважине Иксток-I в Мексиканском заливе, где было разлито более 3,4 миллиона баррелей [92]. Это может быть ответственно за более высокий уровень TPHC, измеренный на месте несколько лет спустя [93]. Другой разлив нефти в регионе из нефтяной скважины в Deepwater Horizon, который в народе называют «худшей экологической катастрофой в истории США», унес не менее 11 жизней в апреле 2010 года. Сообщается, что в результате этого ужасного инцидента было разлито около 4,2 миллиона баррелей. это длилось около 87 дней, в которые была замешана компания British Petroleum (BP), отсюда и причина более высокого уровня TPHC в исследовании, проведенном на месте примерно три года спустя [91, 94].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9380
Район дельты Нигерии
- 4
Целевое значение TPHC в устьях и гаванях Европейского Союза составляет 300 μ г / л.Это значение было значительно превышено во многих водоемах по всему миру, что свидетельствует об антропогенном поступлении углеводородов в окружающую среду [95]. Что касается сопоставленных данных, представленных в таблице 1, уровни TPHC были исключительно выше в Мексиканском заливе и районе дельты реки Нигер в Нигерии, где ведутся работы по разведке нефти, чем в других регионах [63, 91, 93, 96 ].
Таблица 2 показывает, что уровни TPHC в пробах донных отложений, проанализированных по всему миру, варьировались от ND (не обнаружено) до 16 500 мг / кг.Самые низкие значения (ND – 1,71 мг / кг) были зарегистрированы на побережье и в мангровых зарослях северной части Персидского залива [97], а самые высокие (300–16 500 мг / кг) — в устье Жемчужной реки, Китай [98] . Минимальное значение 10 мг / кг, установленное Программой Организации Объединенных Наций по окружающей среде, было превышено в большинстве стран, что свидетельствует об увеличении загрязнения нефтяными углеводородами пресной и морской водной среды во всем мире. Городская промышленная деятельность может повысить концентрацию до 10–1000 мг / кг, тогда как уровни> 3000 мг / кг обычно обнаруживаются на участках разливов нефти [4, 99, 100].Это указывает на большее влияние промышленной деятельности, а также разливов нефти на уровни углеводородов нефти в большинстве прибрежных отложений во всем мире. Уровни были чрезвычайно высокими в некоторых устьях в Китае [56, 98, 101–103], гавани Сеута в Северной Африке [104], проливе Сан-Гонсалу в Пелотасе, Риу-Гранди-ду-Сул, Бразилия [22], и устье Клайд, США. Королевство [105]. TPHC обычно было намного выше в отложениях, чем в толще воды.
Общая оценка аналитических методов, используемых исследователями для определения общего количества нефтяных углеводородов как в воде, так и в матрицах донных отложений, как показано в таблицах 1 и 2, выявила более широкое использование УФФ, которое было быстрее и проще, чем другие существующие методы [106].Хотя оборудование в основном доступно в виде портативных полевых устройств, любые полученные данные часто следует подтверждать с помощью стороннего лабораторного оборудования для повышения качества и надежности [107]. Метод ИК (EPA 418.1) постепенно исчезает из-за обязательных галогенированных растворителей, которые вредны для окружающей среды, так как в настоящее время все чаще используются методы газовой хроматографии и гравиметрии (EPA 1664) [108]. Общее количество нефтяных углеводородов более определено в азиатской среде, чем на других континентах мира, вероятно, из-за большого количества сырой нефти во многих странах региона.Совершенно очевидно, что разлив нефти, сброс промышленных сточных вод и городской сток являются основными причинами более высоких уровней TPHC в морской среде, и поэтому необходимо принять меры для минимизации их до минимума во всем мире [109].
8. Заключение
Хотя твердофазная экстракция имеет лучшую эффективность экстракции, чем LLE, ее применение при экстракции нефтяных углеводородов из водной матрицы ограничено, поскольку для этого конкретного анализа она еще не утверждена Агентством по охране окружающей среды США. .Таким образом, LLE остается наиболее часто используемым методом из-за его доступности, простоты и относительной эффективности. Точно так же твердые образцы чаще извлекаются с помощью экстрактора Сокслета, который требует много времени по сравнению с ускоренной экстракцией растворителем, поскольку он прост в использовании и довольно дешев. Алифатические углеводороды, которые являются первичными компонентами нефтяных углеводородов, в основном более детерминированы в морских отложениях, чем в водной толще, поскольку они имеют относительно низкую растворимость в воде и, таким образом, концентрируются в донных отложениях.
Для измерения TPHC в пробах окружающей среды доступно множество аналитических методов. Некоторые измеряют TPHC на основе одной только алифатической или ароматической фракции, в то время как некоторые другие объединяют две фракции для измерения. Таким образом, результаты, полученные с использованием разных методов, в большинстве случаев несопоставимы из-за разного фона. Тем не менее, внешнее лабораторное оборудование более предпочтительно для аналитического определения аналитов, чем портативные полевые устройства, поскольку оно дает хорошие данные, которые намного надежнее.Было обнаружено, что концентрации TPHC чрезвычайно высоки в местах разлива и в промышленно развитых районах. Следовательно, существует большая потребность в соблюдении природоохранного законодательства в отношении разведки и транспортировки нефти, а также сброса отходов в морскую среду для обеспечения безопасности водных организмов и жизни людей.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
3 тенденции, влияющие на точки кипения — Master Organic Chemistry
Теперь доступно — Загрузите этот замечательный (бесплатный) 3-страничный раздаточный материал о том, как решать типичные проблемы с точкой кипения.С 10 примерами решенных задач! (Также содержит все ключевые моменты, обсуждаемые в этом посте)
MOC_Boiling_Point_Handout (PDF)
Определение порядка точек кипения — это примерно понимание тенденций . Ключевым моментом здесь является то, что точки кипения отражают силу сил между молекулами. Чем больше они слипаются, тем больше энергии потребуется, чтобы выбросить их в атмосферу в виде газов.
Следует учитывать 3 важные тенденции.
- Относительная сила четырех межмолекулярных сил равна: ионная> водородная связь> диполь-диполь> силы дисперсии Ван-дер-Ваальса. Влияние каждой из этих сил притяжения будет зависеть от присутствующих функциональных групп.
- Температуры кипения увеличиваются с увеличением количества атомов углерода.
- Ветвление снижает температуру кипения.
Рассмотрим подробнее :.
Содержание
- Тенденция № 1: Относительная сила четырех межмолекулярных сил
- Тенденция № 2 — для молекул с данной функциональной группой точка кипения увеличивается с увеличением молекулярной массы
- Роль симметрии ( или их отсутствие) по точкам плавления и кипения
1.Тенденция №1: относительная сила четырех межмолекулярных сил.
Сравните различные производные бутанового спирта, показанные ниже. Молекулы диэтилового эфира, C4h20 O, удерживаются вместе за счет диполь-дипольных взаимодействий, которые возникают из-за поляризованных связей C-O. Сравните его точку кипения (35 ° C) с температурой его изомера бутанола (117 ° C). Сильно повышенная температура кипения связана с тем, что бутанол содержит гидроксильную группу, которая способна образовывать водородные связи. Тем не менее, силы притяжения в бутаноле бледнеют по сравнению с силами притяжения соли бутоксида натрия, которая плавит при чрезвычайно высокой температуре (намного выше 260 ° C) и фактически разлагается, прежде чем может превратиться в жидкость.
Тогда подумайте о бутане C4h20, который не содержит полярных функциональных групп. Единственными силами притяжения между отдельными молекулами бутана являются относительно слабые дисперсионные силы Ван-дер-Ваальса. В результате бутан кипит при температуре замерзания воды (0 ° C), что намного ниже даже температуры диэтилового эфира.
Мораль истории : среди молекул с примерно одинаковой молекулярной массой точки кипения будут определяться присутствующими функциональными группами.
Вы можете рассказать похожую историю для подобных изомеров амина и карбоновой кислоты, показанных ниже.
Предыдущее обсуждение четырех межмолекулярных сил см. Здесь. Ссылку на учебник Ройша можно найти здесь.
2. Тенденция № 2 — Для молекул с заданной функциональной группой точка кипения увеличивается с увеличением молекулярной массы.Посмотрите на резкое увеличение точек кипения по мере увеличения молекулярной массы во всех этих сериях:
Вот вопрос: Как именно межмолекулярные силы увеличиваются с увеличением молекулярной массы?
Что ж, ключевой силой, которая здесь действует, являются дисперсионные силы Ван-дер-Ваальса, которые равны пропорционально площади поверхности .Таким образом, по мере увеличения длины цепочки вы также увеличиваете площадь поверхности, что означает, что вы увеличиваете способность отдельных молекул притягиваться друг к другу.
На интуитивном уровне вы можете сравнить эти длинные молекулы с нитями спагетти — чем длиннее лапша, тем больше работы требуется, чтобы их разделить. По мере увеличения длины цепи появятся области, где они могут очень хорошо выстраиваться рядом друг с другом.
По отдельности каждое взаимодействие может не иметь большого значения, но когда вы складываете их все по длине цепочки, дисперсионные силы Ван-дер-Ваальса могут оказывать огромное влияние.
3. Роль симметрии (или ее отсутствия) в точках плавления и кипенияЭто еще один побочный продукт зависимости дисперсионных сил Ван-дер-Ваальса от площади поверхности — чем больше стержневидные молекулы, тем лучше смогут они выстроиться в линию и скрепить. Возьмем еще один интуитивно понятный пример макарон: что больше склеивает: спагетти или макароны? Чем больше сферическая молекула, тем меньше будет площадь ее поверхности и тем меньше межмолекулярных ван-дер-ваальсовых взаимодействий.Сравните точки кипения пентана (36 ° C) и 2,2-диметилпропана (9 ° C).
Его также можно применить к молекулам, связывающим водородные связи, таким как спирты — сравните, например, точки кипения 1-пентанола с 2-пентанолом и 3-пентанолом.



 % C = 168.154 г C294,277 г аспартама × 100 = 57,14% Cmass% H = 18,114 г h394,277 г аспартама × 100 = 6,16% Hmass% N = 28,014 г N294,277 г аспартама × 100 = 9,52% Nmass% O = 79,995 г O 294,277 г аспартама × 100 = 27,18% O
% C = 168.154 г C294,277 г аспартама × 100 = 57,14% Cmass% H = 18,114 г h394,277 г аспартама × 100 = 6,16% Hmass% N = 28,014 г N294,277 г аспартама × 100 = 9,52% Nmass% O = 79,995 г O 294,277 г аспартама × 100 = 27,18% O Если 10,00 мг бензола подвергнуть анализу сгорания, какая масса CO 2 и H 2 O будет произведена?
Если 10,00 мг бензола подвергнуть анализу сгорания, какая масса CO 2 и H 2 O будет произведена?

 99 г / моль. Элементный анализ соединения показывает, что оно содержит 68,43% хрома и 31,57% кислорода. Какова идентичность соединения?
99 г / моль. Элементный анализ соединения показывает, что оно содержит 68,43% хрома и 31,57% кислорода. Какова идентичность соединения? 9
9 Затем остатки повторно взвешивали. На основании следующих результатов, каковы формулы гидратов?
Затем остатки повторно взвешивали. На основании следующих результатов, каковы формулы гидратов?
 Какова его молекулярная формула?
Какова его молекулярная формула? 0060 моль пенициллина G?
0060 моль пенициллина G? Он содержит только углерод, кислород и водород. При сжигании 43,5 мг образца этого соединения было получено 97,1 мг CO 2 и 17,0 мг H 2 O.
Он содержит только углерод, кислород и водород. При сжигании 43,5 мг образца этого соединения было получено 97,1 мг CO 2 и 17,0 мг H 2 O.
 97%
97% 82%
82% 6 мг C и 1,98 мг H
6 мг C и 1,98 мг H е.м.
е.м. 10 см 3
10 см 3
Leave A Comment