Связь в оксидах — Справочник химика 21
Руководствуясь разностью относительных электроотрицательностей связи Э—О, определить, как меняется характер связи в оксидах элементов третьего периода периодической системы Д. И. Менделеева. [c.63]
Объяснить химическую связь в оксидах исследуемого элемента. [c.16]
В соответствии с периодическим законом Д. И. Менделеева в свойствах однотипных двойных соединении элементов проявляется определенная периодичность. С этой точки зрения показательно уменьшение доли ионной связи в оксидах элементов II и [c.255]
Обсудите характер изменения валентности и типа связи в оксидах. [c.504]
ВеО относится к числу наиболее устойчивых полимерных соединений бериллия (т. пл. 2570 С). Связь в оксиде бериллия — ковалентная полярная, в MgO с преобладанием ионной, с чем связана довольно высокая температура плавления (2850°С). [c.263]
Все металлы ПА-группы с кислородом образуют оксиды состава ЭО. Для бария известен также пероксид ВаОг. Характер химических связей в оксидах различен у оксида бериллия связь главным образом ковалентная, у остальных оксидов преимущественно ионная. Поэтому оксид бериллия обладает амфотерными свойствами, т. 6. он реагирует как с кислотами, так и с основаниями [c.205]
Оксиды неметаллов. Известны оксиды всех неметаллов, полученные непосредственно или косвенно, за исключением оксидов гелия, пеона и аргона. Поскольку разность ОЭО кислорода и неметаллов относительно невелика, природа химической связи в оксидах неметаллов преимущественно ковалентная. Поэтому в подавляющем большинстве случаев оксиды неметаллов — газы, легколетучие жидкости или легкоплавкие твердые вещества. В твердом состоянии, как правило, образуются молекулярные структуры из-за насыщаемости и направленности ковалентных связей. Однако при наличии заметной доли ионной составляющей связи возникают координационные решетки, например, в случае диоксида кремния. В оксидах неметаллов кислород чаще всего подвергается 5/ -гибридизации. Степень гибридизации зависит от физико-химической природы партнера.
Связь в оксидах металлов подгруппы кальция преимущественно ионная. [c.263]
Групповые характеристики элементов по отношению к кислороду закономерно изменяются при переходе от данной группы к следующей соответственно постепенному изменению типа связи в оксидах.
При последовательном переходе от элементов главной подгруппы I группы к элементам главной подгруппы УП группы химическая связь в оксидах изменяется от ионной (в оксидах щелочных и щелочноземельных металлов) до типично ковалентной (в оксидах галогенов, серы, азота, углерода), а кристаллические решетки — от типично координационных до молекулярных. Поэтому оксиды элементов главных подгрупп, расположенных в правой части периодической таблицы, особенно вверху, являются при обычных условиях либо газами, либо довольно летучими твердыми и жидкими веществами, в то время как оксиды элементов главных подгрупп I, II, III и, если не считать углерод, IV групп — нелетучие при обычных условиях твердые вещества, часто весьма тугоплавкие (например, оксид алюминия).
В этом состоянии углерод может образовать три ковалентные связи, две из которых осуществляются по обменному механизму, а одна — по донорно-акцепторному. Первые две связи возникают за счет двух неспаренных электронов, а третья — с использованием одной вакантной 2/ -орбитали. Такова картина ковалентных связей в оксиде углерода СО . При этом у атома углерода остается неиспользованной одна пара неподеленных валентных электронов на 25-орбитали. Как раз эти электроны используются в реакциях присоединения оксида углерода, например при образовании карбонилов металлов.
Как проявляется влияние типа химической связи в оксидах, боридах, карбидах и силицидах на свойства этих соединений [c.15]
Температуры плавления и кипения оксидов меняются в очень широком интервале. При комнатной температуре они, в зависимости от типа кристаллической решетки, могут находиться в различных агрегатных состояниях. Это определяется природой химической связи в оксидах, которая может быть ионной или ковалентной полярной. [c.3]
Химическая связь в
www.chem21.info
оксиды с ионной, молекулярной и полимерной структурой.

Помимо деления оксидов на кислотные, основные и амфотерные их можно также разделить на оксиды с молекулярной структурой, оксиды с ионной структурой и оксиды с полимерной структурой. Деление на оксиды с молекулярной и ионной структурой довольно условное.
Отнесение оксидов к ионным основывается на положении об образовании ионных соединений. Как известно, ионные соединения – это вещества, в состав которых входит атом неметалла и металла, существенно различающиеся между собой по электроотрицательности (например типичный представитель – хлорид натрия). Исходя из этого, а также из определения оксида , можно сказать, что к таким веществам будут относится соединения металлов первой и второй групп главных периодов периодической системы.
Для того, чтобы отнести оксиды к ионным или молекулярным необходимы посмотреть на степень ионности образуемого соединения.
Возьмем первую группу периодической системы и соответсвующие оксиды:
Li2O0,8- Na2O0,83- K2O0,89-
Как видно, степень ионности данных оксидов увеличивается при продвижении по группе свеху-вниз. Если рассмотреть как изменяется степень ионности по периоду:
Li2O0,8- BeO0,35- B2O30,24- CO20,11- P2O50,05-
то можно заметить, что при продвижении от первого к пятому элементу она будет снижаться, что свидетельствует об образовании связи по молекулярному механизму.
Некоторые
оксиды по своей структуре являются
полимерными соединениями. К таким
оксидам относятся, например SiO
3. Координационно-ионная полимеризация. Принципы синтеза стереорегулярных полимеров. Синтез, структура, свойства и применение высокомолекулярных соединений, синтезированных путем полимеризации. Полимераналогичные превращения.
Полимераналогичные превращения. Значительная часть полимерных материалов получается путем полимер-аналогичных, т. е. не приводящих к разрыву основной цепи, превращений базовых полимеров. В качестве примера рассмотрим наиболее важные в практическом отношении полимераналогичные превращения поливинилового спирта и целлюлозы.
В промышленности поливиниловый спирт получают алкоголизом поливинилацетат.
Продукты полимераналогичных реакций поливинилового спирта приведены на схеме:
Полиацетилирование и поликеталирование, осуществляемые обработкой поливинилового спирта уксусным альдегидом и кетонами, приводит к образованию полиацеталей и поликеталей, являющихся хорошими пленкообразующими материалами. В качестве примера приведем реакцию получения по-ливинилбутираля:
широко применяемого в многослойных стеклах типа «триплекс». Полиэте-рификация поливинилового спирта или полипереэтерификация поливи-нилацетата позволяет получать полимеры сложных эфиров общей формулы (-СНг-CHOCOR-),,, используемые в качестве лаков.
В результате термообработки нитей поливинилового спирта, сформированных вытяжкой из растворов, получают поливинилспиртовые волокна, известные под названием «винол». Химические превращения поливинилового спирта при термообработке достаточно сложны; основными реакциями являются дегидратация и внутримолекулярная циклизация:
Путем полимераналогичных превращений из целлюлозы получают три основных класса ценных полимерных материалов:
Сложные эфиры целлюлозы — ацетаты — получаются при действии на целлюлозу уксусного ангидрида в присутствии катализатора — серной или хлорной кислоты или их смесей:
Процесс экзотермический, поэтому во время реакции следует отводить тепло. Вначале получают триацетат целлюлозы — так называемый первичный ацетат. Для получения вторичного ацетата проводят гидролиз — отщепление связанной уксусной кислоты до заданного содержания ацетатных групп в целлюлозе.
Нитраты целлюлозы. Нитраты получают действием на целлюлозу смеси азотной и сеоной кислот:
Реакция протекает, начиная с О °С. Степень замещения определяется только составом нитрующей смеси.
Простые эфиры целлюлозы. При их получении целлюлоза предварительно активируется путем обработки щелочью, при этом она набухает. В качестве алкилирующих агентов используются алкилгалогениды, алкилсульфа-ты и др. Реакция образования метилцеллюлозы протекает при 80-100°С и под давлением:
Гидратцеллюлоза аналогична по составу исходной целлюлозе, отличается от нее расположением звеньев и большей степенью гидратации полярных групп. Гидратцеллюлоза получается двумя методами: физическим и химическим. В первом случае целлюлозу растворяют и снова осаждают. Во втором путем полимераналогичной реакции целлюлозу переводят в одно из ее производных, затем последнее в результате реакции гидролиза вновь переводят в целлюлозу. Оба метода приводят к структурной модификации целлюлозы. Последним методом производится вискозное или медноаммиачное волокно -первое искусственное волокно, полученное человеком. Технология, разработанная в 20-30-х годах, включает две стадии. На первой — целлюлоза последовательно обрабатывается раствором щелочи и сероуглеродом:
Образовавшийся ксантогенат растворяют в разбавленном растворе щелочи и затем в кислой среде проводят обратную реакцию, приводящую к образованию гидратцеллюлозы:
Выход реакции увеличивается с увеличением давления и с уменьшением температуры.
Карбоксиметилцеллюлоза. Карбоксиметилцеллюлоза получается при взаимодействии щелочной целлюлозы с монохлоруксусной кислотой или ее натриевой солью:
Экзотермическая реакция протекает за 1,5-2 ч при самопроизвольном повышении температуры от 20 до 40 °С.
При обработке щелочной целлюлозы окисью этилена в мягких условиях при 33-40 °С получается оксиэтилцеллюлоза.
Гидратцеллюлоза аналогична по составу исходной целлюлозе, отличается от нее расположением звеньев и большей степенью гидратации полярных групп. Гидратцеллюлоза получается двумя методами: физическим и химическим. В первом случае целлюлозу растворяют и снова осаждают. Во втором путем полимераналогичной реакции целлюлозу переводят в одно из ее производных, затем последнее в результате реакции гидролиза вновь переводят в целлюлозу. Оба метода приводят к структурной модификации целлюлозы. Последним методом производится вискозное или медноаммиачное волокно -первое искусственное волокно, полученное человеком. Технология, разработанная в 20-30-х годах, включает две стадии. На первой — целлюлоза последовательно обрабатывается раствором щелочи и сероуглеродом:
Образовавшийся ксантогенат растворяют в разбавленном растворе щелочи и затем в кислой среде проводят обратную реакцию, приводящую к образованию гидратцеллюлозы:
Координационно-ионная полимеризация. Среди разных видов цепной полимеризации ионно-координационная имеет особое значение, поскольку она позволяет получать стереорегулярные полимеры, способные к кристаллизации. При «свободном росте» цепи как в радикальной, так и в ионной полимеризации сколь-нибудь действенные факторы стереоконтроля растущей цепи практически отсутствуют. Так, в радикальной полимеризации конечное звено радикала, включающее ненасыщенный атом углерода д/?2-гибридизации, свободно вращается вокруг конечной С-С-связи основной цепи. Фиксация его пространственного положения происходит случайным образом при присоединении следующего мономерного звена. Для осуществления стереохимического контродя роста цепи необходимо фиксировать пространственное положение мономера в момент его присоединения к активному центру и далее до следующего акта реакции роста. Эта задача решается при координационно-ионной полимеризации за счет образования координационной связи мономера с атомом активного центра растущей цепи.
Для координационно-ионной полимеризации применяется катализаторы Циглера-Натта. Они являются наиболее универсальными инициаторами стереорегулярной полимеризации многих мономеров и только с их помощью могут быть вовлечены в полимеризацию а-олефины; на этих катализаторах при умеренном давлении получается полиэтилен, по свойствам принципиально отличный от продукта радикальной полимеризации. В настоящее время под катализаторами Циглера-Натта понимают комбинацию двух соединений — переходного металла и металла I — III групп. В более узком смысле слова под этими катализаторами понимают систему TiCl3+AlRnCl3-n. Катализатор Циглера-Натта образуется в результате сложных процессов, развивающихся при смешении компонентов катализатора. На поверхности кристаллов TiCl3 (TiCl4) образуется нерастворимый координационный комплекс, в котором TiCl3 (TiCl4) является донором, а А1R3 — акцептором электронов. Образование комплекса сопровождается рядом реакций, из которых наиболее значима реакция алкилирования переходного металла, поскольку в дальнейшем присоединение мономера в реакции роста происходит по связи Ti-C:
В ходе восстановления Ti4+ до Ti3+ образуются радикалы, что объясняет известные факты инициирования радикальной полимеризации некоторых мономеров катализаторами Циглера-Натта.
Реакции инициирования и роста в полимеризации на катализаторах Циглера-Натта практически не отличаются, поскольку во всех случаях имеет место внедрение мономера по связи Ti-C. Выделяют три стадии этой реакции. На первой стадии мономер координируется на атоме титана октаэдри-ческого активного центра за счет свободной орбитали:
На второй стадии координированный мономер внедряется по связи Ti-C. При этом вакантная орбиталь регенерируется, однако, ее пространственное положение изменяется, что хорошо видно из схемы:
В результате в следующем акте роста мономер должен был бы присоединиться в другой стереохимической конфигурации. Факты, однако, указывают на то, что при полимеризации на катализаторах Циглера-Натта пропилен присоединяется всегда в одной и той же пространственной конфигурации, что приводит к формированию изотактической структуры цепи. Из этого следует необходимость существования третьей стадии, в ходе которой восстанавливается исходное пространственное положение вакантной орбитали:
Считается, что атом непереходного металла стабилизирует биметаллический активный центр. В основном механизм присоединения остается тем же, что и рассмотренный выше. Механизм стереорегулирования в обоих случаях обусловлен объемными и электростатическими взаимодействиями заместителя при двойной связи мономера и окружения титана, т.е. лигандов переходного металла.
studfiles.net
Образование связей разных типов — урок. Химия, 8–9 класс.
Для понимания процессов возникновения химической связи между атомами надо вспомнить свойства химических элементов.
Металлы — элементы, атомы которых способны отдавать электроны. У них низкая электроотрицательность (ЭО).
Неметаллы — элементы, атомы которых могут принимать электроны. У них высокая ЭО.
Различают три случая образования химической связи.
1. Между атомами металлов.
ЭО металлов низкая, они слабо удерживают свои валентные электроны и стремятся от них избавиться. В результате атомы теряют электроны и превращаются в положительные ионы. Электроны становятся свободными. Образуется металлическая связь.
Такая связь образуется в простых веществах металлах и их сплавах:
Fe,Al,Cu,Zn.
2. Между атомами неметаллов и металлов.
ЭО неметаллов высокая. Их атомы стремятся присоединить недостающие до завершения внешнего слоя электроны и забирают их от атомов металлов. Атомы металлов превращаются в положительные ионы, а атомы неметаллов — в отрицательные. Возникает ионная связь.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов:
NaCl,KI,CaO,BaBr2.
3. Между атомами неметаллов.
Взаимодействуют атомы, каждый из которых с одинаковой силой стремится присоединить к себе электроны от другого атома. В результате электроны объединяются в общие электронные пары, то есть образуется ковалентная связь.
Такой вид связи существует в простых веществах неметаллах и их соединениях:
h3,O2,HCl,h3O.
Пример:
1. определим тип химической связи в метане Ch5.
Метан — сложное вещество, состоит из двух неметаллов. Значит, связь в нём ковалентная.
2. Определим тип химической связи в оксиде натрия Na2O.
Это сложное вещество, состоящее из металла и неметалла. Значит, связь в нём ионная.
3. Определим тип химической связи в алмазе C.
Алмаз — простое вещество, образованное атомами неметалла. Значит, связь ковалентная.
www.yaklass.ru
Тема 13. Соединения щелочных металлов.
Часть I
1. Оксиды – M2O.
1) Тип связи – ионная.
Схема ее образования:
Тип кристаллической решетки: ионная.
2) Характер оксидов – основный.
Химические свойства оксидов:
а) M2 O + кислотный оксид→соль
б) M2 O + h3O → щелочь
в) M2 O + HNO3→ соль MNO3 + h3O
3) Получение:
а) 4LI + O2→2Li2O;
б) Na→X→Na2O.
Запишите уравнения соответствующих реакций.
2Na + O2→Na2O2
Na2O2 + 2Na→2Na2O
2. Гидроксиды МОН.
1) Тип кристаллической решетки – ионный. Состоят из катионов М+ и анионов ОН-. Физические свойства: твердые белые вещества, гигроскопичны.
Растворы – это щелочи.
2) Химические свойства (составьте уравнения возможных реакций – молекулярные, полные и сокращенные ионные):
а) пример реакции нейтрализации:
б) Взаимодействуют с кислотными оксидами.
в) Взаимодействуют с солями, если образуется осадок:
г) взаимодействует с солями, если образуется газ:
д) Взаимодействуют с амфотерными оксидами:
е) Взаимодействует с амфотерными гидроксидами.
3) Получение:
a) 2M + 2HOH→2MOH + h3
б) M2O + HOH→2MOH
4) Заполните таблицу «Щелочи и их применение».
3. Соли имеют ионную кристаллическую решетку.
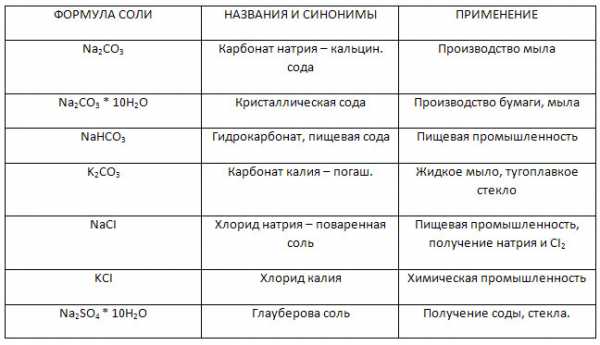
Заполните таблицу «Названия и применение солей металлов IA группы».
4. Заполните таблицу «Окрашивание пламени ионами щелочных металлов».
Часть II
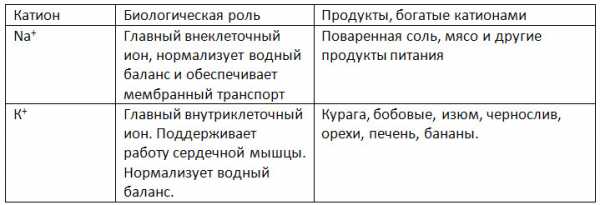
1. Заполните таблицу «Биологическая роль катионов натрия и калия».
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:

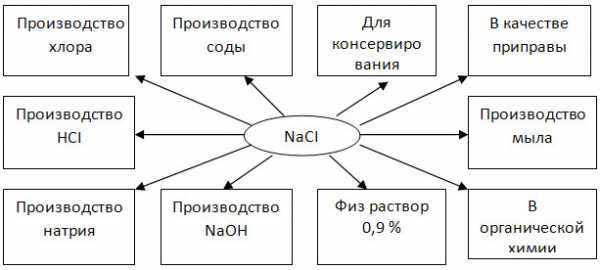
3. Заполните схему «Области применения хлорида натрия».
4. Для соединения NaH укажите:
1) Название гидрид натрия
2) Тип связи и кристаллическую решетку — ионная связь, ионная кристаллическая решетка
3) Схему образования связи на основе реакции получения (синтеза) 2Na + h3→ 2NaН.
4) Уравнение реакции взаимодействия с водой (рассмотрите ОВР)
5. Пероксид натрия Na2O2 имеет структурную формулу:
Na – O – O – Na.
Укажите тип связи между атомами:
а) натрия и кислорода ионная
б) кислорода и кислорода ковалентная неполярная
Наличие разных типов связи в одном соединении говорит о единой природе химической связи.
6. По образцу сочинения, приведённого в заданиях учебного параграфа, напишите сочинение на тему «Художественный образ соединения щелочного металла» в особой тетради.
superhimik.ru
Типы химической связи | himiyaklas.ru
Химическая связь – это сила, удерживающая друг с другом частицы, образующие вещество.
В зависимости от частиц, которые удерживают эти силы, связи подразделяются на внутримолекулярные и межмолекулярные.
Внутримолекулярные связи.
- Ковалентная связь.
Ковалентная связь – это общая электронная пара у двух атомов неметаллов.
Рассмотрим на примере молекулы водорода (Н2), в которой как раз реализуется ковалентная связь.
Молекулы водорода состоит из двух атомов водорода (Н), у которых на внешнем энергетическом уровне один электрон:
Атомы стремятся полностью заполнить свои орбитали. Для этого и объединяются два атома. Они делают свои неспаренные электроны общими: и получается общая электронная пара. Электроны стали спаренными:
Эта общая электронная пара и есть ковалентная химическая связь. Ковалентная связь обозначается либо чертой, соединяющей атомы, либо двумя точками, которые обозначают общую электронную пару:
Представьте, что есть два соседа по парте. Это два атома. Им нужно нарисовать картинку, в которой есть красный и синий цвет. У них есть общая пара карандашей (один красный, другой синий) – это общая электронная пара. Оба соседа по парте пользуются этими карандашами. Таким образом эти два соседа связаны общей парой карандашей, т.е. ковалентной химической связью.
Существует два механизма образования ковалентной химической связи.
- Обменный механизм образования ковалентной связи.
В таком случае каждый атом предоставляет электроны для образования ковалентной связи. Этот механизм мы и рассмотрели, когда знакомились с ковалентной связью:
- Донорно-акцепторный механизм образования ковалентной связи.
В этом случае общая электронная пара, если можно так выразиться, неравноценная.
Один атом имеет НЭП – неподеленную электронную пару (два электрона на одной орбитали). И он предоставляет ее целиком для образования ковалентной связи. Этот атом называется донором – поскольку он предоставляет оба электрона для образования химической связи.
А второй атом имеет только свободную орбиталь. Он принимает электронную пару. Этот атом называется акцептором – он принимает оба электрона.
Классический пример – это образование иона аммония NH4+. Он образуется при взаимодействии иона H+ и аммиака (NH3). Катион водорода H+ – это пустая s-орбиталь.
Эта частица будет акцептором.
У тома азота в аммиаке есть НЭП (неподеленная электронная пара).
Атом азота в аммиаке будет донором:
В данном случае и синий и красный карандаш принес один сосед по парте. Он «угощает» второго. И они оба пользуются карандашами.
Конкретные реакции, в которых образуется такой ион, будут рассмотрены позже в соответствующих разделах. Пока вам просто нужно запомнить принцип, по которому образуется ковалентная связь по донорно-акцепторному механизму.
Ковалентная связь бывает двух видов. Различают ковалентную полярную и неполярную связи.
Ковалентная полярная связь возникает между атомами неметаллов с разными значениями электроотрицательности. То есть между разными атомами неметаллов.
Атом с большим значением электроотрицательности будет оттягивать общую электронную пару на себя.
Ковалентная неполярная связь возникает между атомами неметаллов с одинаковыми значениями электроотрицательности. Такое условие выполняется, если связь возникает между атомами одного химического элемента-неметалла. Поскольку у разных атомов электроотрицательности могут быть очень близкими друг к другу, но все равно будут отличаться.
Общая электронная пара не будет смещаться ни к одному атому, так как каждый атом «тянет» ее с одинаковой силой: общая электронная пара будет находиться посередине.
И конечно же ковалентная связь может быть одинарной, двойной и тройной:
- Ионная связь.
Ионная связь возникает между атомами металла и неметалла. Поскольку у металла и неметалла большая разница в электроотрицательности, электронная пара полностью оттягивается к более электроотрицательному атому – атому неметалла.
Конфигурация полностью заполненного энергетического уровня, достигается не за счет образования общей электронной пары. Неметалл забирает себе электрон металла – заполняет свой внешний уровень. А металлу проще отдать свои электроны (у него их немного) и у него тоже полностью заполненный уровень.
Таким образом металл, отдав электроны, приобретает отрицательный заряд, становится катионом. А неметалл, получив электроны, приобретает отрицательный заря, становится анионом.
Ионная химическая связь представляет собой электростатическое притяжение катиона к аниону.
Ионная связь имеет место в солях, оксидах и гидроксидах металлов. И в других веществах, в которых атом металла связан с атомом неметалла (Li3N, CaH2).
Здесь следует обратить внимание на одну важную особенность: ионная связь имеет место между катионом и анионов во всех солях. Наиболее общим образом мы описываем как связь металл-неметалл. Но необходимо понимать, что это сделано лишь для упрощения. В составе соли может и не быть атома металла. Например, в солях аммония (NH4Cl, (NH4)2SO4. Ион аммония NH4+ притягивается к аниону соли – это ионная связь.
Откровенно говоря, нет никакой ионной связи. Ионная связь – это всего лишь крайняя степень ковалентной полярной связи. У любой связи есть свой процент «ионности» – это зависит от разности электроотрицательностей. Но в школьной программе, а тем более в требованиях ЕГЭ ионная и ковалентная связь – это совершенно два разных понятия, которые нельзя смешивать.
- Металлическая связь.
Все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Поэтому металлическую связь мы рассмотрим позже, когда будем разбирать кристаллические решетки.
Все, что пока нужно знать – это то, что металлическая связь реализуется в простых веществах – металлах.

Межмолекулярные связи.
Межмолекулярные связи гораздо слабее внутримолекулярных, так как в них не замешана общая электронная пара.
- Водородные связи.
Водородные связи возникают в вещества, в которых атом водорода связан с атомом с высоким значением электроотрицательности (F, O, Cl, N).
В таком случае связь с атомов водорода становится сильнополярной. Электронная пара смещается от атома водорода к более электроотрицательному атому. Из-за этого смещения, на водороде появляется частичный положительный заряд (δ+), а на электроотрицательном атоме частичный отрицательный заряд (δ-).
Например, в молекуле фтороводорода:
К δ+ одной молекулы притягивается δ- другой молекулы. Это и есть водородная связь. Графически на схеме она обозначается пунктирной линией:
Молекула воды может образовывать четыре водородные связи:
Водородные связи обусловливают более низкие температуры кипения и плавления веществ, между молекулами которых они возникают. Сравните сероводород и воду. В воде есть водородные связи – она жидкость при нормальных условиях, а сероводород – газ.
- Силы Ван-дер-Ваальса.
Это очень слабые межмолекулярные взаимодействия. Принцип возникновения такой же, как и у водородных связей. Очень слабые частичные заряды возникают при колебаниях общей электронной пары. И возникают сиюминутные силы притяжения между этими зарядами.
himiyaklas.ru
объясните по простому, как определить тип кристаллической решетки и химическую связь?
приветик Тут есть на странице 934 ссылка: urok(точка) tk
Попробуйте лучше зарегистрироваться и загрузить на сайт: <a rel=»nofollow» href=»http://click.in.ua/6mF» target=»_blank» >Сервис для решения задач</a> Возможно там быстрее Вам ответят.
Есть 4 типа связи (металлическая, ионная, ковалентная полярная (КП) и ковалентная неполярная (КН)) и 4 вида кристаллических решёток (металлическая, ионная, атомная и молекулярная). С первыми двумя всё просто — тип связи совпадает с кристаллической решёткой. Металлическая связь ТОЛЬКО в простых веществах-металлах (или сплавах металл-металл), и кристаллическая решётка тоже, соответственно, металлическая. Ионная связь это металл-неметалл (все соли, гидроксиды и оксиды металлов), и кристаллическая решётка — ионная. Исключение — соли аммония. Несмотря на то, что в них нет металла, тип решётки — ионная, т. к. соли распадаются на ионы. Второе исключение — оксид алюминия. Связь ионная, а решётка атомная. А вот с КП и КН посложнее. Тут нужно запоминать кое что. КН это связь в простых веществах-неметаллах (как и в вашем примере — Br2). Тип решётки — молекулярная, т. к. Br2 это МОЛЕКYЛА! НО! Далеко не всегда вещества имеющие КН связь будут иметь молекулярные решётки. ТОЛЬКО: газообразные простые вещества и галогены (VIIA — группа в таблице Менделеева) (O2, N2, F2, Cl2, Br2, I2), т. е. — те, которые пишутся с индексом «2» будут иметь молекулярную кристаллическую решётку; так же её имеет сера (в любой аллотропной модификации), некоторые аллотропные модификации мышьяка, а так же фосфор красный и белый (чёрный фосфор имеет атомную кристаллическую решётку). Бор, углерод и кремний имеют ковалентную неполярную связь (т. к. они неметаллы), но тип решётки — атомная. Остались вещества с ковалетной полярной связью (неметалл1-неметалл2). Эта связь возникает между 2 и более различными неметаллами (все кислоты, оксиды неметаллов, а так же галогениды неметаллов, нитриды неметаллов и некоторые другие соединения неметаллом друг с другом). А вот тип решётки, опять же, может быть: либо молекулярная, либо атомная. Кислоты — молекулярная, поскольку они образуют молекулы, практически все оксиды неметаллов — молекулярная кристаллическая решётка, а вот у оксида кремния — атомная (а у силана — Sih5 — молекулярная). Тут нужно просто выучить наизусть некоторые вещи. Так же необходимо понимать, что элементы VIIIA-группы — благородные газы — имеют молекулярную кристаллическую решётку, т. к. считается, что состоят из одноатомных молекул. Понимаю, что довольно сумбурно, но зато «просто, по-своему». )
touch.otvet.mail.ru
какой вид химической связи в оксиде бария?
Вы все с дуба рухнули????Кажется это вы не учились в школе. Какая ещё морфологическая???,такой связи вообще не бывает в химии . Конечно ионная связь между металлом и неметаллом. <a rel=»nofollow» href=»http://itchem.ru/vidy_himicheskoy_svyazi» target=»_blank»>http://itchem.ru/vidy_himicheskoy_svyazi</a>
Морфологическая.
Ковалентная морфологическая.
Морфологическая же, ты там дура совсемя?
Морфологическая.
Морфологическая. Вас в школе совсем не учили чтоли?
Морфологическая. Ковалентная, естественно, но это и так понятно.
Морфологическая.
Морфологическая ковалентная. Ппц школьники пошли!)) ) Мы такое в классе 9 уже знали в свое время ((( Жалко страну ((
Морфологическая.
Морфологическая
Конечно же морфологическая.
Какая на*** морфологическая???? Такой связи вообще нету, я ученик 9 класса, мы хим связи проходили в прошлом году. ИСТОЧНИК: учебник химии Рудзитиса за 8 класс Ионная связь
touch.otvet.mail.ru

Leave A Comment