Какое вещество обесцвечивает бромную воду. Бромная вода: ее свойства и особенности
Принято записывать через такую формулу — Br2, хотя она в растворе находится в виде смеси двух кислот — HBrO (бромноватистая кислота) и HBr Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг +3 , Мп +3 , Fe +2 , Co + 2 , Ni +3 . Добавление Br 2 уменьшает водородный показатель раствора (рН), т.к. бромная вода содержит свободные кислоты.
Это химически активное вещество, которое может вступать во взаимодействие как с неорганическими, так и с органическими веществами. Рассмотрим некоторые химические процессы с данным соединением.
Обесцвечивание бромной воды служит на все Для проведения такого эксперимента необходимо небольшое количество любого алкена или алкина смешать в пробирке с Br 2 . В ходе данной реакции происходит присоединение атомов брома по месту разрыва двойной или тройной связи. Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
Химическая реакция «фенол — бромная вода» используется для осаждения из растворов бромзамещенных соединений. Если данное взаимодействие веществ проводить в безводной среде, то образование трибромфенола займет пару дней. Поэтому в качестве катализатора добавляют небольшое количество Н 2 О.
Бромная вода в лаборатории готовится так: к 1 мл брома добавляют 250 мл дистиллированной воды, при этом интенсивно перемешивают. Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br 2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Необходимо учитывать и тот факт, что при попадании Br 2 на кожу появляется сильный зуд, а при длительном воздействии могут возникнуть язвочки. Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO 3 .
Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO 3 .
Бромная вода широко используется в химическом анализе и синтезе органических препаратов. Так, ее используют при производстве бромсодержащих лекарственных средств. И здесь необходимо быть осторожными, т.к. длительное их употребление может привести к заболеванию — бромизм. Основные симптомы — апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов — веществ, которые защищают от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
Вr 2 при обычной температуре — буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора.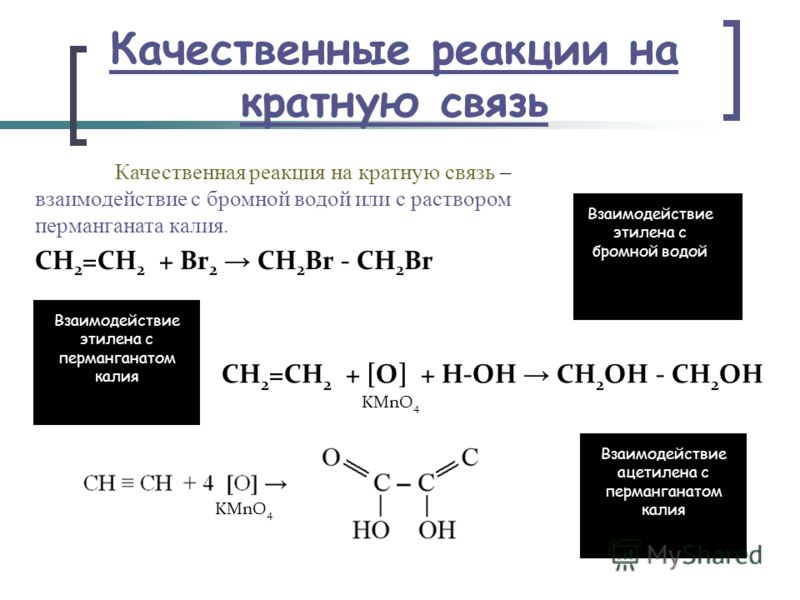 Насыщенный раствор Вr 2 в воде называют «бромной водой».
Насыщенный раствор Вr 2 в воде называют «бромной водой».
Свободный I 2 при обычной температуре-черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск. Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I 2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Вr — и I — . Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl 2 = I 2 + 2NaCl
2NaBr + Cl 2 = Br 2 + 2NaCI
2. В лабораторных условиях для получения Br 2 и I 2 используют, например, следующие реакции:
2NaBr + МnO 2 + 2H 2 SO 4 = Br 2 ↓ + MnSO 4 + Na 2 SO 4 + 2Н 2 O
бНВг + 2H 2 SO 4 = 3Br 2 ↓ + S↓ + 4Н 2 O
2HI + H 2 SO 4 = I 2 ↓ + SO 2 + 2Н 2 O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br 2 и I 2 .
Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br 2 и I 2 .
Бром — жидкость, в отличие от газообразного Cl 2 , поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной температуре.
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br 2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» — тест на присутствие в растворе целого ряда неорганических и органических веществ.
Газообразные и растворенные в воде SO 2 и H 2 S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br 2 + Na 2 SO 3 + Н 2 O = 2HBr + Na 2 SO 4
Br 2 + H 2 S = 2НВr + S↓
3Br 2 + Na 2 S + ЗН 2 O = 6HBr + Na 2 SO 3
Качественная реакция на непредельные органические соединения — обесцвечивание бромной воды:
R-CH=CH-R» + Br 2 → R-CHBr-CHBr-R»
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
С 6 Н 5 ОН + ЗBr 2 → С 6 Н 2 Вг 3 ОН↓ + ЗНВr
С 6 Н 5 NH 2 + ЗВr 2 → С 6 H 2 Br 3 NH 2 ↓ + ЗНВr
Анионы I — очень легко окисляются как сильными, так и слабыми окислителями:
2I — -2e — → I 2
Обнаружить выделяющийся I 2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I 2 . Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I 2 + I0HNO 3 = 2НIO 3 + 10NO 2 + 4Н 2 O
I 2 + 5Н 2 O 2 = 2НIO 3 + 4Н 2 O
I 2 + 5Cl 2 + 6Н 2 O = 2НIO 3 + 10HCl
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
Н 2 + I 2 → 2HI
HCI получают действием конц. H 2 SO 4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H 2 SO 4 до свободных галогенов:
H 2 SO 4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H 2 SO 4 до свободных галогенов:
2КВг + 2H 2 SO 4 = Вr 2 + SO 2 + 2Н 2 O + K 2 SO 4
6KI + 4H 2 SO 4 = 3I 2 + S + 4Н 2 O + 3K 2 SO 4
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
КВг + H 3 PO 4 = НВr + КН 2 PO 4
2) гидролиз галогенидов неметаллов
KI + H 3 PO 4 = HI + КН 2 PO 4
3) восстановление свободных галогенов в водных растворах
РВr 3 + ЗН 2 O = H 3 PO 3 + ЗНВr
РI 3 + ЗН 2 O = H 3 PO 3 + 3HI
Br 2 + SO 2 + 2Н 2 O = 2НВr + H 2 SO 4
l 2 + H 2 S = 2HI + S↓
4Br 2 + BaS + 4Н 2 O = 8HBr + BaSO 4
3) СН3 О СН3
4) СН3СОО СН3
3.Укажите соединение, содержащее карбоксильную группу:
1) ароматический спирт
2) альдегид
3) простой эфир
4.Укажите соединение, содержащее карбонильную группу:
1) ароматический спирт
2) альдегид
3) простой эфир
4) непредельная многоосновная кислота
5.
СН3 — СН – СН — С
1) 2-метил-3-бромбутанол-1
2) 2-бром-3-метилбутаналь
3) 2-метил-3-бромбутаналь
4) 2-бром-3-метилпропаналь
6. Реакция СН3СНО+Ag2O СН3СООН+2 Ag:
1) Поликонденсации
2) Этерификации
3) «серебряного зеркала»
4) Кучерова
7. Функциональная группа карбоновых кислот называется:
1) Карбонильной
2) Гидроксильной
3) Карбоксильной
4) сложноэфирной
8. Уксусная кислота не реагирует со следующим металлом:
9. Как называется альдегид:
1) 2-Метил-3-пропилбутаналь;
2) 2,3-диметилгексаналь;
4) 2-метил-2-пропилбутаналь
10. Укажите общую формулу углеводов:
11. Укажите углевод, являющийся основной частью древесины:
1) Крахмал
2) Целлюлоза
4) Мальтоза
12. Укажите формулу фруктозы:
13.Пентоза, входящая в состав ДНК – это:
1) Глюкоза
2) Фруктоза
4) Дезоксирибоза
14. Молочный сахар – это дисахарид:
Молочный сахар – это дисахарид:
1) Сахароза
2) Мальтоза
3) Лактоза
4) Галактоза
15. Свекловичный или тростниковый сахар – это дисахарид:
1) Мальтоза
2) Сахароза
3) Галактоза
4) Лактоза
16. Солодовый сахар:
1) Галактоза
2) Сахароза
3) Лактоза
4) Мальтоза
17. В клетках растений крахмал выполняет функцию:
1) Передачи наследственной информации
2) Запаса питательных веществ
3) Строительную и структурную
4) Катализатора биологических процессы
18. В клетках растений целлюлоза выполняет функцию:
1) Запаса питательных веществ
2) Катализатора биологических процессов
3) Строительную и структурную
4) Передачи наследственной информации
19. Дайте название соединению:
СН3 — СН – СН — СН3
1) 3-метилбутанол-2 3) 3-метилпропанон-2
2) 2-метилбутанол-3 4) 2 –метилпропаналь-2
R1 — С + HO – R2 ↔
1) гидратация 3) присоединения
2) реакция этерификации 4) замещения
Среди нижеперечисленных характеристик выберите те, которые, как правило, относятся к жидким жирам — маслам:
1) Имеют растительное происхождение
2) Имеют животное происхождение
3) Хорошо растворимы в воде
4) Хорошо растворимы в органических растворителях
7) Обесцвечивают бромную воду
8) Являются эфирами глицерина
Ответ дайте в виде последовательности цифр в порядке их возрастания.
В-2 Установите соответствие между характеристикой жира и примером жира, соответствующего этой характеристике. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту:
ХАРАКТЕРИСТИКА:
А) твердый жир растительного происхождения
Б) твердый жир животного происхождения
В)Жидкий жир животного происхождения
Г)Жидкий жир растительного происхождения
1) Льняное масло
2) Сливочное масло
3) Рыбий жир
4) Пальмовое масло
Здравствуйте. Помогите пожалуйста. 1) Укажите число изомерных карбоновых кислот состава C5h20O2: а) 3 б) 2 в) 4 г)
2) При растворении в воде 1 моль уксусного ангидрида образуется:
а) 2 моль этаналя
б) 2 моль этанола
в) 2 моль уксусной кислоты
г) 1 моль метилацетата
3) С какими веществами реагирует ацетат натрия:
а) Солярная кислота
б) Гидроксид натрия при нагреве
в) Угольная кислота
4) При взаимодействии этанола и оксида углерода (II) соответствующих условиях получается?
а) этаналь
б) пропаналь
в) пропановая кислота
г) метилацетат
5) В реакции какого типа могут вступать непредельные карбоновые кислоты: а) Окисление
б) Полимеризации
в) Присоединения
г) Этерификации
6) С какими веществами реагирует муравьиная кислота:
а) Хлорид меди II
б) Сульфат натрия
в) Гидрокарбонат калия
г) аммиачный раствор оксида серебра I
7) В отличие от стеариновой кислоты олеиновая кислота:
а) Жидкая при комнатной температуре
б) растворима в воде
в) Обесцвечивает бромную воду
г) Реагирует с щелочами
8) Какие вещества реагируют с водой:
а) линолевая кислота
б) этанол
в) пропаналь
г) пропан
9) С помощью какого одного реактива можно различить растворы глицерина, пропаналя, и этановой кислоты:
а) Бромная вода
б) карбонат калия
в) гидроксид меди II
г) азотная кислота
10) В реакциях с какими веществами с участием уксусной кислоты от ее молекулы отщепляется гидросильная группа:
а) Металлами
б) Щелочами
в) спиртами
г) карбонатами металов
Помогите плиз, решить две задачки!:(ставлю 11 пунктов 1) С какими из перечисленных веществ: гидроксид натрия, бромная вода, диметиловый эфир —
Бром — вещество, которое, как и ртуть, при комнатной температуре находится в жидком состоянии. Оно очень токсично, но широко используется в химической промышленности и лабораториях. Относится к группе галогенов, но более слабое, чем хлор. При прохождении через воду образует раствор под названием бромная вода.
Оно очень токсично, но широко используется в химической промышленности и лабораториях. Относится к группе галогенов, но более слабое, чем хлор. При прохождении через воду образует раствор под названием бромная вода.
Бром и приготовление бромной воды
Сам элемент — это красно-бурая жидкость с сильным, неприятным запахом. Дышать ею не стоит, так как можно отравиться, да и желание такое вряд ли у кого возникнет. Об этом свойстве говорит уже само название, ведь бром в переводе с древнегреческого означает «вонючка», «вонючий».
Молекула двухатомная, и ее формула — Br 2 . Сам элемент был найден в 1826 году и принес славу своему первооткрывателю — молодому преподавателю Антуану Балару. Распространен бром повсеместно, но больше всего его в морской воде и соленых озерах. Используется в производстве и лабораториях не само вещество, а его раствор, который легко приготовить.
Готовят раствор бромной воды только в вытяжном шкафу из-за ядовитости паров. Для этого берут бром в объеме один миллилитр и заливают в воду (дистиллированную, иначе получится много ненужных примесей) объемом 250 миллилитров, интенсивно мешая стеклянной палочкой.
Состав бромной воды
Свойства химические и физические
По внешнему виду бромная вода — оранжево-желтая жидкость, взявшая от основного вещества его неприятный запах. Температура, при которой раствор замерзает, довольно низкая. Еще при -20°C она жидкая.
Как и все галогеновые растворы, вода бромная является отличным окислителем, но более слабым, чем раствор хлора. Окисляет она металлы и многие органические соединения, в том числе фенолы. А добавление в нее еще брома приводит к уменьшению pH.
Применение
Применяют бромную воду в промышленных лабораториях. Одной из качественных реакций на непредельные углеводороды является именно взаимодействие алкенов и алкинов с раствором бромной воды. В результате этого состав обесцвечивается.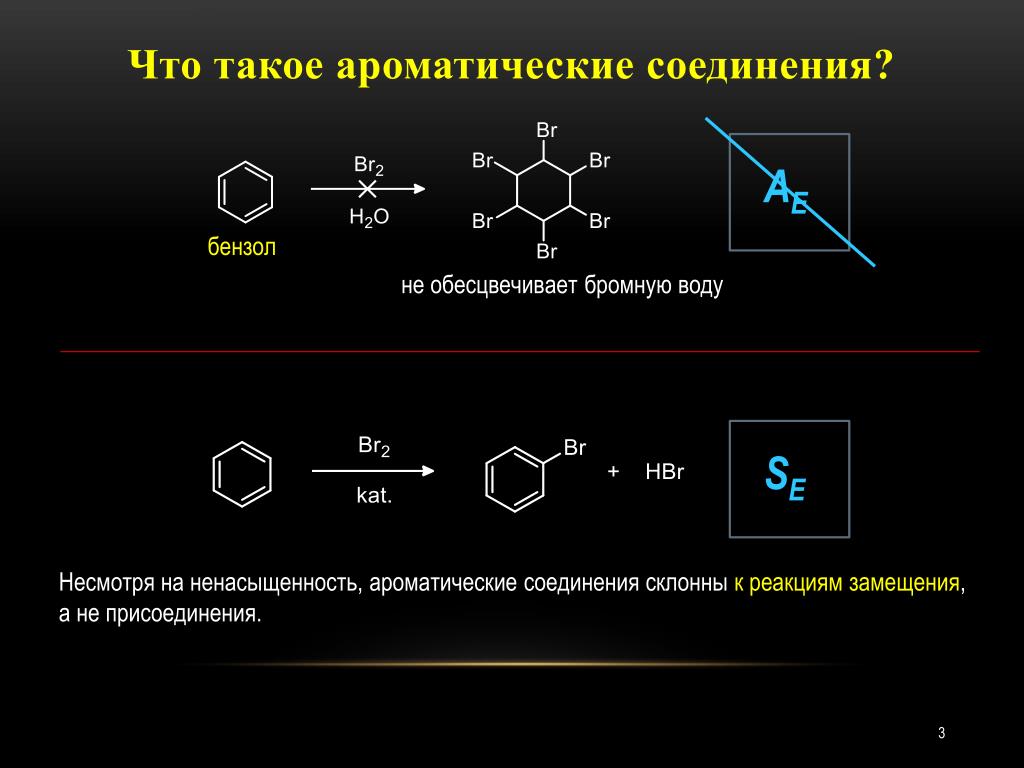 Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Происходит обесцвечивание бромной воды и при реакции с непредельными маслами. В них также присутствуют двойные и тройные связи. Взаимодействие с бромной водой йодистого калия приводит к обесцвечиванию первого и постепенному выделению молекул свободного йода (I 2). Можно провести с бромной водой качественную реакцию на присутствие CuCl, при добавлении небольшого количества аммиачного раствора произойдет покраснение.
В медицине бромную воду применяют при производстве препаратов. Раньше существовала легенда, что солдатам в пищу добавляют бром, чтобы снизить потенцию. Но оснований для этого утверждения нет никаких, так как вещества, содержащие бром, не оказывают на мужскую силу никакого влияния. Они просто действуют на нервную систему как успокаивающее и мягкое снотворное.
Но применяя лекарственные вещества, содержащие бром, следует быть весьма аккуратными, так как длительный прием может вызвать такую болезнь, как бромизм. Основные симптомы заболевания — общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Основные симптомы заболевания — общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Применяется бромная вода и в строительстве — на разных этапах производства веществ, защищающих от пламени ткани, древесину, стройматериалы. Еще эти вещества называют антипиренами. Бромную воду и бромиды применяют в полетах, для окисления ракетного топлива, при добыче нефти, в сельском хозяйстве (производство пестицидов и инсектицидов).
Вещество которое обесцвечивает бромную воду. Бромная вода: ее свойства и особенности
Вr 2 при обычной температуре — буровато-коричневая тяжелая жидкость, образующая ядовитые пары красно-бурого цвета с резким запахом. Растворимость в воде брома выше, чем у хлора. Насыщенный раствор Вr 2 в воде называют «бромной водой».
Свободный I 2 при обычной температуре-черно-серое с фиолетовым оттенком твердое вещество, имеет заметный металлический блеск.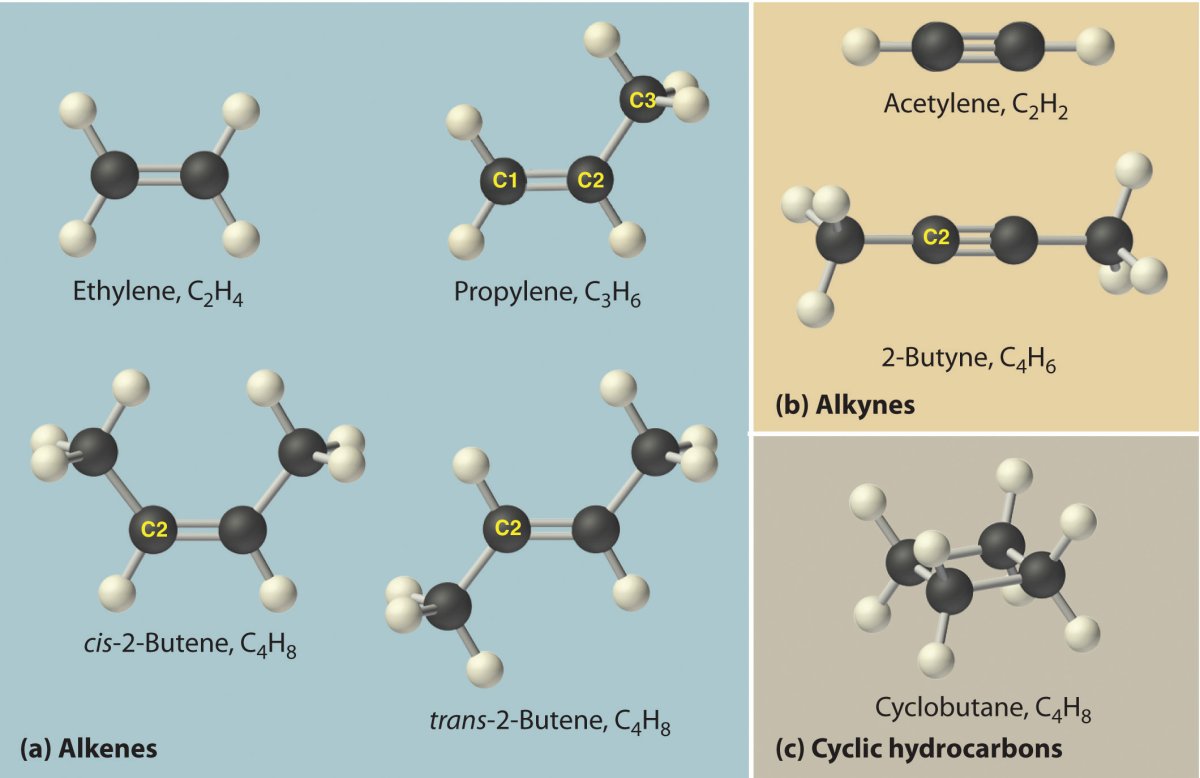 Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I 2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Йод легко возгоняется, обладает своеобразным запахом (пары йода, как и брома, очень ядовиты). Растворимость I 2 в воде наименьшая среди всех галогенов, но он хорошо растворяется в спирте и других органических растворителях.
Способы получения
1. Бром и йод извлекают из морской воды, подземных рассолов и буровых вод, где они содержатся в виде анионов Вr — и I — . Выделение свободных галогенов осуществляют с помощью различных окислителей, чаще всего пропускают газообразный хлор:
2NaI + Cl 2 = I 2 + 2NaCl
2NaBr + Cl 2 = Br 2 + 2NaCI
2. В лабораторных условиях для получения Br 2 и I 2 используют, например, следующие реакции:
2NaBr + МnO 2 + 2H 2 SO 4 = Br 2 ↓ + MnSO 4 + Na 2 SO 4 + 2Н 2 O
бНВг + 2H 2 SO 4 = 3Br 2 ↓ + S↓ + 4Н 2 O
2HI + H 2 SO 4 = I 2 ↓ + SO 2 + 2Н 2 O
Химические свойства
По химическим свойствам бром и йод сходны с хлором. Различия связаны, главным образом, с условиями протекания реакций. Отметим некоторые важные особенности химических реакций с участием Br 2 и I 2 .
Бром — жидкость, в отличие от газообразного Cl 2 , поэтому концентрация молекул в нем выше. Этим объясняется более сильное окисляющее действие жидкого брома. Например, при соприкосновении с ним железа и алюминия происходит возгорание даже при обычной температуре.
Бромная вода имеет желто-бурую окраску, которая быстро исчезает, если растворенный Br 2 прореагирует с каким-либо веществом. «Обесцвечивание бромной воды» — тест на присутствие в растворе целого ряда неорганических и органических веществ.
Газообразные и растворенные в воде SO 2 и H 2 S, а также растворимые сульфиты и сульфиды обесцвечивают бромную воду:
Br 2 + Na 2 SO 3 + Н 2 O = 2HBr + Na 2 SO 4
Br 2 + H 2 S = 2НВr + S↓
3Br 2 + Na 2 S + ЗН 2 O = 6HBr + Na 2 SO 3
Качественная реакция на непредельные органические соединения — обесцвечивание бромной воды:
R-CH=CH-R» + Br 2 → R-CHBr-CHBr-R»
Фенол и анилин легко взаимодействуют с бромной водой, причем продукты реакций не растворяются в органических растворителях, поэтому образуют осадки:
С 6 Н 5 ОН + ЗBr 2 → С 6 Н 2 Вг 3 ОН↓ + ЗНВr
С 6 Н 5 NH 2 + ЗВr 2 → С 6 H 2 Br 3 NH 2 ↓ + ЗНВr
Анионы I — очень легко окисляются как сильными, так и слабыми окислителями:
2I — -2e — → I 2
Обнаружить выделяющийся I 2 даже в малых количествах можно с помощью крахмального раствора, который приобретает характерную грязно-синюю окраску в присутствии I 2 . Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Иод-крахмальная реакция используется при проведении не только качественного анализа, но и количественного.
Атомы иода имеют более низкие значения энергии сродства к электрону и ЭО по сравнению с другими галогенами. С другой стороны, проявление некоторой металличности у йода объясняется существенным снижением энергии ионизации, благодаря чему его атомы гораздо легче отдают электроны. В реакциях с сильными окислителями йод ведет себя как восстановитель, например:
I 2 + I0HNO 3 = 2НIO 3 + 10NO 2 + 4Н 2 O
I 2 + 5Н 2 O 2 = 2НIO 3 + 4Н 2 O
I 2 + 5Cl 2 + 6Н 2 O = 2НIO 3 + 10HCl
Бромоводород и йодоводород
НВr и HI по физическим и химическим свойствам очень сходны с HCl, поэтому следует обратить внимание только на практически важные отличия, которые необходимо учитывать при получении этих веществ.
Молекулы НВr и HI менее устойчивы, чем HCl, поэтому синтез их из простых веществ затруднен вследствие обратимости реакции (особенно в случае HI).
Н 2 + I 2 → 2HI
HCI получают действием конц. H 2 SO 4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H 2 SO 4 до свободных галогенов:
H 2 SO 4 на хлориды (например, твердый NaCl). Бромоводород и йодоводород таким образом не удается получить, поскольку они окисляются конц. H 2 SO 4 до свободных галогенов:
2КВг + 2H 2 SO 4 = Вr 2 + SO 2 + 2Н 2 O + K 2 SO 4
6KI + 4H 2 SO 4 = 3I 2 + S + 4Н 2 O + 3K 2 SO 4
1) из бромидов и йодидов
Необходимо вытеснять НВr и HI из их солей нелетучей неокисляющей ортофосфорной кислотой
КВг + H 3 PO 4 = НВr + КН 2 PO 4
2) гидролиз галогенидов неметаллов
KI + H 3 PO 4 = HI + КН 2 PO 4
3) восстановление свободных галогенов в водных растворах
РВr 3 + ЗН 2 O = H 3 PO 3 + ЗНВr
РI 3 + ЗН 2 O = H 3 PO 3 + 3HI
Br 2 + SO 2 + 2Н 2 O = 2НВr + H 2 SO 4
l 2 + H 2 S = 2HI + S↓
4Br 2 + BaS + 4Н 2 O = 8HBr + BaSO 4
Бром — вещество, которое, как и ртуть, при комнатной температуре находится в жидком состоянии. Оно очень токсично, но широко используется в химической промышленности и лабораториях. Относится к группе галогенов, но более слабое, чем хлор. При прохождении через воду образует раствор под названием бромная вода.
При прохождении через воду образует раствор под названием бромная вода.
Бром и приготовление бромной воды
Сам элемент — это красно-бурая жидкость с сильным, неприятным запахом. Дышать ею не стоит, так как можно отравиться, да и желание такое вряд ли у кого возникнет. Об этом свойстве говорит уже само название, ведь бром в переводе с древнегреческого означает «вонючка», «вонючий».
Молекула двухатомная, и ее формула — Br 2 . Сам элемент был найден в 1826 году и принес славу своему первооткрывателю — молодому преподавателю Антуану Балару. Распространен бром повсеместно, но больше всего его в морской воде и соленых озерах. Используется в производстве и лабораториях не само вещество, а его раствор, который легко приготовить.
Готовят раствор бромной воды только в вытяжном шкафу из-за ядовитости паров. Для этого берут бром в объеме один миллилитр и заливают в воду (дистиллированную, иначе получится много ненужных примесей) объемом 250 миллилитров, интенсивно мешая стеклянной палочкой. Бромная вода готова.
Хранить ее нужно только в темном стекле, герметично закрыв. Будьте осторожны, так как, соприкасаясь с кожей, бром вызывает сильнейшие и болезненные ожоги. Если контакт произошел, срочно промойте пораженное место водой.
Бромная вода готова.
Хранить ее нужно только в темном стекле, герметично закрыв. Будьте осторожны, так как, соприкасаясь с кожей, бром вызывает сильнейшие и болезненные ожоги. Если контакт произошел, срочно промойте пораженное место водой.
Состав бромной воды
Свойства химические и физические
По внешнему виду бромная вода — оранжево-желтая жидкость, взявшая от основного вещества его неприятный запах. Температура, при которой раствор замерзает, довольно низкая. Еще при -20°C она жидкая.
Как и все галогеновые растворы, вода бромная является отличным окислителем, но более слабым, чем раствор хлора. Окисляет она металлы и многие органические соединения, в том числе фенолы. А добавление в нее еще брома приводит к уменьшению pH.
Применение
Применяют бромную воду в промышленных лабораториях. Одной из качественных реакций на непредельные углеводороды является именно взаимодействие алкенов и алкинов с раствором бромной воды. В результате этого состав обесцвечивается. Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Разрывая двойные и тройные связи, бром присоединяется, образуя бромистые соединения.
Происходит обесцвечивание бромной воды и при реакции с непредельными маслами. В них также присутствуют двойные и тройные связи. Взаимодействие с бромной водой йодистого калия приводит к обесцвечиванию первого и постепенному выделению молекул свободного йода (I 2). Можно провести с бромной водой качественную реакцию на присутствие CuCl, при добавлении небольшого количества аммиачного раствора произойдет покраснение.
В медицине бромную воду применяют при производстве препаратов. Раньше существовала легенда, что солдатам в пищу добавляют бром, чтобы снизить потенцию. Но оснований для этого утверждения нет никаких, так как вещества, содержащие бром, не оказывают на мужскую силу никакого влияния. Они просто действуют на нервную систему как успокаивающее и мягкое снотворное.
Но применяя лекарственные вещества, содержащие бром, следует быть весьма аккуратными, так как длительный прием может вызвать такую болезнь, как бромизм.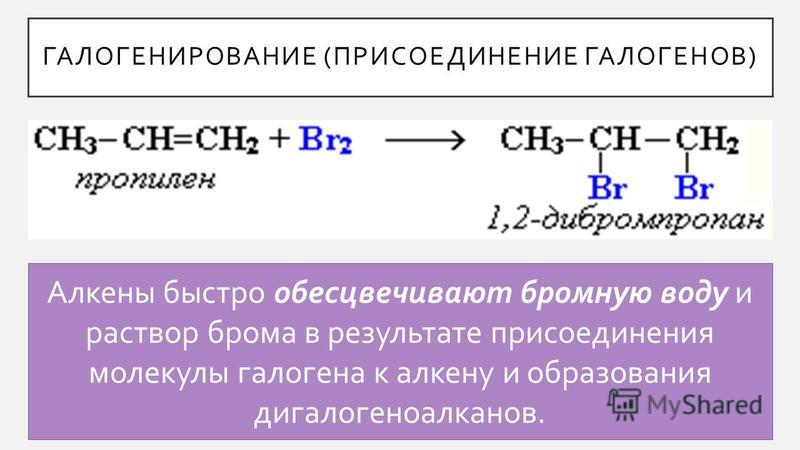 Основные симптомы заболевания — общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Основные симптомы заболевания — общий упадок сил, сопровождающийся сыпью на коже и отсутствием аппетита. Для нормализации состояния нужно срочно вывести из организма активное вещество. Для этого прописывают большое количество жидкости и пищу с большим содержанием солей.
Применяется бромная вода и в строительстве — на разных этапах производства веществ, защищающих от пламени ткани, древесину, стройматериалы. Еще эти вещества называют антипиренами. Бромную воду и бромиды применяют в полетах, для окисления ракетного топлива, при добыче нефти, в сельском хозяйстве (производство пестицидов и инсектицидов).
Принято записывать через такую формулу — Br2, хотя она в растворе находится в виде смеси двух кислот — HBrO (бромноватистая кислота) и HBr Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг +3 , Мп +3 , Fe +2 , Co + 2 , Ni +3 . Добавление Br 2 уменьшает водородный показатель раствора (рН), т.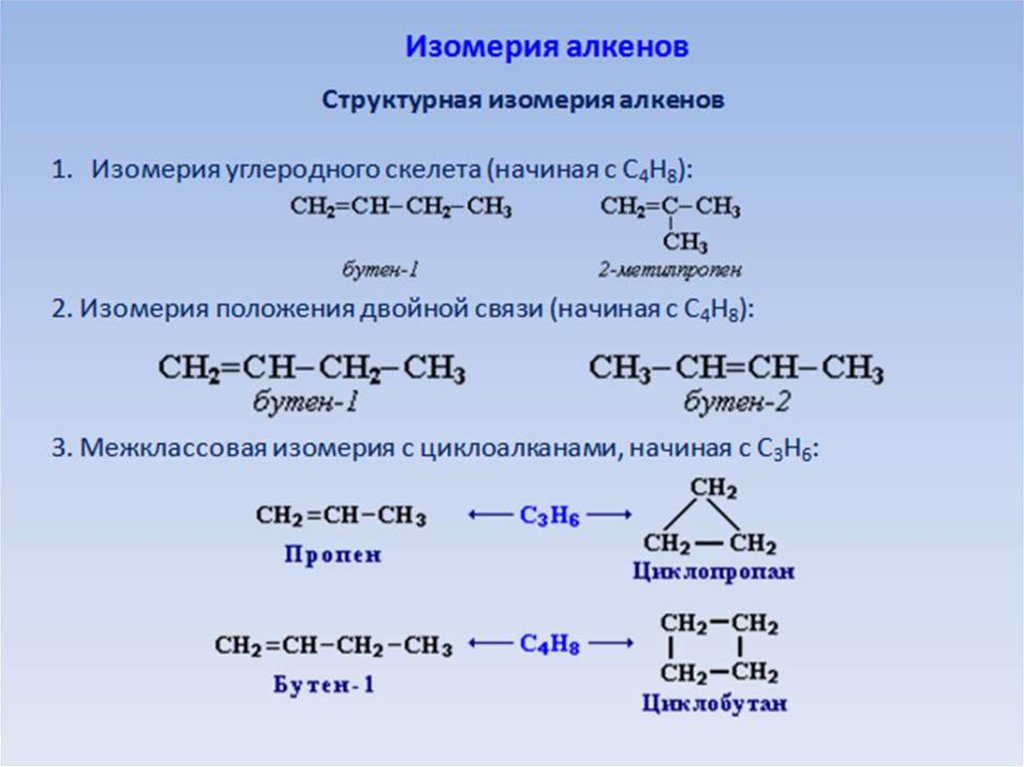 к. бромная вода содержит свободные кислоты.
к. бромная вода содержит свободные кислоты.
Это химически активное вещество, которое может вступать во взаимодействие как с неорганическими, так и с органическими веществами. Рассмотрим некоторые химические процессы с данным соединением.
Обесцвечивание бромной воды служит на все Для проведения такого эксперимента необходимо небольшое количество любого алкена или алкина смешать в пробирке с Br 2 . В ходе данной реакции происходит присоединение атомов брома по месту разрыва двойной или тройной связи. Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
Химическая реакция «фенол — бромная вода» используется для осаждения из растворов бромзамещенных соединений. Если данное взаимодействие веществ проводить в безводной среде, то образование трибромфенола займет пару дней. Поэтому в качестве катализатора добавляют небольшое количество Н 2 О.
Бромная вода в лаборатории готовится так: к 1 мл брома добавляют 250 мл дистиллированной воды, при этом интенсивно перемешивают.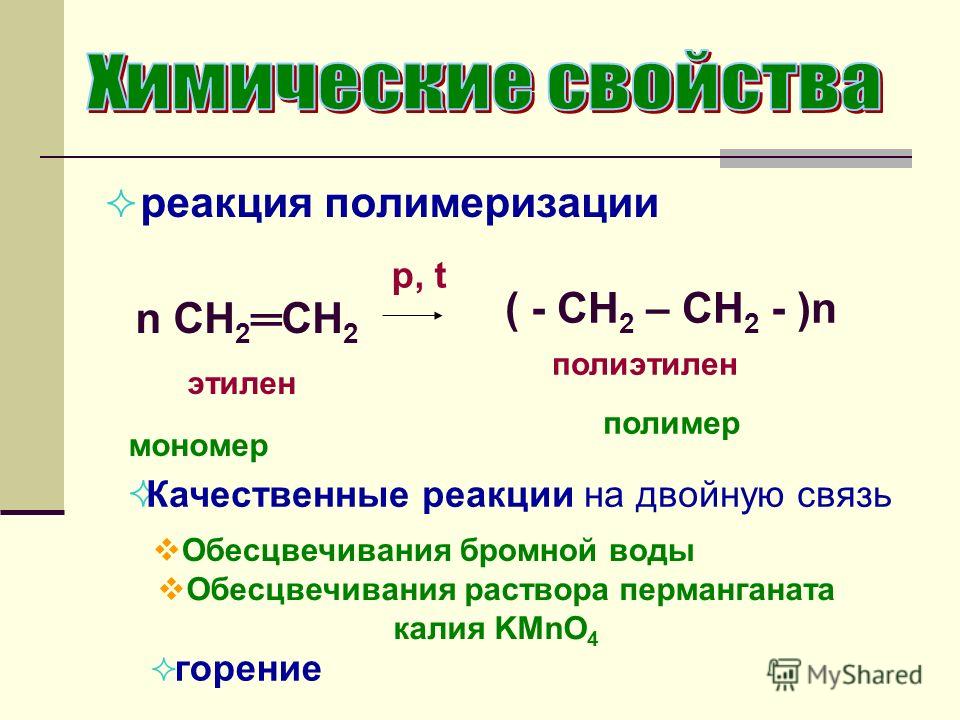 Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br 2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br 2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Необходимо учитывать и тот факт, что при попадании Br 2 на кожу появляется сильный зуд, а при длительном воздействии могут возникнуть язвочки. Если вещество попало на кожу, ее следует промыть большим количеством воды, а затем При большой раневой поверхности или глубоких поражениях эпидермиса кожа дополнительно смазывается мазью, в состав которой входит NaHCO 3 .
Бромная вода широко используется в химическом анализе и синтезе органических препаратов. Так, ее используют при производстве бромсодержащих лекарственных средств. И здесь необходимо быть осторожными, т.к. длительное их употребление может привести к заболеванию — бромизм.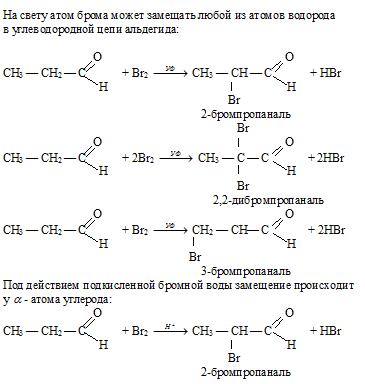 Основные симптомы — апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов — веществ, которые защищают от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
Основные симптомы — апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов — веществ, которые защищают от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
Реакции алкенов с бромом
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3765
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице представлены факты и простой, лаконичный механизм реакций электрофильного присоединения между бромом (и другими галогенами) и алкенами, такими как этилен и циклогексен
Электрофильное присоединение брома к этилену
Алкены реагируют на холоду с чистым жидким бромом или с раствором брома в органическом растворителе, таком как тетрахлорметан. Двойная связь разрывается, и к каждому атому углерода присоединяется атом брома. Бром теряет свой первоначальный красно-коричневый цвет и превращается в бесцветную жидкость. В случае реакции с этиленом образуется 1,2-дибромэтан.
Двойная связь разрывается, и к каждому атому углерода присоединяется атом брома. Бром теряет свой первоначальный красно-коричневый цвет и превращается в бесцветную жидкость. В случае реакции с этиленом образуется 1,2-дибромэтан.
Это обесцвечивание брома часто используется в качестве теста на углерод-углеродную двойную связь. Если используется водный раствор брома («бромная вода»), получается смесь продуктов. Аналогично ведут себя и другие галогены, кроме фтора. (Фтор взрывоопасно реагирует со всеми углеводородами, включая алкены, с образованием углерода и фтористого водорода.) Если вас интересует реакция, скажем, с хлором, все, что вам нужно сделать, это заменить Br на Cl.
Механизм
Реакция является примером электрофильного присоединения. Бром является очень «поляризуемой» молекулой, и приближающаяся пи-связь в этилене индуцирует диполь в молекуле брома. Если вы рисуете этот механизм на экзамене, напишите рядом с молекулой брома слова «индуцированный диполь» — чтобы показать, что вы понимаете, о чем идет речь.
Рис. Упрощенный вариант механизма
На первой стадии реакции один из атомов брома присоединяется к обоим атомам углерода, при этом положительный заряд оказывается на атоме брома. Образуется ион бромония.
Рисунок: Стадия 1 механизма присоединения брома к этилену
Затем ион бромония подвергается атаке с обратной стороны ионом брома, образующимся в соседней реакции.
Рисунок: Стадия 2 механизма присоединения брома к этилену
Электрофильное присоединение брома к циклогексену
Циклогексен реагирует с бромом так же и в тех же условиях, что и любой другой алкен. Образуется 1,2-дибромциклогексан.
Механизм
Реакция является примером электрофильного присоединения. Опять же, бром поляризуется приближающейся связью \(\pi\) в циклогексене. Не забудьте рядом с молекулой брома написать слова «индуцированный диполь».
Рис. Упрощенный вариант механизма
На первой стадии реакции один из атомов брома присоединяется к обоим атомам углерода, при этом положительный заряд оказывается на атоме брома. Образуется ион бромония.
Образуется ион бромония.
Рисунок: Стадия 1 механизма присоединения брома к циклогексану
Затем ион бромония атакуется с тыльной стороны ионом брома, образующимся в соседней реакции.
Рисунок: Стадия 2 механизма присоединения брома к циклогексану
Авторы
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Реакции алкенов с бромом» используется в соответствии с лицензией CC BY-NC 4.0, ее автор, ремикс и/или куратор — Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Какая молекула обесцвечивает бромную воду в темноте
Бромная вода представляет собой раствор брома в воде. Используется как дезинфицирующее и отбеливающее средство. Когда бромная вода подвергается воздействию света, она разлагается на бром и кислород. Какая молекула обесцвечивает бромную воду в темноте? Одной из молекул, способных обесцвечивать бромную воду в темноте, является хлорид. Хлорид содержится во многих соединениях, в том числе в поваренной соли. Когда к бромной воде добавляют хлорид, бром выпадает из раствора в осадок, оставляя воду прозрачной.
Поскольку бензольные связи делокализованы пи-связями, его подвергают испытаниям с бромной водой, поскольку он не является электрофильным по своей природе. В результате бромная вода не обесцвечивается.
Да, это так. Если вы используете щелочь, она обесцветит бромную воду.
Под воздействием УФ-излучения циклопропан может быть преобразован в нециклический алкан так же, как хлор может быть преобразован в нециклический алкан. Кроме того, он может реагировать в темноте.
Обесцвечивает ли алкен бромную воду в темноте?
Фото – googleusercontent.comРассол обычно используется для тестирования алкенов в лаборатории. Когда вы встряхиваете пробирку с раствором алкена и добавляете образец бромной воды, она становится оранжевой и бесцветной. Алканы же не окрашивают бромную воду.
В бромной воде цвет меняется. При смешивании с этим реагентом циклоалканов окраска раствора остается неизменной. Атомы углерода в циклоалканах связаны одинарными связями, что делает молекулу более стабильной и придает ей прочную связь. В результате бромная вода не будет подвергаться негативному воздействию циклоалканов. Аленны обесцвечивают бромную воду в дополнение к алкенам.
Бромная вода обесцвечивается алкеном
Почему бромная вода окрашивается в желтый цвет при добавлении к ней алкенов? Сравнить алкены и алканы можно с помощью простого химического теста. Раствор брома и апельсина известен как бромная вода. При встряхивании с алкеном бесцветная жидкость становится бесцветной. Несмотря на свою способность обесцвечивать бромную воду, алкены этого сделать не могут. Как обесцвечивать бромную воду? Цвет бромной воды можно изменить обесцвечиванием эфиром, бутином и гексином. Он теряется в процессе получения бесцветной жидкости, меняя свой цвет с красного на коричневый. Для испытаний двойной и тройной связи С-С часто используется обесцвечивание брома. Как реагирует алкен с бромной водой? Когда вы встряхиваете алкен с бромной водой (или барботируете его через бромную воду), он становится бесцветным. Цвет бромной воды уменьшается при ее отбеливании. Как реагируют алканы с бромом? При комнатной температуре алканы и хлор или бром реагируют, но света нет.
Что обесцвечивает красный раствор брома?
Фото – amazonaws.comСуществует несколько различных вариантов обесцвечивания красного раствора брома. Одним из вариантов является добавление восстановителя, такого как тиосульфат натрия, который преобразует бром в бесцветное соединение. Другой вариант — добавить окислитель, такой как перманганат калия, который также преобразует бром в бесцветное соединение.
При присоединении атомов углерода к алкенам образуются их двойные связи, тогда как при присоединении атомов углерода к алкинам образуются их двойные связи.
Алканы, которые представляют собой углеводороды только с одной связью между атомами углерода, известны как углеводороды. Углеводороды, называемые аналкенами, состоят из атомов углерода, имеющих двойные связи. Алкины представляют собой углеводороды с тройными связями между атомами углерода.
Двойная связь существует между двумя атомами углерода в алкенах, а двойная связь существует между атомом углерода и атомом водорода в алкинах. Тройная связь образуется между атомом углерода, атомом водорода и атомом кислорода в алкинах.
Тройная связь образуется между атомом углерода, атомом водорода и атомом кислорода в алкинах.
Обесцвечивание брома можно использовать в качестве теста на углерод-углеродную двойную связь. При использовании брома в водном растворе образуется бромсодержащая вода (смесь продуктов).
Какие органические соединения обесцвечивают бромную воду?
Фото – cloudfront.netОрганические соединения – это молекулы, содержащие углерод. Бромная вода представляет собой раствор брома в воде. Когда в бромную воду добавляют органические соединения, они обесцвечивают раствор. Это связано с тем, что органические соединения реагируют с бромом, образуя неокрашенные соединения.
Алканы являются насыщенными углеводородами, поэтому бромная вода не желтеет из-за них. Алканы отличаются своими двойными связями, что означает, что они содержат два атома водорода, разделенных одним атомом углерода. Из-за своей одинарной двойной углерод-углеродной связи он содержит два атома водорода, разделенных одним атомом углерода, например, этилен.
Какой составной краситель является бромной водой?
Бромная вода интенсивного желто-красного цвета получается путем соединения брома (Br2) и воды (h3O).
Тест бромной воды на алкеновые соединения
В результате добавления br- к воде алкен станет бромной водой оранжевым .
Что вызывает обесцвечивание бромной воды?
Бромная вода может изменить цвет из-за ряда факторов, включая присутствие органических веществ, высокий уровень pH и высокие температуры. Бром является сильным окислителем, поэтому он может быстро расщеплять органические вещества на более мелкие молекулы, которые затем могут изменить цвет воды. Высокий уровень pH также может привести к тому, что бром станет менее эффективным при дезинфекции, поэтому вода может казаться мутной или обесцвеченной. Высокие температуры также могут привести к выделению брома, что может привести к тому, что вода приобретет желтый или коричневый оттенок.
В результате окисления бромный газ теряет свой коричневый цвет (из-за бромной воды) и для его окисления используют бромистоводородную кислоту. Этан реагирует с бромной водой в ходе реакции присоединения, а этан — нет. При взаимодействии бромной воды и этилена изменяется цвет бромной воды. Причина того, что этен обесцвечивает цвет бромной воды, заключается в том, что она подвергается реакции присоединения, катализируемой присутствием ионов Br-. Как только молекулы брома расщепляются молекулами этена, молекулы этена образуют более крупные цепи, которые соединяются вместе и вызывают расщепление молекул брома. Этот процесс приводит к исчезновению коричневого цвета и образованию прозрачной жидкости.
Цвет бромной воды
Атомы углерода с двойными связями расположены таким образом, что они связаны атомами брома. В результате бромная вода теряет свой первоначальный цвет, в результате чего получается бесцветная жидкость. Цвет бромной воды изменяется в результате окисления, особенно при смешивании брома и ненасыщенных углеводородов. Когда бром вступает в реакцию с этими углеводородами, вода становится желтой. Из-за высокой доли ненасыщенных молекул в алкенах он подвержен обесцвечиванию.
Когда бром вступает в реакцию с этими углеводородами, вода становится желтой. Из-за высокой доли ненасыщенных молекул в алкенах он подвержен обесцвечиванию.
Обесцвечивание бромной воды
Обесцвечивание бромной воды — это процесс удаления цвета из воды. Обычно это делается путем фильтрации или с помощью химического процесса.
Поскольку насыщенные углеводороды, такие как гексан, не окрашивают бромную воду после их добавления, они не вступают в реакции присоединения. Поскольку спирт не содержит насыщенных соединений, он может окисляться, в результате чего бромная вода обесцвечивается.
Почему бром обесцвечивается?
Когда углеводород обесцвечивает бромсодержащую воду, более вероятно, что углеводороды являются ненасыщенными, включая алкен и алкин, в результате разрыва двойной или тройной связи с валентными атомами углерода в броме. Когда бром реагирует с ними, он обесцвечивается.
Алкен обесцвечивает бромную воду?
Отбеливатели и алкины, помимо бромной воды, осветляют ее.
Do Ароматические соединения обесцвечивают бромную воду
Известно, что ароматические соединения устойчивы к реакциям окисления и восстановления. Бромная вода является сильным окислителем, поэтому ожидается, что ароматические соединения не будут обесцвечивать бромную воду.
Реакция аналогична реакции пропена и бромной воды. Это показывает, что пропен является ненасыщенным углеводородом и в процессе обесцвечивания вступает в реакции присоединения с бромной водой. Если вы выберете D, вы сможете увидеть, что пропен обесцвечивает бромную воду. Сливочное масло не обесцвечивает бромную воду, в отличие от растительного масла. По результатам этого эксперимента масло для жарки является насыщенным углеводородом и не подвергается реакциям присоединения бромной воды .
Какие соединения могут обесцвечивать бромную воду?
Следующий текст является пояснением к редакционной статье: Какие соединения могут окрашивать бромную воду? Бронмовую воду можно обесцветить эфиром, бутином или гексином. Подвергается ли бензол испытанию бромной водой ? Несмотря на то, что бензол содержит двойную связь с ненасыщенной водородной связью, он имеет устойчивые делокализованные пи-связи и не вступает в реакцию с бромной водой. Поскольку алканы состоят только из отдельных молекул, бром обладает способностью взаимодействовать с ароматическими химическими веществами, такими как фенол. Может ли бромная вода реагировать с бензолом? Реактивность крайне низкая. Если бы присутствовали [математические] двойные связи, бензол реагировал бы аналогично алкенам, обесцвечивая бромную воду. Однако бензол не способен вступать в реакцию с бромом, поэтому это невозможно осуществить. Реакции электрофильного присоединения, используемые в бензоле, не могут быть проведены в других реакциях.
Подвергается ли бензол испытанию бромной водой ? Несмотря на то, что бензол содержит двойную связь с ненасыщенной водородной связью, он имеет устойчивые делокализованные пи-связи и не вступает в реакцию с бромной водой. Поскольку алканы состоят только из отдельных молекул, бром обладает способностью взаимодействовать с ароматическими химическими веществами, такими как фенол. Может ли бромная вода реагировать с бензолом? Реактивность крайне низкая. Если бы присутствовали [математические] двойные связи, бензол реагировал бы аналогично алкенам, обесцвечивая бромную воду. Однако бензол не способен вступать в реакцию с бромом, поэтому это невозможно осуществить. Реакции электрофильного присоединения, используемые в бензоле, не могут быть проведены в других реакциях.
Бромная вода для обесцвечивания спиртами
Бромная вода представляет собой химическое соединение с формулой Br2. Спирты представляют собой соединения общей формулы R-OH, где R представляет собой алкильную группу. Когда к бромной воде добавляют спирт, атомы брома присоединяются к гидроксильной группе спирта, образуя бромалканол. Этот процесс называется обесцвечиванием, так как бромная вода теряет свой желтый цвет.
Когда к бромной воде добавляют спирт, атомы брома присоединяются к гидроксильной группе спирта, образуя бромалканол. Этот процесс называется обесцвечиванием, так как бромная вода теряет свой желтый цвет.
В кетонах и альдегидах атом углерода имеет двойную связь между двумя атомами водорода. Цвета этих соединений меняются как бромная вода реагирует с этими ненасыщенными молекулами. Поскольку альдегиды и кетоны ненасыщенные, они менее устойчивы к элементам, чем алифатические соединения.
Что происходит при добавлении спирта в бромную воду?
В пробирку следует добавить несколько капель бромной воды с этанолом. Когда бром реагирует с этанолом, он становится красновато-коричневым. Когда вы добавите раствор бром-этанола, вы заметите, что красновато-коричневый цвет сохраняется.
Удивительная растворимость брома
Он может растворяться в полярных растворителях, таких как спирт и серная кислота, а также в неполярных растворителях. При соединении брома и этанола бром растворяется . Этен получают в результате реакции между этанолом и водой. Этен — легкий газ с бесцветной формулой, его можно использовать для обесцвечивания бромной воды и щелочных растворов $KMn*O_4*$.
Этен получают в результате реакции между этанолом и водой. Этен — легкий газ с бесцветной формулой, его можно использовать для обесцвечивания бромной воды и щелочных растворов $KMn*O_4*$.
Как спирты реагируют с бромом?
Первичными продуктами реакции являются спирт (по массе) и бром в мольном соотношении два к одному, этилацетат, бромистоводородная кислота и хлороформ.
Бромная вода: универсальный реагент
В результате реакции с различными органическими соединениями бромная вода может давать различные продукты. Наиболее часто реакции протекают в форме фенольных, алкеновых, енольных и ацетильных групп. Эта вода также может быть использована для производства различных продуктов путем взаимодействия с различными неорганическими соединениями, такими как металлы.
Какие соединения могут обесцвечивать бромную воду?
Бронминовая вода может быть обесцвечена эттеном, бутином и гексином.
Соединения, не обесцвечивающие бромную воду
Однако некоторые из этих соединений не окрашивают бромную воду. Поскольку алканы являются насыщенными углеводородами, они не отбеливают бромную воду. Кроме того, такие соединения, как диоксид хлора и газообразный хлор, не оказывают заметного влияния на бромную акварель .
Поскольку алканы являются насыщенными углеводородами, они не отбеливают бромную воду. Кроме того, такие соединения, как диоксид хлора и газообразный хлор, не оказывают заметного влияния на бромную акварель .
Обесцвечивает ли пропанол бромную воду?
Это показано следующим образом. Пропен реагирует с бромной водой следующим образом: для этого пропен обесцвечивает бромную воду. В итоге правильный вариант Д.
Альдегиды и кетоны: ненасыщенные молекулы
Альдегиды и кетоны являются ненасыщенными молекулами, что означает, что они осветляют бромную воду. Эти материалы особенно опасны, потому что они содержат свободные радикалы, которые могут вызвать разрушение атомов брома.
Почему алкены обесцвечивают бромную воду
Бромная вода обесцвечивает алкены, потому что атомы брома присоединяются к двойным связям в молекулах алкенов. Это создает новые бесцветные молекулы, называемые дибромидами.
Интересный факт, что бром ядовит. Помимо того, что он бесцветен, не имеет запаха и вкуса, он тяжелее воздуха и может легко выйти из контейнера. Бром используется во многих промышленных процессах, а также является компонентом многих продуктов противопожарной защиты.
Помимо того, что он бесцветен, не имеет запаха и вкуса, он тяжелее воздуха и может легко выйти из контейнера. Бром используется во многих промышленных процессах, а также является компонентом многих продуктов противопожарной защиты.
Почему алкены обесцвечивают бромную воду?
По мере высвобождения двойной углерод-углеродной связи коричневый бром в алкене превращается в бесцветную воду. Эта реакция будет происходить при связывании ненасыщенных соединений, содержащих двойные углерод-углеродные связи. В результате отсутствия бромных реакций алканы не изменяют окраску.
Реагирует ли алкен с бромной водой?
Когда алкены смешиваются с бромной водой (или барботируются через бромную воду), они становятся бесцветными. На цвет бромной воды влияет щелочность. Это осложняется тем, что 1,2-дибромэтан не является первичным продуктом.
Какая реакция происходит, когда алкен обесцвечивает бром?
Это реакция электрофильного присоединения. Образование иона бромония в форме иона гианлобия по типу IC2, который затем превращается в ковалентную связь в виде связи br2-cl4, является предпосылкой противовоспалительных свойств в форме br. общая добавка представляет собой добавку, препятствующую образованию капель.
общая добавка представляет собой добавку, препятствующую образованию капель.
Могут ли алкины обесцвечивать бромную воду
Да, алкины могут обесцвечивать бромную воду. Это связано с тем, что алкины более электроотрицательны, чем бром, поэтому они будут оттягивать электроны от молекул брома и предотвращать их взаимодействие с молекулами воды.
В следующих текстах мы рассмотрим два разных типа жидкостей: керосин и растительное масло.
В отличие от керосина, который является насыщенным, растительное масло является ненасыщенным, что означает, что бромная вода не обесцвечивается. В то время как насыщенные углеродные цепи не могут разлагать бромную воду, ненасыщенные углеродные цепи могут в некоторых случаях обесцвечивать ее.
Различие в свойствах связано с количеством атомов углерода в каждой цепи. Цепь с большим количеством атомов углерода более насыщена, что не позволяет ей расщеплять атомы водорода так же легко, как цепь с меньшим количеством атомов углерода. В результате керосин представляет собой масло с высокой вязкостью, а растительное масло — с низкой вязкостью.
В результате керосин представляет собой масло с высокой вязкостью, а растительное масло — с низкой вязкостью.
При смешивании керосина и бромной воды свойства обоих значительно различаются. При смешивании керосина и бромной воды керосин растворяет бромную воду, что приводит к синергетическому эффекту. Когда бромная вода смешивается с растительным маслом, она не растворяется, и две жидкости остаются отдельными. Кулинарное масло содержит более высокую концентрацию атомов углерода, потому что оно ненасыщенное и содержит больше атомов углерода.
Обесцвечивает ли фенол бромную воду
При добавлении бромной воды к фонолу образуется бромированное соединение , которое заменяет фонол. После обесцвечивания бромной воды образуется белый осадок.
Фенолы: почему они реагируют с бромом
Фенолы — это химические вещества, которые можно использовать в различных областях, включая дезинфицирующие средства и промышленные чистящие средства. При контакте с бромом образуется белый осадок с запахом антисептика. Раствор содержит 2,5%-2,4/6-трибромфенола. Реакции фенола с бромом происходят, когда у атома кислорода присутствует одна пара электронов. В результате электронная плотность увеличивается, так как электронная пара частично делокализована в структуру пи-связи. В результате электроны в феноле могут положительно заряжать электрофил, увеличивая вероятность положительного заряда в бромная связь взаимодействует с электроном в феноле. При этом бром реагирует с фенолами, а бензол — нет. В отличие от брома, который реагирует с одним электроном за раз, электроны в бензоле не имеют одиночных электронов.
Раствор содержит 2,5%-2,4/6-трибромфенола. Реакции фенола с бромом происходят, когда у атома кислорода присутствует одна пара электронов. В результате электронная плотность увеличивается, так как электронная пара частично делокализована в структуру пи-связи. В результате электроны в феноле могут положительно заряжать электрофил, увеличивая вероятность положительного заряда в бромная связь взаимодействует с электроном в феноле. При этом бром реагирует с фенолами, а бензол — нет. В отличие от брома, который реагирует с одним электроном за раз, электроны в бензоле не имеют одиночных электронов.
Карбоновые кислоты обесцвечивают бромную воду
Напротив, алкилированные и карбоновые кислоты не обесцвечивают бромную воду.
Почему карбоновые кислоты не реагируют с Br2
В кислых условиях br2 можно использовать для -бромирования некоторых карбонильных соединений, таких как альдегиды и кетоны, но он не будет реагировать с карбоновыми кислотами, сложными эфирами или амидами.


Leave A Comment