Задачи на растворимость | CHEMEGE.RU
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса (или объем для газов) растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Как же решать задачи на растворимость? Я использую два способа. Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
Давайте их рассмотрим на фрагменте задачи из реального ЕГЭ по химии 2019 года, где впервые появились задачи с упоминанием растворимости.
«Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды.»
Первый способ.
Растворимость не показывает реальное количество соли или количество воды. Это всего лишь способ выражения концентрации в насыщенных растворах, величина, которая показывает, как соотносятся масса растворенного вещества и масса воды (или другого растворенного вещества)! Например, в условии задачи растворимость карбоната натрия 31,8 г на 100 г воды означает, что для растворения каждых 31,8 г соли необходимо 100 г воды. Зато из этих данных можно определить массовую долю растворенного вещества. Рассмотрим этот эталонный раствор, в котором содержится 31,8 г соли и 100 г воды. Массовая доля соли в таком растворе составляет:
Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или 24,13%
Но в нашем, реальном растворе, который получается при растворении карбоната натрия в 400 г воды, массовая доля соли такая же!
Зная массу воды и массовую долю соли, мы без труда составим уравнение и определим массу соли в реальном растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Получается, масса нитрата натрия в реальном растворе равна 127,2 г.
Второй способ.
Используя все тот же эталонный раствор, мы можем составить пропорцию, чтобы определить массу соли в реальном растворе.
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Но будьте осторожны! Пропорции можно составить далеко не для всех величин. Но соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и иногда очень удобно. Также пропорциональны масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500 г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9 г соли в 100 г воды?
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36 г соли в 100 г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Рассмотрим несколько примеров решения задач на растворимость из реальных ЕГЭ по химии.
10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю нитрата натрия в конечном растворе во второй колбе.
Первый этап.
Определяем массу карбоната натрия, который растворится в 400 мл воды:
На 100 г воды приходится 31,8 г соли (по условию)
на 400 г воды будет приходиться х г соли (в реальном растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
n(Na2CO3) = m(Na2CO3)/M = 127,2 г/106 г/моль = 1,2 моль
Массовая доля карбоната натрия в этом растворе:
ω(Na2CO3) = m(Na2CO3)/mр-ра = 127,2 г/(127,2 г + 400 г) = 0,2413 или 24,13%
Далее раствор карбоната натрия разделили на две порции. Как решать задачи с порциями (частями)? Очень просто. Во всем исходном растворе и в порциях (частях), которые мы отделили от основного раствора, кое-что не меняется. Давайте порассуждаем, что именно.
Меняется ли масса раствора? Без сомнения, мы же разделяем раствор на части.
Меняется ли масса растворенного вещества? Также без сомнения — часть вещества попадет в одну порцию, часть в другую.
А меняется ли массовая доля растворенного вещества? Или соотношение массы растворенного вещества и воды, или другое соотношение? Конечно, не изменяется, ведь раствор — это гомогенная система, в которой вещество распределено равномерно.
Второй этап.
В первой колбе протекает реакция:
3Na2CO3 + Fe2(SO4)3 + 3H2O = 2Fe(OH)3 + 3CO2 + 3Na2SO4
Это типичный пример реакции необратимого гидролиза.
Во второй колбе протекает реакция:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O
Пусть в первой колбе выделилось х моль углекислого газа. Количество вещества газов соотносится также, как объемы газов. Поэтому можно сказать, что во второй колбе выделится 2х моль углекислого газа.
Получается, что в первой колбе в реакцию вступает х моль карбоната натрия, а во второй колбе 2х моль карбоната натрия. Общее количество вещества карбоната натрия известно, получаем уравнение:
х + 2х = 1,2
Отсюда х = 0,4 моль.
Во второй колбе количество и масса карбоната натрия:
n2(Na2CO3) = 2х = 0,8 моль
m2(Na2CO3) = n2(Na2CO3)·M = 0,8 моль·106 г/моль = 84,8 г
Масса раствора карбоната во второй колбе (массовая доля соли в исходном растворе и в двух колбах не изменяется):
mр-ра,2(Na2CO3) = m2(Na2CO3)/ω = 84,8 г / 0,2413 = 351,47 г
Масса углекислого газа, который выделился во второй реакции:
m2(CO2) = n2(CO2)·M(СО2) = 0,8 моль·44 г/моль = 35,2 г
Масса нитрата натрия во второй колбе:
m2(NaNO3) = n2(NaNO3)·M(NaNO3) = 1,6 моль·85 г/моль = 136 г
Масса конечного раствора во второй колбе:
mр-ра,2 = mр-ра,2(Na2CO3) + mр-ра(HNO3) — m(CO2) = 351,47 г + 300 г — 35,2 г = 616,27 г
Массовая доля нитрата натрия в конечно растворе во второй колбе:
ω2(NaNO3) = m2(NaNO3)/mр-ра,2 = 136 г/616,27 г = 0,2207 или 22,07%
Ответ: ω(NaNO3) = 22,07%
Решение и ответ
Свернуть
11. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
12. Растворимость безводного хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. При этой температуре приготовили 306,8 г насыщенного раствора хлорида алюминия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора карбоната калия. К раствору во второй колбе добавили 300 г раствора аммиака, также взятого в избытке. При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
При этом, масса осадка, выпавшего во второй колбе, оказалась в 3 раза больше массы осадка, выпавшего в первой колбе. Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
13. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели. К раствору во второй колбе добавили 250 г соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе.
14. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества карбоната натрия к 200 мл воды, разделили на две части. К первой части прилили избыток соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Ко второй части насыщенного раствора добавили 222 г 25%-ного раствора хлорида кальция. Определите массовую долю хлорида кальция в полученном растворе.
15. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-ного раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
16. Растворимость безводного сульфата алюминия при некоторой температуре составляет 34,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата алюминия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 15,6 г осадка. К раствору во второй колбе добавили 320 г 25%-ного раствора гидроксида натрия. Определите массовую долю сульфата натрия в конечном растворе во второй колбе.
17. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор карбоната натрия массой 395,4 г разделили на две части. К первой части прилили избыток раствора нитрата кальция. При этом образовалось 50 г осадка. Ко второй части насыщенного раствора добавили 252 г 30%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
18. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида натрия. При этом образовалось 18 г осадка. К раствору во второй колбе добавили 870 г 15%-ного раствора нитрата бария. Определите массовую долю нитрата бария в конечном растворе во второй колбе.
19. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфида натрия к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. К раствору во второй колбе добавили 450 г 15%-ного раствора хлорида меди(II). Определите массовую долю хлорида меди(II) в конечном растворе во второй колбе.
21. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды.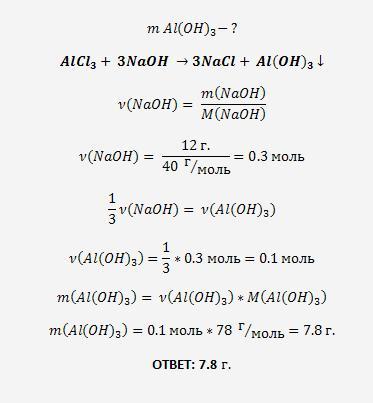 Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
Насыщенный раствор, приготовленный при этой температуре добавлением необходимого количества хлорида кальция к 160 мл воды, разлили на две колбы. В первую колбу добавили избыток раствора карбоната натрия. При этом выпал осадок массой 30 г. Во вторую колбу добавили 595 г 40%-ного раствора нитрата серебра. Определите массовую долю нитрата серебра в растворе, образовавшемся во второй колбе.
22. Растворимость безводного гидрокарбоната натрия при некоторой температуре составляет 12,6 г на 100 г воды. При этой температуре приготовили 450,4 г насыщенного раствора гидрокарбоната натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора гидроксида бария. При этом образовалось 39,4 г осадка. К раствору во второй колбе добавили 245 г 20%-ного раствора серной кислоты. При этом образовалась средняя соль. Определите массовую долю серной кислоты в конечном растворе во второй колбе.
23. Растворимость хлорида алюминия при некоторой температуре составляет 53,4 г на 100 г воды. Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
Приготовленный при этой температуре насыщенный раствор хлорида алюминия массой 767 г разлили по двум колбам. В первую колбу добавили избыток раствора нитрата серебра, при этом выпало 344,4 г осадка. Во вторую колбу добавили 960 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю хлорида натрия в растворе, образовавшемся во второй колбе.
24. Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфата железа(II) к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора аммиака. При этом образовалось 27 г осадка. К раствору во второй колбе добавили 780 г 20%-ного раствора хлорида бария. Определите массовую долю хлорида бария в конечном растворе во второй колбе.
25. Растворимость безводного хлорида кальция при некоторой температуре составляет 55,5 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество хлорида кальция к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 143,5 г осадка. К раствору во второй колбе добавили 1272 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе во второй колбе.
26. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита натрия к 300 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 300 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался равен объёму газа, выделившемуся из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе.
27. Растворимость безводного сульфита натрия при некоторой температуре составляет 25,2 г на 100 г воды. При этой температуре приготовили 250,4 г насыщенного раствора сульфита натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата алюминия. К раствору во второй колбе добавили 200 г разбавленного раствора серной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 3 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю соли в конечном растворе во второй колбе. (Учитывать образование только средних солей).
Понравилось это:
Нравится Загрузка…
21. Задачи Вычисление массовой доли растворенного вещества
1. К раствору силиката калия массой 25,5 г и массовой долей 10% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.

Показать решение »
Решение
1) Составим уравнение реакции:
K2SiO3 + Ca(NO3)2 = CaSiO3↓ + 2KNO3
2) Рассчитаем массу и количество вещества силиката калия, содержащегося в растворе:
m(K2SiO3) = (m(р-ра)∙ω)/100% = (25,5∙10)/100 = 2,55 г.;
n(K2SiO3) = m(K2SiO3)/M(K2SiO3) = 2,55/154 = 0,0166 моль.
3) Определим массу осадка:
по уравнению реакции
n(K2SiO3) = n(CaSiO3) = 0,0166 моль;
m(CaSiO3) = n(CaSiO3)∙M(CaSiO3) = 0,0166∙116 = 1,93 г.
Ответ: 1,93 г.
2. К раствору сульфата алюминия массой 60,8 г и массовой долей 15% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.

Показать решение »
Решение
1) Составим уравнение реакции:
Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
2) Рассчитаем массу и количество вещества сульфата алюминия, содержащегося в растворе:
m(Al2(SO4)3) = (m(р-ра)∙ω)/100% = (60,8∙15)/100 = 9,12 г.;
n(Al2(SO4)3) = m(Al2(SO4)3)/M(Al2(SO4)3) = 9,12/342 = 0,0267 моль.
3) Определим массу осадка:
по уравнению реакции
n(BaSO4) = 3n(Al2(SO4)3) = 3∙0,0267 = 0,08 моль;
m(BaSO4) = n(BaSO4)∙ M(BaSO4) = 0,08∙233 = 18,66 г.
Ответ: 18,66 г.
3. Вычислите объём газа (н. у.), который выделится при действии избытка сульфида железа(II) на 500 г 12%-ного раствора серной кислоты.

Показать решение »
Решение
1) Составим уравнение реакции:
FeS + H2SO4 = FeSO4 + H2S↑
2) Рассчитаем массу и количество вещества серной кислоты, содержащейся в растворе:
m(H2SO4) = (m(р-ра)∙ω)/100% = (500∙12)/100 = 60 г.;
n(H2SO4) = m(H2SO4)/M(H2SO4) = 60/98 = 0,61 моль.
3) Определим объём сероводорода:
по уравнению реакции
n(H2S) = n(H2SO4) = 0,61 моль;
V(H2S) = n(H2S)∙Vm = 0,61∙22,4 = 13,66 л.
Ответ: 13,66 л.
4. Через 60 г раствора с массовой долей гидроксида натрия 11% пропустили сернистый газ. При этом образовался сульфит натрия. Вычислите объём (н. у.) вступившего в реакцию газа.
Показать решение »
Решение
1) Составим уравнение реакции:
2NaOH + SO2↑ = Na2SO3 + H2O
2) Рассчитаем массу и количество вещества гидроксида натрия, содержащегося в растворе:
m(NaOH) = (m(р-ра)∙ω)/100% = (60∙11)/100 = 6,6 г. ;
;
n(NaOH) = m(NaOH)/M(NaOH) = 6,6/40 = 0,165 моль.
3) Определим объём сернистого газа, вступившего в реакцию:
по уравнению реакции
n(SO2) = 0,5∙n(NaOH) = 0,5∙0,165 = 0,0825 моль;
V(SO2) = n(SO2)∙Vm = 0,0825∙22,4 = 1,85 л
Ответ: 1,85 л.
5. Раствор соляной кислоты массой 182,5 г и массовой долей 10% добавили к избытку сульфида магния. Вычислите объём (н. у.) выделившегося газа.
Показать решение »
Решение
1) Составим уравнение реакции:
MgS + 2HCl = MgCl2 + H2S↑
2) Рассчитаем массу и количество вещества соляной кислоты, содержащейся в растворе:
m(HCl) = (m(р-ра)∙ω)/100% = (182.5∙10)/100 = 18,25 г.
n(HCl) = m(HCl)/M(HCl) = 18,25/36,5 = 0,5 моль.
3) Определим объём выделившегося газа:
по уравнению реакции
n(H2S) = 0,5∙n(HCl) = 0,5∙0,5 = 0,25моль;
V(H2S) = n(H2S)∙Vm = 0,25∙22,4 = 5,6 л
Ответ: 5,6 л.
6. После пропускания через раствор гидроксида калия 6,72 л сернистого газа (н. у.) получили 340,5 г раствора сульфита калия. Вычислите массовую долю соли в полученном растворе.
Показать решение »
Решение
1) Составим уравнение реакции:
SO2 + 2KOH = K2SO3 + H2O
2) Рассчитаем массу и количество вещества сульфита калия, полученного в результате реакции:
n(SO2) =V(SO2)/Vm =6,72/22,4 = 0,3 моль
по уравнению реакции
n(K2SO3) = n(SO2) = 0,3 моль;
3) Определим массовую долю сульфита калия в растворе:
m(K2SO3) = n(K2SO3)∙M(K2SO3) = 0,3∙158 = 47,4 г.
ω(K2SO3) = (m(K2SO3)/m(р-ра))∙100% = (47,4/340,5)∙100 = 13,92 %
Ответ: 13,92 %
7.
 При взаимодействии 120 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,5 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.
При взаимодействии 120 г раствора нитрата свинца с небольшим избытком раствора иодида калия выпало 10,5 г осадка. Рассчитайте массовую долю нитрата свинца в исходном растворе.Показать решение »
Решение
1) Составим уравнение реакции:
2KI + Pb(NO3)2 = 2KNO3 + PbI2↓
2) Рассчитаем количество вещества и массу нитрата свинца:
n(PbI2) = m(PbI2)/M(PbI2) = 10,5/461 = 0,023 моль
по уравнению реакции
n(Pb(NO3)2) = n(PbI2) = 0,023 моль;
3) Определим массовую долю нитрата свинца в растворе:
m(Pb(NO3)2) = n(Pb(NO3)2)∙M(Pb(NO3)2) = 0,023∙331 = 7,613 г.
ω(K2SO3) = (m(Pb(NO3)2)/m(р-ра))∙100% = (7,613/120)∙100 = 6,34 %
Ответ: 6,34 %
8.
 При растворении 18,25 г технического цинка в избытке разбавленной соляной кислоты выделилось 5,6 л (н. у.) водорода. Определите массовую долю примесей в этом образце цинка.
При растворении 18,25 г технического цинка в избытке разбавленной соляной кислоты выделилось 5,6 л (н. у.) водорода. Определите массовую долю примесей в этом образце цинка.Показать решение »
Решение
1) Составим уравнение реакции:
Zn + 2HCl = ZnCl2 + H2↑
2) Рассчитаем количество вещества водорода и цинка:
n(H2) =V(H2)/Vm =5,6/22,4 = 0,25 моль
по уравнению реакции
n(Zn) = n(H2) = 0,25 моль;
3) Определим массу чистого цинка и массовую долю примесей:
m(Zn) = n(Zn)∙M(Zn) = 0,25∙65 = 16,25 г.
m(примесей) = m(технич.Zn) — m(Zn) = 18,25 – 16,25 = 2,0 г.
ω(примесей) = (m(примесей)/m(технич.Zn))∙100% = (2,0/18,25)∙100 = 10,96 %
Ответ: 10,96 %.
9. Рассчитайте массу осадка, который выпадет при взаимодействии избытка карбоната калия с 31,4 г раствора нитрата бария с массовой долей последнего 10%.

Показать решение »
Решение
1) Составим уравнение реакции:
K2CO3 + Ba(NO3)2 = BaCO3↓ + 2KNO3
2) Рассчитаем массу и количество вещества нитрата бария в растворе:
m(Ba(NO3)2) = (m(р-ра)∙ω)/100% = (31,4∙10)/100 = 3,14 г.
n(Ba(NO3)2) = m(Ba(NO3)2)/M(Ba(NO3)2) = 3,14/261 = 0,012 моль.
3) Определим массу вещества, выпавшего в осадок:
по уравнению реакции
n(BaCO3) = n(Ba(NO3)2) = 0,012 моль;
m(BaCO3) = n(BaCO3)∙ M(BaCO3) = 0,012∙197 = 2,36 г.
Ответ: 2,36 г.
10. В избытке соляной кислоты растворили 2,11 г. руды, содержащей 71% карбоната железа(II). Определите объём углекислого газа, выделившегося при этом.
Показать решение »
Решение
1) Составим уравнение реакции:
FeCO3 + 2HCl = FeCl2 + H2O + CO2↑
2) Определим массу чистого карбоната железа и его количество вещества:
m(FeCO3) = (m(руды)∙ω)/100% = (2,11∙71)/100 = 1,50 г.
n(FeCO3) = m(FeCO3)/M(FeCO3) = 1,50/116 = 0,013 моль.
3) Рассчитаем количество вещества выделившегося углекислого газа и его объем:
по уравнению реакции
n(CO2) = n(FeCO3) = 0,013 моль;
V(CO2) = n(CO2)∙Vm = 0,013∙22,4 = 0,29 л.
Ответ: 0,29 л
11. При растворении в избытке разбавленной серной кислоты цинка, содержащего 9,5% нерастворимых примесей, выделилось 4,48 л (н. у.) водорода. Определить массу исходного образца металла, содержащего примеси.
Показать решение »
Решение
1) Составим уравнение реакции:
Zn + H2SO4 = ZnSO4 + H2↑
2) Рассчитаем количество вещества водорода и цинка:
n(H2) =V(H2)/Vm =4,48/22,4 = 0,2 моль
по уравнению реакции
n(Zn) = n(H2) = 0,2 моль;
3) Определим массу, массовую долю чистого цинка и массу смеси (исходного образца, содержащего примеси):
m(Zn) = n(Zn)∙ M(Zn) = 0,2∙65 = 13 г.
ω(Zn) = 100 — ω(примесей) = 100-9,5 = 90,5 %
m(смеси) = (m(Zn)∙100)/ω(Zn) = 13∙100/90,5 = 14,36 г.
Ответ: 14,36 г.
12. При обжиге 96 кг пирита (минерала, содержащего FeS
2 ) образовался сернистый газ объёмом 30,69 м3 (в пересчёте на н. у.). Рассчитайте массовую долю негорючих примесей в пирите.Показать решение »
Решение
1) Составим уравнение сгорания пирита:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2) Рассчитаем количество вещества сернистого газа:
n(SO2) = V(SO2)/Vm = 30,69/22,4 = 1,37 кмоль.
3) Определим массу чистого FeS2, массу примесей и их массовую долю в исходном веществе:
Пусть количество вещества пирита приходящегося на 1,37 кмоль сернистого газа составляет x.
Тогда по уравнению реакции составим пропорцию:
х/4 = 1,37/8
n(FeS2) = 0,685 кмоль.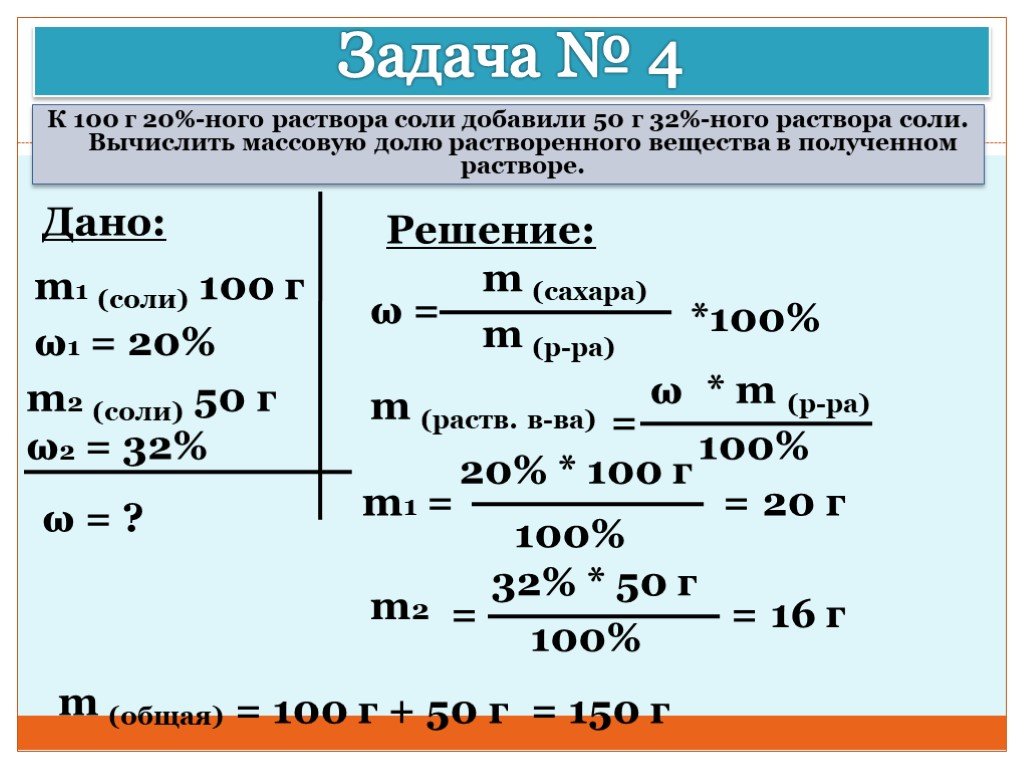
Масса чистого пирита, вступившего в реакцию равна:
m(FeS2) = n(FeS2)∙ M(FeS2) = 0,685∙120 = 82,2 кг.
масса примесей равна:
m(примесей) = 99 – 82,2 = 13,8 кг
Массовая доля примесей:
ω(примесей) = (m(примесей)∙100)/m(пирита) = 13,8∙100/96 = 14,375 %
Ответ: 14,375 %.
13. К 150 г раствора карбоната натрия добавили избыток разбавленной серной кислоты, и раствор нагрели до окончания выделения газа. Всего выделилось 4,48 л газа (н. у.). Рассчитайте массовую долю карбоната натрия в исходном растворе.
Показать решение »
Решение
1) Составим уравнение реакции:
Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
2) Рассчитаем количество вещества и массу карбоната натрия:
n(CO2) = V(CO2)/Vm = 4,48/22,4 = 0,2 моль.
по уравнению реакции
n(Na2CO3) = n(CO2) = 0,2 моль
m(Na2CO3) = n(Na2CO3)∙M(Na2CO3) = 0,2∙106 = 21,2 г.
3) Определим массовую долю карбоната натрия в растворе:
ω(Na2CO3) = (m(Na2CO3)/m(р-ра))∙100% = (21,2/150)∙100 = 14,13 %
Ответ: 14,13 %.
14. К 200 г баритовой воды добавили избыток раствора карбоната натрия, выпал осадок массой 8,9 г. Определите массовую долю гидроксида бария в исходном растворе.
Показать решение »
Решение
1) Составим уравнение реакции:
Ba(OH)2 + Na2CO3 = BaCO3↓ + 2NaOH
2) Рассчитаем количество вещества карбоната бария и гидроксида бария:
n(BaCO3) = m(BaCO3)/M(BaCO3) = 8,9/197 = 0,045 моль.
по уравнению реакции
n(Ba(OH)2) = n(BaCO3) = 0,045 моль
3) Определим массу гидроксида бария и его массовую долю в баритовой воде:
m(Ba(OH)2) = n(Ba(OH)2)∙M(BaCO3) = 0,045∙171 = 7,695 г.
ω(Ba(OH)2) = (m(Ba(OH)2)/m(р-ра))∙100% = (7,695/200)∙100 = 3,85 %
Ответ: 3,85 %.
15. Какой объём воздуха (н. у.) потребуется для полного сжигания 36 кг дисульфида железа(II) FeS
2 до сернистого газа? Объёмная доля кислорода в воздухе составляет 21%.Показать решение »
Решение
1) Составим уравнение реакции:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2) Рассчитаем количества вещества FeS2 и кислорода:
n(FeS2) = m(FeS2)/M(FeS2) = 36000/120 = 300 моль.
Для определения количества вещества кислорода составим пропорцию по уравнению реакции:
300/4 = n(O2)/11
n(O2) = 825 кмоль.
3) Рассчитаем объёмы кислорода и воздуха:
V(O2) = n(O2)∙Vm = 825∙22,4 = 18480 л = 18,48 м3
V(воздуха) = V(O2)∙100/ω(O2) = 18,48∙100/21 = 88 м3
Ответ: 88 м3.
16. К раствору с массовой долей гидроксида натрия 15% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 24,5 г. Определите массу исходного раствора щелочи.
Показать решение »
Решение
1) Составим уравнение реакции:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2) Рассчитаем количество вещества выпавшего в осадок гидроксида меди (II):
n(Cu(OH)2) = m(Cu(OH)2)/M(Cu(OH)2) = 24,5/98 = 0,25 моль.
3) Определим количество вещества, массу гидроксида натрия, массу исходного раствора:
по уравнению реакции
n(NaOH) = 2n(Cu(OH)2) = 2∙0,25 = 0,5 моль
m(NaOH) = n(NaOH)∙M(NaOH) = 0,5∙40 = 20 г.
m(р-ра) = m(NaOH)∙100%/ω(NaOH) = 20∙100/15 = 133,33 г.
Ответ: 133,33 г.
17. Оксид меди(II) массой 38 г может прореагировать с 154 г раствора соляной кислоты.
 Определите массовую долю кислоты в растворе.
Определите массовую долю кислоты в растворе.Показать решение »
Решение
1) Составим уравнение реакции:
СuO + 2HCl = CuCl2 + H2O
2) Рассчитаем количество вещества оксида меди (II):
n(СuO) = m(СuO)/M(СuO) = 38/80 = 0,475 моль.
3) Определим количество вещества, массу соляной кислоты и её массовую долю в растворе:
n(HCl) = 2n(CuO) = 2∙0,475 = 0,95 моль
m(HCl) = n(HC)∙M(HC) = 0,95∙36,5 = 34,675 г.
ω(HCl) = (m(HCl)/m(р-ра))∙100% = (34,675/154)∙100 = 22,52 %
Ответ: 22,52 %.
18. При взаимодействии 19,6 г гидроксида меди(II) с соляной кислотой получили 134 г раствора хлорида меди(II). Вычислите массовую долю соли в полученном растворе.
Показать решение »
Решение
1) Составим уравнение реакции:
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
2) Рассчитаем количество вещества прореагировавшего гидроксида меди (II):
n(Сu(OH)2) = m(Сu(OH)2)/M(Сu(OH)2) = 19,6/98 = 0,2 моль.
3) Определим количество вещества, массу образовавшегося хлорида меди (II) и его массовую долю в получившемся растворе:
n(CuCl2) = n(Сu(OH)2) = 0,2 моль
m(CuCl2) = n(CuCl2)∙M(CuCl2) = 0,2∙135 = 27 г.
ω(CuCl2) = (m(CuCl2)/m(р-ра))∙100% = (27/134)∙100 = 20,15 %
Ответ: 20,15%.
19. Через 126 г раствора с массовой долей азотной кислоты 30% был пропущен аммиак, который полностью прореагировал. Определите объём (н.у.) аммиака, вступившего в реакцию.
Показать решение »
Решение
1) Составим уравнение реакции:
HNO3 + NH3 = NH4NO3
2) Рассчитаем массу и количество вещества прореагировавшей азотной кислоты:
m(HNO3) = (ω(HNO3)∙m(р-ра))/100% = (30∙126)/100 = 37,8 г
n(HNO3) = m(HNO3)/M(HNO3) = 37,8/63 = 0,6 моль.
3) Определим количество вещества и объём вступившего в реакцию аммиака:
n(NH3) = n(HNO3) = 0,6 моль
V(NH3) = n(NH3)∙Vm = 0,6 · 22,4 = 13,44 л.
Ответ: 13,44 л.
20. Определите объемную долю аммиака в его газовой смеси с воздухом, если известно, что на нейтрализацию 150 л (н.у.) этой смеси было израсходовано 2,913 л 4,9 %-ного раствора серной кислоты плотностью 1,03 г/мл (продукт реакции – средняя соль).
Показать решение »
Решение
1) Составим уравнение реакции:
2NH3 + H2SO4 = (NH4)2SO4
2) Рассчитаем массу и количество вещества серной кислоты:
ρ = m/V
V(H2SO4) = 2,913 л = 2913 мл
m(р-ра) = ρ(H2SO4)∙V(H2SO4) = 1,03∙2913 = 3000 г.
m(H2SO4) = (m(р-ра))∙ω(H2SO4)/100% = 3000∙4,9/100 = 147 г.
n(H2SO4) = m(H2SO4)/M(H2SO4) = 147/98 = 1,5 моль.
3) Определим количество вещества и объёмную долю аммиака:
По уравнению реакции:
n(NH3) = 2n(H2SO4) = 2∙1,5 = 3 моль
V(NH3) = n(NH3)∙Vm = 3 · 22,4 = 67,2 л.
φ(NH3) = V(NH3)/V(смеси) = 67,2/150 = 0,448 = 44,8 %
Ответ: 44,8 %
21. Какой объем газа (при н.у.) выделится при взаимодействии избытка меди со 100мл 9,54 %-ного раствора азотной кислоты (ρ=1,057 г/мл)
Показать решение »
Решение
1) Составим уравнение реакции:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
2) Рассчитаем массу и количество вещества азотной кислоты:
ρ = m/V
m(р-ра) = ρ(HNO3)∙V(HNO3) = 1,057∙100 = 105,7 г.
m(HNO3) = (m(р-ра))∙ω(HNO3)/100% = 105,7∙9,54/100 = 10,08 г.
n(HNO3) = m(HNO3)/M(HNO3) = 10,8/63 = 0,16 моль.
3) Определим количество вещества и объём выделившегося газа:
Составим пропорцию:
n(NO)/2 = n(HNO3)/8
n(NO) = 0,16∙2/8 = 0,04 моль
V(NO) = n(HNO3)∙Vm = 0,04 · 22,4 = 0,896 л.
Ответ: 0,896 л
22. Какой объем сероводорода (при н.у.) образуется при взаимодействии 880 г технического сульфида железа(II), содержащего 10% примесей, с раствором, содержащим 10 моль соляной кислоты
Показать решение »
Решение
1) Составим уравнение реакции:
FeS + 2HCl = FeCl2 + H2S↑
2) Рассчитаем массу и количество вещества FeS:
ω(FeS) = 100 — ω(примесей) = 100-10 = 90%
m(FeS) = (m(р-ра))∙ω(FeS)/100% = 880∙90/100 = 792 г.
n(FeS) = m(FeS)/M(FeS) = 792/88 = 9 моль.
3) Определим объём выделившегося газа:
По уравнению реакции:
n(H2S) = n(FeS) = 2n(HCl)
FeS находится в избытке, HCl прореагирует полностью и образуется 5 моль H2S
V(H2S) = n(H2S)∙Vm = 5 · 22,4 = 112 л.
Ответ: 112 л.
23. На мрамор, содержащий 5% примесей, подействовали избытком 10%-ного раствора азотной кислоты , при этом выделилось 5,6 л (при н.у.) газа. Определите массу использованного минерала
Показать решение »
Решение
1) Составим уравнение реакции:
СaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
2) Рассчитаем количество вещества CO2:
n(CO2) = V(CO2)/Vm = 5,6/22,4 = 0,25 моль.
3) Определим массу минерала:
По уравнению реакции:
n(СaCO3) = n(CO2) = 0,25 моль
m(СaCO3) = n(СaCO3)∙M(СaCO3) = 0,25∙100 = 25 г.
ω(СaCO3) = 100 — ω(примесей) = 100-5 = 95%
m(минерала) = m(СaCO3)∙100%/ω(СaCO3) = 25∙100/95 = 26,3 г.
Ответ: 26,3 г
24. Какой объем 60%-ного раствора азотной кислоты плотностью 1,305 г/мл можно получить, используя азотсодержащий продукт каталитического окисления 896 л (при н.
 у.) аммиака?
у.) аммиака?Показать решение »
Решение
1) Составим уравнения реакций:
4NH3 + 5O2 = 4NO↑ + 6H2O
2NO + O2 = 2NO2↑
4NO2 +O2 + H2O = 4HNO3
В процессе не образуется азотсодержащих побочных продуктов, т.е. все атомы азота, входившие в NH3, переходят в HNO3. Поэтому можно составить схему для расчета:
NH3… → HNO3
2) Рассчитаем количество вещества аммиака:
n(NH3) = V(NH3)/Vm = 896/22,4 = 40 моль
3) Рассчитаем массу раствора HNO3:
По схеме расчета:
n(HNO3) = n(NH3) = 40 моль
m(HNO3) = n(HNO3)∙M(HNO3) = 40∙63 = 2520 г.
m(р-ра) = m(HNO3)∙100%/(ω(HNO3) = 2520∙60/100 = 4200 г.
4) Рассчитаем объем раствора HNO3:
V = m/ρ
V(HNO3) = m(р-ра)/ρ(HNO3)∙ = 4200/1,305 = 3218,4 мл = 3,22 л.
Ответ: 3,22 л
25. Техническую кальцинированную соду, содержащий 5% примесей, обработали избытком соляной кислоты. При этом выделилось 2 моль углекислого газа. Определите массу технической соды, вступившей в реакцию с кислотой
Показать решение »
Решение
1) Составим уравнение реакции:
Na2CO3 + 2HCl = NaCl + CO2↑ + H2O
2) Рассчитаем массу чистого Na2CO3:
По уравнению реакции:
n(Na2CO3) = n(CO2) = 2 моль
m(Na2CO3) = n(Na2CO3)∙M(Na2CO3) = 2∙106 = 212 г.
3) Определим массу технической соды:
ω(Na2CO3) = 100 — ω(примесей) = 100-5 = 95%
m(минерала) = m(Na2CO3)∙100%/ω(Na2CO3) = 212∙100/95 = 223,16 г.
Ответ: 223,16 г
Практика
Практика Прогнозирование реакций
Практические задачи
Некоторые из этих практических задач взяты с замечательного сайта The Chem Team. Посетите The Chem Team Site , чтобы найти множество других практических задач, руководств и ресурсов. |
Используйте соответствующие ионные и молекулярные формулы, чтобы показать реагенты и продукты для следующего, каждый из которых встречается в водном растворе, за исключением указанного. Опустите формулы для любых ионных или молекулярных частиц, которые не участвуют в реакции. Вам не нужно балансировать. Во всех случаях возникает реакция.
Перейти к ответам.
Вернуться на страницу прогнозирования реакции.
Варианты реакции по годам:
| 1985 | 1986 | 1987 | 1988 | 1989 | 1990 |
| 1991 | 1992 | 1993 | 1994 | 1995 | 1996 |
| 1997 | 1998 |
1985
(а) Металлический натрий добавляют в воду.
(b) Разбавленную серную кислоту добавляют к раствору гидрокарбоната лития.
(c) Этанол и муравьиная кислота (метановая кислота) смешивают и нагревают.
(d) К осадку гидроксида цинка добавляют избыток концентрированного раствора гидроксида калия.
(e) Газы трифторид бора и аммиак смешиваются.
(f) К раствору сульфата железа(III) добавляют раствор хлорида олова(II).
(g) Окситрихлорид фосфора(V) добавляют в воду.
(h) Подкисленный раствор перманганата натрия добавляют к раствору натрия сульфит.
1986
(a) Кусок металлического лития брошен в сосуд с газообразным азотом.
(b) К раствору сульфита калия добавляют разбавленную соляную кислоту.
(c) К воде добавляют твердый оксид натрия.
(d) К раствору нитрата цинка добавляют раствор сульфида натрия.
(e) К разбавленному раствору уксусной кислоты добавляют раствор аммиака.
(f) В раствор сульфата железа (III) добавляют кусок железа.
(g) Газообразный этилен (этилен) барботируют через раствор брома.
(з) Газообразный хлор пропускают через раствор йодида калия.
1987
(а) Твердый кальций добавляют в теплую воду.
(b) Порошкообразный оксид магния добавляют в контейнер с углекислым газом.
(c) Газообразный сероводород барботируют через раствор никеля (II) нитрат.
(d) К твердому алюминию добавляют избыток концентрированного раствора гидроксида натрия. гидроксид.
(e) Твердое серебро добавляют к разбавленному раствору азотной кислоты (6M).
(f) Избыток раствора гидроксида калия добавляют к раствору калия дигидрофосфат.
г) К раствору сульфата железа(II) добавляют раствор перекиси водорода.
h) Пропанол полностью сгорает на воздухе.
1988
(а) К подкисленному раствору калия добавляют раствор йодида калия. дихромат.
дихромат.
(b) К раствору хлорида аммония добавляют раствор гидроксида натрия.
(c) В раствор азотнокислого серебра добавляют полоску магния.
(d) Твердый хлорат калия нагревают в присутствии диоксида марганца. в качестве катализатора.
(e) К раствору карбоната калия добавляют разбавленную соляную кислоту.
(f) Газообразный триоксид серы добавляется к избытку воды.
(ж) К раствору хлорида бария добавляют разбавленную серную кислоту.
(з) К раствору хлорида меди(II) добавляют концентрированный раствор аммиака.
1989
(а) Смешивают растворы сульфата цинка и фосфата натрия.
(b) Растворы нитрата серебра и бромида лития смешиваются.
(c) Поток газообразного хлора пропускают через раствор холодного разбавленного натрия. гидроксид.
(d) К раствору сульфита калия добавляют избыток раствора соляной кислоты.
(e) К подкисленному раствору перманганата калия добавляют раствор хлорида олова(II).
(е) К раствору хлорида железа (III) добавляют раствор роданида аммония.
(g) Образцы газообразного трихлорида бора и газообразного аммиака смешиваются.
(з) Пары сероуглерода сгорают в избытке кислорода.
1990
(а) Растворы йодида натрия и нитрата свинца смешивают.
(b) К раствору хлорида железа добавляют раствор аммиака.
(в) Раствор перекиси водорода нагревают.
(d) Смешивают растворы нитрата серебра и хромата натрия.
(e) Газообразный сероводород пропускают через раствор гидроксида калия.
(f) К воде добавляют твердый пятиокись азота.
(з) Полоску металлической меди добавляют в концентрированный раствор серной кислоты.
1991
(а) Твердый оксид алюминия добавляют к раствору гидроксида натрия.
(b) Твердый оксид кальция нагревают в присутствии газообразного триоксида серы.
(c) Равные объемы 0,1-молярной серной кислоты и 0,1-молярного гидроксида калия смешанный.
(d) Металлический кальций сильно нагревается в азоте.
(e) Твердый сульфид меди (II) сильно нагревается в газообразном кислороде.
(f) К порошкообразному диоксиду марганца добавляют концентрированный раствор соляной кислоты и осторожно нагревают.
(ж) К раствору йодида цинка добавляют концентрированный раствор аммиака.
(з) К раствору гидроксида бария добавляют раствор сульфата меди(II).
1992
(а) К раствору нитрата магния добавляют избыток раствора гидроксида натрия.
(b) К воде добавляют твердый гидрид лития.
(c) Растворы аммиака и плавиковой кислоты смешивают.
(d) Кусок металлического алюминия добавляют в раствор азотнокислого серебра.
(e) Электролиз раствора йодида калия.
(f) К воде добавляют твердый оксид калия.

(з) Газообразный диоксид углерода пропускают через воду, содержащую суспензию карбоната кальция.
1993
(а) Медную полоску погружают в разбавленную азотную кислоту.
(b) Раствор перманганата калия добавляют к кислому раствору перекиси водорода.
(c) К кислому раствору перекиси водорода добавляют концентрированную соляную кислоту.
(d) Избыток хлора проходит через горячие железные опилки.
(e) К образцу твердого нитрида магния добавляют воду.
(f) Избыток газообразного диоксида серы пропускают через разбавленный раствор гидроксида калия.
(ж) К суспензии хлорида серебра добавляют избыток концентрированного раствора аммиака.
(з) Смешивают растворы трикалийфосфата и нитрата цинка.
1994
(а) К раствору азотнокислого серебра добавляют избыток раствора цианида натрия.
(б) Смешивают растворы сульфата марганца(II) и сульфида аммония.
(c) Порошок оксида фосфора(V) посыпают дистиллированной водой.
(d) Твердый карбонат аммония нагревают.
(e) Газообразный диоксид углерода пропускают через концентрированный раствор гидроксида калия.
(f) К твердому перманганату калия добавляют концентрированный раствор соляной кислоты.
(g) В дистиллированную воду добавляют небольшой кусочек металлического натрия.
(з) К подкисленному раствору хлорида железа(II) добавляют раствор дихромата калия.
1995
(а) Этанол сгорает в кислороде.
(b) Твердый оксид бария добавляют к дистиллированной воде.
(c) Газообразный хлор пропускают через холодный разбавленный раствор гидроксида калия.
(d) Раствор нитрата железа (II) подвергается воздействию воздуха в течение длительного периода времени.
(e) К твердому фосфату кальция добавляют избыток концентрированной серной кислоты.
(f) Газообразный сероводород барботируется в раствор хлорида ртути (II).
(g) К дистиллированной воде добавляют твердый гидрид кальция.
(h) Брусок металлического цинка погружают в раствор сульфата меди(II).
1996
(а) Твердый карбонат кальция сильно нагрет.
(b) Кусок металлического никеля погружен в раствор сульфата меди(II).
(c) Смешивают равные объемы эквимолярных растворов динатрия гидрофосфата и соляной кислоты.
(d) Газообразный хлор пропускают через раствор бромида натрия.
(e) Газообразный аммиак пропускают через раствор этановой (уксусной) кислоты.
(f) Твердый карбонат аммония добавляют к насыщенному раствору гидроксида бария.
(g) Капли жидкого трехокиси азота добавляют к дистиллированной воде.
(з) Смешивают растворы перманганата калия и оксалата натрия.
1997
(а) К раствору нитрата алюминия добавляют избыток раствора гидроксида калия.
(b) К подкисленному раствору бромата калия добавляют раствор бромида натрия.
(c) Газообразный диоксид серы пропускают через дистиллированную воду.
(d) Газообразный фосфин (тригидрид фосфора) барботируется в жидкий трихлорид бора.
(e) Газообразный водород пропускают через горячий порошок оксида железа (II).
(f) К дистиллированной воде добавляют твердый амид калия.
(g) Полоску металлического магния сильно нагревают в чистом газообразном азоте.
(h) К раствору сульфида натрия добавляют раствор хлорида никеля.
1998
(а) Смешивают растворы хлорида олова(II) и хлорида железа(III).
(б) Растворы нитрата кобальта(II) и гидроксида натрия смешивают.
(c) Газообразный этилен сгорает на воздухе.
(d) Смешивают равные объемы эквимолярных растворов фосфорной кислоты и гидроксида калия.
(e) Твердый сульфит кальция нагревают в вакууме.
(f) К раствору нитрата диамминсеребра(I) добавляют избыток соляной кислоты.
(g) К дистиллированной воде добавляют твердый оксид натрия.
(з) Полоску цинка добавляют к раствору 6,0-молярной бромистоводородной кислоты.
Международный энологический кодекс | ОИВ
Скачать документ
- Предисловие
- Вперед
Índice estático
Part I — Monographs
Monographs
Alginic acid
Anti-foaming agents
Lactic acid
Malic acid
Rectified alcohol of сельскохозяйственного происхождения
Rectified alcohol of viti-vinicultural origin
Ammonium chloride
Ammonium hydrogen sulfite
Diammonium hydrogen phosphate
Ammonium sulfate
Silver (chloride)
Argon
Аскорбиновая кислота
Азот
Молочнокислые бактерии
Бентониты
Beta-glucanase
Pieces of oak wood
Wood for wine containers
Calcium carbonate
Potassium carbonate
Calcium phytate
Calcium tartrate
Сульфат кальция
Карамель
Казеины
Целлюлоза
Микрокристаллическая целлюлоза
Carbon (oenological)
Chitin-glucan
Chitosan
Citric acid, monohydrate
Carboxymethylcellulose (cellulose gum, CMC)
Fish glue
Copper сульфат, пентагидрат
Цитрат меди
Диатомит
Диметилдикарбонат
Диоксид углерода
Colloidal silicon dioxide solution
D,L-tartaric acid
Yeast protein extracts
Selective plant fibres
Gelatine
Glutathione
Gum arabic
Каолин
Обезжиренное молоко
Saccharomyces SPP.


Leave A Comment