1-хлорбутан, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ICSC 0703 — 1-ХЛОРБУТАН
ICSC 0703 — 1-ХЛОРБУТАН« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| 1-ХЛОРБУТАН | ICSC: 0703 (Май 2018) |
| CAS #: 109-69-3 |
| UN #: 1127 |
| EINECS #: 203-696-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Очень легко воспламеняется.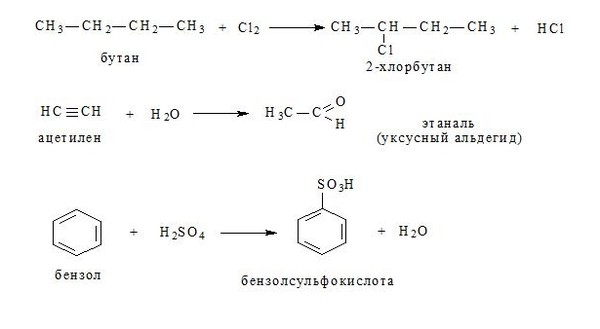 При пожаре выделяет раздражающие или токсичные пары (или газы). Смеси паров с воздухом взрывоопасны. При пожаре выделяет раздражающие или токсичные пары (или газы). Смеси паров с воздухом взрывоопасны. |
НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, вентиляция, взрывозащищенное электрическое оборудование и освещение. Предотвращать образование электростатического заряда (например, используя заземление). НЕ использовать сжатый воздух для загрузки, выгрузки или обработки. | Использовать порошок, пену, двуокись углерода. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЯ ТУМАНА! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Сонливость. | Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. |
Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. Сухость кожи. | Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза | Покраснение. | Использовать защитные очки или средства защиты глаз в комбинации со средствами защиты органов дыхания.. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | См. вдыхание. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить оставшуюся жидкость при помощи песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. НЕ сливать в канализацию. НЕ допускать попадания этого химического вещества в окружающую среду. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Удалить оставшуюся жидкость при помощи песка или инертного абсорбента. Затем хранить и утилизировать в соответствии с местными правилами. НЕ сливать в канализацию. НЕ допускать попадания этого химического вещества в окружающую среду. |
Согласно критериям СГС ООН ОПАСНО Легковоспламеняющаяся жидкость и парВызывает раздражение кожи и глаз Может вызвать раздражение дыхательных путей Транспортировка |
| ХРАНЕНИЕ | |
Обеспечить огнестойкость. Отдельно от несовместимых метераилов. Хорошо закрывать. Хранить в хорошо проветриваемом помещении. Хранить в местах не имеющих сливов или доступа к канализации См. химические опасности. химические опасности. |
|
| УПАКОВКА | |
| Загрязняет морскую среду. |
| 1-ХЛОРБУТАН | ICSC: 0703 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C4H9Cl / CH3(CH2)3Cl |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| MAK: 12 mg/m3, 3 ppm; категория ограничения пикового воздействия: II(2) |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Бионакопление этого химического вещества может происходить по пищевой цепочке.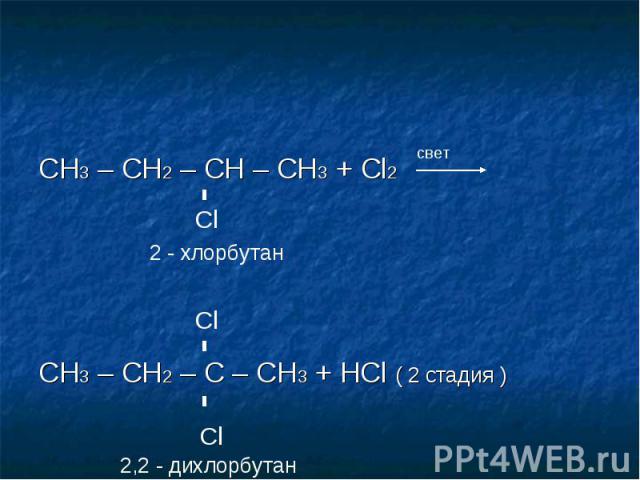 |
| ПРИМЕЧАНИЯ |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Назовите продукты, которые образуются, и классифицируйте реакцию?
Химия Органическая химия
Майкл М.
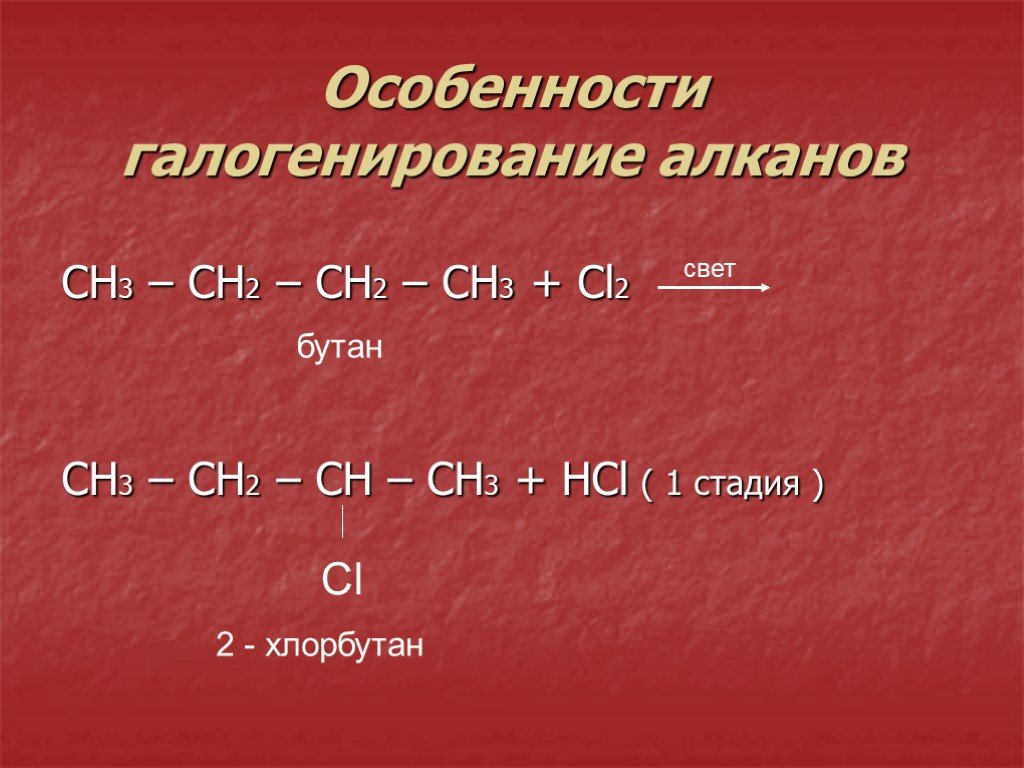
спросил 10.05.191-хлорбутан реагирует + раствор гидроксида натрия →
тип реакции: (присоединение, замещение, отщепление?)
Подписаться І 1
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Ишвар С. ответил 12.05.19
ответил 12.05.19
Репетитор
5 (7)
Профессор университета — Общая и органическая химия
См. таких репетиторов
Смотрите таких репетиторов
Эта реакция замена реакция, а не устранение.
1-Хлорбутан является «беспрепятственным» первичным (1°) алкилгалогенидом, а ион гидроксида (OH —) из гидроксида натрия является сильным нуклеофилом. В этой реакции гидроксид заменит группу хлора с образованием 1-бутанола в качестве единственного продукта. Реакция может быть записана как:
CH 3 CH 2 CH 2 CH 2 –Cl + NaOH → CH 3 CH 2 CH 2 CH 2 –OH + NaCl
Для того, чтобы произошло элиминирование, алкилгалогенид должен быть стерически затруднен, то есть он должен быть либо третичным (3°), либо вторичным (2°). Однако для 2° алкилгалогенидов реакции замещения также могут протекать как конкурирующие реакции, дающие смесь продуктов (отщепление и замещение).
Однако для 2° алкилгалогенидов реакции замещения также могут протекать как конкурирующие реакции, дающие смесь продуктов (отщепление и замещение).
Голосовать за 0 голос против
Подробнее
Отчет
Джесси Э. ответил 10.05.19
Репетитор
4.6 (8)
Опытный репетитор по биохимии
Смотрите таких репетиторов
Смотрите таких репетиторов
Если 1-хлорбутан находится в растворе гидроксида натрия, гидроксид агрессивно депротонирует 1-хлорбутан при элиминировании E2. Это, в свою очередь, приведет к удалению группы хлора и образованию двойной связи. Следовательно, продуктом будет бут-1-ен.
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Lab 5 — Реакции SN2 алкилгалогенидов
Цель
Изучить факторы, влияющие на относительную скорость реакции SN2 алкилгалогенидов, такие как:
•
алкилгалогенидная структура•
характер уходящей группы•
свойства нуклеофила•
стерическое препятствие
Введение
Алкилгалогениды играют важную роль в органическом синтезе. Их можно легко получить из спиртов или алкенов, среди других исходных материалов. Они в свою очередь могут быть использованы в синтезе большого количества функциональных групп. Эти синтезы часто осуществляют с помощью реакций нуклеофильного замещения, в которых галогенид замещается каким-либо нуклеофилом.
Их можно легко получить из спиртов или алкенов, среди других исходных материалов. Они в свою очередь могут быть использованы в синтезе большого количества функциональных групп. Эти синтезы часто осуществляют с помощью реакций нуклеофильного замещения, в которых галогенид замещается каким-либо нуклеофилом.
Эти реакции замещения могут протекать в одну плавную стадию или в две дискретные стадии, в основном в зависимости от структуры алкильной группы. Эти механизмы известны как S N 2 и S N 1. В этом лабораторном периоде мы уделим некоторое время изучению реакций S N 2 .
Для начала предложим механизм реакции:
( 1 )
CH 3 Br + HO − → CH 3 OH + Br −
•
Скорость этой реакции прямо пропорциональна концентрации бромистого метила и гидроксида натрия.
( 2 )
Скорость = k[CH 3 Br][OH − ]
•
Реакция протекает с инверсией конфигурации- Есть идеи?
Этот механизм был первоначально объяснен сэром Кристофером Ингольдом и Эдвардом Хьюзом в 1930 с. Они интерпретировали кинетическое поведение второго порядка как означающее, что стадия, определяющая скорость, представляет собой бимолекулярный согласованный процесс.
Они интерпретировали кинетическое поведение второго порядка как означающее, что стадия, определяющая скорость, представляет собой бимолекулярный согласованный процесс.
( 3 )
| δ − | δ − | ||||||
| HO − + CH 3 Br → | HO | −−CH 3 −− | Br | → CH 3 OH + Br − | |||
| |||||||
Поэтому был предложен следующий механизм — обратная атака нуклеофила с уходом уходящей группы в согласованном шаге. Эта задняя атака вызывает инверсию стереохимии (известную как инверсия Уолдена).
Предварительная лаборатория
1
Получите данные о реагентах для всех указанных материалов (структура, формула, молекулярная масса, точка плавления, точка кипения, плотность и применимые опасности). Организуйте эту информацию в таблице.
Организуйте эту информацию в таблице.2
Дайте краткий план экспериментальной процедуры.3
Ответьте на следующие вопросы.
Вопросы
Вопрос 1: Каков механизм реакции R-2-хлорбутана с NaI в ацетоне? Предсказать стереохимию продукта.
Вопрос 2: Предскажите результат каждой серии экспериментов. Обоснуйте свои прогнозы.
Вопрос 3: Чем отличаются механизмы S N 1 и S N 2. Могут ли алкилгалогениды вступать в реакции S N 1, а также S N 2? Почему?
Процедура
Утилизация отходов
Реакционные смеси из этого эксперимента следует собирать в маркированный контейнер для отходов. Не бросайте их в канализацию. Если у вас есть какие-либо вопросы относительно надлежащих процедур утилизации отходов, обратитесь к своему ассистенту.
Часть 1: Влияние структуры алкилгалогенида на относительные скорости S
N 2 реакцииОтмерьте 2 мл 15% йодида натрия в ацетоне в каждую из трех чистых, сухих 10-сантиметровых пробирок. В первую пробирку добавить 2 капли 1-бромбутана (бутилбромида); во вторую пробирку добавить 2 капли 2-бромбутана (втор-бутилбромида); и добавьте 2 капли 2-метил-2-бромпропана (трет-бутилбромида) в третью пробирку. Закройте пробирки пробками. (Не используйте резиновые пробки.) Встряхните пробирки, чтобы перемешать. Внимательно наблюдайте в течение первых 15–20 минут, а затем с интервалами в течение лабораторного периода. Ищите любые признаки облачности или осадков. Запишите свои наблюдения и время, когда наблюдалось начальное помутнение для каждой реакции.
Часть 2. Стерические эффекты и относительные скорости S
N 2 реакции Отмерьте по 1 мл 15% йодида натрия в ацетоне в каждую из двух чистых, сухих 10-сантиметровых пробирок.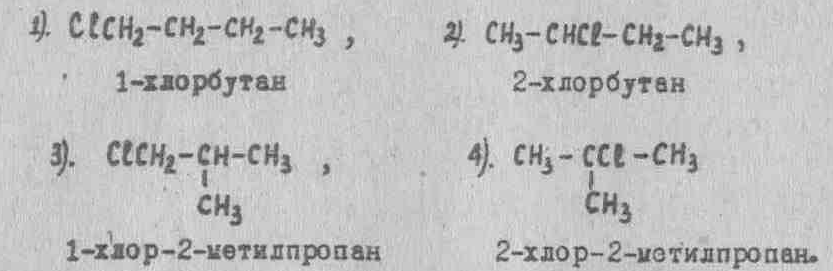 В одну пробирку добавьте 2 капли 1-бромбутана; в другую пробирку добавить 2 капли 1-бром-2,2-диметилпропана (неопентилбромида). Закройте пробирки и встряхните. Внимательно наблюдайте. Запишите свои наблюдения.
В одну пробирку добавьте 2 капли 1-бромбутана; в другую пробирку добавить 2 капли 1-бром-2,2-диметилпропана (неопентилбромида). Закройте пробирки и встряхните. Внимательно наблюдайте. Запишите свои наблюдения.
Часть 3: Влияние уходящей группы на относительные скорости реакций SN2
Отмерьте по 1 мл 15% йодида натрия в ацетоне в каждую из двух чистых сухих 10-сантиметровых пробирок. В одну пробирку добавьте 2 капли 1-бромбутана, в другую – 2 капли 1-хлорбутана. Закройте пробкой и встряхните пробирки. Внимательно наблюдайте. Запишите свои наблюдения.
Лабораторные вопросы
Загрузите и распечатайте следующий рабочий лист. Вы будете использовать этот рабочий лист для записи ответов на лабораторные вопросы.
Вопросы
Вопрос 1: Какой бромистый алкил быстрее всего реагирует с иодидом натрия в ацетоне: 1-бромбутан, 2-бромбутан или 2-бром-2-метилпропан? Какой алкилбромид реагировал медленнее всего? Объясните, как структура алкилгалогенида влияет на скорость реакции S N 2 .

 Приводит к появлению отравления. Интенсивно Реагирует с окислителями и порошкообразными металлами. Приводит к появлению опасности пожара и взрыва. Медленно Реагирует с водой. При этом выделяется соляную кислоту. Разъедает алюминий и многие пластики.
Приводит к появлению отравления. Интенсивно Реагирует с окислителями и порошкообразными металлами. Приводит к появлению опасности пожара и взрыва. Медленно Реагирует с водой. При этом выделяется соляную кислоту. Разъедает алюминий и многие пластики.
 82
82  Организуйте эту информацию в таблице.
Организуйте эту информацию в таблице.
Leave A Comment