или
$2NaCl{→}↖{\text»электролиз»}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$).
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$. {-}+O_2↑+2H_2O$
{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text»электролиз»}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Хром | ЕГЭ по химии
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Электронная конфигурация
Периодический закон
Степень окисления и валентность
Химическая связь
Строение вещества
Классификация неорганических веществ
Типы химических реакций
Оксиды
Основания
Кислоты
Амфотерные гидроксиды
Электролитическая диссоциация. Реакции ионного обмена
Соли
Гидролиз
Электролиз
Окислительно-восстановительные реакции
Химическая промышленность, правила безопасности, посуда и оборудование
Щелочные и щелочноземельные металлы
Алюминий. Цинк
Железо
Медь. Серебро
Хром
Химические свойства металлов
Водород, галогены
Халькогены
Азот, фосфор
Углерод, кремний
Химические свойства неметаллов
Химические свойства неорганических веществ
Взаимосвязь неорганических веществ
Качественные реакции на неорганические вещества и ионы
Массовая доля
Скорость реакции
Химическое равновесие
Тепловой эффект реакции
Объемные отношения газов
Расчеты по уравнению реакции
Классификация органических веществ
Номенклатура органических веществ
Гомология
Изомерия
Гибридизация
Алканы
Алкены, алкадиены
Алкины
Свойства углеводородов
Спирты
Фенолы
Альдегиды и кетоны
Карбоновые кислоты
Эфиры – простые и сложные
Свойства кислородсодержащих органических соединений
Амины
Аминокислоты.
Реакции ионного обмена
Соли
Гидролиз
Электролиз
Окислительно-восстановительные реакции
Химическая промышленность, правила безопасности, посуда и оборудование
Щелочные и щелочноземельные металлы
Алюминий. Цинк
Железо
Медь. Серебро
Хром
Химические свойства металлов
Водород, галогены
Халькогены
Азот, фосфор
Углерод, кремний
Химические свойства неметаллов
Химические свойства неорганических веществ
Взаимосвязь неорганических веществ
Качественные реакции на неорганические вещества и ионы
Массовая доля
Скорость реакции
Химическое равновесие
Тепловой эффект реакции
Объемные отношения газов
Расчеты по уравнению реакции
Классификация органических веществ
Номенклатура органических веществ
Гомология
Изомерия
Гибридизация
Алканы
Алкены, алкадиены
Алкины
Свойства углеводородов
Спирты
Фенолы
Альдегиды и кетоны
Карбоновые кислоты
Эфиры – простые и сложные
Свойства кислородсодержащих органических соединений
Амины
Аминокислоты.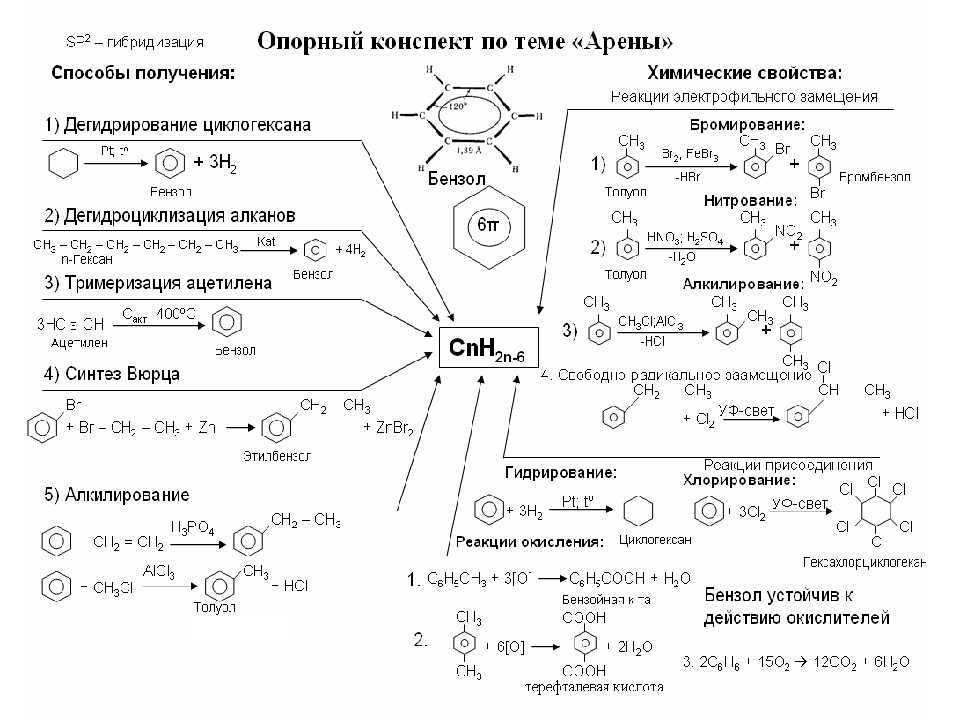
При добавлении раствора щелочи к такому раствору образуется осадок $Me(OH)_2$, который быстро окисляется кислородом воздуха:
$4Cr(OH)_2+O_2+2H_2O=4Cr(OH)_3$.
Ему соответствует амфотерный оксид $Cr_2O_3$. Оксид и гидроксид хрома (в высшей степени окисления) проявляют свойства кислотных оксидов и кислот соответственно. Соли хромовой кислоты
Составим твой персональный план подготовки к ЕГЭ
AP Химия – Студенты AP
Не студент?
Посетите AP Central, чтобы получить ресурсы для учителей, администраторов и координаторов.
AP Химия
Перейти к моей точке доступа
О курсе
Узнайте об основных понятиях химии, включая структуру и состояние вещества, межмолекулярные силы и реакции. Вы будете проводить практические лабораторные исследования и использовать химические расчеты для решения проблем.
Примечание: Сохраняйте лабораторные журналы и отчеты; колледжи могут попросить вас увидеть их, прежде чем предоставить вам кредит.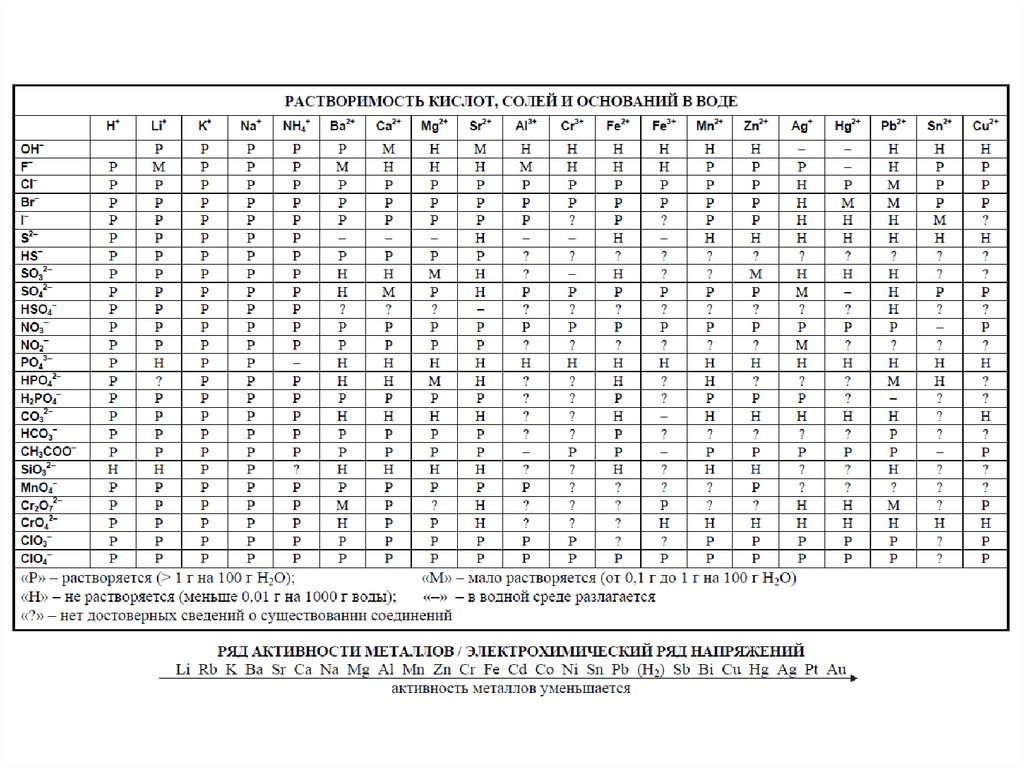
Навыки, которым вы научитесь
Эквивалентность и предварительные условия
Эквивалент курса колледжа
Годовой вводный курс общей химии в колледже
Рекомендуемые предварительные требования
Курсы химии и алгебры для старших классов средней школы 8 Экзамен 105 II 90 90 Дата
О модулях
Содержание курса, описанное ниже, организовано в виде общеизучаемых учебных модулей, которые предоставить одну возможную последовательность для курса. Ваш преподаватель может решить организовать курс контента по-разному в зависимости от местных приоритетов и предпочтений.
Содержание курса
Блок 1: Атомная структура и свойства
Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.
Темы могут включать:
- Моль и молярная масса
- Масс-спектроскопия элементов
- Элементный состав чистых веществ
- Состав смесей
- Атомная структура и электронная конфигурация
- Фотоэлектронная спектроскопия
- Периодические тренды
- Валентные электроны и ионные соединения
7–9% от экзаменационного балла
Модуль 2: Молекулярная и ионная структура и свойства соединений
Вы узнаете о множестве химических связей и о том, как их структура может влиять на свойства создаваемых молекул.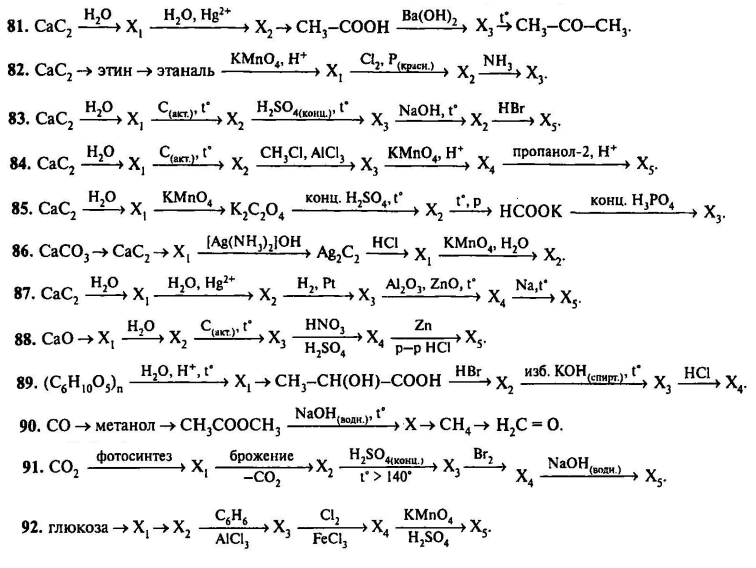
Темы могут включать:
- Типы химической связи
- Внутримолекулярная сила и потенциальная энергия
- Структура ионных твердых тел
- Структура металлов и сплавов
- Диаграммы Льюиса
- Резонанс и официальное обвинение
- ВСЕПР и гибридизация связи
7–9% от экзаменационного балла
Блок 3: Межмолекулярные силы и свойства
Вы узнаете, как атомы собираются вместе, чтобы создавать твердые тела, жидкости и газы, и как субатомные силы управляют свойствами всего вокруг вас.
Темы могут включать:
- Межмолекулярные силы
- Твердые вещества, жидкости и газы
- Кинетическая молекулярная теория
- Растворы и смеси
- Фотоэлектрический эффект
18–22% от экзаменационного балла
Раздел 4: Химические реакции
Вы научитесь различать физические и химические процессы, а также измерять и выражать химические реакции с помощью химических уравнений.
Темы могут включать:
- Введение для реакций
- Сводные ионные уравнения
- Представления реакций
- Физические и химические изменения
- Стехиометрия
- Типы химических реакций
7–9% от экзаменационного балла
Раздел 5: Кинетика
Вы изучите различные методы наблюдения за изменениями, происходящими во время химической реакции, и последствиями ряда реакций.
Темы могут включать:
- Скорость реакции
- Введение в закон о тарифах
- Элементарные реакции
- Модель столкновения
- Введение в механизмы реакции
- Энергетический профиль многоступенчатой реакции
- Катализ
7–9% от экзаменационного балла
Раздел 6: Термодинамика
Вы узнаете об изменениях энергии в химических реакциях и о том, как передача энергии может изменить физические свойства вещества.
Темы могут включать:
- Эндотермические и экзотермические процессы
- Теплопередача и тепловое равновесие
- Теплоемкость и калориметрия
- Энергия фазовых переходов
- Введение в энтальпию реакции
- Энтальпия образования
- Закон Гесса
7–9% от экзаменационного балла
Раздел 7: Равновесие
Вы наметите, как химические реакции меняются с течением времени, что заставляет вещества достигать равновесия и как системы реагируют, когда это равновесие нарушается.
Темы могут включать:
- Введение в равновесие
- Расчет константы равновесия
- Расчет равновесных концентраций
- Введение в принцип Ле Шателье
- Введение в равновесие растворимости
- рН и растворимость
- Свободная энергия растворения
7–9% от экзаменационного балла
Раздел 8: Кислоты и основания
Вы узнаете больше о рН, качествах и свойствах кислот и оснований, а также о том, как они взаимодействуют в химических реакциях.
Темы могут включать:
- Введение в кислоты и основания
- pH и pOH сильных кислот и оснований
- Кислотно-основные реакции и буферы
- Молекулярная структура кислот и оснований
- рН и рК и
- Свойства буферов
11%–15% от экзаменационного балла
Модуль 9: Приложения термодинамики
Вы познакомитесь с концепцией «термодинамической благоприятности» реакций, что означает вероятность их возникновения с учетом изменений энергии и факторов окружающей среды.
Темы могут включать:
- Введение в энтропию
- Свободная энергия Гиббса и термодинамическая благоприятность
- Термодинамический и кинетический контроль
- Свободная энергия и равновесие
- Гальванические (гальванические) и электролитические элементы
- Электролиз и закон Фарадея
7–9% от экзаменационного балла
Химия – CLEP | College Board
Экзамен по химии охватывает материал, который обычно преподается на годичных курсах общей химии в колледже. Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Требуется понимание структуры и состояний вещества, типов реакций, уравнений и стехиометрии, равновесия, кинетики, термодинамики, описательной и экспериментальной химии, а также способность интерпретировать и применять этот материал к новым и незнакомым проблемам. Во время этого экзамена функция научного онлайн-калькулятора и таблица Менделеева доступны как часть программного обеспечения для тестирования.
Научный калькулятор
Научный (неграфический) калькулятор TI-30XS MultiView™ интегрирован в экзаменационное программное обеспечение и доступен учащимся в течение всего времени тестирования.
Чтобы использовать калькулятор во время экзамена, учащиеся должны выбрать значок Calculator . Информация о том, как использовать калькулятор, доступна на значке Справка на вкладке Калькулятор . Ожидается, что учащиеся будут знать, как и когда правильно использовать калькулятор.
Посетите ETS, чтобы узнать больше и попрактиковаться в использовании научного калькулятора. Онлайновый инженерный калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Онлайновый инженерный калькулятор поможет учащимся выполнять вычисления (например, арифметические, экспоненты, корни и логарифмы).
Периодическая таблица
Чтобы использовать Периодическую таблицу элементов во время экзамена, выберите значок Справка в меню в верхней части экрана, а затем выберите вкладку Периодическая таблица .
Экзамен содержит примерно 75 вопросов, на которые нужно ответить в 90 минут. Некоторые из них являются предварительными вопросами, которые не будут оцениваться.
Вопросы на экзамене по химии требуют от кандидатов демонстрации одной или нескольких из следующих способностей:
- Вспомнить: запомнить определенные факты; продемонстрировать простое знание информации и знакомство с терминологией
- Применение: понимать концепции и переформулировать информацию в другие эквивалентные термины; применять знания в незнакомых и/или практических ситуациях; использовать математику для решения задач по химии
- Интерпретация: делайте выводы и выводы на основе имеющихся данных и объединяйте информацию для формирования выводов; признавать невысказанные предположения
Предмет экзамена по химии состоит из следующих тем. Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Проценты рядом с основными темами указывают приблизительный процент экзаменационных вопросов по этой теме.
Структура материи (20%)
Атомная теория и строение атома
- Доказательства атомной теории
- Атомные массы; определение химическими и физическими средствами
- Атомный номер и массовое число; изотопы и масс-спектроскопия
- Энергетические уровни электронов: атомные спектры и атомные орбитали
- Периодические зависимости, включая, например, атомные радиусы, энергии ионизации, сродство к электрону и степени окисления
- Ядерная химия: ядерные уравнения, периоды полураспада и радиоактивность; химическое применение
Химическая связь
- Связующие силы
- Типы: ковалентная, ионная, металлическая, макромолекулярная (или сетчатая), дисперсионная и водородная связь
- Отношения к структуре и свойствам
- Полярность связей и электроотрицательность
- Теория VSEPR и электронно-точечные диаграммы Льюиса
- Гибридизация орбиталей
- Геометрия молекул, ионов и координационных комплексов
- Структурная изомерия
- Резонанс
- Сигма- и пи-облигации
- Дипольные моменты молекул
- Связь свойств со структурой
Состояния вещества (19%)
Газы
- Законы идеальных газов; уравнения состояния идеального газа
- Концепция крота; Номер Авогадро
- Кинетико-молекулярная теория
- Интерпретация законов идеальных газов на основе этой теории
- Зависимость кинетической энергии молекул от температуры: распределение Больцмана
- Отклонения от законов идеальных газов
Жидкости и твердые тела
- Жидкости и твердые тела с кинетической молекулярной точки зрения
- Фазовые диаграммы однокомпонентных систем
- Изменения состояния и критические явления
Растворы
- Типы растворов и факторы, влияющие на растворимость
- Методы выражения концентрации
- Коллигативные свойства; например, закон Рауля
- Влияние межионного притяжения на коллигативные свойства и растворимость
Типы реакций (12%)
Кислотно-основные реакции; концепции Аррениуса, Бренстеда-Лоури и Льюиса; амфотеризм
Реакции с участием координационных комплексов
Реакции осаждения
Окислительно-восстановительные реакции
- Число окисления
- Роль электрона в окислительно-восстановительных процессах
- Электрохимия; электролитические ячейки, стандартные потенциалы полуячейки, предсказание направления окислительно-восстановительных реакций и влияние изменения концентрации
Уравнения и стехиометрия (10%)
Ионные и молекулярные частицы, присутствующие в химических системах; чисто-ионные уравнения
Стехиометрия: соотношение массы и объема с упором на понятие молей
Балансировка уравнений, в том числе для окислительно-восстановительных реакций
Равновесие (7%)
Концепция динамического равновесия физических и химических веществ; принцип ЛеШателье; константы равновесия
Количественная обработка
- Константы равновесия для газовых реакций с точки зрения как молярных концентраций, так и парциального давления (K c , K p )
- Константы равновесия для реакций в растворах
- Константы для кислот и оснований; рК; рН
- Константы произведения растворимости и их применение для осаждения и растворения малорастворимых соединений
- Константы для комплексных ионов
- Общий ионный эффект; буферы
Кинетика (4%)
Понятие скорости реакции
- Порядок реакции и константа скорости
- Определение порядка реакции и константы скорости по экспериментальным данным
- Влияние изменения температуры на скорость
Энергия активации и роль катализаторов
Связь между скоростью определяющей стадии и механизмом реакции
Термодинамика (5%)
Государственные функции
Первый закон:
- Теплота образования
- Теплота реакции, изменение энтальпии и закон Гесса
- Теплоемкость; теплоты парообразования и плавления
Второй закон:
- Свободная энергия образования
- Свободная энергия реакции
- Зависимость изменения свободной энергии от изменения энтальпии и энтропии
Связь изменения свободной энергии с константами равновесия и электродными потенциалами
Описательная химия (14%)
Накопление некоторых конкретных химических фактов необходимо для того, чтобы учащиеся:
- понимали развитие принципов и понятий
- продемонстрировать применение принципов
- связать факты с теорией и свойства со структурой
- развивать понимание систематической номенклатуры, которая облегчает общение
В экзамен обычно включаются следующие разделы:
- Химическая активность и продукты химических реакций
- Отношения в периодической таблице: по горизонтали, вертикали и диагонали
- Химия основных групп и переходных элементов, включая типичные примеры каждой
- Органическая химия, включая такие темы, как функциональные группы и изомерия (может рассматриваться как отдельная единица или как пример материала в других областях, таких как связывание)
Экспериментальная химия (9%)
Некоторые вопросы основаны на лабораторных экспериментах, широко проводимых в области общей химии, и касаются используемого оборудования, проведенных наблюдений, выполненных расчетов и интерпретации результатов. Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Вопросы предназначены для обеспечения понимания основных инструментов химии и их применения к простым химическим системам.
Рекомендации АСЕ по химии
| Оценка предоставления кредита | 50 |
| Семестровые часы | 6 |
Примечание: Каждое учреждение оставляет за собой право устанавливать свою собственную политику предоставления кредитов, которая может отличаться от политики Американского совета по образованию (ACE). Свяжитесь с вашим колледжем, чтобы узнать количество баллов, необходимых для получения кредита, и количество предоставляемых кредитных часов.
Руководство по сдаче экзамена по химии CLEP
Экзамен по химии охватывает материал, который обычно преподается на годовом курсе общей химии.
- 10,00 $
Кредитные рекомендации ACE
Рекомендации по выдаче кредитов от Американского совета по образованию.

Leave A Comment