Алгоритм решения задачи 35 (С5). Подготовка к ЕГЭ по химии. Задача №35
В настоящее время на Едином госэкзамене по химии во второй (более сложной) части предлагается шесть заданий. Первые четыре не связаны с количественными расчетами, последние два — это достаточно стандартные задачи.
Этот урок целиком посвящен разбору задачи №35 (С5). Кстати, ее полное решение оценивается в три балла (из 60).
Начнем с несложного примера.
Пример 1. 10,5 г некоторого алкена способны присоединить 40 г брома. Определите неизвестный алкен.
Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2) = m/M = 40/160 = 0,25 моль.
Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(C
Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль).
Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение:
12n + 2n = 42.
Решением этого уравнения является n = 3. Формула алкена: C3H6.
Ответ: C3H6.
Приведенная задача — типичный пример задания №35. 90% реальных примеров на ЕГЭ строятся по аналогичной схеме: есть некоторое органическое соединение X, известен класс, к которому оно относится; определенная масса X способна прореагировать с известной массой реагента Y. Другой вариант: известна масса Y и масса продукта реакции Z.
Алгоритм решения подобных заданий также достаточно очевиден.
- 1) Определяем общую формулу гомологического ряда, к которому относится соединение Х.
- 2) Записываем реакцию исследуемого вещества Х с реагентом Y.
- 3) По массе Y (или конечного вещества Z) находим его количество.
- 4) По количеству Y или Z делаем вывод о количестве Х.
- 5) Зная массу Х и его кол-во, рассчитываем молярную массу исследуемого вещества.
- 6) По молярной массе X и общей формуле гомологического ряда можно определить молекулярную формулу Х.
- 7) Осталось записать ответ.
Рассмотрим этот алгоритм подробнее, по пунктам.
1. Общая формула гомологического ряда
Наиболее часто используемые формулы сведены в таблицу:
| Гомологический ряд | Общая формула |
| Алканы | CnH2n+2 |
| Алкены | CnH2n |
| Алкины | CnH2n-2 |
| Диены | CnH2n-2 |
| Арены | CnH2n-6 |
| Предельные одноатомные спирты | CnH2n+1ОН |
| Предельные альдегиды | CnH2n+1СОН |
| Предельные монокарбоновые кислоты | CnH2n+1СОOН |
Кстати, нет необходимости механически запоминать формулы всевозможных гомологических рядов.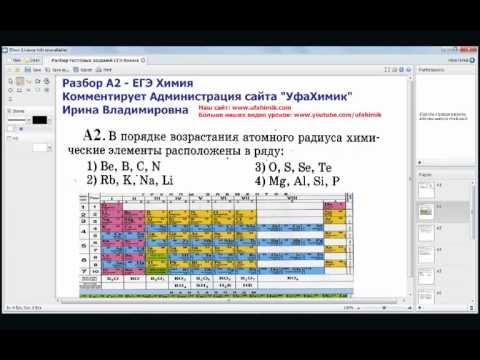 Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
2. Уравнение реакции
Нет надежды, что мне удастся перечислить ВСЕ реакции, которые могут встретиться в задаче 35. Напомню лишь наиболее важные:
1) ВСЕ органические вещества горят в кислороде с образованием углекислого газа, воды, азота (если в соединении присутствует N) и HCl (если есть хлор):
CnHmOqNxCly + O2 = CO2 + H2O + N2 + HCl (без коэффициентов!)
2) Алкены, алкины, диены склонны к реакциям присоединения (р-ции с галогенами, водородом, галогенводородами, водой):
CnH2n + Cl2 = CnH2nCl2
CnH2n + H2 = CnH2n+2
CnH2n + HBr = CnH2n+1Br
CnH2n + H2O = CnH2n+1OH
Алкины и диены, в отличие от алкенов, присоединяют до 2 моль водорода, хлора или галогенводорода на 1 моль углеводорода:
CnH2n-2 + 2Cl2 = CnH2n-2Cl4
CnH2n-2 + 2H2 = CnH2n+2
При присоединении воды к алкинам образуются карбонильные соединения, а не спирты!
3) Для спиртов характерны реакции дегидратации (внутримолекулярной и межмолекулярной), окисления (до карбонильных соединений и, возможно, далее до карбоновых кислот). Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
CnH2n+1OH = CnH2n + H2O
2CnH2n+1OH = CnH2n+1OCnH2n+1 + H2O
2CnH2n+1OH + 2Na = 2CnH2n+1ONa + H2
4) Химические свойства альдегидов весьма разнообразны, однако здесь мы вспомним лишь об окислительно — восстановительных реакциях:
CnH2n+1COH + H2 = CnH2n+1CH2OH (восстановление карбонильных соединений в прис. Ni),
CnH2n+1COH + [O] = CnH2n+1COOH
Для последней реакции записана лишь схема, поскольку в качестве окислителей могут выступать разные соединения.
Обращаю внимание на весьма важный момент: окисление формальдегида (НСОН) не останавливается на стадии муравьиной кислоты, НСООН окисляется далее до СО2 и Н2О.
5) Карбоновые кислоты проявляют все свойства «обычных» неорганических кислот: взаимодействуют с основаниями и основными оксидами, реагируют с активными металлами и солями слабых кислот (напр., с карбонатами и гидрокарбонатами). Весьма важной является реакция этерификации — образование сложных эфиров при взаимодействии со спиртами.
CnH2n+1COOH + KOH = CnH2n+1COOK + H2O
2CnH2n+1COOH + CaO = (CnH2n+1COO)2Ca + H2O
2CnH2n+1COOH + Mg = (CnH2n+1COO)2Mg + H2
CnH2n+1COOH + NaHCO3 = CnH2n+1COONa + H2O + CO2
CnH2n+1COOH + C2H5OH = CnH2n+1COOC2H5 + H2O
Ну, кажется, пора остановиться — я же не собирался писать учебник по органической химии. В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
3. Нахождение количества вещества по его массе (объему)
Здесь все очень просто! Любому школьнику знакома формула, связывающая массу вещества (m), его количество (n) и молярную массу (M):
m = n*M или n = m/M.
Например, 710 г хлора (Cl2) соответствует 710/71 = 10 моль этого вещества, поскольку молярная масса хлора = 71 г/моль.
Для газообразных веществ удобнее работать с объемами, а не с массами. Напомню, что количество вещества и его объем связаны следующей формулой: V = Vm*n, где Vm — молярный объем газа (22,4 л/моль при нормальных условиях).
4. Расчеты по уравнениям реакций
Это, наверное, главный тип расчетов в химии. Если вы не чувствуете уверенности при решении подобных задач, необходимо тренироваться.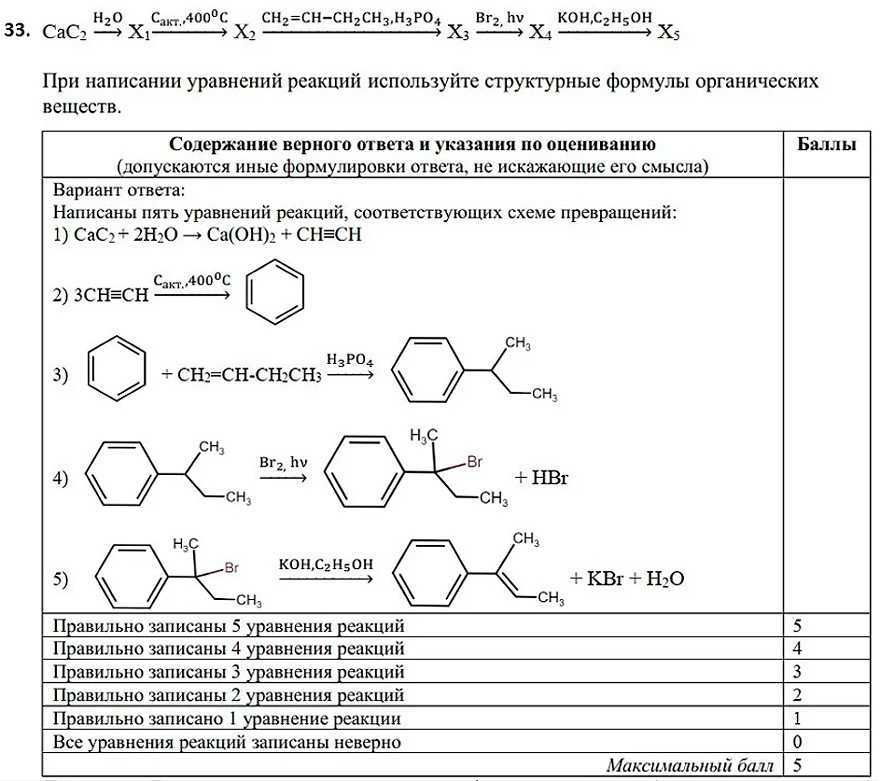
Основная идея заключается в следующем: количества реагирующих веществ и образующихся продуктов относятся так же, как соответствующие коэффициенты в уравнении реакции (вот почему так важно правильно их расставить!)
Рассмотрим, например, следующую реакцию: А + 3B = 2C + 5D. Уравнение показывает, что 1 моль А и 3 моль B при взаимодействии образуют 2 моль C и 5 моль D. Количество В в три раза превосходит количество вещества А, количество D — в 2,5 раза больше количества С и т. д. Если в реакцию вступит не 1 моль А, а, скажем, 10, то и количества всех остальных участников реакции увеличатся ровно в 10 раз: 30 моль В, 20 моль С, 50 моль D. Если нам известно, что образовалось 15 моль D (в три раза больше, чем указано в уравнении), то и количества всех остальных соединений будут в 3 раза больше.
5. Вычисление молярной массы исследуемого вещества
Масса Х обычно дается в условии задачи, количество Х мы нашли в п. 4. Осталось еще раз использовать формулу М = m/n.
6.
 Определение молекулярной формулы Х.
Определение молекулярной формулы Х.Финальный этап. Зная молярную массу Х и общую формулу соответствующего гомологического ряда, можно найти молекулярную формулу неизвестного вещества.
Пусть, например, относительная молекулярная масса предельного одноатомного спирта равна 46. Общая формула гомологического ряда: CnH2n+1ОН. Относительная молекулярная масса складывается из массы n атомов углерода, 2n+2 атомов водорода и одного атома кислорода. Получаем уравнение: 12n + 2n + 2 + 16 = 46. Решая уравнение, получаем, что n = 2. Молекулярная формула спирта: C2H5ОН.
Задача решена. Не забудьте записать ответ!
Конечно, не все задачи С 5 полностью соответствуют приведенной схеме. Никто не может дать гарантии, что на реальном ЕГЭ по химии вам попадется что-либо, дословно повторяющее приведенные примеры. Возможны незначительные вариации и даже сильные изменения. Все это, однако, не слишком важно! Не следует механически запоминать приведенный алгоритм, важно понять СМЫСЛ всех пунктов. Если будет понимание смысла, никакие изменения вам не страшны!
Если будет понимание смысла, никакие изменения вам не страшны!
В следующей части мы рассмотрим несколько типичных примеров.
Решение задачи С5 (35) на экзамене по химии. Часть II. →
Как решать 33 задание ЕГЭ по химии, примеры и алгоритмы решения
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи. Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
| Дано: | Анализ и решение: |
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».
При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».
Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, h3O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).
Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.
2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:
Пусть прореагировало x моль Cu(NO3)2, тогда
г)
3) По уравнению (1) находим количество прореагировавшего HNO3:
г)
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а)
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а)
в) находим количество вещества HNO3 в отобранной порции:
а)
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).
б) По уравнению (3).
в)
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток).
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Дано: | Анализ и решение: |
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».
2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»
3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»
4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой.
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество Nh5NO3.
Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.
В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество Nh5NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(Nh5NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.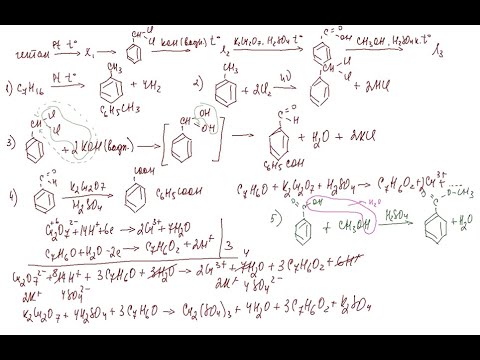
а) находим количество Al(NO3)3·12h3O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,
б)
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):
в) по уравнению (3):
г)
3) По уравнению (3) находим количество Nh5NO3:
а)
4) По уравнению (3) находим количество образовавшегося Al(OH)3:
5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
6) Находим массовую долю Nh5NO3 в растворе:
а)
б)
- Как эффективно подготовиться к ЕГЭ по химии?
- Обзорная лекция по функциональной грамотности
- Бесплатные тренировочные варианты ЕГЭ по химии
- Обмен методическими знаниями
Вернуться
Поделиться
Химия 31 Количественный анализ
Химия 31 Количественный анализ
Весна 2012
Преподаватель: Брэд Бейкер
Офис: Sequoia Room 530
Телефон: 278 7409
Электронная почта: bbaker@csus. edu
edu
Часы работы: понедельник с 12:00 до 13:30, вторник 11:00. до 12:30 в Sequoia 530
и по предварительной записи
Время проведения лекций: понедельник и среда с 11:00 до 11:50
Место проведения лекции: Sequoia 456
Время проведения лабораторных собраний:
Раздел 2: Понедельник и по средам с 8:00 до 10:30
Раздел 3: понедельник и по средам с 13:30 до 16:00
Раздел 4: вторник и четвергам с 8:00 до 10:30
Раздел 5: вторник и по четвергам с 13:00 до 15:30
Расположение лаборатории: Sequoia 446
Промежуточный экзамен 1: 29 февраля, ключ ответа
Промежуточный экзамен 2: 18 апреля, ключ ответа
Заключительный экзамен: ключ ответа 16 мая
Ссылки на классы вам понадобится программа Adobe Reader для открытия PDF-файлов. Скачать Acrobat Reader можно по этой ссылке. Вам также понадобится Microsoft PowerPoint и
Word установлен на вашем компьютере для просмотра некоторых файлов. Пожалуйста, дайте мне знать, если у вас есть проблема
просмотр любого из размещенных файлов.
Пожалуйста, дайте мне знать, если у вас есть проблема
просмотр любого из размещенных файлов.
Учебный план
Рекомендуемое чтение и практические задания
Лабораторный график
Информация об исследовании водопроводной воды и данные
Официальный отчет лаборатории водопроводной воды До 30 апреля
Руководство по составлению официального лабораторного отчета этого не было написано специально для этого лабораторного отчета, но содержит много советов по формальным оформление научных результатов.
Лекции
1. 23.01.12 | 12. 05.03.12 | 23. 23.04.12 |
2. 25.01.12 Викторина 1 | 13. 07.03.12 Викторина 6 | 24. |
3. 30.01.12 | 14. 12.03.12 | 25. 30.04.12 |
4. 01.02.12 Викторина 2 | 15. 14.03.12 Викторина 7 | 26. 02.05.12 Викторина 12 |
5. 06.02.12 Ответы на задачи | 16. 26.03.12 | 27. 07.05.12 |
6. 08.02.12 Викторина 3 | 17. 28.03.12 Викторина 8 | 28. 09.05.12 нет занятий, ставить лаборатории в |
7. 13.02.12 Ответы на задачи | 18. | почта моего кабинета химии коробка или |
8. 15.02.12 Викторина 4 Ответы на задачи | 19. 4/4/12 Викторина 9 | под дверью моего кабинета. Ничего не будет |
9. 20.02.12 | 20. 09.04.12 | принимаются после 16:00. |
10. 22.02.12 Викторина 5 Задача ответы | 21. 11.04.12 Викторина 10 |
|
11. 27.02.12 | 22. 16.04.12 |
|
Образцы экзаменов
Осень 2008 Промежуточный экзамен 1 Весна 2009 г. Midterm 1 Fall 2010 Midterm 1 Spring 2011 Midterm 1
Midterm 1 Fall 2010 Midterm 1 Spring 2011 Midterm 1
Fall 2008 Midterm 2 Spring 2009 Midterm 2 Fall 2010 Midterm 2 Spring 2011 Midterm 2
Fall 2008 Final Exam Spring 2009 Final Exam Fall 2010 Final Exam Spring 2011 Final Экзамен
Образцы экзаменационных ключей
Осень 2008 Среднесрочная 1 Весна 2009 Среднесрочная 1 Осень 2010 Среднесрочная 1 Весна 2011 Среднесрочная 1
Осень 2008 Среднесрочная 2 Весна 2009 Среднесрочная 2 Осень 2010 Среднесрочная 2 Весна 2011 Среднесрочная перспектива 2
Выпускной экзамен, осень 2008 г. Весна 2009 г. Выпускной экзамен, осень 2010 г. Выпускной экзамен, весна 2011 г. Выпускной экзамен
Другие ссылки
Веб-калькулятор квадратных уравнений 900 05
Веб-страница учебника
Последнее обновление 2 мая , 2012
упрощение математики с помощью многомерного анализа
Джон Чанг
17 ноября 2021 г.
Экзамен AP по химии до краев заполнен вычислениями. Вы будете регулярно нажимать клавиши умножения и деления на своем калькуляторе, выясняя, сколько осадка образуется при смешивании двух растворов разной концентрации. В разделе множественного выбора вам даже придется работать вручную. Упорядочить и упорядочить всю информацию может быть непросто.
Правый этап Cue: анализ размеров.
Что такое размерный анализ?По сути, размерный анализ — это метод, который позволяет сжать множество направлений работы в значительно меньшее количество шагов. Ключевым моментом здесь является использование коэффициентов преобразования: коэффициентов, которые связывают две идеи. Эти коэффициенты преобразования часто представляются как «ЭТО то же самое, что и ТО», но это не совсем так. Вместо этого подумайте об этом как об отношении между двумя переменными, в духе «Для каждого X количества ЭТОГО я связываю его с Y количеством ЭТОГО».
При правильной настройке коэффициента пересчета у вас есть величина, которая «действует» как число 1. Умножение нескольких коэффициентов пересчета подряд аналогично умножению на 1 несколько раз подряд. Это не меняет ваших первоначальных отношений.
Умножение нескольких коэффициентов пересчета подряд аналогично умножению на 1 несколько раз подряд. Это не меняет ваших первоначальных отношений.
Запутались? Давайте выйдем из страны абстрактной математики и посмотрим на пример, чтобы увидеть, как применять анализ измерений на практике.
Как это работает?У вас есть пекарня во Франции, которая продает круассаны дюжинами. На деньги (в евро, €), которые вы зарабатываете на продаже круассанов, вы предпочитаете покупать гёдза в Японии (в иенах, ¥), которые покупаются упаковками по 25 штук. Вам также предоставляется следующая информация:
1 дюжина круассанов = 15,99 евро
1 упаковка гёдза из 25 штук = 1250 иен
1 евро = 1,16 доллара США en конверсия, вы заставляете свою команду по выпечке работать и производите 1000 дюжин круассанов. Сколько упаковок по 25 пельменей вы могли бы купить?
Да, вы можете составить четыре разных уравнения и получить правильный ответ. Вы можете вычислить, сколько евро вы зарабатываете на продаже круассанов, конвертировать это в доллары, конвертировать в иены, а затем вычислить, сколько упаковок гёдза вы можете купить. Но создание четырех отдельных уравнений может привести к некоторой неорганизованности работы над вашей статьей. Вы можете подобрать неверный фрагмент информации или умножить, когда хотите разделить.
Вы можете вычислить, сколько евро вы зарабатываете на продаже круассанов, конвертировать это в доллары, конвертировать в иены, а затем вычислить, сколько упаковок гёдза вы можете купить. Но создание четырех отдельных уравнений может привести к некоторой неорганизованности работы над вашей статьей. Вы можете подобрать неверный фрагмент информации или умножить, когда хотите разделить.
С помощью многомерного анализа вы можете очистить свою работу и получить гораздо более четкое представление о том, что происходит. Здесь в игру вступают наши коэффициенты преобразования.
Начните с первоначальной суммы, которую вы заработали: 1000 дюжин круассанов. Ваш первый коэффициент пересчета говорит о том, что 1 дюжина круассанов будет продана за 15,99 евро. Вы можете умножить свои 1000 дюжин круассанов на 15,99 евро за 1 дюжину круассанов. Единица «дюжина круассанов», связанная с 1000, уравновешивается единицей «дюжина круассанов» в знаменателе вашего коэффициента преобразования. Кроме того, вы умножаете на что-то, что действует как 1, так что вы не меняете никаких величин. При этом вы конвертируете свои круассаны в наличные деньги (в евро). Таким же образом вы продолжаете настраивать другие коэффициенты пересчета, получая что-то вроде этого:
При этом вы конвертируете свои круассаны в наличные деньги (в евро). Таким же образом вы продолжаете настраивать другие коэффициенты пересчета, получая что-то вроде этого:
Если вы используете метод, в котором вы составляете несколько отдельных уравнений, вы вполне можете получить тот же ответ 1673,8 25 упаковок пельменей. Однако использование размерного анализа четко маркирует все ваши единицы и то, как они уравновешиваются друг с другом, пока вы не останетесь с той единицей, которую действительно хотите (упаковка пельменей из 25 штук). Вы значительно снижаете вероятность ошибочного принятия умножения за деление или вставки неправильного вычисления в следующий шаг.
Вот еще один пример.Чтобы увидеть, как размерный анализ работает в задаче по химии, давайте перейдем от хлебобулочных изделий к автомобилям.
Двигатель вашего автомобиля использует топливо с октановым числом (C8h28) и сжигает его. Вы не знаете, сколько октана вы израсходовали во время последней поездки, но вы заметили, что в итоге произвели 100 граммов воды. Сколько граммов CO2 вы произвели?
Сколько граммов CO2 вы произвели?
Экзамен AP Chemistry не часто будет представлять вам коэффициенты пересчета в явном виде, но вы можете рассчитать их самостоятельно, выяснив сбалансированную реакцию, манипулируя формулами и самостоятельно вычисляя молярные массы.
Сбалансированная реакция: 2 C8H28 + 25 O2 -> 16 CO2 + 18 H3O
Молекулярная масса H3O = 18 граммов на моль
Молекулярная масса CO2 = 44 грамма на моль
. , вы можете настроить его по мере необходимости в соответствии с вашей ситуацией. Вы работаете с решениями? Рассматривайте свою молярность как коэффициент преобразования молей на литр. Как насчет измерения количества тепловой энергии, выделяемой в результате реакции? Добавьте его в коэффициент преобразования, который включает один из ваших продуктов или реагентов.
Неважно, занимаетесь ли вы тонкостями международной кулинарной практики или оцениваете количество углекислого газа, которое вы выбрасываете в воздух, исходя из массы остаточной воды. Дименсиональный анализ всегда обеспечит ясный и чистый путь к тому, что конкретно задает вопрос.
Дименсиональный анализ всегда обеспечит ясный и чистый путь к тому, что конкретно задает вопрос.
Нужен более индивидуальный совет?
Приведенные выше рекомендации являются общими. Если у вас есть конкретные вопросы, свяжитесь с нашими экспертами здесь . Мы рады помочь всем, чем можем.
О компании ArborBridge
ArborBridge — мировой лидер в области инновационного цифрового индивидуального обучения. Имея почти десятилетний опыт онлайн-обучения студентов, ArborBridge поддерживает студентов всех типов: домашних школьников, студентов AP, тех, кто готовится к экзаменам, и многих других. Наши преподаватели специализируются на создании индивидуальных планов и оказании сострадательной поддержки студентам и их семьям.
О Джоне Чанге
Джон имеет степень магистра Медицинской школы Университета Джона Хопкинса и Нью-Йоркского университета. Он помог учащимся всех возрастов подготовиться к стандартным тестам, включая SAT, ACT, PSAT, GRE и MCAT.

 25.04.12
Викторина 11
25.04.12
Викторина 11 02.04.12
02.04.12
Leave A Comment