Гидроксид натрия: формула, уравнения реакций, свойства
Гидроксид натрия, формула которого — NaOH, относится к разряду сильных щелочей, едких и опасных для человека, но несмотря на это, каждый человек встречается с гидроокисью натрия ежедневно. В косметических и фармацевтических средствах, в бытовой химии и даже в пищевых продуктах.
Свойства едкой щелочи
Гидроокись (гидроксид) натрия называют также едким натром, едкой щёлочью (такое название обусловлено способностью вещества разъедать стекло, кожу, бумагу, вызывать сильнейшие химические ожоги) и каустической содой (каустик — от греч. kaustikos жгучий, едкий).
Физические свойства
Гидроксид натрия выпускается в виде гранул белого цвета, скользких на ощупь.
Растворение вещества в воде, происходит с выделением большого количества тепла. Гидроксид натрия является гигроскопичным веществом, т. е. он активно поглощает водяные пары из воздуха. А также каустик способен поглощать углекислый газ, образуя на воздухе NaНCO3.
Молярная масса NaOH равна 39,997 г/моль, плотность вещества 2,02 г/см3, растворимость в воде 108,7 г/100 мл, температуры кипения и плавления для каустической соды равны соответственно 1403 °C и 323 °C.
Молекулы гидроокиси натрия полностью диссоциируют на ионы в водных растворах, а значит едкий натр — сильное основание. Водные растворы гидроокиси натрия обладают сильнейшей щелочной реакцией (pH 1%-раствора = 13).
Химические свойства
NaOH способен вступать в реакции с кислотами (серной h3SO4, угольной h3CO3, соляной HCl и другими), в результате чего образуются соли и вода:
- 2NaOH + h3CO3 → Na2СO3 + 2h3O,
- 2NaOH + h3SO4 → Na2SO4 + 2h3O.
С кислотными оксидами в результате взаимодействия образуются соль и вода:
- SiO2 + 2NaOH → Na2SiO3 + h3O,
- 2NaOH + SO2 → Na2SO3 + h3O.
C основными оксидами реакция не идёт: MgO/ Bao /CaO + NaOH ≠.
C амфотерными оксидами гидроксид натрия также образует соли и воду: ZnO + 2NaOH + h3O → Na2[Zn (OH)4] (раствор).
C солями гидроокись натрия реагирует при условии, что в результате будет образовано нерастворимое как, например, в реакции с сульфатом меди (CuSO4 + NaOH), газообразное вещество или вода:
- Fe2 (SO4)3 + 6NaOH → 2Fe (OH)3↓ + 3Na2SO4,
- CuSO4 + 2NaOH → Cu (OH)2↓ + Na2SO4,
- CuCl2 + 2NaOH → Cu (OH)2↓ + 2NaCl.
C неметаллами:
- с фосфором 3NaOH + 4P + 3h3O → 3Nah3PO4 + Ph4,
- с серой 6NaOH + 3S → 2Na2S + Na2SO3 + 3h3O.
C металлами гидроокись натрия реагирует с цинком (Zn), алюминием (Al), титаном (Ti). C железом же и медью NaOH не взаимодействует. Примеры:
- Zn + 2NaOH + 2h3O → h3↑ + Na2[Zn (OH)4] тетрагидроксицинкат натрия,
- 2NaOH + 2Al + 6h3O → 3h3↑ + 2Na[Al (OH)4] тетрагидроксиалюминат натрия.
C жирами щёлочь реагирует с образованием мыла: (C17h45COO)3C3H5 + 3NaOH → C3H5 (OH)3 + 3C17h45COONa.
Методы получения вещества
Промышленные методы, с помощью которых можно получить едкий натр, делятся на химические и электрохимические.
Химические методы
Существует три основных химических метода.
Пиролитический метод состоит из двух стадий:
- Получение оксида натрия, разложением карбоната или гидрокарбоната при температуре: Na2CO3 = Na2O + CO2 или NaНCO3 = Na2O + 2CO2↑ + Н2О — при 1000 °C.
- Получение непосредственно гидроокиси натрия, растворением оксида: Na2O + h3O = 2NaOH.
Известковый метод: взаимодействие карбоната натрия (соды) с гашёной известью (гидроксидом кальция) при температуре (80 °C) называют каустификацией. Результатом такой реакции является раствор каустической соды и осадок карбоната кальция.
Уравнение реакции: Na2CО3 + Са (ОН)2 = CaCО3 ↓ + 2NaOH.
Ферритный метод получения может происходить двумя способами:
- Спекание кальцинированной соды с оксидом железа (III) при температуре 1100−1200 °C с образованием феррита натрия: Na2CO3 + Fe2O3 = NaFeO2 + CO2↑.
- Получение гидроокиси натрия происходит с помощью «ощелачивания» (добавления воды) феррита: 2NaFeO2 + h3O = 2NaOH + Fe2O3*h3O↓.

Серьёзными недостатками таких способов является большой расход энергии и сильная загрязнённость продукта. Такие методы получения NaOH в настоящее время почти не используются в промышленности.
Электрохимические методы
Из минерала галита, состоящего преимущественно из NaCl, с помощью электролиза получают гидроксид натрия. Помимо щёлочи в результате такой реакции, получают ещё и хлор и водород.
Записать процесс можно уравнением: 2NaCl + 2h3O → h3↑ + Cl2↑ + 2NaOH.
В лабораторных условиях щёлочь можно получить, например:
- растворением оксида в воде Na2O + h3O = 2NaOH,
- реакцией перекиси натрия с водой Na2O2 + h3O = 2NaOH+Н2О2.
Но в настоящее время химические методы получения редко используются в лаборатории, чаще используют электрохимические методы.
Области применения
Гидроокись натрия применяют в различных областях промышленности, в производстве, а также широко применяется для бытовых нужд:
- производство моющих агентов (мыла, шампуни), средства бытовой химии,
- целлюлозно-бумажная промышленность,
- химическая промышленность (в качестве катализатора или реагента, в аналитической химии для титрования, в нефтепереработке),
- оборонная промышленность использует каустик для нейтрализации отравляющих газов, как агент, очищающий воздух, вдыхаемый через дыхательный аппарат, от углекислого газа,
- текстильная промышленность (обработка хлопковых и шерстяных нитей — мерсеризация),
- пищевая промышленность (в процессе производства множества различных продуктов, таких как хлеб, различные напитки, карамель, мороженое и многое другое),
- косметология (в составах для пилинга),
- фотография (вещество используется в проявлении фотоматериалов).

Химическая опасность
Вещества, относящиеся ко второму (II) классу опасности — высокоопасные вещества — требуют применения защитных средств (химически устойчивая одежда, очки, перчатки), строгого соблюдения правил работы в лаборатории, осторожности и внимательности.
Едкий натр при попадании на кожу вызывает серьёзные химические ожоги, а при попадании в глаза способен вызвать серьёзные поражения зрения, вплоть до повреждения зрительного нерва и, как результат, — слепоты.
Необходимо помнить, что нейтрализовать действие каустика при попадании на слизистые или кожу можно слабыми растворами борной или уксусной кислоты. Глаза следует промывать слабым раствором борной кислоты и водой.
Fe = 56, S = 32, O = 16) а) Рассчитайте молярную массу Fe2(So4)3. б) Сколько молей каждого элемента содержится в 40 г сульфата железа?
Вопрос
Обновлено: 08.10.2021
MTG IIT JEE FOUNDATION-ATOMS AND MOLECULES — УПРАЖНЕНИЕ (СУБЪЕКТИВНЫЕ ЗАДАЧИ ДЛИННЫЙ ОТВЕТ)
5 видеоРЕКЛАМА
Text Solution
Проверено экспертами
(a ) Молярная масса Fe2(SO4)3=2(56)+3[32+(4×16)=400 г
(б) Число молей =Данная массамолярная масса=40400=0,1
1 моль сульфата железа содержит 2 моля железа
0,1 моль сульфата железа содержит =2×0,1=0,2 моля Fe
1 моль сульфата железа содержит 3 моля S
0,1 моль сульфата железа содержит =3×0,1= 0,3 моля S
1 моль сульфата железа содержит 12 молей O
0,1 моль сульфата железа содержит =12×0,1=1,2 моля O
Был ли этот ответ полезен?
664
Ab Padhai каро бина объявления ке
Khareedo DN Про и дехо сари видео бина киси объявление ки rukaavat ке! 9(-1) ) окисляется до Fe_2(SO_4)_3 .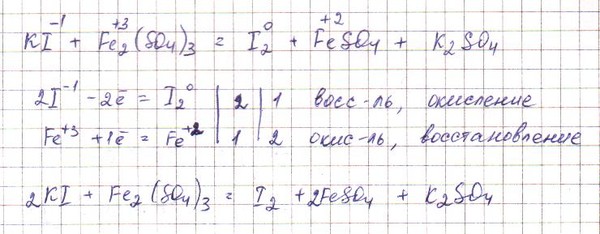 Рассчитайте эквивалентную массу двухвалентного железа.
Рассчитайте эквивалентную массу двухвалентного железа.
278689033
Для окисления смеси по одному молю каждого из FeC2O4, Fe2(C2O4)3, FeSO4 и Fe2(SO4)3 в кислой среде требуется количество молей KMnO4
435649278
Текстовое решение
Балансируйте следующие уравнения Fe_2(SO_4)_3 + NH_3 + H_2O в Fe(OH)_3 + (NH_4)_2SO_4
546904178
Балансируйте следующие уравнения Fe_2(SO_4)_3 + NH_3 + H_2O в Fe(OH)_3 + (NH_4)_2SO_4
548568874
Сбалансируйте следующие уравнения Fe_2(SO_4)_3 + NH_3 + H_2O в Fe(OH)_3 + (NH_4)_2SO_4
549026314
अम्ल ीय माध्यम में, FeC2O4, Fe2(C2O4)3, FeSO4 तथा Fe2( SO4)3 िए आवश्यक KMnO4 के मोलों की संख्या होगी
555834961
90 002 Сбалансируйте следующие уравненияFe2(SO4)3+Nh4+h3O→Fe(OH)3+(Nh5)2SO4
558723415
Сбалансируйте следующие уравнения
Fe2(SO4)3+Nh4+h3O→Fe(OH)3+(Nh5)2SO4
560934578
अम्लीय माध्यम में, FeC2O4,Fe2(C2O4)3,FeSO4 तथा Fe2(SO4)3 प ्रत्येक के एक मोल मिश्रण को उपचयित करने के लिए KMnO4 के मोलों की संख्या होगी
576994779
При окислении оксалата железа [Fe2(C2O4)3] в углекислый газ, если требуется 18F электричества сколько молей оксалата железа окисляется
637880811
में, FeC2O4, Fe2(C2O4)3, FeSO4 तथा Fe2(SO4)3 प्रत्येक के एक मोल मिश्रण को उपचयित करने के लि ए आवश्यक KMnO4 के मोलों की संख्या होगी 923 сульфат-иона, SO4 с отрицательными двумя вверху?
Выберите область веб-сайта для поиска
Искать на этом сайте
Цитата страницы Начать эссе значок-вопрос Задайте вопросНачать бесплатную пробную версию
Скачать PDF PDF Цитата страницы Цитировать Поделиться ссылкой Делиться 923 иона сульфата, поэтому количество молей, которое у нас есть, составляет 3,59/18,06 = 0,19878 моль сульфата железа.
каждый моль сульфата железа имеет атомный вес, который представляет собой сумму стомических весов всех атомов, составляющих молекулу.
ат.вес = 2Fe + 3S + 3×4 O = 2 (55,847) + 3 (32,06) + 12 (15,9994) = 399,8668. Масса в граммах одного моля сульфата железа составляет 399,8668 г
масса 0,19878 молей = 0,19878 X 399,8668 г = 79,486 г
См. eNotes Ad-Free
Запустите 48-часовую бесплатную пробную версию , чтобы получить доступ к более чем 30 000 дополнительных руководств и более чем 350 000 вопросов помощи при выполнении домашних заданий, на которые ответили наши эксперты.
Получите 48 часов бесплатного доступаУже зарегистрирован? Войдите здесь.
Утверждено редакцией eNotes
Похожие вопросы
Просмотреть всеНаука
Последний ответ опубликован 17 июля 2012 г.



Leave A Comment