онлайн-тестирование с ответами, заданиями, решениями
Рассказываем о том, как пройти онлайн-тесты ЕГЭ по химии 2023, найти задания и решения с ответами.
КСЕНИЯ АДАМОВИЧ
Автор
Единый государственный экзамен по химии на фоне остальных не пользуется популярностью: его выбирают для сдачи лишь 10-12 процентов выпускников. Однако без ЕГЭ по химии невозможно поступить на специальности, связанные с медициной, биотехнологиями и некоторыми областями промышленности.
Экзамен по химии считается одним из самых сложных: почти 15 процентов учеников получают на нем «неуд», а средний результат остается на уровне, плюс-минус, 55 баллов. Впрочем, число высокобалльников по этому предмету с каждым годом растет, так что получить хороший результат на этом экзамене вполне реально.
Как сдать ЕГЭ по химии на 100 баллов
Перейти
Как проходит экзамен ЕГЭ по химии
Перейти
Онлайн тест ЕГЭ по химии с ответами
Перейти
В ЕГЭ по химии встречаются задания базовой и повышенной сложности. Первых большинство: это 21 задача, которые принесут ученику почти две трети оценки. В этом разделе проверяется, как школьники знают строение атомов и молекул, а также типы связей, насколько хорошо умеют вычислять валентность атома и степень окисления. Чаще всего здесь встречаются задачи по неорганической химии.
Первых большинство: это 21 задача, которые принесут ученику почти две трети оценки. В этом разделе проверяется, как школьники знают строение атомов и молекул, а также типы связей, насколько хорошо умеют вычислять валентность атома и степень окисления. Чаще всего здесь встречаются задачи по неорганической химии.
Оставшиеся задания – это вопросы повышенной сложности и с развернутыми ответами, которые потребуют от учеников умения составлять химические реакции разных типов, разбираться в химических процессах (например, нужно знать особенности электролиза и гидролиза), а также знания свойств веществ. Выполнение заданий этого блока принесет выпускнику еще треть итоговой оценки, то есть 36 первичных баллов из 56 максимально возможных.
Всего на экзамен по химии отводится 210 минут – три с половиной часа. Но реально стоит постараться решить все задания за три часа, оставив дополнительное время на то, чтобы перенести ответ из черновика на официальный бланк. Иначе можно недобрать баллов: экзаменаторы проверяют только то, что написано на чистовике.
Иначе можно недобрать баллов: экзаменаторы проверяют только то, что написано на чистовике.
Решение первых 10 задач лучше довести до автоматизма: составители экзамена рекомендуют тратить на них по 1-2 минуты. А вот 11-я задача в ЕГЭ по химии – одна из самых трудоемких: в ней проверяется знание свойств неорганических веществ. Вместо того, чтобы сходу определить, что за вещество представлено в формуле – оксид, кислота или что-то другое, и понять, что с чем может взаимодействовать, ученики часто начинают расписывать все возможные комбинации и теряют на этом уйму времени. Поэтому на него стоит отводить хотя бы 10 минут.
Другое сложное задание, с которым многие не справляются, – это задача, где необходимо обладать знаниями о химической промышленности и лабораториях, а также иметь представление о химическом загрязнении окружающей среды. Выполнение этого задания может занять 15-20 минут.
Вспомогательные материалы
На ЕГЭ по химии, как и по другим предметам, нельзя приносить мобильники, планшеты и умные часы – за это организаторы выгоняют из аудитории без разговоров, а экзамен автоматически считается не сданным.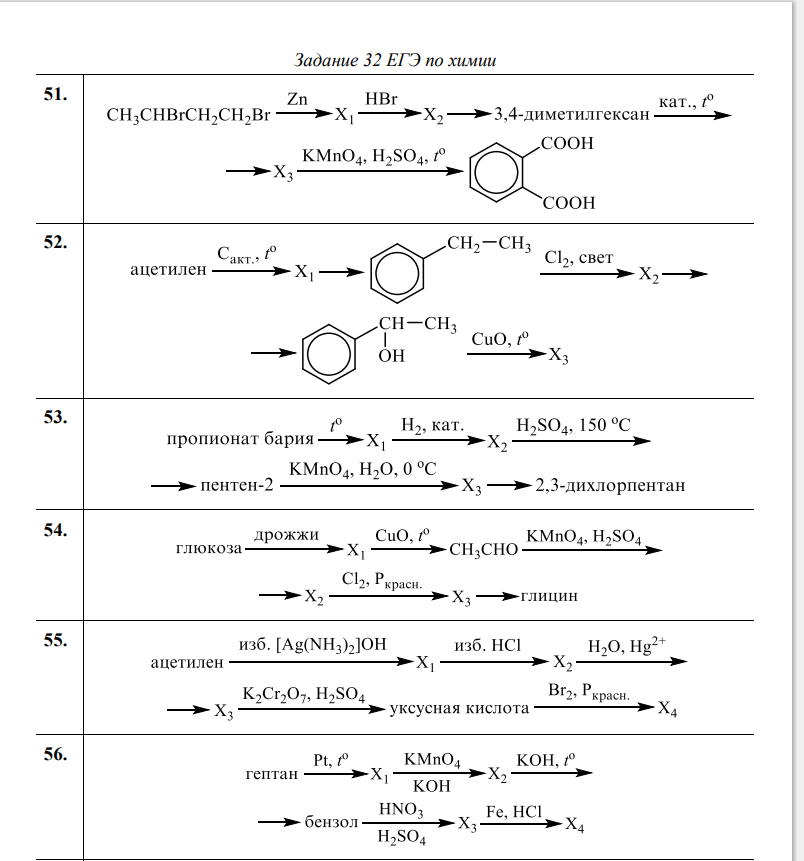 Пересдать его можно уже только в следующем году.
Пересдать его можно уже только в следующем году.
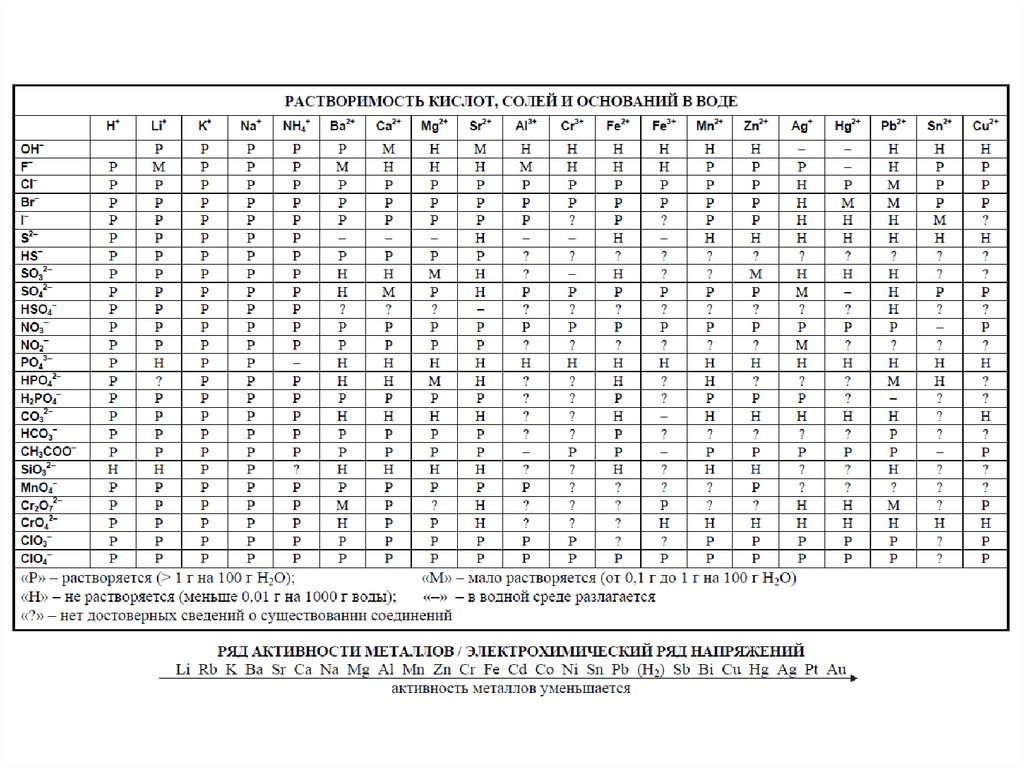
С собой на экзамен можно принести непрограммируемый калькулятор с возможностью вычисления синусов и косинусов. Кроме того, в раздаточных материалах, кроме бланков ответов и заданий будут еще и справочные пособия, в том числе таблица Менделеева, таблица растворимости солей, кислот и оснований в воде, а также электрохимический ряд напряжений металлов.
Пройти онлайн-тест по химии
ЕГЭ. Химия
Ответом к заданиям 1–26 является последовательность цифр.
| Пройти тест |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
2,1,5,3
3,2,5,4
3,2,4,1
| Дальше |
| Проверить |
| Узнать результат |
6,6,2,1
1,2,4,5
6,4,6,3
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
5,2,3,6
1,4,6,2
3,2,6,5
| Дальше |
| Проверить |
| Узнать результат |
1,6,2,3
4,6,2,4
5,1,3,5
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
1,6,3,5
2,4,4,2
4,2,4,6
| Дальше |
| Проверить |
| Узнать результат |
1,3,2,4
4,3,1,2
3,1,4,2
| Дальше |
| Проверить |
| Узнать результат |
1,2,3,1
1,1,3,1
3,1,1,2
| Дальше |
| Проверить |
| Узнать результат |
4,5,3,5
1,3,2,5
5,4,2,5
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
Вам не помешает подтянуть свои знания.
| Пройти еще раз |
Вам не помешает подтянуть свои знания.
| Пройти еще раз |
Вам не помешает подтянуть свои знания.
| Пройти еще раз |
У вас есть еще пробелы в знаниях.
| Пройти еще раз |
Неплохой результат!
| Пройти еще раз |
Очень неплохой результат!
| Пройти еще раз |
Тесты ЕГЭ по химии 2023
Учебник Курсы Книги Тесты Вопросы
Личный кабинет
Задания по линиям ЕГЭ
Тесты ЕГЭ
Studarium ОВР
Вариант 1Вариант 2Вариант 3Вариант 4Вариант 5Вариант 6Вариант 7Вариант 8Вариант 9Вариант 10Вариант 11Вариант 12Вариант 13Вариант 14Вариант 15Вариант 16Вариант 17Вариант 18Вариант 19Вариант 20Вариант 21Вариант 22Вариант 23Вариант 24Вариант 25Вариант 26Вариант 27Вариант 28Вариант 29Вариант 30Вариант 31Вариант 32Вариант 33Вариант 34
-
1.
 Электронная конфигурация атома
Электронная конфигурация атома
- 1. Все задания
- 2. Внешний уровень, валентные электроны
- 3. Возбужденное состояние
- 4. Изотопы
-
2. Закономерности изменения химических свойств элементов и их соединений по периодам и группам.
- 1. Все задания
- 2. Атомный радиус
- 3. Электроотрицательность, энергия ионизации
-
4.
 Кислотные и основные свойства
Кислотные и основные свойства
- 5. Валентность, электроны
- 6. Окислительные и восстановительные свойства
-
3. Электроотрицательность. Степень окисления и валентность химических элементов.
- 1. Все задания
- 2. Валентность, электроны
- 3. Степень окисления
-
4. Химические связи. Ковалентная, ионная, металлическая, водородная.

- 1. Все задания
- 2. Ковалентные связи, донорно-акцепторный механизм
- 3. Ионные и металлические связи
- 4. Водородные связи
- 5. Кристаллические решетки
-
5. Классификация и номенклатура неорганических веществ.
- 1. Все задания
- 2. Тренировка
-
6.
 Характерные химические свойства простых веществ-металлов, веществ-неметаллов. Оксиды основные, амфотерные, кислотные.
Характерные химические свойства простых веществ-металлов, веществ-неметаллов. Оксиды основные, амфотерные, кислотные.
- 1. Все задания
- 2. Тренировка
- 3. Щелочные металлы (Ia) — Li, Na, K, Rb, Cs и водород
- 4. Щелочноземельные металлы (IIa) — Be, Mg, Ca, Sr, Ba
- 5. IIIa — B, Al
- 6. IVa — C, Si, Ge, Sn, Pb
-
7.
 Va — N, P, As, Sb
Va — N, P, As, Sb
- 8. Халькогены (VIa) — O, S, Se
- 9. Галогены (VIIa) — F, Cl, Br, I
- 10. Металлы побочных групп — Cr, Fe, Cu
- 11. Металлы побочных групп — Mn, Zn, Ag
-
7. Характерные химические свойства оснований, амфотерных гидроксидов, кислот, солей.
- 1. Все задания
-
8. Характерные химические свойства неорганических веществ.

- 1. Все задания
- 2. Щелочные металлы (Ia) — Li, Na, K, Rb, Cs и водород
- 3. Щелочноземельные металлы (IIa) — Be, Mg, Ca, Sr, Ba
- 4. IIIa — B, Al
- 5. IVa — C, Si, Ge, Sn, Pb
- 6. Va — N, P, As, Sb
- 7. Халькогены (VIa) — O, S, Se
-
8.

- 9. Металлы побочных групп — Cr, Fe, Cu
- 10. Металлы побочных групп — Mn, Zn, Ag
-
9. Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа)
- 2. Щелочные металлы (Ia) — Li, Na, K, Rb, Cs и водород
- 3. Щелочноземельные металлы (IIa) — Be, Mg, Ca, Sr, Ba
-
4.
 IIIa — B, Al
IIIa — B, Al
- 5. IVa — C, Si, Ge, Sn, Pb
- 6. Va — N, P, As, Sb
- 7. Халькогены (VIa) — O, S, Se
- 8. Галогены (VIIa) — F, Cl, Br, I
- 9. Металлы побочных групп — Cr, Fe, Cu
- 10. Металлы побочных групп — Mn, Zn, Ag
-
10.
 Классификация и номенклатура органических веществ.
Классификация и номенклатура органических веществ.
- 1. Все задания
- 2. Классы, группы и названия веществ
- 3. Общая формула
-
11. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Типы связей в молекулах органических веществ.
- 1. Все задания
- 2. Изомеры
- 3. Гомологи
-
4.
 Гибридизация, связи, функциональные группы
Гибридизация, связи, функциональные группы
-
12. Характерные химические свойства углеводородов (алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов), спиртов, фенолов, альдегидов, карбоновых кислот, сложных эфиров
- 1. Все задания
- 2. Тренировка
-
13. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Химические свойства жиров, углеводов, белков.
- 1. Все задания
- 2. Амины
-
3.
 Аминокислоты
Аминокислоты
- 4. Углеводы, жиры
-
14. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола).
- 1. Все задания
-
15. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров.
- 1. Все задания
-
16. Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений
- 1. Все задания
-
17.
 Классификация химических реакций в неорганической и органической химии
Классификация химических реакций в неорганической и органической химии
- 1. Все задания
- 2. Неорганическая химия
- 3. Органическая химия
-
18. Скорость реакции, её зависимость от различных факторов
- 1. Все задания
- 2. Неорганическая химия
- 3. Органическая химия
-
19. Реакции окислительно-восстановительные
- 1.
 Все задания
Все задания - 2. Восстановитель
- 3. Окислитель
- 4. Сера
- 5. Азот
- 6. Разные задания
- 1.
-
20. Электролиз расплавов и растворов (солей, щелочей, кислот)
- 1. Все задания
- 2. Анод
-
3.
 Катод
Катод
- 4. Анод + катод
- 5. Получение веществ
-
21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- 1. Все задания
- 2. Тренировка
-
22. Химическое равновесие. Обратимые и необратимые химические реакции.
- 1. Все задания
- 2. Разные задания
-
3.
 Изменение давления
Изменение давления
-
23. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.
- 1. Все задания
-
24. Качественные реакции на неорганические вещества и ионы, качественные реакции органических соединений.
- 1. Все задания
- 2. Неорганическая химия
- 3. Органическая химия
- 4. Разные задания
-
25.
 Правила работы в лаборатории. Лабораторная посуда и оборудование. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Полимеры. Пластмассы, волокна, каучуки.
Правила работы в лаборатории. Лабораторная посуда и оборудование. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Полимеры. Пластмассы, волокна, каучуки.
- 1. Все задания
- 2. Неорганическая химия
- 3. Органическая химия
- 4. Разные задания
- 5. Лабораторная посуда
-
26. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе»
- 1.
 Все задания
Все задания - 2. Разные задания
- 3. Изменение массы вещества
- 4. Изменение массы воды
- 5. Изменение массы вещества и воды
- 1.
-
27. Расчёты теплового эффекта (по термохимическим уравнениям)
- 1. Все задания
- 2. Объемные отношения газов
-
3.
 Термохимические уравнения
Термохимические уравнения
-
28. Расчёты массовой доли (массы) химического соединения в смеси. Расчёты массы вещества или объёма газов, расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного.
- 1. Все задания
- 2. Тренировка
-
29. Окислитель и восстановитель. Реакции окислительно-восстановительные.
- 1. Все задания
- 2. Металлы побочных групп — Cr, Fe, Cu
- 3. Металлы побочных групп — Mn, Zn, Ag
-
4.
 Разные задания
Разные задания
-
30. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена.
- 1. Все задания
-
31. Реакции, подтверждающие взаимосвязь различных классов неорганических веществ.
- 1. Все задания
- 2. Щелочные металлы (Ia) — Li, Na, K, Rb, Cs и водород
- 3. Щелочноземельные металлы (IIa) — Be, Mg, Ca, Sr, Ba
- 4. IIIa — B, Al
-
5.
 IVa — C, Si, Ge, Sn, Pb
IVa — C, Si, Ge, Sn, Pb
- 6. Va — N, P, As, Sb
- 7. Халькогены (VIa) — O, S, Se
- 8. Галогены (VIIa) — F, Cl, Br, I
- 9. Металлы побочных групп — Cr, Fe, Cu
- 10. Металлы побочных групп — Mn, Zn, Ag
-
32. Реакции, подтверждающие взаимосвязь органических соединений.
- 1.
 Все задания
Все задания - 2. Алкины
- 3. Спирты, фенолы
- 4. Альдегиды, кетоны
- 5. Карбоновые кислоты, сложные эфиры
- 6. Алканы, циклоалканы
- 7. Алкены, алкадиены
- 1.
-
33. Установление молекулярной и структурной формул вещества.
- 1.
 Все задания
Все задания - 2. Реакции с различными веществами
- 3. Сгорание
- 4. Количество атомов
- 1.
-
34. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества), Расчёты массовой доли (массы) химического соединения в смеси.
- 1. Все задания
- 2. Растворимость
- 3. Электролиз
-
4.
 Задачи на металлическую пластинку
Задачи на металлическую пластинку
- 5. Атомистика (число, соотношение атомов)
Курсы искусственного интеллекта Studarium по химии
Онлайн-викторины для CliffsNotes Chemistry QuickReview, 2-е издание
Онлайн-викторины для CliffsNotes Chemistry QuickReview, 2-е издание
Ниже приведены тесты из CliffsNotes Chemistry Quick Review , 2-е издание. Используйте эти викторины, чтобы проверить себя, насколько хорошо вы знаете химию. Мы подготовили сотни вопросов по химии, чтобы вы могли подготовиться к следующему тесту или викторине по химии.
Используйте эти викторины, чтобы проверить себя, насколько хорошо вы знаете химию. Мы подготовили сотни вопросов по химии, чтобы вы могли подготовиться к следующему тесту или викторине по химии.
Глава 1: Элементы
- Открытие и сходство
- Атомные массы
- Периодическая таблица
Глава 2: Атомы
- Химические соединения
- Стехиометрия
- Подразделение «Крот»
- Химические реакции
Глава 3: Атомная структура
- Субатомные частицы
- Изотопы
- Радиоактивность
- Ионы
Глава 4: Электронные конфигурации
- Валентные электроны
- Периодическая таблица
- орбитали
Глава 5: Химическая связь
- Ковалентные связи
- Ионные связи
- Полярные облигации
- Прочие облигации
Глава 6: Органические соединения
- Структурные формулы
- Углеводороды
- Соединения с дополнительными элементами
- Введение в органические соединения
Глава 7: Состояние вещества
- Твердые тела, жидкости и газы
- Фазовые диаграммы
- Теплоемкость и превращения
Группа 8: Газы
- Закон Бойля
- Закон Чарльза
- Закон Авогадро
- Уравнение идеального газа
Глава 9: Решения
- Единицы концентрации
- Растворимость
- Точки замерзания и кипения
- Введение в решения
Группа 10: Кислоты и основания
- Шкала pH
- Сильные и слабые кислоты
- Два типа баз
- Полипротоновые кислоты
- Введение в кислоты и основания
Глава 11: Окислительно-восстановительные реакции
- Введение в окислительно-восстановительные реакции
- числа окисления
- Электронный перенос
- Уравнения баланса
Глава 12: Электрохимия
- Электрохимические ячейки
- Электродный потенциал
- Законы Фарадея
- Введение в электрохимию
Глава 13: Равновесие
- Два направления реакции
- Равновесные концентрации
- Принцип Ле Шателье
- Введение в равновесие
Глава 14: Термодинамика
- Энтальпия
- Энергия и энтропия
- Свободная энергия Гиббса
- Введение в термодинамику
Онлайн-тест по химии | Химия GK Вопросы и ответы
Добро пожаловать на портал онлайн-экзаменов freeonlinetest. in для тех, кто готовится к конкурсным экзаменам, таким как SSC, SSC CGL, UPSC, банковское дело, LIC, NDA, IAS, TET, CTET, Police, Railway, ASM, и т. д., тогда это хорошее место, чтобы попрактиковаться в MCQ по химии.
in для тех, кто готовится к конкурсным экзаменам, таким как SSC, SSC CGL, UPSC, банковское дело, LIC, NDA, IAS, TET, CTET, Police, Railway, ASM, и т. д., тогда это хорошее место, чтобы попрактиковаться в MCQ по химии.
Химия является хорошей темой для всех видов конкурсных экзаменов, вступительных экзаменов JEE, продвинутых экзаменов JEE (Всеиндийская основа). Некоторые вопросы относятся к общей науке, которая является частью химии.
Онлайн-тест по химии
Здесь вы получите более 1000 лучших вопросов MCQ по химии в формате онлайн-теста. Все вопросы новые и предстоящие экзамены. попрактикуйтесь в этой серии онлайн-тестов по химии или в этих пробных тестах на химию, и вы получите несколько вопросов.
Общие вопросы по химии
На некоторых экзаменах также задаются общие вопросы по химии (общие знания).
Серия онлайн-тестов по химии
- Сокращения
- Физика
- Индийская политика
- География
- Индийская экономика
- Химия
- Биология
- Награды и почести
- Книги и авторы
- Виды спорта
- Всемирные организации
- Дни и даты
- Викторина по логотипу
- История компьютера
- Тест MCQ по экономике
- Онлайн-тест по географии мира
- История MCQ Онлайн-тест
- Индийский город на берегах реки MCQ
- Ботаника MCQ Онлайн-тест
- Онлайн-тест MCQ по зоологии
- Индийские национальные символы
- Памятники Индии
TAG: Общая научная химия MCQ, Практика MCQ Вопросы и ответы по химии, NEET Химия MCQS, Химия MCQ с ответами Класс 12
ХИМИЯ:
Ниже приведены вопросы, заданные на экзамене в прошлом году. Просим вас ответить на приведенные ниже вопросы и пройти онлайн-тест позже.
Просим вас ответить на приведенные ниже вопросы и пройти онлайн-тест позже.
1. Что из следующего используется для создания искусственного дождя?
A. окись углерода B. окись углерода C. йодид серебра D. нитрат серебра
Ответ. иодид серебра
2. Какой элемент в периодической таблице стоит первым?
A. Водород B. Гелий C. Литий D. Цинк Водород
3. Каково значение рН воды?
A. 7 B. 6 C. 8 D. 5
ANS. 7
4. Какой из них используется в спирте ___
A. пропанол B. этиловый спирт C. метиловый спирт D. этиленгликоль
Ans. этиловый спирт
5. Что из перечисленного используется для изготовления динамита?
A. Глицерин B. Спирт этиловый C. Спирт метиловый D. Метан
Ans. Глицерин
Глицерин
6. Какой элемент по массе является четвертым по распространенности во Вселенной?
A. Водород B. Ртуть C. Кислород D. Углерод
Ans. Углерод
7. Жидкость для снятия лака содержит ___
A. хлор B. бензол Ацетон
8. Каково значение рН крови?
A. 10.4 B. 7 C. 7.4 .0003
Ответ. 7.4
9. Атомное число равно ____
A. Количество протонов B. Количество электронов
C. Количество нейтронов D. Все вышеперечисленное
Ans. Количество протонов
10. Какое атомное количество кислорода ___
A. Шесть B. пять C. Восемь D. D. Ten 9
Ответ. C
11. Какой из перечисленных ниже газов является причиной глобального потепления?
A. Кислород B.

 Электронная конфигурация атома
Электронная конфигурация атома
 Кислотные и основные свойства
Кислотные и основные свойства

 Характерные химические свойства простых веществ-металлов, веществ-неметаллов. Оксиды основные, амфотерные, кислотные.
Характерные химические свойства простых веществ-металлов, веществ-неметаллов. Оксиды основные, амфотерные, кислотные.
 Va — N, P, As, Sb
Va — N, P, As, Sb


 IIIa — B, Al
IIIa — B, Al
 Классификация и номенклатура органических веществ.
Классификация и номенклатура органических веществ.
 Гибридизация, связи, функциональные группы
Гибридизация, связи, функциональные группы
 Аминокислоты
Аминокислоты
 Классификация химических реакций в неорганической и органической химии
Классификация химических реакций в неорганической и органической химии
 Все задания
Все задания Катод
Катод
 Изменение давления
Изменение давления
 Правила работы в лаборатории. Лабораторная посуда и оборудование. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Полимеры. Пластмассы, волокна, каучуки.
Правила работы в лаборатории. Лабораторная посуда и оборудование. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Полимеры. Пластмассы, волокна, каучуки.
 Все задания
Все задания Термохимические уравнения
Термохимические уравнения
 Разные задания
Разные задания
 IVa — C, Si, Ge, Sn, Pb
IVa — C, Si, Ge, Sn, Pb
 Все задания
Все задания Все задания
Все задания Задачи на металлическую пластинку
Задачи на металлическую пластинку
Leave A Comment