Ацетон, химические свойства, производство, Ch4COCh4, Ch4-C(O)-Ch4
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
описание, получение, применение, химические свойства
Химические свойства ацетона позволяют использовать его во многих отраслях промышленности (в основном, в качестве растворителя). У ацетона формула следующая – C₃H₆O, вещество органического происхождения, является элементарным представителем насыщенных кетонов. По виду это жидкость без цвета. Многие знают какой запах у ацетона, для тех, кто не знает сообщаем – запах ацетона резкий, но может вызывать привыкание. Может смешиваться в любых пропорциях с водой, диэтиловым спиртом и другими эфирными соединениями.
Особенности производства ацетона
Получение ацетона возможно разными методами:
- Кумольный способ – сначала выполняется алкирование бензола пропеном с образованием кумола, затем проводится окисление кумола воздухом с образованием гидропероксида, распадающегося при добавлении серной кислоты на фенол и ацетон;
- Из изопропанола – базовый состав, в виде пара, окисляется в условиях от +450 до +650 °C на катализаторе, где появляется ацетон;
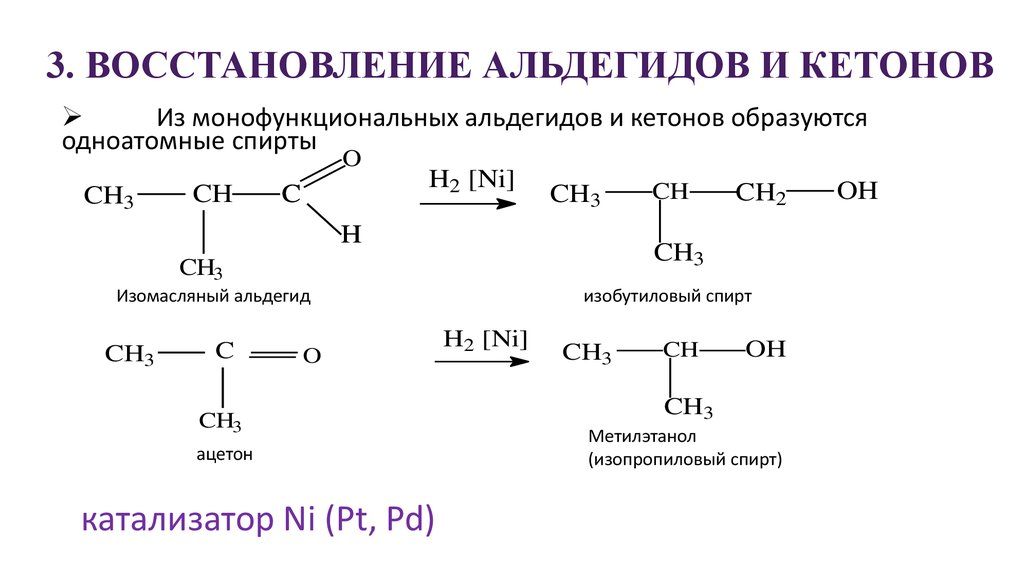
- Из пропена – жидкая основа окисляется с добавлением PdCl2 и растворов солей Pd, Cu, Fe в условиях от +50 до 120 °C при давлении 50-100 атм.
 В результате образуется ацетон.
В результате образуется ацетон.
Химические свойства
Химические свойства ацетона выделяют такие:
- Может восстанавливаться, присоединяя водород;
- Образует диацетоновый спирт при альдольной самоконденсации в щелочной среде;
- Образует пинакон при восстановлении цинком;
- При реакции с гидросульфитом натрия ацетон способен формировать бисульфитное соединение;
- Преобразуется в кетен и метан при пиролизе в условиях от 500°C;
- Взаимодействует с циановодородом, образуя ацетонциангидрин;
- Превращается в хлороформ (йодоформ) при воздействии хлора (йода) в щелочной среде;
- Образует ацетонциангидрин при реакции с синильной кислотой.
Применение ацетона
Использование ацетона в промышленности актуально при получении различной химической продукции, например, уксусного ангидрида, диацетонового спирта, метилметакрилата и т. д. Сырье широко применяется для получения поликарбонатов, полиуретанов, эпоксидных смол и для других целей.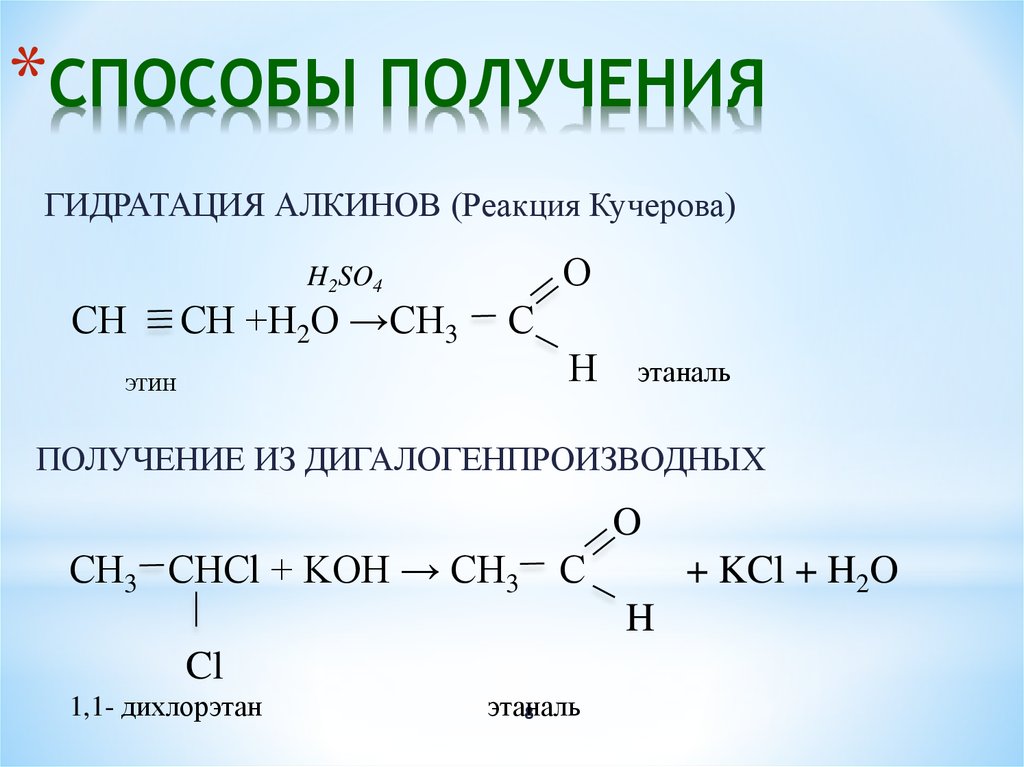
Растворяющие качества ацетона технического позволяют применять его в производстве лакокрасочной продукции, метилметакрилата и Бисфенола А, в фармакологии, в производстве стекловолокна и химволокна (для обезжиривания поверхностей), в изготовлении составов для очищения различных поверхностей и во многих других сферах. Также используется для хранения ацетилена в баллонах.
В лабораториях применяется в реакциях алкилирования, при окислении спиртов. При смешивании с «сухим льдом» и жидким аммиаком используется для создания охлаждающих бань. Вещество хорошо растворяется в воде, поэтому активно применяется для мытья химической посуды.
Метаболизм и токсикология
В небольшом количестве ацетон содержится в организме человека (используется для процессов метаболизма). Его выведение из организма производится тремя способами: при выдыхании воздуха, через потовые железы и мочу. При нарушении метаболизма в организме образуется и выводится больше ацетона, например, при сахарном диабете.
Вещество является токсичным (класс опасности IV, малоопасный продукт). Приводит к раздражению слизистых оболочек, воспалениям при вдыхании больших концентраций. Также для ацетона характерен наркотический эффект (вызывает состояние опьянения, интоксикацию).
Перекись ацетона – обычные ингредиенты для экстраординарной взрывчатки | News
Правительство Великобритании в срочном порядке проводит меры по борьбе со злоупотреблениями в Интернете после очевидной легкости, с которой террористы могут получить необходимые средства для изготовления бомб, подобных тем, которые использовались при недавней атаке на Лондон.
«Использование Интернета террористами и экстремистами представляет собой серьезную угрозу», — заявил представитель Министерства внутренних дел Chemistry World , — «Мы уже работаем с нашими партнерами по G8 и европейскими партнерами, чтобы найти способы борьбы с сайтами и выявить лиц и группы, ответственные за . Люди, которые загружают инструкции по изготовлению бомб, а затем пытаются им следовать, вполне могут быть виновны в новом предлагаемом Законе о подготовке к террористической деятельности, о котором мы объявили 18 июля, и который будет включен в новый законопроект о предотвращении терроризма».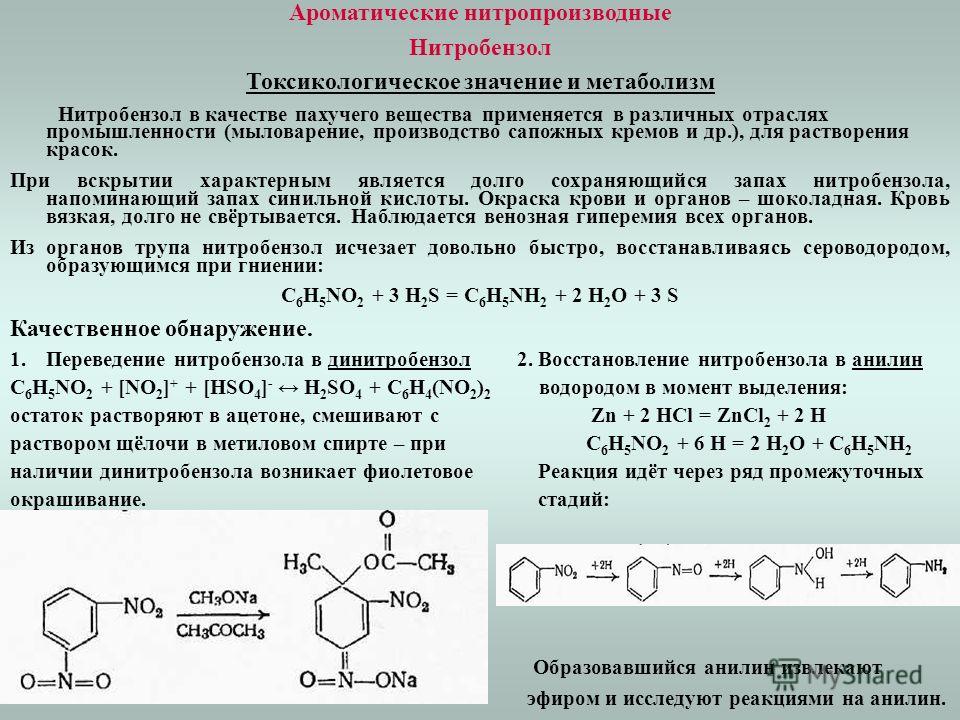
В Интернете можно найти точные инструкции о том, как сделать перекись ацетона, излюбленное оружие террористов-смертников. Обычные бытовые ингредиенты — разбавители для краски (ацетон), отбеливатель или антисептик (перекись водорода) и мощное средство для разблокировки стоков (> 85-процентная серная кислота) — можно приобрести в хозяйственных магазинах и аптеках. Смешанные в правильных пропорциях, эти ингредиенты образуют белые кристаллы перекиси ацетона.
Тример пероксида ацетона
По взрывной силе пероксид ацетона (или трипероксид триацетона — ТАТФ — его правильное химическое название) близок к тротилу. TATP настолько чувствителен к теплу, трению и механическим ударам, что неопытное обращение с ним может привести к увечьям и смерти. Эксперты по борьбе с терроризмом сообщают, что комплекс известен исламскими экстремистами как «Мать Сатаны» за его разрушительную нестабильность. То, что 40 палестинцев якобы были убиты при работе с TATP, ничего не говорит о политике палестинской боевой организации ХАМАС в отношении здоровья и безопасности на рабочем месте.
TATP до недавнего времени было трудно обнаружить. Его можно комбинировать с другими взрывчатыми веществами в качестве детонатора, наиболее известным из которых является неудавшаяся попытка Ричарда Рида, так называемого «обувного бомбардировщика», взорвать трансатлантический рейс в декабре 2001 года. до трех форм пероксида ацетона, включая мономер, циклический димер и циклический тример.
Обычно считается, что тример немного более стабилен, чем два других, и образуется предпочтительно, когда температура реакции и последующего образования продукта поддерживается ниже 10 градусов Цельсия. Некоторые из наиболее нестабильных димеров всегда обнаруживаются связанными с тримером, а ТАТФ разлагается при длительном хранении, что делает его непригодным для обычных взрывоопасных боеприпасов, но идеальным для терактов типа «удар-и-самоубийство», излюбленных экстремистами.
ТАТФ — необычное взрывчатое вещество. «Обычно мы думаем о взрывчатых материалах, таких как топливо, как о высокоэнергетических соединениях, высвобождающих свою энергию в быстрых экзотермических реакциях. Таким образом, чрезмерная теплота образования считается ключевым свойством всех взрывчатых веществ», — сказал Эхуд Кейнан, профессор химии Хайфского Техниона, Израиль. Он и группа исследователей в Израиле и Германии изучают динамику взрывов TATP. «Хотя TATP действительно горит, когда его поджигают, выделяя большие объемы углекислого газа и воды, похоже, что при взрывном разложении выделяется очень мало тепла», — сказал Кейнан.
Таким образом, чрезмерная теплота образования считается ключевым свойством всех взрывчатых веществ», — сказал Эхуд Кейнан, профессор химии Хайфского Техниона, Израиль. Он и группа исследователей в Израиле и Германии изучают динамику взрывов TATP. «Хотя TATP действительно горит, когда его поджигают, выделяя большие объемы углекислого газа и воды, похоже, что при взрывном разложении выделяется очень мало тепла», — сказал Кейнан.
Расчеты Кейнана и его команды предсказывают, что ТАТФ подвергается энтропийному взрыву, каждая молекула ТАТФ коллапсирует с образованием трех молекул ацетона и одной молекулы озона. «Всплеск энтропии, распространяющийся со сверхзвуковой скоростью, приводит в действие взрывную силу TATP, а не обычное тепло, выделяемое при разложении обычных взрывчатых веществ», — заключил он.
Ссылки
F Дубникова и др.; Дж. Ам. хим. Soc ., 2005, 127 ( 4 ), стр. 1146–1159; DOI: 10.1021/ja0464903
- Acetone peroxide
- Atoms and bonds
- Defence and military
- Explosive
- Government
- Legislation
- Policy
- Reactions and synthesis
- Safety
- TATP
- terrorist атака
- Трипероксид триацетона
- Великобритания
Расследование выявило ошибки студента, который невольно изготовил взрывчатку | Новости
Бристольский университет усилит меры безопасности для некоторых реакций после случайного синтеза трипероксида триацетона
Ранее в этом месяце аспирант Бристольского университета непреднамеренно изготовил взрывоопасный трипероксид триацетона (TATP), что вызвало эвакуацию сотрудников химического факультета и привело к вызову группы по обезвреживанию бомб для проведения контролируемого взрыва материала. Подробности того, что именно произошло, теперь были обнародованы университетом, который рассматривает инцидент как учебный опыт.
Подробности того, что именно произошло, теперь были обнародованы университетом, который рассматривает инцидент как учебный опыт.
Третьекурсник кандидата наук сразу же забил тревогу, когда понял, что потенциально может получить более 30 г ТАТФ в растворе. «Ситуация, к которой мы пришли, заключалась в том, что у нас потенциально было много этого материала, который представлял опасность взрыва, но риск взрыва в растворе был небольшим», — объясняет Ник Норман, глава Бристольской школы химии. Они рассматривали возможность утилизации TATP путем химического разложения или разбавления, чтобы сделать его более безопасным, но, учитывая количество, решили, что аварийное реагирование будет лучшим способом действий. «Он мог кристаллизоваться позже и затвердеть, поэтому мы хотели избавиться от него побыстрее» 9.0003
Мы, безусловно, собираемся ужесточить оценку конкретных рисков, связанных с использованием перекиси водорода. Это было драматическое событие, поверьте мне!
Ник Норман, Бристольский университет
В виде сухого вещества ТАТФ представляет собой чрезвычайно чувствительный белый кристаллический порошок, который может взрываться при нагревании, трении или механическом ударе. Его трудно обнаружить, и он сделан из довольно распространенных химических веществ. Он приобрел известность как оружие, используемое террористами, производящими бомбы, некоторые из которых окрестили его «матерью Сатаны» из-за его нестабильности.
Его трудно обнаружить, и он сделан из довольно распространенных химических веществ. Он приобрел известность как оружие, используемое террористами, производящими бомбы, некоторые из которых окрестили его «матерью Сатаны» из-за его нестабильности.
«TATP представляет собой серьезную опасность, и мы согласились, что эвакуация здания и привлечение группы по обезвреживанию бомб являются надлежащими мерами предосторожности», — говорит Том Бейкер, старший консультант Национального центра химических аварийных ситуаций, который консультировал пожарно-спасательную службу Avon по химическим веществам. Услуга в рамках реагирования на инцидент. «Опасность концентрирования пероксидов с помощью роторных испарителей часто упускается из виду, что привело к многочисленным несчастным случаям».
Следование протоколу
Студент случайно сделал TATP, следуя протоколу оценки риска из литературы, чтобы окислить альдегид в карбоновую кислоту с использованием водного подкисленного хлорита.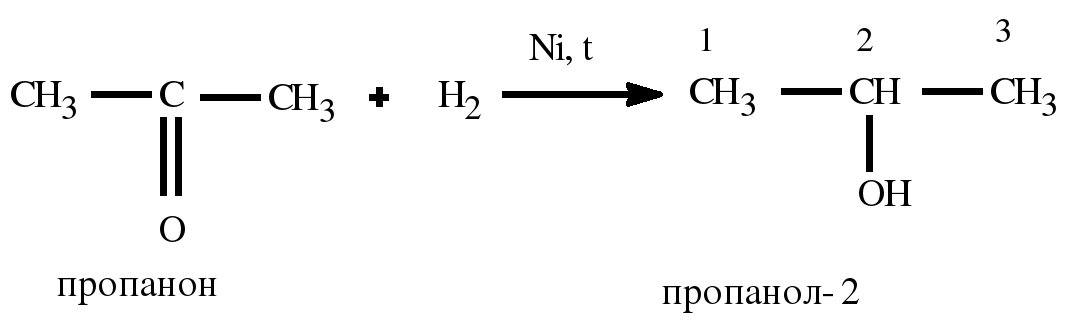 В реакции использовалось 50 мл ацетона в качестве растворителя, и образовались некоторые побочные продукты, связанные с желтым цветом раствора. Один из этих побочных продуктов потенциально включал небольшое количество диоксида хлора, который по оценке риска был определен как токсичный.
В реакции использовалось 50 мл ацетона в качестве растворителя, и образовались некоторые побочные продукты, связанные с желтым цветом раствора. Один из этих побочных продуктов потенциально включал небольшое количество диоксида хлора, который по оценке риска был определен как токсичный.
В литературе указано, что 30% перекись водорода следует добавлять до тех пор, пока раствор не перестанет быть желтым, что указывает на удаление побочных продуктов. Сосредоточившись на удалении диоксида хлора и подождав, пока исчезнет желтый цвет, вместо того, чтобы рассчитать, сколько потребуется перекиси водорода, студент добавил около 50 мл перекиси водорода, когда 1 мл было бы достаточно. Перекись водорода реагировала с ацетоном с образованием ТАТФ и могла образовать до 30-40 г. «Сосредоточенность на одной опасности привела к игнорированию другой, хотя обе они были выявлены при первоначальной оценке рисков», — объясняет Норман.
Когда студент пошел, чтобы удалить растворитель, он обнаружил, что он не уменьшается в объеме, а жидкость становится вязкой, вызывая тревогу. После анализа ГХ-МС было подтверждено присутствие ТАТФ. «В идеальном мире они не допустили бы эту ошибку, но они ее признали и немедленно сообщили об этом руководителю и мне, и это похвально», — говорит Норман. «Последнее, чего мы хотим, это чтобы люди пытались скрыть что-то или разобраться с этим сами, опасаясь попасть в беду» 9.0003
После анализа ГХ-МС было подтверждено присутствие ТАТФ. «В идеальном мире они не допустили бы эту ошибку, но они ее признали и немедленно сообщили об этом руководителю и мне, и это похвально», — говорит Норман. «Последнее, чего мы хотим, это чтобы люди пытались скрыть что-то или разобраться с этим сами, опасаясь попасть в беду» 9.0003
Хотя существуют похожие реакции окисления альдегидов с использованием более безопасных химикатов, оценка риска по описанному в литературе протоколу, которому следовал учащийся, выявила опасности, обеспечив уверенность в том, что нет необходимости рассматривать другой подход. Норман говорит, что в будущем следует рассмотреть и принять к сведению более безопасные способы выполнения этой реакции.
‘Основной урок состоит в том, что потенциально серьезный инцидент удалось предотвратить благодаря хорошей культуре безопасности. Когда опасность была осознана, исследователи осознали свою ответственность и смогли принять соответствующие меры», — говорит Бейкер.

 В результате образуется ацетон.
В результате образуется ацетон.
Leave A Comment