UNEC – Azərbaycan Dövlət İqtisad Universiteti — Page not found
Why UNEC?
Regionda iqtisad elmini dərindən öyrədən fundamental elm və təhsil mərkəzidir;
Tədris prosesi və kadr hazırlığı beynəlxalq təhsil sisteminə uyğundur;
İxtisaslar bakalavr, magistr və doktorantura təhsil pillələri üzrə
azərbaycan, ingilis, rus və türk dillərində tədris edilir;
Auditoriyada mərkəz nöqtəsi tələbədir;
Tələbə universiteti iki və daha çox ixtisasla (dual major) bitirə bilər;
Tələbələrin müxtəlif mübadilə proqramlarında iştirak etmək imkanı vardır;
Universitetdə 10 fakültə və 17 kafedra fəaliyyət göstərir;
403 professor və dosent çalışır.
Son xəbərlər Elanlar Bütün xəbərlər ALL ANNOUNCEMENTS
The Journal of Economic Sciences: Theory and Practice
№ 2
ECONOMIC HERITAGE OF HEYDAR ALIYEV
Connect with
rector
-
Graduates
Mikayıl Cabbarov
İqtisadiyyat naziri
-
Graduates
Ceyhun Bayramov
Xarici işlər naziri
-
Graduates
Şahin Mustafayev
Azərbaycan Respublikası Baş Nazirinin müavini
Graduates
Muxtar Babayev
Ekologiya və təbii sərvətlər naziri
-
Graduates
Fərid Qayıbov
Gənclər və idman naziri
-
Graduates
Səttar Möhbalıyev
Azərbaycan Həmkarlar İttifaqları Konfederasiyasının sədri
-
Graduates
Vüqar Gülməmmədov
-
Graduates
Vüsal Hüseynov
Dövlət Miqrasiya Xidmətinin rəisi
-
Graduates
Ramin Quluzadə
Azərbaycan Respublikası Prezidentinin İşlər müdiri
-
Graduates
Natiq Əmirov
-
Graduates
Kərəm Həsənov
Prezident Administrasiyasının Dövlət nəzarəti məsələləri şöbəsinin müdiri
-
Graduates
Azər Əmiraslanov
Nazirlər Kabineti Aparatının İqtisadiyyat şöbəsinin müdiri
-
Graduates
Rövşən Nəcəf
-
Graduates
Firudin Qurbanov
Elm və təhsil nazirinin müavini
-
Graduates
İdris İsayev
Elm və təhsil nazirinin müavini
-
Graduates
Sevinc Həsənova
İqtisadiyyat nazirinin müavini
-
Graduates
Şirzad Abdullayev
İqtisadiyyat nazirinin müşaviri
-
Graduates
Azər Bayramov
Maliyyə nazirinin müavini
-
Graduates
Sahib Məmmədov
İqtisadiyyat nazirinin müavini
-
Graduates
Məmməd Musayev
-
Graduates
Vüsal Qasımlı
İqtisadi İslahatların Təhlili və Kommunikasiya Mərkəzinin direktoru
-
Graduates
İlqar Rəhimov
Milli Paralimpiya Komitəsinin prezidenti
Graduates
Rüfət Rüstəmzadə
Qida Təhlükəsizliyi Agentliyinin sədr müavini
-
Graduates
Rəşad Mafusov
Qida Təhlükəsizliyi Agentliyinin sədr müavini
-
Graduates
Rauf Səlimov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Cabbar Musayev
-
Graduates
Fərhad Hacıyev
Gənclər və idman nazirinin müavini
-
Graduates
Süleyman Qasımov
AR Dövlət Neft Şirkətinin iqtisadi məsələlər üzrə vitse-prezidenti
-
Graduates
Fərhad Tağı-zadə
-
Graduates
Ziyad Səmədzadə
Millət vəkili
-
Graduates
Xanhüseyn Kazımlı
Azərbaycan Sosial Rifah Partiyasının sədri
-
Graduates
Mikayıl İsmayılov
AR Dövlət Neft Şirkətinin vitse-prezidenti
-
Graduates
Vahab Məmmədov
Dövlət Statistika Komitəsi sədrinin birinci müavini
-
Graduates
Yusif Yusifov
Dövlət Statistika Komitəsi sədrinin müavini
-
Graduates
Fəxrəddin İsmayılov
Auditorlar Palatası sədrinin müavini
Graduates
Xalid Əhədov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Emin Hüseynov
Birinci vitse-prezidentin köməkçisi
-
Graduates
Qəşəm Bayramov
Auditorlar Palatası aparatının rəhbəri
-
Graduates
Rafiq Aslanov
-
Graduates
Tahir Mirkişili
Millət vəkili, Milli Məclisin İqtisadi siyasət, sənaye və sahibkarlıq komitəsinin sədri
-
Graduates
Əli Məsimli
Millət vəkili
-
Graduates
Vüqar Bayramov
Millət vəkili
-
Graduates
Eldar Quliyev
Millət vəkili
-
Graduates
Əli Nuriyev
AMEA-nın müxbir üzvü
-
Graduates
İqbal Məmmədov
Millət vəkili
-
Graduates
Şahin Əliyev
Nəqliyyat, Rabitə və Yüksək Texnologiyalar Nazirliyi yanında Elektron Təhlükəsizlik Xidmətinin rəisi
-
Graduates
Şahin Bayramov
Mingəçevir Dövlət Universitetinin rektoru
-
Graduates
Balakişi Qasımov
İctimai Televiziya və Radio Yayımları Şirkətinin baş direktoru
-
Graduates
Elnur Rzayev
Xaçmaz Rayon İcra Hakimiyyətinin başçısı
-
Graduates
Kamran İbrahimov
“Azərpoçt” MMC-nin baş direktor müavini
-
Graduates
Alim Quliyev
Mərkəzi Bankın sədrinin birinci müavini
-
Graduates
Vadim Xubanov
Mərkəzi Bankın sədrinin müavini
-
Graduates
Aftandil Babayev
Mərkəzi Bankın sədrinin müavini
-
Graduates
Mehman Məmmədov
“Expressbank” ASC-nin İdarə Heyətinin sədri
-
Graduates
Anar Həsənov
AccessBankın İdarə Heyətinin Sədri
-
Graduates
Fərid Hüseynov
«Kapital Bank»ın İdarə Heyəti sədrinin I müavini
-
Graduates
Rövşən Allahverdiyev
Kapital Bankın İdarə Heyətinin sədri
-
Graduates
Rza Sadiq
“Bank BTB” Müşahidə Şurasının Sədri
-
Graduates
Elnur Qurbanov
“AFB Bank” ASC-nin Müşahidə Şurasının Sədri
-
Graduates
Zaur Qaraisayev
“AFB Bank” ASC-nin İdarə Heyətinin Sədri
-
Graduates
Kamal İbrahimov
“Baku Steel Company” şirkətinin direktoru
-
Graduates
Vaqif Həsənov
«Qarant Sığorta» ASC-nin İdarə Heyətinin sədri
Elektron Kitabxana
ABCÇDEƏFGĞHXIİJKQLMNOÖPRSŞTUÜVYZ0-9
Налоги и налогообложение в Азербайджане
460 PAGES | DOWNLOAD
Dördüncü sənaye inqilabı
204 PAGES | DOWNLOAD
Mühasibat hesabatı
258 PAGES | DOWNLOAD
İaşə məhsullarının texnologiyası kursundan laboratoriya praktikumu
219 PAGES | DOWNLOAD
Susuz həyat yoxdur
215 PAGES | DOWNLOAD
Elektron kommersiya
212 PAGES | DOWNLOAD
www. president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.com
president.az
www.mehriban-aliyeva.org
www.heydar-aliyev-foundation.org
www.azerbaijan.az
www.edu.gov.az
www.tqdk.gov.az
www.economy.gov.az
www.science.gov.az
www.azstat.org
www.atgti.az
www.virtualkarabakh.az
www.ecosciences.edu.az
www.polpred.com3. Карбонильные соединения. Альдегиды и кетоны — ЗФТШ, МФТИ
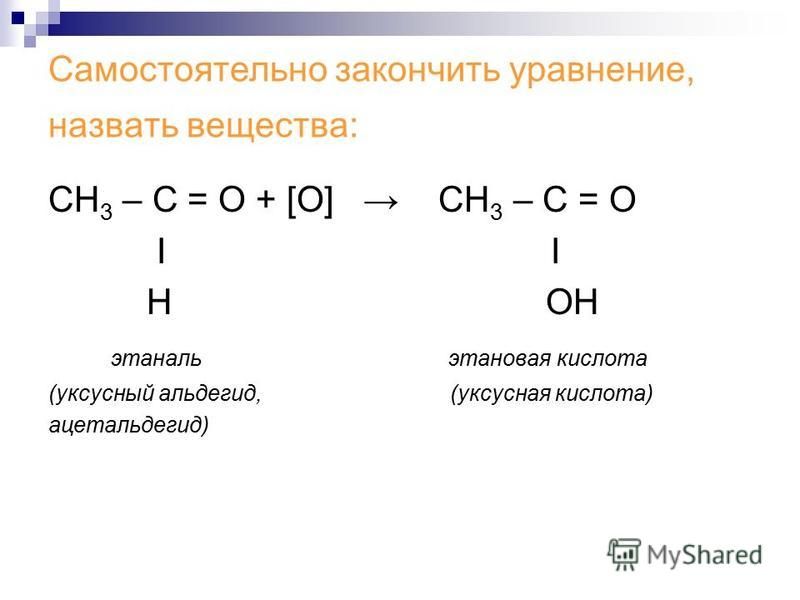
Органические соединения, в молекуле которых имеется карбонильная группа , называются карбонильными или оксосоединениями. Альдегиды – соединения, в которых карбонильная группа связана с углеводородным радикалом и с атомом водорода, в кетонах карбонил связан с двумя одинаковыми или различными углеводородными группами. Исключение составляет простейший альдегид – метаналь, в формуле которого вместо радикала содержится атом водорода: . Общая формула предельных альдегидов и кетонов `»C»_»n»»H»_(2″n»)»O»`.
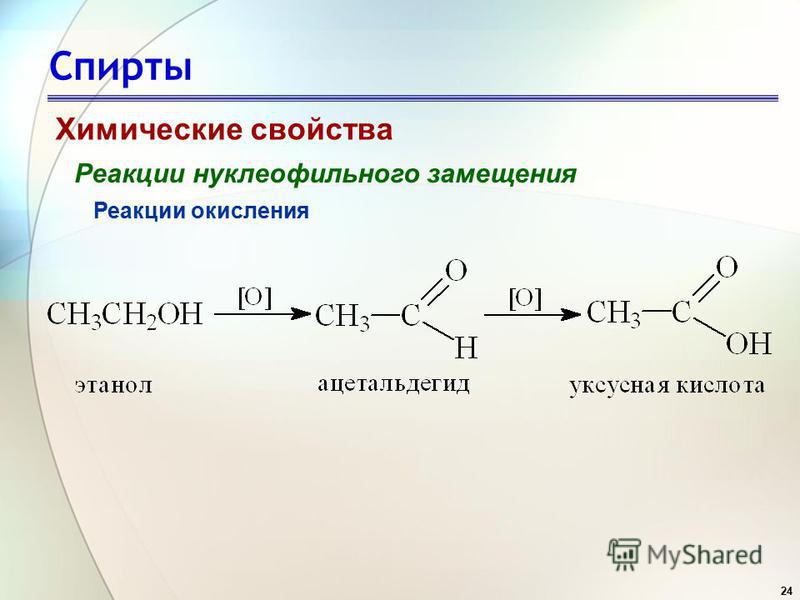
1. Окисление спиртов (см. «Спирты», химические свойства, мягкое окисление).
2. Гидратация алкинов (см.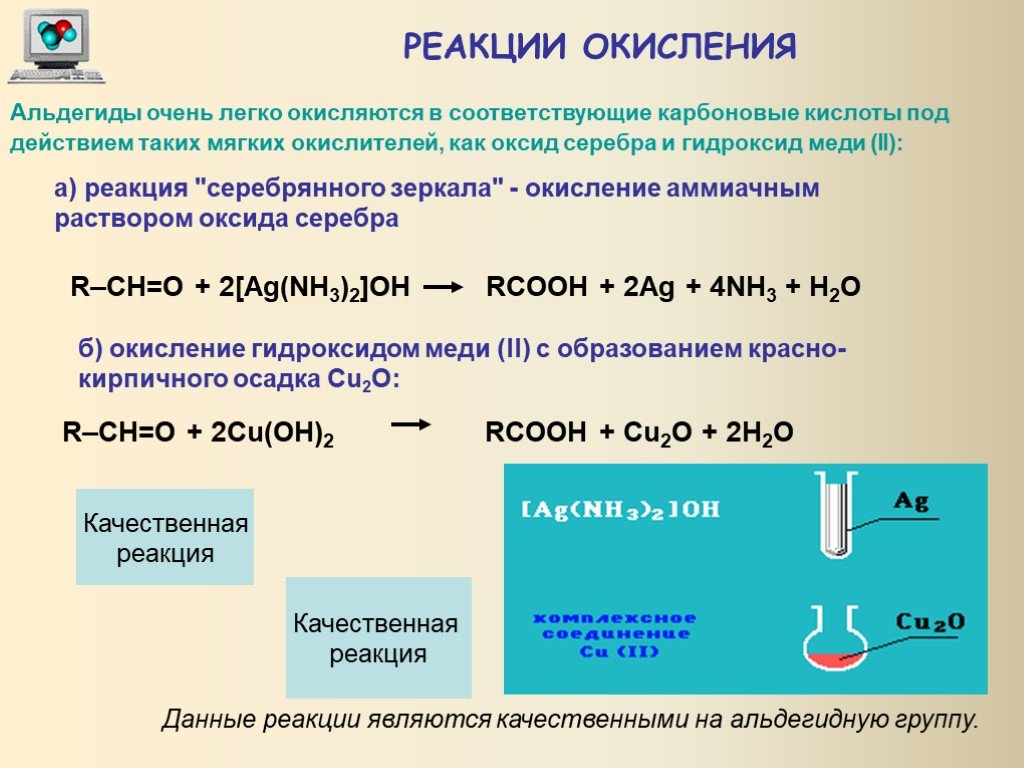 «Алкины», химические свойства, реакция Кучерова).
«Алкины», химические свойства, реакция Кучерова).
3. Простейший кетон – ацетон – получают кумольным методом вместе с фенолом (см. «Фенолы», получение из кумола)
4. Щелочной гидролиз геминальных (содержащих два галогена около одного углеродного атома) дигалогеналканов. Образующиеся неустойчивые диолы претерпевают самопроизвольную дегидратацию с образованием альдегидов, если гидроксильные группы оказались у концевого атома:
`»CH»_3-«CH»_2-«CHCl»_2+2″NaOH»->`
`->»CH»_3-«CH»_2-«CH»(«OH»)_2+2″NaCl»->`
`->»CH»_3-«CH»_2-«CH»=»O»+»H»_2″O»`
и кетонов – в остальных случаях:
5. Каталитическое дегидрирование спиртов (промышленный способ). Процесс осуществляется пропусканием паров спирта над медью, никелем или оксидом цинка. При дегидрировании первичных спиртов получают альдегиды, вторичных – кетоны:
$$ {\mathrm{CH}}_{3}-{\mathrm{CH}}_{2}\mathrm{OH}\underset{\mathrm{t}°}{\overset{\mathrm{Cu}}{\to }}{\mathrm{CH}}_{3}\mathrm{CH}=\mathrm{O}+{\mathrm{H}}_{2}\uparrow $$.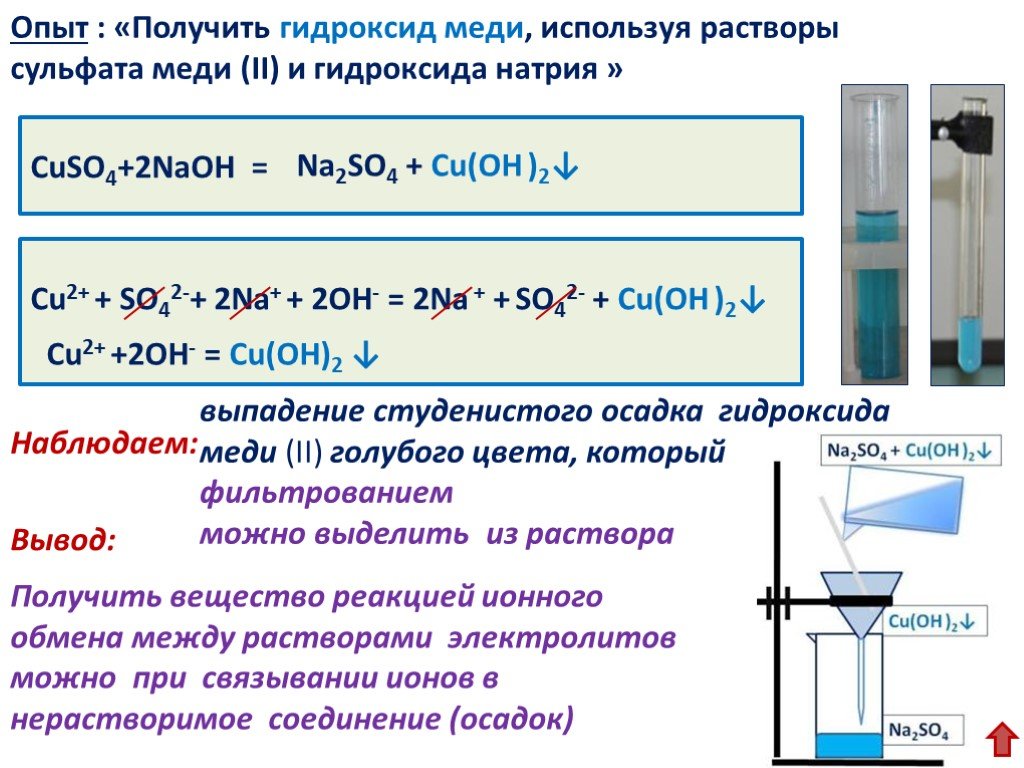
6. Окисление углеводородов кислородом воздуха в присутствии катализаторов (промышленный метод для получения низших альдегидов и кетонов):
$$ {\mathrm{CH}}_{4}+{\mathrm{O}}_{2}\stackrel{\mathrm{t}°}{\to }\mathrm{HCH}=\mathrm{O}+{\mathrm{H}}_{2}\mathrm{O} (\mathrm{кат}. \mathrm{Cu} \mathrm{или} \mathrm{Ag})$$
`2″CH»_2=»CH»_2+»O»_2->2″CH»_3″CH»=»O» («кат». «PdCl»_2 «и» «CuCl»_2)`
`2″CH»_3-«CH»=»CH»_2+»O»_2->2″CH»_3″COCH»_3 («кат». «PdCl»_2 «и» «CuCl»_2)`.
7. Декарбоксилирование кальциевых или бариевых солей карбоновых кислот приводит к образованию кетонов:
Характерными реакциями для альдегидов являются: нуклеофильное присоединение `»A»_»N»`, реакции окисления, полимеризация и поликонденсация. Кетоны менее активны в реакциях `»A»_»N»`. Это объясняется тем, что у кетонов в молекуле не один, а два углеводородных радикала, присоединённых к карбонильной группе. Электронодонорные группы уменьшают `delta+` на атоме углерода карбонила, снижая реакционную способность кетонов в реакциях нуклеофильного присоединения. -`)
-`)
`»CH»_3-«CH»=»O»+»NaHSO»_3->»CH»_3-«CH(OH)»-«SO»_3″Na»`.
Эта реакция позволяет не только обнаружить карбонильные соединения, но и выделить альдегиды и кетоны, поскольку сульфопроизводное выпадает в осадок в избытке гидросульфита.
3. Взаимодействие со спиртами в присутствии каталитических количеств кислоты:
4. Присоединение реактива Гриньяра. Галогеноводороды при взаимодействии с магнием в растворе абсолютного диэтилового эфира образуют магнийорганическое соединение или реактивы Гриньяра:
`»R»-«X»+»Mg»->»R»-«Mg»-«X»`.
Присоединение реактивов Гриньяра к карбонильным соединениям с последующим гидролизом промежуточных алкоголятов магния приводит к спиртам:
5. Присоединение воды. Гидратация оксосоединений – обратимая реакция. Устойчивость образующихся гидратов определяется величиной `delta+` на атоме углерода группы и её пространственным окружением. Так, формальдегид и трихлорацеталь гидратированы практически нацело, ацетальдегид – наполовину, а ацетон практически не гидратирован:
Окислительно-восстановительные реакции
1. Гидрирование (восстановление) карбонильных соединений (см. «Спирты», получение). В лабораторных условиях для восстановления используют `»LiAlH»_4`.
Гидрирование (восстановление) карбонильных соединений (см. «Спирты», получение). В лабораторных условиях для восстановления используют `»LiAlH»_4`.
2. Реакция «серебряного зеркала»:
$$\mathrm{R}-\mathrm{C}\mathrm{H}=\mathrm{O}+2[\mathrm{A}\mathrm{g}{\mathrm{N}\mathrm{H}}_{3}{}_{2}]\mathrm{O}\mathrm{H}\stackrel{\mathrm{t}°}{\to }{\mathrm{R}\mathrm{C}\mathrm{O}\mathrm{O}\mathrm{N}\mathrm{H}}_{4}+2\mathrm{A}\mathrm{g}\downarrow +3{\mathrm{N}\mathrm{H}}_{3}\uparrow +{\mathrm{H}}_{2}\mathrm{O}$$.
Выделяющееся серебро осаждается тонким слоем на стенках пробирки, образуя зеркальный налёт. Это – качественная реакция на альдегиды (формальдегид в этой реакции окисляется до `»CO»_2`). Раньше эту реакцию использовали для изготовления зеркал, ёлочных игрушек.
3. Окисление гидроксидом меди (II) также является качественной реакцией на альдегиды. При нагревании свежеосаждённого `»Cu»(«OH»)_2` вначале образуется жёлтый осадок `»СuOH»`, который разлагается с образованием оксида меди (I) красного цвета:
4. Окисление альдегидов раствором перманганата калия:
Окисление альдегидов раствором перманганата калия:
а) в кислой среде:
б) в щелочной среде:
в) в нейтральной среде:
Реакции поликонденсации и полимеризации
1. Реакции полимеризации характерны для низших альдегидов:
$$ {\mathrm{nH}}_{2}\mathrm{CO}\stackrel{\mathrm{кат}}{\to }[-{\mathrm{CH}}_{2}-\mathrm{O}-{]}_{\mathrm{n}}$$
В результате реакции получается твёрдое вещество – пара-формальдегид. Кетоны не подвергаются полимеризации.
2. Формальдегид вступает в реакцию поликонденсации с фенолом. В результате реакции каждая молекула формальдегида связывает между собой две молекулы фенола и происходит отщепление одной молекулы воды:
Процесс поликонденсации протекает с образованием линейного полимера, в котором молекулы формальдегида присоединяются в орто-положение:
Возможно образование и более сложных «сшитых» полимерных соединений.
20.8 Окисление альдегидов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 32959
На этой странице рассматриваются способы различения альдегидов и кетонов с использованием окислителей, таких как подкисленный раствор дихромата калия (VI), реактив Толленса, раствор Фелинга и раствор Бенедикта.
Почему альдегиды и кетоны ведут себя по-разному?
Вы помните, что разница между альдегидом и кетоном заключается в наличии атома водорода, присоединенного к двойной связи углерод-кислород в альдегиде. В кетонах нет такого водорода.
Присутствие этого атома водорода делает альдегиды очень легко окисляемыми. Или, другими словами, они являются сильными восстановителями. Однако, поскольку кетоны не имеют именно этого атома водорода, они устойчивы к окислению, и только очень сильные окислители, такие как раствор манганата калия (VII) (раствор перманганата калия), окисляют кетоны. Однако делают они это разрушительным образом, разрывая углерод-углеродные связи.
Если вы избегаете использования этих мощных окислителей, вы можете легко отличить альдегид от кетона. Альдегиды легко окисляются всевозможными окислителями, а кетоны — нет.
Что образуется при окислении альдегидов?
Зависит от того, в кислых или щелочных условиях протекает реакция.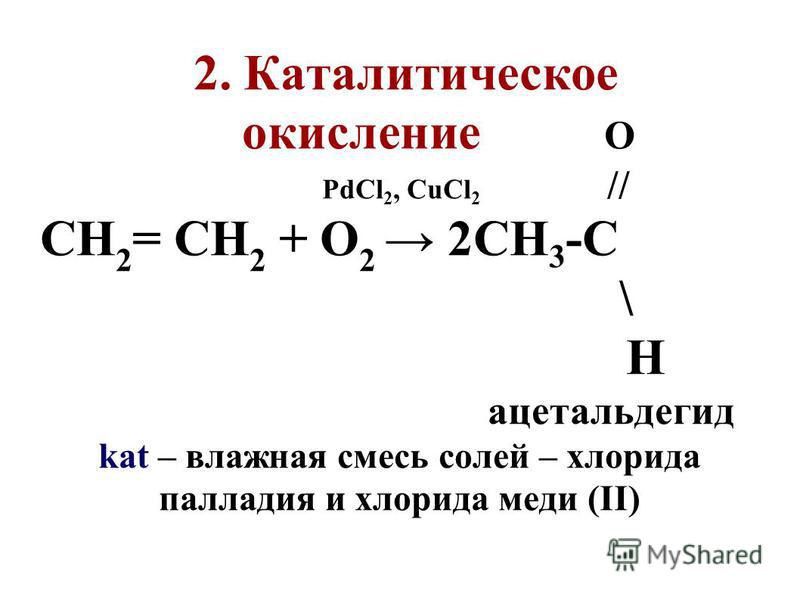 В кислых условиях альдегид окисляется до карбоновой кислоты. В щелочных условиях он не мог образовываться, потому что вступал в реакцию со щелочью. Вместо этого образуется соль. 9-\]
В кислых условиях альдегид окисляется до карбоновой кислоты. В щелочных условиях он не мог образовываться, потому что вступал в реакцию со щелочью. Вместо этого образуется соль. 9-\]
Затем эти полууравнения объединяются с полууравнениями любого окислителя, который вы используете. Примеры подробно приведены ниже.
Конкретные примеры
В каждом из следующих примеров мы предполагаем, что вы знаете, что у вас есть альдегид или кетон. Есть много других вещей, которые также могут дать положительный результат. Предполагая, что вы знаете, что это должно быть одно или другое, в каждом случае кетон ничего не делает. Только альдегид дает положительный результат.
Использование подкисленного раствора дихромата(VI) калия
Небольшое количество раствора дихромата(VI) калия подкисляют разбавленной серной кислотой и добавляют несколько капель альдегида или кетона. Если на морозе ничего не происходит, смесь пару минут осторожно прогревают — например, в стакане с горячей водой.

 К реагенту добавляют несколько капель альдегида или кетона и смесь осторожно нагревают на водяной бане в течение нескольких минут.
К реагенту добавляют несколько капель альдегида или кетона и смесь осторожно нагревают на водяной бане в течение нескольких минут.
 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.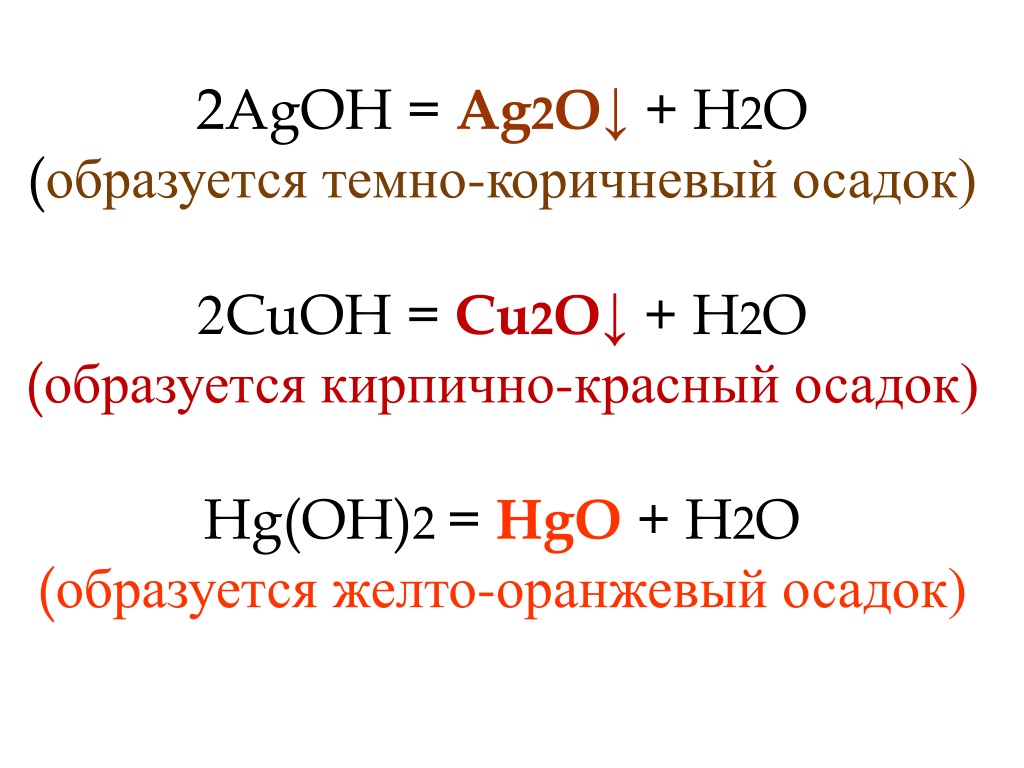 2 + 2CH 2 =CH 2 → 2CH 3 CHO
2 + 2CH 2 =CH 2 → 2CH 3 CHO
Leave A Comment