составьте уравнения реакций при помощи которых можно осуществить следующие превращения C — Ch5 — Ch4Cl — C2H6
Последние вопросы
Химия
12 минут назад
Выберите два внешних воздействия, которые приводят к увеличению скорости реакции кислорода с сульфидом цинка.Химия
52 минут назад
Помогите по химииХимия
58 минут назад
СРОЧНО ХЕЛП!!! с решениемХимия
1 час назад
Химия, первый курс, помогите пожалуйста решить задачу, или найти ответы(5 задача)Химия
1 час назад
ХИМИЯ!!!!! Помогите решить уравнениеХимия
1 час назад
!!!!!ПОМОГИТЕ СРОЧНО !!!!!!!Химия
1 час назад
Даю 30 балів! До 12 г суміші міді й магнію додали достатню кількість розчину етанової кислоти . Ви ділилось 0,4 моль газу .Обчисліть масу міді в суміші
Ви ділилось 0,4 моль газу .Обчисліть масу міді в сумішіХимия
2 часа назад
Составить Цепочку превращения. Химия… Помогите, очень срочно, пожалуйстаХимия
2 часа назад
Составьте цепочку превращений на основании описания химических реакций.
Кусочек алюминия сожгли в кислороде, получившийся продукт растворили в азотной кислоте,
затем к полученному раствору добавили раствор щёлочи до образования осадка. Полученный
осадок отделили и прокалили.
→ Al2O3 Al2O3 Al → Al(OH)3 → → Al(NO3)3
Нужно составить цепочку из того, что есть выше…
Дописывать ничего не нужно
Химия
2 часа назад
Укажите вещества, с которыми будет взаимодействовать раствор хлорида железа (II).

Na2SO4
h3SiO3
KOH
Zn
Na3PO4
Hg
AgNO3
h3O
CO2
Срочно, пожалуйста
2 часа назад
СРОЧНО! Який об’єм водню виділиться при взаємодії 5,4 г алюмінію з 255,5 г 10% розчином хлоридної кислотиХимия
2 часа назад
1. Як називається функціональна група органічних кислот, 2. Як називаються органічні кислоти, що містять карбоксильн групу? 3. Який агрегатний стан оцтової кислоти? А який вищих карбово вих кислот, що містять 15 і більше атомів Карбону, 4. Чому під час дії натрієм на оцтову кислоту виділяється г Який? 5. Який газ виділяється під час дії оцтової кислоти на соду, 6. Де застосовують оцтову кислоту?Химия
3 часа назад
Помогите пожалуйста с задачей по химииХимия
4 часа назад
Sio2-> Si -> Mg2SiХимия
4 часа назад
Определите оксид неметалла равный массе кислорода пж
Все предметы
Выберите язык и регион
English
United States
Polski
Polska
Português
Brasil
English
India
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
How much to ban the user?
1 hour 1 day 100 years
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
Другие ответы
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
h3S + h3SO4 = SO2 + S + h3O МОЖНО ОВР
Высота правильной треугольной пирамиды равна a корень из 3
,
радиус окружности, описанной около е основания, 2a. Найдите:
а)0 апофему пирамиды;
б)0 угол
Найдите:
а)0 апофему пирамиды;
б)0 угол
Решено
реагирует ли уксусная кислота с гидроксидом меди (2)? Если реагирует, то какие получаются продукты реакции? Объясните пожалуйста.
Решено
Mg + HNO3(разб.) = ? Написать ОВР :
Напишите изомеры пентановой кислоты изомеры пентаналя
Пользуйтесь нашим приложением
5.1: Написание и балансировка химических уравнений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 217270
Развитие навыков
- Получение химических уравнений из повествовательных описаний химических реакций.

- Написать и сбалансировать химические уравнения
Видео \(\PageIndex{1}\) : Введение в написание химических уравнений.
Предыдущий блок представил использование символов элементов для представления отдельных атомов. Когда атомы приобретают или теряют электроны, образуя ионы, или объединяются с другими атомами, образуя молекулы, их символы модифицируются или комбинируются для создания химических формул, которые должным образом представляют эти виды. Расширение этого символизма для представления как идентичности, так и относительных количеств веществ, претерпевающих химические (или физические) изменения, требует написания и балансировки химического уравнения. Рассмотрим в качестве примера реакцию между одной молекулой метана (CH 4 ) и двух двухатомных молекул кислорода (O 2 ) для получения одной молекулы двуокиси углерода (CO 2 ) и двух молекул воды (H 2 O).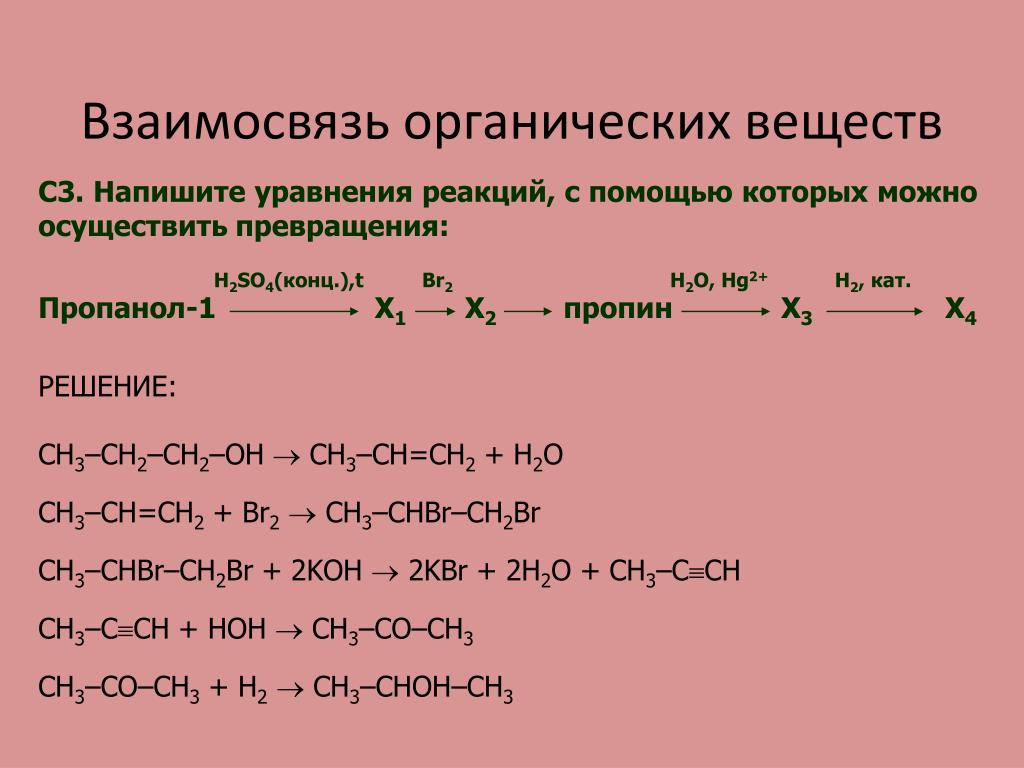 Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка \(\PageIndex{1}\), а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Химическое уравнение, представляющее этот процесс, представлено в верхней половине рисунка \(\PageIndex{1}\), а молекулярные модели, заполняющие пространство, показаны в нижней половине рисунка.
Рисунок \(\PageIndex{1}\) : Реакция между метаном и кислородом с образованием углекислого газа и воды (показана внизу) может быть представлена химическим уравнением с использованием формул (вверху).
Этот пример иллюстрирует основные аспекты любого химического уравнения:
- Вещества, вступающие в реакцию, называются реагентами, и их формулы помещаются в левой части уравнения.
- Вещества, образующиеся в результате реакции, называются продуктами, а их формулы помещаются в правой части уравнения.
- Знаки плюс (+) разделяют отдельные формулы реагентов и продуктов, а стрелка (⟶) разделяет реагенты и продукты (левую и правую) части уравнения.
- Относительное количество видов реагентов и продуктов представлено коэффициентами (числа расположены непосредственно слева от каждой формулы).
 Коэффициент 1 обычно опускается.
Коэффициент 1 обычно опускается.
Общепринятой практикой является использование наименьших возможных целочисленных коэффициентов в химическом уравнении, как это сделано в этом примере. Заметьте, однако, что эти коэффициенты представляют относительных числа реагентов и продуктов, и, следовательно, их можно правильно интерпретировать как отношения. Метан и кислород реагируют с образованием углекислого газа и воды в соотношении 1:2:1:2. Это соотношение выполняется, если числа этих молекул соответственно равны 1-2-1-2, или 2-4-2-4, или 3-6-3-6 и т. д. (Рисунок \(\PageIndex{ 2}\)). Точно так же эти коэффициенты могут быть интерпретированы по отношению к любой единице количества (числа), и поэтому это уравнение может быть правильно прочитано многими способами, в том числе:
- Одна молекула метана и две молекулы кислорода реагируют, образуя одну молекулу углекислого газа и две молекулы воды.
- Одна дюжина молекул метана и две дюжины молекул кислорода реагируют, образуя одну дюжину молекул углекислого газа и две дюжины молекул воды.

- Один моль молекул метана и 2 моля молекул кислорода реагируют с выходом 1 моль молекул углекислого газа и 2 моля молекул воды.
Рисунок \(\PageIndex{2}\) : Независимо от абсолютного числа вовлеченных молекул отношения между количеством молекул каждого вида, которые реагируют (реагенты), и молекулами каждого вида, которые образуются ( продукты) одинаковы и даны в химическом уравнении.
Уравнения баланса
Видео \(\PageIndex{2}\) : Введение в подсчет атомов в химическом уравнении.
Когда химическое уравнение сбалансировано, это означает, что равное количество атомов для каждого элемента, участвующего в реакции, представлено на стороне реагента и продукта. Это требование, которому должно удовлетворять уравнение, чтобы соответствовать закону сохранения материи. Это можно подтвердить, просто просуммировав количество атомов по обе стороны от стрелки и сравнив эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на индекс элемента в формуле. Если элемент встречается более чем в одной формуле данной части уравнения, количество атомов, представленных в каждой из них, должно быть вычислено, а затем сложено. Например, оба продукта реакции в примере, \(\ce{CO2}\) и \(\ce{h3O}\), содержат элемент кислород, поэтому количество атомов кислорода в продукте уравнения
Это можно подтвердить, просто просуммировав количество атомов по обе стороны от стрелки и сравнив эти суммы, чтобы убедиться, что они равны. Обратите внимание, что количество атомов для данного элемента рассчитывается путем умножения коэффициента любой формулы, содержащей этот элемент, на индекс элемента в формуле. Если элемент встречается более чем в одной формуле данной части уравнения, количество атомов, представленных в каждой из них, должно быть вычислено, а затем сложено. Например, оба продукта реакции в примере, \(\ce{CO2}\) и \(\ce{h3O}\), содержат элемент кислород, поэтому количество атомов кислорода в продукте уравнения
\[\left(1\: \cancel{\ce{CO_2} \: \text{молекула}} \times \dfrac{2\: \ce{O} \: \text{атомы}}{ \cancel {\ce{CO_2} \: \text{молекула}}}\right) + \left( \cancel{ \ce{2H_2O} \: \text{молекула} }\times \dfrac{1\: \ce{O }\: \text{атом}}{\cancel{ \ce{H_2O} \: \text{молекула}}}\right)=4\: \ce{O} \: \text{атомы}\]
Подтверждено, что уравнение реакции между метаном и кислородом с образованием углекислого газа и воды сбалансировано в соответствии с этим подходом, как показано здесь:
\[\ce{Ch5 +2O2\rightarrow CO2 +2h3O}\]
Сбалансированное химическое уравнение часто может быть получено из качественного описания некоторой химической реакции с помощью довольно простого подхода, известного как уравновешивание путем проверки. Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированное химическое уравнение:
Рассмотрим в качестве примера разложение воды с образованием молекулярного водорода и кислорода. Этот процесс качественно представлен несбалансированное химическое уравнение:
\[\ce{h3O \rightarrow h3 + O2} \tag{несбалансированный}\]
Сравнение количества атомов H и O по обе стороны этого уравнения подтверждает его дисбаланс:
Количество атомов H в сторонах реагента и продукта уравнения одинаково, а количество атомов O – нет. Для достижения баланса коэффициента уравнения могут быть изменены по мере необходимости. Имейте в виду, конечно, что 9Индексы формулы 0034 частично определяют идентичность вещества, поэтому их нельзя изменить без изменения качественного смысла уравнения. Например, изменение формулы реагента с H 2 O на H 2 O 2 позволило бы сбалансировать количество атомов, но это также изменило бы идентичность реагента (теперь это перекись водорода, а не вода). Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2,
Например, изменение формулы реагента с H 2 O на H 2 O 2 позволило бы сбалансировать количество атомов, но это также изменило бы идентичность реагента (теперь это перекись водорода, а не вода). Баланс атомов O может быть достигнут путем изменения коэффициента для H 2 O на 2,
\[\ce{2h3O \rightarrow h3 + O2} \tag{несбалансированный}\]
Баланс атомов H был нарушен этим изменением, но его легко восстановить, изменив коэффициент для произведения H 2 на 2.
\[\ce{2H_2O \rightarrow 2h3 + O2} \tag{сбалансированный}\]
| Элемент | Реагенты | Продукты | Сбалансированный? |
|---|---|---|---|
| Н | 2 × 2 = 4 | 2 × 2 = 2 | 4 = 4, да |
| О | 2 × 1 = 2 | 1 × 2 = 2 | 2 = 2, да |
Эти коэффициенты дают одинаковое количество атомов H и O на стороне реагента и продукта, поэтому сбалансированное уравнение выглядит так:
\[\ce{2H_2O \rightarrow 2H_2 + O_2}\]
youtube.com/embed/0HaUz8gt1Oo?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Видео \(\PageIndex{3}\) : Обзор балансировки химических уравнений с дополнительными практическими задачами.
Пример \(\PageIndex{1}\): Уравновешивание химических уравнений
Напишите сбалансированное уравнение реакции молекулярного азота (N 2 ) и кислорода (O 2 ) с образованием пятиокиси азота.
Раствор
Сначала напишите уравнение несбалансированности.
\[\ce{N_2 + O_2 \rightarrow N_2O_5} \tag{несбалансированный}\]
Затем подсчитайте количество атомов каждого типа, присутствующих в несбалансированном уравнении.
Хотя азот сбалансирован, необходимо изменить коэффициенты, чтобы сбалансировать количество атомов кислорода.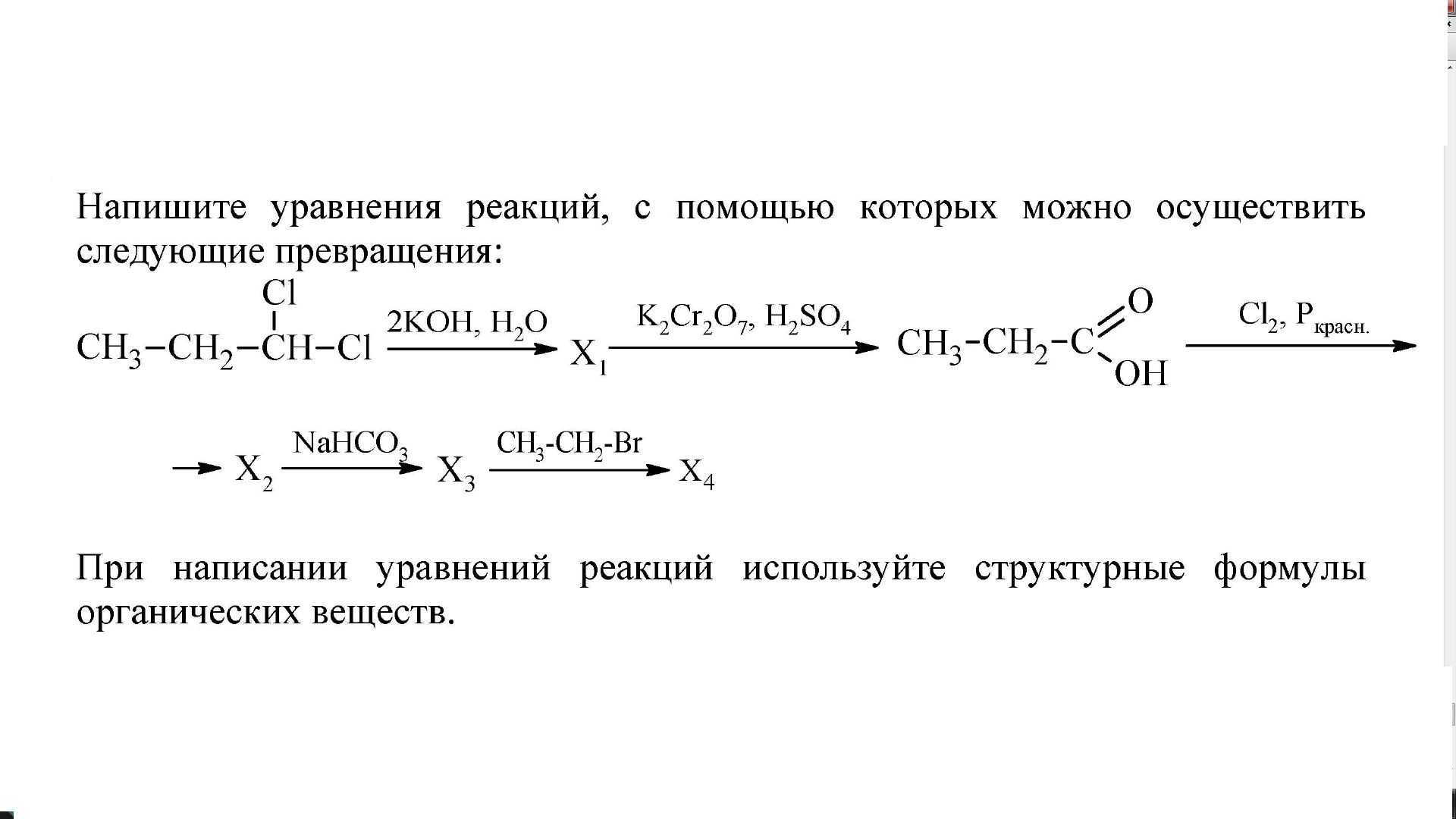 Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O нижние индексы в этих двух формулах).
Чтобы сбалансировать количество атомов кислорода, разумной первой попыткой было бы изменить коэффициенты для O 2 и N 2 O 5 на целые числа, которые дадут 10 атомов O (наименьшее общее кратное для атома O нижние индексы в этих двух формулах).
\[\ce{N_2 + 5 O2 \rightarrow 2 N2O5} \tag{несбалансированный}\]
Баланс атомов азота был нарушен этим изменением; восстанавливается изменением коэффициента для реагента N 2 на 2.
\[\ce{2N_2 + 5O_2\стрелка вправо 2N_2O_5}\]
Количество атомов N и O по обе стороны уравнения теперь одинаково, и поэтому уравнение сбалансировано.
Упражнение \(\PageIndex{1}\)
Напишите сбалансированное уравнение разложения нитрата аммония с образованием молекулярного азота, молекулярного кислорода и воды. (Подсказка: уравновешивайте кислород последним, поскольку он присутствует более чем в одной молекуле в правой части уравнения.)
- Ответ
\[\ce{2Nh5NO3 \rightarrow 2N2 + O2 + 4h3O} \номер\]
Иногда удобно использовать дроби вместо целых чисел в качестве промежуточных коэффициентов в процессе балансировки химического уравнения. Когда баланс достигнут, все коэффициенты уравнения можно затем умножить на целое число, чтобы преобразовать дробные коэффициенты в целые числа, не нарушая баланса атомов. Например, рассмотрим реакцию этана (C 2 H 6 ) с кислородом для получения H 2 O и CO 2 , представленного несбалансированным уравнением:
\[\ce{C_2H_6 + O_2 \rightarrow H_2O + CO_2} \tag{несбалансированный}\]
Следуя обычному подходу к проверке, можно сначала сбалансировать атомы C и H, изменив коэффициенты для двух видов продуктов, как показано:
\[\ce{C_2H_6 + O_2 \rightarrow 3H_2O + 2CO_2} \tag{несбалансированный}\]
Это приводит к семи атомам O на стороне продукта уравнения, нечетное число — целочисленный коэффициент не может использоваться с O 2 реагент, чтобы получить нечетное число, поэтому вместо него используется дробный коэффициент \(\ce{7/2}\), чтобы получить предварительное сбалансированное уравнение:
\[\ce{C2H6 + 7/2 O2\rightarrow 3h3O + 2CO2} \номер\]
Обычное сбалансированное уравнение с целыми коэффициентами получается путем умножения каждого коэффициента на 2:
\[\ce{2C2H6 +7O2\rightarrow 6h3O + 4CO2}\]
Наконец, что касается сбалансированных уравнений, напомним, что соглашение диктует использование наименьшие целочисленные коэффициенты . Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
Хотя уравнение реакции между молекулярным азотом и молекулярным водородом с образованием аммиака действительно сбалансировано,
\[\ce{3N2 +9h3\стрелка вправо 6Nh4}\]
коэффициенты не являются наименьшими возможными целыми числами, представляющими относительное количество молекул реагента и продукта. Разделив каждый коэффициент на наибольший общий делитель, 3, мы получим предпочтительное уравнение:
.\[\ce{N2 + 3h3\стрелка вправо 2Nh4}\]
Phet Simulation
Используйте этот интерактивный учебник для дополнительной практики балансировки уравнений.
Символы состояний в химических уравнениях
Видео \(\PageIndex{4}\) : Как использовать символы состояний для предоставления дополнительной информации в ваших химических уравнениях.
Физические состояния реагентов и продуктов в химических уравнениях очень часто обозначаются аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водные растворы , введенные в предыдущей главе). Эти обозначения проиллюстрированы в примере уравнения здесь:
Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водные растворы , введенные в предыдущей главе). Эти обозначения проиллюстрированы в примере уравнения здесь:
\[\ce{2Na (т) + 2h3O (л) \rightarrow 2NaOH (водн.) + h3(г)} \]
Это уравнение представляет реакцию, которая имеет место при помещении металлического натрия в воду. Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистом виде, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначаются словом или символом над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена заглавной греческой буквой дельта (Δ) над стрелкой.
\[\ce{CaCO3}(s)\xrightarrow{\:\Delta\:} \ce{CaO}(s)+\ce{CO2}(g)\]
Другие примеры этих особых условий будут будут встречаться более подробно в более поздних единицах.
Ключевые понятия и резюме
Видео \(\PageIndex{5}\) : Обзор балансировки химических уравнений в контексте стехиометрии.
Химические уравнения представляют собой символическое представление химических и физических изменений. Формулы для веществ, претерпевающих изменение (реагентов), и веществ, образующихся при изменении (продуктов), разделены стрелкой, и им предшествуют целые коэффициенты, обозначающие их относительные номера. Сбалансированные уравнения — это те уравнения, коэффициенты которых приводят к равному количеству атомов для каждого элемента в реагентах и продуктах. Химические реакции в водном растворе, в которых участвуют ионные реагенты или продукты, могут быть более реалистично представлены полными ионными уравнениями и, более кратко, сводными ионными уравнениями.
Глоссарий
- сбалансированное уравнение
- химическое уравнение с равным числом атомов для каждого элемента в реагенте и продукте
- химическое уравнение
- символическое представление химической реакции
- коэффициент
- число, помещаемое перед символами или формулами в химическом уравнении для обозначения их относительного количества
- молекулярное уравнение
- химическое уравнение, в котором все реагенты и продукты представлены как нейтральные вещества
- продукт
- вещество, образовавшееся в результате химического или физического изменения; показано справа от стрелки в химическом уравнении
- реагент
- вещество, подвергающееся химическому или физическому изменению; показано слева от стрелки в химическом уравнении
Авторы
Пол Флауэрс (Университет Северной Каролины, Пемброк), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).- Аделаида Кларк, Орегонский технологический институт
- Fuse School, открытый бесплатный образовательный ресурс, в соответствии с лицензией Creative Commons: Attribution-NonCommercial CC BY-NC (см. лицензионный договор: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry, ссылки и лицензии на изображения для этого эпизода можно найти в документе Google здесь: http://dft.ba/-51j; Crash Course — это подразделение Complexly, и видео можно бесплатно транслировать в образовательных целях.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- источник[1]-хим-98771
- источник[2]-chem-98771
3.9: Энергия химических реакций
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17002
- Сюзанна Ваким и Мандип Грюал
- Колледж Бьютт
Медленное горение
Эти старые железные цепи выделяют небольшое количество тепла при ржавчине. Ржавление железа — это химический процесс. Это происходит, когда железо и кислород вступают в химическую реакцию, похожую на горение или горение. Химическая реакция, которая происходит, когда что-то горит, очевидно, выделяет энергию. Вы можете чувствовать жар, и вы можете увидеть свет пламени. Ржавление железа — гораздо более медленный процесс, но он все же выделяет энергию. Просто он высвобождает энергию так медленно, что вы не можете обнаружить изменение температуры.
Химическая реакция, которая происходит, когда что-то горит, очевидно, выделяет энергию. Вы можете чувствовать жар, и вы можете увидеть свет пламени. Ржавление железа — гораздо более медленный процесс, но он все же выделяет энергию. Просто он высвобождает энергию так медленно, что вы не можете обнаружить изменение температуры.
Что такое химическая реакция?
А химическая реакция — это процесс, в ходе которого одни химические вещества превращаются в другие. Вещество, которое запускает химическую реакцию, называется реагентом , , а вещество, образующееся в результате химической реакции, называется продуктом . В ходе реакции реагенты расходуются на создание продуктов.
Другим примером химической реакции является горение газообразного метана, показанное на рисунке \(\PageIndex{2}\). В этой химической реакции реагентами являются метан (Ch5) и кислород (O2), а продуктами являются углекислый газ (CO2) и вода (h3O).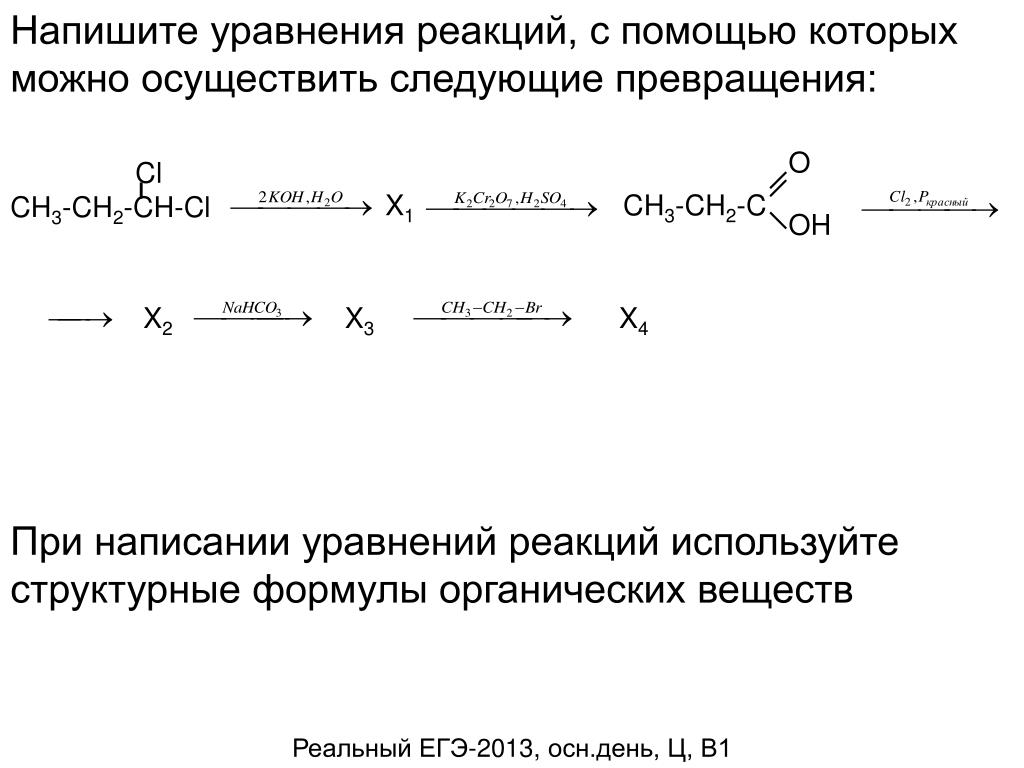 Как показывает этот пример, химическая реакция включает разрыв и образование химических связей. Химические связи – это силы, удерживающие вместе атомы молекулы. Связи возникают, когда атомы разделяют электроны. Например, при горении метана разрываются связи внутри молекул метана и кислорода, а в молекулах углекислого газа и воды образуются новые связи.
Как показывает этот пример, химическая реакция включает разрыв и образование химических связей. Химические связи – это силы, удерживающие вместе атомы молекулы. Связи возникают, когда атомы разделяют электроны. Например, при горении метана разрываются связи внутри молекул метана и кислорода, а в молекулах углекислого газа и воды образуются новые связи.
Химические уравнения
Химические реакции могут быть представлены химическими уравнениями. Химическое уравнение — это символический способ показать, что происходит во время химической реакции. Например, горение метана можно представить химическим уравнением:
\[\ce{CH_4 + 2O_2 \rightarrow CO_2 + 2 H_2O}\]
Стрелка в химическом уравнении отделяет реагенты от продуктов и показывает направление, в котором протекает реакция. Если бы реакция могла происходить и в противоположном направлении, использовались бы две стрелки, указывающие в противоположных направлениях. Цифра 2 перед О 2 и H 2 O показывает, что в реакции участвуют две молекулы кислорода и две молекулы воды. Если задействована только одна молекула, перед химическим символом не ставится число.
Цифра 2 перед О 2 и H 2 O показывает, что в реакции участвуют две молекулы кислорода и две молекулы воды. Если задействована только одна молекула, перед химическим символом не ставится число.
Роль энергии в химических реакциях
Ржавление или горение вещества являются типичными примерами химических изменений. Химические изменения включают химические реакции, в которых некоторые вещества, называемые реагентами, изменяются на молекулярном уровне с образованием новых веществ, называемых продуктами. Все химические реакции требуют энергии. Однако не все химические реакции выделяют энергию, как при ржавчине и горении. В некоторых химических реакциях энергия поглощается, а не выделяется.
Экзергонические реакции
Химическая реакция, которая высвобождает энергию, называется экзергонической реакцией . Этот тип реакции может быть представлен общим химическим уравнением:
\[\mathrm{Реагенты \rightarrow Продукты + Энергия}\]
Помимо ржавчины и горения, примеры экзотермических реакций включают соединение хлора с натрием с образованием поваренной соли. При разложении органического вещества также выделяется энергия из-за экзергонических реакций. Иногда холодным утром из-за этих химических реакций из компостной кучи поднимается пар (см. рис. \(\PageIndex{3}\)). Экзергонические химические реакции происходят и в клетках живых существ. В химическом процессе, похожем на горение, называемом клеточным дыханием, сахарная глюкоза «сгорает», чтобы обеспечить клетки энергией.
При разложении органического вещества также выделяется энергия из-за экзергонических реакций. Иногда холодным утром из-за этих химических реакций из компостной кучи поднимается пар (см. рис. \(\PageIndex{3}\)). Экзергонические химические реакции происходят и в клетках живых существ. В химическом процессе, похожем на горение, называемом клеточным дыханием, сахарная глюкоза «сгорает», чтобы обеспечить клетки энергией.
Эндергонические реакции
Химическая реакция, которая поглощает энергию, называется эндергонической реакцией . Этот тип реакции также может быть представлен общим химическим уравнением:
\[\mathrm{Реагенты + Энергия \rightarrow Продукты}\]
Использовали ли вы когда-нибудь химический холодный компресс, как на картинке ниже? Пачка остывает из-за эндергонической реакции. Когда трубка внутри упаковки разрывается, выделяется химическое вещество, которое вступает в реакцию с водой внутри упаковки. Эта реакция поглощает тепловую энергию и быстро охлаждает содержимое упаковки.
Когда трубка внутри упаковки разрывается, выделяется химическое вещество, которое вступает в реакцию с водой внутри упаковки. Эта реакция поглощает тепловую энергию и быстро охлаждает содержимое упаковки.
Многие другие химические процессы включают эндергонические реакции. Например, в большинстве случаев приготовления пищи и выпечки используется энергия для проведения химических реакций. Вы не можете испечь пирог или сварить яйцо без добавления тепловой энергии. Возможно, наиболее важные эндергонические реакции происходят во время фотосинтеза. Когда растения производят сахар путем фотосинтеза, они потребляют световую энергию для обеспечения необходимых эндергонических реакций. Сахар, который они производят, обеспечивает растения и практически все другие живые существа глюкозой для клеточного дыхания.
Энергия активации
Для запуска всех химических реакций требуется энергия. Даже реакции, которые высвобождают энергию, нуждаются в энергии, чтобы начаться. Энергия, необходимая для начала химической реакции, называется энергией активации . Энергия активации подобна толчку, который нужен ребенку, чтобы начать спускаться с горки на игровой площадке. Толчок дает ребенку достаточно энергии, чтобы начать двигаться, но как только он начинает двигаться, он продолжает двигаться, и его снова не подталкивают. Энергия активации показана на рисунке \(\PageIndex{5}\).
Энергия, необходимая для начала химической реакции, называется энергией активации . Энергия активации подобна толчку, который нужен ребенку, чтобы начать спускаться с горки на игровой площадке. Толчок дает ребенку достаточно энергии, чтобы начать двигаться, но как только он начинает двигаться, он продолжает двигаться, и его снова не подталкивают. Энергия активации показана на рисунке \(\PageIndex{5}\).
Почему для запуска всех химических реакций требуется энергия? Чтобы началась реакция, молекулы реагентов должны столкнуться друг с другом, поэтому они должны двигаться, а движение требует энергии. Когда молекулы реагентов сталкиваются, они могут отталкиваться друг от друга из-за межмолекулярных сил, раздвигающих их. Преодоление этих сил, чтобы молекулы могли собраться вместе и вступить в реакцию, также требует энергии.
Рисунок \(\PageIndex{5}\): На этой диаграмме энергии активации реагенты показаны слева, а продукты справа. Обратите внимание, что реагенты имеют более высокий энергетический уровень, чем продукты; так что эта реакция высвобождает энергию в целом. Но для запуска реакции требуется энергия — это энергия активации реакции.
Но для запуска реакции требуется энергия — это энергия активации реакции.Review
- Что такое химическая реакция?
- Определите реагенты и продукты химической реакции.
- Перечислите три примера обычных изменений, связанных с химическими реакциями.
- Дайте определение химической связи.
- Что такое химическое уравнение? Приведите пример.
- Наши клетки используют глюкозу (C 6 H 12 O 6 ) для получения энергии в результате химической реакции, называемой клеточным дыханием. В этой реакции шесть молекул кислорода (O 2 ) реагируют с одной молекулой глюкозы. Ответьте на следующие вопросы об этой реакции.
- Сколько атомов кислорода в одной молекуле глюкозы?
- Напишите, как будет выглядеть реагентная часть этого уравнения.
- Сколько всего атомов кислорода содержится в реагентах? Объясните, как вы рассчитали ответ.

- Сколько всего атомов кислорода содержится в продуктах? Можно ли ответить на этот вопрос, не зная, что это за продукты? Почему или почему нет?
- Ответьте на следующие вопросы относительно уравнения, которое вы видели выше: CH 4 + 2O 2 → CO 2 + 2H 2 O
- Может ли диоксид углерода (CO 2 ) превратиться в метан (CH 4 ) и кислород (O 2 ) в этой реакции? Почему или почему нет?
- Сколько молекул двуокиси углерода (CO 2 ) образуется в этой реакции?
- Является ли превращение жидкой воды в водяной пар химической реакцией? Почему или почему нет
- Почему рвутся связи в реагентах во время химической реакции?
- Сравните эндергонические и экзергонические химические реакции. Приведите пример каждого.
- Определить энергию активации.
- Объясните, почему для всех химических реакций требуется энергия активации.

- Тепло – это форма ____________.
- В какой реакции происходит подвод тепла к реагентам?
- В какой реакции выделяется тепло?
- Если бы к эндотермической реакции не добавлялась тепловая энергия, происходила бы эта реакция? Почему или почему нет?
- Если бы к экзотермической реакции не добавлялась тепловая энергия, происходила бы эта реакция? Почему или почему нет?
- Объясните, почему химический охлаждающий компресс кажется холодным при активации.
- Объясните, почему клеточное дыхание и фотосинтез «противоположны» друг другу.
- Объясните, как солнце косвенно дает энергию нашим клеткам.
Принадлежности
- Цепочка от Daplaza, лицензия CC BY-SA 3.0 через Wikimedia Commons
- Горелка газовой плиты Blue Flame от Federico Cardoner, лицензия CC BY 2.0 через Flickr
- Пропаривание компоста от Lucabon, CC BY-SA 4.0 через Wikimedia Commons
- Cooler pack от Julie Magro, лицензия CC BY 2.


 Ви ділилось 0,4 моль газу .Обчисліть масу міді в суміші
Ви ділилось 0,4 моль газу .Обчисліть масу міді в суміші
 .. — Учеба и наука
.. — Учеба и наука 03.19
03.19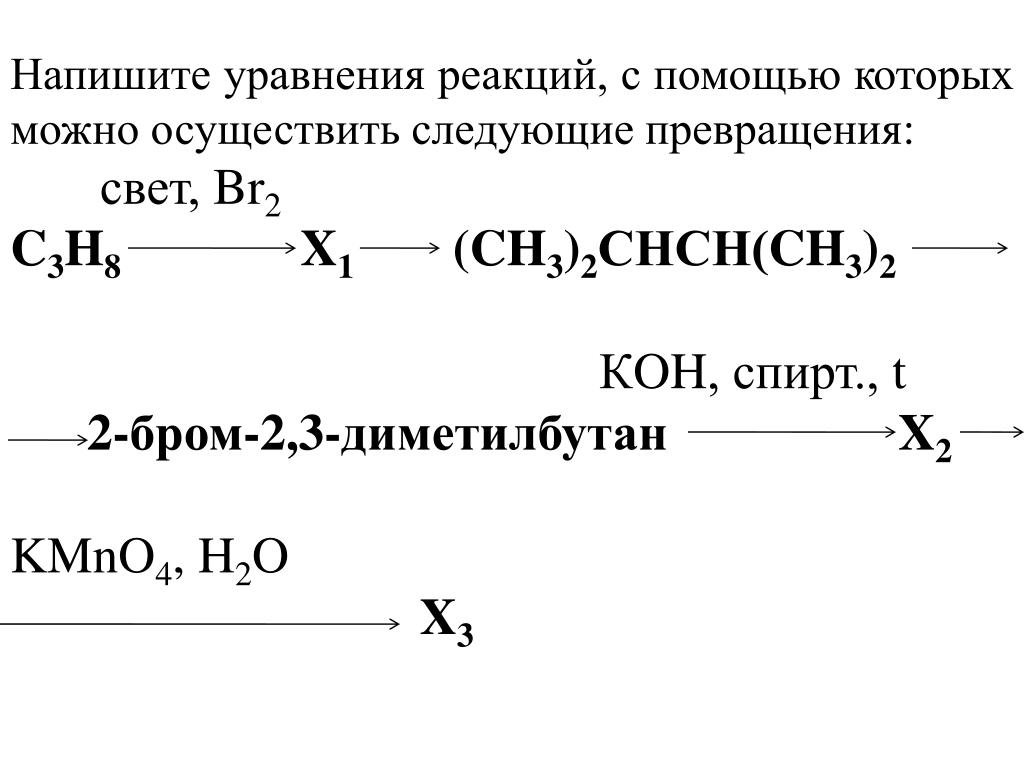 хлор на свету
хлор на свету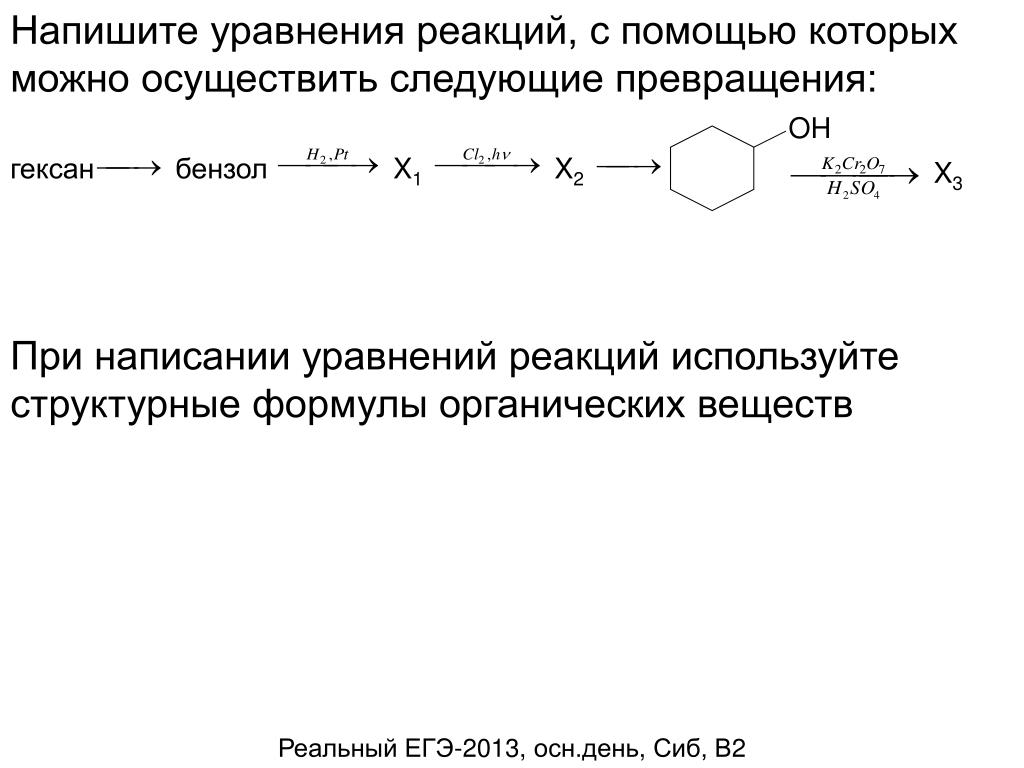
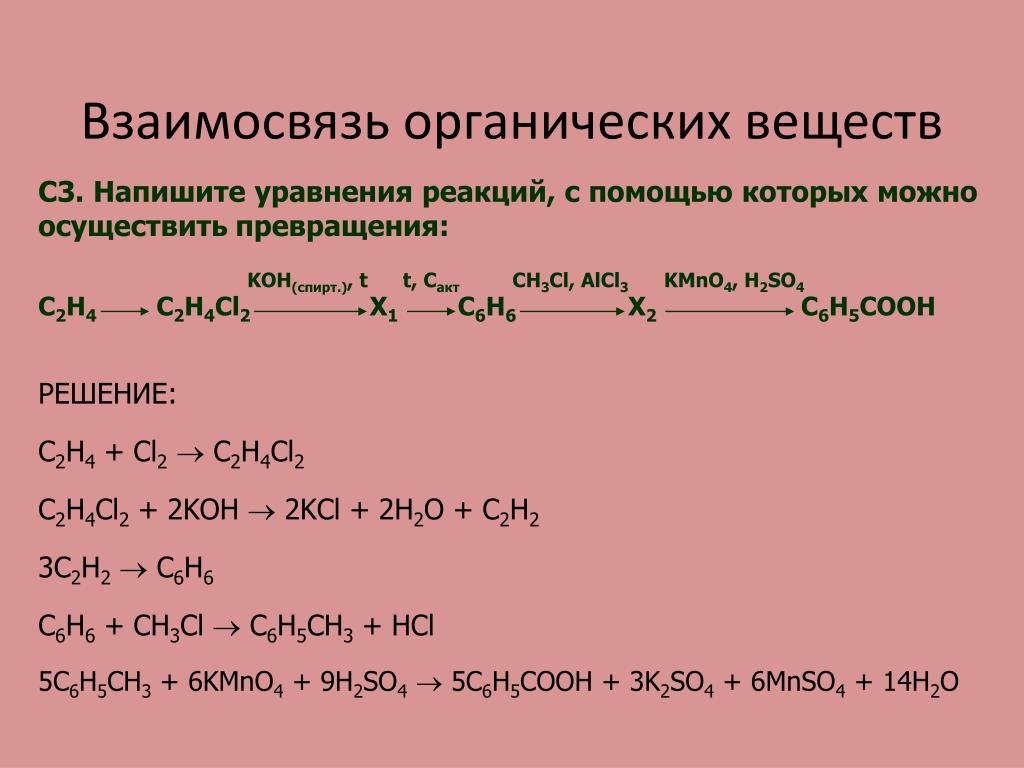 Коэффициент 1 обычно опускается.
Коэффициент 1 обычно опускается.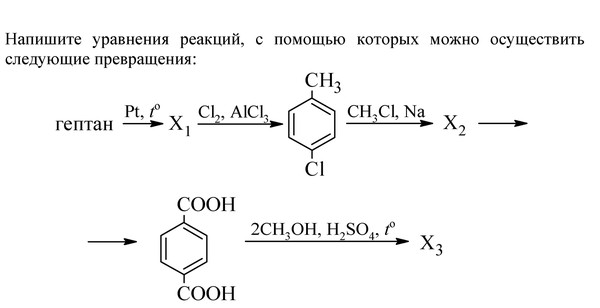
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…



Leave A Comment