Задание 3 ЕГЭ по химии 2023: теория и практика
Русский язык Математика (профиль) Математика (база) Обществознание История Биология Физика Химия Английский язык Информатика Литература
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
За это задание ты можешь получить 1 балл. На решение дается около 3 минут. Уровень сложности: базовый.
На решение дается около 3 минут. Уровень сложности: базовый.
Средний процент выполнения: 80.6%
Ответом к заданию 3 по химии может быть
Разбор сложных заданий в тг-канале
Посмотреть
Задачи для практики
Задача 1
1) O 2) N 3) S 4) C 5) As
Из числа указанных в ряду элементов выберите два элемента, которые образуют кислоты, в которых элементы имеют степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Решение
Кислоты мышьяка аналогичны кислотам азота из той же группы, кислород в кислотах всегда проявляет СО -2 (например, HNO3) а у азота в кислотах СО +5 (азотная) и +3 (азотистая), так как он в пятой группе. Сера находится в VI группе и проявляет степень окисления +4, кислота тоже имеется, сернистая ($H_2SO_3$), так что выбираем серу, а так же элемент IV группы, углерод ($H_2CO_3$).
Ответ: 34
Показать решение
Бесплатный интенсив
Задача 2
1) K 2) S 3) Na 4) Si 5) Se
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях имеют единственную степень окисления. Запишите в поле ответа номера выбранных элементов.
Решение
Единственную степень окисления (+1) в соединениях проявляют щелочные металлы. Среди представленных элементов щелочными металлами являются K и Na.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 3
1) Te 2) I 3) O 4) S 5) Sr
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления, равную +6. Запишите в поле ответа номера выбранных элементов.
Решение
Высшая степень окисления для элементов, находящихся в главных подгруппах, равна, как правило, номеру группы.
Вывод: правильные ответы — 1, 4.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 4
1) Sn 2) Pb 3) Ca 4) Ba 5) Sr
Из числа указанных в ряду элементов выберите два элемента, которые в высшем оксиде и летучем водородном соединении проявляют одинаковую валентность. Запишите в поле ответа номера выбранных элементов.
Решение
Валентность — число химических связей, которые атом образует в соединении. Для высших оксидов валентность равна высшей степени окисления. Высшая степень окисления для элементов главных подгрупп равна номеру группу (исключения — кислород (+2) и фтор (0)).
Вывод: правильные ответы (1, 2) найдены, оставшиеся варианты рассматривать не будем.
Ответ: 12
Показать решение
Бесплатный интенсив
Задача 5
1) Al 2) S 3) P 4) Cr 5) Si
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших оксидах равна +6. Запишите в поле ответа номера выбранных элементов.
Решение
Базовые знания. Для большинства элементов номер группы равен высшей степени окисления элемента.
Вывод: степень окисления +6 в соединениях могут иметь сера (находится в главной подгруппе VI группы, номер (2)) и хром (находится в побочной подгруппе VI группы, номер (4)).
Ответ:
Показать решение
Бесплатный интенсив
Задача 6
1) Se 2) O 3) K 4) Te 5) Cs
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять высшую степень окисления +6. {+6}O_3$).
{+6}O_3$).
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 7
1) F 2) Br 3) N 4) P 5) I
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять высшую степень окисления, равную +7. Запишите в поле ответа номера выбранных элементов.
Решение
Высшую степень окисления +7 способны проявлять элементы главной подгруппы VII группы таблицы Менделеева, то есть галогены. Но фтор имеет наивысшую среди элементов электроотрицательность и поэтому не проявляет степени окисления +7. Из представленных элементов её проявляют I и Br .
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 8
1) S 2) Na 3) He 4) Cl 5) Se
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степень окисления +1. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Решение
Степень +1 могут проявлять металлы, то есть натрий, а также хлор, например в соединении $Cl_2O$.
Ответ: 24
Показать решение
Бесплатный интенсив
Задача 9
1) Cu 2) Te 3) Se 4) Ag 5) O
Из числа указанных в ряду элементов выберите два элемента, которые образуют оксиды в степени окисления +1. Запишите в поле ответа номера выбранных элементов.
Решение
Оксиды в степени окисления +1 могут образовывать элементы нечетных групп — здесь это серебро и медь — элементы 1 группы побочной подгруппы.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 10
1) S 2) K 3) O 4) Te 5) Na
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления +6. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Решение
Высшую степень окисления +6 проявляют элементы главной подгруппы VI группы (халькогены), к ним относятся сера, кислород и теллур, но кислород имеет очень высокую электроотрицательность и поэтому его максимальная степень окисления +2.
Ответ: 14
Показать решение
Бесплатный интенсив
Задача 11
1) Se 2) Ca 3) Br 4) Sr 5) Ba
Из числа указанных в ряду элементов выберите два элемента, которые в соединении с водородом проявляют свою низшую степень окисления. Запишите в поле ответа номера выбранных элементов.
Решение
Соединения металлов с водородом – гидриды, в них металлы проявляют не низшую положительную степень окисления, а водород — отрицательную. А вот селен и бром образуют с водородом соединения, где проявляют низшую степень окисления.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 12
1) O 2) S 3) N 4) Te 5) P
Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять степени окисления +3 и +5. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Решение
Как правило, устойчивые СО элементов следуют через одну, поэтому СО +3 и +5 могут проявлять элементы, стоящие в пятой группе, то есть азот и фосфор.
Ответ: 35
Показать решение
Бесплатный интенсив
Задача 13
1) Ga 2) S 3) B 4) In 5) Se
Из числа указанных в ряду элементов выберите два элемента, которые образуют с водородом соединения со степенью окисления –2. Запишите в поле ответа номера выбранных элементов.
Решение
Отрицательную степень проявляют только неметаллы. Для бора нехарактерна степень окисления -2. Значит, сера и селен.
Ответ: 25
Показать решение
Бесплатный интенсив
Задача 14
1) Cs 2) He 3) Na 4) Ar 5) Ne
Из числа указанных в ряду элементов выберите два элемента, которые проявляют высшую степень окисления +1, и расположите их в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Решение
Высшую степень окисления +1 проявляют элементы главной подгруппы первой группы. Электроотрицательность в пределах группы увеличивается снизу-вверх, по мере удаления от цезия и приближения ко фтору. Правильный порядок следующий: цезий, натрий.
Ответ: 13
Показать решение
Бесплатный интенсив
Задача 15
1) Cl 2) Fe 3) I 4) Mn 5) Br
Из числа указанных в ряду элементов выберите два элемента, которые могут образовывать соединения в степени окисления +6. Запишите в поле ответа номера выбранных элементов.
Решение
Для галогенов не характерна степень окисления +6. Она встречается в соединениях железа и марганца, например, в ферратах и манганатах.
Ответ: 24
Показать решение
Задача 16
1) N 2) Be 3) B 4) Al 5) P
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях с донорно-акцепторной связью могут проявлять степень окисления –3, и расположите их в порядке уменьшения длины связи Э–Н. Запишите в поле ответа номера выбранных элементов.
Запишите в поле ответа номера выбранных элементов.
Решение
Отрицательную степень проявляют только неметаллы. Ищем их, это азот, бор и фосфор. Однако бор имеет электроотрицательность меньше водорода и проявляет в соединении с ним положительную степень окисления +3. Длина связи Э-Н увеличивается снизу вверх и слева направо в таблице Менделеева, поэтому сначала фосфор, а потом азот.
Ответ: 51
Показать решение
Бесплатный интенсив
Задача 17
1) N 2) Sb 3) P 4) O 5) S
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –2. Запишите в поле ответа номера выбранных элементов.
Решение
Низшая степень окисления неметаллов находится как разность номера их группы и восьми, то есть, чтобы она равнялась -2, неметалл должен находиться в -2 + 8 = 6-ой группе. В этой группе находятся кислород и сера.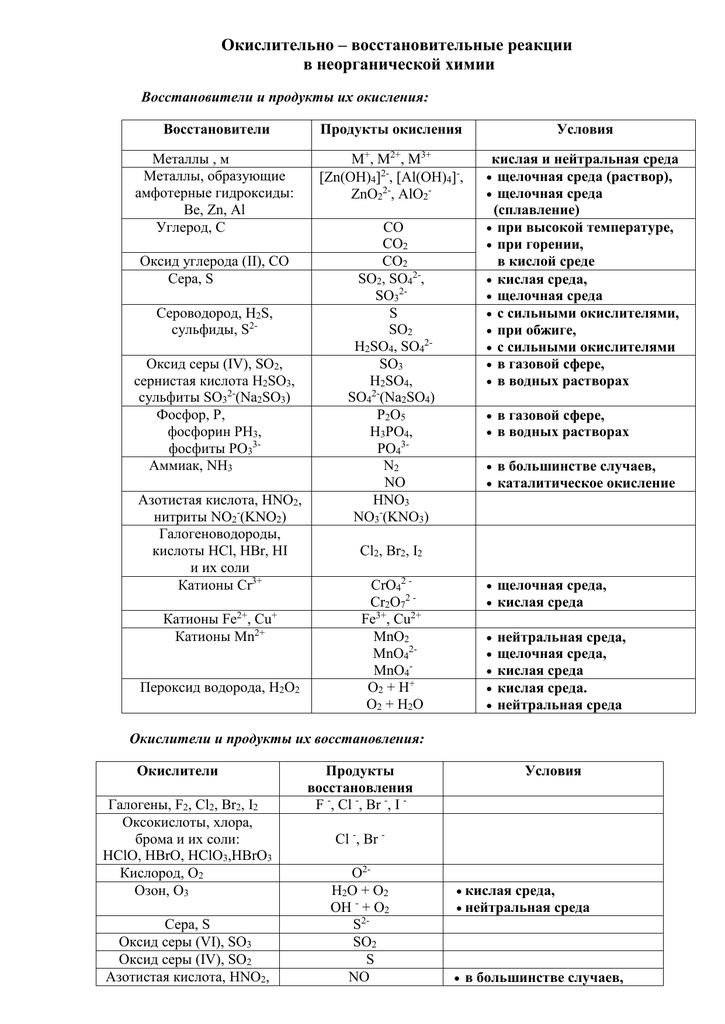
Ответ: 45
Показать решение
Бесплатный интенсив
Показать еще
Для доступа к решениям необходимо включить уведомления от группы Турбо в вк — это займет буквально 10 секунд. Никакого спама, только самое важное и полезное для тебя. Ты всегда можешь запретить уведомления.
Включить уведомления
Бесплатный интенсив по химии
3 огненных вебинара, домашние задания, беседа курса, личный кабинет, связь с преподавателем и многое другое.
Курс стартует 4 сентября. Бесплатный интенсив
Задание 29 на ЕГЭ по химии. Особенности, советы, рекомендации.
Оглавление:
- org/ListItem»>
Теоретические сведения.
- Перманганат калия как окислитель.
- Дихромат и хромат как окислители.
- Повышение степеней окисления хрома и марганца.
- Азотная кислота с металлами.
- Серная кислота с металлами.
- Диспропорционирование. org/ListItem»> Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
- Диспропорционирование оксида азота (IV) и солей.
- Активность металлов и неметаллов.
- Электрохимический ряд напряжений металлов.
- Особенности поведения некоторых окислителей и восстановителей.
- Необходимые навыки.
- Последовательность расстановки коэффициентов в уравнении.

- Возможные ошибки.
- Ответы и решения к заданиям с пояснениями.
Автор статьи — профессиональный репетитор О. В. Овчинникова.
Вторая часть на ЕГЭ по химии включает 6 заданий, и каждое из них требует развёрнутого ответа. Для сдачи экзамена на высокий балл потребуется научиться решать все. Первым идёт задание 29, где нужно составить окислительно-восстановительную реакцию, используя вещества из списка. Вот один из вариантов формулировки:
Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительновосстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
Это задание в последние годы заметно усложнили. Если ранее было достаточно найти любые два вещества, между которыми протекает окислительно-восстановительная реакция (ОВР), записать её и уравнять методом электронного баланса, то теперь необходимо также знать визуальные признаки взаимодействия этих веществ.
Нам подойдёт реакция, которая описана в условии, любую другую не зачтут. Из-за этого для выполнения данного задания на ЕГЭ требуется не только научиться уравнивать ОВР методом электронного баланса, проработать огромное количество материала, связанного с химическими свойствами веществ, но и запомнить, что происходит в процессе большинства из данных реакций внешне. Звучит страшно, но надо понимать: всё это пригодится вам и в других заданиях.
Приведённая ниже информация поможет понять, на что обратить внимание.
к оглавлению ▴
Теоретические сведения.
Перманганат калия как окислитель.
| + восстановители | |||
| Среда, куда переходит | в кислой среде | в нейтральной среде | в щелочной среде |
| Образующееся соединение марганца | (соль той кислоты, которая участвует в реакции) | Манганат | |
| Внешние признаки реакции | Обесцвечивание тёмно-фиолетового раствора | Обесцвечивание тёмно-фиолетового раствора и выпадение бурого осадка | Раствор из тёмно-фиолетового становится зелёным |
к оглавлению ▴
Дихромат и хромат как окислители.
| (кислая и нейтральная среда), (щелочная среда) + восстановители всегда получается | ||
| кислая среда | нейтральная среда | щелочная среда |
| Соли тех кислот, которые участвуют в реакции: | ||
| Раствор из оранжевого (жёлтого) становится зелёным | Выпадение зелёного осадка, обесцвечивание оранжевого раствора | |
к оглавлению ▴
Повышение степеней окисления хрома и марганца.
| + очень сильные окислители (всегда независимо от среды!) | ||
| , соли, гидроксокомплексы | + очень сильные окислители: а), кислородсодержащие соли хлора (в щелочном расплаве) б) (в щелочном растворе) | Щелочная среда: образуется хромат |
| , соли | + очень сильные окислители в кислой среде или | Кислая среда: образуется дихромат или дихромовая кислота |
| — оксид, гидроксид, соли | + очень сильные окислители: , кислородсодержащие соли хлора (в расплаве) | Щелочная среда: — манганат |
| — соли | + очень сильные окислители в кислой среде или | Кислая среда: — перманганат |
к оглавлению ▴
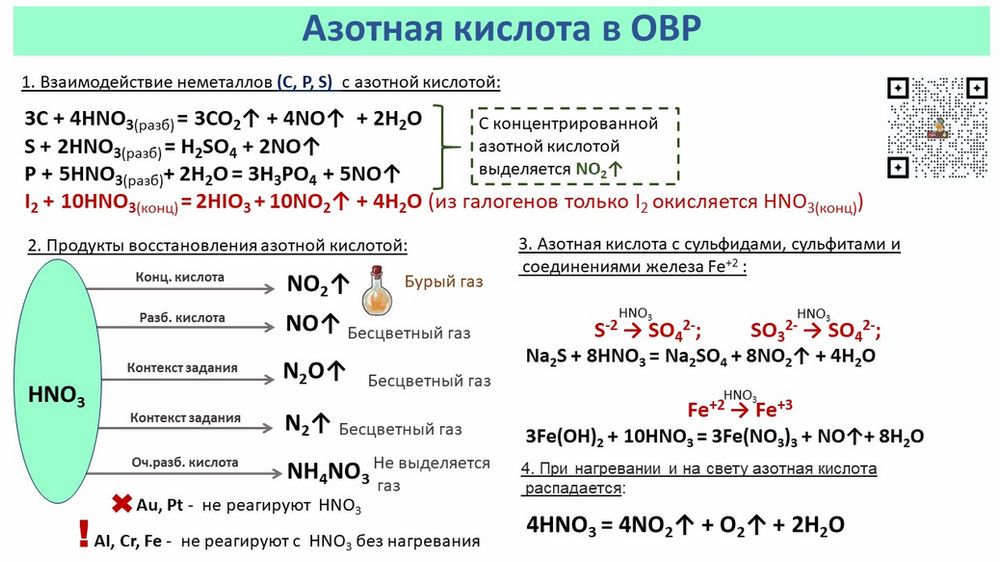
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
| Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот | ||||
| (чаще)/ | ||||
| Неактивные металлы (правее алюминия включительно) + конц. Кислота; Неметаллы + конц. Кислота | Активные металлы (левее Mg включительно) + конц. Кислота | Активные металлы (левее Mg включительно) + разб Кислота | Металлы от алюминия до железа включительно + разб. кислота | Неактивные металлы (правее кобальта включительно) + разб. Кислота |
| Пассивация: с холодной концентрированной азотной кислотой не реагируют: | ||||
| Не реагируют с азотной кислотой ни при какой концентрации: | ||||
к оглавлению ▴
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
| Неактивные металлы (правее железа) + конц. кислота Неметаллы + конц. Кислота | Щелочные металлы до магния включительно + концентрированная кислота. |
| Пассивация: с холодной концентрированной серной кислотой не реагируют: | |
| Не реагируют с серной кислотой ни при какой концентрации: | |
к оглавлению ▴
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
к оглавлению ▴
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).

| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит (реакция идёт при кипячении) | и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода | и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода | и |
к оглавлению ▴
Диспропорционирование оксида азота (IV) и солей.
| + вода 2 кислоты, азотная и азотистая + щелочь 2 соли, нитрат и нитрит | и | ||||
| и | ||||
| и |
к оглавлению ▴
Активность металлов и неметаллов.

Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
В заданиях ЕГЭ считается, что азот — более активный неметалл, чем хлор.
На самом деле по поводу того, кто имеет большую электроотрицательность – азот или хлор, давно идут споры. Мы придерживаемся позиции, что хлор в данном противостоянии побеждает – он находится в седьмой группе, до устойчивого состояния ему не хватает одного электрона, в отличие от азота, которому не хватает трёх.
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).
Таблица электроотрицательности (Х) некоторых атомов
Элемент | X | Элемент | X |
Cs | 0,79 | H | 2,20 |
K | 0,82 | C | 2,55 |
Na | 0,93 | S | 2,58 |
Li | 0,98 | I | 2,66 |
Ca | 1,0 | Br | 2,96 |
Mg | 1,31 | N | 3,04 |
Be | 1,57 | Cl | 3,16 |
Si | 1,90 | O | 3,44 |
B | 2,04 | F | 3,98 |
P | 2,19 |
к оглавлению ▴
Особенности поведения некоторых окислителей и восстановителей.

а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
к оглавлению ▴
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.Задание 1: Расставьте степени окисления в веществах:
- Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0.
Задание 2: Определите степень окисления атомов углерода, обведённых рамкой вместе с неуглеродным окружением:
2-метилбутен-2: –=
ацетон:
уксусная кислота: –
- Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример:
В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 3: Какой коэффициент нужно поставить перед и перед
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием?
- Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.
Задание 5: Определите среду и вещества в каждой реакции:
- Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк?
Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до .Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:
(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
- Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.

Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
к оглавлению ▴
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
к оглавлению ▴
Возможные ошибки.
- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:а) степени окисления в водородных соединениях неметаллов: фосфин — степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атома учтено;
в) аммиак и соли аммония — в них азот всегда имеет степень окисления ;
г) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления ;
д) пероксиды и надпероксиды — в них кислород не имеет степени окисления , бывает , а в — даже ;
е) двойные оксиды: — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.Задание 14: Допишите и уравняйте:
Задание 15: Допишите и уравняйте:
- Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.

Пример: в реакции свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
- Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
к оглавлению ▴
Ответы и решения к заданиям с пояснениями.
Задание 1:
Задание 2:
2-метилбутен-2: –=
ацетон:
уксусная кислота: –
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т. е. 6.
е. 6.
Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .
Задание 5:
Если среда щелочная, то фосфор будет существовать в виде соли — фосфата калия.
Если среда кислая, то фосфин переходит в фосфорную кислоту.
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:
Задание 7:
Электроны отдают два атома в молекуле алкена. Поэтому мы должны учесть общее количество отданных всей молекулой электронов:
(хол. р-р.)
Обратите внимание, что из 10 ионов калия 9 распределены между двумя солями, поэтому щелочи получится только одна молекула.
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.
Задание 12:
(пероксид — окислитель, т. к. восстановитель — )
к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
В молекуле из трех атомов железа только один имеет заряд . Он окислится в .
Задание 15:
Общий заряд частицы в надпероксиде калия равен . Поэтому он может отдать только .
Задание 16:
(водный раствор)
(щелочная среда)
(водный раствор)
(кислая среда)
Если вам нравятся наши материалы — записывайтесь на курсы подготовки к ЕГЭ по химии онлайн
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Задание 29 на ЕГЭ по химии. Особенности, советы, рекомендации.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Особенности, советы, рекомендации.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена: 07.04.2023
Химия 483
Химия 483 Квант Химия Осень 2009
Лектор Джеймс Ф. Харрисон
Комната 37 Химия
517-355-9715 доб. 295
Структура курса course_structure.pdf
Темы программы.pdf 9 0004
Лекция 1
Излучение черного тела 1
Черное тело излучение 2
Излучение черного тела 3
Фотоэлектрический 1
Характеристики фотоэффекта
Фотоэлектрический 2
Фотоэлектрический 3
Рабочие функции
Водород спектр атома 1
спектр линии атома водорода 2
спектр линии атома водорода 3
лекция 2
волновые числа
Balmer and Ry dberg
Бор теория атома водорода
ДеБройль длина волны
Де Бройля длина волны различных частиц
Домашнее задание 1
Глава 1, задачи 1,2,9,11,14,17,18,21,22,25,31,33
Математика Глава А; Комплексные числа: задачи 1,2,3,4,6
Глава 3
Уравнение Шрёдингера
Частица на прямой
Свойства решения Шредингера
Ожидаемые значения
Частица на окружности
Зависимое от времени уравнение Шредингера
Частица в 2D-коробка
Частица в 3D-коробке
Мы также обсудили
линейных оператора, собственные значения, коммутаторы
Следствие отделимости гамильтонианов
Домашнее задание 2
Глава 3 примеры 1,2,3,4,6
Задачи 1,3,4,6,7,17,18,24,26,27,33
Домашнее задание 3
Глава 4 примеры 1,2,3,7
задачи 1,5,9,10,14
Математика Глава D
Константы
Уравнения
Интегралы
Практический экзамен 1
Practice_exam_1_key
Верх ics для экзамена 1
Глава 1-все
Глава 3- разделы 1, 2, 3, 4, 5, 6, 7, 9
Глава 4- все
Глава 5-основная идея гармонического осциллятора
Частица в двумерный ящик
Частица на круг
Математика Глава A- Комплексные числа
Exam_1_key
Домашнее задание 4
Глава 5, Примеры 2,3,4 и 7
Задачи 7, 8, 12, 13, 14, 15, 29, 34, 35,37
Домашнее задание 5
Глава 6, Примеры 1, 4, 9, 10
Задачи 1, 9, 10, 17, 20, 21, 23, 25, 27, 29, 33, 35
Lecture_notes Глава 6
Домашнее задание 6
Глава 7, Все примеры
Проблемы 1, 2, 4, 6, 7, 9, 16, 17, 20, 21, 22, 23, 24, 26, 27
Математика Глава D Сферические координаты
Математика Глава E Детерминанты
Практический экзамен 2
Клавиша практического экзамена 2
Темы экзамена 2
Все главы 5, 6 и 7
Математические главы D и E
Формула для экзамена 2
Exam_2_key
900 04
Домашнее задание 7
Глава 8
Проблемы 2, 5, 7, 10, 18, 19, 20, 26, 27, 29, 30, 31, 32, 33, 34, 35, 36, 37, 47
Упражнения 1, 3, 4, 5, 6, 8, 9 10
Домашнее задание 8
Глава 9
Проблемы 4, 9, 12, 13, 14, 15, 16, 19, 23, 24, 27, 28, 34, 36, 37, 38, 39
Домашнее задание 9
Глава 10
Проблемы
1, 2, 3, 4, 5, 6, 8, 9, 11, 12, 13, 24, 27, 29, 30, 31, 32, 34, 36, 37, 38. 9Примечания к главе 9 _KEY
9Примечания к главе 9 _KEY
Конспект лекций по гибридизации
Конспект лекций по теории Хюккеля
Домашнее задание 10
Глава 12
Проблемы 3, 7, 8, 9, 10, 11, 12, 13, 16, 19, 20, 21, 22, 24, 30, 31, 37
Примеры 2, 3, 5, 6, 7, 9, 11, 12, 14
Домашнее задание 11
Глава 13
Проблемы1, 2, 3, 4, 7, 8, 11, 14, 20, 44, 45, 46, 47, 48
Примеры 1, 2, 3, 4, 5, 6, 8, 9, 10, 11, 12, 13, 14
Практика экзамен 4
Определить и/или охарактеризовать для экзамена 4
Ключ для экзамена 4
Окончательный экзамен 2008
Определить и/или характеристика для выпускного экзамена
Репетитор по химии: подготовка к экзамену AP по химии
За последние два года учебы в старшей школе вы обычно сталкиваетесь с натиском стандартизированных тестов.
 В то время как многие из них, такие как тесты SAT, ACT или SAT II, требуются как часть вашего пакета документов для поступления в колледж, экзамены AP несколько уникальны тем, что они могут фактически повлиять на вашу курсовую работу в колледже, направляя вас на курсы более высокого уровня. Возможно, неудивительно, что экзамены AP являются одними из самых сложных из стандартизированных тестов, которые вы будете сдавать, и требуют гораздо большей глубины знаний для успеха. Сегодня мы рассмотрим формат экзамена AP по химии и рассмотрим некоторые стратегии, которые помогут вам пройти его. Формат экзамена:
В то время как многие из них, такие как тесты SAT, ACT или SAT II, требуются как часть вашего пакета документов для поступления в колледж, экзамены AP несколько уникальны тем, что они могут фактически повлиять на вашу курсовую работу в колледже, направляя вас на курсы более высокого уровня. Возможно, неудивительно, что экзамены AP являются одними из самых сложных из стандартизированных тестов, которые вы будете сдавать, и требуют гораздо большей глубины знаний для успеха. Сегодня мы рассмотрим формат экзамена AP по химии и рассмотрим некоторые стратегии, которые помогут вам пройти его. Формат экзамена: Экзамен AP по химии длится 3 часа 5 минут и состоит из двух частей. Часть I представляет собой 90-минутный раздел с несколькими вариантами ответов из 75 вопросов. Вторая часть состоит из шести кратких ответов или открытых вопросов и длится 1 час 35 минут. Вы можете использовать калькулятор только для некоторых вопросов в части II, и для обеих частей предусмотрена таблица Менделеева. Только для части II вам также будет предоставлена таблица восстановительных потенциалов, а также несколько часто используемых уравнений и констант.
Только для части II вам также будет предоставлена таблица восстановительных потенциалов, а также несколько часто используемых уравнений и констант.
Часть I: Множественный выбор
Вопросы с множественным выбором в первой части теста можно разделить на три основные категории: расчеты, концепции и факты. Давайте рассмотрим примеры каждого:
EX1. Какое из следующих названий является правильным для соединения с молекулярной формулой Mg 3 As 2 ?
(A) Магний мышьяк
(B) Тримагний димышьяк
(C) Магний арсенит
(D) Арсенат магния
(E) Арсенид магния
Это типичный фактический вопрос. Вы либо знаете ответ наизусть, либо можете быстро найти ответ, основываясь на своих знаниях химии в целом. В данном случае мы имеем дело с бинарной солью магния и мышьяка; они называются путем написания названия катиона (магний), за которым следует анион, окончание которого заменено на -ид (мышьяк становится арсенидом).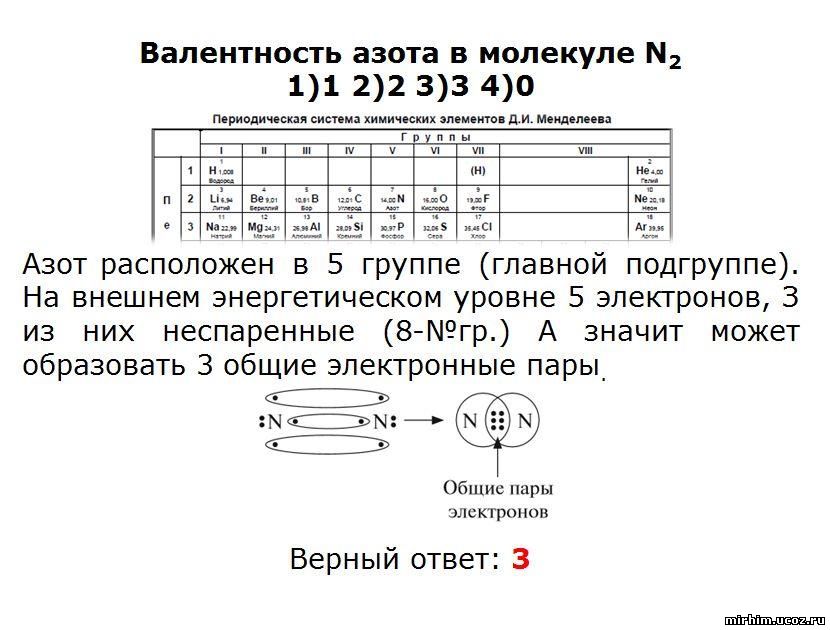 Таким образом, правильный ответ E , арсенид магния.
Таким образом, правильный ответ E , арсенид магния.
ЕХ2. Какое из следующих изменений в реакционной системе, находящейся в равновесии, повлияет на значение константы равновесия (K eq ) для реакции?
(A) Добавление реагентов в систему
(B) Добавление катализатора в реакционную систему
(C) Повышение давления в системе
(D) Повышение температуры в системе
(E ) Удаление продукта реакции из системы
Это концептуальная проблема. Никаких вычислений не требуется, но вопрос требует тщательного анализа всех вариантов реакции, чтобы определить правильный ответ. Это, пожалуй, самые каверзные вопросы в этом разделе, отчасти потому, что они часто проверяют мельчайшие детали вашего понимания. В этом случае, например, легко ввести в заблуждение — на первый взгляд может показаться, что несколько вариантов реакции верны, так как многие из них влияют на положение 90–375 равновесия реакции (т. е. относительные количества реагентов и продуктов).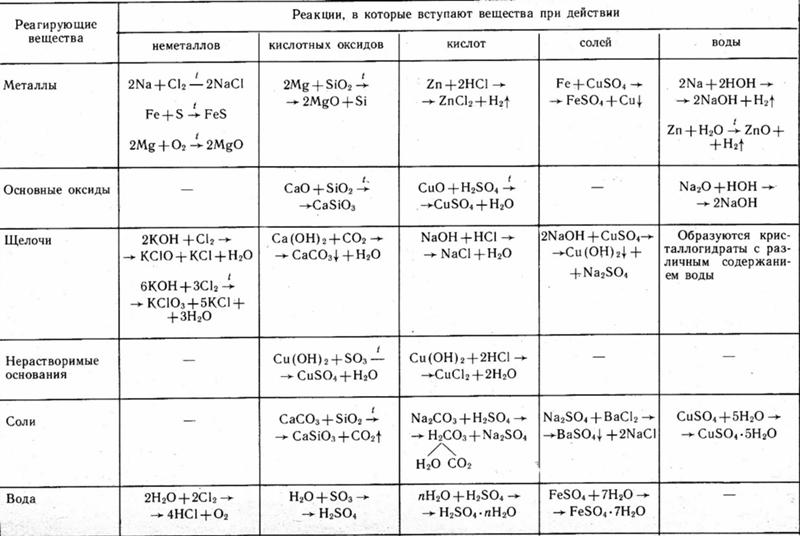 ). Однако вопрос касается именно равновесия постоянная , которая не зависит от количества присутствующих веществ, но зависит от температуры (но не от давления). Таким образом, правильный ответ — D .
). Однако вопрос касается именно равновесия постоянная , которая не зависит от количества присутствующих веществ, но зависит от температуры (но не от давления). Таким образом, правильный ответ — D .
В целом, если несколько вариантов ответа на вопрос кажутся правильными, полезно перечитать вопрос, обращая особое внимание на детали формулировки. Вы можете обнаружить, что ключевое слово было пропущено, что делает невозможным решение вопросов.
ЕХ3. Через расплавленный MgCl 9 пропускают постоянный электрический ток.0388 2 в течение 1,00 часа, что дает 243 г металлического Mg. Если через расплавленный AlCl 3 пропускают одинаковый ток, масса полученного металлического алюминия будет ближайшей к: D) 243. g
(E) 270. g
Это простой расчетный вопрос – вы получите концептуальную настройку, за которой последует простой числовой расчет. Как мы увидим, с приведенными числами часто легко работать (помните, что в этом разделе нет калькулятора!).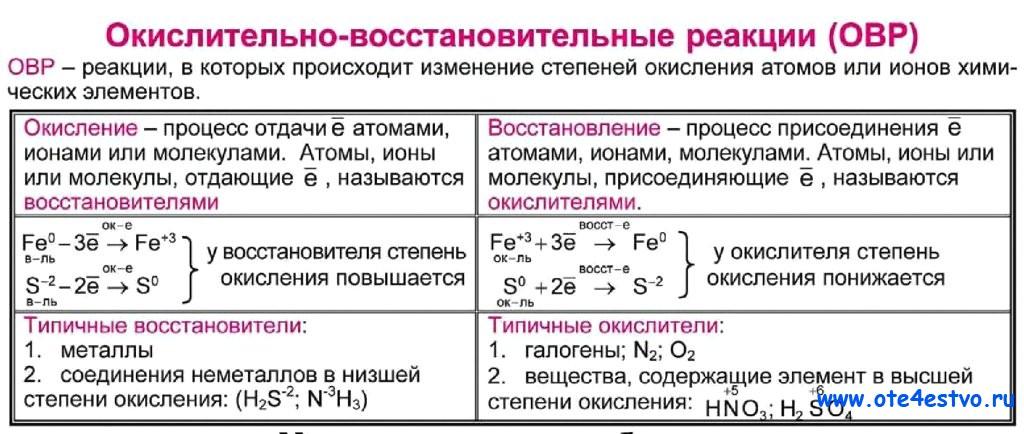 Из периодической таблицы вы обнаружите, что атомная масса Mg равна 24,30, поэтому за 1 час эксперимента было произведено 10 молей Mg. Но, однако, заметьте, это не значит, что будет произведено 10 молей Al! Скорее это означает, что к металлу поступило 2*10=20 моль электронов. Таким образом, работая с этим числом, количество произведенных молей алюминия будет 20/3. Атомная масса Al 26,9.8, или примерно 27,0. Таким образом, правильный ответ 20*27/3 = 180. г, выбор C .
Из периодической таблицы вы обнаружите, что атомная масса Mg равна 24,30, поэтому за 1 час эксперимента было произведено 10 молей Mg. Но, однако, заметьте, это не значит, что будет произведено 10 молей Al! Скорее это означает, что к металлу поступило 2*10=20 моль электронов. Таким образом, работая с этим числом, количество произведенных молей алюминия будет 20/3. Атомная масса Al 26,9.8, или примерно 27,0. Таким образом, правильный ответ 20*27/3 = 180. г, выбор C .
Часть II: Часть II обычно содержит два типа вопросов — «сухие лабораторные» вопросы, где вы пройдете шаги, связанные с лабораторной работой, и вопросы на реакцию, где вам нужно будет написать химическое уравнение. , и ответьте на короткий вопрос о реакции.
Давайте рассмотрим несколько примеров.
ЕХ4. Следующий вопрос касается титрования 10,00 мл 0,0732 М HBr раствором NaOH неизвестной концентрации.
а. Опишите шаги, которые вы предпримете, чтобы подготовить и заполнить бюретку для титрования.
б. Рассчитайте рН исходного раствора HBr.
в. Для достижения конечной точки титрования потребовался объем 8,39 мл неизвестного раствора NaOH. Рассчитайте молярность раствора NaOH, используемого для титрования.
д. Предполагая, что фактическая концентрация раствора NaOH составляет 0,0900 М, рассчитайте процент ошибки в вашем результате.
эл. Рассчитайте объем 12,0 М NaOH, необходимый для приготовления 400,0 мл раствора 0,0900 М раствор NaOH.
Это довольно стандартный вопрос для сухой лаборатории — в основном он проведет вас через все шаги, которые вы предпримете для определения концентрации неизвестного основания (или кислоты) титрованием. Если вы проводили этот эксперимент в лаборатории, вы точно знаете, что здесь делать! Итак, пошагово:
а. Промойте бюретку дистиллированной водой, затем раствором неизвестного основания, чтобы не разбавить его в бюретке. Затем наполните бюретку неизвестным основанием и слейте ее через запорный кран до тех пор, пока не будут выпущены все пузырьки воздуха. Запишите в бюретку начальный объем раствора.
Запишите в бюретку начальный объем раствора.
б. Поскольку HBr является сильной кислотой, она полностью ионизируется в воде, поэтому [H + ] = [HBr] исходное . Таким образом, [H + ] = 0,0732 М. Наконец, pH = -log[H + ], поэтому pH = — log (0,0732) = 1,13 .
в. В конечной точке моли (HBr) = моли (NaOH).
моль (HBr) = (объем HBr) * [HBr]
моль (HBr) = (10,00 * 10 -3 л) * (0,0732 M) = 7,32 * 10 -4 моль = моль (NaOH )
[NaOH] = моли (NaOH) / объем (NaOH) = (7,32 * 10 -4 моль)/(0,00839 л)
[NaOH] = 0,0872 M.
9 0375 д. % погрешность = (|измерено – действительное|/фактическое) * 100 %
% погрешность = (|0,0872 – 0,0900)/0,0900) * 100 %
% погрешность = 3,11 %
эл. Для смешивания двух растворов, C 1 V 1 + C 2 V 2 = C f V f
В данном случае C 2 = 0, так как мы разбавляем 12,0 М раствор NaOH водой 2,0 М)В 1 = (0,0900 М)(400,0 мл)
V 1 = (0,0900 М)(400,0 мл)/(12,0 М) = 3,00 мл .
Как правило, эти вопросы сосредоточены на концепциях, а не просто на получении правильного числового ответа. Таким образом, если у вас мало времени, часто бывает лучше проработать все части вопроса для сухой лабораторной работы, даже если у вас нет чисел для подстановки из предыдущих частей. Точно так же, даже если вы знаете, что получили неправильный ответ, например, в части c, все равно решите часть d — политика оценивания заключается в том, что до тех пор, пока вопрос решен правильно, использование неправильного значения из предыдущей части не будет учитываться. против тебя. Точно так же за математические ошибки и значащие числа взимается штраф, но он относительно небольшой и может быть вычтен только один раз за вопрос.
ЕХ5а. Напишите сбалансированное уравнение реакции, происходящей при добавлении порошка меди к раствору нитрата серебра (любые соединения, которые не изменились в ходе реакции, не учитываются).
EX5b. Какие соединения восстанавливаются в этой реакции?
Какие соединения восстанавливаются в этой реакции?
а. Cu + 2 Ag + à Cu 2+ + 2 Ag
б. Ag + восстанавливается.
Как следует из этих ответов, на вопросы можно ответить быстро и без подробных объяснений. Суть в том, чтобы сбалансировать все ваши уравнения и убедиться, что вы исключили все ненужное (в данном случае нитрат-ион).
Экзамен AP по химии – это сложный и длительный экзамен, требующий глубоких знаний как общей химии, так и лабораторных методов. Хорошая новость, однако, заключается в том, что оценка определенно более дружелюбна, чем оценка SAT II. Неправильные ответы на вопросы с несколькими вариантами ответов не вычитаются из вашей оценки, а политика частичного кредита в разделах с бесплатными ответами довольно снисходительна. Кроме того, 5-балльная шкала обеспечивает более дружелюбную кривую, чем на SAT I/II.







Leave A Comment