ЦЕПОЧКИ ПРЕВРАЩЕНИЙ С УГЛЕВОДОРОДАМИ
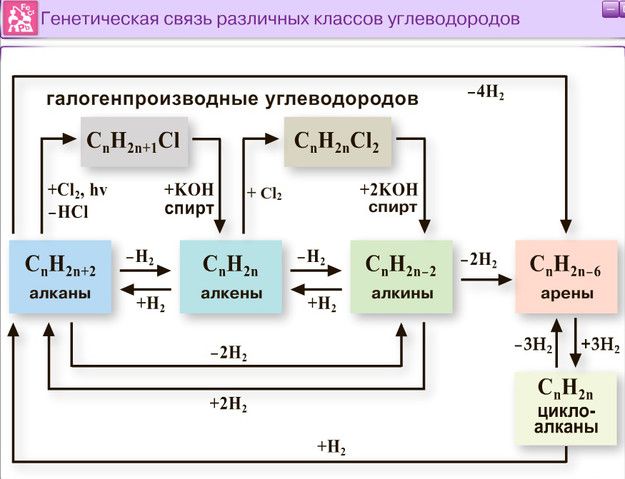
Цепочки превращений с углеводородами так же разнообразны, как велико разнообразие самих углеводородов. И это несмотря на то, что вещества состоят из атомов всего двух элементов: углерода и водорода.
Существует генетическая связь между классами углеводородов, а также между углеводородами и органическими веществами других классов (спиртами, альдегидами и т.д.). Такая взаимосвязь часто является основой цепочек превращений.
Условимся, что при решении цепочек по органической химии будем подписывать названия только органических веществ.
Пример 1.
Исходным веществом в этой цепочке является этилен – углеводород непредельного строения.
Первая реакция – присоединение галогеноводорода HCl по месту разрыва двойной связи. В результате образуется галогеналкан (хлорэтан):
Во второй реакции требуется получить спирт этанол. Реакция идет с участием раствора щелочи. Здесь очень важно указать, какой именно это раствор: водный или спиртовой.
В случае реакции галогеналкана с водным раствором щелочи получаем первичный спирт. В случае взаимодействия его со спиртовым раствором щелочи – алкен.
Третья реакция – внутримолекулярная дегидратация (то есть отщепление воды) спирта. В результате получаем алкен.
Продуктом четвертой реакции является двухатомный спирт этиленгликоль (этандиол — 1,2). Это результат окисления этилена раствором перманганата калия KMnO4:
Кстати! Данная реакция является качественной реакцией, позволяющей определить наличие в веществе двойной связи: происходит обесцвечивание раствора KMnO4.
Пятая реакция – присоединение галогена к алкену по месту разрыва двойной связи. Результат – образование дигалогеналкана:
Шестая реакция схожа со второй. Отличием является – образование не одноатомного, а двухатомного спирта. Условия реакции те же: взаимодействие с водным раствором щелочи:
Условия реакции те же: взаимодействие с водным раствором щелочи:
Пример 2.
В этой цепочке превращений с углеводородами известны не все вещества. Они зашифрованы латинскими буквами X,Y и Z.
Реакция первая – межмолекулярное дегидрирование (отщепление H2 от двух молекул СН4) метана с получением ацетилена:
Реакция происходит в жестких условиях: t=1500℃. Нагревание нужно проводить очень быстро, так как в противном случае метан разлагается с образованием простых веществ H2 и С. Подробнее здесь.
Вторая реакция – присоединение к ацетилену галогеноводорода. По условию цепочки присоединяется одна молекула HCl. Реакция будет сопроводжаться разрывом только одной π-связи из двух. Результат реакции – образование непредельного соединения, содержащего галоген: хлорэтена, или хлорвинила.
Таким образом, хлорвинил – это вещество Х.
Третья реакция – реакция полимеризации хлорвинила, приводящая к образованию поливинилхлорида (ПВХ):
Подробнее об этой реакции здесь.
Поливинилхлорид – это вещество Y.
В четвертой реакции получаем ацетальдегид (этаналь) по реакции Кучерова: гидратацией (присоединением H2O) ацетилена:
Таким образом, этаналь – это вещество Z.
Пятая реакция – восстановление ацетальдегида (присоединением водорода) до спирта:
Подробнее о подобных реакциях здесь.
Пример 3.
Цепочка превращений с углеводородами в данном случае также содержит несколько зашифрованных веществ X,Y и Z.
Исходным веществом является алкан этан, который подвергается хлорированию на свету. Реакция имеет свободно-радикальный механизм.
По условию цепочки в реакции замещения участвует 1 моль хлора, поэтому получаем моногалогеналкан – хлорэтан – вещество Х.
Реакция превращения вещества X в вещество Y происходит при участии Na. Это реакция Вюрца, приводящая к удлинению углеродной цепи:
Таким образом, вещество Y – это н.-бутан.
В третьей реакции при дегидрировании (отщеплении водорода H2) н. -бутана образуется дивинил (или бутадиен – 1,3). Процесс протекает при высокой температуре и в присутствии катализаторов (Al2O3 и Cr2O3):
-бутана образуется дивинил (или бутадиен – 1,3). Процесс протекает при высокой температуре и в присутствии катализаторов (Al2O3 и Cr2O3):
Взаимодействие полученного дивинила и стирола – реакция полимеризации, приводящая к образованию бутадиен-стирольного каучука (вещество Z):
Пример 4.
Это пример цепочки превращений с углеводородами, в которой даны не молекулярные формулы веществ, а их названия. Кроме того, два вещества зашифрованы: А и В.
Еще одна особенность данной цепочки: прямого способа получения гексана из пропана не существует. В связи с этим предположим промежуточные реакции. Вариантов может быть два:
Рассмотрим реакции 1 пути.
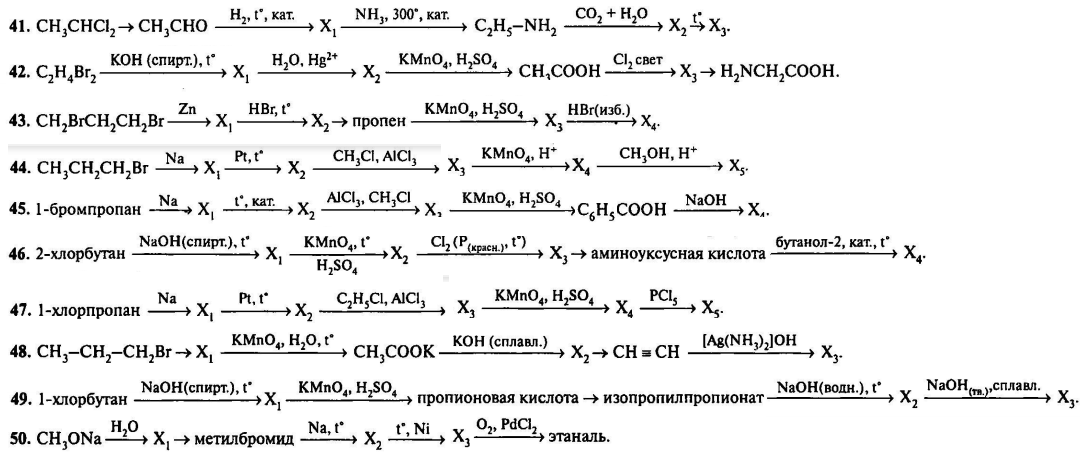
Первая реакция – галогенирование пропана. Это реакция замещения, идущая по свободно-радикальному механизму.
В молекуле пропана два атома углерода первичные и один (средний) вторичный. Благодаря взаимному влиянию атомов замещение водорода на атом брома будет идти по вторичному атому углерода. Получим не 1-бромпропан, а 2-бромпропан. Подробнее о подобных реакциях здесь.
Получим не 1-бромпропан, а 2-бромпропан. Подробнее о подобных реакциях здесь.
Вторая реакция – получение пропилена путем взаимодействия 2-бромпропана и спиртового раствора щелочи.
Обратите внимание, что применение водного раствора щелочи приведет к получению одноатомного спирта.
Третья реакция также имеет свои особенности. Можно ожидать, что присоединение бромоводорода к пропилену пойдет с соблюдением правила Марковникова. Но тогда будет получен 2-бромпропан.
В нашем случае необходимо получить 1-бромпропан. В таком случае присоединение осуществляется против правила Марковникова в присутствии пероксидов .
Четвертая реакция – синтез Вюрца, идущий с удлинением углеродной цепи:
Реакции 2 пути отличаются только одним моментом: можно из пропана сразу получить пропилен, минуя 2-бромпропан:
Возвращаемся к основной цепочке.
Пятая реакция – получение бензола из н.-гексана («ароматизация гексана»). Из-за того, что алканы химически мало активны, процесс идет в присутствии катализатора Cr2O3, при нагревании и под давлением:
В шестой реакции взаимодействие бензола с водородом Н2 приводит к получению вещества А, которым оказывается циклогексан.
Седьмая реакция – бромирование бензола.
Следует отметить, что бензол не реагирует с бромной водой (раствор Br2 в воде) и не обесцвечивает ее. То есть бромирование бензола не является реакцией присоединения, как это происходит у других непредельных соединений (алкенов, алкадиенов и др.). В данном случае – это реакция замещения. Осуществляется она при нагревании с собственно бромом и в присутствии бромида железа (III) FeBr3:
Таким образом, вещество В – это бромбензол.
Пример 5.
Цепочка превращений с углеводородами, имеющими ароматическое кольцо. Для лучшего восприятия под названиями веществ составим их структурные формулы.
Для лучшего восприятия под названиями веществ составим их структурные формулы.
В основе первого процесса реакция Фриделя-Крафтса — взаимодействие бензола с бромметаном в присутствии бромида алюминия. Получаем из бензола его гомолог – метилбензол (или толуол):
Вторая реакция – галогенирование гомолога бензола. Здесь важным является влияние метильной группы -СН3 на ход реакции замещения. Она оказывает воздействие на перераспределение электронной плотности в бензольном кольце. Это приводит к возможности замещения атомов водорода у строго определенных атомов углерода.
Подробнее о правилах ориентации при электрофильном замещении здесь.
В третей реакции происходит окисление 4-бромтолуола по боковой углеродной цепи (то есть по метильной группе). Процесс протекает при воздействии сильных окислителей (K2Cr2O7 или KMnO4) в кислой среде (H2SO4):
Начало было здесь.
Продолжение следует…
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
«Цепочки химических превращений в органической химии»
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. ацетат калия → этан → X → этанол → диэтиловый эфир
2.CaC2 → этин → этанальX1X2X3
3.Al4C3X1X2этаналь X3X1
4. CaC2 → этин →этанальX1X2X3
5. CaC2X1X2→ H3C–COOH X3→ (CH3)2–C=O
6. HCCHX1CH3COOHX2X3 уксусная кислота
7.Метилат калия→ бромметанХ2Х3этаналь —>Х4
8. Ацетальдегид → ацетат калия → этановая кислота → этилацетат → ацетат кальция → ацетон
9. CH3CHO Х1Х2 → этилен
→ CH3
CH3CHO Х1Х2 → этилен
→ CH3
10. CH3COOH → X1С2H6 X2X3X4
11. C2H5OHX1X2X3этин C2H4O
12. CH2BrCH2CH2BrX1X2→ пропенX3 → 1,2- дибромпропан
13. CH4X1 → C6H6X2X3X4
14. карбид алюминия Х1Х2 бензол X3X4
15. 1-хлорпропан Х1X2X3X2 → изопропилбензол
16. этенX1X2X3 → толуолX4
17. C
18. CH3CH2CH2OH → X1C6H14X2C6H5СН3 → C6H5CООН
19. С2Н2Х1 → C6H5С2Н5X2X3X4
С2Н2Х1 → C6H5С2Н5X2X3X4
20. ацетиленбензол этилбензол X1X2полистирол
21. C6H6→C6H5CH
22.
23. C2H2→X1→X2→C6H5CH3→NO2–C6H4–CH3X3
24. CH3-CH2-CH(CH3)-CH3X1X2X1X3 CO2
25. CH4 → HCHOX1X2X1X3
26. пропилацетатX1 → CH4X2винилацетатX3
28. Ацетат калия X1 X2 X3 X4 X5
Ацетат калия X1 X2 X3 X4 X5
29. этанол Х1Х2Ag2C2 X2X3
30. C6H6→C6H5-CH(CH3)2X1X2X3X4
Ответы на задания практической части:
Задание 1
Электролиз раствора ацетата калия:
K(-) (K+) – не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH– | 2
А(+) 2CH3COO––2ē = CH3-CH3 + 2CO2 | 2
Суммарное уравнение:
2CH3COO– + 2H2O = H2+ 2OH– + CH3-CH3 + 2CO2
Или 2CH3COOK + 2H2O = H2+ 2KOH + CH3-CH3 + 2CO2
При нагревании этана в присутствии катализатора Ni, Pt, происходит дегидрирование, X – этен: CH3-CH3CH2=CH2
Следующая стадия – гидратация этена:
CH2=CH2 + H2OCH3-CH2OH;
Перманганат калия в кислой среде – сильный окислитель и окисляет спирты до карбоновых кислот:
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
Наконец, взаимодействие уксусной кислоты и спирта приведет к образованию сложного эфира:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Задание 2
1)
CaC2 + 2H2O
→ Ca(OH)
2) C2H2 + H2O CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH+ K2SO4 + 2MnSO4 + 3H2O
4) 2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
5) (CH3COO)2Ca CaCO3 + (CH3)2CO
Задание 3
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2 CH4 C2H2 + 3H2
3)
C
4) 3CH3СHO + 2KMnO4 + 3H2O → 2CH3COOK+ CH3COOH+ 2MnO2 + H2O
5) CH3COOK + KOHCH4 + K2CO3
Задание 4
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) C2H2 + H2O CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH+ K2SO4 + 2MnSO4 + 3H2O
4)
2CH3COOH
+ Cl
5) CH2ClCOOH + NH3 —> CH2(NH2)COOH + HCl
20) CaC2X1X2→ H3C–COOH X3→ (CH3)2–C=O
Задание 5
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) Н-С≡С-Н H3C – COH
3) H3C–COH +2Сu(ОН)2 → H3C–COOH +Сu2О + 2Н2О
4) 2H3C–COOH + Ba(OH)2 →(СН3COO)2Ba + 2Н2О
5)
(СН3COO)2Ba
(к) (CH
Задание 6
1) Н-С≡С-Н H3C – COH
2) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH+ K2SO4 + 2MnSO4 + 3H2O
3) H3C–COOH + NaOH→СН3COONa + Н2О
4) СН3COONa + CH3I —> СН3COOCH3 + NaI
5) СН3COOCH3 + H2O CH3COOH + CH3OH
Задание 7
1) CH3OK+ H2O KOH + CH3OH
2) CH3OH + HBr CH3Br + H2O
3)
2CH
4) С2H6 C2H4 + H2
5) 2C2H4 + O22CH3CHO
Задание 8
Ацетальдегид —> ацетат калия —> этановая кислота —> этилацетат —> ацетат кальция —> ацетон. Перепишем:
Перепишем:
CH3CHO —> CH3COOK —> CH3COOH —> CH3COOC2H5 —> (CH3COO)2Ca —> (CH3)2CO
Тип реакции может подсказать сравнение состава исходного и получаемого веществ. Так, для первого превращения видно, что необходимо окислить альдегид в щелочной среде, например:
CH3CHO + 2KMnO4 + 3KOH —> CH3COOK + 2K2MnO4 + 2H2O
CH3COOK + HCl = CH3COOH + KCl
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Чтобы из эфира получить ацетат, надо провести его гидролиз в щелочной среде, причем в качестве щелочи взять гидроксид кальция:
2CH3COOC2H5 + Ca(OH)2 (CH3COO)2Ca + 2C2H5OH
Особую сложность может вызвать последнее превращение,
поскольку способы получения кетонов в базовом курсе химии обычно не
рассматриваются.
(CH3COO)2Ca (CH3)2CO + CaCO3
Задание 9
1) CH3CHO + H2 C2H5OH
2) C2H5OH + HBr —> C2H5Br + H2O
3) C2H5Br + KOH (спирт) —> C2H4 + KBr + H2O
4) 2C2H4 + O22 CH3CHO
5) CH3CHO + Ag2O + NH3 —> CH3COONH4 + 2Ag
Задание 10:
1) CH3COOH + KOH —> CH3COOK + H2O
2) CH3COOK + 2H2O H2+ 2KOH + CH3-CH3 + 2CO2
3) CH3-CH3 + Cl2 CH3-CH2Cl + HCl
4) CH3-CH2Cl + NaOH (водн) —>CH3-CH2-OH +NaCl
5) 2CH3-CH2-OHH2O + CH3-CH2-O-CH2-CH3
Задание 11
1) C2H5OHCH2=CH2 + H2O
2) 3CH2=CH2 + 2KMnO4 + 4H2O 3CH2OH-CH2OH + 2MnO2 + 2KOH
3) CH2OH-CH2OH + 2HBrCH2BrCH2Br +2H2O
4) CH2BrCH2Br +2KOH (спирт) Н-С≡С-Н + 2H2O +2KBr
5) Н-С≡С-Н +H2O
Задание 12
1) CH2BrCH2CH2Br + Zn CH2=CH2CH3 + ZnCl2
2) CH2=CH2CH3+ HBr CH3-CH2BrCH3
3) CH3-CH2BrCH3 +KOH (спирт) —> CH2=CH2CH3 + KBr
4) CH2=CH2CH3CH2(OH)-CH(OH)-CH3
5) CH2(OH)-CH(OH)-CH3 + 2HBr CH2BrCH2BrCH3 + 2H2O
Задание 13
1) 2CH4C2H2 + 3H2
2) 3C2H2 C6H6
3) C6H6 + CH3Cl C6H5CH3 + HCl
4) C6H5CH3 C6H5-COOH
5) C6H5-COOH C6H5-COOC2H5 +H2O
Задание 14
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2CH4C2H2 + 3H2
3) 3C2H2 C6H6
4) C6H6 + CH3Cl C6H5CH3 + HCl
5) C6H5CH3 + Cl2C6H5CH2Cl +HCl
Задание 15:
1) H2CCl-CH2-CH3 + KOH (водн) —>KCl + H2COH-CH2-CH3
2) H2COH-CH2-CH3 H2C=CH2-CH3 + H2O
3) H2C=CH2-CH3 + HCl —> H3C-CH2Cl-CH3
4) H3C-CH2Cl-CH3 + KOH (спирт) —> H2C=CH2-CH3 + KCl
5)
Задание 16 и 17
1) С2H4 + Cl2 —> CH2Cl-CH2Cl
2) CH2Cl-CH2Cl + 2KOH (спирт) —> C2H2 +2KCl + 2H2O
3) 3C2H2 C6H6
4) C6H6 + CH3Cl C6H5CH3 + HCl
5) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O (возможно использование другого окислителя)
Задание 18:
1) CH3CH2CH2OH + НСl→ CH3CH2CH2Сl + Н2O
2) CH3CH2CH2Сl + 2NаC6H14 +2NаСl
3) C6H14C6H6 + 4Н2
4) C6H6 + СН3Сl H3C–C6H5+ НСl
5) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O (возможно использование другого окислителя)
Задание 19
1) 3C2H2 C6H6
2) C6H6 + С2Н5Cl HCl+ C6H5С2Н5
3) C6H5С2Н5 + Br2 C6H5СНBrСH3 + HBr
4) C6H5СНBrСH3 + KOH (спирт) + KBr + H2O
5) 3+2KMnO4 + 4H2O 3 + 2MnO2 + 2KOH
Задание 20
1) 3C2H2 C6H6
2) C6H6 + С2Н5Cl HCl+ C6H5С2Н5
3) C6H5С2Н5 + Cl2 C6H5СНClСH3 + HCl
4) C6H5СНClСH3 + KOH (спирт) + KCl + H2O
5) n ()
Задание 21
1) C6H6 + CH3Cl C6H5CH3 + HCl
2) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O
3) C6H5CООН + CH3OH C6H5CООCH3 +H2O
4) C6H5CООCH3 + NaOH C6H5CООNa + CH3OH
5) 2CH3OH CH3-O-CH3 + H2O
Задание 22:
1) C6H12O6 —> 2C2H5OH + 2CO2 (р-я идет в присутствии ферментов)
2) C2H5OH + HCl —> C2H5Сl + H2O
3) C2H5Сl + C6H6 CH3–CH2–C6H5
4) CH3–CH2–C6H5 + Сl2CH3–CH2–C6H4Cl + HCl
5) CH3–CH2–C6H4Cl + 6[O] —> C6H4Cl–COOH + 2H2O + CO2
Задание 23:
1) 3C2H2 C6H6
2) C6H6 + Cl2 C6H5Cl + HСl
3) C6H5Cl + CH3Cl + 2Na C6H5CH3 + 2NaCl
4) C6H5CH3 + HNO3 NO2–C6H4–CH3 + H2O
5) 5NO2–C6H4–CH3 + 6КМnО4 + 9Н2SO4→ 5NO2–C6H4–CООН +3К2SO4+ 6МnSО4 + 14Н2O (возможно использование другого окислителя)
Задание 24:
1) CH3-CH2-CH(CH3)-CH3 + Br2 CH3-CH2-CBr(CH3)-CH3 + HBr
2) CH3-CH2-CBr(CH3)-CH3 + KOH CH3-CH2=C(CH3)-CH3 + H2O +KBr
3) CH3-CH2-CBr(CH3)-CH3 + HBr CH3-CH2-CBr(CH3)-CH3
4) CH3-CH2-CBr(CH3)-CH3 + 2Na 2NaBr +
5) 2C10H22 + 31 O2 —>20 CO2 + 22 H2O
Задание 25:
CH4 + O2HCHO + H2O
HCHO + H2 CH3OH
2CH3OH + 2Na —>2CH3ONa +H2
CH3ONa + HCl —> CH3OH +NaCl
5CH3OH + 2KMnO4 +3H2SO45HCHO + 2MnSO4 + K2SO4 + 8H2O
Задание 26:
1) CH3COO-CH2CH2CH3 +KOH CH3COOK + CH2CH2CH3OH
2) CH3COOK + KOHCH4 + K2CO3
3) 2CH4C2H2 + 3H2
4) C2H2 + CH3COOH СН3СООСН=СН2 +H2O
5) СН3СООСН=СН2 + Br2 СН3СООСНBr-СН2Br
Задание 27:
1) CH3-CH2-CHO + 2Сu(OH)2 —> CH3-CH2-COOH + Сu2О + 2Н2О
2) CH3-CH2-COOH + Cl2CH3-CHCl-COOH + HCl
3) CH3-CHCl-COOH +NaOH (спирт) —> CH2=CH-COOH +NaCl + H2O
4) CH2=CH-COOH + CH3OH CH2=CH-COOCH3 + H2O
5) nCH2=CH-COOCH3
Задание 28:
Смотри ответ на задание №1
Сложность данной цепочки в том, что если не знать первой реакции, понять
о каких веществах идет речь в остальной ее части невозможно.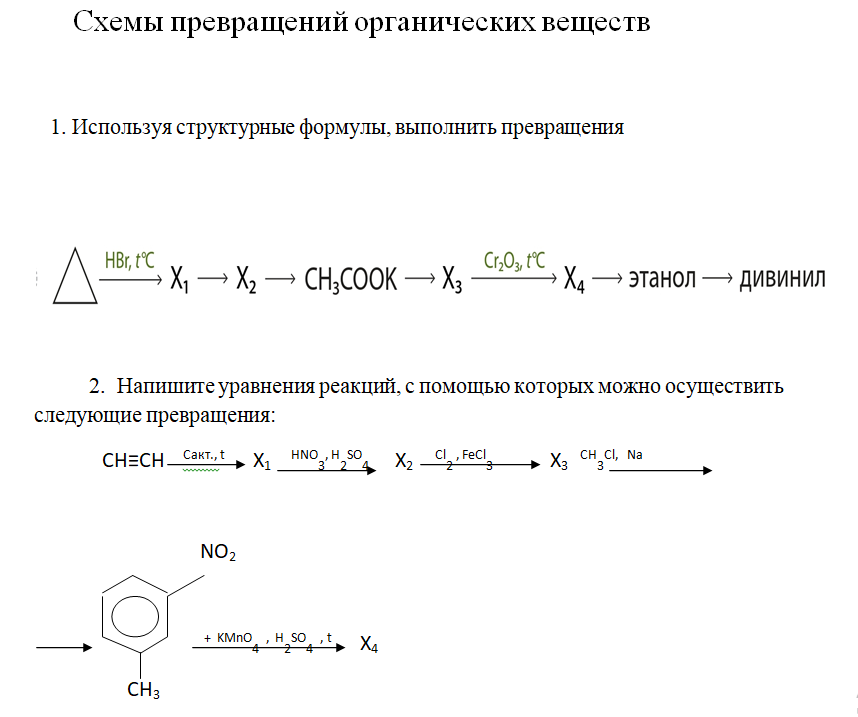
Задание 29:
C2H5OHCH2=CH2+H2O
CH2=CH2HC≡CH + H2
HC≡CH + 2[Ag(NH3)2]OH —> AgC≡CAg +4NH3 + 2H2O
AgC≡CAg + 2HCl —> HC≡CH + 2AgCl
3HC≡CH + 8KMnO4 —> 3K2C2O4 + 2KOH + 2H2O + 8 MnO2
Задание 30:
1) C6H6 + CH2=CH-CH3 C6H5-CH(CH3)2
2) C6H5-CH(CH3)2 C6H5-COOH
3) + HNO3+ H2O
4) + 6[H] + 2H2O
5) + NaOH = + H2O
7.17: Введение в органический синтез
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 28183
- Layne Morsch
- University of Illinois Springfield
Задача
После завершения этого раздела вы должны быть в состоянии разработать многостадийный синтез для получения данного продукта из данного исходного материала, используя любую из реакций, представленных в учебнике до этого момента.
Учебные заметки
Вы должны были заметить, что некоторые из предложенных задач требовали объединения нескольких органических реакций для превращения одного органического соединения в другое, когда для достижения этой цели не существует единой реакции. Такая цепочка реакций называется «органическим синтезом». Одна из основных целей этого курса — помочь вам в разработке таких синтезов. Для достижения этой цели вам необходимо иметь в памяти все реакции, описанные в курсе. Некоторые реакции вам придется вспоминать гораздо чаще, чем другие, и единственный способ справиться с этой задачей — практиковаться. Примеры, приведенные в этой главе, будут относительно простыми, но вскоре вы увидите, что можете изобретать довольно сложные синтезы, используя ограниченное число основных реакций.
Введение
Изучение органической химии знакомит учащихся с широким спектром взаимосвязанных реакций. Алкены, например, могут быть преобразованы в структурно подобные алканы, спирты, алкилгалогениды, эпоксиды, гликоли и бораны; расщепляется до более мелких альдегидов, кетонов и карбоновых кислот; и расширен за счет карбокатионов и радикальных добавок, а также циклоприсоединений. Большинство этих реакций показаны на карте реакций алкенов ниже. Все эти продукты впоследствии могут быть преобразованы во множество новых соединений, включающих широкий спектр функциональных групп. Следовательно, логическая концепция многостадийного синтеза конструирования указанного соединения из определенного исходного материала становится одной из самых сложных проблем, которые могут быть поставлены. Карты реакций функциональных групп, подобные приведенной ниже для алкенов, могут быть полезны при разработке многоэтапных синтезов. Может быть полезно составить и разработать собственные карты реакций для каждой изучаемой функциональной группы.
Большинство этих реакций показаны на карте реакций алкенов ниже. Все эти продукты впоследствии могут быть преобразованы во множество новых соединений, включающих широкий спектр функциональных групп. Следовательно, логическая концепция многостадийного синтеза конструирования указанного соединения из определенного исходного материала становится одной из самых сложных проблем, которые могут быть поставлены. Карты реакций функциональных групп, подобные приведенной ниже для алкенов, могут быть полезны при разработке многоэтапных синтезов. Может быть полезно составить и разработать собственные карты реакций для каждой изучаемой функциональной группы.
Карта алкеновых реакций
Обратите внимание: реагенты для каждого химического превращения намеренно опущены, чтобы эту карту можно было использовать в качестве учебного пособия. Ответы приведены в конце этого раздела как часть упражнений.
Простые многоступенчатые синтезы
Одно- или двухстадийную последовательность простых реакций не так уж сложно вывести. Например, синтез мезо-3,4-гександиола из 3-гексина может осуществляться более чем одним многостадийным путем.
Например, синтез мезо-3,4-гександиола из 3-гексина может осуществляться более чем одним многостадийным путем.
Один из подходов заключается в восстановлении алкина до цис- или транс-3-гексена перед образованием гликоля. Гидроксилирование цис-3-гексена перманаганатом или четырехокисью осмия может привести к образованию желаемого мезоизомера.
Из транс-3-гексена необходимо сначала эпоксидировать алкен надкислотой с последующим раскрытием цикла кислотным или основным гидролизом.
Более длительные многоэтапные синтезы требуют тщательного анализа и обдумывания, поскольку необходимо рассмотреть множество вариантов. Подобно опытному шахматисту, оценивающему плюсы и минусы потенциальных ходов на большом расстоянии, химик должен оценивать потенциальный успех различных возможных путей реакции, сосредотачиваясь на масштабах и ограничениях, ограничивающих каждую из используемых реакций. Навык приобретается практикой, опытом и часто методом проб и ошибок.
Размышление на трех примерах
Следующие три примера иллюстрируют стратегии разработки многоэтапных синтезов на основе реакций, изученных в первых десяти главах этого учебника. Полезно систематически искать структурные изменения, начиная с углеродной цепи, и проводить мозговой штурм соответствующих реакций превращения функциональных групп. Ретро-синтез — это подход, работающий в обратном направлении от продукта к исходному материалу.
В первом примере нас просят синтезировать 1-бутанол из ацетилена.
Размер углеродной цепи удваивается, что указывает на реакцию ацетилида S N 2 с алкилгалогенидом. Образование первичного спирта в результате реакции гидратации антимарковниковского алкена (гидроборирование-окисление) более вероятно, чем реакция замещения. Применяя ретросинтез, мы работаем в обратном направлении от спирта к алкену и алкину от реакции ацетилида, которая первоначально строит углеродную цепь.
Ретро-синтез
В дальнейшем мы определяем реагенты, необходимые для каждой трансформации, выявленной в ходе ретросинтеза. Этилбромид также должен быть получен из ацетилена, поэтому несколько путей реакции объединяются, как показано ниже.
Этилбромид также должен быть получен из ацетилена, поэтому несколько путей реакции объединяются, как показано ниже.
Во втором примере нас просят синтезировать 1,2-дибромбутан из ацетилена.
Снова наблюдается увеличение длины углеродной цепи, что указывает на реакцию ацетилида S N 2 с алкилгалогенидом, аналогичную первому примеру. Гидрогалогенирование может быть трудно различимым, поскольку атомы водорода не показаны в структурах линий связи. При сравнении химических формул 1-бутина с 1,2-дибромбутаном видно различие в два атома H и два атома Br, что указывает на гидрогалогенирование, а не на галогенирование. Присоединение обоих атомов брома к одному и тому же атому углерода также подтверждает идею о том, что гидрогалогенирование происходит на алкине, а не на алкене. Образование геминального дигалогенида также указывает на гидрогалогенирование вместо галогенирования, поскольку при галогенировании образуются вицинальные дигалогениды. При таком понимании ретросинтез указывает на следующую серию химических превращений.
Ретро-синтез
В дальнейшем мы определяем реагенты, необходимые для каждой трансформации.
В третьем примере нас просят произвести 6-оксогептаналь из метилциклогексана.
С учетом атомов углерода исходный материал и продукт содержат по семь атомов углерода, и в восстановительных условиях происходит реакция расщепления алкена. Одним важным недостающим аспектом этой реакции является хорошая уходящая группа (LG). Алканы химически довольно скучны. Мы можем сжигать их в качестве топлива или проводить радикальное галогенирование для создания алкилгалогенидов с отличными уходящими группами. С учетом этих наблюдений разумен следующий ретросинтез.
Ретро-синтез
В дальнейшем мы определяем реагенты, необходимые для каждой реакции. Для начального радикального галогенирования алкана у нас есть возможность использовать хлор (Cl 2 ) или бром (Br 2 ). Поскольку метилциклогексан имеет несколько различных классификаций углерода, селективность Br 2 более важна, чем более быстрая реакционная способность Cl 2 . Сильное основание с нагреванием можно использовать для второй стадии, чтобы следовать механизму E2 и образовывать 1-метилциклогексен. Альдегидная группа в конечном продукте указывает на мягкое окислительное расщепление по любому из нескольких путей реакции. Эти реакции могут быть объединены в следующий многостадийный синтез.
Сильное основание с нагреванием можно использовать для второй стадии, чтобы следовать механизму E2 и образовывать 1-метилциклогексен. Альдегидная группа в конечном продукте указывает на мягкое окислительное расщепление по любому из нескольких путей реакции. Эти реакции могут быть объединены в следующий многостадийный синтез.
Карты реакций для развития мастерства преобразования функциональных групп
Проработав приведенные выше примеры, мы видим, насколько важно запомнить все реакции функциональных групп, изученные в первых десяти главах. Мы можем применить знание этих реакций к мудрости многоступенчатого синтеза.
Обратите внимание: реагенты для каждого химического превращения намеренно опущены, чтобы эти карты можно было использовать в качестве инструментов исследования. Ответы приведены в конце этого раздела как часть упражнений.
Алкан и алкилгалогенидская реакция карта
Алкиновая реакция карта
Упражнение
1) Начало с 3-хексиновых предсказания.
б) 3,4-дибромгексан
в) 3-гексанол.
2) Исходя из ацетилена и любых алкилгалогенидов, предлагаем синтез для получения
а) пентаналя
б) гексана.
3) Покажите, как бы вы выполнили следующие синтетические преобразования.
а)
б)
- Ответить
1)
2)
3)
а)
б)
Эта страница под названием 7.17: Introduction to Organic Synthesis распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором которой является Лейн Морш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Лейн Морш
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Трансформирующий химический синтез
- РЕКЛАМА Рекламодатель несет исключительную ответственность за содержание этой статьи
Химики Нанкинского университета находят новые способы создания сложных молекул.
Произведено
Скачать PDF
Новый гетерометаллический кластер d-f с множественными связями уран-металл, синтезированный группой Цунцина Чжу. Кредит: Нанкинский университет
Достижения в области синтетической химии позволили спроектировать и создать сложные молекулярные структуры для использования в медицине, материалах и энергетике. Функционализация углерод-водород (C-H), реакция, которая разрывает связь C-H, становится особенно привлекательной стратегией преобразования органических химических веществ, учитывая ее многочисленные привлекательные особенности. Ученые из Школы химии и химической инженерии Нанкинского университета (SCCE) разрабатывают новые решения, которые раздвигают границы органического синтеза, особенно функционализации C-H.
Функционализация углерод-водород (C-H), реакция, которая разрывает связь C-H, становится особенно привлекательной стратегией преобразования органических химических веществ, учитывая ее многочисленные привлекательные особенности. Ученые из Школы химии и химической инженерии Нанкинского университета (SCCE) разрабатывают новые решения, которые раздвигают границы органического синтеза, особенно функционализации C-H.
Сайт-селективная C-H функционализация алкенов, которые являются легкодоступными исходными материалами, ценна для синтеза, но сложна. Группа SCCE под руководством Шаолиня Чжу разработала решение для проведения этой реакции путем сочетания кросс-сочетания и катализируемого гидридом никеля движения по цепочке, а именно миграции двойной связи вдоль углеводородной цепи. Ожидается, что это повлечет за собой разработку других удаленных функций и асимметричных преобразований.
Учитывая стоимость и возможную токсичность металлов, разработка безметалловой функционализации C-H вызывает интерес. Другая группа SCCE, возглавляемая Чжуанчжи Ши, недавно открыла стратегию направленного C-H борилирования (гетеро)аренов в условиях отсутствия металлов с использованием трибромида бора (BBr3) в качестве реагента и катализатора. Бесцветное, дымящееся жидкое соединение, BBr3 коммерчески доступно в количествах от нескольких граммов до килограммов, и дешевле, чем большинство обычных борных реагентов, что делает его привлекательным выбором. Эта более мягкая и более эффективная реакция преобразования образовавшихся соединений бора имеет потенциальное применение в синтезе каркасов натуральных продуктов и лекарств.
Другая группа SCCE, возглавляемая Чжуанчжи Ши, недавно открыла стратегию направленного C-H борилирования (гетеро)аренов в условиях отсутствия металлов с использованием трибромида бора (BBr3) в качестве реагента и катализатора. Бесцветное, дымящееся жидкое соединение, BBr3 коммерчески доступно в количествах от нескольких граммов до килограммов, и дешевле, чем большинство обычных борных реагентов, что делает его привлекательным выбором. Эта более мягкая и более эффективная реакция преобразования образовавшихся соединений бора имеет потенциальное применение в синтезе каркасов натуральных продуктов и лекарств.
Сосредоточив внимание на реакциях функционализации C-H в более мягких условиях, Чэнцзян Чжу из SCCE и его команда разработали функционализацию C-H, запускаемую фотокатализом. Вместе со своим коллегой Цзинь Се Чжу также разработал методы деоксигенации для синтеза кетонов из ароматических карбоновых кислот и алкенов, а также для получения дейтерированных альдегидов из ароматических и алифатических карбоновых кислот с использованием оксида дейтерия в качестве источника. Эти стратегии перспективны для синтеза лекарственных соединений. Другая группа, возглавляемая Шоуюном Ю, нашла мягкие способы получения азотцентрированных радикалов из производных гидроксиламина при фотоокислительно-восстановительном катализе.
Эти стратегии перспективны для синтеза лекарственных соединений. Другая группа, возглавляемая Шоуюном Ю, нашла мягкие способы получения азотцентрированных радикалов из производных гидроксиламина при фотоокислительно-восстановительном катализе.
Ученые SCCE также совершили прорыв в области полного синтеза и металлоорганических соединений. Команда под руководством Чжуцзюня Яо осуществила первый полный синтез серии сложных биоактивных натуральных продуктов. Их стратегии синтеза некоторых алкалоидов с противоопухолевыми функциями являются эффективными и высокопродуктивными. Эти исследования пролили свет на эффективное и экономичное производство противораковых и противогриппозных препаратов. В то время как команда Цунцина Чжу разработала простую стратегию построения серии гетерометаллических кластеров с несколькими связями уран-металл, демонстрируя первый пример тройной связи металл-металл f-блока.
Сложные вычислительные ограничения
Молекулярное моделирование и расчеты электронной структуры необходимы для понимания поведения химических систем.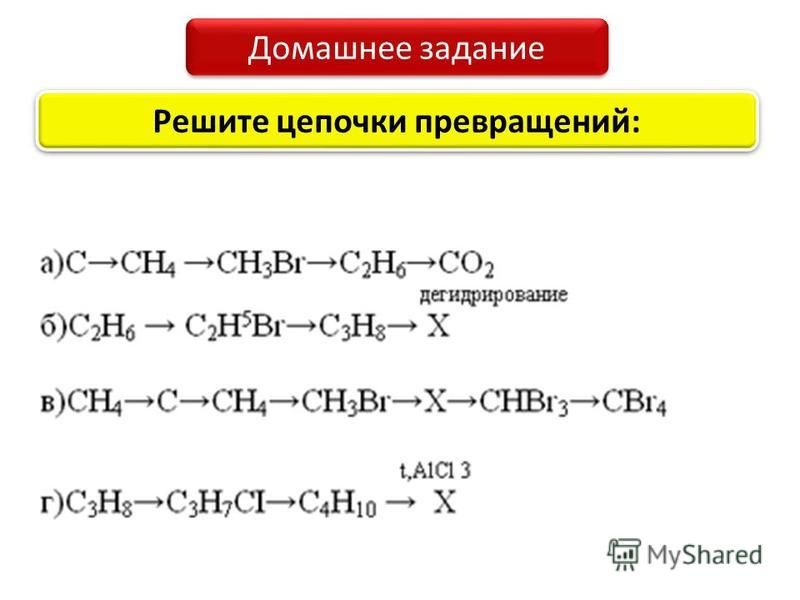 Однако традиционные методы расчета часто не подходят для более крупных и сложных систем, поскольку они слишком требовательны к вычислительным ресурсам.
Однако традиционные методы расчета часто не подходят для более крупных и сложных систем, поскольку они слишком требовательны к вычислительным ресурсам.
Например, традиционные методы, основанные на квантовой химии, для расчета электронных структур в основном состоянии применимы только для молекул среднего размера. Чтобы решить эту проблему, группа под руководством профессоров SCCE Шухуа Ли, Вей Ли и Цзин Ма предложила подходы фрагментации на основе энергии и локальной корреляции «кластер в молекуле», позволяющие исследовать структуры, свойства и реактивность сложных систем, содержащих до тысячи атомов. Хайбо Ма и его коллеги также добились недорогих расчетов больших молекул в возбужденном состоянии, что облегчило изучение органических солнечных элементов.
Сосредоточившись на динамике квантовых реакций, другая команда под руководством Дайцянь Се улучшила приближение связанных состояний, чтобы лучше описать динамику молекулярных столкновений. Их подход значительно снижает вычислительные затраты, не влияя на точность.

Leave A Comment