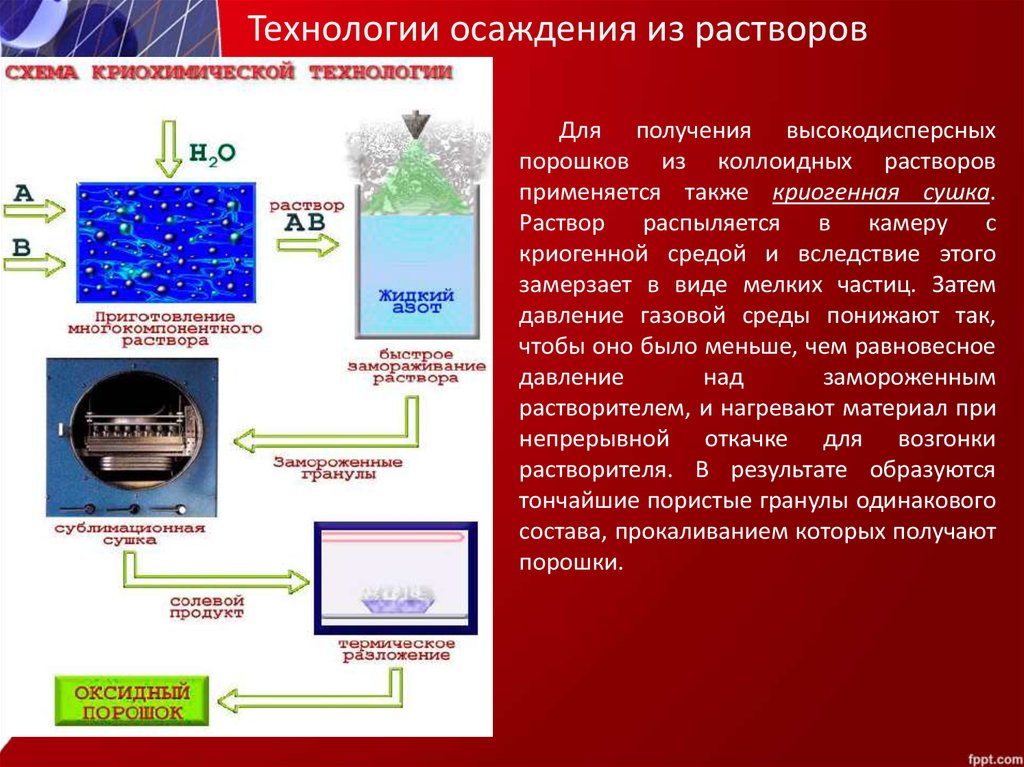
Высушивание и прокаливание осадка. Задача С2 на ЕГЭ по химии. Особенности и подводные камни Задания С2 из вариантов ЕГЭ по химии для самостоятельной работы
Задание С2 ЕГЭ по химии представляет собой описание химического эксперимента, в соответствии с которым нужно будет составить 4 уравнения реакции. По статистике, это одно из самых сложных заданий, очень низкий процент сдающих с ним справляется. Ниже приводятся рекомендации по поводу решения задания С2.
Во — первых, чтобы верно решить задание С2 ЕГЭ по химии нужно правильно представлять себе те действия, которым подвергаются вещества (фильтрование, выпаривание, обжиг, прокаливание, спекание, сплавление). Необходимо понимать, где с веществом происходит физическое явление, а где – химическая реакция. Наиболее часто используемые действия с веществами описаны ниже.
Фильтрование – способ разделения неоднородных смесей с помощью фильтров – пористых материалов, пропускающих жидкость или газ, но задерживающих твёрдые вещества. При разделении смесей, содержащих жидкую фазу, на фильтре остается твердое вещество, через фильтр проходит
При разделении смесей, содержащих жидкую фазу, на фильтре остается твердое вещество, через фильтр проходит
Выпаривание — процесс концентрирования растворов путём испарения растворителя. Иногда выпаривание проводят до получения насыщенных растворов, с целью дальнейшей кристаллизации из них твердого вещества в виде кристаллогидрата, или до полного испарения растворителя с целью получения растворенного вещества в чистом виде.
Прокаливание – нагревание вещества с целью изменения его химического состава. Прокаливание может проводиться на воздухе и в атмосфере инертного газа. При прокаливании на воздухе кристаллогидраты теряют кристаллизационную воду, например, CuSO 4 ∙5H 2 O→CuSO 4 + 5H 2 O
Термически нестойкие вещества разлагаются:
Cu(OH) 2 →CuO + H 2 O; CaCO 3 → CaO + CO 2
Спекание, сплавление – это нагревание двух и более твердых реагентов, приводящее к их взаимодействию. Если реагенты устойчивы к действию окислителей, то спекание можно проводить на воздухе:
Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2
Если же один из реагентов или продукт реакции могут окисляться компонентами воздуха, процесс проводят с инертной атмосфере, например: Сu + CuO → Cu 2 O
Вещества, неустойчивые к действию компонентов воздуха, при прокаливании окисляются, реагируют с компонентами воздуха:
2Сu + O 2 → 2CuO;
4Fe(OH) 2 + O 2 →2Fe 2 O 3 + 4H 2 O
Обжиг – процесс термической обработки, приводящий к сгоранию вещества.
Во-вторых, знание характерных признаков веществ (цвет, запах, агрегатное состояние) Вам послужит подсказкой или проверкой правильности выполненных действий. Ниже представлены наиболее характерные признаки газов, растворов, твердых веществ.
Признаки газов:
Окрашенные: Cl 2 – желто-зеленый; NO 2 – бурый; O 3 – голубой (все имеют запахи). Все ядовиты, растворяются в воде, Cl 2 и NO 2 реагируют с ней.
Бесцветные без запаха: Н 2 , N 2 , O 2 , CO 2 , CO (яд), NO (яд), инертные газы. Все плохо растворимы в воде.
Бесцветные с запахом: HF, HCl, HBr, HI, SO 2 (резкие запахи), NH 3 (нашатырного спирта) –хорошо растворимы в воде и ядовиты, PH 3 (чесночный), H 2 S(тухлых яиц) — мало растворимы в воде, ядовиты.
Окрашенные растворы:
Желтые: Хроматы, например K 2 CrO 4 , растворы солей железа (III), например, FeCl 3 .
Оранжевые: Бромная вода, cпиртовые и спиртово-водные растворы йода (в зависимости от концентрации от жёлтого до бурого) , дихроматы, например, K 2 Cr 2 O 7
Зеленые: Гидроксокомплексы хрома (III), например, K 3 , соли никеля (II), например NiSO 4 , манганаты, например, K 2 MnO 4
От розового до фиолетового: Перманганаты, например, KMnO 4
От зеленого до синего: Соли хрома (III), например, CrCl 3
Окрашенные осадки:
Желтые: AgBr, AgI, Ag 3 PO 4 , BaCrO 4 , PbI 2 ,CdS
Бурые: Fe(OH) 3 , MnO 2
Черные, черно-бурые: Сульфиды меди, серебра, железа, свинца
Синие: Cu(OH) 2 , KFе
Зеленые: Cr(OH) 3 – серо-зеленый, Fe(OH) 2 – грязно-зеленый, буреет на воздухе
Другие окрашенные вещества:
Желтые : сера, золото, хроматы
Оранжевые: oксид меди (I) – Cu 2 O, дихроматы
Красные:
Черные: СuO, FeO, CrO
Серые с металлическим блеском: Графит, кристаллический кремний, кристаллический йод (при возгонке – фиолетовые пары), большинство металлов.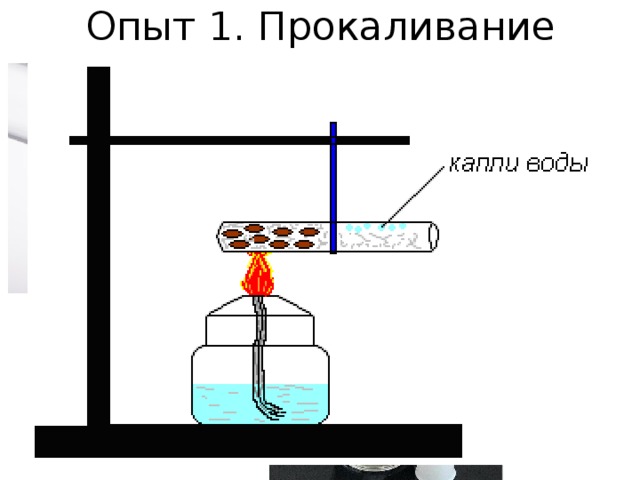
Зеленые: Cr 2 O 3 , малахит (CuOH) 2 CO 3 , Mn 2 O 7 (жидкость)
В-третьих, при решении заданий С2 по химии для большей наглядности, можно порекомендовать составлять схемы превращений или последовательность получаемых веществ.
И наконец, для того, чтобы решать такие задачи, надо чётко знать свойства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей.
Данный урок представляет собой практическое занятие, в ходе которого проводятся различные опыты, представляющие собой как физические, так и химические процессы. Проведенным химическим реакциям даются характеристики с указанием условий начала и протекания реакций, а также их признаков.
Тема: Первоначальные химические представления
Урок: Практическое занятие 3. Химические реакции
ОПЫТ 1.
Кусочек парафина помещаем на металлическую пластинку и нагреваем. В результате мы наблюдаем изменение агрегатного состояния парафина (переход в жидкое состояние). Несмотря на то, что расплавленный парафин стал бесцветным (изменился цвет), это явление относится к физическим, т.к. состав вещества остался прежним, изменилось только его агрегатное состояние.
Рис. 1. Плавление парафина
ОПЫТ 2.
Зажжем свечу и дадим ей немного погореть. В процессе горения свечи сгорает фитиль и парафин, часть парафина плавится, нагреваясь от тепла, выделяемого в процессе горения. Горение фитиля и парафина – это химические процессы, т.к. исходные вещества превращаются в новые продукты реакции. Эти продукты – газообразные, т.к. свеча уменьшается в размерах. Горение сопровождается выделением тепла и света.
Плавление парафина, как было сказано выше, относится к физическим явлениям.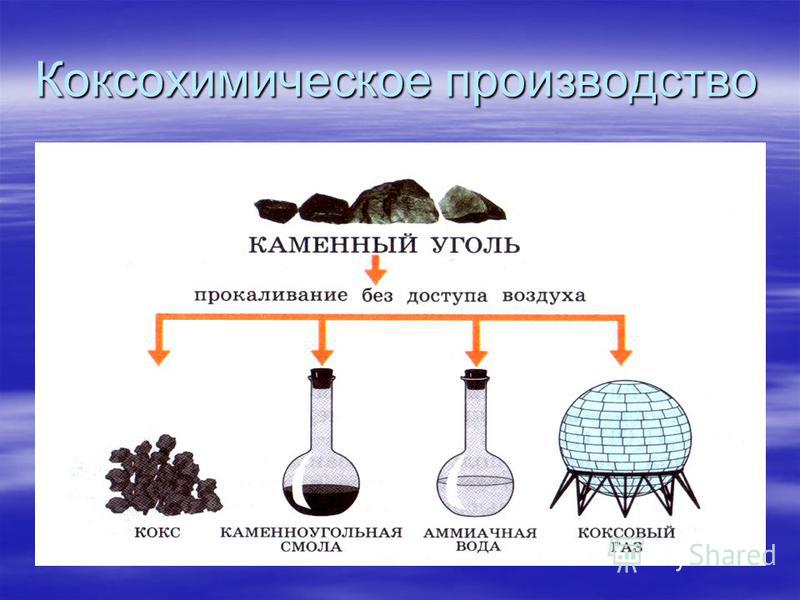 Охарактеризуем процесс горения свечи. Условиями начала реакции является поджог и соприкосновение фитиля с воздухом. Условие течения реакции – приток свежего воздуха (если его прекратить, свеча погаснет). Признаки реакции – выделение тепла и света.
Охарактеризуем процесс горения свечи. Условиями начала реакции является поджог и соприкосновение фитиля с воздухом. Условие течения реакции – приток свежего воздуха (если его прекратить, свеча погаснет). Признаки реакции – выделение тепла и света.
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с.14-15 №№ 9, 10 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Для полного
удаления летучих веществ, получаемых
в результате термического разложения,
применяют прокаливание, которое
можно проводить при помощи пламени
газовой горелки, в муфельных или тигельных
печах. Для прокаливания в пламени горелки
вещество помещают в металлический или
фарфоровый тигель. Затем его вставляют
в фарфоровый треугольник так, чтобы он
входил в треугольник на 2/3 своей
высоты. Фарфоровый треугольник кладут
на кольцо штатива.
Муфельные печи применяют для прокаливания веществ при повышенных температурах (до 1600 °С). В рабочем пространстве печи нельзя разливать реактивы. Раскаленные тигли извлекают из муфельной печи длинными тигельными щипцами.
Фильтрование
Это процесс движения через пористую перегородку жидкости или газа, который сопровождается осаждением на пористой перегородке взвешенных в них твердых
частиц. Эффективность
процесса фильтрования оценивается
скоростью и полнотой отделения
твердых частиц от жидкости или газа. На
него оказывают влияние: вязкость (легче
фильтруются жидкости, имеющие малую
вязкость), температура (чем выше
температура, тем легче фильтруется
раствор, так как вязкость жидкости
уменьшается при нагревании), давление
(чем больше разность давлений по обе
стороны фильтра, тем выше скорость
фильтрования), размер и характер частиц
твердого вещества (чем больше размер
частиц по сравнению с размером пор
фильтра, тем быстрее и легче идет
фильтрование).
В качестве фильтрующих материалов применяют различные органические и неорганические вещества. Необходимо помнить, что для фильтрования нельзя использовать материалы, каким-либо образом взаимодействующие с фильтруемой жидкостью. Например, щелочи, особенно концентрированные, нельзя фильтровать через фильтр из прессованного стекла и других материалов, содержащих диоксид кремния, так как SiO 2 растворяется в щелочах. Фильтрующие материалы могут быть: волокнистыми (вата, шерсть, различные ткани, синтетические волокна), зернистыми (кварцевый песок), пористыми (бумага, керамика). Выбор фильтрующего материала зависит от требований к чистоте раствора, а также от его свойств.
Фильтрование
можно проводить различными способами:
в обычных условиях, при нагревании, под
вакуумом. При обычных условиях для
фильтрования применяют стеклянные
воронки. Внутрь воронки помещают
какой-либо фильтрующий материал,
например вату, фильтровальную бумагу.
Из фильтровальной бумаги делают простые
или складчатые фильтры.
Для приготовления простого фильтра берут лист фильтровальной бумаги квадратной формы. Складывают сначала вдвое, затем еще раз, как показано на рисунке а:
Получается уменьшенный в 4 раза квадрат. Угол сложенного квадрата обрезают ножницами по дуге. Отделяют пальцем один слой бумаги от трех остальных и расправляют.
Для приготовления складчатого фильтра поступают вначале так же, как при изготовлении простого, затем складывают его пополам и каждую половину сгибают несколько раз в одну и другую сторону подобно гармошке (рис. б). Верхний край фильтра не должен доходить до края воронки на 5 мм. Правильно уложенный в воронку фильтр смачивают фильтруемой жидкостью или дистиллированной водой.
При фильтровании воронку укрепляют на кольце штативе. Кончик воронки должен касаться стенки сосуда для фильтрата.
Жидкость сливают
по стеклянной палочке, прижав ее к стенке
воронки. Если требуется отфильтровать
горячий раствор, то применяют специальную
воронку для горячего фильтрования с
электрическим или водяным обогревом.
Фильтрование
при пониженном давлении (под вакуумом)
позволяет достигнуть более полного
отделения твердого вещества от
ж
идкости
и увеличить скорость процесса. Для этого
собирают прибор, состоящий из устройства
для фильтрования — воронка Бюхнера (1),
соединенная с колбой Бунзена (2), колба
Бюхнера посредством резинового шланга
подсоединяется к насосу. Размер воронки
Бюхнера должен соответствовать массе
осадка, но не жидкости. На сетчатое дно
воронки Бюхнера кладут два кружочка
фильтровальной бумаги, смачивают их
дистиллированной водой, присоединяют
прибор к насосу, добившись плотного
прилегания фильтра к сетке воронки.
Начинают процесс фильтрования. Сначала
сливают большую часть жидкости на
фильтр, затем оставшуюся жидкость
взбалтывают с осадком и выливают смесь
в воронку. При фильтровании осадок не
должен переполнять воронку, а фильтрат
в колбе Бунзена не должен доходить
до отростка, соединяющего колбу с
предохранительной склянкой. По
окончании фильтрования сначала отключают
насос, затем воронку вынимают из колбы,
выбирают осадок на лист фильтровальной
бумаги.
Отфильтрованный и промытый осадок еще содержит влагу; обычно его высушивают и прокаливают. Эти операции позволяют получить вещество со строго определенным химическим составом.
Высушивание осадка. Осадок высушивают вместе с фильтром. Воронку с осадком накрывают листком влажной фильтровальной бумаги. Ее края плотно прижимают к наружной поверхности воронки, лишнюю бумагу удаляют. Получается бумажная крышечка, плотно сидящая на воронке и защищающая осадок от пыли.
После этого воронку с осадком следует поместить на 20—30 мин в сушильный шкаф, имеющий полки с круглыми отверстиями. В одно из них и вставляют воронку. Температуру в шкафу поддерживают не выше 90—105° С — при более сильном нагреве фильтр обугливается и распадается.
Прокаливают осадки в фарфоровых тиглях различных размеров. Прежде чем приступить к прокаливанию, необходимо узнать массу пустого тигля. Для этого тигель предварительно прокаливают до постоянной массы, т. е. до тех пор, пока масса его перестанет изменяться. Прокаливают тигли в электрической муфельной печи, в тигельной печи или на газовой горелке, но обязательно при тех же температурных условиях, при которых предполагается прокаливать осадок. О температуре прокаливания ориентировочно судят по цвету каления муфельной (тигельной) печи:
Прокаливают тигли в электрической муфельной печи, в тигельной печи или на газовой горелке, но обязательно при тех же температурных условиях, при которых предполагается прокаливать осадок. О температуре прокаливания ориентировочно судят по цвету каления муфельной (тигельной) печи:
| Начало темно-красного каления…………………………… | ~525°С |
| Темно-красное каление…………………………………………. | -7000C |
| Светло-красное каление………………………………………… | -900 — 10000C |
| Светло-оранжевое каление…………………………………… | ~1200°С |
| Белое каление…………………………………………………….. | -13000C |
| Ослепительно-белое каление………………………………… | -1400 — 15000C |
Предназначенный для прокаливания тигель берут тигельными щипцами за край и помещают в муфельную печь.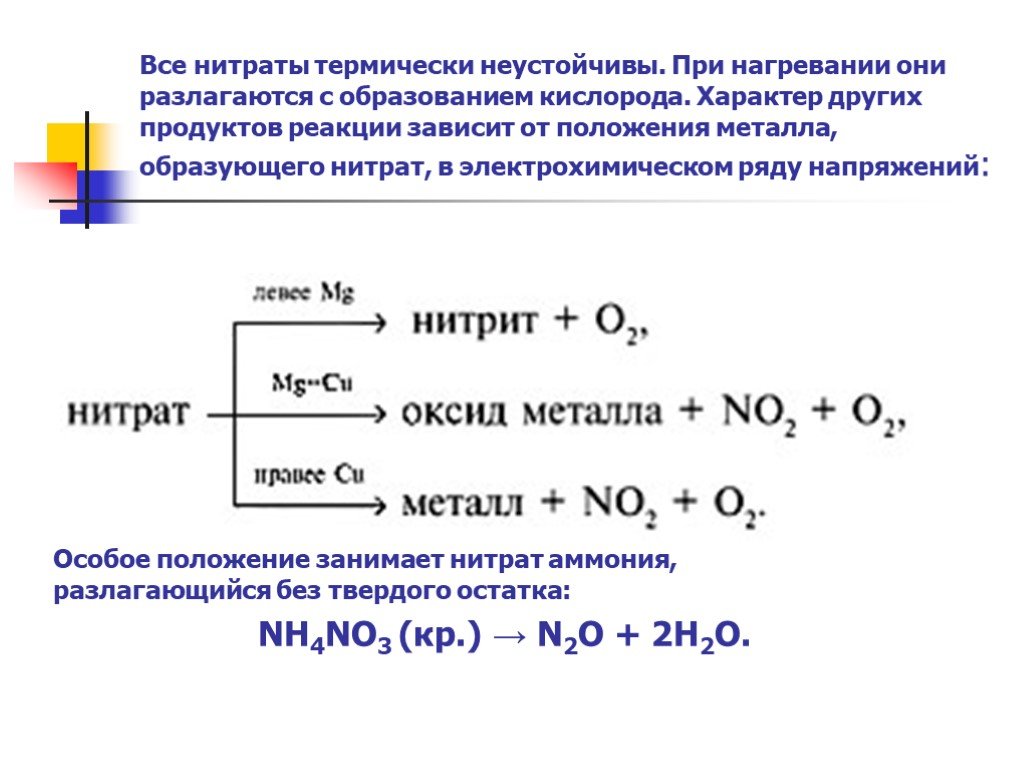 После 25—30 мин прокаливания его вынимают из печи, дают остыть на листе асбеста (или на гранитной плитке) и переносят в эксикатор. Последний закрывают крышкой не сразу, а спустя 1—2 мин; иначе при охлаждении в эксикаторе создается разрежение и крышку будет трудно открыть. Затем эксикатор относят в весовую комнату и оставляют на 15—20 мин, чтобы тигель принял температуру весов.
После 25—30 мин прокаливания его вынимают из печи, дают остыть на листе асбеста (или на гранитной плитке) и переносят в эксикатор. Последний закрывают крышкой не сразу, а спустя 1—2 мин; иначе при охлаждении в эксикаторе создается разрежение и крышку будет трудно открыть. Затем эксикатор относят в весовую комнату и оставляют на 15—20 мин, чтобы тигель принял температуру весов.
Взвесив тигель на аналитических весах, его снова прокаливают 15—20 мин, охлаждают в эксикаторе и повторяют взвешивание. Если результат последнего взвешивания будет отличаться от предыдущего не более чем на ±0,0002 г, считают, что тигель доведен для постоянной массы, т. е. подготовлен для прокаливания осадка. В противном случае тигель прокаливают, охлаждают и взвешивают еще раз. Результаты всех взвешиваний непременно записывают в лабораторный журнал.
Прокаливание осадка. Кристаллизационная, или конституционная вода, которую может содержать даже высушенный осадок, должна быть полностью удалена путем прокаливания.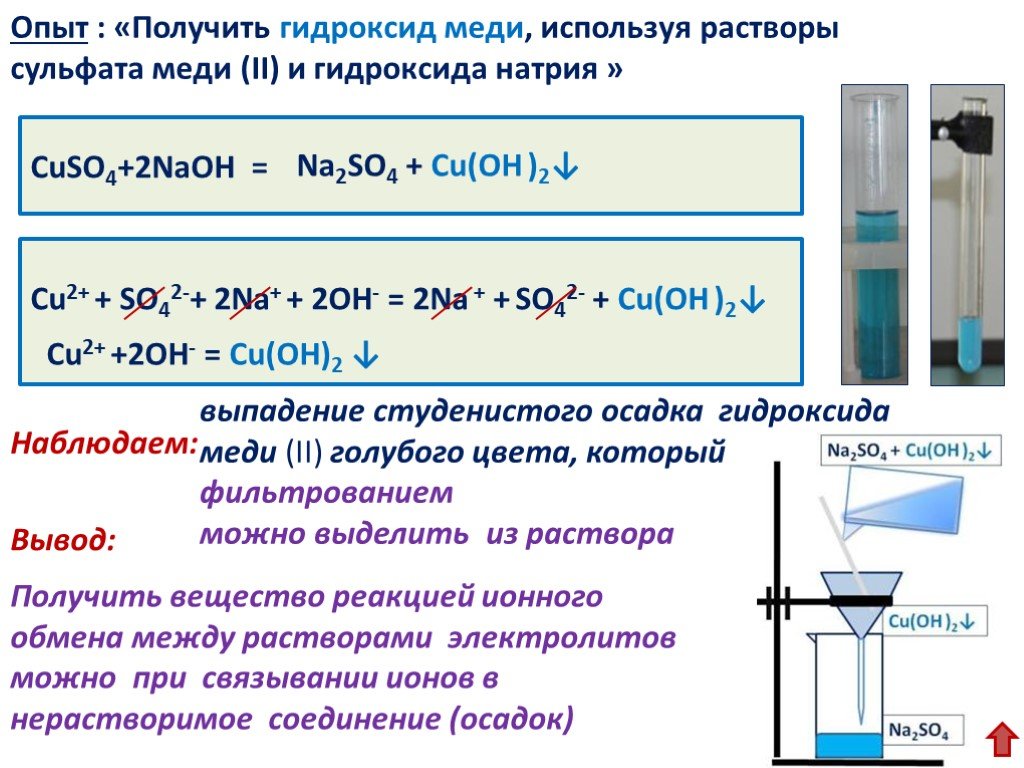 Кроме того, при прокаливании нередко происходит химическое разложение вещества. Например, оксалат кальция CaC2О4.Н2О, получаемый при осаждении ионов Са2+ оксалатом аммония, уже при высушивании теряет кристаллизационную воду:
Кроме того, при прокаливании нередко происходит химическое разложение вещества. Например, оксалат кальция CaC2О4.Н2О, получаемый при осаждении ионов Са2+ оксалатом аммония, уже при высушивании теряет кристаллизационную воду:
CaC2O4 . h3O → CaC2O4 + h3O
При слабом прокаливании он выделяет окись углерода и превращается в карбонат кальция:
CaC2O4 → СО2 + СаСО3
Наконец, при сильном прокаливании карбонат кальция разлагается с образованием двуокиси углерода и окиси кальция:
CaCO3 → CaO + CO2
По массе окиси кальция и вычисляют результат определения. Температура и продолжительность прокаливания осадков могут быть различны.
В самой технике прокаливания различают два случая.
1. Прокаливание осадка без отделения фильтра. Этот способ используют, когда прокаливаемый осадок не взаимодействует с углеродом обуглившегося фильтра. Так, без удаления фильтра прокаливают осадки оксидов Al2O3, CaO и некоторые другие.
Фарфоровый тигель, доведенный до постоянной массы, ставят на глянцевую (лучше черную) бумагу. Осторожно извлекают из воронки высушенный фильтр с осадком и, держа над тиглем, свертывают. После этого аккуратно укладывают его в тигель. Если при внимательном осмотре на воронке обнаруживают следы осадка, то тщательно вытирают внутреннюю поверхность ее кусочком беззольного фильтра, который помещают в тот же тигель. Наконец, крупинки осадка, просыпавшиеся на бумагу при свертывании фильтра, также стряхивают в тигель. Затем ставят тигель на электрическую плитку и осторожно озоляют (сжигают) фильтр. Иногда вместо этого тигель вставляют в фарфоровый треугольник на кольце штатива и нагревают на небольшом пламени горелки. Желательно, чтобы фильтр медленно обуглился и истлел, не вспыхивая, так как горение приводит к потере мельчайших частиц осадка. Если он все-таки загорится, то пламя ни в коем случае не задувают, а только перестают нагревать и ждут, когда горение прекратится.
Осторожно извлекают из воронки высушенный фильтр с осадком и, держа над тиглем, свертывают. После этого аккуратно укладывают его в тигель. Если при внимательном осмотре на воронке обнаруживают следы осадка, то тщательно вытирают внутреннюю поверхность ее кусочком беззольного фильтра, который помещают в тот же тигель. Наконец, крупинки осадка, просыпавшиеся на бумагу при свертывании фильтра, также стряхивают в тигель. Затем ставят тигель на электрическую плитку и осторожно озоляют (сжигают) фильтр. Иногда вместо этого тигель вставляют в фарфоровый треугольник на кольце штатива и нагревают на небольшом пламени горелки. Желательно, чтобы фильтр медленно обуглился и истлел, не вспыхивая, так как горение приводит к потере мельчайших частиц осадка. Если он все-таки загорится, то пламя ни в коем случае не задувают, а только перестают нагревать и ждут, когда горение прекратится.
Закончив озоление фильтра, переносят тигель в муфельную печь и прокаливают 25—30 мин. Охлаждают тигель в эксикаторе, взвешивают и записывают значение его массы в лабораторный журнал. Повторяют прокаливание (15—20 мин), охлаждение и взвешивание до тех пор, пока не будет достигнута постоянная масса тигля с осадком.
Повторяют прокаливание (15—20 мин), охлаждение и взвешивание до тех пор, пока не будет достигнута постоянная масса тигля с осадком.
2. Прокаливание осадка с отделением фильтра. К этому способу прибегают, когда осадок при обугливании фильтра может химически взаимодействовать с углеродом (восстанавливаться). Например, осадок хлорида серебра AgCl восстанавливается углеродом до свободного серебра; прокаливать его вместе с фильтром нельзя.
Хорошо высушенный осадок возможно полнее высыпают из фильтра на глянцевую бумагу и накрывают химическим стаканом (или опрокинутой воронкой), чтобы предотвратить потери. Фильтр с оставшимися на нем частицами осадка укладывают в тигель (доведенный до постоянной массы), сжигают и прокаливают. К прокаленному остатку в том же тигле присоединяют ранее отделенный осадок. После этого, как обычно, содержимое тигля прокаливают до постоянной массы.
Если осадок отфильтровывают с помощью стеклянного тигля, то вместо прокаливания прибегают к высушиванию до постоянной массы. Разумеется, фильтрующий тигель должен быть предварительно доведен до постоянной массы при той же температуре.
Разумеется, фильтрующий тигель должен быть предварительно доведен до постоянной массы при той же температуре.
Если в ходе анализа будет допущена непоправимая ошибка (например, потеряна часть осадка, пролита часть раствора с осадком и т. п.), то определение следует начать снова, не расходуя время на получение заведомо неверного результата.
Взвешивание
Взвешивание производят на аналитических весах с точностью до 10-6 г. (ВЛР 200)
Условие задачи С2 на ЕГЭ по химии — это текст, описывающий последовательность экспериментальных действий. Данный текст нужно превратить в уравнения реакций.
Трудность такого задания в том, что школьники слабо представляют себе экспериментальную, не «бумажную» химию. Не все понимают используемые термины и протекающие процессы. Попробуем разобраться.
Очень часто понятия, которые химику кажутся совершенно ясными, абитуриентами воспринимаются неправильно. Вот кратких словарь таких понятий.
Словарь непонятных терминов.
- Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах ).
 Она не имеет отношения к навесу над крыльцом:-)
Она не имеет отношения к навесу над крыльцом:-) - Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. Это не «смешивание с калием» и не «прокалывание гвоздём».
- «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Колба или сосуд при этом не взрываются !
- Отфильтровать — отделить осадок от раствора.
- Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
- Фильтрат — это профильтрованный раствор .
- Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли NaCl получается раствор поваренной же соли NaCl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария).
 Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д. - Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
- Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения.
- Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. С плаванием по реке ничего общего не имеет:-)
- Осадок и остаток.
Очень часто путают эти термины. Хотя это совершенно разные понятия.
«Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. Такие вещества выпадают на дно реакционного сосуда (пробирки или колбы).
«Остаток» — это вещество, которое осталось , не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком .
- Насыщенный раствор — это раствор, в котором при данной температуре концентрация вещества максимально возможная и больше уже не растворяется.
Ненасыщенный раствор — это раствор, концентрация вещества в котором не является максимально возможной, в таком растворе можно дополнительно растворить ещё какое-то количество данного вещества, до тех пор, пока он не станет насыщенным.
Разбавленный и «очень» разбавленный раствор — это весьма условные понятия, скорее качественные, чем количественные. Подразумевается, что концентрация вещества невелика.
Для кислот и щелочей также используют термин «концентрированный» раствор. Это тоже характеристика условная. Например, концентрированная соляная кислота имеет концентрацию всего около 40%. А концентрированная серная — это безводная, 100%-ная кислота.
Для того, чтобы решать такие задачи, надо чётко знать свойства большинства металлов, неметаллов и их соединений: оксидов, гидроксидов, солей. Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Необходимо повторить свойства азотной и серной кислот, перманганата и дихромата калия, окислительно-восстановительные свойства различных соединений, электролиз растворов и расплавов различных веществ, реакции разложения соединений разных классов, амфотерность, гидролиз солей и других соединений, взаимный гидролиз двух солей.
Кроме того, необходимо иметь представление о цвете и агрегатном состоянии большинства изучаемых веществ — металлов, неметаллов, оксидов, солей.
Именно поэтому мы разбираем этот вид заданий в самом конце изучения общей и неорганической химии.
Рассмотрим несколько примеров подобных заданий.
Пример 1: Продукт взаимодействия лития с азотом обработали водой. Полученный газ пропустили через раствор серной кислоты до прекращения химических реакций. Полученный раствор обработали хлоридом бария. Раствор профильтровали, а фильтрат смешали с раствором нитрита натрия и нагрели.
Решение:
Пример 2: Навеску алюминия растворили в разбавленной азотной кислоте, при этом выделялось газообразное простое вещество. К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили , фильтрат упарили , полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
К полученному раствору добавили карбонат натрия до полного прекращения выделения газа. Выпавший осадок отфильтровали и прокалили , фильтрат упарили , полученный твёрдый остаток сплавили с хлоридом аммония. Выделившийся газ смешали с аммиаком и нагрели полученную смесь.
Решение:
Пример 3: Оксид алюминия сплавили с карбонатом натрия, полученное твёрдое вещество растворили в воде. Через полученный раствор пропускали сернистый газ до полного прекращения взаимодействия. Выпавший осадок отфильтровали, а к профильтрованному раствору прибавили бромную воду. Полученный раствор нейтрализовали гидроксидом натрия.
Решение:
Пример 4: Сульфид цинка обработали раствором соляной кислоты, полученный газ пропустили через избыток раствора гидроксида натрия, затем добавили раствор хлорида железа (II). Полученный осадок подвергли обжигу. Полученный газ смешали с кислородом и пропустили над катализатором.
Решение:
Пример 5: Оксид кремния прокалили с большим избытком магния. Полученную смесь веществ обработали водой. При этом выделился газ, который сожгли в кислороде. Твёрдый продукт сжигания растворили в концентрированном растворе гидроксида цезия. К полученному раствору добавили соляную кислоту.
Решение:
Задания С2 из вариантов ЕГЭ по химии для самостоятельной работы.
- Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в концентрированной азотной кислоте.
- Фосфат кальция сплавили с углём и песком, затем полученное простое вещество сожгли в избытке кислорода, продукт сжигания растворили в избытке едкого натра. К полученному раствору прилили раствор хлорида бария. Полученный осадок обработали избытком фосфорной кислоты.
- Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде.
 В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия. - На сухой хлорид натрия подействовали концентрированной серной кислотой при слабом нагревании, образующийся газ пропустили в раствор гидроксида бария. К полученному раствору прилили раствор сульфата калия. Полученный осадок сплавили с углем. Полученное вещество обработали соляной кислотой.
- Навеску сульфида алюминия обработали соляной кислотой. При этом выделился газ и образовался бесцветный раствор. К полученному раствору добавили раствор аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом осадок обработали раствором пероксида водорода.
- Порошок алюминия смешали с порошком серы, смесь нагрели, полученное вещество обработали водой, при этом выделился газ и образовался осадок, к которому добавили избыток раствора гидроксида калия до полного растворения. Этот раствор выпарили и прокалили. К полученному твёрдому веществу добавили избыток раствора соляной кислоты.

- Раствор иодида калия обработали раствором хлора. Полученный осадок обработали раствором сульфита натрия. К полученному раствору прибавили сначала раствор хлорида бария, а после отделения осадка — добавили раствор нитрата серебра.
- Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным.
- (МИОО 2011, тренинговая работа) Алюминий растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропускали углекислый газ до прекращения выделения осадка. Осадок отфильтровали и прокалили. Полученный твердый остаток сплавили с карбонатом натрия.
- (МИОО 2011, тренинговая работа) Кремний растворили в концентрированном растворе гидроксида калия.
 К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Ответы к заданиям для самостоятельного решения:
- или
Прокаливание медной проволоки и взаимодействие с серной кислотой. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 1.
Прокаливание медной проволоки и взаимодействие с серной кислотой. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 1. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Проведите следующий опыт. Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой.
Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой.
Зажгите спиртовку (газовую горелку). Возьмите тигельными щипцами медную проволоку и внесите её в пламя. Через некоторое время выньте проволоку из пламени и счистите с неё образовавшийся чёрный налёт на лист бумаги. Опыт повторите несколько раз. Поместите полученный чёрный налёт в пробирку и прилейте в неё раствор серной кислоты. Подогрейте смесь. Что наблюдаете?
Образовалось ли новое вещество при накаливании меди? Запишите уравнение химической реакции и определите её тип по признаку числа и состава исходных веществ и продуктов реакции. Какие признаки химической реакции вы наблюдали? Образовалось ли новое вещество при взаимодействии оксида меди (II) с серной кислотой? Определите тип реакции по признаку числа и состава исходных веществ и продуктов реакции и запишите её уравнение.
ответы
Выполнение работы:
Внесли в пламя горелки медную проволоку, происходит нагревание меди и окисление ее на воздухе.
Произошла химическая реакция, образовавшийся черный налет —
оксид меди (II).
Счистим образовавшийся налет на лист бумаги. Повторим опыт
несколько раз. Полученный налет поместили в пробирку и прилили в нее раствор серной кислоты, смесь подогрели. Весь порошок растворился, раствор стал голубым:
— реакция обмена.
Произошла химическая реакция, образовался сульфат меди (II).
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
9. Определите ряд, в котором в обоих словах пропущена одна и та же буква. ЕГЭ-2017 Русский язык Цыбулько И. П. ГДЗ. Вариант 12.
9.
Определите ряд, в котором в обоих словах пропущена одна и та же буква. Выпишите
Выпишите
эти слова, вставив пропущенную букву. (Подробнее…)
ГДЗРусский языкЕГЭЦыбулько И.П.
Что такое кальцинирование?
Прокаливание – это процесс нагревания твердого материала с целью химического разделения его компонентов. Разнообразие химического разделения позволяет прокалке решать ряд задач, от удаления химически связанной (кристаллической) воды до улетучивания загрязняющих веществ из исходного материала, термического разложения и даже фазовых переходов. Каждая из этих целей, в свою очередь, обеспечивает широкий спектр отраслевых и материальных приложений и технологических целей.
Прокаливание дает промышленным производителям инструмент для контроля характеристик конечного продукта, сведения к минимуму загрязнения отходами или побочными продуктами процесса и многого другого. Таким образом, прокаливание стало важной обработкой в условиях промышленного процесса, а ротационная кальцинатор — краеугольным камнем процесса.
Примечание. Важно понимать, что термин «кальцинирование» часто используется взаимозаменяемо с другими процессами термической обработки, несмотря на то, что оно не соответствует техническому определению настоящего процесса кальцинирования. Это привело к значительной путанице в отношении процесса и общего использования термина.
Более глубокий взгляд на процесс прокаливания
Прокаливание заключается в нагревании материала до заданной температуры в течение заданного периода времени в контролируемой атмосфере. Истинное прокаливание происходит, когда материал доводится до температуры, при которой один или несколько компонентов химически разделяются на более основные строительные блоки. Это часто приводит к окислению целевого компонента, удалению летучих компонентов или органических веществ, химическому обезвоживанию и/или разложению карбонатов.
Поскольку этот термин имеет столь широкое применение, в некоторых случаях его можно использовать для обозначения других термических процессов, таких как восстановление, затвердевание, термофиксация и т. д.
д.
Когда материал подвергается кальцинированию, его часто называют «кальцинированным», независимо от его происхождения или состава.
Важные параметры прокаливания
Процесс прокаливания является гибким в том смысле, что можно манипулировать различными параметрами процесса для управления реакцией(ями) и точной настройки характеристик конечного продукта. Здесь собраны наиболее важные параметры.
Температурный профиль
Во время прокаливания тщательно измеряются и контролируются как температура процесса, так и температура материала. Во многих случаях температуру регулируют для быстрого или постепенного повышения, выдерживания материала при заданной температуре в течение определенного периода времени и/или быстрого или постепенного охлаждения.
Управление температурой осуществляется через систему управления декарбонизатором с датчиками внутри устройства, предоставляющими данные оператору.
Время удерживания
Время удерживания или пребывания тесно связано с температурными требованиями, поскольку материал часто требует выдержки при температуре для достижения желаемой реакции. Время удерживания регулируется скоростью барабана, наклоном, размером и, при необходимости, перемычками.
Время удерживания регулируется скоростью барабана, наклоном, размером и, при необходимости, перемычками.
Атмосферные условия
Атмосферные условия внутри кальцинатора обеспечивают технологическую среду, необходимую для проведения намеченной реакции. Это обычно требует тщательного контроля количества кислорода в печи, а в некоторых случаях может потребовать введения инертного газа для облегчения или максимизации эффективности реакции.
Вращающиеся кальцинаторы (печи)
Для проведения процесса кальцинирования доступны различные типы оборудования, причем вращающиеся печи являются одним из наиболее часто используемых типов.
Прокаливание можно проводить во вращающихся печах прямого или косвенного нагрева, которые в данном случае часто называют кальцинаторами.
Вращающиеся кальцинаторы прямого нагрева
Печи прямого нагрева используют прямой контакт между материалом и продуктами сгорания для нагревания материала. Материал подается во вращающийся барабан вместе с продуктами сгорания. Материал и продукты сгорания могут двигаться прямотоком (параллельно) или противотоком друг другу в зависимости от целей процесса и характеристик материала.
Материал и продукты сгорания могут двигаться прямотоком (параллельно) или противотоком друг другу в зависимости от целей процесса и характеристик материала.
Две печи FEECO с прямым нагревом (кальцинаторы)
Вращающиеся печи с непрямым нагревом
В то время как в печах с прямым нагревом используется прямой контакт между материалом и продуктами сгорания, в печах с непрямым нагревом контакт между материалом и продуктами отсутствует. сгорания. Это позволяет жестко контролировать или инертить среду обработки и идеально подходит для материалов, которые не могут вступать в контакт с кислородом или которым требуется особая атмосфера для протекания желаемой реакции.
В этом случае внутренняя часть барабана герметизирована и нагревается снаружи. Материал нагревается не за счет контакта с продуктами сгорания, а за счет контакта с корпусом барабана. Этот подход гораздо менее эффективен, но необходим для некоторых материалов и целей процесса.
Кальцинатор FEECO
Печь FEECO косвенного нагрева/кальцинатор для переработки древесной щепы
Для повышения эффективности печи любого типа можно использовать различные внутренние компоненты. Это может включать в себя добавление пролетов, дамб, нарушителей кроватей и многого другого.
Промышленные примеры обжига
Обжиг – это распространенный процесс, наиболее известным примером которого является диссоциация карбоната кальция с образованием оксида кальция и двуокиси углерода при производстве цемента из известняка. Другие области применения прокаливания включают:
- Подготовка катализатора
- Переработка диатомита
- Обработка каолиновой глины
- Преобразование сподумена в литий
- Производство керамзитобетона
- Производство пигментов
- Производство алюминия и глинозема
В зависимости от материала и целей процесса процесс прокаливания часто используется для контроля качества продукта, например:
- Яркость
- Чистота
- Пористость и/или площадь поверхности
- Пористая структура
- Показатель преломления
- Химическая стабильность
- Рыхлость
- Инертность
- Поглощающая способность
- Химическая фаза
- Цвет
- Плотность
- Абразивность
- Непрозрачность
- И еще…
Разработка эффективного процесса кальцинирования
Множество целей кальцинирования в сочетании с рядом материалов, их уникальными характеристиками и различными целями конечного продукта делают тестирование важной частью разработки эффективного и действенного процесса кальцинирования для данного применения. .
.
Инновационный центр FEECO предлагает несколько серийных и опытных испытательных печей (как прямых, так и непрямых) для тестирования опытно-конструкторских работ, включая демонстрацию концепции, продукта и процесса. Процесс тестирования также дает производителям возможность собирать важные данные о процессе обработки своего материала для масштабирования и проектирования кальцинатора промышленного масштаба, в том числе:
- Отбор проб и анализ газа
- Требования к предварительной обработке
- Параметры процесса
- Расход топлива горелкой
- Калибровка кальцинатора
- Выбросы
Испытание прокаливанием в кальцинаторе периодического действия в Инновационном центре FEECO
Заключение
Прокаливание – это разнообразная термическая обработка, при которой химическое разделение компонентов дает производителям возможность удалять летучие компоненты, улучшать характеристики продукта, удалять кристаллическую воду, и более. Температура, время удерживания и рабочая атмосфера являются важными факторами при прокаливании и часто определяются в ходе испытаний.
Температура, время удерживания и рабочая атмосфера являются важными факторами при прокаливании и часто определяются в ходе испытаний.
FEECO разрабатывает и производит лучшие в отрасли ротационные кальцинаторы на заказ. А с хорошо оборудованным испытательным оборудованием производители могут быть уверены, что их процесс прокаливания будет работать эффективно и надежно. Для получения дополнительной информации о наших кальцинаторах или возможностях тестирования свяжитесь с нами сегодня!
Известняк кальцинированный в области химии.
Известняк является одним из наиболее широко используемых и наименее дорогих подщелачивающих агентов во всем мире. Он часто используется в химических операциях в виде гашеной или гидроксида кальция. Тепловой распад известняка на твердый известняк и углекислый газ называется «кальцинированием известняка». Его часто называют «кальцинацией». Довольно простые химические процессы характеризуют разложение известняка.
При работе с известняком наблюдается сложность, приводящая к различиям в кристаллографии и микроструктуре. Кинетика разрушения гранулированного и кускового известняка довольно сложна. В результате возможность разработки единой теории кальцинирования ограничена. Этот модуль поможет нам узнать об кальцинировании известняка.
Кинетика разрушения гранулированного и кускового известняка довольно сложна. В результате возможность разработки единой теории кальцинирования ограничена. Этот модуль поможет нам узнать об кальцинировании известняка.
Прокаливание представляет собой металлургический процесс, при котором металлы обжигают при высоких температурах и давлении или ограниченной подаче воздуха для удаления летучих соединений и превращения металлов в их оксиды. Другими словами, кальцинирование относится к процессу превращения умершего человеческого трупа в остаток, который не так значителен, как депозит, полученный в результате кремации.
Точное химическое определение кальцинирования относится к термическому разложению карбонатных минералов, таких как карбонат кальция (это один из важных минералов в семействе известняков), который помогает создать соединение, называемое оксидом кальция, в печи, состоящей из цемента.
Некоторые системы также содержат альтернативные варианты мощности измельчения до, во время и после прокаливания, в зависимости от желаемых продуктов. Коммерческое оборудование для обжига включает в себя кальцинаторы мгновенного испарения, котловые кальцинаторы, ротационные кальцинаторы, кальцинаторы с псевдоожиженным слоем для бета-гипса и автоклавные кальцинаторы для альфа-гипса. Различные системы обжига имеют различную производительность, периоды пребывания и эффективность и производят различные характеристики гипса, которые определяют их наилучшее применение.
Коммерческое оборудование для обжига включает в себя кальцинаторы мгновенного испарения, котловые кальцинаторы, ротационные кальцинаторы, кальцинаторы с псевдоожиженным слоем для бета-гипса и автоклавные кальцинаторы для альфа-гипса. Различные системы обжига имеют различную производительность, периоды пребывания и эффективность и производят различные характеристики гипса, которые определяют их наилучшее применение.
При кальцинировании известняка с образованием негашеной извести термическое разложение карбоната кальция можно представить как-.
CaCO3 (100 г) + тепло ⇆ CaO (56 г) + CO2 (44 г)
Давление диссоциации кальцита зависит от температуры. При температуре около 900 ° C оно достигает 1 атм (101,3 кПа). По сравнению с предыдущими исследованиями, которые показали температуру 898°C, недавнее исследование показало значение 902,5°C.
Известняк Прокаливание сопровождается тепловой диссоциацией. В литературе теплота диссоциации кальцита эквивалентна 25°C и измерена в диапазоне от 695 до 834 ккал/кг CaO. Бойнтон сообщил о средней цифре 770 ккал/кг, а Шварцкопф сообщил о норме 754 ккал/кг.
В литературе теплота диссоциации кальцита эквивалентна 25°C и измерена в диапазоне от 695 до 834 ккал/кг CaO. Бойнтон сообщил о средней цифре 770 ккал/кг, а Шварцкопф сообщил о норме 754 ккал/кг.
Кальцинирование является сбалансированной реакцией. CaCO3 распадается на известняк, если атмосферное давление CO2 меньше, чем парциальное равновесное давление при определенной температуре. Если атмосферное давление CO2 превышает эту точку равновесия, любой созданный известняк снова превращается в карбонат.
Таким образом, скорость разложения определяется парциальным давлением CO2, температурой реакции и размером частиц. Даже в отсутствие СО2 темп реакции становится крайне медленным при 700 градусах Цельсия и атмосферном давлении. Химическая активность варьируется в зависимости от источников известняка не только из-за изменений в кристаллической структуре, но и из-за состава примесей.
Прокаливание CaCO3 является высокоэндотермическим процессом, требующим около 755 Мкал подводимого тепла и образующим одну тонну известняка (CaO). При повышении температуры выше температуры диссоциации карбонатов в известняке начинается реакция. Обычно это от 780 до 1340 градусов по Цельсию.
При повышении температуры выше температуры диссоциации карбонатов в известняке начинается реакция. Обычно это от 780 до 1340 градусов по Цельсию.
После начала реакции температуру необходимо поддерживать выше точки диссоциации, а образовавшийся CO2 необходимо удалить. Диссоциация CaCO3 происходит постепенно от внешней поверхности частицы внутрь, оставляя пористый слой CaO, что является желаемым результатом.
Таким образом, процесс зависит от достаточной температуры обжига около 800°C, чтобы гарантировать разрушение и хорошее время контакта, т.е. выдерживать известь/известняк в течение достаточно длительного периода времени при температуре от 1000°C до 1200°С, чтобы регулировать его реакционную способность.
Использование известняка после кальцинирования Известняк является одним из основных сырьевых материалов, используемых в сталелитейной промышленности, и он используется как в процессах производства чугуна и стали, так и во вспомогательных операциях.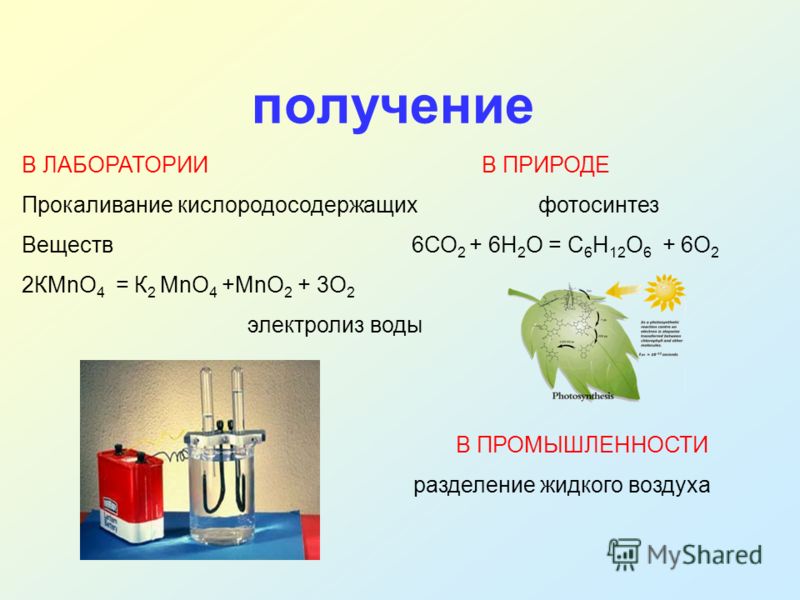 Подавляющее большинство известняка используется в производстве стали для флюсования примесей в сталеплавильных печах и в некоторых других процессах производства стали. Известняк также используется в различных количествах в процессе агломерации для подготовки железной руды, десульфурации чугуна, нейтрализации кислоты и в водоочистных сооружениях.
Подавляющее большинство известняка используется в производстве стали для флюсования примесей в сталеплавильных печах и в некоторых других процессах производства стали. Известняк также используется в различных количествах в процессе агломерации для подготовки железной руды, десульфурации чугуна, нейтрализации кислоты и в водоочистных сооружениях.
Реактивность известняка измеряет, насколько быстро известняк реагирует в присутствии воды. Гашение известняка в воде — это процедура испытания, используемая для определения реакционной способности измельченной извести. На реакционную способность известняка влияют различные факторы, связанные с сырьем и процессом. Это параметры-
- Кристаллическая структура известняка
- Время и температура горения
- Примеси известняка
- Тип печи
- Топливо
Этот модуль объяснит и поможет учащимся узнать все о теме кальцинирования.

 Она не имеет отношения к навесу над крыльцом:-)
Она не имеет отношения к навесу над крыльцом:-) Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т.д.
 В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия. К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
К полученному раствору добавили избыток соляной кислоты. Помутневший раствор нагрели. Выделившийся осадок отфильтровали и прокалили с карбонатом кальция. Напишите уравнения описанных реакций.
Leave A Comment