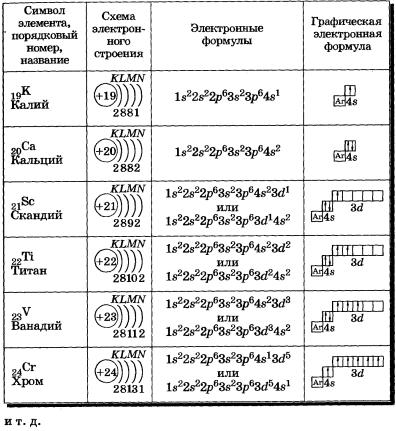
Четвертый период, 4 период, периодическая система химических элементов
Четвертый период, 4 период, периодическая система химических элементов- Главная
- Статьи
- Периодическая система элементов — Периодическая система химических элементов, периодическая система элементов Менделеева
- Четвертый период, 4 период, периодическая система химических элементов
+++++
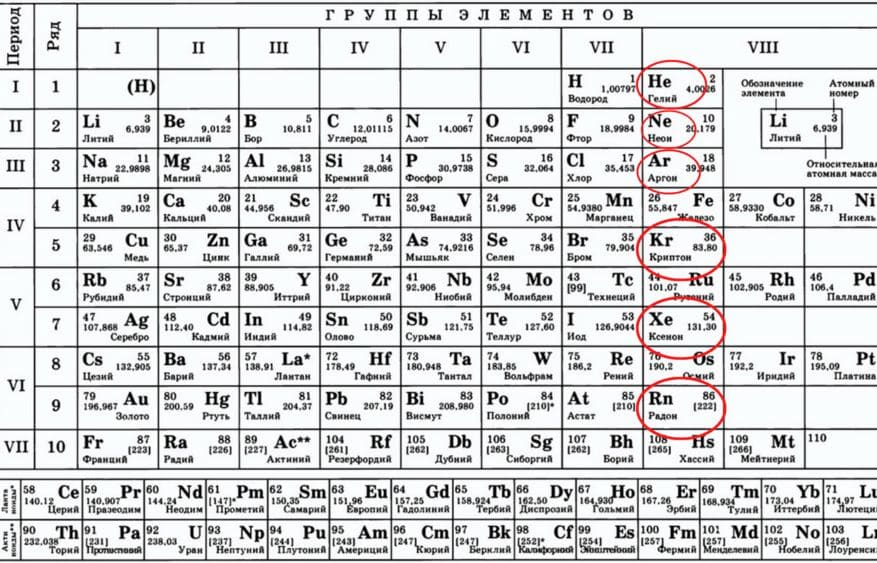
Четвёртый период периодической системы элементов
Четвёртый период (K — Kr) содержит 18 элементов (первый большой период, по Менделееву). После щелочного металла K и щёлочноземельного Ca (s-элементы) следует ряд из десяти так называемых переходных элементов (Sc — Zn), или d-элементов (символы даны синим цветом), которые входят в подгруппы б соответствующих групп П.
Большинство переходных элементов (все они металлы) проявляет высшие степени окисления, равные номеру группы. Исключение — триада Fe — Co — Ni, где два последних элемента максимально положительно трёхвалентны, а железо в определённых условиях известно в степени окисления VI. Элементы, начиная с Ga и кончая Kr (р-элементы), принадлежат к подгруппам а, и характер изменения их свойств такой же, как и в соответствующих интервалах Z у элементов второго и третьего периодов. Установлено, что Kr способен образовывать химические соединения (главным образом с F), но степень окисления VIII для него неизвестна.
Четвертый период периодической системы химических элементов
|
IA |
IIA |
IIIB |
IVB |
VB |
VIB |
VIIB |
—- |
VIIIB |
—- |
IB |
IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
|
| Период | ||||||||||||||||||
| 4 |
19
K |
20
Ca |
21
Sc |
22
Ti |
23
V |
24
Cr |
25
Mn |
26
Fe |
27
Co |
28
Ni |
29
Cu |
30
Zn |
31
Ga |
32
Ge |
33
As |
Se |
35
Br |
36
Kr |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Полуметаллы | Неметаллы | Галогены | Инертные газы |
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||
| Период | ||||||||||||||||||
| 1 |
1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 |
3 Li Литий |
4 Be Бериллий |
5 Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 |
11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 |
19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 |
37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 |
55 Cs Цезий |
56 Ba Барий |
* |
72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 |
87 Fr Франций |
88 Ra Радий |
** |
(104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 |
(119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * |
57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** |
89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Полуметаллы — полуметаллы, металл, химия, уровень и свойства.
Полуметаллы, Полуметаллы.
Полуметаллы (металлоиды, амфотерные металлы) — химические элементы, расположенные в периодической системе на границе между металлами и неметаллами. Для них характерно образование ковалентной кристаллической решётки и наличие металлической проводимости.
В физике твёрдого тела полуметаллами называются различные вещества, занимающие по электрическим свойствам промежуточное положение между металлами и полупроводниками.
К полуметаллам относят Bi, Sb, Po, иногда — As, Te, Ge, которые по своим химическим свойствам являются неметаллами, но по типу проводимости относятся к проводникам, а также Sn, имеющее полупроводниковую форму, и аллотропную модификацию углерода — графит.
Группа элементов, металлов относящихся к Полуметаллам:
Bi
Sb
Po
As
Te
Ge
Отличие от полупроводников полуметаллы обладают электрической проводимостью при абсолютном нуле температуры, и в отличие от металлов их проводимость с температурой возрастает.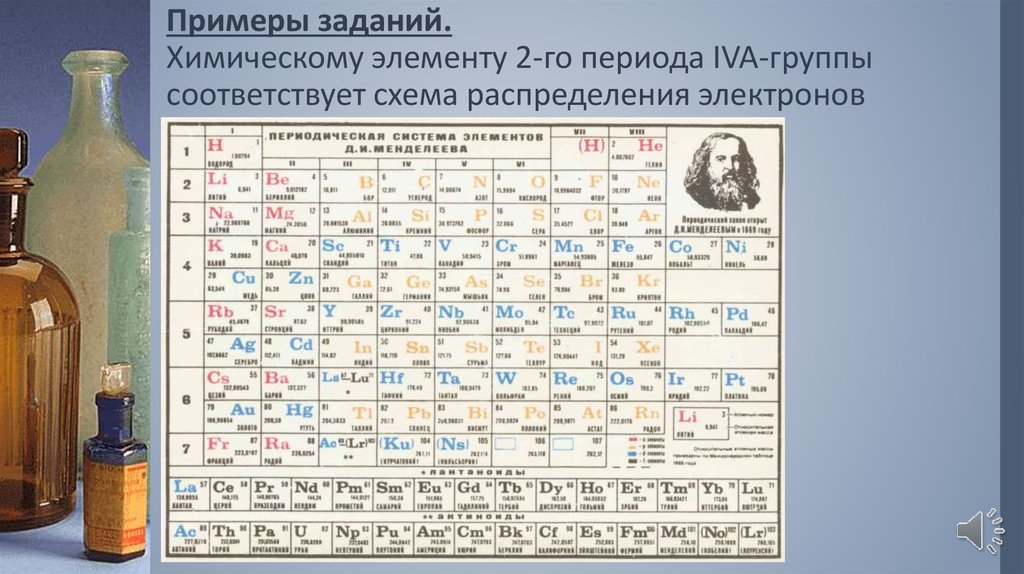 Характерной особенностью полуметаллов является слабое перекрытие валентной зоны и зоны проводимости, что приводит, с одной стороны, к тому, что полуметаллы остаются проводниками электрического тока вплоть до абсолютного нуля температуры, а с другой стороны — с повышением температуры число носителей тока (электронов и дырок) возрастает, но всё-таки остаётся небольшим, достигая концентрации 1018—1020 см–3, или 10–3 на атом.
Характерной особенностью полуметаллов является слабое перекрытие валентной зоны и зоны проводимости, что приводит, с одной стороны, к тому, что полуметаллы остаются проводниками электрического тока вплоть до абсолютного нуля температуры, а с другой стороны — с повышением температуры число носителей тока (электронов и дырок) возрастает, но всё-таки остаётся небольшим, достигая концентрации 1018—1020 см–3, или 10–3 на атом.
Носители тока в полуметаллах отличаются большой подвижностью и малой эффективной массой. Благодаря этому полуметаллы — наиболее подходящие объекты для наблюдения размерных эффектов, фазовых переходов полуметалл — диэлектрик в сильных магнитных полях и ряда других явлений.
Близки к группе неметаллы — химическим элементам с неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
Нас находят по запросам:
— полуметаллы
— уровень ферми
— полуметаллах
— полуметалл и его свойства
— химия и полуметаллы
— Полуметаллы и физика
— Физика твёрдого тела
6.4: Современная периодическая таблица — периоды и группы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53035
Как менялся словарь английского языка с течением времени?
Язык меняется со временем. Новые слова входят в язык, а старые слова часто исчезают из-за неиспользования. Словари издаются, чтобы люди могли быть в курсе изменений в языке и знать, как правильно использовать слова. Эти публикации могут быть в печатном виде, как приведенный ниже юридический словарь, или в электронном виде. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари бесценны для хорошего, надежного общения.
Новые слова входят в язык, а старые слова часто исчезают из-за неиспользования. Словари издаются, чтобы люди могли быть в курсе изменений в языке и знать, как правильно использовать слова. Эти публикации могут быть в печатном виде, как приведенный ниже юридический словарь, или в электронном виде. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари бесценны для хорошего, надежного общения.
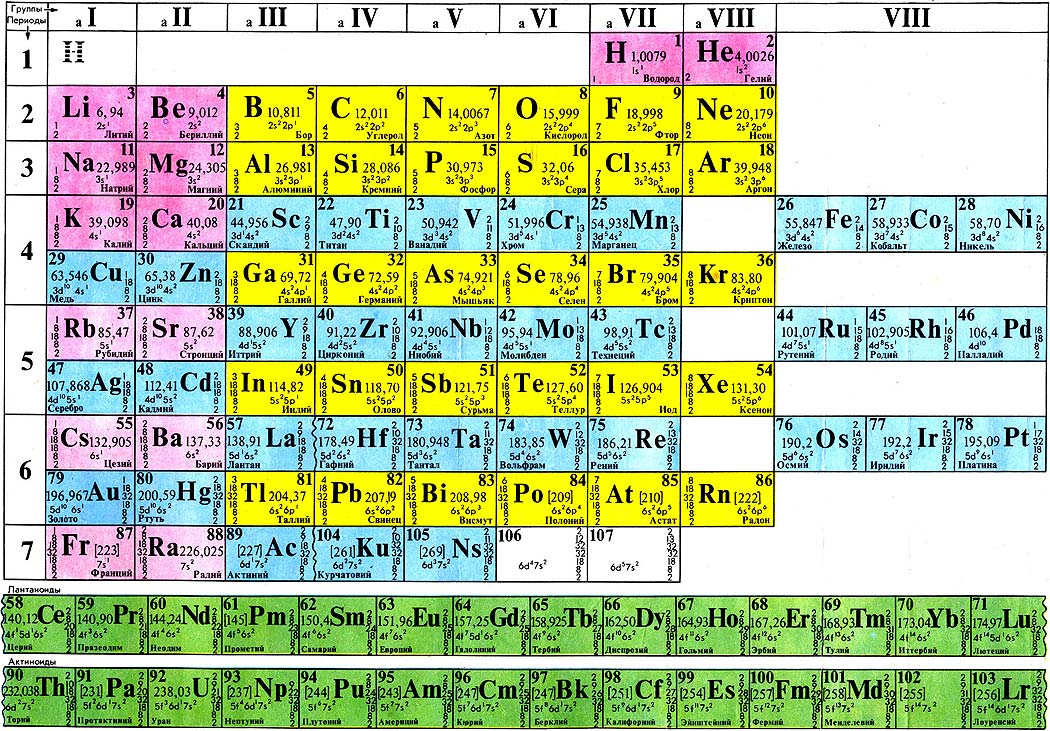
Современная периодическая таблица
Периодическая таблица претерпела значительные изменения с тех пор, как она была первоначально разработана Менделеевым и Мозли. Было открыто много новых элементов, а другие были искусственно синтезированы. Каждый правильно вписывается в группу элементов со схожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы со схожими свойствами появляются в одном и том же вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева.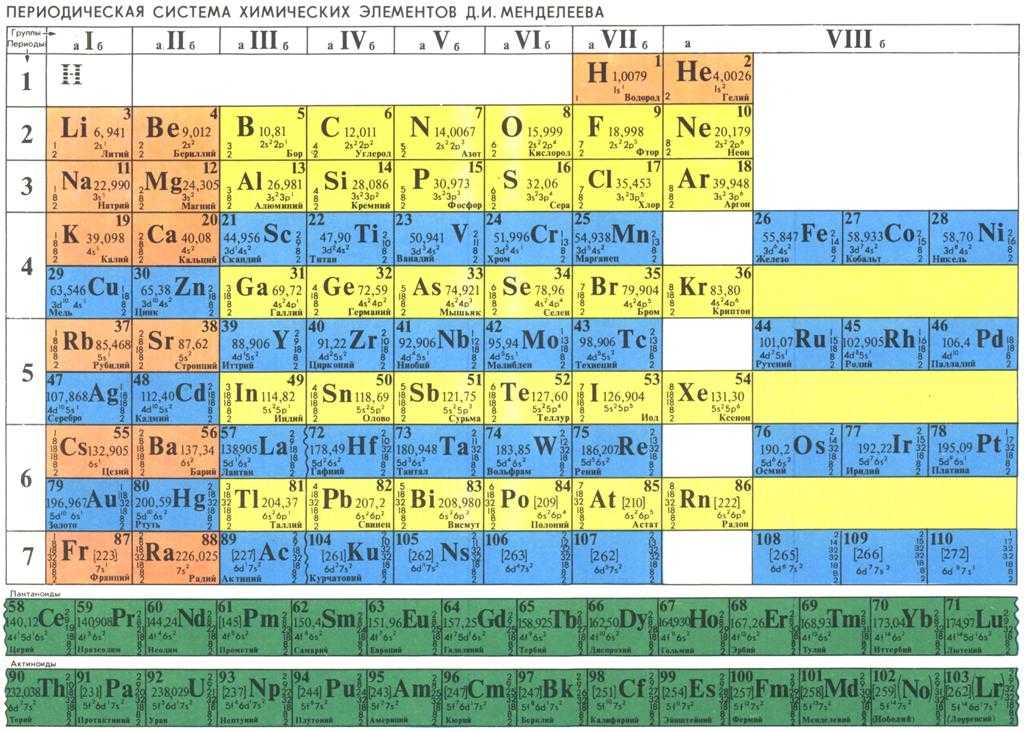 Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые из символов кажутся не связанными с названием элемента: \(\ce{Fe}\) для железа, \(\ce{Pb}\) для свинца и т. д. Большинство из них — это элементы, которые известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые из символов кажутся не связанными с названием элемента: \(\ce{Fe}\) для железа, \(\ce{Pb}\) для свинца и т. д. Большинство из них — это элементы, которые известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период — это горизонтальная строка периодической таблицы. В периодической таблице семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый главный энергетический уровень начинает заполняться электронами. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 — 8 элементов. Периоды 4 и 5 имеют 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, относятся к этим периодам. Эти две строки удалены, чтобы сама таблица легче помещалась на одной странице.
Эти две строки удалены, чтобы сама таблица легче помещалась на одной странице.
Группа — это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Всего 18 групп. Существуют две различные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими. Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы — это 1A и 2A, а последние шесть групп — от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы устранить путаницу, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
Самые последние изображения периодической таблицы показывают неполный седьмой период. Фактически, многие из этих элементов седьмого периода не были известны до начала двадцатого века. Многие элементы были синтезированы путем бомбардировки известных элементов субатомными частицами, такими как нейтроны или альфа-частицы. Уран использовался таким образом для получения элементов 93-100. Более крупные элементы (атомные номера 101 и выше) образуются путем слияния ядер более мелких элементов вместе.
Многие элементы были синтезированы путем бомбардировки известных элементов субатомными частицами, такими как нейтроны или альфа-частицы. Уран использовался таким образом для получения элементов 93-100. Более крупные элементы (атомные номера 101 и выше) образуются путем слияния ядер более мелких элементов вместе.
Эти синтетические элементы очень нестабильны, часто существуют меньше секунды, поэтому о них мало что известно. Элементы до атомного номера 112 известны (однако, не во всех подробностях), и были выдвинуты некоторые доказательства для элементов 113 и выше, причем элементы 114 и 116 были добавлены в таблицу в 2011 г. В декабре 2015 г. IUPAC подтвердил существование четырех новых элементов 113, 115, 117 и 118 и одобрил их добавление в периодическую таблицу.
Ниже приведены названия новых элементов и их происхождение:
- Элемент 113 был назван Нихоний, символ Nh, предложенный японскими исследователями после японского слова Нихон, что означает Япония.

- Группа ученых из России и США назвала элемент 115, Московий, символ Mc, в честь Москвы и элемент 117, Теннесси, символ Ts, в честь Теннесси.
- Российская команда, открывшая элемент 118, назвала его Оганессон (символ Ог) в честь Юрия Оганесяна, плодовитого охотника за элементами.
Эти элементы завершают седьмой период или строку периодической таблицы.
В приведенном ниже видеоролике рассматриваются группы и тенденции в периодической таблице:
Посмотрите дополнительные видеоролики ниже, чтобы узнать больше о новых идентифицированных и названных химических элементах:
Название и символ элемента: Нигоний (Nh)
Атомный номер: 113
Название элемента и символ: Московий (MC)
Атомный номер: 115
youtube.com/embed/ewQAJtbgr7w?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Наименование элемента и символ: Tennessine (TS)
Atomic Number: 117
900899666666.69666666.66666.966666.66966. ИСПРАВЛЕНИЕ. Символ: Oganesson (Og)Атомный номер: 118
Резюме
- Периодическая таблица упорядочена по атомному номеру.
- Период — это горизонтальная строка периодической таблицы.
- Группа — это вертикальная строка периодической таблицы.
Обзор
- Чем современная таблица Менделеева отличается от той, которую опубликовал Менделеев?
- Все ли элементы современной таблицы Менделеева встречаются в природе? Поясните свой ответ.
- Что такое период? Что он представляет?
- Что такое «группа»? Что она представляет?
- Почему существуют две разные системы нумерации групп?
Эта страница под названием 6. 4: Modern Periodic Table — Periods and Groups распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами Платформа LibreTexts; подробная история редактирования доступна по запросу.
4: Modern Periodic Table — Periods and Groups распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами Платформа LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- нет на странице
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Как читать периодическую таблицу | Группы и периоды
Основные понятия:
В этом уроке вы научитесь читать периодическую таблицу. Мы внимательно рассмотрим группы периодической таблицы. Кроме того, вы узнаете о различных свойствах групп периодической таблицы, периодов и семейств. Если вам понравилась эта статья, обязательно ознакомьтесь с нашими другими!
Статьи по теме:
- Периодические тенденции стали проще
- Элементы
- Как написать конфигурацию электронной оболочки
- Тренд атомного радиуса
- Тренд энергии ионизации
- Периодическая таблица с названиями элементов
Словарь
- Элементы: Чистое вещество, состоящее из одного атома с уникальным атомным номером.
- Группы: Вертикальный столбец периодической таблицы, который обозначает количество валентных электронов в элементе.

- Периоды: горизонтальные ряды в периодической таблице, которые обозначают количество электронных оболочек в элементе.
- Семейства: Элементы, имеющие одинаковое количество валентных электронов и, следовательно, схожие свойства.
Просмотр тенденций, семей и групп в интерактивном режиме!
Мы считаем нашу периодическую таблицу одной из лучших в мире! Посетите нашу новую интерактивную периодическую таблицу. Вы можете просматривать всевозможные тенденции, свойства, магнетизм, электроны и даже статьи обо всех элементах!
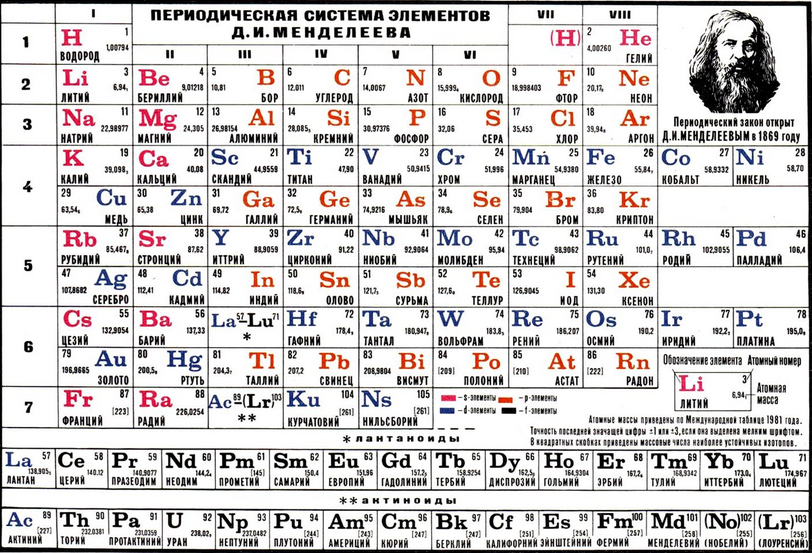
Периодическая таблица и периодические тенденции
Периодическая таблица разделена на группы (вертикальные столбцы), периоды (горизонтальные строки) и семейства (группы сходных элементов). Элементы одной и той же группы имеют одинаковое количество валентных электронов. Между тем, элементы в одном и том же периоде имеют одинаковое количество занятых электронных оболочек. В 1869 году русский химик Дмитрий Менделеев заметил, что существует врожденная модель организации химических элементов. Из этого вывода он составил периодическую таблицу. Важно отметить, как расположение элементов в этой таблице говорит нам об их свойствах. Быстрый способ понять химические и физические свойства элемента — это знать периодические тренды. Эти тенденции говорят вам, где в периодической таблице сосредоточены самые высокие и самые низкие типы свойств. Для более подробного объяснения периодических тенденций нажмите здесь.
Из этого вывода он составил периодическую таблицу. Важно отметить, как расположение элементов в этой таблице говорит нам об их свойствах. Быстрый способ понять химические и физические свойства элемента — это знать периодические тренды. Эти тенденции говорят вам, где в периодической таблице сосредоточены самые высокие и самые низкие типы свойств. Для более подробного объяснения периодических тенденций нажмите здесь.
Группа и период
Группы — это столбцы периодической таблицы, а периоды — это строки. Есть 18 групп и 7 периодов плюс лантаноиды и актиноиды.
Периоды в периодической таблице
Так что же такое период в периодической таблице? Периоды — это горизонтальные строки периодической таблицы. Всего периодов семь, и каждый элемент периода имеет одинаковое количество атомных орбиталей. Верхний период, содержащий водород и гелий, имеет только две орбитали. По мере продвижения вниз по ряду количество орбиталей увеличивается. Ниже приведена таблица, помогающая визуализировать периодическое число и соответствующие ему орбитали.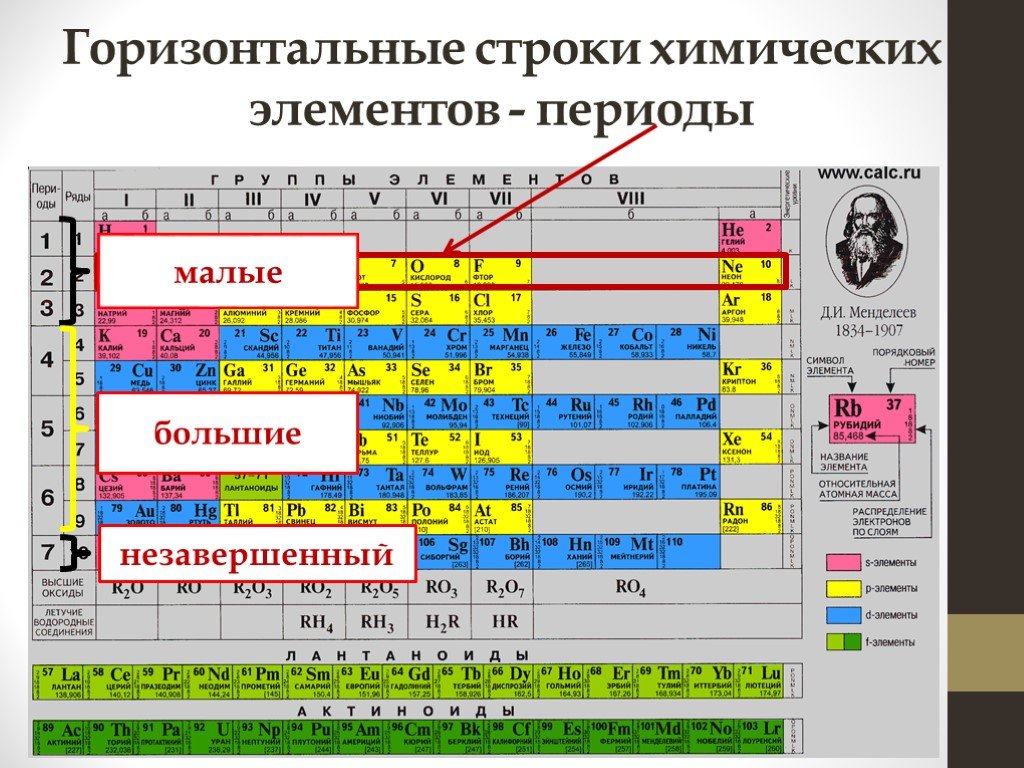
| Period Number | Number of Orbitals | Number of Elements |
| 1 | 1 | 2 |
| 2 | 2 | 8 |
| 3 | 3 | 8 |
| 4 | 4 | 18 |
| 5 | 5 | 18 |
| 6 | 6 | 32 |
| 7 | 7 | 32 |
Группы периодической таблицы
Как упоминалось ранее, вертикальные столбцы периодической таблицы называются «группами».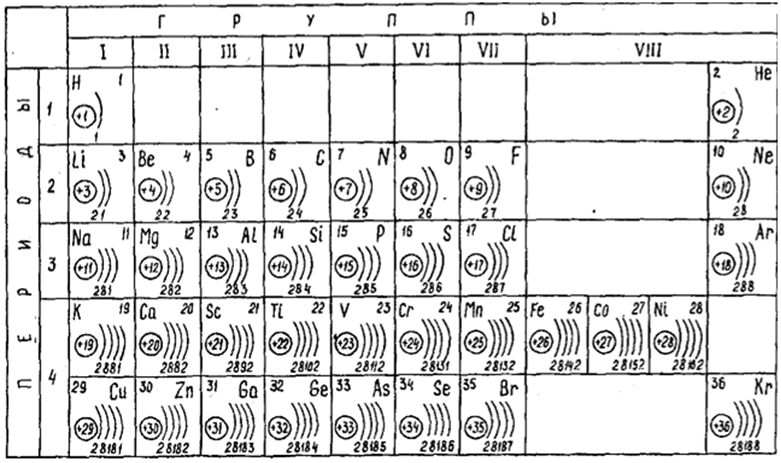 Всего в периодической таблице восемнадцать групп, и в каждой по группа таблицы Менделеева содержит элементы с одинаковым количеством валентных электронов.
Всего в периодической таблице восемнадцать групп, и в каждой по группа таблицы Менделеева содержит элементы с одинаковым количеством валентных электронов.
Количество присутствующих валентных электронов определяет свойства элемента. Причина этого в том, что валентные электроны, то есть электроны на самой внешней оболочке, принимают участие в химических реакциях. Эти электроны либо отдают, либо принимают, либо делятся. При этом чем более заполнена валентная оболочка, тем устойчивее элемент.
Сколько групп в периодической таблице?
В периодической таблице 18 групп, по одной на каждый столбец периодической таблицы. Первый столбец слева — группа 1, а последний столбец справа — группа 18.
Группы и валентные электроны
Первая группа наименее стабильна, так как имеет только один валентный электрон. Между тем восемнадцатая группа является наиболее стабильной, так как эти элементы имеют полную валентную оболочку (восемь валентных электронов).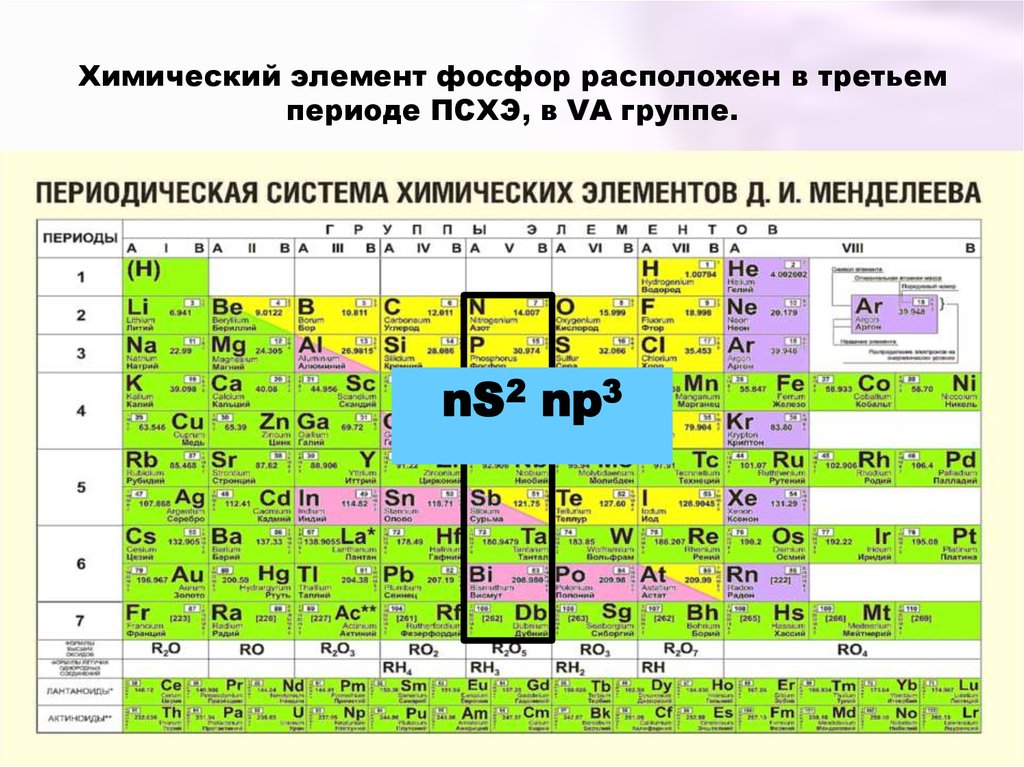 Ниже приведена таблица, связывающая номера групп с числом валентных электронов.
Ниже приведена таблица, связывающая номера групп с числом валентных электронов.
| Group Number | Number of Valence Electrons |
| 1 | 1 |
| 2 | 2 |
| 3-12 | 2 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
Families of the Периодическая таблица
В периодической таблице есть семейств , которые представляют собой группы элементов со схожими свойствами. К этим семействам относятся щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, металлоиды, галогены, благородные металлы и благородные газы. Многие из этих семейств принадлежат к одной группе периодической таблицы. Однако не все семейства пересекаются с группами периодической таблицы. Например, переходные металлы содержат все элементы от третьей до двенадцатой группы. Ниже приведена таблица Менделеева, в которой указано местонахождение каждой семьи.
К этим семействам относятся щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, металлоиды, галогены, благородные металлы и благородные газы. Многие из этих семейств принадлежат к одной группе периодической таблицы. Однако не все семейства пересекаются с группами периодической таблицы. Например, переходные металлы содержат все элементы от третьей до двенадцатой группы. Ниже приведена таблица Менделеева, в которой указано местонахождение каждой семьи.
Щелочные металлы (группа 1)
Щелочные металлы состоят из всех элементов первой группы, за исключением водорода. Эти элементы чрезвычайно реакционноспособны и по этой причине обычно находятся в соединениях. Кроме того, они чувствительны к воде (бурно реагируют с водой), поэтому их необходимо хранить в масле. Наиболее реакционноспособным щелочным металлом является франций, и его активность уменьшается по мере продвижения вверх по группе. Это означает, что литий наименее реактивен. Физически семейство щелочных металлов серебристое, белое и светлое. Они также имеют низкую температуру плавления и низкую температуру кипения.
Они также имеют низкую температуру плавления и низкую температуру кипения.
Щелочноземельные металлы (группа 2)
Щелочноземельные металлы являются вторым наиболее реакционноспособным семейством в периодической таблице (после щелочных металлов). Кроме того, они являются сильными восстановителями, что означает, что они отдают электроны в химических реакциях. Они также являются хорошими тепловыми и электрическими проводниками. Физически они имеют низкую плотность, низкую температуру плавления и низкую температуру кипения.
Редкоземельные металлы: лантаниды
Лантаниды представляют собой семейство редкоземельных металлов, содержащих один валентный электрон в 5d-оболочке. Они очень реакционноспособны и являются сильным восстановителем в реакциях. Кроме того, они представляют собой серебристо-яркий металл и относительно мягки. Они также имеют как высокие температуры плавления, так и высокие температуры кипения. К редкоземельным элементам относятся такие элементы, как неодим и эрбий.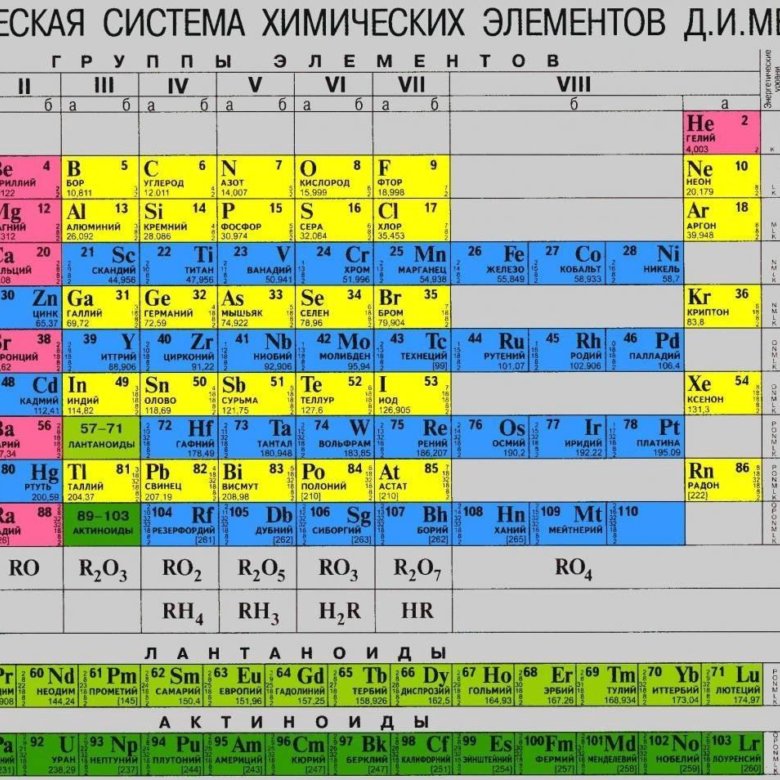
Редкоземельные металлы: актиниды
Актиниды — еще одно семейство редкоземельных металлов. Как и лантаноиды, эти элементы очень реакционноспособны. Они также обладают высокой электроположительностью и радиоактивны. Кроме того, эти элементы обладают парамагнитными, пироморфными и аллотропными свойствами. Физически они очень похожи на лантаноиды. Это серебристые металлы, мягкие, ковкие и пластичные.
Переходные металлы (группы 3-11)
Переходные металлы обычно имеют две или более степеней окисления. Они имеют низкую энергию ионизации и высокую проводимость. Кроме того, они имеют высокие температуры плавления, высокие температуры кипения и высокую проводимость. Физически они металлические и податливые.
Постпереходный металл
Постпереходные металлы расположены между переходными металлами и металлоидами. При стандартной температуре они находятся в твердом состоянии. Они, как правило, имеют высокую плотность, а также высокую проводимость. Физически они податливы и пластичны.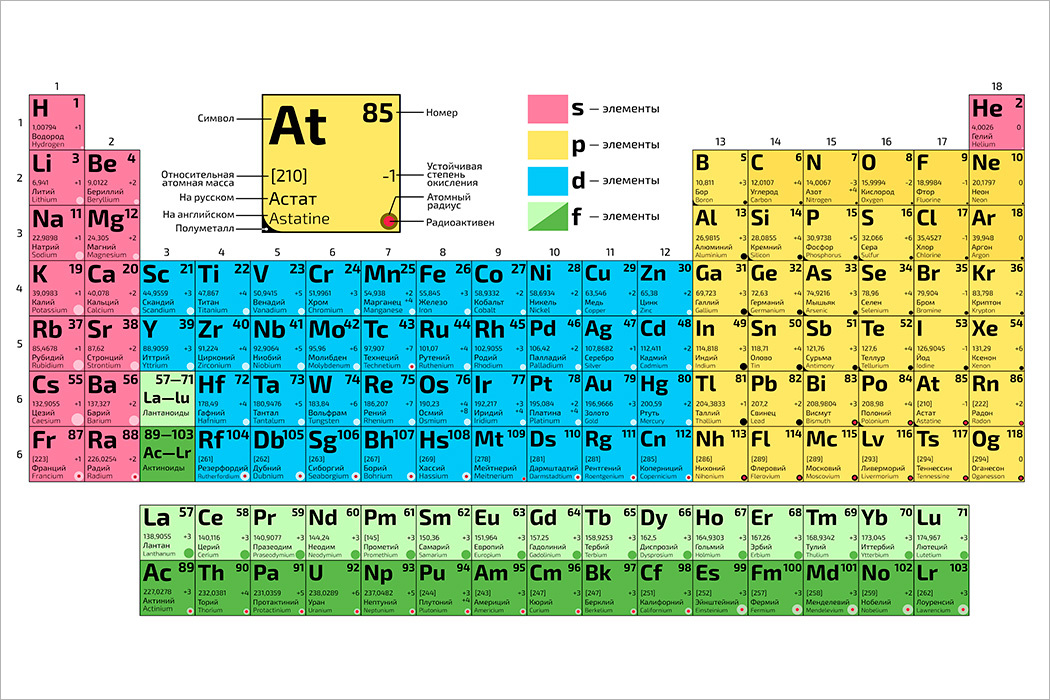
Металлоиды
Металлоиды проявляют свойства как металлов, так и неметаллов. Например, металлы являются хорошими проводниками, а неметаллы — плохими проводниками. Это означает, что металлоиды являются полупроводниками (проводят электричество только при высоких температурах). Кроме того, они более хрупкие, чем металлы, но менее хрупкие, чем неметаллы. Физически они могут быть как блестящими, так и тусклыми, обычно пластичными и податливыми.
Галогены (группа 17)
Название «галоген» в переводе с греческого означает «солеобразующие». Это очевидно в природе, поскольку галогены взаимодействуют с металлами с образованием различных солей. С другой стороны, галогены представляют собой уникальную группу элементов. Это единственное периодическое семейство, которое содержит элементы в трех состояниях вещества при стандартной температуре. Существует 6 галогенов, и они расположены в группе 17. Эти элементы включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).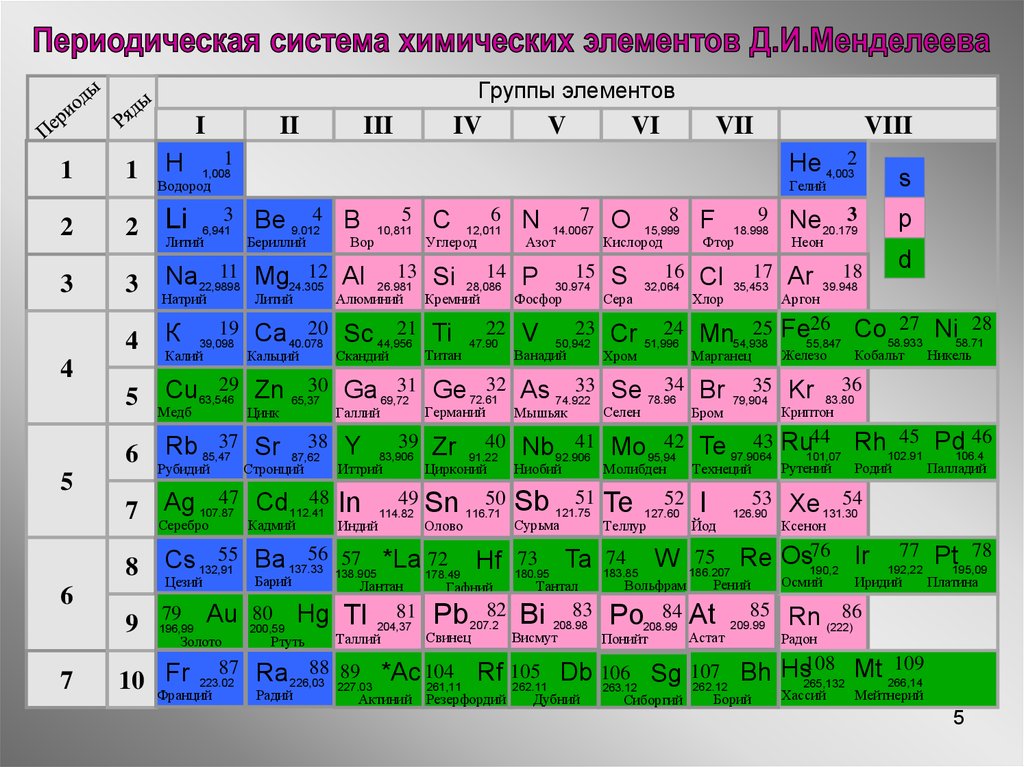 Это высокореактивные, высокоэлектроотрицательные и высокотоксичные неметаллы.
Это высокореактивные, высокоэлектроотрицательные и высокотоксичные неметаллы.
Благородные металлы
Благородные металлы состоят из рутения (Ru), осмия (Os), родия (Rh), иридия (Ir), Pd, платины (Pt), золота (Au), серебра (Ag). Как и благородные газы, они инертны из-за полной валентной оболочки. Кроме того, благородные металлы обладают каталитическими свойствами. Кроме того, они очень устойчивы к коррозии, потускнению и окислению. Наконец, как и многие другие металлы, они мягкие и пластичные.
Инертные газы (группа 18)
Инертные газы, также называемые аэрогенами, являются инертными газами. Некоторые примеры включают аргон, криптон и неон. Их можно найти в восемнадцатой группе периодической таблицы. Точно так же это означает, что они имеют полную валентную оболочку. По этой причине они стабильны и относительно инертны. Кроме того, благородные газы имеют низкие температуры кипения и низкие температуры плавления. Физически они бесцветны и не имеют запаха.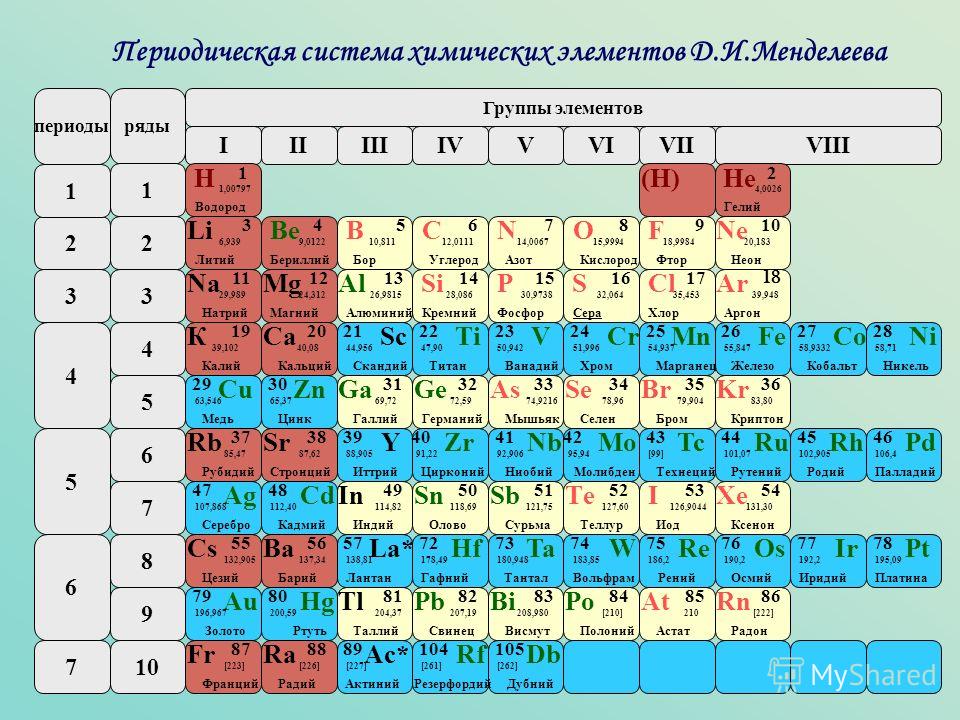

 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/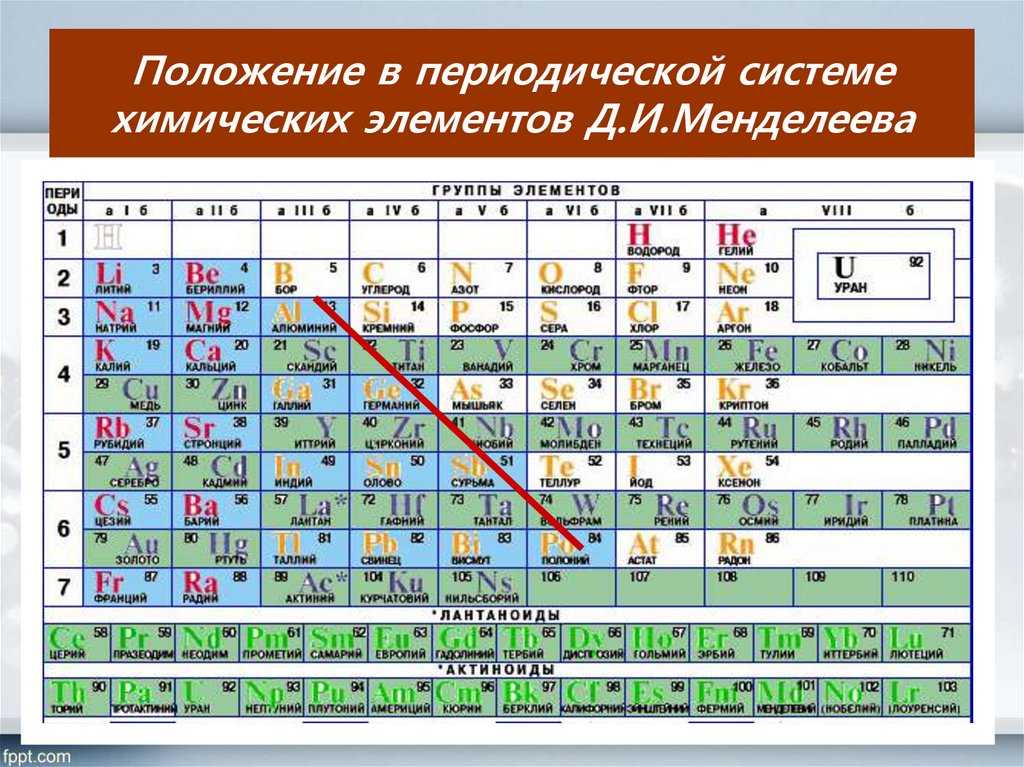
 MORSLAIL
MORSLAIL
Leave A Comment