Реальные варианты ЕГЭ по химии
Дорогие друзья! На этой странице вы можете найти варианты реальных КИМ ЕГЭ по химии. На сайте размещены только ссылки на варианты КИМ ЕГЭ. Если вы хотите помочь и дополнить коллекцию вариантов, пожалуйста, присылайте свои материалы на почту: [email protected]. Все качественные материалы я опубликую с обратными ссылками.
Приобрести сборник вариантов ЕГЭ по химии вы можете здесь.
2021-2022 учебный год
| Демонстрационный вариант КИМ ЕГЭ по химии-2022 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Перспективный вариант демо-версии КИМ ЕГЭ по химии-2022 | ||
| Вариант | Спецификация | |
2020-2021 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Вариант 1 | Ответы и решения | 31 мая 2021 |
| Все задания второй части реального ЕГЭ по химии-2021 с решениями: 30-31, 32, 33, 34, 35 | ||
| Открытый вариант ЕГЭ по химии-2021 от ФИПИ | ||
| Вариант | Ответы и решения | |
| Демонстрационный вариант ЕГЭ по химии-2021 (проект) | ||
| Вариант Ответы | Кодификатор | Спецификация |
Тренировочные варианты ЕГЭ по химии-2021 | ||
| Вариант 1 Вариант 2 | Вариант 1 — ответы и решения | |
2019-2020 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Основная волна ЕГЭ по химии-2020 | ||
| Вариант 1 | Ответы и решения | 16 июля 2020 г. |
| Вариант 2 | 16 июля 2020 г. | |
| Все задания второй части реального ЕГЭ по химии-2020 с решениями: 30-31, 32, 33, 34, 35 | ||
| Демонстрационный ЕГЭ по химии-2020 | ||
| Вариант Ответы | Кодификатор | Спецификация |
Досрочный ЕГЭ по химии-2020 | ||
| Вариант 1 Вариант 2 | Вариант 1 — ответы, критерии Вариант 2 — ответы, критерии | апрель 2020 г. |
2018-2019 учебный год
| Реальные варианты КИМ ЕГЭ по химии | ||
| Демонстрационный ЕГЭ по химии-2019 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии | ||
| Вариант 1 | Решения и ответы | |
| Вариант от ФИПИ | ||
| Основная волна 31 мая 2019 года | ||
2017-2018 учебный год
| Демонстрационный ЕГЭ по химии-2018 | ||
| Вариант Ответы | Кодификатор | Спецификация |
| Досрочный ЕГЭ по химии 26 марта 2018 года | ||
 04.2018 04.2018 | ||
| Вариант от ФИПИ | ||
| Основная волна 4 июня 2018 года | ||
Понравилось это:
Нравится Загрузка…
© 2023 CHEMEGE.RU — Онлайн-курс ЕГЭ по химии
Портал по химии CHEMEGE.RU — Вверх ↑
%d такие блоггеры, как:
Реальный вариант ЕГЭ по химии-2021
Реальный вариант КИМ ЕГЭ по химии 2021 — с ответами и решениями. КИМ реального экзамена по химии 31 мая 2021 года (основная волна, Центр, Сибирь, Дальний Восток.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1) Na 2) Al 3) Si 4) N 5) V |
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число валентных электронов. Запишите в поле ответа номера выбранных элементов.
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число валентных электронов. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной
3. Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разницу между высшей и низшей степенью окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества молекулярного строения, которые содержат ковалентную неполярную связь.
1) хлороводород
2) бром
3) метанол
4) циклопропан
5) хлорид аммония
Запишите номера выбранных ответов.
5.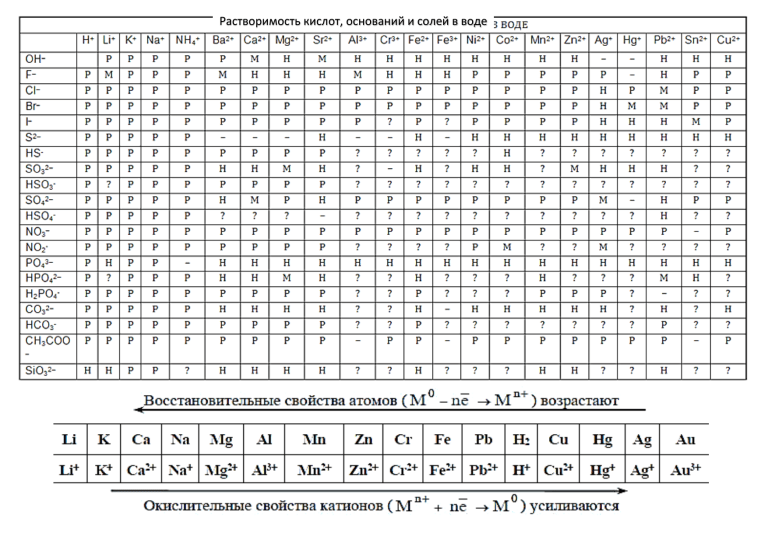
| НАЗВАНИЕ ВЕЩЕСТВА | ГРУППА |
| А) гидроксокарбонат меди | 1) кислые соли |
| Б) сульфат натрия | 2) основные соли |
| В) гидрофосфат натрия | 3) средние соли |
| 4) двойные соли |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид азота (IV).
1) CuSO4
2) H2O
3) SiO2
4) Ba(OH)2
5) Al3(PO4)2
Запишите номера выбранных ответов.
7. Даны две пробирки с раствором гидроксида натрия. В одну из них добавили раствор вещества X и нагрели. В результате выделился газ с неприятным запахом. В другую – нерастворимое вещество Y. В результате произошло растворение этого вещества. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
В результате выделился газ с неприятным запахом. В другую – нерастворимое вещество Y. В результате произошло растворение этого вещества. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
2) хлорид аммония
3) кремниевая кислота
4) гидроксид железа (II)
5) сульфат бария
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) H2S | 1) KI, Na2S, K2CO3 |
| 2) HF, KOH, C | |
| В) SiO2 | 3) O2, Br2, SO2 |
| Г) FeCl3 | 4) KCl, O2, HNO3 |
| 5) H2O, N2, Cl2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Установите соответствие между исходными веществами, вступающим в реакцию, и продуктом(-ами) этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ(-Ы) РЕАКЦИИ |
| А) SiCl4 и KOH (изб.) | 1) H2SiO3, KCl |
| Б) Si и KOH | 2) K2SiO3, HCl и H2O |
| В) SiO2 и KOH | 3) K2SiO3, KCl и H2O |
| Г) K2SiO3 и HCl | 4) K2SiO3 и H2O |
| 5) K2SiO3 и H2 | |
| 6) H2SiO3 и HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) C
2) Cu
3) CuO
4) MgO
5) Mg
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
11. Установите соответствие между названием вещества и общей формулой класса/группы органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА |
| А) глицилаланин | 1) сложные эфиры |
| Б) метилформиат | 2) пептиды |
| В) метанол | 3) спирты |
| 4) углеводы |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, в молекулах которых только один атом углерода находится в состоянии sp3 -гибридизации.
1) метилацетат
2) метилформиат
3) метилбутират
4) метилбензоат
5) муравьиная кислота
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые не окисляются перманганатом калия.
1) толуол
2) бензол
3) метан
4) стирол
5) пропилен
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, которые могут образоваться в результате щелочного гидролиза этилформиата.
1) муравьиная кислота
2) формиат калия
3) этилат калия
4) этанол
5) диэтиловый эфир
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня веществ выберите два вещества, которые реагируют с аланином, но не вступают в реакцию с анилином.
1) Br2(p-p)
2) Cu(OH)2
3) HCl
4) KOH
5) H2SO4
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между схемой реакции и реагентом, который необходимо добавить для осуществления реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.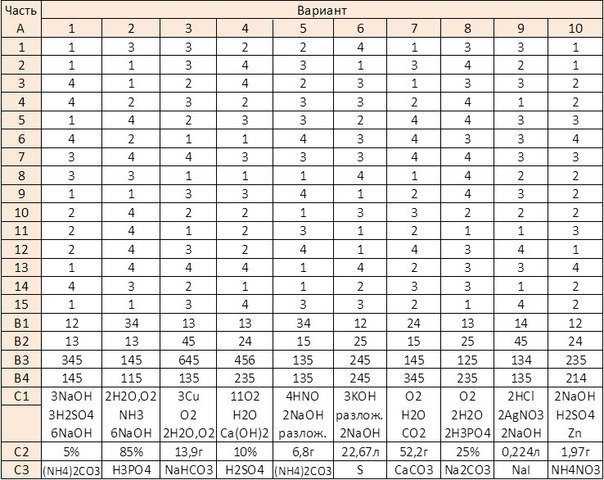
| СХЕМА РЕАКЦИИ | РЕАГЕНТ |
| А) ацетилен → этаналь | 1) H2O |
| Б) циклопропан → 1-хлорпропан | 2) пропанон |
| В) этилен → этанол | 3) KOH |
| Г) ацетилен → хлорэтен | 4) Cl2 |
| 5) KCl | |
| 6) HCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Установите соответствие между реагирующими веществами и органическим веществом – продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | РЕАГЕНТ |
| А) C2H5OH → C2H5OK | 1) K2Cr2O7 (H+) |
| Б) HCO2H → CO2 | 2) H2O |
| В) HCO2CH3 → HCO2H | 3) H2SO4(k) |
| Г) CH3OH → CH3OCH3 | 4) KOH (p-p) |
| 5) K | |
| 6) Br2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
18. Задана следующая последовательность превращений веществ:
Определите, какие из указанных веществ являются веществами Х и Y.
1) хлорбензол
2) циклогексан
3) 2,3-диметибутан
4) гексахлорциклогексан
5) н-гексан
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все характеристики типов реакции
взаимодействия иодида калия с хлором.
1) присоединения
2) окислительно-восстановительная
3) обмена
4) замещения
5) разложения
Запишите номера выбранных ответов.
20. Из предложенного перечня выберите все фактора, которые приводят к уменьшению скорости химической реакции между железом и хлором.
1) увеличение температуры
2) понижение температуры
3) внесение хлора
4) добавление ингибитора
5) понижение давления
Запишите в поле ответа номера выбранных воздействий.
21. Установите соответствие между уравнением реакции и свойством атома углерода в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВА АТОМА УГЛЕРОДА |
| А) CO2 + NaOH → NaHCO3 | 1) только окислитель |
| Б) CH4 + Cl2 → CH3Cl + HCl | 2) только восстановитель |
| В) CO2 + Mg → MgO + C | 3) и окислитель, и восстановитель |
| 4) не проявляет окислительно-восстановительных свойств |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.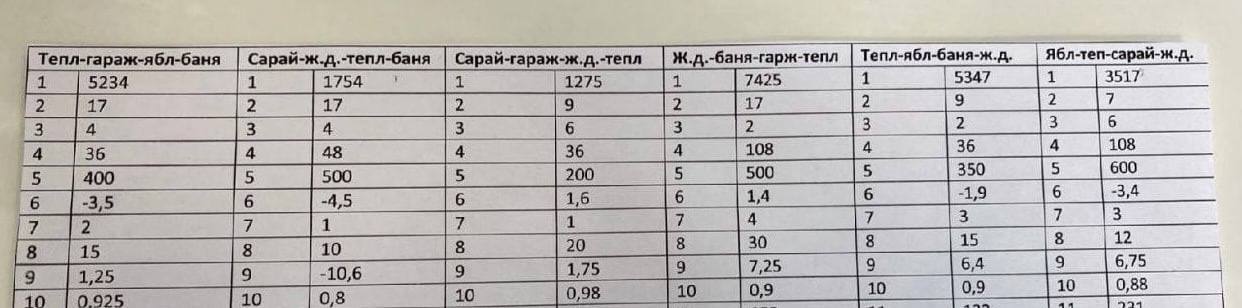
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) Na2CO3 | 1) металл и хлор |
| Б) MgSO4 | 2) водород и кислород |
| В) Cu(NO3)2 | 3) металл и кислород |
| Г) CuCl2 | 4) водород и хлор |
| 5) водород, металл и кислород | |
| 6) водород, металл и хлор |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) карбонат натрия | 1) гидролизуется по катиону |
| Б) сульфид алюминия | 2) гидролизуется по аниону |
| В) сульфат аммония | 3) гидролизуется по катиону и аниону |
| Г) хлорид натрия | 4) гидролизу не подвергается |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему
ZnCO3(тв) ⇄ Zn2+(p-p) + CO32–(p-p) – Q
и смещением химического равновесия в результате этого воздействия.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление твердого K2CO3 | 1) в сторону прямой реакции |
| Б) добавление твердого ZnSO4 | 2) в сторону обратной реакции |
| В) увеличение давления | 3) практически не смещается |
| Г) увеличение температуры |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАГЕНТ |
| А) CuCl2 и CuBr2 | 1) AgNO3 |
| Б) AlCl3 и MgCl2 | 2) KOH |
| В) Al(NO3)3 и KNO3 | 3) HNO3 |
| Г) HCl и KCl | 4) BaSO4 |
| 5) Zn |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между названием полимера и мономером, которое образует этот полимер: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПОЛИМЕР | МОНОМЕР |
| А) полиэтилен | 1) этен |
| Б) поливинилхлорид | 2) хлорэтен |
| В) полистирол | 3) винилбензол |
| 4) 1,2-дихлорэтан |
Запишите в поле ответа выбранные цифры в нужной последовательности.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответа указывать не нужно.
27. Вычислите массу 14 %-го раствора нитрата калия, к которому необходимо добавить 15 г воды, чтобы получить 5 %-й раствор соли. (Запишите число с точностью до десятых.)
28. Определите объем оксида углерода (н.у.), которые образуется при обжиге углерода согласно термохимическому уравнению реакции
С(тв.) + O2(г) = СO2(г) + 400 кДж.
В процессе реакции выделилось 1000 кДж (Запишите число с точностью до целых.)
29. Вычислите объем (н.у.) газообразного продукта, полученный при взаимодействии соляной кислоты с 30 г сульфида алюминия. (Запишите число с точностью до сотых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ: азотная кислота, фторид аммония, иод, хлорид железа (II), аммиак, оксид хрома (VI). Допустимо использование водных растворов веществ. Допустимо использование водных растворов веществ. |
30. Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. В результате реакции восстановитель отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
31. Из предложенного перечня веществ выберите два вещества, которое вступает в реакцию ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
32. К раствору иодида калия прилили нитрит калия, подкисленный серной кислотой. Выделившийся газ поместили в сосуд, через некоторое время газ в сосуде приобрел бурый цвет. Полученный бурый газ поместили в воду и продули кислород. К образованной кислоте поместили пирит. Напишите уравнения четырёх описанных реакций.
К образованной кислоте поместили пирит. Напишите уравнения четырёх описанных реакций.
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Кристаллогидрат сульфата алюминия, в котором массовая доля серы меньше массовой доли кислорода в 5 раз, растворили в воде с образованием раствора 722,4 г. Полученный раствор подвергли электролизу до выделения на аноде 35,84 л (н.у.) газа. К образовавшемуся раствору добавили 424 г 10 %-го раствора карбоната натрия, после всех реакций его массовая доля уменьшилась в 10 раз. Определите массу растворенного кристаллогидрата сульфата алюминия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
35. При сжигании образца органического вещества массой 38,5 г получено 92,4 г углекислого газа и 18,9 г воды. Известно, что функциональные заместители находятся у соседних атомов углерода.
При сжигании образца органического вещества массой 38,5 г получено 92,4 г углекислого газа и 18,9 г воды. Известно, что функциональные заместители находятся у соседних атомов углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите взаимодействие данного вещества с избытком гидроксида натрия (используйте структурную формулу органического вещества).
Понравилось это:
Нравится Загрузка…
Общие вопросы об экзамене AP по химии
Каждый год примерно в это время в списках рассылки и дискуссионных форумах начинают появляться одни и те же вопросы о структуре и содержании экзамена AP по химии. Учителя начинают волноваться, освоили ли они весь материал и достаточно ли подготовлены их ученики к сложному экзамену.
Экзаменационный курс и описание экзамена AP (CED) — это ценный инструмент для получения ответов на все вопросы, но он слишком сложен и иногда сложен в навигации. Лучший совет, который я могу дать новым учителям AP в это время года, — сдавать все выпущенные экзамены, как если бы вы были студентом. Ознакомьтесь с тем, как организован экзамен, как он выглядит в распечатанном виде, сколько в нем вопросов, какие темы поднимаются чаще всего и т. д. Кажется, что много, но когда я впервые начал преподавать AP Chemistry, я сдавал каждый экзамен. доступный. Теперь доступны практические экзамены, если вы войдете на сайт аудита курса College Board AP. Эти практические экзамены являются золотыми, потому что они отформатированы так, чтобы соответствовать реальному экзамену. Практические экзамены содержат листы ответов, руководства по оценке экзамена, а также шкалу экзамена, и в каждом вопросе указывается цель обучения, которая выявляется в вопросе. Практические экзамены должны быть безопасными, поскольку учащиеся должны использовать их только в классе. (Безопасные практические экзамены были созданы для того, чтобы учителя могли использовать их для оценки своих учеников. Вопросы и ответы никогда не должны быть доступны онлайн для учащихся.) Экзамен по химии АП. Я собрал несколько и постараюсь ответить на каждый вопрос.
(Безопасные практические экзамены были созданы для того, чтобы учителя могли использовать их для оценки своих учеников. Вопросы и ответы никогда не должны быть доступны онлайн для учащихся.) Экзамен по химии АП. Я собрал несколько и постараюсь ответить на каждый вопрос.
ВОПРОСЫ О ФОРМАТЕ ЭКЗАМЕНА И ОЦЕНКАХ
Как организован экзамен?
Это отличная идея, чтобы ознакомить ваших студентов с форматом экзамена, чтобы обеспечить правильные ожидания и наиболее эффективно спланировать свое время. Большую часть этой информации можно найти на второй странице этой ссылки.
- Экзамен AP по химии Раздел I состоит из 60 вопросов с несколькими вариантами ответов, 10 из которых являются вопросами полевого тестирования (эти вопросы не будут учитываться при выставлении итоговой оценки, но учащиеся не смогут узнать, какие вопросы относятся к вопросам полевого тестирования). являются).
- Вопросы связаны в книге со справочной таблицей, в которой они должны переключаться между вопросами и таблицами.

- Учащиеся могут делать заметки и делать наброски в любом месте экзамена, но обязаны ответить на вопросы в предоставленном бланке для ответов в течение 90 минут. Читатели экзамена, которые посещают чтения в июне, никогда не увидят эти вопросы с несколькими вариантами ответов.
- Студенты не могут использовать калькуляторы во время секции экзамена с несколькими вариантами ответов.
- Учащимся должен быть предоставлен небольшой перерыв между разделом с несколькими вариантами ответов и разделом со свободным ответом. Студенты получают все новые экзаменационные пакеты для раздела II. Учащимся выдается новая книга в переплете, содержащая новую справочную таблицу.
- Раздел бесплатных ответов состоит из трех длинных вопросов, каждый из которых требует в среднем 23 минут и дает учащимся до десяти баллов за каждый.
- Есть также четыре коротких вопроса, требующих в среднем девять минут и дающих до четырех баллов за каждый.
- Каждый вопрос с бесплатным ответом написан на одной-двух страницах без места для работы.
 После вопроса в переплетенной книге предоставляется несколько страниц бумаги для ответов.
После вопроса в переплетенной книге предоставляется несколько страниц бумаги для ответов. - Студентам рекомендуется использовать калькулятор во время свободной части экзамена.
- Вопросы с несколькими вариантами ответов Раздела I составляют 50% экзаменационного балла; Остальные 50% общего балла составляют свободные ответы в разделе II.
Почему безопасные практические экзамены содержат только 50 вопросов с несколькими вариантами ответов, в то время как настоящий экзамен по химии AP включает 60 вопросов с несколькими вариантами ответов?
Как указано выше, десять из 60 вопросов с несколькими вариантами ответов на экзамене AP по химии являются вопросами полевого тестирования и не будут учитываться при выставлении оценок учащимся. При сдаче экзамена невозможно узнать, какие вопросы они задают, поэтому студенты должны ответить на каждый вопрос. Совет колледжей решил опустить эти полевые вопросы и опубликовать только 50 оцениваемых вопросов. Теперь возникает дополнительный вопрос; что мне делать со сроками и оценками моего практического экзамена в классе? Ну, у вас есть несколько вариантов:
Теперь возникает дополнительный вопрос; что мне делать со сроками и оценками моего практического экзамена в классе? Ну, у вас есть несколько вариантов:
- Оставьте практический экзамен как есть и дайте только 75 минут, чтобы ответить на 50 вопросов. Ответ на каждый вопрос с несколькими вариантами ответов должен занимать в среднем около 1,5 минут, независимо от суммы вопросов. Затем используйте оценочную рубрику, найденную в конце пробного экзамена, для оценки экзамена.
- Добавьте еще десять своих вопросов и соблюдайте ограничение по времени в 90 минут. Затем вы должны решить: хотите ли вы оценить эти дополнительные десять вопросов и изменить шкалу оценок? Или вы не должны оценивать эти вопросы и оставить шкалу оценок нетронутой?
Могут ли учащиеся писать ручкой или карандашом на экзамене AP?
Подойдет ручка или карандаш. Карандаши отлично подходят для исправления ошибок, однако скажите учащимся писать разборчиво и темно. Светлый карандаш трудно читать.
Если учащийся делает математическую ошибку в первой части вопроса, наказывается ли он в следующей части (двойное наказание)?
Нет двойной опасности. Если учащийся делает ошибку в части a и должен использовать ее в части b, читатель AP будет следовать математике, чтобы убедиться, что у него есть новый правильный ответ. Более важно, чтобы учащийся показал понимание того, как решить часть b, чем чтобы учащийся записал правильные числа.
ВОПРОСЫ ПО СОДЕРЖАНИЮ ЭКЗАМЕНА
В этом разделе я постараюсь ответить на вопросы, которые возникают снова и снова по поводу содержания экзамена. Там, где это применимо, я процитировал экзаменационный вопрос, касающийся этой темы. Вы можете найти эти экзамены на веб-сайте College Board AP Chemistry Exam, прокрутив страницу вниз.
Как оцениваются значащие цифры на экзамене AP?
Один ответ будет оцениваться по всему разделу кратких ответов на каждом экзамене. Это один балл из 100 баллов экзамена. Экзаменационный вопрос, связанный со значащими цифрами, скорее всего, не будет помечен, и учащиеся не смогут узнать, когда использовать значащие цифры; поэтому они должны округлять свои ответы до соответствующего количества значащих цифр для каждого вычисления, чтобы получить один балл. Поскольку значащие цифры не имеют большого значения на экзамене AP, учителям, возможно, не нужно подчеркивать их так сильно, как мы, вероятно, делаем это в классе. Вот совет по значащим цифрам: постарайтесь убедиться, что учащиеся не округляют молярные массы до значений, меньших, чем количество значащих цифр, приведенное в примере. Не округляйте молярные массы из таблицы Менделеева, прилагаемой к экзамену AP. Другой способ обращения к значащим цифрам — это чтение измерений. Обязательно научите студентов читать «место за пределами» того, что они видят на устройстве. Например, в вопросе 1d экзамена 2018 года учащимся предлагалось сообщить об изменении температуры на графике, а учащиеся должны были указать 12,5 градуса Цельсия, тогда как 12 и 13 не были приняты.
Экзаменационный вопрос, связанный со значащими цифрами, скорее всего, не будет помечен, и учащиеся не смогут узнать, когда использовать значащие цифры; поэтому они должны округлять свои ответы до соответствующего количества значащих цифр для каждого вычисления, чтобы получить один балл. Поскольку значащие цифры не имеют большого значения на экзамене AP, учителям, возможно, не нужно подчеркивать их так сильно, как мы, вероятно, делаем это в классе. Вот совет по значащим цифрам: постарайтесь убедиться, что учащиеся не округляют молярные массы до значений, меньших, чем количество значащих цифр, приведенное в примере. Не округляйте молярные массы из таблицы Менделеева, прилагаемой к экзамену AP. Другой способ обращения к значащим цифрам — это чтение измерений. Обязательно научите студентов читать «место за пределами» того, что они видят на устройстве. Например, в вопросе 1d экзамена 2018 года учащимся предлагалось сообщить об изменении температуры на графике, а учащиеся должны были указать 12,5 градуса Цельсия, тогда как 12 и 13 не были приняты. (См. также вопрос 7а экзамена 2016 г.)
(См. также вопрос 7а экзамена 2016 г.)
Нужно ли запоминать правила растворимости?
После изменения дизайна в 2014 году учащиеся должны знать, что ионы группы 1, ацетат, нитрат и ионы аммония растворимы. Все остальные правила будут считаться неразрешимыми, если они не указаны в основе вопроса.
Нужно ли запоминать серию упражнений?
Нет. Но знание того, что он есть, может иметь значение. Студенты должны быть в состоянии объяснить реакционную способность с группой металлов или неметаллов. Некоторые учителя до сих пор раздают стандартные таблицы сокращения из старых справочных таблиц экзамена AP и используют их для привязки к электрохимии, чтобы предсказать, какие виды с большей вероятностью будут восстановлены или окислены (вопрос 7a экзамена 2017 г. и вопрос 3e экзамена 2016 г.).
Сетчатые ионные уравнения, используемые для ответа на все вопросы 4 на экзамене. Их уже не оценивают?
Они абсолютно оценены. Вместо того, чтобы иметь целый вопрос, посвященный написанию реакции, чистые ионные уравнения были включены в другие вопросы. На экзамене 2018 года вопрос 1g требовал сбалансированного чистого ионного уравнения для данной реакции. В 2017 г., вопрос 3ci, учащиеся могли бы использовать чистое ионное уравнение, чтобы объяснить свой ответ. В 2016 году, вопрос 3f, учащиеся составили результирующее ионное уравнение из полуреакций. Кроме того, многие чистые ионные уравнения появятся в разделе экзамена с множественным выбором.
Вместо того, чтобы иметь целый вопрос, посвященный написанию реакции, чистые ионные уравнения были включены в другие вопросы. На экзамене 2018 года вопрос 1g требовал сбалансированного чистого ионного уравнения для данной реакции. В 2017 г., вопрос 3ci, учащиеся могли бы использовать чистое ионное уравнение, чтобы объяснить свой ответ. В 2016 году, вопрос 3f, учащиеся составили результирующее ионное уравнение из полуреакций. Кроме того, многие чистые ионные уравнения появятся в разделе экзамена с множественным выбором.
Нужно ли учащимся запоминать значения электроотрицательности, чтобы определять типы связей?
Нет. Вместо этого предложите учащимся изучить общие тенденции для периодов и групп. Начните модуль, отрабатывая эти тенденции, используя таблицу значений электроотрицательности, а затем мы перейдем только к использованию тенденций для определения полярности. Я заставляю своих студентов запоминать, что углерод и водород достаточно близки, чтобы считаться неполярными.
Как учащиеся узнают при изучении межмолекулярных сил притяжения, когда лондонские дисперсионные силы сильнее, чем водородные связи?
Будет представлена таблица данных с точками кипения или другими данными о соединениях, которые необходимо сравнить. Как правило, лондонские дисперсионные силы являются самой слабой силой, присутствующей во всех соединениях, но в зависимости от количества поляризуемых электронов эти силы могут быстро увеличиваться (вопрос 4a экзамена 2018 г. и вопрос 1dii экзамена 2017 г.). Распространенная ошибка, которую совершают некоторые студенты, заключается в том, что они пытаются аргументировать данные экзамена и утверждать, что данные неверны. Важно объяснить учащимся, что если не задан вопрос «Согласны ли вы или не согласны…», то приведенные данные не подлежат обсуждению.
Студентам действительно нужно запомнить все формы VSEPR, валентные углы и гибридизации!?
Да. Нет никакого способа обойти это. Должны быть известны все геометрии, включая расширенные октеты, а также их общие валентные углы. Понимание того, что увеличение числа неподеленных пар на центральном атоме уменьшит валентный угол, полезно, но фактические значения не оцениваются (вопрос 1cii экзамена 2017 г.). Гибридизация ограничена соединениями, которые подчиняются правилу октета, и, следовательно, ограничена sp, sp 2 и sp 3 (вопрос 1e экзамена 2015 г.).
Понимание того, что увеличение числа неподеленных пар на центральном атоме уменьшит валентный угол, полезно, но фактические значения не оцениваются (вопрос 1cii экзамена 2017 г.). Гибридизация ограничена соединениями, которые подчиняются правилу октета, и, следовательно, ограничена sp, sp 2 и sp 3 (вопрос 1e экзамена 2015 г.).
Всегда ли учащимся нужно рисовать структуру, которая снижает формальную нагрузку?
Нет. Допустимы структуры, которые соответствуют октету (и могут не иметь уменьшенного формального заряда). Формальные заряды можно использовать для обоснования того, какая структура может быть лучшим представлением связи в конкретной молекуле (вопрос 2а экзамена 2017 г.).
Нужно ли учащимся вычислять энергию решетки ионного соединения?
Нет. Они должны уметь качественно сравнивать значения энергии решетки различных соединений, используя закон Кулона, путем сравнения атомных радиусов и расстояния между ионами (вопрос 3c экзамена 2018 г. и вопрос 6b экзамена 2017 г.).
и вопрос 6b экзамена 2017 г.).
Нужно ли учащимся запоминать все многоатомные ионы?
Учащиеся могут прилично сдать экзамен по химии AP без полного запоминания многоатомных ионов. Однако знание многоатомных ионов поможет с сильными кислотами и основаниями, написанием формул, электрохимией и т. д. Я заставляю своих учеников запоминать важные «-аты» (такие как сульфат, ацетат, нитрат, фосфат, карбонат), а затем понимать правила. для «-ites», «hypo—ites» и «per—ates». Многие учителя также используют мнемоническое устройство, известное как «Верблюд Ник». Я посмотрел его в Google и начал использовать в этом году. Моим ученикам это понравилось.
Имеет ли значение порядок электронной конфигурации? И должны ли они знать исключения для групп d
4 и d 9 ? Учащимся разрешается писать 3d до или после 4s, если они понимают, что подуровень 4s является валентным подуровнем, на котором электроны будут удалены и добавлены к первому. Исключения из Aufbau больше не оцениваются.
Исключения из Aufbau больше не оцениваются.
Оцениваются ли фазовые диаграммы (трехточечные диаграммы)? Кристаллические структуры? Кислоты и основания Льюиса? Коллигативные свойства?
Нет. Я до сих пор использую фазовые диаграммы для графического анализа и обсуждения взаимосвязей между температурой и давлением. Кристаллические структуры больше не оцениваются. Кислоты и основания Льюиса не оцениваются. Коллигативные свойства не рассчитываются, так как они считаются частью курса химии первого года обучения (по данным College Board, химия AP является курсом второго года обучения).
Нужно ли учащимся строить графики интегрированных законов скорости?
Нет. Учащимся вовсе не обязательно иметь графический калькулятор. Когда в вопросах упоминаются интегральные законы скоростей, на них обычно легко ответить, исходя из концепции, что реакции нулевого порядка изображаются в виде графика [A] в зависимости от времени, реакции первого порядка — в виде графика ln[A] в зависимости от времени, а реакции второго порядка — в виде графика 1/[ А] в зависимости от времени. Какой бы график ни был более прямой, это правильный порядок видов (экзаменационный вопрос 2016 г., вопрос 5b). В экзаменационном вопросе 2eii 2107 года студентам дали график экспоненциального распада вида и попросили объяснить, как этот график представляет предложенный закон скорости первого порядка. Некоторые студенты пытались изобразить данные в виде графика, запустив естественный журнал заданных концентраций в зависимости от времени, но студенты получали оценку только в том случае, если они доказывали, что действительно отображали данные в виде графика, показывая расчеты и значения удерживания. Большинство студентов не предоставили доказательств, необходимых для ответа на вопрос, и просто заявили: «Если бы я построил график естественного логарифма концентрации в зависимости от времени, я бы получил прямую линию, указывающую на первый порядок», чего было недостаточно. Приемлемым ответом было то, что график представляет собой реакцию разложения с постоянным периодом полураспада, что доказывает ее первый порядок.
Какой бы график ни был более прямой, это правильный порядок видов (экзаменационный вопрос 2016 г., вопрос 5b). В экзаменационном вопросе 2eii 2107 года студентам дали график экспоненциального распада вида и попросили объяснить, как этот график представляет предложенный закон скорости первого порядка. Некоторые студенты пытались изобразить данные в виде графика, запустив естественный журнал заданных концентраций в зависимости от времени, но студенты получали оценку только в том случае, если они доказывали, что действительно отображали данные в виде графика, показывая расчеты и значения удерживания. Большинство студентов не предоставили доказательств, необходимых для ответа на вопрос, и просто заявили: «Если бы я построил график естественного логарифма концентрации в зависимости от времени, я бы получил прямую линию, указывающую на первый порядок», чего было недостаточно. Приемлемым ответом было то, что график представляет собой реакцию разложения с постоянным периодом полураспада, что доказывает ее первый порядок. Как видите, эти вопросы не требуют создания графа, и на них можно ответить другими способами. Заявив об этом, я все еще заставляю своих студентов выполнять лабораторные работы с графическими калькуляторами, чтобы узнать, что нужно установить на осях x и y.
Как видите, эти вопросы не требуют создания графа, и на них можно ответить другими способами. Заявив об этом, я все еще заставляю своих студентов выполнять лабораторные работы с графическими калькуляторами, чтобы узнать, что нужно установить на осях x и y.
Нужно ли учащимся использовать квадратную формулу для вопросов о кислотно-щелочном равновесии?
Нет. Многие расчеты можно решить одним из трех способов. Либо в основе вопроса указана равновесная концентрация, которую можно использовать для определения значения «x» (вопрос 3b экзамена 2017 г., либо вопрос 2b экзамена 2014 г.), выражение равновесия имеет квадраты как в числителе, так и в знаменателе, в которых можно извлеките квадратный корень (например, x 2 /(5-x) 2 , рассматриваемый в разделах с множественным выбором), или значение константы равновесия настолько мало, что учащийся может сказать, что изменение концентрации данного вида незначительно; следовательно, исключая изменение выражения равновесия, извлекая квадратный корень из обеих частей и решая без квадратного уравнения (2016 вопрос 4а). В последнем сценарии, который очень распространен, учащимся не нужно доказывать, что изменение достаточно мало, чтобы его можно было игнорировать, однако, если их спросят, какова конечная концентрация начальных видов, или если их попросят подставить это в другую формулу, такую как процент ионизации кислоты, учащимся необходимо вычесть значение x (значение изменения) из исходного значения концентрации, если оно показывает небольшое снижение концентрации при равновесии (вопрос 5b 2018 г.).
В последнем сценарии, который очень распространен, учащимся не нужно доказывать, что изменение достаточно мало, чтобы его можно было игнорировать, однако, если их спросят, какова конечная концентрация начальных видов, или если их попросят подставить это в другую формулу, такую как процент ионизации кислоты, учащимся необходимо вычесть значение x (значение изменения) из исходного значения концентрации, если оно показывает небольшое снижение концентрации при равновесии (вопрос 5b 2018 г.).
Нужно ли учащимся сбалансировать окислительно-восстановительные реакции в кислых и щелочных растворах?
Не совсем. Учащимся могут быть даны две полуреакции, которые им могут понадобиться, чтобы исключить виды и суммировать общую реакцию, которая уже была уравновешена в кислых или щелочных условиях. Или учащимся может потребоваться выбрать одну половинную реакцию из общей реакции (вопрос 3d экзамена 2018 г.). Мои ученики до сих пор изучают метод балансировки, поэтому они знают, откуда взялись те полууравнения, которые были даны, и не видят это впервые на экзамене. Как правило, учащимся все еще необходимо уметь присваивать степени окисления, определять, какие виды окисляются, а какие восстанавливаются, и суммировать реакции. Термины и понятия восстановителя и окислителя были удалены из экзамена AP. Таким образом, применение этого метода балансировки в кислых или щелочных растворах помогает отработать другие цели обучения, но не оценивается напрямую.
Как правило, учащимся все еще необходимо уметь присваивать степени окисления, определять, какие виды окисляются, а какие восстанавливаются, и суммировать реакции. Термины и понятия восстановителя и окислителя были удалены из экзамена AP. Таким образом, применение этого метода балансировки в кислых или щелочных растворах помогает отработать другие цели обучения, но не оценивается напрямую.
Что нужно знать учащимся об органических соединениях?
На экзамене AP Chemistry нет прямых вопросов по органической химии. Учащимся не будет предложено называть органические соединения, идентифицировать изомеры или органические реакции. В некоторых вопросах органические соединения могут использоваться в вопросах о структурах Льюиса и валентных углах или для сравнения межмолекулярных сил притяжения. Поэтому рекомендуется использовать органические соединения на уроках по этим темам. Но нет необходимости сосредотачиваться на номенклатуре или особенностях органической химии. На все вопросы, связанные с органическими соединениями, можно ответить, используя связи, межмолекулярные силы или другие темы в учебной программе.
Есть ли на экзамене [преобразование Kc/Kp, уравнение Аррениуса, уравнение Нернста, расчет депрессии точки замерзания, молекулярная орбитальная теория, среднеквадратичная скорость и т. д.]?
Как правило, если его нет в справочной таблице AP Chemistry, учащимся не нужно его вычислять. Убедитесь, что у вас самый последний список уравнений, так как элементы были удалены после изменения дизайна экзамена. Это ваше решение, если вы хотите преподавать за рамками курса, зная, что некоторые из этих уравнений могут помочь лучше описать и доказать химическое явление. Некоторые пункты, которые я заставлял своих студентов запоминать в том, что касается вычислений:
- Изменение энтальпии = [Сумма разорванных связей] – [Сумма образовавшихся связей] (2017, вопрос 2b)
- M 1 V 1 =M 2 V 2 для разбавлений (хотя можно использовать два расчета молярности)
У меня осталось две недели и три темы для преподавания, что я могу пропустить?
Это довольно сложный вопрос.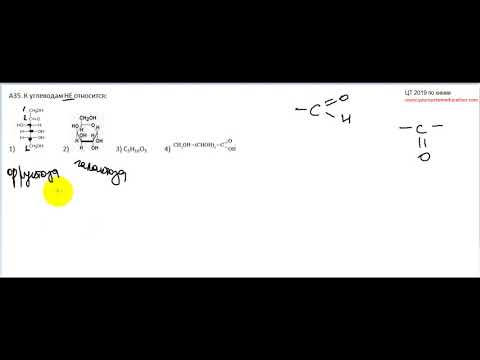 В химии все взаимосвязано. Трудно полностью понять объем химии без каждого кусочка головоломки. Столь же трудно уместить такой объем информации за один год. Я закодировал последние шесть практических экзаменов (множественный выбор и краткий ответ) по подтемам, чтобы использовать их в качестве справочного материала при написании собственных экзаменов. Я обнаружил, что наиболее оцениваемые темы включают: стехиометрию, связи и межмолекулярные силы, кинетику, равновесие, кислоты и основания и термодинамику. Менее оцененными темами оказались атомная структура, периодичность и электрохимия. Опять же, все темы должны быть охвачены и будут оцениваться на каждом экзамене. Но пропустить такую тему, как химия кислотно-щелочного взаимодействия, было бы серьезной ошибкой.
В химии все взаимосвязано. Трудно полностью понять объем химии без каждого кусочка головоломки. Столь же трудно уместить такой объем информации за один год. Я закодировал последние шесть практических экзаменов (множественный выбор и краткий ответ) по подтемам, чтобы использовать их в качестве справочного материала при написании собственных экзаменов. Я обнаружил, что наиболее оцениваемые темы включают: стехиометрию, связи и межмолекулярные силы, кинетику, равновесие, кислоты и основания и термодинамику. Менее оцененными темами оказались атомная структура, периодичность и электрохимия. Опять же, все темы должны быть охвачены и будут оцениваться на каждом экзамене. Но пропустить такую тему, как химия кислотно-щелочного взаимодействия, было бы серьезной ошибкой.
Обновления по химии — Международный бакалавриат®
Эта страница содержит последние обновления курса химии Diploma Programme (DP).
Новый курс химии DP будет запущен в феврале 2023 г. , а первое обучение состоится в августе 2023 г. Первое оценивание состоится в мае 2025 г.
, а первое обучение состоится в августе 2023 г. Первое оценивание состоится в мае 2025 г.
Ниже вы найдете обзор обновлений курса. Техническое описание учебной программы DP и методов оценки для этого курса см. в кратком изложении предмета по химии (SL и HL) (PDF, 307 КБ).
Обзор нового курса
Актуальное и эффективное образование в области химии должно отражать изменения в обществе, уделяя больше внимания навыкам и взаимосвязи концепций, контекстов и содержания, а также способствовать глубокому обучению и пониманию учащимися.
Учебная программа по химии построена на двух широких организационных концепциях: структура и реактивность. Каждая из этих концепций подразделяется на темы и подтемы, которые связаны идеей о том, что структура определяет реактивность, которая, в свою очередь, трансформирует структуру.
Навыки изучения химии | |
Структура Структура относится к природе материи от простых до более сложных форм | Реактивность Реакционная способность относится к тому, как и почему происходят химические реакции |
Структура 1. Модели дисперсной природы материи | Реактивность 1. Что запускает химические реакции? |
Структура 2. Модели склеивания и структуры | Реактивность 2. Сколько, как быстро и как далеко? |
Структура 3. Классификация веществ | Реактивность 3. Каковы механизмы химических изменений? |
Концептуальное обучение
Новый курс химии стремится сократить содержание и выделить концепции, лежащие в основе обучения. Курс направлен на развитие понимания, которое связывает фактические, процедурные и метакогнитивные знания, и признает важность соединения обучения с концептуальным пониманием. Это включает в себя нелинейный, непрерывный процесс добавления новых знаний, развития понимания и выявления неправильных представлений.
Концептуальное понимание позволит учащимся осознавать и критически относиться к своим собственным знаниям, а также передавать и применять навыки и понимание в новых или других контекстах творчески, генеративно, автономно и динамично.
Структура учебной программы была переосмыслена, в нее включены понятия, относящиеся к конкретным предметам — структура и реактивность — в рамках, которые фокусируются на моделях и концепциях, которые позволяют учителям создавать свой собственный путь для двухлетней программы.
Больше внимания развитию навыков
Практический характер предмета подчеркивается включением в руководство раздела «Навыки изучения химии». различных аспектов, включая исследовательские навыки и методы, подходящие для этого уровня обучения.
Природа науки
Природа науки (NOS) является всеобъемлющей темой курсов DP по биологии, химии и физике, которая исследует концептуальное понимание, связанное с целью, особенностями и влиянием научных знаний. Студенты-химики DP будут иметь возможность анализировать, обсуждать, оспаривать и уточнять свое понимание научных идей и концепций, встречающихся в ходе курса. Понимание БДУ ценно на нескольких уровнях:
Студенты-химики DP будут иметь возможность анализировать, обсуждать, оспаривать и уточнять свое понимание научных идей и концепций, встречающихся в ходе курса. Понимание БДУ ценно на нескольких уровнях:
- развивает научную грамотность
- он обеспечивает структуру, в которой учащиеся могут более легко получить доступ к содержанию курса химии
- поддерживает обучение студентов.
Экспериментальная программа
Практическая работа
Практическая работа продолжает оставаться центральным аспектом курса химии DP. Учителям предлагается разработать собственную практическую схему работы, позволяющую учащимся глубже понять содержание предмета и связанных с ним понятий, а также предоставить возможности для развития широкого спектра практических и исследовательских навыков. Практическая схема работы должна быть широкой и сбалансированной, чтобы дать учащимся возможность испытать широкий спектр задач, от закрытых до открытых исследований, от практических экспериментов до использования симуляций и моделирования, включая технологии, где это необходимо.
Практическая схема работы должна быть широкой и сбалансированной, чтобы дать учащимся возможность испытать широкий спектр задач, от закрытых до открытых исследований, от практических экспериментов до использования симуляций и моделирования, включая технологии, где это необходимо.
Совместный научный проект
Совместный проект текущего курса будет обновлен.
Совместный научный проект — это междисциплинарный научный проект, направленный на решение реальных проблем, которые можно исследовать с помощью целого ряда предметов научной группы.
В рамках этого проекта студенты будут:
- интегрировать фактические, процедурные и концептуальные знания, полученные в ходе изучения их научных дисциплин
- применяют свое коллективное понимание для разработки ориентированных на решение стратегий, направленных на решение проблемы
- развивать понимание того, как взаимосвязанные системы, механизмы и процессы влияют на проблему
- оценивать и размышлять о присущей сложности решения реальных проблем
- развивать понимание степени глобальной взаимосвязи между региональными, национальными и местными сообществами
- получить возможность стать активными и заинтересованными гражданами мира
- получить высокую оценку коллективных действий и международного сотрудничества
- укрепляют свои навыки ATL, включая сплочение команды, переговоры и лидерство.

Совместный научный проект предоставляет учащимся прекрасную возможность работать с теми, кто изучает другие научные курсы DP, как в своей школе, так и в других школах мира IB.
Изменения в модели оценивания
Внешнее оценивание
Все учащиеся сдают только два внешних экзамена.
Документ 1A включает в себя вопросы с несколькими вариантами ответов по программе, а документ 1B включает вопросы анализа данных. Эти документы дают возможность оценить некоторые из экспериментальных навыков и методов.
Документ 2 включает вопросы с краткими и расширенными ответами на переплетение навыков, концепций и понимания, помещенных в соответствующий химический контекст.
Другие изменения включают удаление дополнительных тем (материалы, биохимия, энергия и медицинская химия). Из существующих четырех вариантов часть контента была включена в курс либо на стандартном, либо на более высоком уровне.
Внутреннее оценивание
«Научное исследование» (внутреннее оценивание) также претерпит изменения: учащиеся смогут сотрудничать и поддерживать друг друга в небольших группах.


 После вопроса в переплетенной книге предоставляется несколько страниц бумаги для ответов.
После вопроса в переплетенной книге предоставляется несколько страниц бумаги для ответов.

Leave A Comment