Реальный ЕГЭ по химии 2019. Задание 33 (№ 32 в ЕГЭ 2022)
Чтобы поделиться, нажимайте
Реальный ЕГЭ по химии 2019. Задание 33
Представляем вашему вниманию задание 33 из реального ЕГЭ 2019 и резервных дней основного периода (31 мая 2019 года, 20 июня 2019 года и 1 июля 2019 года) с подробными текстовыми решениями и ответами.
Реальный ЕГЭ 2019. Задание 33. Вариант 1.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 2.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 3.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 4.
Развернуть/свернуть решение
Реальный ЕГЭ 2019.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 6.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 7.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 8.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 9.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 10.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 11.
Задание 33. Вариант 11.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 12.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 13.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 14.
Развернуть/свернуть решение
Реальный ЕГЭ 2019. Задание 33. Вариант 15.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 1.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 2.
Задание 33. Вариант 2.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 3.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 4.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 5.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 6.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 7.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33.
Задание 33.
Развернуть/свернуть решение
Ещё вы можете скачать Подборку всех цепочек превращений, которые встречались в задании 32 на реальном ЕГЭ по химии за все годы.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
Типичные ошибки в ЕГЭ-2019 по химии – статья – Корпорация Российский учебник (издательство Дрофа – Вентана)
Блок «Теоретические основы химии»
№ 4 (базовый уровень сложности)
В 2019-м году, как и в 2018-м, задание 4 оказалось сложным для выпускников. Вопрос проверял знание типов химической связи и кристаллических решеток, знание веществ молекулярного и немолекулярного строения, понимание зависимости свойств веществ от их состава и строения.
Вопрос проверял знание типов химической связи и кристаллических решеток, знание веществ молекулярного и немолекулярного строения, понимание зависимости свойств веществ от их состава и строения.
Ошибки и их причины
Непонимание причинно-следственных связей строение – свойство (зная строение, можно предсказать свойство, а зная свойство, определить строение).
Пример
Ответ. 2, 4
Комментарий. Не все помнят, что в одном и том же соединении между атомами может существовать связь как ионная, так и ковалентная — то есть несколько видов связи. В данном случае ковалентная полярная связь есть в веществе с ионной кристаллической решеткой. Это карбонат магния и гидроксид натрия. Но здесь следует учесть, что между углеродом и кислородом в карбонате магния связь ковалентная полярная — так же, как между кислородом и водородом в гидроксиде натрия.
№ 30 (высокий уровень сложности)
Задания на понимание окислительно-восстановительных реакций базового уровня сложности были выполнено неплохо, а вот вопросы на ту же тему высокого уровня сложности давались непросто.
Ошибки и их причины
- Неправильно выбраны окислитель и восстановитель (в паре Ag2O — KClO Ag2O не сможет быть окислителем).
- Неверно вычислены степени окисления элементов.
- Неверно записаны степени окисления элементов (Cr6+ вместо Cr+6 или Cr2+6 вместо 2Cr+6).
- Неверно записаны процессы окисления и восстановления.
- Продукты составлены без учета среды (в щелочной среде K2Cr2O7 вместо K2CrO4).
- Незнание номенклатуры неорганических веществ (гипохлорит калия: KClO3 вместо KClO) ⇒ выбраны вещества не из предложенного перечня.
Пример
Возможный ответ
3KClO + 2CrCl3 + 10KOH = 2K2 CrO4 + 9KCl + 5H2O
| 2 | Cr+3 − 3e— → Cr+6 | хром за счет Cr+3 — восстановитель | |
| 3 | Cl+1 + 2e— → Cl‒1 | хлор за счет Cl |
Комментарий. В данном случае проще всего было взять гипохлорит калия и хлорид хрома (III) и помнить, что хлорид хрома (III) проявляет восстановительные свойства именно в щелочной среде. На экзамене многие школьники отходили от вариантов ответов из критериев и составляли другие уравнения реакций. Если эти ответы не противоречили здравому смыслу, то они приносили максимальные 2 балла.
В данном случае проще всего было взять гипохлорит калия и хлорид хрома (III) и помнить, что хлорид хрома (III) проявляет восстановительные свойства именно в щелочной среде. На экзамене многие школьники отходили от вариантов ответов из критериев и составляли другие уравнения реакций. Если эти ответы не противоречили здравому смыслу, то они приносили максимальные 2 балла.
№ 31 (высокий уровень сложности)
Среди прочих вызывали затруднения задания на знание электролитической диссоциации электролитов в водных растворах, сильных и слабых электролитов, реакций ионного обмена, на умение определять характер среды водных растворов веществ, объяснять сущность реакций ионного обмена и составлять их уравнения.
- Неверно указаны заряды ионов (Cr+3 вместо Cr3+).
- В сокращенном ионном уравнении коэффициенты не являются минимальными целыми числами (2Н+ + 2ОН‒ = 2Н2О вместо Н+ + ОН‒ = Н2О).

- В ионном уравнении формулы слабых электролитов, практически нерастворимых веществ записаны не в молекулярной форме, а в виде ионов (СН
- Вместо требуемого одного уравнения записаны несколько (но даже если первое неверное, а второе верное, учитывается только первое).
Пример
Возможный ответ
CH3COONH4 + KOH = CH3COOK + NH3 + H2O
CH3COO‒ + NH4+ + K+ + OH‒ = CH3COO‒ + K+ + NH3 + H2O
Nh5+ + OH‒ = Nh4 + h3O
Комментарий. Вариант ответа из критериев подразумевал, что берется ацетат аммония, щелочь, и выделяется аммиак. Но, как и в задании № 30, здесь были возможны разные подходы, не противоречащие здравому смыслу.
Блок «Неорганическая химия»
№ 8 (повышенный уровень сложности)
Традиционно сложное задание. От школьников требовалось вспомнить химические свойства веществ разных классов (как общие для данного класса веществ, так и специфические). В частности свойства: простых веществ-металлов, переходных металлов, простых веществ-неметаллов, оксидов, оснований и амфотерных гидроксидов, кислот, солей, комплексных веществ (на примере гидроксосоединений алюминия и цинка).
От школьников требовалось вспомнить химические свойства веществ разных классов (как общие для данного класса веществ, так и специфические). В частности свойства: простых веществ-металлов, переходных металлов, простых веществ-неметаллов, оксидов, оснований и амфотерных гидроксидов, кислот, солей, комплексных веществ (на примере гидроксосоединений алюминия и цинка).
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических и органических соединений, свойства отдельных представителей этих классов.
Пример
Ответ
А — 5, Б — 2, В — 1, Г — 4.
Комментарий. Из данного перечня, калий, как щелочной металл, будет взаимодействовать с кислородом, водородом и хлором. Рассматривая фтороводород, нужно вспомнить, что это слабая кислота, и что она также проявляет специфические свойства и взаимодействует, например, с оксидом кремния – SiO2. Углекислый газ — типичный кислотный оксид; в перечне находим вещества, которые проявляют его основные свойства (плюс вода).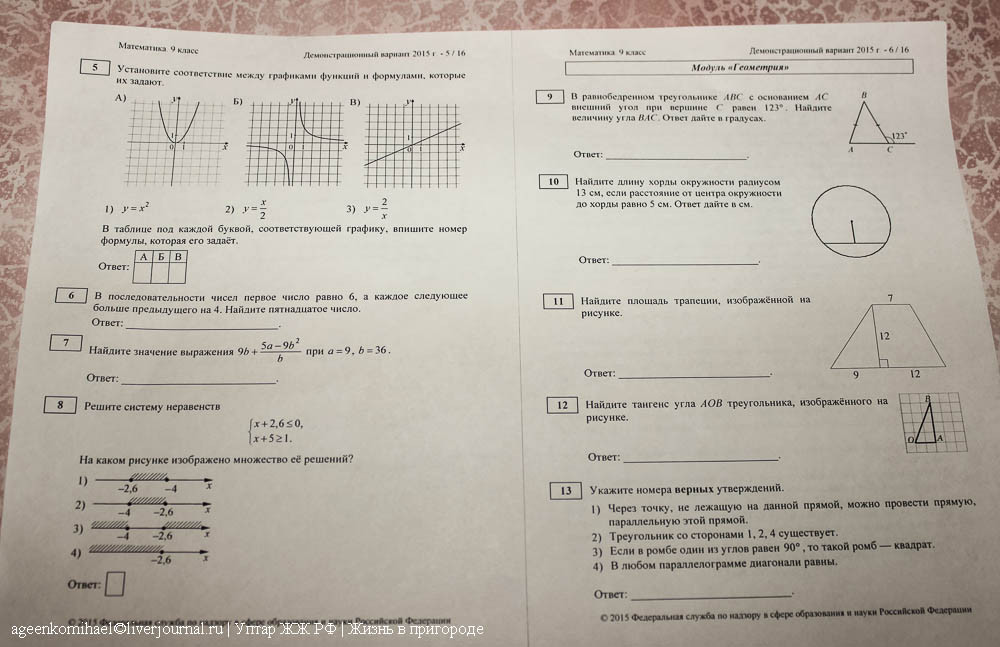 Что касается нитрата меди (II), то тут можно представить разные обменные взаимодействия, но и окислительно-восстановительные реакции тоже, и в данном случае с йодоводородом, который является сильным окислителем, пойдет окислительно-восстановительная реакция.
Что касается нитрата меди (II), то тут можно представить разные обменные взаимодействия, но и окислительно-восстановительные реакции тоже, и в данном случае с йодоводородом, который является сильным окислителем, пойдет окислительно-восстановительная реакция.
№ 9 (повышенный уровень сложности)
Задание по элементам содержания аналогично вопросу № 8, отлично только по формату.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений и свойства отдельных представителей этих классов, а также и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность реакций.
Пример
Ответ
А — 1, Б — 1, В — 6, Г — 4.
Комментарий. В первых двух случаях один и тот же вариант ответа, поскольку кислые соли взаимодействуют с щелочами и могут переходить в средние соли (многие школьники об этом забывают). Гидрид калия и вода — эта реакция, которая приводит к образованию щелочи и водорода. Далее классическое взаимодействие: основной оксид активного щелочного металла с водой, конечно же, даст просто щелочь.
Далее классическое взаимодействие: основной оксид активного щелочного металла с водой, конечно же, даст просто щелочь.
№ 10 (базовый уровень сложности)
Вопрос на понимание взаимосвязей неорганических веществ.
Ошибки и их причины
Неумение характеризовать общие химические свойства основных классов неорганических соединений, свойства отдельных представителей этих классов и объяснять зависимость свойств неорганических веществ от их состава и строения, сущность химических реакций.
Пример
Ответ
X — 2, Y — 4.
Комментарий. Нужно обратить внимание на степень окисления серы: было +4, стало +6, то есть идет окислительно-восстановительный процесс. Берется хлор — но раствор, обязательно водный раствор (тогда это взаимодействие возможно). Калий присутствует только в одном соединении, это карбонат калия. При оценке ответа один балл начисляется за ответ X, и второй за Y.
№ 32 (высокий уровень сложности)
Задание на понимание взаимосвязи неорганических веществ. От школьников требуется сделать мысленный эксперимент.
От школьников требуется сделать мысленный эксперимент.
Ошибки и их причины
- Не учтены амфотерные свойства оксидов и гидроксидов (Na2CO3 + Fe2O3 → …, Al2O3 + Na2CO3 → …).
- Неверно составлены уравнения окислительно-восстановительных реакций.
- Неверно составлены уравнения реакций электролиза.
- Не учтено взаимное усиление гидролиза (Fe(NO3 )3 + Na2CO3 + h3O → …).
Пример
Ответ
Na2CO3 + Fe2O3 = 2NaFeO2 + CO2↑
4NO2 + O2 + 2h3O = 4HNO3
NaFeO2 + 4HNO3 = NaNO3 + Fe(NO3 )3 + 2h3O
2Fe(NO3 )3 + 3Na2CO3 + 3h3O = 2Fe(OH)3↓ + 3CO2↑ + 6NaNO3
Комментарий. Нужно вспомнить, что оксид железа (III) обладает все же слабыми амфотерными свойствами (здесь многие школьники допускали ошибки). Соответственно, в данном случае он ведет себя как нелетучий кислот оксид, поэтому дает такую соль. Далее следует классическая реакция образования азотной кислоты. Следующая реакция тоже вызвала сложность у учеников, поскольку образовались две соли: нитрат железа (III) и нитрат натрия. В последнем взаимодействии многие школьники забыли про реакции взаимного усиления гидролиза. Желательно, чтобы при написании подобных реакций ученики обращались к таблице растворимостей — там стоит прочерк на месте карбоната железа (III). Говорить об альтернативных ответах в заданиях данного типа сложно — все вполне однозначно.
В последнем взаимодействии многие школьники забыли про реакции взаимного усиления гидролиза. Желательно, чтобы при написании подобных реакций ученики обращались к таблице растворимостей — там стоит прочерк на месте карбоната железа (III). Говорить об альтернативных ответах в заданиях данного типа сложно — все вполне однозначно.
Блок «Органическая химия»
№ 11 (базовый уровень сложности)
Задание на классификацию органический веществ. Ученики справились с ним очень плохо, хотя на первый взгляд вопросы довольно простые.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Пример
Ответ
А — 2, Б — 1, В — 4.
Комментарий. Нужно знать номенклатуру, и не только международную, но еще и тривиальную. Например, аланин — это тривиальная номенклатура.
№ 12 (базовый уровень сложности)
Проверяет понимание строения органических веществ. Нужно знать, что такое гомологи, что такое изомеры, каково взаимное влияние атомов в молекулах, типы связей, гибридизацию орбиталей и т. д.
д.
Ошибки и их причины
Незнание номенклатуры органических и неорганических веществ.
Пример
Ответ. 1, 4
Комментарий. Здесь даны, в том числе, и тривиальные названия (стирол, толуол). Как и в задании 11, у школьников возникаю проблемы с номенклатурой, а также с пониманием, что такое изомеры и гомологи (два важнейших понятия в органической химии).
№ 14 (базовый уровень сложности)
Требует понимания кислородсодержащих соединений. Нужно помнить свойства этих соединений.
Ошибки и их причины
Неумение характеризовать строение и химические свойства изученных органических соединений.
Пример
Ответ. 2,3
Комментарий. Требуемое вещество является спиртом, циклическим спиртом, содержит гидроксогруппу — соответственно, будет проявлять свойства одноатомных спиртов. При подготовке, когда дети выполняют такие, на первый взгляд, простые задания базового или повышенного уровня сложности, в которых не требуется записывать уравнение реакций, пусть они параллельно, без спешки, но все-таки записывают уравнения — иначе знания будут слишком формальные.
№ 17 (повышенный уровень сложности)
Как и задание № 14, проверяет знание кислородсодержащих органических соединений — но в немного другом формате.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
Пример
Ответ
А — 6, Б — 1, В — 5, Г — 4.
Комментарий. В продуктах реакции даны не формулы, а названия, что возвращает нас к проблеме незнания номенклатуры. В первом случае представлена типичная реакция этерификации, и получится, безусловно, этилацетат (сложный эфир). Во втором случае тоже сложный эфир, только метилформиат, производное муравьиной кислоты. В пункте «В» даны два спирта: между разными спиртами тоже может быть взаимодействие, но с образованием простых эфиров — и в данном варианте это будет метилэтиловый эфир. В последней реакции: спирт и серная кислота, нагревание — здесь не может быть никакой дегидратации (как, скажем, у этанола), а может быть только образование простого эфира, диметилового эфира.
№ 15 (базовый уровень сложности)
Вопрос на знание азотосодержащих химических соединений — из года в год он вызывает трудности у ребят при сдаче ЕГЭ по химии. Тема действительно сложная, и, к тому же, она изучается в конце года.
Ошибки и их причины
- Неумение характеризовать строение и химические свойства изученных органических соединений.
- Незнание номенклатуры.
Пример
Ответ. 1, 5
Комментарий. Для начала нужно вспомнить, что такое дипептиды (это продукт конденсации аминокислот). В данном случае выбираем две аминокислоты: аланин и глицин. Казалось бы, классика — но очень низкий процент выполнения задания.
№ 18 (базовый уровень сложности)
Задание на понимание генетических связей органических соединений.
Ошибки и их причины
- Не знание способов получения веществ и их химических свойств.
- Неумение применить конкретные знания в незнакомой ситуации.
Пример
Ответ
X — 3, Y — 4.
Комментарий. Достаточно сложное задание. Даны три превращения: нужно додуматься, как все эти вещества взаимосвязаны между собой. Что необходимо получить из хлорэтана, чтобы получить дигологен производную? Конечно, этилен — путем реакции взаимодействия со спиртовым раствором щелочи. Затем, при взаимодействии с бромом, получается дигологен производная: 1, 2 дибромэтан. После снова берется спиртовой раствор щелочи. Но, если дигологен производная, рождается уже соединение с тройной связью: в данном случае это ацетилен. При подготовке важно, чтобы ученики оформляли ход рассуждений, а не просто угадывали ответ.
№ 33 (высокий уровень сложности)
Задание на понимание реакций, подтверждающих взаимосвязь органических соединений. Даны цепочки с пропусками, нужно восстановить схему, подтвердить генетическую связь уравнениями реакций.
Ошибки и их причины
- Не использованы структурные формулы веществ.
- Составлены схемы, а не уравнения реакций.
- Не расставлены коэффициенты в уравнениях реакций.

- Продукты не соответствуют условиям протекания реакций.
Ответ
Комментарий. Условий нет. Требуется заглянуть немного вперед, чтобы понять, что же там может быть. В данном случае дано только одно промежуточное вещество: 2-бромбутан — значит, следует изначально связать его и этан. Вначале нужно получить хлор этан, затем — реакция Вюрца (удвоение углеводородного радикала, и получается бутан). Далее бромирование на свету. Следует учитывать, что бром в данной реакции ведет себя достаточно селективно, то есть с большим выходом получается продукт замещения именно у вторичного атома углерода. Когда школьники писали продукт замещения (мизерный процент) у первичного атома, это считалось ошибкой. С хлором было бы не так, а вот с бромом селективность очень высокая. Далее вспоминается правило Зайцева, как идет реакция дегидрогалогенирования, идет образование связи, каким образом отщепление водорода идет от атома углерода (соединенного с меньшим числом атомов водорода). То есть получается бутен-2. Затем окисление, жесткие условия: перманганат калия, серная кислота и нагревание — здесь пойдет реакция с разрывом этого углеродного скелета по месту двойной связи, и получится кислота. В данном случае — симметричное соединение, поэтому получится в два раза больше молей уксусной кислоты. Альтернативные варианты представить сложно.
То есть получается бутен-2. Затем окисление, жесткие условия: перманганат калия, серная кислота и нагревание — здесь пойдет реакция с разрывом этого углеродного скелета по месту двойной связи, и получится кислота. В данном случае — симметричное соединение, поэтому получится в два раза больше молей уксусной кислоты. Альтернативные варианты представить сложно.
Блок «Методы познания в химии. Химия и жизнь»
№ 25 (повышенный уровень сложности)
Вопросы на качественные реакции даются школьникам нелегко. Почему? Потому что из школы, к сожалению, уходит реальный химический эксперимент. Выучить все признаки реакций без жизненных наблюдений очень сложно.
Ошибки и их причины
Неумение планировать и проводить эксперимент по получению и распознаванию важнейших неорганических и органических соединений.
Пример
Ответ
А — 5, Б — 5, В — 2, Г — 5.
Комментарий. Важно помнить, что не просто идет взаимодействие, а идет такое взаимодействие, которые имеет характерные видимые особенности. Есть признаки, по которым сразу можно отличить вещества. Толуол и фенол — это бромная вода, образование осадка трибромфенола. Толуол не будет взаимодействовать с бромной водой, в отличие от фенола. Пропанон и гексен — здесь соединение с кратной связью, снова нужно взять бромную воду. Что касается пропанола-2 и уксусной кислоты: в вариантах есть гидрокарбонат, который будет взаимодействовать с уксусной кислотой, и получится видимый признак, выделение газа. Пропановая кислота и пропеновая кислота — опять же соединение не предельное и следует взять бромную воду.
Есть признаки, по которым сразу можно отличить вещества. Толуол и фенол — это бромная вода, образование осадка трибромфенола. Толуол не будет взаимодействовать с бромной водой, в отличие от фенола. Пропанон и гексен — здесь соединение с кратной связью, снова нужно взять бромную воду. Что касается пропанола-2 и уксусной кислоты: в вариантах есть гидрокарбонат, который будет взаимодействовать с уксусной кислотой, и получится видимый признак, выделение газа. Пропановая кислота и пропеновая кислота — опять же соединение не предельное и следует взять бромную воду.
№ 26 (базовый уровень сложности)
Задание связано с применением веществ, поэтому тоже дается ученикам крайне сложно, процент выполнения очень низкий.
Ошибки и их причины
Незнание номенклатуры и областей применения веществ.
Пример
Ответ
А — 2, Б — 4, В — 3.
Комментарий. Нужно знать, что такое полипропилен и найти, соответственно, формулу пропилена (пропена). Далее — к полиизопрену найти формулу изопрена, и к полистиролу, соответственно, формулу стирола.
Далее — к полиизопрену найти формулу изопрена, и к полистиролу, соответственно, формулу стирола.
№№ 27, 28, 29 (базовый уровень сложности)
Школьники допускают ошибки и в расчетных задачах, в которых фигурируют массовые доли растворенных веществ, объемные отношения газов, термохимические уравнения.
Ошибки и их причины
- Незнание формул.
- Неумение преобразовывать формулы.
- Отступление от условий задачи (использование не тех единиц измерения, неверное округление).
Пример
Ответ. 8,6%
Ответ. 4,48 л
Ответ. 4,48 л
№ 34 (высокий уровень сложности)
В 2019 году впервые в ЕГЭ по химии появилось понятие «растворимость». Также в задачах данного типа встречаются «избыток» и «недостаток», «массовая доля растворенного вещества». Задачи усложняются. Для успешного выполнения нужно внимательно читать условия, а дальше продумывать логику (что от чего следует).
Ошибки и их причины
- Неверно составлены уравнения реакций (не понят химизм процессов).
- Невнимательное прочтение условия задачи («раствор разделили на две части», но не на две равные части; «часть вещества разложилась»).
- Не усвоено понятие «растворимость».
- Неверно определена масса полученного раствора.
- Математические ошибки (в том числе при нахождении молекулярных масс веществ).
Пример
Ответ
m(Na2CO3) = 31,8 ⋅ 2 = 63,6 г;
n(Na2CO3) = 63,6 / 106 = 0,6 моль;
n(CO2) = 4,48 / 22,4 = 0,2 моль;
n1(Na2CO3) = n(CO2) = 0,2 моль;
n2 (Na2CO3) = 0,6 — 0,2 = 0,4 моль;
m(CaCl2) = 222 ⋅ 0,25 = 55,5 г;
n(CaCl2) = 55,5/111 = 0,5 моль — избыток n(CaCl2)прореаг. = n2 (Na2 CO3) = 0,4 моль;
n(CaCl2)ост. = 0,5 — 0,4 = 0,1 моль;
= 0,5 — 0,4 = 0,1 моль;
m(CaCl2)ост. = 0,1 ⋅ 111 = 11,1 г;
n(CaCO3) = n2 (Na2 CO3) = 0,4 моль;
m(CaCO3) = 0,4 ⋅ 100 = 40 г;
m2 (Na2 CO3 )р-ра = (200 + 63,6) ⋅ 0,4 / 0,6 = = 175,7 г;
w(CaCl2 ) = 11,1 / 175,7 = 0,03, или 3%
Комментарий. Речь идет о делении на две части, но нигде не сказано, что это равные части. Однако в ответах некоторые школьники прямо писали: «Так как разделили на две равные части…» — ошибка. Решение следует начать с того, что бы посмотреть: сколько было карбоната натрия. Задачу можно решить по-разному: например, через массовую долю соли в насыщенном растворе. Здесь представлен наиболее простой вариант. Что характеризует растворимость? Сколько грамм вещества растворяется в 100 г растворителя (в данном случае воды) при комнатной температуре. Соответственно, если растворимость 31,8 и взято 200 мл воды (200 г), то умножается на 2 — столько карбоната натрия содержалось в растворе. Далее деление, выделение углекислого газа. Отсюда следует, что первая порция — 0,2 моль и всего карбоната было 0,6 моль. Нужно смотреть по разности. Во вторую реакцию вступило 0,4 моль. После следует определить, сколько выделилось осадка, сколько было хлорида кальция, сколько прореагировало и т.д. Часто дети допускают ошибки, когда находят массу раствора. Для успешного решения нужно внимательно посмотреть что смешали, что добавили, а после все сложить и вычесть то, что выпало в осадок и улетело в виде газа.
Далее деление, выделение углекислого газа. Отсюда следует, что первая порция — 0,2 моль и всего карбоната было 0,6 моль. Нужно смотреть по разности. Во вторую реакцию вступило 0,4 моль. После следует определить, сколько выделилось осадка, сколько было хлорида кальция, сколько прореагировало и т.д. Часто дети допускают ошибки, когда находят массу раствора. Для успешного решения нужно внимательно посмотреть что смешали, что добавили, а после все сложить и вычесть то, что выпало в осадок и улетело в виде газа.
№ 35 (высокий уровень сложности)
Задача на установление молекулярной и структурной формулы вещества (либо по продуктам сгорания, либо по массовым долям).
Ошибки и их причины
- Математические ошибки (грубое или неверное округление чисел).
- Не составлена структурная формула вещества в соответствии с условием задачи.
- Не составлено уравнение реакции, соответствующее условию задачи.
- Допущены ошибки в уравнении реакции (пропущены коэффициенты; пропущены формулы побочных продуктов реакции, например, воды; ошибки в написании структурных формул веществ).

Пример
Ответ
Комментарий. Нужно найти общую формулу, затем эмпирическую, и, исходя из условий записи свойств этих веществ, попытаться понять, о каком веществе идет речь. В данном случае — многоатомный спирт. Далее — составление уравнения реакции.
Для эффективной подготовки к ЕГЭ по химии эксперты советуют учебники «Химия» углубленного уровня для 10-11 классов. Авторы УМК: В.В. Еремин, Н.Е. Кузьменко, В.И. Теренин, А.А. Дроздов и В.В. Лунин.
#ADVERTISING_INSERT#
Информация об экзамене Chem 101 (архив)
Университет Иллинойса Урбана-Шампейн
Пожалуйста, посетите эту страницу, чтобы узнать о практических экзаменах, экзаменационных комнатах и времени сеансов вопросов и ответов.
Финальный экзамен
Финальный экзамен будет состоять из 50 вопросов с несколькими вариантами ответов. На выпускном экзамене нет вопросов со свободным ответом.
На выпускном экзамене нет вопросов со свободным ответом.
Советы по финальному экзамену
Экзамен 3 Цели
Экзамен 2 Цели
Экзамен 1 Цели
Экзамен 3:
Экзамен 3, осень 2022 г., ответы на экзамен 3, осень 2022 г. (экзамен 1, осенний 2022 г., был сдан в электронном виде на холсте.)
Экзамен 3, весна 2022 г., Весенний экзамен 2022 г., экзамен 3 Ответы
, осенний экзамен 2021 г. 3 ответа (осенний экзамен 3 2021 г. был сдан в электронном виде на Moodle.)
Весенний экзамен 3 2021 г. .)
Весенний экзамен 3 2020 г. и ответы (недоступно — весенний экзамен 3 был сдан в электронном виде на Lon-Capa.) 003
Ответы на экзамен 3, осень 2018 г., экзамен 3, экзамен 3, осень 2018 г. Экзамен 3 Ответы
Осень 2014 Экзамен 3, осень 2014 Экзамен 3 Ответы
Экзамен 2:
Экзамен 2, осень 2022 г., ответы на экзамен 2, осень 2022 г. (экзамен 1, осенний 2022 г. , был сдан в электронном виде на холсте.)
, был сдан в электронном виде на холсте.)
Экзамен 2, весна 2022 г., Экзамен 2 весны 2022 года Ответы
Экзамен осени 2021 года 2 ответа (осенний экзамен 2 2021 г. был сдан в электронном виде на Moodle). .)
Ответы на экзамен 2, весна 2020 г. (весенний экзамен 2, экзамен 2 был сдан в электронном виде на Lon-Capa.)
Ключ, экзамен 2, осень 2019 г., ключ экзамена 2, осень 2019 г.
Осенний экзамен 2018 г.
Ключ к экзамену 2, осень 2016, экзамен 2, ключ
, ключ к экзамену 2, осень 2015, ключ к экзамену 2, осень 2015 – 9000 3
Осень 2014 Экзамен 2, Осень 2014 г. Экзамен 2 Ключ
Экзамен 1:
Fall 2022 Exam 1, Fall 2022 Exam 1 Answers (осень 2022 Exam 1 был сдан в электронном виде на холсте.) 2021 Экзамен 1 был
Ответы на экзамен 1, весна 2021 г. (Экзамен 1, весна 2021 г., был сдан в электронном виде на Moodle.) 1 , Осень 2020 г. Экзамен 1 Ключ
Spring 2020 Exam 1, Spring 2020 Exam 1 Key
Fall 2019 Exam 1, Fall 2019 Exam 1 Key
Spring 2019 Exam 1, Spring 2019 Exam 1 Answers
Fall 2018 Экзамен 1, осень 2018 г. Экзамен 1 Ключ
Экзамен 1 Ключ
Осенний экзамен 1, осенний экзамен 2017, ключ 1
Осенний экзамен 1, осенний экзамен 2016, ключ 1
осенний экзамен 1, осенний экзамен 2015, ключ 1
осенний экзамен 1, осенний экзамен 2014, ключ
1 ключ
Решения для экзаменационной бумаги HSC по химии, 2019 г.
Хотите узнать, как вы сдали экзамен по химии HSC 2019? Что ж, наша команда химиков усердно работала над приготовлением решений для вас!
2019 HSC Chemistry Exam Paper Worked Solutions
Ниже приведены ответы и рабочие решения экзамена HSC по химии этого года.
Раздел 1. Решения с несколькими вариантами ответов
| Вопрос | Решение | Пояснение |
| 1 | Д | |
| 2 | Б | Основание Аррениуса — это вещество, которое отдает OH – при растворении в воде. |
| 3 | А | Карбонат кальция имеет самое высокое значение K sp среди данных карбонатов металлов. Поскольку каждый из карбонатов металлов образует в растворе одинаковое количество ионов, их значения можно сравнивать напрямую, чтобы определить вещество с наибольшей молярной растворимостью. Поскольку каждый из карбонатов металлов образует в растворе одинаковое количество ионов, их значения можно сравнивать напрямую, чтобы определить вещество с наибольшей молярной растворимостью. |
| 4 | Б | Отношение массы к заряду (m/z) исходного иона (молекулярного иона) равно 88. Это соответствует молекулярной массе бутановой кислоты. Примечание: другие фрагменты в масс-спектре обусловлены сложной реакцией перегруппировки, за которой следует процесс фрагментации (перегруппировка Маклафферти). В результате значения m/z других фрагментов не соответствуют фрагментам, которые можно было бы ожидать для молекулы бутановой кислоты. |
| 5 | С | Диапазон изменения окраски изопикраминовой кислоты (pH 4,0–5,6) содержит точку эквивалентности титрования (приблизительно pH 5). |
| 6 | А | Кривая титрования слабого основания NH 3 титруется сильной кислотой HCl. |
| 7 | Д | Катализатор обеспечивает альтернативный путь реакции для реакции с более низкой энергией активации. Уменьшение энергии активации одинаково как для прямой, так и для обратной реакции. Уменьшение энергии активации одинаково как для прямой, так и для обратной реакции. |
| 8 | А | |
| 9 | Б | Водородная связь является сильнейшим межмолекулярным взаимодействием. Карбоновые кислоты могут образовывать наибольшее количество взаимодействий водородных связей, поэтому требуется больше тепловой энергии для преодоления межмолекулярных сил при переходе из жидкого состояния в газообразное (кипение). |
| 10 | Д | |
| 11 | С | В насыщенном растворе карбоната бария твердый и водный карбонат бария находятся в динамическом равновесии: BaCO 3(s) ⇌ Ba 2+ (водн.) + CO 3 2- (водн.) Несмотря на отсутствие макроскопических признаков изменений, прямая и обратная реакции продолжаются. Следовательно, твердый карбонат бария, содержащий радиоактивный углерод-14, будет растворяться в растворе. |
| 12 | С | Чтобы максимизировать доход, равновесие должно сместиться в прямом направлении. Высокое давление : Прямая реакция превращает 3 моля газа в 2 моля газа. Согласно принципу Ле Шателье, при повышении давления равновесие смещается в сторону с меньшим количеством молей газа, что снижает давление и минимизирует возмущение. Низкотемпературный : Прямая реакция экзотермическая. Согласно принципу Ле Шателье, при понижении температуры равновесие смещается в экзотермическую сторону, чтобы заменить тепло и минимизировать возмущение. |
| 13 | Б | Повторяющееся звено полимера C 2 F 2 H 2 Молярная масса повторяющегося звена 64,036 г моль -1 Количество повторяющихся единиц (4,8 x 10 4 ) / 64,036 = 750 В повторяющейся единице два атома углерода, поэтому количество атомов углерода равно 750 x 2 = 1500 |
| 14 | А | Только один сигнал в 1 H ЯМР-спектр, указывающий на наличие только одного водородного окружения. Это означает, что все атомы водорода должны находиться в одной среде. Это означает, что все атомы водорода должны находиться в одной среде.В A все атомы водорода эквивалентны. B неверно, так как существует три водородных среды, поэтому ожидается 3 сигнала. C и D неверны, поскольку существует четыре водородных среды, поэтому ожидается четыре сигнала. |
| 15 | Б | рОН = 14 – 8,53 = 5,47 [ОН-] = 10 92 {0,0430 \ умножить на 0,0620} = 48,1 \) |
| 17 | Д | Реакция осаждения: Ba(NO 3 ) 2(водн.) + 2NaOH (водн.) → Ba(OH) 2(т) + 2NaNO 3(водн.) Осадок, который может образоваться, представляет собой гидроксид бария. Ba(OH) 2(s) ⇌ Ba 2+ (водн.) + 2OH – (водн.) К sp = [Ba 2+ ][OH – ] 2 = 2,55 x 10 -4 Равные объемы нитрата бария и гидроксида натрия означают, что концентрация уменьшится вдвое. [Ba 2+ ] = 0,025 моль л -1 [OH-] = 0,05 моль л -1 Q = (0,025)(0,05) 2 = 6,25 х 10- 5 Поскольку Q < K sp , осадок не образуется. |
| 18 | А | К eq очень мало, поэтому при равновесии концентрация реагентов выше, чем продуктов, и равновесие смещено влево. Это означает, что предпочтительна обратная реакция, и F – предпочтительно принимает протон по сравнению с CF 3 COO – , что делает его более сильным основанием. Точно так же CF 3 COOH будет предпочтительно отдавать протон по сравнению с HF, что делает его более сильной кислотой. |
| 19 | Д | Подкисленный перманганат калия является окислителем, поэтому соединение Y образуется в результате окисления X. Соединение Y окрашивает лакмус в синий цвет. Таким образом, соединение Y должно быть карбоновой кислотой, а соединение X должно быть первичным спиртом. Обработка соединения X (спирт) горячей концентрированной серной кислотой приводит к реакции дегидратации.
9{-3}}{12,0} \умножить на 100 = 0,48\%\) Обработка соединения X (спирт) горячей концентрированной серной кислотой приводит к реакции дегидратации.
9{-3}}{12,0} \умножить на 100 = 0,48\%\) |
Раздел 2. Вопросы с развернутым ответом
Вопрос 21a (2 балла)
Вопрос 21b (2 балла) формула C
3 H 6 O Однако атомы в молекулах расположены по-разному, так что они имеют разные функциональные группы. Изомер А содержит функциональную группу кетона, тогда как изомер В содержит функциональную группу альдегида.
Вопрос 21c (3 балла)
Изомер А можно отличить от изомера В по их реакции с подкисленным перманганатом калия. Изомер B может быть окислен до пропановой кислоты. На реакцию указывает изменение цвета с фиолетового на бесцветный. Однако изомер А не вызывает изменения цвета, так как не может подвергаться дальнейшему окислению.
Вопрос 22 (4 балла)
Буфер – это раствор, устойчивый к изменению рН при добавлении небольших количеств кислоты или основания. Раствор, содержащий CH 3 COOH и CH 3 COO – (из NaCH 3 COO) будут находиться в равновесии следующим образом:
Раствор, содержащий CH 3 COOH и CH 3 COO – (из NaCH 3 COO) будут находиться в равновесии следующим образом:
CH 3 COOH (водн.) + H 2 О (л) ⇌ CH 3 COO – (водн.) + H 3 O + (водн.)
При небольшом количестве 0,1 моль л 9 0158 -1 HCl добавляют к буферному раствору, [H 3 O + ] увеличивается, нарушая равновесие. Согласно принципу Ле Шателье, равновесие смещается влево, чтобы израсходовать H 3 O + и минимизировать помехи. Следовательно, [H 3 O + ] остается относительно стабильным, а поскольку pH = -log 10 [H 3 O + ], pH также остается относительно стабильным. Аналогично при добавлении 0,1 моль L -1 NaOH ионы OH — будут реагировать с ионами H 3 O + , уменьшая их концентрацию в равновесной смеси. Это сдвинет равновесие вправо в соответствии с принципом Ле Шателье, увеличивая H 3 O + концентрация для минимизации беспокойства.
Это сдвинет равновесие вправо в соответствии с принципом Ле Шателье, увеличивая H 3 O + концентрация для минимизации беспокойства.
Поскольку pH остается относительно стабильным при добавлении HCl и NaOH, цвет индикатора не изменится.
Вопрос 23а (4 балла)
q(H 2 O) = mc∆T = 105 x 10 -3 x 4,18 x 10 3 x (30 – 18. 5) = 5047,35 Дж = 5,04735 кДж
n(C 2 H 5 OH) = m / MM = 0,370 / 46,068 = 8,0316 x 10 -3 моль
∆H = -q / n = -5,04735 / 8,0316 x 10 -3 = -628 кДж моль -1 (3 ст.ф.)
Вопрос 23b (2 балла) 9046 7
Спиртовку можно принести близко к стакану с водой. Это минимизирует потери тепла в окружающую среду. Так как большее количество тепла, выделяемого в результате реакции горения, будет поглощаться водой, расчетное значение ∆H будет больше по величине и, следовательно, ближе к принятому значению.
(Другие возможные ответы: использовать зажим и подставку для реторты вместо штатива и сетчатого коврика или изолировать калориметр теплозащитными экранами)
Хотите узнать, как создать химический ответ Band 6?
Наши специалисты HSC Chemistry помогут вам получить всестороннее представление о содержании курса и отточить навыки расширенных ответов!
Уверенно начните HSC Chem
Опытные преподаватели, исчерпывающие ресурсы, индивидуальная помощь! Учитесь дома с Matrix+ Online.
Вопрос 24а (3 балла)
Проводимость изначально очень высокая из-за высокой концентрации ионов в растворе, что является результатом полной ионизации соляной кислоты. При добавлении гидроксида бария проводимость уменьшается, потому что концентрация ионов уменьшается, поскольку количество молей ионов уменьшается по мере того, как происходит нейтрализация и увеличивается объем. Кроме того, по мере нейтрализации H 9Ионы 0158 + замещаются менее проводящими ионами Ba 2+ . Проводимость достигает минимума в точке эквивалентности, так как все ионы H + удалены и присутствуют только ионы Ba 2+ и Cl – . После точки эквивалентности проводимость увеличивается по мере добавления большего количества гидроксида бария. Поскольку реакции не происходит, количество молей ионов в растворе увеличивается. Следовательно, концентрация ионов увеличивается, что приводит к увеличению проводимости.
Кроме того, по мере нейтрализации H 9Ионы 0158 + замещаются менее проводящими ионами Ba 2+ . Проводимость достигает минимума в точке эквивалентности, так как все ионы H + удалены и присутствуют только ионы Ba 2+ и Cl – . После точки эквивалентности проводимость увеличивается по мере добавления большего количества гидроксида бария. Поскольку реакции не происходит, количество молей ионов в растворе увеличивается. Следовательно, концентрация ионов увеличивается, что приводит к увеличению проводимости.
Вопрос 24b (4 балла)
Ba(OH) 2(водн.) + 2HCl (водн.) → BaCl 2(водн.) + 2H 2 О (л)
н( HCl) = c x V = 1,050 x 10 -3 x 0,250 = 2,625 x 10 -4 моль
n(Ba(OH) 2 ) = ½ x n(HCl) = 1,3125 x 10 901 58 -4 моль
c(Ba(OH) 2 ) = n / V = 1,3125 x 10 -4 / 0,01715 = 7,653 x 10 -3 моль л -1 (4 s. f.) 900 03
f.) 900 03
Вопрос 25а (2 балла)
Вопрос 25б (3 балла)
Удаление CO снижает его концентрацию, что вызывает уменьшение частоты успешных столкновений между CO и H 2 O. Отсюда скорость прямая реакция уменьшается, а скорость обратной остается неизменной, так как концентрации CO 2 и H 2 не изменяются. Поскольку скорость прямой реакции меньше, чем обратной, равновесие смещается влево, что приводит к увеличению концентрации СО. Со временем, чем больше СО и Н 2 O и концентрации CO 2 и H 2 уменьшаются, скорость прямой реакции увеличивается, а скорость обратной уменьшается до тех пор, пока скорости снова не станут равными, а все концентрации останутся постоянными.
Вопрос 26а (5 баллов)
В ИК-спектре наблюдается сильное поглощение около 1700 см -1 , характерное для связи С=О, и еще одно широкое поглощение в области 2500–3500 см -1 , что характерно для связи O–H в кислотах. Соединение реагирует с порошком карбоната натрия с образованием пузырьков углекислого газа. Это указывает на то, что соединение представляет собой карбоновую кислоту.
Соединение реагирует с порошком карбоната натрия с образованием пузырьков углекислого газа. Это указывает на то, что соединение представляет собой карбоновую кислоту.
Масс-спектр имеет исходный пик при m/z = 74, что соответствует молекулярной формуле C 3 H 6 O 2 . Пики при m/z = 45 и 57 соответствуют осколочным ионам:
Спектр ЯМР 13 С показывает 3 сигнала, указывающие на то, что каждый углерод находится в различном углеродном окружении. Сигнал около 180 м.д. характерен для карбонильного углерода.
Может также включать:
Спектр ЯМР 1 H показывает 3 сигнала:
- Синглет с интегрированием 1, что указывает на отсутствие соседних водородов и только один водород в данной среде. Это соответствует кислому водороду.
- Квартет с интегрированием 2, который указывает на присутствие соседнего –CH 3 и двух атомов водорода в этой среде. Это соответствует атомам водорода на втором углероде.

- Триплет с интегрированием 3, указывающий на присутствие соседнего –CH 2 – и трех атомов водорода в этой среде. Это соответствует атомам водорода на третьем углероде.
Вопрос 26b (3 балла)
Химикам следует использовать более одного спектроскопического метода, поскольку разные методы дают разную информацию о структуре органического соединения. Например, ЯМР-спектроскопия дает информацию о типе присутствующей связи посредством химических сдвигов и предоставляет информацию о связности посредством картины расщепления в 1 H ЯМР спектр. ИК-спектроскопия дает информацию о присутствующих связях или функциональных группах.
Использование комбинации методов позволяет полностью понять структуру и гарантирует правильность предлагаемой структуры, поскольку она поддерживается несколькими наборами данных.
Вопрос 27a (1 балл)
K b = K w / K a = 10 -14 / 3,0 x 10 90 158 -8 = 3,3 х 10 -7
Вопрос 27b (4 балла)
| Концентрация (моль л -1 ) | ОСl – | HOCl | ОХ – |
| Начальный | 0,20 | 0 | 0 |
| Изменить | -? | +? | +? |
| Равновесие | 0,20 – ? | ? | ? |
Предположим, 0,20 – ? ≈ 0,20, так как K b мал.
К б = ? 2 / 0,20 = 3,3 х 10 -7
? = 2,569 x 10 -4
Следовательно, [OH – ] = 2,569 x 10 -4 моль л -1
pOH = -log 10 (2,56 9 х 10 -4 ) = 3,59
pH = 14 – 3,59 = 10,41 (2 ст.ф.)
Вопрос 28
Модель классификации кислот и оснований Бренстеда-Лоури определяет кислоту как протон (H + ) донор и основание в качестве акцептора протона (H + ). Эта модель лучше подходит для классификации кислот и оснований, чем модель Аррениуса.
В отличие от определения кислот и оснований по Аррениусу, модель Бренстеда-Лоури смогла объяснить основную природу видов, не содержащих ОН – . Например, основная природа аммиака (NH 3 ):
NH 3 (водн.) + H 2 O (I) ⇌ NH 4 + 9 0159 (водный) + OH – (водный)
Модель Бренстеда-Лоури также может объяснить неводные кислотно-основные реакции. Например, реакция между хлористым водородом и газообразным аммиаком:
Например, реакция между хлористым водородом и газообразным аммиаком:
NH 3(г) + HCl (г) → NH 4 Cl (тв)
Следовательно, теория Бренстеда-Лоури была ан улучшение предыдущих теорий кислот и оснований, поскольку оно объясняло кислотно-щелочное поведение большего количества видов.
Вопрос 29а (2 балла)
При добавлении твердого Ca(OH) 2 в ливневую воду образуются ионы Ca 2+ и OH – . Ионы Pb 2+ и Cu 2+ будут образовывать осадки с ионами OH – по следующим уравнениям: (водный) ⇌ Pb(OH) 2(т)
Cu 2+ (водн.) + 2OH – (водн.) ⇌ Cu(OH) 2(s)
Вопрос 29b (2 балла)
Для измерения концентрации элемента в образце ААС использует длину волны света, которая соответствует атомному поглощению этот элемент. Поскольку каждый элемент имеет уникальную длину волны поглощаемого света, концентрация аналита может быть избирательно измерена в присутствии других частиц. Следовательно, концентрации Pb 2+ и Cu 2+ могут быть независимо измерены в пробе ливневой воды, содержащей оба иона.
Поскольку каждый элемент имеет уникальную длину волны поглощаемого света, концентрация аналита может быть избирательно измерена в присутствии других частиц. Следовательно, концентрации Pb 2+ и Cu 2+ могут быть независимо измерены в пробе ливневой воды, содержащей оба иона.
Вопрос 29c (7 баллов)
Измеренная абсорбция Cu 2+ : 0,040 = 0,3 x 10 -5 моль л -1 (из графика) 90 497 с(Cu 2+ после обработки ) = 0,3 x 10 -5 моль л -1 x 63,55 г моль -1
= 1,9065 x 10 -4 г л -1
= 0,19 мг L -1 (2 с.ф. )
Измеренная абсорбция Pb 2+ : 0,080 = 0,9 x 10 -5 моль л -1 (из графика)
c(Pb 2+ после обработки) = 0,9 x 10 -5 моль л -1 x 207 г моль -1
= 1,863 x 10 -3 г л -1
= 1,9 мг л -1 (2 ст. ф.)
ф.)
Таким образом, обработка эффективна для снижения концентрации ионов Cu 2+ ниже предела разряда, однако не может снизить концентрацию Pb 2+ ниже предела разряда.
Вопрос 30 (3 балла)
Чтобы эти соли были растворимыми, ΔG должно быть меньше нуля (ΔG < 0). В результате хлорид магния растворяется в воде при 298 К, а фторид магния — нет.
С учетом уравнения ΔG = ΔH – TΔS:
Растворение как хлорида магния, так и фторида магния является экзотермическим (ΔH < 0). Однако изменение энтальпии, связанное с растворением хлорида магния, более отрицательное, чем у фторида магния, что означает, что оно является более энтальпийно благоприятным.
Растворение хлорида магния и фторида магния имеет отрицательное изменение энтропии (ΔS), что делает каждый процесс энтропийно неблагоприятным (для благоприятного процесса ΔS > 0). Однако изменение энтропии для фторида магния более отрицательно, чем для хлорида магния.
Чтобы преодолеть отрицательное изменение энтропии, связанное с растворением каждой из этих солей при 298 K (значения T∆S), процесс должен иметь большое отрицательное значение ∆H, чтобы быть благоприятным. Как следствие, хлорид магния растворим, а фторид магния — нет.
Как следствие, хлорид магния растворим, а фторид магния — нет.
Вопрос 31 (4 балла)
| Концентрация (моль л -1 ) | HgCl 4 2- | Медь 2+ | CuCl 4 2- | рт.ст. 2+ |
| Начальный | 0,100 | 0,100 | 0 | 0 |
| Изменить | -? | -? | +? | +? |
| Равновесие | 0,100 – ? | 0,100 – ? | ? | ? |
К экв = ? 2 / (0,100 – ?) 2 = 4,55 x 10 -11
Извлечение квадратного корня из обеих частей:
? / (0,100 – ?) = 6,74536878 х 10 -6
? = 6,74536878 х 10 -6 х 0,100 / (1 + 6,74536878 х 10 -6 ) = 6,745323 х 10 -7
[Hg 2+ ] = 6,75 x 10 -7 моль л -1 (3 с. ф.)
ф.)
Вопрос 32 (4 балла)
Рассматривая простейшие примеры соединений каждого класса, доминирующая межмолекулярная сила метанол представляет собой водородную связь, тогда как для метантиола это диполь-дипольные силы. Поскольку водородная связь представляет собой более сильную межмолекулярную силу, чем диполь-дипольные силы, для преодоления межмолекулярных сил требуется меньше тепловой энергии, а это означает, что тиоловые соединения имеют более низкие температуры кипения, чем их спиртовые аналоги.
Однако по мере увеличения длины цепи разница температур кипения спиртов и тиолов уменьшается. Это связано с увеличением силы дисперсионных сил (дисперсионные силы пропорциональны молекулярной массе). Поскольку тиоловые соединения имеют большую молекулярную массу, чем их спиртовые аналоги, дисперсионные силы становятся более доминирующей межмолекулярной силой при определении температуры кипения. Это приводит к более резкому увеличению их температуры кипения с увеличением длины цепи по сравнению со спиртами.
Вопрос 33 (4 балла)
Al(OH) 3(водн.) + 3HCl (водн.) → AlCl 3(водн.) + 3H 2 О (л)
нет (Al(OH) 3 ) = m / MM = 1,17 / 78,004 = 0,014999 моль
n(HCl) = c x V = 0,100 x 0,500 = 0,05 моль
Al(OH) 3 ограничивающий реагент и HCl находится в избыток
n(HCl) оставшийся = n(HCl) исходный – n(HCl) использованный = 0,05 – 0,044998
= 5,002308 x 10 -3 моль
n(H + ) = n(HCl) = 5,002308 x 10 -3 моль
[H + ] = n / V = 5,002308 x 10 -3 / 0,500 = 0,0100046 моль л -1
pH = -log 10 (0,0100046) = 2,000 (3 ст.ф.)
Вопрос 34 (7 баллов)
Этап 1: NaOH (водн.) , нагревание
Этап 2: KMnO 9 0170 4 /H + , тепло
Этап 3: Концентрированная серная кислота, флегма
Продукт B можно идентифицировать с помощью инфракрасной спектроскопии.




 Через некоторое время радиоактивный изотоп будет присутствовать как в твердом остатке, так и в фильтрате.
Через некоторое время радиоактивный изотоп будет присутствовать как в твердом остатке, так и в фильтрате.

Leave A Comment