Задание 3 ЕГЭ по химии 2019: теория и практика
Рассмотрим задания, представленные в экзаменационной работе, обратившись для этого к демонстрационному варианту ЕГЭ по химии 2019 года.
Блок «Строение атома. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Закономерности изменения свойств химических элементов по периодам и группам». «Строение вещества. Химическая связь»
Этот блок содержит задания только базового уровня сложности, которые были ориентированы на проверку усвоения понятий, характеризующих строение атомов химических элементов и строение веществ, а также на проверку умений применять Периодический закон для сравнения свойств элементов и их соединений.
Рассмотрим эти задания.
Задания 1-3 объединены единым контекстом:
|
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. |
Задание 3
Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную —4.
Запишите в поле ответа номера выбранных элементов.
Для выполнения задания 3 следует владеть следующими понятиями: химический элемент, атом, молекула, ион, химическая связь, электроотрицательность, валентность, степень окисления
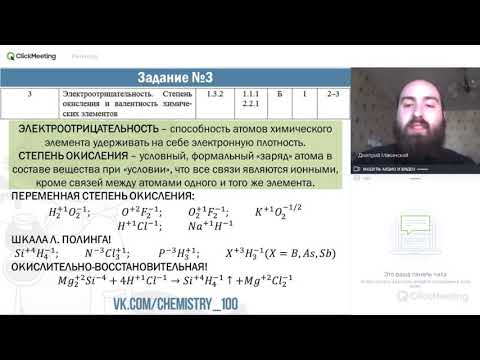 Низшую степень окисления, равную —4, будут иметь элементы-неметаллы 4 группы; в данном контексте — кремний и углерод.
Низшую степень окисления, равную —4, будут иметь элементы-неметаллы 4 группы; в данном контексте — кремний и углерод.
С заданием 3 успешно справились 80,2 % участников экзамена.
ЕГЭ-2020. Химия. Сборник заданий: 600 заданий с ответами
Пособие содержит тренировочные задания базового и повышенного уровней сложности, сгруппированные по темам и типам. Задания расположены в такой же последовательности, как предлагается в экзаменационном варианте ЕГЭ. В начале каждого типа задания указаны проверяемые элементы содержания – темы, которые следует изучить, прежде чем приступать к выполнению. Пособие будет полезно учителям химии, так как дает возможность эффективно организовать учебный процесс на уроке, проведение текущего контроля знаний, а также подготовку учащихся к ЕГЭ.
Купить
Тесты ЕГЭ по химии 2021
Тесты ЕГЭ по химии
Об экзамене
Химию нельзя сдать на высокий балл, просто выучив теорию. Химию надо любить. И любить всем сердцем, чтобы тот безграничный объем информации ровным слоем уложился в голове. А когда мы говорим о будущем, о профессиях, которые будут востребованы долгие годы, то практически все направления, которые связаны с химией, с рынка труда никуда не уйдут. Потребность в “химических мозгах” стабильно растет. Поэтому если вы чувствуете, что есть хоть какая-то предрасположенность к данной науке, не поленитесь и попробуйте себя. И если все получится, то вам откроется безграничное поле для новых открытий и свершений. Меняйте себя и мир вокруг!
Химию надо любить. И любить всем сердцем, чтобы тот безграничный объем информации ровным слоем уложился в голове. А когда мы говорим о будущем, о профессиях, которые будут востребованы долгие годы, то практически все направления, которые связаны с химией, с рынка труда никуда не уйдут. Потребность в “химических мозгах” стабильно растет. Поэтому если вы чувствуете, что есть хоть какая-то предрасположенность к данной науке, не поленитесь и попробуйте себя. И если все получится, то вам откроется безграничное поле для новых открытий и свершений. Меняйте себя и мир вокруг!
Структура
Часть 1 содержит 29 заданий с кратким ответом, часть 2 содержит 5 заданий высокого уровня сложности, с развернутым ответом (порядковые номера этих заданий: 30, 31, 32, 33, 34). На выполнение всех заданий отводится 3,5 часа.
Дополнительные материалы и оборудование
К каждому варианту экзаменационной работы прилагаются следующие материалы:
− Периодическая система химических элементов Д. И. Менделеева;
И. Менделеева;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов.
Во время выполнения экзаменационной работы разрешается использовать непрограммируемый калькулятор.
Пояснения к оцениванию заданий
За правильный ответ на каждое из заданий 1–8, 12–16, 20, 21, 27–29 ставится 1 балл. Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 9–11, 17–19, 22–26 считаются выполненными верно, если правильно указана последовательность цифр. За полный правильный ответ в заданиях 9–11, 17–19, 22–26 ставится 2 балла; если допущена одна ошибка, – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
Задания части 2 (с развёрнутым ответом) предусматривают проверку от трёх до пяти элементов ответа. Задания с развёрнутым ответом могут быть выполнены выпускниками различными способами. Наличие каждого требуемого элемента ответа оценивается 1 баллом, поэтому максимальная оценка верно выполненного задания составляет от 3 до 5 баллов в зависимости от степени сложности задания: задание 30 – 3 балла; 31 – 4 балла; 32 – 5 баллов; 33 – 4 балла; 34 – 4 балла. Проверка заданий части 2 осуществляется на основе сравнения ответа выпускника с поэлементным анализом приведённого образца ответа.
Наличие каждого требуемого элемента ответа оценивается 1 баллом, поэтому максимальная оценка верно выполненного задания составляет от 3 до 5 баллов в зависимости от степени сложности задания: задание 30 – 3 балла; 31 – 4 балла; 32 – 5 баллов; 33 – 4 балла; 34 – 4 балла. Проверка заданий части 2 осуществляется на основе сравнения ответа выпускника с поэлементным анализом приведённого образца ответа.
Любой учитель или репетитор может отслеживать результаты своих учеников по всей группе или классу. Для этого нажмите ниже на кнопку «Создать класс», а затем отправьте приглашение всем заинтересованным.
Ознакомьтесь с подробной видеоинструкцией по использованию модуля.
Алгоритм решения задачи 35 (С5). Подготовка к ЕГЭ по химии. Задача №35
В настоящее время на Едином госэкзамене по химии во второй (более сложной) части предлагается шесть заданий. Первые четыре не связаны с количественными расчетами, последние два — это достаточно стандартные задачи.
Этот урок целиком посвящен разбору задачи №35 (С5). Кстати, ее полное решение оценивается в три балла (из 60).
Начнем с несложного примера.
Пример 1. 10,5 г некоторого алкена способны присоединить 40 г брома. Определите неизвестный алкен.
Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем количество брома, вступившего в реакцию: M(Br2
Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n) = n(Br2) = 0,25 моль.
Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль).
Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение:
12n + 2n = 42.
Решением этого уравнения является n = 3. Формула алкена: C3H6.
Ответ: C3H6.
Приведенная задача — типичный пример задания №35. 90% реальных примеров на ЕГЭ строятся по аналогичной схеме: есть некоторое органическое соединение X, известен класс, к которому оно относится; определенная масса X способна прореагировать с известной массой реагента Y. Другой вариант: известна масса Y и масса продукта реакции Z. Конечная цель: идентифицировать Х.
Алгоритм решения подобных заданий также достаточно очевиден.
- 1) Определяем общую формулу гомологического ряда, к которому относится соединение Х.
- 2) Записываем реакцию исследуемого вещества Х с реагентом Y.
- 3) По массе Y (или конечного вещества Z) находим его количество.

- 4) По количеству Y или Z делаем вывод о количестве Х.
- 5) Зная массу Х и его кол-во, рассчитываем молярную массу исследуемого вещества.
- 6) По молярной массе X и общей формуле гомологического ряда можно определить молекулярную формулу Х.
- 7) Осталось записать ответ.
Рассмотрим этот алгоритм подробнее, по пунктам.
1. Общая формула гомологического ряда
Наиболее часто используемые формулы сведены в таблицу:
| Гомологический ряд | Общая формула |
| Алканы | CnH2n+2 |
| Алкены | CnH2n |
| Алкины | CnH2n-2 |
| Диены | CnH2n-2 |
| Арены | CnH2n-6 |
| Предельные одноатомные спирты | CnH2n+1ОН |
| Предельные альдегиды | CnH2n+1СОН |
| Предельные монокарбоновые кислоты | CnH2n+1СОOН |
Кстати, нет необходимости механически запоминать формулы всевозможных гомологических рядов. Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
2. Уравнение реакции
Нет надежды, что мне удастся перечислить ВСЕ реакции, которые могут встретиться в задаче 35. Напомню лишь наиболее важные:
1) ВСЕ органические вещества горят в кислороде с образованием углекислого газа, воды, азота (если в соединении присутствует N) и HCl (если есть хлор):
CnHmOqNxCly + O2 = CO2 + H2O + N2 + HCl (без коэффициентов!)
2) Алкены, алкины, диены склонны к реакциям присоединения (р-ции с галогенами, водородом, галогенводородами, водой):
CnH2n + Cl2 = CnH2nCl2
CnH2n + H2 = CnH2n+2
CnH2n + HBr = CnH2n+1Br
CnH2n + H2O = CnH2n+1OH
Алкины и диены, в отличие от алкенов, присоединяют до 2 моль водорода, хлора или галогенводорода на 1 моль углеводорода:
CnH2n-2 + 2Cl2 = CnH2n-2Cl4
CnH2n-2 + 2H2 = CnH2n+2
При присоединении воды к алкинам образуются карбонильные соединения, а не спирты!
3) Для спиртов характерны реакции дегидратации (внутримолекулярной и межмолекулярной), окисления (до карбонильных соединений и, возможно, далее до карбоновых кислот). Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
CnH2n+1OH = CnH2n + H2O
2CnH2n+1OH = CnH2n+1OCnH2n+1 + H2O
2CnH2n+1OH + 2Na = 2CnH2n+1ONa + H2
4) Химические свойства альдегидов весьма разнообразны, однако здесь мы вспомним лишь об окислительно — восстановительных реакциях:
CnH2n+1COH + H2 = CnH2n+1CH2OH (восстановление карбонильных соединений в прис. Ni),
CnH2n+1COH + [O] = CnH2n+1COOH
Для последней реакции записана лишь схема, поскольку в качестве окислителей могут выступать разные соединения.
Обращаю внимание на весьма важный момент: окисление формальдегида (НСОН) не останавливается на стадии муравьиной кислоты, НСООН окисляется далее до СО2 и Н2О.
5) Карбоновые кислоты проявляют все свойства «обычных» неорганических кислот: взаимодействуют с основаниями и основными оксидами, реагируют с активными металлами и солями слабых кислот (напр., с карбонатами и гидрокарбонатами). Весьма важной является реакция этерификации — образование сложных эфиров при взаимодействии со спиртами.
CnH2n+1COOH + KOH = CnH2n+1COOK + H2O
2CnH2n+1COOH + CaO = (CnH2n+1COO)2Ca + H2O
2CnH2n+1COOH + Mg = (CnH2n+1COO)2Mg + H2
CnH2n+1COOH + NaHCO3 = CnH2n+1COONa + H2O + CO2
CnH2n+1COOH + C2H5OH = CnH2n+1COOC2H5 + H2O
Ну, кажется, пора остановиться — я же не собирался писать учебник по органической химии. В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
3. Нахождение количества вещества по его массе (объему)
Здесь все очень просто! Любому школьнику знакома формула, связывающая массу вещества (m), его количество (n) и молярную массу (M):
m = n*M или n = m/M.
Например, 710 г хлора (Cl2) соответствует 710/71 = 10 моль этого вещества, поскольку молярная масса хлора = 71 г/моль.
Для газообразных веществ удобнее работать с объемами, а не с массами. Напомню, что количество вещества и его объем связаны следующей формулой: V = Vm*n, где Vm — молярный объем газа (22,4 л/моль при нормальных условиях).
4. Расчеты по уравнениям реакций
Это, наверное, главный тип расчетов в химии. Если вы не чувствуете уверенности при решении подобных задач, необходимо тренироваться.
Основная идея заключается в следующем: количества реагирующих веществ и образующихся продуктов относятся так же, как соответствующие коэффициенты в уравнении реакции (вот почему так важно правильно их расставить!)
Рассмотрим, например, следующую реакцию: А + 3B = 2C + 5D. Уравнение показывает, что 1 моль А и 3 моль B при взаимодействии образуют 2 моль C и 5 моль D. Количество В в три раза превосходит количество вещества А, количество D — в 2,5 раза больше количества С и т. д. Если в реакцию вступит не 1 моль А, а, скажем, 10, то и количества всех остальных участников реакции увеличатся ровно в 10 раз: 30 моль В, 20 моль С, 50 моль D. Если нам известно, что образовалось 15 моль D (в три раза больше, чем указано в уравнении), то и количества всех остальных соединений будут в 3 раза больше.
5. Вычисление молярной массы исследуемого вещества
Масса Х обычно дается в условии задачи, количество Х мы нашли в п. 4. Осталось еще раз использовать формулу М = m/n.
6. Определение молекулярной формулы Х.
Финальный этап. Зная молярную массу Х и общую формулу соответствующего гомологического ряда, можно найти молекулярную формулу неизвестного вещества.
Пусть, например, относительная молекулярная масса предельного одноатомного спирта равна 46. Общая формула гомологического ряда: CnH2n+1ОН. Относительная молекулярная масса складывается из массы n атомов углерода, 2n+2 атомов водорода и одного атома кислорода. Получаем уравнение: 12n + 2n + 2 + 16 = 46. Решая уравнение, получаем, что n = 2. Молекулярная формула спирта: C2H5ОН.
Задача решена. Не забудьте записать ответ!
Конечно, не все задачи С 5 полностью соответствуют приведенной схеме. Никто не может дать гарантии, что на реальном ЕГЭ по химии вам попадется что-либо, дословно повторяющее приведенные примеры. Возможны незначительные вариации и даже сильные изменения. Все это, однако, не слишком важно! Не следует механически запоминать приведенный алгоритм, важно понять СМЫСЛ всех пунктов. Если будет понимание смысла, никакие изменения вам не страшны!
Если будет понимание смысла, никакие изменения вам не страшны!
В следующей части мы рассмотрим несколько типичных примеров.
Решение задачи С5 (35) на экзамене по химии. Часть II. →
Рособрнадзор ответил на претензии школьников к сложности ЕГЭ по химии :: Общество :: РБК
Организаторов ЕГЭ по химии обвинили в слишком сложных заданиях, которые требуют подготовки по вузовским учебникам
Фото: Владимир Смирнов / ТАСС
Анализировать и обсуждать претензии родителей и выпускников к заданиям ЕГЭ по химии можно будет после получения результатов экзамена. Так в Рособрнадзоре ответили на обращение по поводу слишком сложных заданий, которые были предложены выпускникам.
Так в Рособрнадзоре ответили на обращение по поводу слишком сложных заданий, которые были предложены выпускникам.
«Результаты ЕГЭ по химии стоит обсуждать после экзамена, когда мы увидим, как участники его реально сдали. После получения результатов ЕГЭ и статистических данных о выполнении участниками экзамена всех заданий КИМ будет проведен содержательный анализ выполнения экзаменационных работ участниками ЕГЭ 2020 года», — цитирует ответ пресс-службы ведомства «Интерфакс».
Чиновники заявили, что сложность заданий была адекватной и соответствовала школьной программе, а для поступления в вуз со средним конкурсом на бюджетные места выполнять задания высокого уровня сложности не обязательно.
Красноярская учительница химии сдала ЕГЭ вместе с выпускникамиЕГЭ по химии состоялся 16 июля, в Рособрнадзоре отчитались, что экзамен прошел штатно, в нем участвовали около 90 тыс. человек.
человек.
Сложный ЕГЭ по химии 2020
Единый государственный экзамен по химии 2020 года поверг школьников и репетиторов в шок. На формах, в пабликах, в чатах нарастают возмущения. Даже подготовили петицию. И не кому-нибудь, а самому Президенту.
Недавно пришли результаты экзамена – есть возможность проанализировать реальные работы.
Чем же все так недовольны? Как говорят у нас в медицине, разберем основные жалобы:
- Задания выходят за рамки школьной программы
- Новый тип задач – на атомистику
- ЕГЭ по химии рассчитан на профессиональных химиков
- Дети падали в обморок на экзамене, вызывали скорую
- Цитирую: “формулировки заданий были усложненными”, “не было шаблонов и заданий, к которым готовили детей”
Вы хочите пруфов? Их есть у меня! Вот выдержка из петиции:
Давайте рассмотрим жалобы, спокойно и без эмоций.
Задания выходят за рамки школьной программы
“Задание не помню, но оно было сложным и не по школьной программе”
Эта первая фраза, которую я услышал от учеников, вернувшихся с экзаменов. Но никто не смог привести конкретное задание.
Но никто не смог привести конкретное задание.
Если вам попалось задание не по школьной программе, и вы его помните – напишите в комментариях.
Вот несколько “сложных” заданий, которые я отыскал в гневных комментариях:
Список веществ для заданий 30 и 31:
Что трудного в РИО или ОВР с этими веществами? Азотная кислота выходит за пределы школьной программы или сероводород?
В 35 задании испугались бензоата метиламмония:
- Бензойную кислоту в школе проходят
- Метиламин проходят
- Взаимодействие аминов и кислот проходят
В чем проблема?
Новый тип задач – на атомистику
Во-первых, информация о заданиях на атомистику появилась задолго до экзамена.
Во-вторых, давайте разберемся, что значит “задача на атомистику”.
Это всего лишь еще один способ выразить процентное содержание веществ в смеси. Раньше была только массовая доля вещества, в прошлом году появилась растворимость, теперь атомистика.
Но эти новшества не меняют ход решения задачи. Закон сохранения массы тот же, слова “моль” и “молярная масса” не поменяли значения.
Закон сохранения массы тот же, слова “моль” и “молярная масса” не поменяли значения.
Просто плюс одна формула. И то не новая, а из восьмого класса.
Я впервые узнал, что существуют разные “типы задач”: на пластинку, на смеси и пр. на первом курсе, когда начал преподавать на курсах. Меня просветили ученики.
Раньше я всегда просто решал задачи, не задумываясь: “сейчас я решаю задачу на пластинку”.
Аналогия: дорога из дома в магазин, в школу и на дачу – это разные маршруты. Допустим, в магазин вы ходите пешком, в школу – на автобусе, а на дачу – на машине. Но вы не зубрите маршрут: “…потом я поворачиваю налево и прибавляю скорость…”
Все, что вам нужно – уметь ходить, уметь водить велосипед или машину и знать пункт назначения: “о Боже, это же новый тип маршрута – на парикмахерскую”.
ЕГЭ по химии рассчитан на профессиональных химиков
Посмотрите лекцию МГУ по органической химии для будущих профессиональных химиков. Читает профессор Лукашев Н.В.:
В. — Органическая химия. Часть 1 — Спирты» src=»https://www.youtube.com/embed/txC0hTHsGUU?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Уровень вуза на несколько голов выше заданий ЕГЭ 2020 года.
Профессиональные химики занимаются совсем другими задачами и изучают химию с других позиций.
Для профессионального химика важны:
- условия реакций
- в каком растворителе
- катализаторы
- механизм реакций
- выход продукта
- практическое применение реакции
- препаративное значение
- и множество других нюансов
Никаких особых знаний “профессиональных химиков” для решения заданий ЕГЭ не требуется.
Дети падали в обморок на экзамене, вызывали скорую
Это не говорит о сложности заданий. Это показатель низкой стрессоустойчивости.
Если сейчас дети падают в обморок от сложного задания на экзамене, то что с ними случится, когда произойдет что-то действительно страшное?
Психологически готовиться к экзамену тоже нужно. Для этого проводятся пробные ЕГЭ. После 9 класса можно порепетировать – сдать ОГЭ.
Для этого проводятся пробные ЕГЭ. После 9 класса можно порепетировать – сдать ОГЭ.
Никто не мешает ходить на олимпиады. Олимпиадные задания – прививка от страха сложных и нестандартных заданий.
Если человек морально не готов, то и стандартные задания ему покажутся сложными. Плохо ему станет не от заданий, а от обстановки и напряженной атмосферы.
Цитаты: “формулировки заданий были усложненными”, “не было шаблонов и заданий, к которым готовили детей” раскрывают причину проблемы
Причина недовольства и низких баллов – подготовка к шаблонным заданиям.
Вместо того, чтобы учить химию и понять ее законы, ребята учились решать шаблонные задания.
Вся их подготовка сводилась к нарешиванию вариантов без какой-либо системы и понимания.
Такой подход очень уязвим к изменению шаблона. Немного поменяли формулировку – и вы потерялись.
А выражение “усложненная формулировка” лишено смысла. Если вы разбираетесь в теме, то вам не важно в какой формулировке вас спросят:
- Как вас зовут?
- Назовите ваше имя
- Представьтесь, пожалуйста
- Что написано в вашем паспорте в графе “имя”?
Вы затрудняетесь ответить на эти вопросы? Нет, потому что, как говорят психиатры, ориентация в собственной личности у вас сохранена.
Смоделируем ситуацию. Сравните два задания:
| Бромоводородная кислота – это водный раствор _______________ а. фтороводорода б. хлороводорода в. бромоводорода г. иодоводорода | Нашатырный спирт – это водный раствор _______________ а. углекислого газа б. аммиака в. фосфина г. нашатыря |
Формулировка у них одинаковая. Первый вопрос – это то, по чему готовились ребята. Они сильно не вдавались в суть. А зачем? БРОМОВОДОРОДная кислота. Ответ в самом вопросе. Этого им было достаточно.
А на экзамене им попался второй вопрос. Они, следуя своему лайфхаку, выбирают “нашатырь”. Зачем учить химию, если есть способы отвечать на задания без понимания?
А верным ответом оказался аммиак (NH3). А нашатырь – это NH4Cl.
И что виноваты составители? Подсунули гады сложный вопрос, с хитринкой.
В этом году в ЕГЭ было очень много заданий с хитринкой. У тех, кто учил химию они вызвали затруднений. Попались те, кто учился механически выбирать ответ без понимания.
Попались те, кто учился механически выбирать ответ без понимания.
Изменился ли ЕГЭ по химии?
Да, изменился. Составители заданий учатся вместе с нами.
Все больше становится заданий на понимание и умение логически мыслить.
И все меньше заданий, на который можно ответить без понимания.
Хорошо это или плохо? Для тех, кто привык работать по шаблону и зубрить без понимания – плохо. Для тех, кто опирается на логическое мышление и умеет думать – хорошо.
Вузам и работодателям нужны вторые. Поэтому ЕГЭ оправдывает свое назначение.
А если вы не хотите логически мыслить, то зачем сдаете химию? В специальностях, на которые нужен ЕГЭ по химии, без логического мышления будет туговато.
Я надеюсь, что экзамен этого года начисто отобьет желание зубрить без понимания и говоря словами учеников “тупо нарешивать задания”. А смотивирует
Что вы думаете по этому поводу? Пишите в комментарии.
Задание С1 на ЕГЭ по химии. Особенности, советы, рекомендации.

Автор статьи — профессиональный репетитор О. В. Овчинникова.
Часть С на ЕГЭ по химии начинается с задания С1, которое предполагает составление окислительно-восстановительной реакции (содержащей уже часть реагентов и продуктов). Оно сформулировано таким образом:
С1. Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
Часто абитуриенты считают, что уж это задание не требует особой подготовки. Однако оно содержит подводные камни, которые мешают получить за него полный балл. Давайте разберёмся, на что обратить внимание.
Теоретические сведения.
Перманганат калия как окислитель.
Дихромат и хромат как окислители.
Повышение степеней окисления хрома и марганца.
Азотная кислота с металлами.
— не выделяется водород, образуются продукты восстановления азота.
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
| Сера + щёлочь 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) | и |
| Фосфор + щелочь фосфин и соль гипофосфит (реакция идёт при кипячении) | и |
| Хлор, бром, иод + вода (без нагревания) 2 кислоты, Хлор, бром, иод + щелочь (без нагревания) 2 соли, и и вода | и |
| Бром, иод + вода (при нагревании) 2 кислоты, Хлор, бром, иод + щелочь (при нагревании) 2 соли, и и вода | и |
Диспропорционирование оксида азота (IV) и солей.

Ты нашел то, что искал? Поделись с друзьями!
Активность металлов и неметаллов.
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.

а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).
Необходимые навыки.
- Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю. Задание 1: Расставьте степени окисления в веществах: - Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0. - Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
 Пример:
Пример: В этой реакции надо увидеть, что иодид калия может являться только восстановителем, поэтому нитрит калия будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из в ближайшую степень окисления . - Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия , когда он в роли окислителя переходит в :Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 4: Какой коэффициент в уравнении реакции будет стоять перед магнием? - Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции:
Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции: - Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться. Задание 6: В какой стороне реакции окажется вода? Bо что перейдёт цинк? Задание 7: Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:(хол. р-р.)
(водн.р-р) - Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше: Задание 8: Какие продукты ещё получатся? Допишите и уравняйте реакцию:
- Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из в , обычно окисление идёт только до .
И наоборот, если — сильный восстановитель и может восстановить серу из до , то — только до . Задание 9: Во что перейдёт сера? Допишите и уравняйте реакции:(конц.)
- Проверьте, чтобы в реакции был и окислитель, и восстановитель. Задание 10: Сколько ещё продуктов в этой реакции, и каких?
- Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем. Задание 11: Кто из этих галогенов окислитель, а кто восстановитель?
- Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12: Какую роль выполняет пероксид водорода в каждой реакции?
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
- Задание 13: Допишите и уравняйте:
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.

- Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях: Задание 14: Допишите и уравняйте: Задание 15: Допишите и уравняйте: - Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот. Пример: в реакции свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
- Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
Задание 16: Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Ответы и решения к заданиям с пояснениями.

Задание 1:
Задание 2:
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.Задание 4:
Так как в молекуле два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент .Задание 5:
Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:Задание 7:
Задание 8:
В процессе составления баланса мы видим, что на 2 иона приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:
(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
(конц.)
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.Хлор выделяется в виде простого вещества.
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления , образуя йодноватую кислоту.Задание 12:
(пероксид — окислитель, т.к. восстановитель — )
(пероксид — восстановитель, т.к. окислитель — перманганат калия)
(пероксид — окислитель, т. к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:
Задание 14:
Задание 15:
Задание 16:
Читаем дальше: Задача С2 на ЕГЭ по химии.
Задачи на сплавы и смеси на ЕГЭ по химии.
Задача С5 на ЕГЭ по химии. Определение формул органических веществ.
Курсы подготовки к ЕГЭ по химии онлайн и в классе / Maximum
Maximum Education Москва Контакты:Адрес: Подсосенский переулок, д. 23, стр. 2, этаж 3, пом. 1, метро Курская Москва,
Телефон:8 800 775 53 81, Факс:8 800 775 53 81, Электронная почта: Maximum Education Санкт-Петербург Контакты:Адрес: улица Рубинштейна 13, Бизнес Центр «Агат», 4-й этаж Санкт-Петербург,
Телефон:8 (812) 385-52-55 , Факс:8 (812) 385-52-55 , Электронная почта: Maximum Education Бердск Контакты: Адрес:
ул. Первомайская д.19 оф.2 Бердск,
Первомайская д.19 оф.2 Бердск,
Адрес: пр. Красного знамени, д.34 Владивосток ,
Телефон:8 (423) 290-90-99, Факс:8 (423) 290-90-99, Электронная почта: Maximum Education Владикавказ Контакты:Адрес: пр.Коста, 15, оф.1-8 Владикавказ,
Телефон:8 (926) 265-17-16, Факс:8 (926) 265-17-16, Электронная почта: Maximum Education Владимир Контакты:Адрес: Октябрьский пр-кт, д. 7 (ДЦ «Типография», вход номер 4, 4 этаж, башня), офис 417. Владимир,
Телефон:8 (4922) 600-007, Факс:8 (4922) 600-007, Электронная почта: Maximum Education Волгоград Контакты:Адрес: ул. Ткачева, 7 Волгоград,
Телефон:8 (8442) 60-10-97, Факс:8 (8442) 60-10-97, Электронная почта: Maximum Education Воронеж Контакты: Адрес:
ул. Карла Маркса 70А Воронеж,
Карла Маркса 70А Воронеж,
Адрес: ул. Г. Н. Трошева, д. 7 Грозный,
Телефон:8 (928) 948-20-00, Факс:8 (928) 948-20-00, Электронная почта: Maximum Education Екатеринбург Контакты:Адрес: Ул. Чернышевского, д. 16, эт. 2, метро Площадь 1905 года Екатеринбург,
Телефон:8 (343) 288-58-19, Факс:8 (343) 288-58-19, Электронная почта: Maximum Education Иркутск Контакты:Адрес: Степана Разина 27, оф. 205 Иркутск,
Телефон:8 (3952) 500-131, Факс:8 (3952) 500-131, Электронная почта: Maximum Education Калуга Контакты:Адрес: Бизнес-Центр «Московский», ул.Суворова, 121 Калуга,
Телефон:+7 (484) 220-71-76, Факс:+7 (484) 220-71-76, Электронная почта: kaluga@maximumtest. ruMaximum Education Краснодар
Контакты:
ruMaximum Education Краснодар
Контакты:Адрес: ул. Кожевенная, д. 56 Краснодар,
Телефон:8 (861) 205-34-45, Факс:8 (861) 205-34-45, Электронная почта: Maximum Education Красноярск Контакты:Адрес: ул. Парижской Коммуны, д. 33, оф. 302 Красноярск,
Телефон:8 (391) 269-90-33, Факс:8 (391) 269-90-33, Электронная почта: Maximum Education Махачкала Контакты:Адрес: ул. Леваневского 3, 3й этаж. Махачкала,
Телефон:+7 (928) 599-63-33, Факс:+7 (928) 599-63-33, Электронная почта: Maximum Education Мурманск Контакты:Адрес: ул. Полярные Зори, дом 1, этаж 4 Мурманск,
Телефон:78-77-14, Факс:78-77-14, Электронная почта: Maximum Education Мытищи Контакты: Адрес:
Олимпийский пр-кт, вл. 13, стр.1. БЦ «Фрегат». Мытищи,
13, стр.1. БЦ «Фрегат». Мытищи,
Адрес: ул. Московская, 33 Назрань,
Телефон:+7 (928) 918-05-65, Факс:+7 (928) 918-05-65, Электронная почта: Maximum Education Нижний Новгород Контакты:Адрес: м.Горьковская, ул. Костина, д. 3, эт. 4 Нижний Новгород,
Телефон:8 (831) 260-12-47, Факс:8 (831) 260-12-47, Электронная почта: Maximum Education Новосибирск Контакты:Адрес: м. Площадь Ленина. Ул. Максима Горького 75 Новосибирск,
Телефон:8 (383) 383-26-21, Факс:8 (383) 383-26-21, Электронная почта: Maximum Education Одинцово Контакты:Адрес: Можайское шоссе, д. 71 Одинцово,
Телефон:8 (499) 322-44-36, Факс:8 (499) 322-44-36, Электронная почта: Maximum Education Оренбург Контакты: Адрес:
ул. 8 Марта 49 (ТЦ Панорама), офис 204 Оренбург,
8 Марта 49 (ТЦ Панорама), офис 204 Оренбург,
Адрес: ул. Советская, 72, 4ый этаж Пермь,
Телефон:8 (342) 207-10-15, Факс:8 (342) 207-10-15, Электронная почта: Maximum Education Подольск Контакты:Адрес: Г. Подольск, ул. К.Готвальда, 6В, 2эт, 19 павильон Подольск,
Телефон:8(916) 055-96-65, Факс:8(916) 055-96-65, Электронная почта: Maximum Education Ростов-на-Дону Контакты:Адрес: ул. Пушкинская, д. 144 Ростов-на-Дону,
Телефон:8 (863) 320-02-15, Факс:8 (863) 320-02-15, Электронная почта: Maximum Education Салехард Контакты:Адрес: undefined Салехард,
Телефон:8 (482) 273-44-18, Факс:8 (482) 273-44-18, Электронная почта: Maximum Education Сочи Контакты: Адрес:
ул. Советская, д. 42, 2 этаж, офис 205 Сочи,
Советская, д. 42, 2 этаж, офис 205 Сочи,
Адрес: ул. Маяковского, дом 9/1 Сургут,
Телефон:8 (3462) 550-812, Факс:8 (3462) 550-812, Электронная почта: Maximum Education Тверь Контакты:Адрес: ул. Советская 36 Тверь,
Телефон:8 (482) 273-44-18, Факс:8 (482) 273-44-18, Электронная почта: Maximum Education Тольятти Контакты:Адрес: ул. Фрунзе, 8, офис 1010 (10 этаж) Тольятти,
Телефон:8 (927) 768-95-89, Факс:8 (927) 768-95-89, Электронная почта: Maximum Education Томск Контакты:Адрес: ул. Проспект Фрунзе, 103, оф. 605 Томск,
Телефон:8 (3822) 908 910, Факс:8 (3822) 908 910, Электронная почта: Maximum Education Тула Контакты: Адрес:
ул. Софьи Перовской 4, 2 этаж оф. 22,23 Тула,
Софьи Перовской 4, 2 этаж оф. 22,23 Тула,
Адрес: ул. Гончарова, 5 Ульяновск,
Телефон:8 (8422) 50-57-50, Факс:8 (8422) 50-57-50, Электронная почта: Maximum Education Ярославль Контакты:Адрес: Октябрьский переулок, дом 3 Ярославль,
Телефон:8 (4852) 208-996, Факс:8 (4852) 208-996, Электронная почта:Программа охватывает все темы ЕГЭ от простых к сложным, включая их повторение в течение года, поэтому каждый ученик получит свой максимально возможный балл.
Смотри вебинары, тренируйся, читай теорию, отслеживай прогресс — в онлайн модуле! Тебе не придется искать информацию в интернете или копить распечатки.
Держи связь с преподавателем в социальных сетях, а не только на уроках. Обсуждай прогресс и задавай вопросы на личных беседах — преподаватель всегда ответит и поможет.
80+баллов по химии ученики MAXIMUM получают в 1,5 раза чаще, чем в среднем по России
Запишитесь на консультацию
Это бесплатно и ни к чему вас не обязывает. Мы вам сразу перезвоним, и вы сможете уточнить все детали у нашего консультанта
Что вы получите на курсе
подготовки к ЕГЭ?
Только темы, необходимые для ЕГЭ, в простом и понятном формате — ничего лишнего!
На уроках мы будем работать только с актуальными заданиями в формате ЕГЭ
Мы научим тебя отвечать на любой вопрос так, чтобы получить за него максимум баллов
Поделимся с тобой секретными алгоритмами и методами решения заданий ЕГЭ
Мы проведем для тебя симуляции ЕГЭ и специальные мастер-классы, чтобы ты чувствовал себя уверенно
Гарантируем поступление нашим ученикам
Что вы могли не знать о
ЕГЭ по химии- ЕГЭ по химии включает в себя 4 блока: теоретически основы в химии, неорганическая химия, органическая химия и методы познания в химии.

- Для решения ЕГЭ необходимо уметь писать уравнения химических реакций.
- Самое ценное задание (№ 33) требует продемонстрировать знание реакций и механизмы их протекания (за верное решение можно получить 5 первичных баллов).
Учитесь с нами в удобном формате
Нужна помощь в выборе курса?
Оставьте номер телефона, и мы перезвоним в течение 24 часов,
чтобы ответить на все вопросы
Результаты наших учеников в 2019 году
Посмотри, что происходило в чатах групп в день публикации результатов ЕГЭ
Образовательная
лицензия В MAXIMUM занятия с преподавателем проходят в любом удобном для
ученика формате:
В классе или онлайн, мини-группе или один на
один. На курсе ученик узнает теорию и формат экзамена, осваивает
лайфхаки и оптимальные методы
На курсе ученик узнает теорию и формат экзамена, осваивает
лайфхаки и оптимальные методы
Курсы
MAXIMUM по другим предметамЗанимайтесь онлайн или в классе
Оставьте заявку на консультацию
Протокол оценки трехмерного обучения
Abstract
Многие призывы улучшить естественнонаучное образование в колледжах и университетах были сосредоточены на улучшении педагогической работы преподавателей. Между тем, естественнонаучное образование на уровне K-12 претерпевает значительные изменения в результате упора на научные и инженерные практики, сквозные концепции и основные дисциплинарные идеи. Эта структура «трехмерного обучения» основана на литературе о том, как люди изучают науку и как мы можем помочь студентам применить свои знания на практике.В последнее время аналогичные изменения происходят в высшем образовании за счет включения трехмерного обучения в курсы естествознания в колледжах. По мере продвижения этих преобразований станет важным оценивать трехмерное обучение как для согласования оценок с учебной средой, так и для оценки степени преобразований. В этой статье мы представляем протокол трехмерной оценки обучения (3D-LAP), который предназначен для описания и поддержки разработки оценочных задач в биологии, химии и физике, которые согласуются с усилиями по преобразованию.Мы описываем процесс разработки, используемый нашей междисциплинарной командой, обсуждаем валидность и надежность протокола и предоставляем доказательства того, что протокол может различать оценки, которые могут выявить доказательства трехмерного обучения, и те, которые этого не делают.
По мере продвижения этих преобразований станет важным оценивать трехмерное обучение как для согласования оценок с учебной средой, так и для оценки степени преобразований. В этой статье мы представляем протокол трехмерной оценки обучения (3D-LAP), который предназначен для описания и поддержки разработки оценочных задач в биологии, химии и физике, которые согласуются с усилиями по преобразованию.Мы описываем процесс разработки, используемый нашей междисциплинарной командой, обсуждаем валидность и надежность протокола и предоставляем доказательства того, что протокол может различать оценки, которые могут выявить доказательства трехмерного обучения, и те, которые этого не делают.
Образец цитирования: Лаверти Дж. Т., Андервуд С. М., Матц Р. Л., Поузи Л. А., Кармель Дж. Х., Кабальеро М. Д. и др. (2016) Характеристика оценок естествознания в колледже: протокол трехмерной оценки обучения.PLoS ONE 11 (9):
e0162333.
https://doi.org/10.1371/journal. pone.0162333
pone.0162333
Редактор: Эндрю Р. Далби, Вестминстерский университет, СОЕДИНЕННОЕ КОРОЛЕВСТВО
Поступило: 22 апреля 2016 г .; Принята к печати: 22 августа 2016 г .; Опубликован: 8 сентября 2016 г.
Авторские права: © 2016 Лаверти и др. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и его файлах с вспомогательной информацией.
Финансирование: Благотворительный фонд Леоны М. и Гарри Б. Хелмсли (http://helmsleytrust.org/) наградил Ассоциацию американских университетов (http://www.aau.edu/) грантом № 2012PG- EDU005. Университет штата Мичиган получил суб-грант этого гранта (MMC). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
От «Нации в опасности» до «Надвигающейся бури» и «Приобщения к Excel» существует явная необходимость в улучшении образования в области STEM как для подготовки будущих специалистов в области STEM, так и для развития научно грамотных граждан. [1–4]. В ответ на эти отчеты было разработано и реализовано несколько инициатив на национальном уровне в области школьного образования и высшего образования.Например, для естественнонаучного образования в школах K-12 были разработаны три набора стандартов естественнонаучного образования, последним из которых являются научные стандарты нового поколения (NGSS) [5–8]. Несмотря на отсутствие последовательного подхода к разработке и реализации реформы учебных программ в высшем образовании, есть ряд важных отчетов. В недавнем отчете «Исследования в области образования на основе дисциплины» обобщено текущее состояние науки и инженерного образования в высшем образовании, описаны существующие исследования в области образования в области науки и техники и указаны области исследований, которые следует расширить [9].В следующем отчете «Охват студентов» обсуждаются основанные на исследованиях стратегии классной педагогики для практиков [10]. Другие инициативы на национальном уровне включают отчет «Видение и изменения» для бакалавров по биологическим наукам и обновление курсов повышения квалификации (AP) по биологии, химии и физике [11–15].
В недавнем отчете «Исследования в области образования на основе дисциплины» обобщено текущее состояние науки и инженерного образования в высшем образовании, описаны существующие исследования в области образования в области науки и техники и указаны области исследований, которые следует расширить [9].В следующем отчете «Охват студентов» обсуждаются основанные на исследованиях стратегии классной педагогики для практиков [10]. Другие инициативы на национальном уровне включают отчет «Видение и изменения» для бакалавров по биологическим наукам и обновление курсов повышения квалификации (AP) по биологии, химии и физике [11–15].
На сегодняшний день большая часть исследований по трансформации курсов STEM в высшем образовании сосредоточена на включении основанной на исследованиях педагогики в классы, лаборатории и дискуссионные секции колледжей.Теперь ясно, что «активное обучение» может улучшить общие оценки и удержание на курсах STEM, особенно для недостаточно подготовленных и недостаточно представленных студентов [16], но менее ясно то, что студенты изучают на этих курсах. Существует достаточно свидетельств того, что студенты (даже аспиранты) выходят из курсов STEM (даже тех, которые используют методы «активного обучения») с глубоким непониманием важных идей во многих дисциплинах, и мало свидетельств того, что студенты могут передавать свои знания новым ситуации [9].Наша работа учитывает не только то, что студенты должны знать, но также то, как они это знают и как они могут использовать эти знания. Мы рассматриваем способы изменения учебной программы и оценки успеваемости учащихся в дополнение к включению педагогических стратегий, основанных на исследованиях.
Существует достаточно свидетельств того, что студенты (даже аспиранты) выходят из курсов STEM (даже тех, которые используют методы «активного обучения») с глубоким непониманием важных идей во многих дисциплинах, и мало свидетельств того, что студенты могут передавать свои знания новым ситуации [9].Наша работа учитывает не только то, что студенты должны знать, но также то, как они это знают и как они могут использовать эти знания. Мы рассматриваем способы изменения учебной программы и оценки успеваемости учащихся в дополнение к включению педагогических стратегий, основанных на исследованиях.
Мы (и другие) ранее утверждали, что один из путей вперед — это использовать наилучший из имеющихся обобщающих данных об обучении студентов и вытекающее из этого видение будущего научного образования [17,18].Защитники предлагают использовать отчет Национального исследовательского совета (NRC) «Основы научного образования для школьников до 12 лет: практики, сквозные концепции и ключевые идеи» (далее именуемый «Структура»), чтобы помочь нам реструктурировать наши научные учебные планы, инструкции и т. Д. и способы оценки обучения студентов в системе высшего образования [19]. Структура поддерживает идею построения учебных программ на основе прогрессии основных дисциплинарных идей, использования научных практик и акцентирования внимания на сквозных концепциях (в данном документе это называется трехмерным обучением и более подробно определяется ниже).В Университете штата Мичиган (МГУ) мы предпринимаем такие усилия по преобразованию. Здесь мы сообщаем о разработке протокола для определения степени, в которой оценки, полученные на основных курсах по биологии, химии и физике, предоставляют студентам возможности для взаимодействия с тремя измерениями, определенными в Структуре. Этот протокол можно использовать для оценки задач оценивания, описания всех оценок и руководства преподавателями при разработке задач трехмерной оценки.
Д. и способы оценки обучения студентов в системе высшего образования [19]. Структура поддерживает идею построения учебных программ на основе прогрессии основных дисциплинарных идей, использования научных практик и акцентирования внимания на сквозных концепциях (в данном документе это называется трехмерным обучением и более подробно определяется ниже).В Университете штата Мичиган (МГУ) мы предпринимаем такие усилия по преобразованию. Здесь мы сообщаем о разработке протокола для определения степени, в которой оценки, полученные на основных курсах по биологии, химии и физике, предоставляют студентам возможности для взаимодействия с тремя измерениями, определенными в Структуре. Этот протокол можно использовать для оценки задач оценивания, описания всех оценок и руководства преподавателями при разработке задач трехмерной оценки.
Трехмерное обучение
Структура объединила большую часть литературы о том, как учащиеся изучают науку, в видение того, как должно осуществляться естественное и инженерное образование. В Концепции обозначены три аспекта:
В Концепции обозначены три аспекта:
- Что студенты должны уметь делать со своими знаниями . Структура описывает восемь «научных и инженерных практик» , которые можно рассматривать как разукрупненные компоненты исследования. К ним относятся такие идеи, как Разработка и использование моделей , Построение объяснений, , Планирование и проведение расследований, и Использование аргументов на основе доказательств .Именно эти практики могут вовлечь студентов в процессы науки и техники, используя их знания для моделирования систем, объяснения явлений и разработки решений проблем.
- Идеи, общие для научных дисциплин . Структура определила семь «сквозных концепций» , которые охватывают научные дисциплины. Эти концепции включают такие идеи, как Причинно-следственные связи , Системы и модели систем и Структура и функции .Эти концепции можно рассматривать как «способы размышления» о явлениях, которые могут позволить учащимся устанавливать связи между дисциплинами.

- Основные понятия для изучения дисциплины . Третье измерение в Структуре предполагает, что учащиеся должны развивать свои знания вокруг «основных дисциплинарных идей» , а не пытаться собрать свое понимание важных идей из большого количества разрозненных фактов и фрагментов знаний.Мы знаем, что дисциплинарные эксперты обладают обширными знаниями, которые организованы и контекстуализированы вокруг нескольких важных концепций [20]. Сосредоточив обучение на основных идеях дисциплины, учащимся предоставляется больше поддержки для установления связей между концепциями и построения более надежной базы знаний. Имеющиеся данные свидетельствуют о том, что основные дисциплинарные идеи должны развиваться с течением времени с тщательно выверенными последовательностями учебной деятельности и формирующими оценками [20].
Авторы Концепции подчеркнули, что эти три аспекта не следует преподавать по отдельности, а вместо этого следует интегрировать во все аспекты обучения, включая инструкции, учебную программу и оценивание.
Несмотря на то, что Структура была написана для аудитории K-12, результаты почти наверняка применимы к классам колледжей, поскольку мало оснований полагать, что учащиеся, заканчивающие среднюю школу, учатся иначе, чем учащиеся начальной школы (которые во многих случаях закончили среднюю школу несколькими месяцами ранее).Недавние изменения в курсах AP переместились в сторону идеи объединения научных практик и основных идей [13–15]. Кроме того, как Отчет DBER, так и «Видение и изменение» подчеркивают, что научные практики достигают того же уровня, что и содержание [9,11]. Основная причина ограничения Основы для K-12 заключалась в том, что ответственность комитета была ограничена системой образования K-12. Подход, изложенный в Структуре, резко контрастирует с тематической учебной программой, согласованной с главами в учебниках, которые в настоящее время используются в учебных классах многих колледжей.
Опираясь на структуру, мы утверждали, что идея трехмерного обучения может устранить ряд недостатков, существующих в высшем образовании [17]. Это позволяет отделам решать проблему «шириной в милю, глубиной в дюйм», сначала определяя центрально важные идеи, а затем фокусируя учебный план на этих целях [21]. Использование Структуры в качестве руководства для разработки или пересмотра учебной программы может изменить разговор с вопросов о том, что можно исключить из учебной программы, на то, чему мы должны учить учащихся для достижения целей, которые мы для них поставили, — фундаментальная идея. в обратном дизайне [22].
Это позволяет отделам решать проблему «шириной в милю, глубиной в дюйм», сначала определяя центрально важные идеи, а затем фокусируя учебный план на этих целях [21]. Использование Структуры в качестве руководства для разработки или пересмотра учебной программы может изменить разговор с вопросов о том, что можно исключить из учебной программы, на то, чему мы должны учить учащихся для достижения целей, которые мы для них поставили, — фундаментальная идея. в обратном дизайне [22].
Определяя и сосредотачиваясь на центрально важных концепциях внутри (основные идеи) и во всех (сквозные концепции) дисциплинах, мы можем помочь студентам сформировать устойчивое понимание науки. Эта организация понимания основных идей отражает то, как эксперты думают о своих дисциплинах [20]. Кроме того, вовлекая студентов в эти концепции так же, как это делают ученые (научная практика), студенты учатся применять свои знания в новых ситуациях, что является ключевой целью высшего образования [9].Такой подход дает студентам возможность развить понимание природы доказательств, моделей и объяснений в науке, способностей, которые могут хорошо послужить им в мире, где научная компетентность становится все более необходимой [23,24]. Взаимодействие со всеми тремя измерениями также позволяет студентам получить представление не только о концепциях, которые ученые считают важными, но и о том, почему ученые решили, что эти концепции важны в первую очередь, что имеет значение для воздействия на эпистемологию студентов по отношению к науке [25].
Взаимодействие со всеми тремя измерениями также позволяет студентам получить представление не только о концепциях, которые ученые считают важными, но и о том, почему ученые решили, что эти концепции важны в первую очередь, что имеет значение для воздействия на эпистемологию студентов по отношению к науке [25].
Представленное здесь исследование фокусируется на том, как оценки курса биологии, химии и физики могут быть использованы для получения свидетельств участия студентов в трех измерениях Структуры, что требует определения характеристик оценочных заданий, соответствующих определенным критериям.
Концентрация на оценке
Структура была разработана, чтобы дать представление о том, как естествознание и инженерное образование могут основываться на накопленных исследованиях и данных, полученных в результате обучения наукам.Он также послужил основой для NGSS, представленного как набор ожидаемых характеристик, которые со временем усложняются. Каждая ожидаемая успеваемость представляет собой трехмерное описание того, что учащиеся должны уметь делать со своими знаниями [8]. Усилия по трансформации в МГУ следуют этому подходу, работая над объединением научных практик, сквозных концепций и основных идей в основные научные курсы. Чтобы включить в наши курсы больше возможностей для трехмерного обучения, мы должны донести до наших студентов важность этих идей, а это значит, что мы должны изменить способы оценки успеваемости учащихся [26,27].Оценки должны соответствовать нашим ожиданиям от учащихся, а это означает, что необходимо разработать системы оценивания, ориентированные на три измерения.
Усилия по трансформации в МГУ следуют этому подходу, работая над объединением научных практик, сквозных концепций и основных идей в основные научные курсы. Чтобы включить в наши курсы больше возможностей для трехмерного обучения, мы должны донести до наших студентов важность этих идей, а это значит, что мы должны изменить способы оценки успеваемости учащихся [26,27].Оценки должны соответствовать нашим ожиданиям от учащихся, а это означает, что необходимо разработать системы оценивания, ориентированные на три измерения.
На вводном уровне в высшем образовании оценивание, как правило, сосредоточено на восприятии фактов, процедурных знаниях и алгоритмическом решении проблем [28]. Хотя существует несколько подходов к изменению используемых типов оценивания, ни один из них не касается трехмерного обучения. Например, начиная с конца 1980-х годов с разработки диагностических тестов, за которыми последовали более известные реестры концепций (например,грамм. Опись концепций силы () по физике, Реестр концепций химии () по химии и Оценка генетических концепций () по биологии), попытки разработать отдельные тесты реакции на основе исследования мышления учащихся привели к вопросам с множественным выбором концепций, а также отвлекающие факторы, которые включают в себя типичные неправильные идеи или заблуждения учащихся [29–32]. Эти тесты и инвентаризация полезны для исследования, когда учащиеся узнают больше научно нормативных идей или концепций [16,33].Однако эти типы оценок никогда не предназначались для определения того, могут ли студенты использовать эти идеи так же, как это делают ученые, и не для оценки того, могут ли студенты использовать свои знания. Короче говоря, хотя эксперты, безусловно, могут преуспеть в этих тестах, хорошие результаты в таком тесте не являются доказательством того, что учащиеся могут использовать эти идеи для предсказания или объяснения явлений (то есть для научных исследований). Следовательно, хотя диагностические тесты и описи концепций важны и доказали свою полезность в прошлом, их пригодность для оценки трехмерного обучения, вероятно, ограничена и должна быть оценена (см. Обсуждение).
Другой подход к разработке оценок, чтобы предоставить информацию о понимании учащимися, — это использование таксономии Блума [34,35]. Этот подход включает разработку вопросов для согласования с набором иерархических уровней с использованием глаголов действия, таких как «выбрать» для нижних уровней и «построить» для верхних уровней. Действительно, таксономия Блума широко используется, особенно в исследованиях в области биологии высшего образования и повышения квалификации преподавателей, а также в химии и физике [36–41].Однако значение дескрипторов Блума может быть неясным (особенно с точки зрения студентов, завершающих оценивание), тонкие различия между уровнями трудно оправдать, а преподаватели ценят больше, чем просто уровень вопроса [42,43]. Кроме того, недавние отчеты об исследованиях преподавания и обучения естествознания не включают таксономию Блума как полезную конструкцию для разработки целей обучения или оценки обучения студентов [9,11,19,44,45]. И все же таксономия Блума полезна, чтобы прояснить различие между изучением фактов и более глубоким концептуальным пониманием.Тем не менее, научная практика, изложенная в Концепции, основана на наблюдении и анализе реальной научной практики, что позволяет предположить, что их можно использовать для более систематической характеристики того, что мы хотим, чтобы учащиеся знали и могли делать с этими знаниями.
Совсем недавно в отчете NRC «Знание того, что знают студенты» была предложена идея оценивания в качестве доказательного аргумента [46]. Оценка должна выявить свидетельства об оцениваемой конструкции, и на основе этих свидетельств можно построить аргумент об обучении учащегося.Одним из подходов к оценке как доказательному аргументу является доказательно-ориентированный дизайн [47]. При таком подходе каждый определяет конструкт, который необходимо оценить, решает, что является убедительным свидетельством того, что учащиеся понимают эту конструкцию, и разрабатывает оценочные задания, которые могут выявить это свидетельство. Затем ответы учащихся можно анализировать с помощью ряда методов, таких как использование критериев или применение теории ответов по заданным вопросам. Результатом является итеративный процесс, который направляет разработку задач оценки, направленных на достижение представляющих интерес результатов
В нашей работе оценка рассматривается как аргумент, основанный на фактах; представляющие интерес конструкции — это три измерения Основы, и наша цель — научиться распознавать оценочные задачи, которые могут выявить доказательства трехмерного обучения.Как мы обсудим позже, наша цель состоит в том, чтобы оценить потенциальных оценочных задач для получения таких свидетельств; что мы не можем сделать, так это оценить качество доказательств, которые могут быть получены из этой задачи, потому что мы не можем знать, что студенты будут делать, столкнувшись с такими задачами. Оценка доказательств предоставляется разработчикам оценочных задач.
Несмотря на то, что отчет NRC «Разработка оценок для научных стандартов следующего поколения» [8,45] суммирует существующую литературу и предоставляет руководство для разработчиков оценок (включая рекомендации по разработке, ориентированной на доказательства), в настоящее время доступно несколько примеров задач трехмерной оценки.Примечательно, что авторы этого отчета заявляют, что выборочные ответные задания не должны быть единственным методом сбора информации об обучении учащихся, поскольку существует множество свидетельств того, что выбранные тесты с ответами переоценивают способность учащихся использовать свои знания [48]. В отчете NRC далее делается вывод:
«ВЫВОД 2–1 […] задания по оценке, как правило, должны содержать несколько компонентов (например, набор взаимосвязанных вопросов). Может быть полезно сосредоточиться на отдельных практиках, основных идеях или сквозных концепциях в различных компонентах оценочной задачи, но вместе компоненты должны поддерживать выводы о трехмерном научном обучении учащихся… »[45]
В конечном итоге авторы отчета рекомендуют использовать комбинацию сконструированных ответных задач, выбранных ответных задач и проектов для оценки трехмерного обучения.Большая часть этих советов адресована разработчикам оценивания или предлагается в качестве руководства для разработки формирующих оцениваний в небольших классах. Однако на научных курсах на уровне колледжа преподаватели, как правило, дисциплинарные эксперты, не имеющие формального опыта в разработке оценок, пишут большинство оценок. В частности, в крупных курсах для зачисления, выбранные задачи по оценке ответов чаще всего используются для оценки фрагментированных знаний и базовых навыков (например, размерный анализ). Чтобы усилия по трансформации были успешными, оценки, используемые на курсах, должны отражать цели трансформации.Важно охарактеризовать, каким образом существующие и будущие оценочные задания могут выявить доказательства того, что учащийся занимается научной практикой, сквозной концепцией или основной идеей (для простоты фраза «потенциально может выявить доказательства того, что учащийся занимался Здесь будет сокращено до «выявить»). Нам также нужно будет предоставить преподавателям рекомендации о способах разработки трехмерных оценок. Чтобы удовлетворить эти потребности, мы разработали протокол трехмерной оценки обучения (3D-LAP), который описывает критерии для каждой научной практики, сквозную концепцию и основную идею, которые определяют, что требуется для задачи оценки, чтобы выявить эту конкретную конструкцию.Возможные варианты использования 3D-LAP включают: 1) идентификацию индивидуальных оценочных заданий как трехмерных, 2) характеристику оценок курса и 3) повышение квалификации преподавателей.
Нашей целью было разработать протокол, позволяющий пользователям определять оценки, которые могут выявить доказательства трехмерного обучения. В этой статье мы описываем, как мы разработали протокол, и предоставляем доказательства того, что протокол может различать оценки, которые могут выявить идеи в Концепции, и те, которые этого не делают.
Методы
Протокол оценки трехмерного обучения (3D-LAP)
Процесс разработки начался с обзора Структуры, NGSS и вспомогательной литературы [8,19,49–52]. На начальном этапе этой работы группа разработчиков (состоящая из дисциплинарных экспертов, многие из которых считают себя исследователями дисциплинарного образования в области биологии, химии и физики) сосредоточила свои обсуждения на научных методах и сквозных концепциях, изложенных в Каркас (таблица 1).Специфические инженерные практики, определенные в Концепции, были исключены из рассмотрения из-за нашего интереса к разработке протокола, который был бы применим к оцениванию на научных курсах (и потому что мы не хотели выходить за рамки нашего опыта, который не включает инженерное дело). Представление экспертов из области биологии, химии и физики в команде разработчиков было важным для понимания того, что значит для задачи оценки выявить конкретную научную практику, применимую в разных дисциплинах.Кроме того, сама природа пересекающихся концепций требует ввода данных из этих трех дисциплин для достижения консенсуса по их ключевым характеристикам, которые можно использовать для определения их присутствия в оценках.
Параллельно члены команды разработчиков и коллеги из соответствующих дисциплин начали определять и обсуждать основные идеи каждой дисциплины. Включение преподавателей помимо команды разработчиков в эту часть процесса дало возможность рассмотреть более разнообразные точки зрения при выявлении и разработке основных идей, отражающих взгляды преподавателей дисциплины в нашем учреждении.Более того, разработка 3D-LAP была частью более крупной инициативы по преобразованию вводных научных курсов по каждой дисциплине [53]. Преподаватели каждой дисциплины определили набор основных идей и критериев для оценки этих идей. Мы ожидаем, что пользователи 3D-LAP могут выбрать свой собственный набор основных идей и критериев, но предоставить наши списки в качестве примеров того, как идеи могут быть реализованы.
Первоначально мы использовали описания научных практик и сквозных концепций, содержащихся в Концепции, для разработки критериев для определения того, является ли задача оценки следствием конкретной научной практики или сквозной концепции.Эти критерии применялись к ряду оценочных задач, в том числе к вопросам из учебников, задачам из измененных учебных программ, а также к задачам, которые мы определили в качестве примеров конкретных научных практик, сквозных концепций или основных идей. Используя эти оценочные задания, мы смогли описать ряд задач, которые преподаватели используют для экзаменов, и уточнить критерии. Расхождения между согласованным пониманием научных практик, пересекающихся концепций и основных идей и оценкой оценочных задач с использованием критериев способствовали пересмотру критериев.Этот процесс повторялся до тех пор, пока команда разработчиков не убедилась в том, что критерии соответствуют нашим согласованным договоренностям о трех измерениях. Результат этого процесса принимает различную форму для каждого из трех измерений: каждая научная практика включает в себя список из 2–4 критериев, все из которых должны быть выполнены, чтобы задача могла выявить эту научную практику; каждая пересекающаяся концепция имеет краткое описание того, что необходимо для задачи, чтобы выявить эту пересекающуюся концепцию; и каждая основная идея поставляется со списком, описывающим идеи, которые должны быть задействованы в задаче, чтобы квалифицироваться как выявление основной идеи (только один элемент из списка должен быть согласован для подсчета).Сам протокол можно найти в протоколе S1.
В процессе разработки мы сталкивались с примерами оценочных задач, которые удовлетворяли некоторым, но не всем критериям конкретной научной практики, или не соответствовали описанию конкретной сквозной концепции или основной идеи. Это было особенно характерно для научных практик, которые включают рассуждение в качестве центрального элемента, таких как Разработка и использование моделей и Создание объяснений .Несмотря на соответствие большинству критериев для практики, аргументный компонент часто отсутствовал в оценочных задачах. Чтобы различать оценочные задачи, которые полностью соответствовали критериям конкретной научной практики, и те, которые удовлетворяли большинству критериев, мы экспериментировали с «явными» и «неявными» подкатегориями. Аналогичным образом, мы охарактеризовали наличие определенной основной идеи (или сквозной концепции) как «явной» или «неявной» в зависимости от того, имела ли задача оценивания потенциал побудить студентов использовать основную идею (или сквозную концепцию) или была просто связана к основной идее (или сквозной концепции).Однако стало ясно, что этот подход был неэффективным, потому что конечная цель — помочь преподавателям составить оценочные задачи, согласованные с трехмерным обучением. Следовательно, задачи оценки кодирования, которые могли бы в лучшем случае использовать «неявные» доказательства, не имеют смысла в этом контексте. Поэтому от возможной классификации задач оценки на «неявные» или «явные» отказались как от элемента 3D-LAP.
Ниже мы обсуждаем разработку критериев для каждого из трех измерений отдельно и последствия для разработки и характеристики оценок.
Научная практика
Разработка критериев для определения научных практик при оценивании была основана на вопросе «Какие конкретные компоненты должны присутствовать в задаче, чтобы она могла потенциально выявить свидетельства участия студентов в данной практике?» Команда разработчиков рассмотрела, что значит участвовать в каждой из восьми научных практик (Таблица 1), определенных в Концепции, и договорилась о понимании того, что влечет за собой каждая из практик.Специфические инженерные практики определения проблем и проектирования решений не учитывались при разработке 3D-LAP, так как мы фокусировались на оценках по биологии, химии и физике.
В ходе разработки 3D-LAP стало очевидно, что необходимы отдельные критерии для определения того, вызывает ли задача оценивания научную практику, в зависимости от того, просили ли учащихся построить или выбрать ответ. В то время как оценочные задания, требующие построенного ответа, являются наиболее убедительным доказательством трехмерного обучения, большое количество учащихся в колледжах и сопутствующая нехватка ресурсов для выставления оценок часто требуют использования выбранного ответа (например,грамм. множественный выбор) задачи. Поскольку научная практика обычно требует от студентов «конструирования», «развития» или «вовлечения», мы разработали параллельные критерии для научных практик как для построенных ответов, так и для выбранных задач оценки ответов. Команда разработчиков признает и поддерживает идею о том, что выбранных ответных задач недостаточно для предоставления убедительных доказательств вовлечения студентов в научную практику, как указано в отчете NRC «Разработка оценок для научных стандартов следующего поколения»,
«Традиционные подходы […], которые в значительной степени полагаются на отдельные ответы, вряд ли будут адекватными для оценки всей широты и глубины ожидаемых результатов работы NGSS, особенно при оценке уровня знаний учащихся с применением научных и инженерных практик в контексте основных дисциплинарных идей.»[45]
Были разработаны отдельные критерии для составленных и выбранных ответных задач, поскольку способы, которыми студенты могут участвовать в научной практике, значительно различаются. В таблице 2 сравниваются критерии для Разработка и использование моделей , чтобы проиллюстрировать различия между заданиями с сконструированным и выбранным ответом, которые определяют научные практики. Отобранные ответные задания, соответствующие этим критериям, не являются убедительным доказательством трехмерного обучения, однако мы включили эти критерии, потому что выбранные ответы широко используются в оценках.
Адаптация научных практик, представленных в Структуре, стала необходимой, поскольку мы определили, что студентам будет предложено сделать, чтобы предоставить свидетельства участия в практике оценивания, а затем фактически применили разработанные критерии к задачам оценивания. Например, мы обнаружили значительное совпадение критериев, выработанных для научной практики Построение объяснений и Вовлечение аргументов на основе свидетельств . Было достаточно сложно разработать критерии, которые четко разграничивали бы эти две практики по диапазону оценочных задач, проанализированных в трех дисциплинах, поэтому мы в конечном итоге объединили два набора критериев в единую практику в 3D-LAP: Построение объяснений и Использование доказательств .Различие между объяснением и аргументацией неясно, поскольку исследователи в этой области продолжают обсуждать, нужно ли различать объяснения и аргументы [49,54,55].
3D-LAP не делает различий между итоговым и формирующим оцениванием, но применим к обоим типам. Следовательно, мы адаптировали несколько других научных практик. Например, Получение , Оценка , и обмен информацией было сокращено до Оценка информации , потому что в итоговых оценочных заданиях, собранных на вводных курсах лекций по биологии, химии и физике, мы не нашли примеров, в которых студентов спрашивали на Получить информацию из внешнего источника.Нам также не удалось создать типовые задания для Получение информации , пригодные для итоговой оценки. Мы исключили Общение из практики, потому что, возможно, каждый ответ может быть истолкован как передача информации, хотя и не обязательно в соответствии с видением Концепции. Планирование и проведение расследований было сокращено до Планирование расследований , потому что маловероятно, что студентов лекционного курса попросят провести расследование в рамках задачи итоговой оценки.Наконец, мы удалили задающих вопросы из научных практик для выбранных ответных задач, потому что мы не нашли задач и не могли построить задачи, которые содержали бы эту практику значимым образом. Наиболее тесно связанная задача заключалась в следующем: «Что из следующего является научным вопросом?» Однако такая задача не дает доказательств того, что учащиеся могут создавать продуктивные научные вопросы, когда им представлены данные, наблюдения или явления. Наша адаптация научных практик, изложенных в Концепции, отражает различия в целях между Концепцией и 3D-LAP.Научные практики и их описания в Структуре предназначены для руководства разработкой учебной программы, инструктажем, а также формирующим и итоговым оцениванием, тогда как 3D-LAP был разработан как инструмент для определения потенциала задач итогового и формирующего оценивания для вовлечения студентов в три -мерное обучение.
Окончательный список научных практик в 3D-LAP и связанных критериев можно найти в протоколе S1.
Общие концепции
При первоначальном обсуждении пересекающихся концепций мы следовали подходу, аналогичному подходу к научной практике.Мы определили критерии для каждой пересекающейся концепции, содержащейся в Структуре (Таблица 1), на основе приведенных в ней описаний. Эти критерии использовались для характеристики существующих и новых задач оценивания по трем дисциплинам, а затем подвергались итеративному пересмотру на основе отзывов по мере того, как группа разработчиков применяла их к задачам оценки. Как и в случае с практиками, важно было достичь согласия между дисциплинами о значении каждой пересекающейся концепции и о том, как это значение будет реализовано.Со временем стало ясно, что использование списка критериев, все из которых должны быть соблюдены для выявления наличия пересекающейся концепции (аналогично научной практике), является ограничивающим фактором. Было несколько примеров оценочных заданий, которые, по мнению членов группы разработчиков, соответствовали определенной сквозной концепции, но не соответствовали всем критериям. Это побудило группу разработчиков переосмыслить целесообразность использования списка критериев для определения знаний, охватываемых сквозными концепциями, охватывающими дисциплины.
В отличие от научных практик, которые предоставляют учащимся способы использовать свои знания (действия), пересекающиеся концепции являются элементами этих знаний с объяснительной ценностью по дисциплинам (идеям). В конечном итоге мы разработали краткие описания того, что необходимо для выявления каждой сквозной концепции, чтобы помочь кодерам определить компоненты, которые должны присутствовать. Никаких различий в описаниях построенных и выбранных ответных задач не делалось. Пример этих описаний —
Чтобы закодировать задачу оценки с помощью структуры и функции, в вопросе студенту предлагается предсказать или объяснить функцию или свойство на основе структуры или описать, какая структура может привести к данной функции или свойству.
Мы сделали одну модификацию пересекающихся концепций, найденных в Структуре (Таблица 1). В Структуре идеи масштаба, пропорции и количества объединены в единую сквозную концепцию: Масштаб , Пропорции , и Количество . Команда разработчиков определила, что концепция масштаба достаточно отличается от представлений, связанных с пропорциями и количеством, и заслуживает независимого рассмотрения. Следовательно, мы отделили масштаб от пропорции и количества, чтобы создать две независимые концепции пересечения в 3D-LAP: Масштаб и Пропорции и Количество .Полный набор критериев для концепций пересечения, разработанных для 3D-LAP, можно найти в протоколе S1.
Основные идеи
Для разработки критериев основных идей в 3D-LAP требовался подход, отличный от того, который использовался для научных практик и сквозных концепций. Что касается научных практик и пересекающихся концепций, мы смогли использовать те, которые были найдены в Структуре, с небольшими изменениями. Напротив, основные дисциплинарные идеи для физических наук и наук о жизни в структуре, даже для классов 9–12, не согласуются напрямую с содержанием или организацией по дисциплинам многих университетских курсов естествознания.Следовательно, команда разработчиков определила, что необходимы новые списки центрально важных идей для каждой дисциплины. В 3D-LAP мы называем их «ключевыми идеями», чтобы отличать их от «основных дисциплинарных идей», содержащихся в Концепции. Требования, которым должны удовлетворять наши основные идеи, были основаны на критериях, изложенных для основных дисциплинарных идей на странице 31 Концепции. Чтобы концепция квалифицировалась как основная идея в 3D-LAP, она должна иметь 1) дисциплинарное значение, 2) способность объяснять широкий спектр явлений и 3) потенциал для генерации новых идей.
Разработка 3D-LAP была частью более масштабных усилий по преобразованию основных научных курсов в нашем учреждении, и поэтому было важно привлечь широкий круг дисциплинарных преподавателей помимо команды разработчиков, особенно тех, кто участвует в преподавании этих курсов. . Смещение акцента в оценке с того, что студенты знают, на то, как студенты используют свои знания для объяснения и прогнозирования явлений, начинается с обсуждения между преподавателями того, какие знания они ценят. Дисциплинарный факультет был приглашен для участия в определении основных идей для своей дисциплины, чтобы полученный продукт был оценен и потенциально использован преподавателями за пределами команды разработчиков, поскольку мы пытаемся расширить включение трехмерного обучения в оценку и обучение [56] .По всем трем дисциплинам группы преподавателей в МГУ работали вместе, чтобы прийти к соглашению по основным идеям в каждой дисциплине, частично руководствуясь национальными усилиями [11,13–15]. Члены команды разработчиков 3D-LAP участвовали в этом процессе как равные. Способы, которыми преподаватели, не входящие в группу разработчиков 3D-LAP, были вовлечены в выявление и определение основных идей, разыгрывались по-разному в каждой дисциплине: одна дисциплина широко участвовала со стороны своих преподавателей в обсуждениях основных идей; другой создал комитеты, ответственные за два основных курса, которые работали над развитием основных идей; по третьей дисциплине небольшая рабочая группа разработала основные идеи, а затем запросила отзывы у дисциплинарного факультета.Примеры одной ключевой идеи, разработанной каждой дисциплиной, представлены на рис. 1. Чтобы задача могла выявить основную идею, задача должна соответствовать либо основному определению, либо одному из пунктов под ним.
Хотя эти основные идеи полезны для наших усилий по преобразованию и для работы группы разработчиков, мы с готовностью принимаем и поощряем возможность того, что другие группы могут разработать и использовать набор основных идей, имеющих отношение к их проекту или дисциплине. Как и в случае пересекающихся концепций, критерии, с помощью которых мы охарактеризовали основные идеи, носят описательный характер, поскольку они имеют согласованное значение в рамках соответствующих дисциплин.Исследования показывают, что дисциплинарные эксперты могут легко определить основные принципы, лежащие в основе оценочной задачи; принципы, из которых проистекает большинство наших основных идей [57]. Вероятно, это результат того, что дисциплинарные эксперты согласовали значение этих концепций в рамках процесса присоединения к сообществу практикующих ученых [58]. Полный набор наших основных идей и их критериев можно найти в протоколе S1.
Использование 3D-LAP
Характерные оценки
Первая цель 3D-LAP — охарактеризовать существующие оценочные задания по курсам биологии, химии и физики.Задача оценки, закодированная как выявление научной практики, должна соответствовать всем критериям для конкретной практики. Задачи оценки, закодированные как выявление сквозной концепции, должны соответствовать краткому описанию сквозной концепции. Задачи оценки, закодированные как выявление основной идеи, должны соответствовать либо основному описанию, либо одному из его подпунктов. На рис.2 показана построенная оценка реакции из вводной биологии, которая была охарактеризована как выявление каждого из трех параметров (т.е. это «трехмерная задача»). Многочисленные примеры (по 13 по каждой дисциплине) закодированных оценок по биологии, химии и физике приведены во вспомогательной информации S1.
Рис. 2. Оценочное задание вводного курса биологии, которое выявляет доказательства трехмерного обучения.
Панель A показывает части задачи, которые соответствуют каждому из критериев для научной практики Разработка и использование моделей (см. Таблицу 2). Панель B показывает части задачи, которые соответствуют критериям как для сквозной концепции ( Структура и функция, , данные в тексте выше), так и для основной идеи ( Структура и функция , см. Рис. 1).Дальнейший анализ этой задачи представлен во вспомогательной информации S1.
https://doi.org/10.1371/journal.pone.0162333.g002
В каждой из дисциплин есть по крайней мере одна основная идея, которая похожа на сквозную концепцию (например, на рис. 2). В этих случаях высказывались опасения, что определенные задачи «вызовут два измерения по цене одного». Команда разработчиков определила, что отделение критериев сквозной концепции от критериев основной идеи (и наоборот) было ненужным, потому что задача, которая вызывает одно, безусловно, может вызвать другое.В каждом случае совпадения между сквозной концепцией и основной идеей критерии различаются между ними, поэтому задачи могут быть закодированы одним, а не другим, хотя они часто кодируются вместе.
Изучение каждой оценочной задачи на экзамене (или аналогичной оценке) с помощью 3D-LAP дает нам возможность охарактеризовать полные оценки (наша вторая цель). На рис. 3 показаны два экзамена по химии, которые были закодированы с помощью 3D-LAP. Эти экзамены были выбраны специально потому, что экзамен A состоял из оценочных заданий, подобных тем, что можно найти в большинстве учебников, а экзамен B был взят из курса, в котором использовалась учебная программа, основанная на исследованиях.Эти экзамены были выбраны специально потому, что ожидалось, что они подчеркнут полезность 3D-LAP: для определения оценок, которые могут выявить доказательства трехмерного обучения. При сравнении экзаменов по химии A и B, различия, обнаруженные 3D-LAP, очевидны. Экзамен по химии A состоит из нескольких задач, которые определяют одно или несколько измерений, тогда как экзамен по химии B содержит больше примеров задач, закодированных от одного до трех измерений, а некоторые из них закодированы со всеми тремя измерениями.
Рис. 3. Сравнение двух исследований, охарактеризованных с помощью 3D-LAP.
В первой строке каждой диаграммы показан номер вопроса. В последних трех строках ячейки, закрашенные синим, зеленым и красным цветом, указывают на наличие свидетельств научной практики, сквозной концепции или основной идеи, соответственно. Вопросы 21–23 на экзамене по химии B представляют собой построенные ответы. Все остальные показанные вопросы являются выбранными ответами.
https://doi.org/10.1371/journal.pone.0162333.g003
Подобная характеристика оценок может использоваться для сравнения курсов с течением времени (например, для сбора доказательств того, что преобразование курса было успешным), для сравнения экзаменов в рамках курса (например, для характеристики того, что оценивается в курсе), и для сравнения экзаменов между курсами в рамках дисциплины (например, чтобы охарактеризовать, где студенты оцениваются по каждой научной практике в рамках программы на получение степени).
В рамках нашего анализа мы отслеживали процент общих баллов, связанных с каждой задачей, в дополнение к кодам, полученным с помощью 3D-LAP.Мы утверждаем, что количество баллов, присвоенных преподавателями определенным заданиям на экзамене, информирует учащихся об относительной важности этих заданий. Мы используем эту относительную важность, чтобы продемонстрировать, какой процент баллов на каждом экзамене соответствует трем параметрам. На рис. 4 показана разница между двумя экзаменами, которые мы закодировали по каждой дисциплине. Как и на рис. 3, эти экзамены были выбраны специально, потому что экзамены A были составлены из канонических оценочных заданий, в то время как экзамены B были взяты из учебных программ, основанных на исследованиях, чтобы подчеркнуть полезность 3D-LAP.Экзамены, показанные на рис. 3, являются теми же экзаменами, что и в разделе «Химия» на рис. 4, теперь они масштабируются по количеству баллов, присвоенных каждой задаче. На рис. 4 показано, что на каждом из экзаменов A большая часть баллов присуждается задачам с небольшим потенциалом выявления более чем одного измерения. Напротив, в каждом из экзаменов B преобладают задания, которые могут выявить двух- или трехмерные доказательства, при этом не менее 40% баллов присуждается за трехмерные задания.
На рис. 5 показано другое представление данных с указанием процента баллов по каждому экзамену, связанных с задачами, которые могут вызывать каждый из параметров.Мы обнаружили, что на экзаменах A все три дисциплины присуждают несколько баллов за задания, затрагивающие какое-либо измерение, за исключением экзамена A по физике, где основные идеи проявились во многих задачах оценивания. Наиболее вероятное объяснение этой разницы состоит в том, что основные идеи физики более детализированы, чем основные идеи биологии и химии. Как обсуждалось выше, основные идеи были намеренно разработаны так, чтобы быть значимыми и соответствовать дисциплине в нашем учреждении. Факультет физики утверждал, что руководящие принципы, которые появляются во вводной физике (например,g., второй закон Ньютона, сохранение энергии) преобладали во многих оценочных задачах, включая те, которые просили студентов решать канонические числовые задачи. Однако они признали, что немногие задачи такого типа дают студентам возможность заниматься научной практикой или пересекающимися концепциями. По всем трем дисциплинам мы видим, что экзамены B присваивают значительно больше баллов задачам, которые раскрывают научные практики, пересекающиеся концепции и основные идеи.
Рис. 5. Сравнение двух экзаменов по каждой дисциплине, отображающее процент экзаменационных баллов, присвоенных задачам, закодированным с использованием научных практик, сквозных концепций и основных идей.
Это представление показывает, что, хотя в физике есть несколько задач нулевого измерения, подавляющее большинство задач затрагивают основные идеи, а два других измерения почти никогда не обнаруживаются.
https://doi.org/10.1371/journal.pone.0162333.g005
Действительность и надежность
Здесь мы устанавливаем валидность и надежность протокола для характеристики оценок в рамках усилий по преобразованию в МГУ. Важно отметить, что сам протокол не следует считать действительным и надежным для всех возможных наборов данных, потому что достоверность и надежность являются характеристиками инструментов анализа и данных вместе [59,60].Поэтому мы закодировали экзамены из нашего набора данных, чтобы проверить достоверность и надежность этого проекта. Группы, проводящие другие исследования, должны подтвердить достоверность и надежность своих наборов данных. Ниже мы предлагаем модель для этого.
Доступно множество типов проверки достоверности и надежности, но не все подходят для 3D-LAP. Мы описываем доказательства, которые подтверждают достоверность критериев для наших данных. В случае 3D-LAP наша команда дисциплинарных экспертов и исследователей в области образования в области биологии, химии и физики совместно разработала протокол, который позволил нам применить критерии во всех трех дисциплинах.В рамках итеративного цикла между командой разработчиков проходили обширные переговоры по разработке критериев для каждой научной практики и сквозных концепций. При создании критериев для практик и сквозных концепций на каждом этапе переговоров учитывались как теория (например, Основы), так и практика (т.е. существующие задачи оценки). Аналогичный процесс был установлен с группами преподавателей дисциплины (в дополнение к команде разработчиков), которые работали над тем, чтобы обеспечить включение всех аспектов основных идей.По этим причинам мы утверждаем, что протокол с нашим набором данных имеет как фактическую достоверность, так и достоверность содержимого.
Чтобы оценить надежность протокола с нашими данными, мы закодировали два экзамена по каждой дисциплине из нашего набора данных с репрезентативными оценочными задачами. Эти экзамены были выбраны специально, потому что мы ожидали, что один экзамен будет включать в себя очень мало задач, раскрывающих три аспекта, а другой экзамен — намного больше. Исследователи из группы разработчиков закодировали каждую задачу в соответствии со своей дисциплиной, и процентное согласие использовалось для оценки надежности между экспертами.Для этого сравнения мы считали, что два кодировщика согласны, если они оба указали, что задача может выявить доказательства научной практики, сквозной концепции или основной идеи, или согласились, что они этого не сделали (Таблица 3 показывает сводку случаев ). Мы выбрали это определение согласия, потому что задачи могут соответствовать критериям нескольких научных практик, пересекающихся концепций или основных идей. Например, просьба к учащимся построить химическую структуру для набора соединений с последующим ранжированием и объяснением тенденции точки кипения для соединений соответствует критериям для обоих Построение объяснений и Привлечение аргументов на основе доказательств и Разработка и использование моделей .В этом случае кодировщики могут согласиться с тем, что задача оценки может быть закодирована как одна из двух практик; однако, если согласие не принято на более высоком уровне («есть ли практика?»), кодировщики расходятся во мнениях, если один кодирует обе практики, а другой выбирает только одну (сценарий 3 в таблице 3). Следовательно, разногласия были определены только тогда, когда один кодировщик сказал, что задача выявила научную практику, сквозную концепцию или основную идею, а другой кодировщик определил, что это не так (сценарий 5 в таблице 3).
После кодирования экзаменов мы измерили надежность между экспертами, посмотрев на процентное соответствие между кодировщиками в рамках дисциплины, установив наш нижний предел на уровне 75%. Для биологии и химии (дисциплины с> 2 кодировщиками) процентное соответствие вычислялось для каждой пары кодировщиков, и эти значения были усреднены. В таблице 4 показано количество кодировщиков для каждой дисциплины, общее количество задач, закодированных в каждой дисциплине, и значения процентного согласия для каждого измерения в каждой дисциплине.
Обсуждение
3D-LAP можно использовать для характеристики потенциала оценочных заданий для получения доказательств того, что учащиеся участвуют в научных практиках, сквозных концепциях и основных идеях в контексте вводных курсов биологии, химии и физики на уровне колледжа. Протокол может надежно использоваться исследователями и отличать экзамены, которые могут выявить доказательства трехмерного обучения, от экзаменов, которые этого не делают. Этот новый протокол обращается к отчету NRC «Разработка оценок для научных стандартов следующего поколения», в котором говорится, что «необходимы новые виды научных оценок для поддержки нового видения и понимания научного обучения учащихся» [45].3D-LAP помогает как практикам, так и исследователям определять или создавать эти новые виды научных оценок.
Мы продемонстрировали, что 3D-LAP можно использовать для характеристики задач как имеющих потенциал для получения свидетельств того, что студент занимается научной практикой, сквозной концепцией и / или основной идеей. Повторяя этот процесс для каждой задачи оценивания (например, набора домашних заданий или экзамена), мы можем использовать 3D-LAP для сравнения оценок. Такие сравнения могут быть полезны для оценки успешности трансформации путем сравнения оценок до и после трансформации, для определения того, что оценивается студентами в конкретном курсе, и для изучения того, где студенты оцениваются по различным аспектам трехмерного обучения как часть образовательной программы.
Мы используем 3D-LAP для оценки усилий по преобразованию в МГУ. Характеризуя оценки как до, так и после преобразования, мы исследуем, привело ли преобразование к оценкам, которые могут выявить научные практики, сквозные концепции и ключевые идеи. Кроме того, 3D-LAP будет использоваться для изучения влияния трехмерного обучения на набор студентов и их настойчивость в областях STEM.
Мы также исследуем полезность существующих оценок (например,грамм. описи концепций) для оценки трехмерного обучения учащихся. Выявляя или изменяя существующие оценки или разрабатывая новые, мы можем лучше оценить способности учащихся заниматься наукой, используя основные идеи дисциплины. Мы можем приступить к разработке новых типов оценочных заданий для измерения обучения студентов в системе высшего образования, которые, в свою очередь, можно использовать для руководства при разработке инструкций и учебных программ. В идеале учащиеся должны достичь целей трехмерного обучения как на местном, так и на национальном уровнях.
Мы не утверждаем, что все задачи оценивания должны выявить все три измерения, но если мы участвуем в преобразованиях курса, в которых трехмерное обучение является центральным, то мы также должны обеспечить соответствующее согласование оценок курса. С этой целью мы утверждаем, что оценки, аналогичные экзаменам A на рис. 3, 4 и 5, не оценивают способности учащихся заниматься наукой так, как это делают ученые. Однако мы понимаем, что инструкторы могут захотеть напрямую оценить определенные навыки, такие как рисование структур Льюиса, построение квадрата Паннета или создание диаграммы свободного тела (дополнительные примеры таких навыков см. В разделе «Вспомогательная информация S2»).Задачи, оценивающие только эти виды навыков, часто кодируются как нулевые или одномерные с использованием 3D-LAP. Учитывая необходимость оценивать навыки, а также тот факт, что на ответы на более многомерные задачи требуется больше времени, при разработке оценки необходимо подумать о балансе. Мы не заявляем об оптимальном сочетании заданий, при котором оценка считается «хорошей», но утверждаем, что оценка не должна состоять почти полностью из нулевых или одномерных задач (например, экзаменов A), а должна состоять из массива многомерных задач и навыков (больше похоже на экзамены B).
3D-LAP также может использоваться в качестве инструмента профессионального развития, чтобы помочь преподавателям в написании оценочных заданий, способных выявить доказательства того, что студент занимался научной практикой, сквозной концепцией и / или основной идеей. Преподаватели, заинтересованные в том, чтобы привнести идеи трехмерного обучения в свой класс, должны иметь способы оценить этот вид обучения. 3D-LAP может служить руководством для преподавателей при самостоятельной разработке оценочных материалов, но их, вероятно, потребуется обучить использовать протокол таким образом, который согласуется с намерениями разработчиков.Именно таким образом мы проводим семинары на крупных конференциях, используя 3D-LAP. На двух недавних семинарах (один по физике, другой по химии) участников познакомили с 3D-LAP, затем попросили закодировать существующие оценочные задания и, наконец, использовали его для разработки своих собственных задач. Как ни странно, реакция на инструмент положительная, и его использование начинающими пользователями согласуется с нашими намерениями. Хотя семинары включают в себя самостоятельно выбранную группу участников, мы намерены определить степень, в которой другие преподаватели нуждаются в руководстве по применению и использованию 3D-LAP, как для определения задач, которые соответствуют трехмерному обучению, так и для разработки новых оценок.
Разработка 3D-LAP основана на существующих исследованиях в области научного обучения и оценки студентов. Необходимо проделать дополнительную работу, чтобы изучить, как учащиеся взаимодействуют с трехмерными оценками и реагируют на них. Такая работа может привести к модификации 3D-LAP или может выявить специфические для дисциплины шаблоны, которые, возможно, потребуется решить в будущем.
Ограничения
3D-LAP предоставляет информацию о потенциале оценочных заданий для выявления свидетельств трехмерного обучения, но не учитывает, как студенты на самом деле реагируют на оценочные задания.Кроме того, мы не приняли во внимание особенности оценочных заданий, которые влияют на то, как студенты отвечают, такие как структура предвзятости подсказок или вопросов [46]. Таким образом, задачи, которые мы идентифицируем как потенциально вызывающие доказательства взаимодействия учащихся с тремя измерениями, могут, но не обязательно, вызывать трехмерное мышление. Кроме того, мы не делаем вывод о том, какой факультет предназначен для выполнения своих оценочных заданий, и мы не знаем целей курсов, на которых даются эти оценочные задания.Наконец, 3D-LAP был разработан для использования при оценке результатов вводных лекционных курсов по биологии, химии и физике на уровне колледжа. Хотя мы ожидаем, что некоторые компоненты 3D-LAP будут применимы к другим уровням и типам курсов, 3D-LAP не тестировался на этих курсах.
Заключение
Мы разработали 3D-LAP, протокол для определения задач оценки, которые потенциально могут выявить доказательства трехмерного обучения. Чтобы продемонстрировать его полезность, мы охарактеризовали шесть экзаменов из нашего набора данных; по два из биологии, химии и физики.Эти характеристики позволили нам определить оценки, которые потенциально могут предоставить доказательства того, что студенты могут делать со своими знаниями в области науки.
3D-LAP был разработан в первую очередь для оценки успеха трансформации, направленной на внедрение трехмерного обучения во вводные курсы биологии, химии и физики в МГУ. Характеризуя, как оценки меняются с течением времени, мы намерены оценить успех этих усилий в будущих публикациях.Мы предоставили доказательства того, что протокол действителен и надежен в применении к нашему набору данных.
Хотя 3D-LAP был разработан с учетом оценок вводных курсов биологии, химии и физики, его можно было использовать (или адаптировать) для других курсов или дисциплин высшего образования или даже для естественных курсов K-12. Дальнейшая работа с протоколом будет включать определение степени успеха наших усилий по преобразованию, изучение того, как учащиеся участвуют в оценках, разработанных на основе 3D-LAP, и использование протокола в качестве инструмента профессионального развития.
Наконец, мы включаем полный 3D-LAP и примеры описания задач из биологии, химии и физики в протокол S1 и вспомогательную информацию S1 и призываем других использовать его для характеристики или разработки своих собственных оценок.
Благодарности
Этот проект был поддержан Инициативой по обучению студентов STEM Ассоциации американских университетов (которая финансируется благотворительным фондом Helmsley Charitable Trust) и Офисом ректора Университета штата Мичиган.Мы благодарим преподавателей, которые предоставили оценочные задания для нашего обзора, участвовали в обсуждениях основных идей и предприняли шаги по включению трехмерного обучения в свои курсы.
Вклад авторов
- Концептуализация: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Обработка данных: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Формальный анализ: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Методология: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Администрация проекта: JTL SMU RLM MMC.
- Ресурсы: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Контроль: JTL SMU RLM MDC MMC.
- Проверка: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Визуализация: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Написание — первоначальный черновик: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
- Написание — просмотр и редактирование: JTL SMU RLM LAP JHC MDC CLF DE SEJ MMC.
Ссылки
- 1. Гарднер Д.П. и другие. Нация в опасности: необходимость реформы образования. Открытое письмо американскому народу. Отчет народу и министру образования. 1983 г., апрель. Доступно: http://eric.ed.gov/?id=ED226006. По состоянию на 5 апреля 2016 г.
- 2. Комитет по процветанию мировой экономики в 21 веке Повестка дня для американской науки и технологий. Восхождение над надвигающейся бурей. Национальная академия прессы; 2007 г.(Энергия и использование Америки для более светлого экономического будущего).
- 3. Возвращение к надвигающейся буре: быстро приближается к категории 5. Вашингтон, округ Колумбия: National Academies Press; 2010.
- 4. Совет советников президента по науке и технологиям. Взаимодействие с Excel: подготовка миллиона дополнительных выпускников колледжей со степенью в области естественных наук, технологий, инженерии и математики. 2012 Февраль
- 5. AAAS. Атлас научной грамотности: проект 2061.Вашингтон, округ Колумбия: проект 2061 AAAS; 2001.
- 6. Проект 2061. Атлас научной грамотности, том 2. Вашингтон, округ Колумбия: American Assn. для развития науки; 2007.
- 7. Национальные стандарты научного образования. Вашингтон, округ Колумбия: Пресса национальных академий; 1996.
- 8. Ведущие государства NGSS. Стандарты науки нового поколения: для государств, по штатам. 2013.
- 9. Национальный исследовательский совет. Исследования в области образования на основе дисциплины: понимание и улучшение обучения в области естественных наук и инженерии.Национальная академия прессы; 2012.
- 10. Охват студентов: что говорят исследования об эффективном обучении в области естественных наук и инженерии. Вашингтон, округ Колумбия: Пресса национальных академий; 2015.
- 11. Брюэр К.А., Смит Д., редакторы. Видение и изменения в бакалавриате биологического образования: призыв к действию. AAAS; 2011.
- 12. Смит Д., редактор. Видение и изменения в бакалавриате биологического образования: хронические изменения, вдохновляющие будущее.AAAS; 2015.
- 13. Совет колледжа. Структура учебной программы AP по биологии. 2011.
- 14. Совет колледжа. AP Chemistry. 2014.
- 15. Совет колледжа. AP Physics 1: Основанная на алгебре и AP Physics 2: Основа учебной программы на основе алгебры. 2015.
- 16. Freeman S, Eddy SL, McDonough M, Smith MK, Okoroafor N, Jordt H и др. Активное обучение повышает успеваемость учащихся в области естественных наук, инженерии и математики. Proc Natl Acad Sci.2014 Май;
- 17. Купер М.М., Кабальеро М.Д., Эберт-Мэй Д., Фата-Хартли К.Л., Ярделеза С.Е., Крайчик Д.С. и др. Призовите преподавателей изменить обучение STEM. Наука. 2015 16 октября; 350 (6258): 281–2. pmid: 26472897
- 18. Макдональд Дж. Стандарты науки следующего поколения: влияние на преподавание естественных наук в колледжах. J Coll Sci Teach. 2015 окт. 9; 45 (1): 13–4.
- 19. Национальный исследовательский совет. Рамки для естественнонаучного образования. Национальная академия прессы; 2012 г.
- 20. Как люди учатся: мозг, разум, опыт и школа: расширенное издание. Вашингтон, округ Колумбия: Пресса национальных академий; 2000.
- 21. Шмидт WH, McKnight CC, Raizen S, редакторы. Разрозненное видение. Дордрехт: издательство Kluwer Academic Publishers; 2002.
- 22. Виггинс Дж., МакТиг Дж. Понимание по замыслу. Александрия Вирджиния: Ассоциация по надзору и разработке учебных программ. Soc Stud Grade. 2005; 6: 31.
- 23. Айкенхед GS.Научные профессии и учебная программа по естествознанию: концепции доказательств. Sci Educ. 1 марта 2005 г .; 89 (2): 242–75.
- 24. Дагган С., Готт Р. Какое научное образование нам действительно нужно? Int J Sci Educ. 2002 г., 1 июля; 24 (7): 661–79.
- 25. Торранс Х. Формирующая оценка на перепутье: конформативная, деформативная и трансформирующая оценка. Oxf Rev Educ. 2012. 38 (3): 323–42.
- 26. Хаммер Д, Элби А, Шерр РЭ, Рыжий Э.Ф. Ресурсы, обрамление и передача.ResearchGate.
- 27. Зал KL. Изучение влияния ожиданий студентов в классе на реформу курса биологии бакалавриата. 2013. Доступно: http://drum.lib.umd.edu/handle/1903/14080
- 28. Момсен Дж., Оффердал Э., Криевская М., Монплезир Л., Андерсон Э., Грош Н. Использование оценок для исследования и сравнения характера обучения на курсах естественных наук. CBE-Life Sci Educ. 2013, 20 июня; 12 (2): 239–49. pmid: 23737631
- 29. Треагуст Д.Разработка и использование диагностических тестов для оценки неправильных представлений учащихся о науке. Int J Sci Educ. 1988 апр; 10: 159–69.
- 30. Hestenes D, Wells M, Swackhamer G. Инвентаризация концепции силы. Phys Teach. Март 1992 г., 30 (3): 141–58.
- 31. Малфорд Д.Р., Робинсон В.Р. Перечень альтернативных концепций среди студентов-химиков первого семестра. J Chem Educ. 2002, 1 июня; 79 (6): 739.
- 32. Смит МК, Вуд ВБ, Найт Дж. К. Оценка концепции генетики: новый перечень концепций для оценки понимания студентами генетики.CBE-Life Sci Educ. 2008 21 декабря; 7 (4): 422–30. pmid: 1 28
- 33. Hake RR. Интерактивное взаимодействие по сравнению с традиционными методами: обзор данных испытаний механики для вводных курсов физики с участием шести тысяч студентов. Am J Phys. 1998, январь; 66 (1): 64–74.
- 34. Блум Б.С. Таксономия образовательных целей Книга 1: Когнитивная область. 1956.
- 35. Андерсон Л.В., Кратвол Д.Р., Айразиан П.В., Крукшанк К.А., Майер Р.Э., Пинтрих П.Р. и др. Таксономия для обучения, преподавания и оценки: пересмотр таксономии образовательных целей Блума, сокращенное издание.1 издание. Нью-Йорк: Пирсон; 2000. 336 с.
- 36. Knight JK, Wise SB, Rentsch J, Furtak EM. Подсказки имеют значение: помощники по обучению влияют на вводные взаимодействия студентов-биологов во время обсуждения вопросов-кликеров. CBE-Life Sci Educ. 2015 21 декабря; 14 (4): ar41. pmid: 265
- 37. Stanger-Hall KF. Экзамены с множественным выбором: препятствие для более высокого уровня мышления на вводных курсах естественных наук. CBE-Life Sci Educ. 2012 21 сентября; 11 (3): 294–306. pmid: 22949426
- 38.Zheng AY, Lawhorn JK, Lumley T., Freeman S. Применение таксономии Блума развенчивает «миф о MCAT». Наука. 25 января 2008 г., 319 (5862): 414–5. pmid: 18218880
- 39. Кроу А., Диркс С., Вендерот член парламента. Биология в цвету: внедрение таксономии Блума для улучшения обучения студентов биологии. CBE-Life Sci Educ. 2008 21 декабря; 7 (4): 368–81. pmid: 1 24
- 40. Города MH. Руководство по разработке высококачественных, надежных и достоверных оценок с множественным выбором. J Chem Educ.2014 9 сентября; 91 (9): 1426–31.
- 41. Лоуренс Ф., Вуд Н. Б., Кирхгоф А., Ким Н. К., Эйзенкрафт А. Переменные, влияющие на достижения в области физики. J Res Sci Teach. 1 ноября 2009 г .; 46 (9): 961–76.
- 42. Wood WB. Нововведения в преподавании биологии бакалавриата и зачем они нужны. Annu Rev Cell Dev Biol. 2009. 25: 93–112. pmid: 19575638
- 43. Лимоны PP, Лимоны JD. Вопросы для оценки когнитивных навыков высшего порядка: не только Блума. CBE-Life Sci Educ.2013 20 марта; 12 (1): 47–58. pmid: 23463228
- 44. Принимая науку в школу: изучение и преподавание естественных наук в классах K-8. Вашингтон, округ Колумбия: Пресса национальных академий; 2007.
- 45. Разработка оценок для научных стандартов следующего поколения. Вашингтон, округ Колумбия: Пресса национальных академий; 2014.
- 46. Зная, что знают студенты: наука и дизайн образовательной оценки. Вашингтон, округ Колумбия: Пресса национальных академий; 2001.
- 47.Мислевы Р.Дж., Миндаль Р.Г., Лукас Дж.Ф. Краткое введение в доказательно-ориентированный дизайн. 2004.
- 48. Linn RL. Образовательные измерения. 3 издание. Образование AC, редактор. Вашингтон; Феникс: Прегер; 1988. 624 с.
- 49. Осборн Дж. Ф., Паттерсон А. Научный аргумент и объяснение: необходимое различие? Sci Educ. 1 июля 2011 г .; 95 (4): 627–38.
- 50. Хестенес Д. К теории моделирования в обучении физике. Am J Phys. 1987. 55 (5): 440–54.
- 51. Schwarz CV, Reiser BJ, Davis EA, Kenyon L, Achér A, Fortus D и др. Развитие процесса обучения для научного моделирования: сделать научное моделирование доступным и значимым для учащихся. J Res Sci Teach. 1 августа 2009 г.; 46 (6): 632–54.
- 52. Виндшитл М., Томпсон Дж., Браатен М. За пределами научного метода: исследование на основе моделей как новая парадигма предпочтения для школьных научных исследований. Sci Educ. 2008 сентябрь; 92 (5): 941–67.
- 53.Хендерсон С., другие. Содействие изменениям в учебной практике студентов STEM: аналитический обзор литературы. JRST. 2011. 48 (8): 952–84.
- 54. Берланд LK, McNeill KL. Для кого аргумент и объяснение — необходимое различие? Ответ Осборну и Паттерсону. Sci Educ. 2012 1 сентября; 96 (5): 808–13.
- 55. Осборн Дж., Паттерсон А. Ответ авторов на вопрос «Для кого аргумент и объяснение — необходимое различие? Ответ Осборну и Паттерсону »Берланда и Макнила.Sci Educ. 2012 1 сентября; 96 (5): 814–7.
- 56. Лаверти Дж. Т., Тессмер Ш., Купер М. М., Кабальеро, доктор медицины. Привлечение физического факультета к трансформации курса. В: Конференция по исследованиям в области физического образования, 2014 г. Миннеаполис, Миннесота; 2014. с. 147–50. (PER Конференция).
- 57. Чи М.Т., Фельтович П.Дж., Глейзер Р. Категоризация и представление физических проблем экспертами и новичками *. Cogn Sci. 1981, 1 апреля; 5 (2): 121–52.
- 58. Венгер Э. Практикующие сообщества: обучение, значение и идентичность.1 издание. Кембридж, Великобритания; Нью-Йорк, Нью-Йорк: Издательство Кембриджского университета; 1999. 336 с.
- 59. Bretz SL. Разработка инструментов оценки для оценки учащихся? Концептуальные познания в химии. В: Инструменты исследования химического образования. Американское химическое общество; 2014. с. 155–68. (Серия симпозиумов ACS; т. 1166).
- 60. АЭРА. Стандарты образовательного и психологического тестирования 2014 года. Вашингтон, округ Колумбия: AERA; 2014. 230 с.
Тест № 2-1 ПРАКТИКА: Типы химических реакций
Какое химическое уравнение правильно представляет реакцию разложения, которая происходит, когда аммиак распадается с образованием газообразного водорода и газообразного азота?
A | NH 3 + H 2 → N 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
B | 9049 2 NH | 9049 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
C | NH 3 → N + H | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
D | N 2 + H 2 Когда пропан реагирует в присутствии газообразного кислорода, продуктами этой реакции горения являются: A CH 2 + H 2 O CO 2 + H 2 C C + H 2 D CO 2 + H 2 O Комбинированные реакции всегда: A использовать только один реагент C требуется газообразный кислород D образуют только одно химическое уравнение 9000O5 9Cl4 → KCl + O 2 , пример какого типа реакции? A с двойной заменой B с одной заменой горение Какая из приведенных ниже реакций является реакцией двойного замещения? A Nh5Cl → NH 3 + HCl B Cd (NO 3 ) + 2 NaNO 3 C 2 Mg + O 2 → 2 MgO D N 2497 3 2 NH 3 A Все являются реакциями разложения. B 4 только C 2, 3 и 4 D D A 2 Mg + O 2 → 2 MgO B 2 N 2 9049 2 2 NH 2 9049 2 3 C CaO + H 2 O → Ca (OH) 2 D 2 CH2 4 9049 2 CO 2 + 4 H 2 O Химическое уравнение Cr + Fe (NO 3 ) 2 → Fe + Cr (NO 3 ) 3 , является примером какой тип реакции? A двойная замена B декомпозиция горение AlCl 3 + NaOH → X + NaCl A Al 3 OH B 949 не может быть определено C Al (OH) 3 D AlOH 9048 реакция разложения реагенты обычно представляют собой два ионных соединения в водном растворе B одним из реагентов часто является вода C энергия в виде тепла или тепла часто производится D реагентами обычно являются металл и неметалл Когда вы закончите, нажмите кнопку ниже.Все незавершенные задания будут отмечены как неправильные.
Получить результаты Сдать экзамен по химии может показаться непосильной задачей, но вы справитесь! Вот 10 лучших советов по сдаче экзамена по химии. Примите их близко к сердцу и пройдите это испытание! Изучать. Хорошо выспитесь. Есть завтрак. Если вы пьете напитки с кофеином, сегодня не время, чтобы их пропускать.Точно так же, если вы никогда не пьете кофеин, сегодня не время для начала. Придите к экзамену достаточно рано, чтобы у вас было время собраться и расслабиться. Не рискуйте вытащить бланк, столкнувшись с расчетом! Если вы запомнили константы или уравнения, запишите их еще до просмотра теста. Прочтите инструкцию к тесту! Узнайте, будут ли вычитаться баллы за неправильные ответы и нужно ли вам отвечать на все вопросы.Иногда тесты по химии позволяют выбрать, на какие вопросы отвечать. Например, вам может понадобиться проработать всего 5 из 10 задач. Если вы не читаете инструкции к тесту, вы можете выполнить больше работы, чем нужно, и потратить драгоценное время. Отсканируйте тест, чтобы увидеть, какие вопросы приносят наибольшее количество баллов. Расставьте по приоритетам самые важные вопросы, чтобы убедиться, что вы их ответили. У вас может возникнуть соблазн торопиться, но найдите минутку, чтобы расслабиться, собраться с мыслями и понять, где вам нужно быть, когда отведенное вам время наполовину закончилось.Решите, на какие вопросы вы собираетесь ответить в первую очередь и сколько времени вы дадите себе, чтобы вернуться к своей работе. Вы можете подумать, что знаете, к чему ведет вопрос, но лучше перестраховаться. Кроме того, вопросы по химии часто состоят из нескольких частей. Иногда вы можете получить подсказку о том, как решить проблему, увидев, в чем заключается вопрос. Иногда таким образом можно даже найти ответ на первую часть вопроса. На это есть две причины.Во-первых, это вселяет уверенность, которая помогает расслабиться и улучшает ваши результаты в оставшейся части теста. Во-вторых, он дает вам несколько быстрых очков, поэтому, если у вас заканчивается время на тест, по крайней мере, вы получили несколько правильных ответов. Может показаться логичным проработать тест от начала до конца. Если вы уверены, что у вас есть время и вы знаете ответы на все вопросы, это хороший способ избежать случайного пропуска вопросов, но большинство студентов добиваются большего успеха, если пропускают более сложные вопросы, а затем возвращаются к ним. Запишите, что вы знаете, даже если не знаете, как решить проблему. Это может служить наглядным пособием, которое нарушит вашу память, или может принести вам частичную пользу. Если вы в конечном итоге зададите вопрос неправильно или оставите его незавершенным, это поможет вашему преподавателю понять ваш мыслительный процесс, чтобы вы все равно могли усвоить материал. Кроме того, не забудьте показать свою работу аккуратно, . Если вы решаете проблему целиком, обведите или подчеркните ответ, чтобы инструктор мог его найти. Тесты редко наказывают вас за неправильные ответы. Даже если они это сделают, если вы можете исключить хотя бы одну возможность, стоит сделать предположение. Если вас не наказывают за угадывание, нет причин, по которым или могут ответить на вопрос. Если вы не знаете ответа на вопрос с несколькими вариантами ответов, постарайтесь исключить возможные варианты и сделать предположение. Если это верное предположение, выберите «Б» или «В». Если это проблема, и вы не знаете ответа, запишите все, что знаете, и надейтесь на частичную оценку. Убедитесь, что вы ответили на все вопросы. Вопросы по химии часто позволяют проверить ваши ответы, чтобы убедиться, что они имеют смысл. Если вы не определились с двумя вариантами ответа на вопрос, руководствуйтесь своим первым инстинктом. Химия — один из тех уроков, которые вы любите или боитесь. В средней школе химия обычно не является обязательным курсом — это факультатив.Однако наиболее уважаемые колледжи требуют, чтобы все студенты бакалавриата прошли хотя бы один курс химии в качестве предварительного условия для получения диплома. Если вы планируете сделать карьеру в области медицины, инженерии или естествознания, вам, скорее всего, потребуется пройти хотя бы один курс химии перед выпуском. Химия — сложный предмет для большинства людей, но это не обязательно. Причина номер один, по которой люди борются с химией, заключается в том, что они не подходят к ней правильно.Ниже мы рассмотрим проверенные стратегии и методы, которые, в случае их применения, улучшат вашу способность изучать химию. В традиционной модели обучения студенты приходят в класс, инструктор представляет материал, разъясняет соответствующие концепции, назначает дополнительные чтения и задания и заканчивает урок. Затем ожидается, что учащиеся пойдут домой, просмотрят свои классные заметки, попытаются выполнить назначенные чтения и задания, фактически узнают, чему учили в классе (что не всегда случается), придут в класс на следующей неделе с любыми вопросами, которые у них возникнут от учеников. предыдущей лекции, и будьте готовы двигаться дальше и исследовать новый материал и концепции.Проблема с этой моделью в том, что она неэффективна, особенно с предметами и материалами, которые сложно усвоить. Лучший способ изучить химию — приходить на каждую лекцию, уже прочитав и изучив материал, который будет представлен в этот день. Этот метод обучения известен как «перевернутый класс», иногда называемый «перевернутый класс», и это растущая тенденция преподавания многих предметов в школах и колледжах по всей стране. Эта модель особенно эффективна для изучения (и преподавания) химии по нескольким причинам.Во-первых, он побуждает учеников прийти в класс, уже изучив материал, который будет представлен. Во-вторых, приходя в класс, уже знакомые с предметом, студенты могут следить за ними и понимать, что им преподают. Если студенты не поняли концепций в ходе своих занятий, они могут задавать вопросы во время соответствующей лекции. Наконец, учебное время более эффективно используется как инструмент обучения. Студенты уходят с каждой лекции с гораздо лучшим пониманием концепций курса и с меньшим количеством вопросов. Изучение заданий по химии, чтения и материала перед каждым уроком — одна из самых эффективных стратегий изучения химии. Как и в любой другой науке, в химии есть много новой информации, которую нужно выучить и запомнить. На самом деле, когда вы начнете изучать химию, вам будет представлено так много новой информации, что вы быстро увязнете, если вас поймают, пытаясь запомнить все детали.Сначала сосредоточьтесь на получении понимания фундаментальных концепций. Когда у вас появится хорошее понимание основ, вы можете потратить время на запоминание деталей. Кроме того, по мере того, как вы овладеете основами химии и поймете концепции, вам будет намного легче запоминать все остальное. Помните, запоминание никогда не должно заменять понимание. Сначала постарайтесь понять. Регулярно посещать занятия и уделять внимание важно, но этого недостаточно.Изучая химию, необходимо делать подробные, внятные записи, которые помогут вам лучше понять обсуждаемые концепции. Запись имеет особое значение при изучении химии по следующим причинам. Делая заметки, не сосредотачивайтесь только на том, что ваш инструктор пишет на доске. Слушайте и запишите все ключевые словесные тезисы и концепции, обсужденные во время лекции. После каждой лекции уделите несколько минут тому, чтобы просмотреть свои записи. Убедитесь, что вы понимаете все концепции, затронутые в лекции. Используйте свой учебник, чтобы улучшить свои записи и понимание ключевых понятий. Ключ к изучению химии — это практика. Выполнение практических задач, решение уравнений, рабочих формул и т. Д. Должно быть основной частью вашей повседневной учебной программы. Правильно, ежедневная программа обучения .Вы должны каждый день уделять немного времени (1 час) изучению химии, если вы хотите выучить ее и оставаться на вершине своей игры. Проверьте свое понимание и знание химии, просмотрев и проработав практические задачи, обнаруженные в образцах химических тестов, а также проблемы, обнаруженные на предыдущих химических тестах (если вы можете их получить). При работе с химическими задачами не смотрите на ключ ответа, если (1) вы не смогли выработать ответ или (2) полностью запутались.Прежде чем посмотреть на ответ, попросите помощи в понимании того, как решить проблему, у напарника по учебе, помощника учителя или вашего инструктора. Перечитайте свой учебник, чтобы получить понимание и разъяснения. Если вы определились с проблемой, повторите ее на бумаге, пока не сможете исправить ее. Убедитесь, что вы понимаете каждый шаг проблемы и почему это необходимо. Как только вы сможете выяснить проблему, найдите другую проблему того же типа и решите ее. Продолжайте делать это, пока вы полностью не поймете изучаемую концепцию. Когда дело доходит до понимания и изучения химии, ничто не может заменить практический опыт, и нет лучшего способа получить этот опыт, чем посещение химических лабораторий. Используйте любую представленную возможность для работы в лаборатории. Работа над химическими задачами и проведение химических экспериментов в практической среде укрепит ваше понимание и знание химии. В карточках нет ничего нового, но они работают.Они особенно полезны для изучения химии. Химия полна научных символов, формул и словаря, которые необходимо запоминать и правильно интерпретировать. Карточки идеально подходят для систематизации и изучения химических символов, формул и словарного запаса, включая периодическую таблицу элементов. После того, как вы создадите организованный набор карточек, вы обнаружите, что запоминание должно быть проще. Использование хорошо организованной учебной группы — отличный способ изучить любой сложный предмет, включая химию.Учебные группы позволяют студентам-химикам делиться друг с другом своими мыслями, обмениваться идеями, объяснять друг другу сложные концепции, преподавать то, что они узнали, делиться заметками, готовиться к экзаменам и покрывать больше материала. Ниже приведены советы по формированию эффективных учебных групп. Изучая химию, разбейте материал на более мелкие части, которые вы сможете освоить. Хотя иногда это может показаться медленным и утомительным, на самом деле это поможет вам изучить то, что вы изучаете.Освоив одну концепцию, переходите к следующей. Вы будете удивлены, обнаружив, что после того, как вы действительно хорошо поймете несколько более мелких концепций, вам станет намного легче изучать и усваивать более крупные концепции. Изучение химии требует полной концентрации. Постоянное внимание к своей оценке отвлекает от изучения химии. Если вы сосредоточитесь на изучении химии, ваша оценка последует. Нет никаких ярлыков.В конце концов, важно то, что вы узнаете. А если выучите химию, вы получите хорошую оценку. Как и в случае с другими сложными предметами, включая биологию, прыжки на обеих ногах — ключ к успеху в изучении химии. Частичные усилия никуда не годятся. Решили, что добьетесь успеха в химии и сделаете все возможное. Ниже приведены ссылки на другие ресурсы по изучению навыков, которые мы рекомендуем студентам-химикам. История США: 15 мая, 14:00 ET Экзамены по истории будут состоять из модифицированного DBQ с 5 документами , заменяющего 60-минутный DBQ с 7 документами. У студентов будет 45 минут, чтобы прочитать и ответить на вопрос, и 5 минут, чтобы загрузить свой ответ. DBQ — лучший тест на умение и применение знаний, чем LEQ и SAQ, ориентированные на контент, а также дает меньше возможностей для обмана.Рубрика на 2020 год изменена с учетом сокращенного количества документов. Обратите внимание, что DBQ 2020 года приносит 10 баллов, а не 7 баллов за традиционный год экзамена. Хотя студентов просят предоставить меньше документов, у них также больше возможностей для оценки. Дополнительные баллы можно заработать по трем категориям: доказательства из документов, доказательства помимо документов, а также анализ и обоснование. Тезис и контекст остаются без изменений. Наша рекомендация: Сосредоточьте уроки и практикуйте на DBQ.Хотя ранее выпущенные экзамены теряют свою актуальность из-за изменения рубрик в 2017 году и теперь более короткого формата, навыки, которые студенты могут практиковать, по-прежнему будут актуальны для нового экзамена. Студенты должны попрактиковаться в написании исторически обоснованных тезисов и использовании доказательств из документов для поддержки своих аргументов, не позволяя им подавлять их ответ. Хотя документальные доказательства и точки анализа дают учащимся новые дополнительные возможности для получения баллов, обратите особое внимание на новые дополнительные баллы, которые учащиеся могут заработать за получение дополнительных доказательств помимо документов. 11 мая, 16:00 ET Экзамен правительства США будет состоять из аргументационного эссе и концептуального вопроса . Это соответствует традиционным FRQ # 4 и # 1. Традиционные правила выставления оценок для аргументационного эссе будут изменены с учетом разницы в структуре и времени: дополнительный балл будет добавлен к строке B за второе доказательство, и дополнительный балл будет добавлен к строке C для оценки рассуждение отдельно для каждого доказательства.Строка D (альтернативная перспектива) будет удалена. В содержание экзамена будут входить блоки 1-3 (основы американской демократии, взаимодействие между ветвями власти и гражданские свободы и гражданские права) и исключать блоки 4-5 (американские политические идеологии и убеждения, участие в политической жизни) Наша рекомендация: Сосредоточьте уроки на FRQ, которые будут проверяться: просмотрите содержание года, чтобы убедиться, что учащиеся понимают и готовы применить его к вопросу о концептуальном приложении.Предложите студентам попрактиковаться в написании аргументов, уделяя особое внимание разработке тезиса, устанавливающего цепочку рассуждений, и особенно включению доказательств и аргументов, которые явно связывают его с тезисом. Студентам не нужно беспокоиться о включении альтернативных точек зрения, но им следует обратить особое внимание на то, что анализ и аргументация имеют больший вес. Чем конкретнее они могут быть в своем ответе, тем более определенными будут эти моменты! Студентам НЕ нужно готовиться к сравнению дел в Верховном суде или количественному анализу, как это обычно бывает. 12 мая, 16:00 ET Экзамены по географии человека будут состоять из двух FRQ «стимул-ответ» , без учета исходного FRQ # 1. У студентов будет 25 минут, чтобы ответить на FRQ с двумя стимулами (FRQ # 3 на традиционном экзамене), а затем 15 минут, чтобы ответить на FRQ с одним стимулом (FRQ # 2 на традиционном экзамене). Экзаменационный материал будет охватывать блоки 1–5 (географическое мышление, модели населения и миграции, модели и процессы культурного, политического, аграрного / сельского землепользования).Блоки 6 и 7 (Города и городское землепользование, Промышленное и экономическое развитие) не будут охвачены. Как и на стандартном экзамене, студентов попросят описать, объяснить и применить географические концепции, процессы и модели в прикладных контекстах. Наша рекомендация: Поскольку вопросы напрямую соответствуют традиционным вопросам с ответами на стимулы, практика с прошлыми экзаменами по-прежнему будет лучшей подготовкой! Предложите студентам потренироваться делать выводы из карт и источников данных, применяя концепции, которые они усвоили в течение года. 19 мая, 14:00 ET Экзамен по психологии, рассчитанный на 40 минут, а не на стандартный 50-минутный раздел FRQ, будет очень похож на то, что вы готовили в течение всего года. Он будет состоять из двух FRQ , аналогичных по структуре традиционным вопросам. У студентов будет 25 минут, чтобы прочитать и ответить на Вопрос 1, вопрос о концептуальном приложении, 5 минут, чтобы загрузить свои ответы, затем 15 минут, чтобы прочитать и ответить на Вопрос 2, вопрос о методах исследования. Материал экзамена будет охватывать блоки 1-7 (основы, биологические основы, ощущения и восприятие, обучение, когнитивная психология, психология развития, а также мотивация, эмоции и личность) и исключать блоки 8-9 (клиническая психология, социальная психология) Наша рекомендация: Хотя структура может быть немного более жесткой, а формат более коротким, содержание и структура FRQ по психологии в основном не изменились. Практика с прошлыми выпущенными экзаменами, анализ концепций из всех охватываемых модулей и практическое применение концепций в различных сценариях помогут студентам подготовиться.Убедитесь, что учащиеся готовы анализировать данные исследований в различных формах и делать выводы на основе того, что они узнали в этом году. 18 мая, 14:00 ET Экзамен по биологии будет состоять из двух вопросов, а не из шести, изначально запланированных на 2020 год. У студентов будет 25 минут, чтобы заполнить Вопрос 1 (что составляет 65% оценки за экзамен) и 5 минут, чтобы загрузить свой ответ. После отправки они не смогут вернуться к нему .Затем они будут направлены к вопросу 2 (который составляет 35% оценки за экзамен), где у них будет 15 минут, чтобы ответить, и еще 5 минут, чтобы загрузить свой ответ. Вопрос 1 представит студентам аутентичный экспериментальный сценарий (аналогичный длинным вопросам из предыдущих экзаменов), а Вопрос 2 представит студентам аутентичный сценарий , описывающий биологическое явление с нарушением (аналогично FRQ # 4 с предыдущих экзаменов). Как и на стандартном экзамене, студенты будут оцениваться на предмет их способности описывать и объяснять биологические концепции, процессы или модели, определять и обосновывать процедуры экспериментального проектирования, анализировать данные и делать / обосновывать прогнозы и утверждения с помощью аргументов и доказательств. Содержание блоков 1-6 (химия жизни, структура / функция клеток, клеточная энергетика, клеточная коммуникация и клеточный цикл, наследственность и экспрессия / регуляция генов) являются справедливой игрой для двух экзаменационных вопросов, тогда как блоки 7 и 8 ( естественный отбор и экология) будут исключены. Наши рекомендации: Продолжайте фокусировать уроки на интерпретации и оценке экспериментальных сценариев и моделей биологического явления. Рассмотрение длинных вопросов и коротких вопросов «Анализ модели» из предыдущих экзаменов AP познакомит учащихся с типами вопросов, используемых для оценки этих навыков (например.грамм. Определить, предсказать, обосновать, объяснить, описать). Студенты должны повторить биологические явления из блоков 1-6, чтобы освежить в памяти объяснения и описание ключевых процессов. 14 мая, 14:00 ET Экзамен по химии будет состоять только из , двух длинных FRQ . У студентов будет 25 минут, чтобы заполнить Вопрос 1 (что составляет 60% оценки за экзамен) и 5 минут, чтобы загрузить свой ответ. После отправки они не смогут вернуться к нему .Затем они будут направлены к Вопросу 2 (который составляет 40% оценки за экзамен), где у них будет 15 минут на ответ и еще 5 минут на загрузку ответа. Студентам понадобится лист Периодической таблицы элементов и физических констант, и они должны быть распечатаны / готовы к доступу перед экзаменом (их можно найти в Приложении к курсу химии и описанию экзамена AP). Хотя использование калькулятора (как «четырехфункционального», так и графического / статистического) разрешено и может быть полезным, вопросы составлены таким образом, что вычисления могут выполняться без калькулятора. Оба вопроса познакомят студентов с химической системой и / или данными. Студенты будут оцениваться на предмет их способности объяснять химические явления с использованием моделей, теорий и представлений на уровне частиц и макроскопических частиц, анализировать систему с помощью количественных рассуждений, определять и объяснять экспериментальные процедуры, делать выводы из экспериментальных результатов, анализировать источники ошибок, и подкреплять претензии доказательствами и аргументацией. Содержимое блоков 1-7 (атомная структура и свойства, структура и свойства молекулярных и ионных соединений, межмолекулярные силы и свойства, химические реакции, кинетика, термодинамика и равновесие) являются справедливой игрой для двух экзаменационных вопросов, тогда как блоки 8 и 9 (Кислоты / основания и применения термодинамики) будут исключены. Наши рекомендации: Продолжать концентрировать уроки на развитии навыков с упором на основные научные практики. Студентам будет полезно изучить длинные вопросы из предыдущих экзаменов AP, чтобы понять ожидания, связанные с общими глаголами задач (например, вычислить, объяснить, определить, предсказать и т. Д.). Просмотрите химические явления, модели и теории из блоков 1-7, чтобы освежить знания учащихся об основных экспериментах, процессах и математических концепциях. 18 мая, 4 стр.м. ET [Тестирование макияжа: 3 июня, 14:00. ET] Экзамен по науке об окружающей среде будет состоять из 2 вопросов с бесплатными ответами. У студентов будет 25 минут, чтобы прочитать и ответить на вопрос 1, а затем 5 минут, чтобы загрузить свой ответ (что составляет 60% их оценки). Затем у них будет 15 минут, чтобы ответить на вопрос 2, и еще 5 минут, чтобы загрузить свой ответ (что составляет 40% их оценки). После того, как их ответ на вопрос 1 был отправлен, они не могут вернуться к нему. Вопрос 1 будет вопросом Design and Investigation , который точно отражает FRQ # 1 на прошлых экзаменах. В вопросе 2 учащимся предлагается выполнить «Анализировать экологическую проблему и предложить решение». Этот вопрос полностью соответствует FRQ # 2 прошлых экзаменов. Оба вопроса оценивают способность учащихся описывать экологические концепции, процессы и модели, анализировать данные и исследования, а также описывать экологические проблемы и / или возможные ответы. Содержимое блоков 1-7 (экосистемы, биоразнообразие, популяции, земные системы и ресурсы, земельные и водные ресурсы, энергетические ресурсы и потребление, а также загрязнение атмосферы) будет включено в экзамен, где блоки 8-9 (водные и наземные загрязнение и глобальные изменения) не будут включены. Наши рекомендации: Продолжайте сосредотачивать уроки на анализе визуальных представлений данных, а также на исследованиях, и предлагайте студентам практиковаться в описании экологических концепций и проблем, предлагая обоснованные решения. Предоставляя практику для студентов, обязательно включайте только FRQ № 1 и № 2 с прошлых экзаменов. Студенты должны повторить экологические концепции из блоков 1-7, чтобы освежить в памяти описание этих концепций и процессов. Physics 1: 14 мая, 4 с.м. ET [Тестирование макияжа: 2 июня, 14:00. ET] Экзамены по физике 1 и физике 2 будут состоять из 2 вопросов с бесплатными ответами. У студентов будет 25 минут, чтобы прочитать и ответить на вопрос 1, а затем 5 минут, чтобы загрузить свой ответ (что составляет 60% их оценки). Затем у них будет 15 минут, чтобы ответить на вопрос 2, и еще 5 минут, чтобы загрузить свой ответ (что составляет 40% их оценки). После того, как их ответ на вопрос 1 был отправлен, они не могут вернуться к нему. Вопрос 1 будет представлять собой вопрос «Качественный / количественный перевод» (QQT) , который будет оценивать способность учащихся переводить между количественным и качественным обоснованием и аргументацией. Вопрос 2 будет состоять из параграфа аргумента, краткого ответа вопроса. Этот тип вопросов оценивает способность учащихся составлять ответ длиной в абзац, который состоит из последовательного аргумента о физическом явлении, который использует информацию, представленную в вопросе, и продолжает логически объяснительно, чтобы прийти к выводу. Физика 1: Содержимое блоков 1-7 (кинематика, динамика, круговое движение и гравитация, энергия, импульс, простое гармоническое движение, крутящий момент и вращательное движение) будет включено в экзамен, где блоки 8-10 (электрический заряд электрическая сила, цепи, механические волны и звук) не будут включены. Физика 2: Содержимое блоков 1-5 (жидкости, термодинамика, электрическая сила, поле и потенциал, электрические цепи, магнетизм и электромагнитная индукция) будет включено в экзамен, где блоки 6-7 (геометрическая и физическая оптика) , а также квантовая, атомная и ядерная физика) не будут включены. Наши рекомендации: Продолжайте сосредотачивать уроки на оценке способности учащихся предоставлять качественные и количественные аргументы и обоснование определенных физических явлений, а также их способности построить ответ длиной в абзац, включающий в себя обоснованный аргумент о физическом явлении. Студенты должны рассмотреть физические явления из блоков 1-7 (физика 1) или блоков 1-5 (физика 2), чтобы освежить в памяти объяснение и описание ключевых процессов. 12 мая, 2 стр.м. ET Экзамен Calculus AB будет состоять из только из двух FRQ. У студентов будет 25 минут, чтобы заполнить Вопрос 1 (60% баллов за экзамен), и пять минут, чтобы загрузить свой ответ. Затем у них будет 15 минут, чтобы заполнить Вопрос 2 (40% баллов за экзамен), и пять минут, чтобы загрузить свой ответ. Они не могут вернуться к вопросу 1 после того, как перешли к вопросу 2! Каждый вопрос оценивает навыки, приобретенные в двух или более разделах 1-7: пределы и непрерывность, дифференциация [определение и свойства, функции, контекстные и аналитические приложения], интеграция и накопление изменений и дифференциальные уравнения.Блок 8 (приложения интеграции) не будет включен в экзамен. Учащиеся смогут 1) напечатать свои ответы, для чего им будет предоставлена математическая «подсказка по клавиатуре», или 2) загрузить фотографии своих рукописных ответов. Калькуляторы и даже калькуляторы разрешены; тем не менее, вопросы не потребуют графического калькулятора или каких-либо вычислений, кроме тех, которые реально можно сделать с помощью карандаша и бумаги. Помните, что учащимся рекомендуется отправлять непростые цифровые ответы, чтобы сэкономить время и избежать поспешных ошибок! Calculus BC также будет состоять из двух вопросов с тем же весом, распределением времени и логистикой, что и в Calculus AB.Оба вопроса 1 и 2 будут взяты из блоков 1-8 и половины блока 10 (работа с геометрическими рядами, гармоническими рядами и p-рядами, проверка чередующихся рядов на сходимость, проверка отношения на сходимость и поиск полиномиальных приближений функций Тейлора) . Блок 9 (параметрические уравнения, полярные координаты и векторнозначные функции) и оставшийся материал из блока 10 не будут допущены к экзамену. Наши рекомендации: В то время как экзамены AP Calculus не включают вопросы с несколькими вариантами ответов и четыре из шести FRQ, два оставшихся FRQ будут основаны на почти том же количестве материала, что и на обычных экзаменах.Студенты должны продолжать практиковать вопросы, которые включают навыки из нескольких блоков и областей содержания, а также вопросы, которые включают различные типы представлений (аналитические, графические, табличные и вербальные). 22 мая, 14:00 ET Укороченный экзамен по статистике AP будет состоять из только из 2 FRQ. У студентов будет 25 минут, чтобы заполнить Вопрос 1 (55% баллов за экзамен), и пять минут, чтобы загрузить свой ответ.Затем у них будет 15 минут, чтобы заполнить Вопрос 2 (45% баллов за экзамен), и пять минут, чтобы загрузить свой ответ. Они не могут вернуться к вопросу 1 после перехода к вопросу 2! Оба FRQ будут основываться на материалах, описанных в разделах 1-7: изучение данных с одной и двумя переменными, сбор данных, вероятности, случайных величин и распределений вероятностей, выборочных распределений и вывод для категориальных данных (пропорции) и количественных данных (средние). . Единицы 8-9 (вывод для категориальных и количественных данных: хи-квадрат и наклоны) в экзамен не включаются! Студенты должны загрузить и / или распечатать формуляр для статистики AP перед экзаменом.Использование калькулятора или приложения-калькулятора разрешено, но вопросы не потребуют графического калькулятора или каких-либо вычислений, помимо тех, которые реально можно сделать с помощью карандаша и бумаги. Наши рекомендации: В то время как FRQ статистики AP обычно ориентированы в первую очередь на одну категорию навыков, два FRQ на экзамене 2020 будут охватывать навыки из двух или более из следующих категорий: изучение данных, выборка и экспериментирование, вероятность и моделирование, и выводы.Несмотря на то, что на экзамене 2020 года не будет следственного задания, учащиеся по-прежнему получат пользу от практических вопросов, которые просят их сосредоточиться на нескольких областях контента или применить несколько навыков одновременно. Дополнительные сведения о предметах рассматриваются здесь. Примеры эссе, которые следуют ниже, были написаны в ответ на приглашение, которое появляется под .Комментарии оценщика, которые следуют за каждым образцом эссе, объясняют, насколько ответ соответствует критериям для этой оценки. Для более полного понимания критериев для каждого балла см. Руководство по подсчету баллов «Анализ аргумента». В опросах жители Мейсон-Сити причисляют водные виды спорта (плавание, катание на лодках и рыбалку) к своим любимым видам отдыха. Однако река Мейсон, протекающая через город, редко используется для этих целей, и департамент городского парка тратит мало из своего бюджета на содержание прибрежных рекреационных объектов.В течение многих лет жители жаловались на качество речной воды и запах реки. В ответ штат недавно объявил о планах по очистке реки Мейсон. Поэтому использование реки для водных видов спорта обязательно возрастет. По этой причине городскому правительству следует выделить больше средств в бюджете этого года на рекреационные объекты на берегу реки. Напишите ответ, в котором вы исследуете изложенные и / или неустановленные предположения аргумента. Обязательно объясните, как аргумент зависит от предположений и каковы последствия, если предположения окажутся необоснованными. Примечание: Все ответы воспроизводятся точно так, как написано, включая ошибки, орфографические ошибки и т. Д., Если таковые имеются. Хотя может быть и правда, что правительству Мейсон-Сити следовало бы выделять больше денег на рекреационные объекты на берегу реки, аргумент автора не является убедительным аргументом в пользу увеличения ресурсов, основанных на использовании реки. Легко понять, почему горожане хотят, чтобы река была чище, но этот аргумент полон дыр и предположений и, следовательно, недостаточно силен, чтобы привести к увеличению финансирования. Ссылаясь на опросы горожан, автор сообщает о любви горожан к водным видам спорта. Однако неясны масштабы и достоверность этого исследования. Например, в ходе опроса жителей можно было спросить, предпочитают ли они использовать реку для водных видов спорта или хотят увидеть построенную плотину гидроэлектростанции, которая, возможно, подтолкнула жителей к занятиям речными видами спорта. Выборка, возможно, не была репрезентативной для жителей города, и спрашивались только те жители, которые живут на реке. Опрос, возможно, состоял из 10 страниц с двумя вопросами, посвященными речным видам спорта.Мы просто не знаем. Если опрос не является полностью репрезентативным, достоверным и надежным, его нельзя использовать для эффективной поддержки аргументов автора. Кроме того, автор подразумевает, что жители не используют реку для купания, катания на лодках и рыбалки, несмотря на их явный интерес, потому что вода загрязнена и имеет неприятный запах. В то время как загрязненная, вонючая река, скорее всего, помешает занятиям речными видами спорта, конкретная связь между тем, что жители не пользуются рекой и ее текущим состоянием, эффективно не установлена.Хотя были жалобы, мы не знаем, поступали ли многочисленные жалобы от широкого круга людей или, возможно, от одного или двух человек, подавших многочисленные жалобы. Чтобы укрепить свои аргументы, автору было бы полезно провести нормированное исследование, в котором спросили бы широкий круг жителей, почему они в настоящее время не используют реку. Основываясь на предположении, что жители не пользуются рекой из-за ее качества и запаха, автор предполагает, что очистка реки приведет к увеличению использования реки.Если качество воды в реке и ее запах вызваны проблемами, которые можно очистить, это может быть правдой. Например, если ухудшение качества воды и ее запаха вызвано загрязнением заводов вдоль реки, это, вероятно, можно исправить. Но если качество и аромат являются результатом естественных минеральных отложений в воде или окружающих породах, это может быть неправдой. Некоторые водоемы источают сильный запах серы из-за географического положения местности. Это не то, что может быть затронуто очисткой.Следовательно, очистка реки может не повлиять на использование реки. Независимо от того, можно ли улучшить качество реки или нет, автор не показывает эффективно связь между качеством воды и использованием реки. Чистая, красивая и безопасная река часто увеличивает стоимость собственности города, ведет к росту туризма и доходов от тех, кто приезжает воспользоваться рекой, а также к повышению общего качества жизни жителей. По этим причинам городские власти могут принять решение об инвестировании в улучшение рекреационных объектов на берегу реки.Однако аргумент этого автора вряд ли убедит городское правительство в необходимости увеличения финансирования. Этот содержательный ответ определяет важные предположения и тщательно исследует их значение. В эссе показано, что предложение увеличить расходы на рекреационные объекты на берегу реки основано на трех сомнительных предположениях, а именно: Показывая, что каждое предположение весьма подозрительно, это эссе демонстрирует слабость всего аргумента.Например, в параграфе 2 указывается, что в опросе, возможно, не использовалась репрезентативная выборка, могло быть предложено ограниченное количество вариантов и могло быть очень мало вопросов о водных видах спорта. Параграф 3 исследует слабую связь между жалобами и ограниченным использованием реки для отдыха. Жалобы на качество воды и запах могут поступать только от нескольких человек, и даже если таких жалоб много, другие совершенно другие факторы могут иметь гораздо большее значение в сокращении использования реки.Наконец, в параграфе 4 поясняется, что определенные геологические особенности могут помешать эффективной очистке реки. Такие детали обеспечивают убедительную поддержку. Кроме того, тщательная организация гарантирует, что каждый новый пункт основывается на предыдущем. Например, обратите внимание на четкие переходы в начале абзацев 3 и 4, а также на логическую последовательность предложений внутри абзацев (особенно абзаца 4). Хотя это эссе действительно содержит незначительные ошибки, оно все же свободно передает идеи.Обратите внимание на эффективный выбор слов (например, «изобилует… предположениями» и «могло поколебать жителей»). Кроме того, предложения не просто разнообразны; они также демонстрируют умелое встраивание подчиненных элементов. Поскольку этот ответ предлагает убедительное исследование аргумента и умело передает смысл, он получает 6. Автор этого предложения об увеличении бюджета для рекреационных объектов на берегу реки Мейсон-Сити предлагает интересный аргумент, но для продвижения вперед по предложению определенно потребуется дополнительная информация и размышления.Хотя указанные корреляции логичны и вероятны, могут быть скрытые факторы, которые не позволяют городским властям направлять ресурсы на этот проект. Например, рассмотрим рейтинг жителей Мейсон-Сити. Мысль заключается в том, что такое большое внимание к водным видам спорта перейдет в практику. Но ответы на опросы вряд ли можно использовать в качестве индикаторов реального поведения. Многие опросы, проводимые после зимних каникул, показывают, что люди, которые считают упражнения и похудание первоочередными задачами.И все же не каждая профессия означает новое членство в спортзале. Даже формулировки результатов опроса остаются неоднозначными и расплывчатыми. Хотя водные виды спорта могут быть одними из любимых занятий жителей, здесь есть и другие любимые занятия. Что остается неизвестным, так это приоритеты широкой публики. Предпочитают ли они эти водные виды спорта над полем для софтбола или футбольным полем? Готовы ли они пожертвовать муниципальным полем для гольфа ради лучших прибрежных сооружений? Действительно, обзор вряд ли дает достаточно информации, чтобы определить будущее использование улучшенных средств обслуживания. Тесно связано с исследованиями смелое предположение, что более чистая река приведет к увеличению использования. Хотя вполне логично ожидать некоторого увеличения, на каком уровне люди начнут использовать реку? Чтобы ответить на этот вопрос, необходимо провести опрос, чтобы выяснить, по каким причинам наши жители используют или не используют реку. Является ли качество речной воды основным ограничивающим фактором для использования или отсутствие доков и пирсов? Люди больше интересуются водными видами спорта, чем уже занятыми развлечениями? Эти вопросы помогут городскому правительству спрогнозировать, насколько увеличится использование реки, и назначить пропорциональное увеличение в бюджет. Точно так же автор с оптимизмом смотрит на обещание государства очистить реку. Нам нужно услышать источник голосов и рассмотреть любые скрытые мотивы. Является ли это годом кампании, а планы — обещанием представителя государства? Каков график работ по очистке? Будет ли государство полностью финансировать этот проект? Мы можем представить себе нецелевое расходование средств на ремонт прибрежных сооружений только для того, чтобы наблюдать, как новые здания приходят в упадок, в то время как государство тянет за очисткой реки. Наконец, автор не рассматривает, откуда будут отвлечены эти дополнительные средства. Необходимо оценить текущую бюджетную ситуацию, чтобы определить, можно ли допустить это увеличение. В некотором смысле городские власти могут не захотеть отвлекать деньги от других ключевых проектов — от улучшения дорог до школ и образования. Автор наивно предполагает, что деньги могут просто появиться, не задумываясь о том, откуда они появятся. Анализируя все аспекты и факторы, связанные с улучшением рекреационных объектов на берегу реки, этот аргумент не оправдывает увеличения бюджета.Хотя предложение действительно указывает на возможность, требуется дополнительная информация для обоснования каких-либо действий. Каждый абзац в этом эссе для восприятия определяет и исследует неустановленное предположение, которое имеет решающее значение для аргументации. Основные обсуждаемые допущения: Поддержка в каждом абзаце продуманная и исчерпывающая.Например, в параграфе 2 указывается на расплывчатость формулировок опроса: даже если водные виды спорта входят в число излюбленных видов отдыха жителей Мейсон-Сити, другие виды спорта могут быть гораздо более популярными. Таким образом, если первое предположение окажется необоснованным, аргумент в пользу финансирования прибрежных объектов, а не футбольных полей или полей для гольфа, станет намного слабее. В пункте 4 рассматривается несколько причин, по которым планы очистки реки могут быть неудачными (планы могут быть не более чем обещаниями кампании, или финансирование может быть недостаточным).Таким образом, слабость третьего предположения опровергает аргумент о том, что рекреация на реке будет увеличиваться и что прибрежные улучшения вообще потребуются. Вместо того, чтобы отвергать каждое предположение по отдельности, этот ответ помещает их в логический порядок и рассматривает их связи. Обратите внимание на соответствующие переходы между абзацами и внутри абзацев, уточняя связи между предположениями (например, «Тесно связано с опросами…» или «Для ответа на этот вопрос требуется…»). Наряду с сильным развитием, этот ответ также демонстрирует способность к языку.Присутствуют незначительные ошибки в пунктуации, но выбор слов уместен, а предложения варьируются по образцу и длине. В ответе используется ряд риторических вопросов, но подразумеваемые ответы всегда достаточно ясны, чтобы поддержать высказанные мысли. Таким образом, ответ удовлетворяет всем требованиям для оценки 5, но его разработка недостаточно тщательна или убедительна для получения 6. Проблема с аргументом заключается в предположении, что если бы реку Мейсон очистили, люди использовали бы ее для водных видов спорта и отдыха.Это не обязательно так, поскольку люди могут причислять водные виды спорта к своим любимым видам отдыха, но это не означает, что у этих же людей есть финансовые возможности, время или оборудование для реализации этих интересов. Однако, даже если автор аргументации прав, предполагая, что река Мейсон будет больше использоваться жителями города, аргумент не говорит о том, почему рекреационным объектам нужно больше денег. Если на берегу реки Мейсон уже есть места для отдыха, зачем городу выделять больше денег на их финансирование? Если уже существующие рекреационные объекты будут больше использоваться в ближайшие годы, то они будут зарабатывать больше денег для себя, избавляя городское правительство от необходимости выделять на них больше денег. Согласно аргументу, причина, по которой люди не используют реку Мейсон для занятий водными видами спорта, заключается в запахе и качестве воды, а не в том, что условия для отдыха неприемлемы. Если городские власти выделили больше денег на объекты отдыха, значит, бюджет урезается из другого важного городского проекта. Кроме того, если предположения оказались неоправданными, и больше людей не использовали реку для отдыха, то было потрачено много денег, не только денег на рекреационные объекты, но и деньги, которые были потрачены на очистку реки, чтобы привлечь больше люди в первую очередь. Этот компетентный ответ определяет два невысказанных предположения: В параграфе 1 приводятся причины, по которым первое предположение вызывает сомнения (например, у жителей может не быть необходимого времени или денег для занятий водными видами спорта). Точно так же в параграфах 2 и 3 объясняется, что рекреационные объекты на берегу реки уже могут быть адекватными и могут, фактически, приносить дополнительный доход, если их использование увеличивается.Таким образом, ответ разработан и удовлетворительно организован, чтобы показать, как аргумент зависит от сомнительных предположений. Тем не менее, это эссе не достигает 5 баллов, потому что в нем не учтены некоторые другие невысказанные предположения (например, что исследование является надежным или что усилия по очистке реки будут успешными). Кроме того, в последнем абзаце содержатся некоторые посторонние, неподтвержденные утверждения. На самом деле у Мейсон-Сити может быть профицит бюджета, поэтому сокращения других проектов не потребуются, а очистка реки может принести другие реальные выгоды, даже если она больше не используется для водных видов спорта. Этот ответ, как правило, не содержит грамматических ошибок и ошибок в использовании и демонстрирует достаточный уровень владения языком для поддержки 4 баллов. Опросы созданы, чтобы говорить от имени людей; однако опросы не всегда говорят от имени всего сообщества. Опрос, проведенный жителями Мейсон-Сити, показал, что жители наслаждаются водными видами спорта как формой отдыха. Если это так очевидно, почему река не использовалась? Вину нельзя возлагать только на управление городского парка.Департамент городского парка может делать ровно столько, сколько они наблюдают. Реальная проблема не в том, что жители пользуются рекой, а в их стремлении к более приятному запаху и более приятному виду. Если городские власти очистят реку, запах исчезнет через несколько лет. Если бюджет будет изменен на очистку реки Мейсон, возникнут другие проблемы. Затем жители начнут жаловаться на другие проблемы в их городе, которые будут проигнорированы из-за того, что большое внимание будет уделяться реке Мейсон.Если из бюджета будет выделено больше денег на очистку реки, можно сделать предположение. Это предположение состоит в том, что бюджет для другой части обслуживания или строительства города будет использован. В дополнение к бюджету, используемому для очистки реки Мейсон, он также будет направлен на увеличение количества рекреационных объектов на берегу реки. Правительство пытается успокоить своих жителей, и можно утверждать, что роль правительства состоит в том, чтобы доставить удовольствие людям. Делается много предположений; однако правительство не может сделать предположение, что люди хотят, чтобы река была очищена, чтобы они могли использовать ее для рекреационных водных мероприятий.Правительство должно осознавать долгосрочные последствия, которые их решение окажет на денежную стоимость их бюджета. Несмотря на то, что большая часть этого эссе носит косвенный характер, в нем предлагается релевантное рассмотрение допущений аргумента. В первых предложениях упоминается сомнительное предположение (что результаты опроса надежны), но не объясняется, почему опрос мог быть ошибочным. Затем реакция смещается в сторону неактуальных вопросов — защиты городского управления парка, прогноза бюджетных проблем и проблемы удовлетворения горожан. Некоторые утверждения даже вводят необоснованные предположения, которые не являются частью первоначального аргумента (например, «Жители затем начнут жаловаться на другие проблемы» и «Это предположение состоит в том, что бюджет для другой части обслуживания города или строительства будет задействован. «). Ближе к концу ответ правильно отмечает, что городские власти не должны предполагать, что жители хотят использовать реку для отдыха. Следовательно, предложение об увеличении финансирования рекреационных объектов на берегу реки может быть неоправданным. Таким образом, формулировка в этом ответе достаточно ясна, но его рассмотрение невысказанных предположений остается ограниченным и, следовательно, получает оценку 3. Это утверждение выглядит логичным, но в нем есть несколько неправильных предложений, что не логично. Во-первых, в первом предложении этого утверждения водные виды спорта упоминаются как их любимое развлечение. Тем не менее, похоже, есть связь между первым предложением и словом, в котором упоминается, что улучшает качество речной воды и запах реки.Это неправильная причина и неправильный результат для решения проблемы. Во-вторых, в ответ на жалобы жителей государство планирует очистить реку. В результате государство ожидает увеличения количества водных видов спорта. Когда вы смотрите на два предложения, результат не соответствует причине. В-третьих, последнее утверждение — заключение. Однако, несмотря на то, что жители причисляют водные виды спорта к водным видам спорта, городские власти могут направить бюджет на другое решение. Это утверждение также является неправильной причиной и результатом. Таким образом, утверждение не логично, потому что в нем есть некоторые ошибки. Поддерживающие группы недостаточно сильны, чтобы поддержать эту проблему. Хотя это эссе кажется тщательно организованным, оно не следует указаниям по поставленной задаче. В своих расплывчатых ссылках на причинные заблуждения автор пытается логический анализ, но никогда не ссылается на какие-либо неустановленные предположения. Кроме того, несколько ошибок в грамматике и структуре предложения влияют на смысл (например,g., «Это утверждение выглядит логичным, но в нем есть несколько неправильных предложений, которые не логичны»). Поскольку этот ответ «не соответствует указаниям для поставленной задачи» и содержит ошибки в структуре предложения и логическом развитии, он получает 2 балла. В заявлении предполагается, что каждый в Мейсон-Сити наслаждается какой-то развлекательной деятельностью, что не обязательно соответствует действительности. В заявлении также предполагается, что если государство очистит реку, использование реки для водных видов спорта обязательно увеличится. Краткость этого ответа из двух предложений делает его в корне несовершенным. Предложение 1 утверждает предположение, которого фактически нет в аргументе, а предложение 2 правильно формулирует предположение, но не обсуждает его последствия. Хотя ответ может начать решать поставленную задачу, он не предлагает развития. Таким образом, он явно «чрезвычайно краток … мало свидетельств организованного реагирования» и получает оценку 1. Теория атома в девятнадцатом веке предполагала, что ядра имеют фиксированный состав. Но в 1896 году французский ученый Анри Беккерель обнаружил, что соединение урана, помещенное рядом с фотографической пластиной, создает изображение на пластине, даже если это соединение было завернуто в черную ткань.Он рассудил, что соединение урана испускает какое-то излучение, которое проходит через ткань, обнажая фотопластинку. Дальнейшие исследования показали, что излучение представляет собой комбинацию частиц и электромагнитных лучей, а его конечным источником является атомное ядро. Эти излучения в конечном итоге получили общее название радиоактивность . После случайного открытия Беккерелем радиоактивности многие выдающиеся ученые начали исследовать это новое интригующее явление.Среди них были Мария Кюри (первая женщина, получившая Нобелевскую премию, и единственный человек, получивший две Нобелевские премии по разным наукам — химии и физике), которая первая ввела термин «радиоактивность», и Эрнест Резерфорд (из известность эксперимента с золотой фольгой), который исследовал и назвал три наиболее распространенных типа излучения. В начале двадцатого века было обнаружено много радиоактивных веществ, свойства излучения были исследованы и количественно определены, и было разработано твердое понимание излучения и ядерного распада. Самопроизвольное превращение нестабильного нуклида в другой — это радиоактивный распад . Нестабильный нуклид называется родительским нуклидом ; нуклид, образующийся в результате распада, известен как дочерний нуклид . Дочерний нуклид может быть стабильным или может сам распадаться. Излучение, образующееся во время радиоактивного распада, таково, что дочерний нуклид находится ближе к полосе стабильности, чем родительский нуклид, поэтому расположение нуклида относительно полосы стабильности может служить ориентиром для определения типа распада, которому он подвергнется ( Рисунок 3.1). Рис. 3.1 Ядро урана-238 (родительский нуклид) подвергается α-распаду с образованием тория-234 (дочернего нуклида). Альфа-частица удаляет два протона (зеленый) и два нейтрона (серый) из ядра урана-238. Эксперименты Резерфорда показали, что существует три основных вида радиоактивных выбросов. Первая называется альфа-частица , что обозначается греческой буквой α.Альфа-частица состоит из двух протонов и двух нейтронов и аналогична ядру гелия. (Мы часто используем 2 4 He для представления альфа-частицы.) Она имеет заряд 2+. Когда радиоактивный атом испускает альфа-частицу, атомный номер исходного атома уменьшается на два (из-за потери двух протонов), а его массовое число уменьшается на четыре (из-за потери четырех ядерных частиц). Мы можем представить эмиссию альфа-частицы с помощью химического уравнения — например, эмиссия альфа-частицы урана-235 выглядит следующим образом: Вместо того, чтобы называть это уравнение химическим уравнением, мы называем его ядерным уравнением , чтобы подчеркнуть, что изменение происходит в атомном ядре.Как мы узнаем, что продуктом этой реакции является 90 231 Th? Мы используем закон сохранения материи , который гласит, что материя не может быть создана или разрушена. Это означает, что у нас должно быть одинаковое количество протонов и нейтронов по обе стороны ядерного уравнения. Если наше ядро урана теряет 2 протона, остается 90 протонов, идентифицируя элемент как торий. Более того, если мы потеряем четыре ядерные частицы из исходных 235, останется 231.Таким образом, мы используем вычитание, чтобы определить изотоп атома Th — в данном случае 90 231 Th. Второй тип радиоактивного излучения называется бета-частица , что обозначается греческой буквой β. Бета-частица — это электрон, выброшенный из ядра (а не из электронных оболочек вокруг ядра) и имеющий заряд -1. Мы также можем представить бета-частицу как -1 0 e.Чистый эффект испускания бета-частиц на ядро заключается в том, что нейтрон превращается в протон. Общее массовое число остается прежним, но поскольку количество протонов увеличивается на единицу, атомный номер увеличивается на единицу. Углерод-14 распадается с испусканием бета-частицы: Опять же, сумма атомных номеров одинакова с обеих сторон уравнения, как и сумма массовых чисел. (Обратите внимание, что электрону присвоен «атомный номер» –1, равный его заряду.) Третий основной тип радиоактивного излучения — это не частица, а скорее очень энергичная форма электромагнитного излучения , называемая гамма-излучением , обозначаемая греческой буквой γ.Электромагнитное излучение можно разделить на разные категории в зависимости от длины волны и энергии фотонов. Электромагнитный спектр, показанный на рисунке 3.2, показывает основные категории электромагнитного излучения. Обратите внимание, что человеческие сенсорные адаптации зрения и слуха эволюционировали для обнаружения электромагнитного излучения, при этом радиоволны имеют длину волны от 1 мм до 100 км, а видимый свет — с длинами волн от 380 до 700 нм. Технологические достижения помогли человечеству использовать другие формы электромагнитного излучения, включая рентгеновские лучи и микроволны. Рисунок 3.2 Электромагнитный спектр. Диаграмма электромагнитного спектра, показывающая различные свойства в диапазоне частот и длин волн. Изображение доступно из Википедии Некоторое электромагнитное излучение с очень короткими длинами волн достаточно активно, чтобы выбивать электроны из атомов в образце вещества и делать его электрически заряженным. Типы излучения, которые могут это сделать, называются ионизирующими излучениями .Рентгеновские лучи и гамма-лучи являются примерами ионизирующего излучения. Некоторые радиоактивные материалы при распаде излучают гамма-излучение. Например, при распаде радиоактивного технеция-99 испускается гамма-излучение. Обратите внимание, что при радиоактивном распаде, когда происходит испускание гамма-излучения, идентичность исходного материала не изменяется, поскольку физически частицы не испускаются. Иногда радиоактивный распад образца может привести к высвобождению нескольких форм радиоактивности.Например, при радиоактивном распаде радона-222 испускаются как альфа-, так и гамма-излучение, причем последнее имеет энергию 8,2 × 10 -14 Дж на одно распавшееся ядро: Может показаться, что это не такая уж большая энергия, но если бы 1 моль атомов Rn распался, энергия гамма-излучения составила бы 4,9 × 10 7 кДж! Альфа, бета и гамма-излучение обладают различной способностью проникать в материю. Относительно большая альфа-частица легко останавливается материей (хотя она может передавать значительное количество энергии веществу, с которым контактирует).Бета-частицы незначительно проникают в вещество, возможно, максимум на несколько сантиметров. Гамма-лучи могут глубоко проникать в материю и передавать большое количество энергии окружающей материи. Таблица 3.1 суммирует свойства трех основных типов радиоактивных выбросов, а Рисунок 3.3 суммирует способность каждого радиоактивного типа проникать в материю. Таблица 3.1 Три основных формы радиоактивных выбросов Рисунок 3.3 Иллюстрация относительной способности трех различных типов ионизирующего излучения проникать в твердое вещество. Типичные альфа-частицы (α) задерживаются листом бумаги, а бета-частицы (β) задерживаются алюминиевой пластиной. Гамма-излучение (γ) затухает при проникновении в свинец. Рисунок предоставлен Stannered В дополнение к трем основным типам радиоактивных частиц, перечисленным выше, были обнаружены два дополнительных, менее распространенных типа выбросов.К ним относятся эмиссии позитронов и захвата электронов . Эмиссия позитрона (β + распад ) — это испускание позитрона из ядра. Кислород-15 является примером нуклида, испускающего позитроны: Излучение позитронов наблюдается для нуклидов с низким отношением n: p. Эти нуклиды находятся ниже зоны стабильности. Распад позитрона — это превращение протона в нейтрон с испусканием позитрона.Отношение n: p увеличивается, и дочерний нуклид находится ближе к полосе стабильности, чем родительский нуклид. Позитрон имеет массу электрона, но имеет положительный заряд. Таким образом, общая масса нуклида не меняется, но атомный номер уменьшается на единицу, что вызывает изменение элементной идентичности дочернего изотопа. Захват электронов происходит, когда один из внутренних электронов атома захватывается ядром атома. Например, калий-40 подвергается электронному захвату: Захват электрона происходит, когда электрон внутренней оболочки соединяется с протоном и превращается в нейтрон.Потеря электрона внутренней оболочки оставляет вакансию, которая будет заполнена одним из внешних электронов. Когда внешний электрон падает в вакансию, он излучает энергию. В большинстве случаев излучаемая энергия будет в форме рентгеновского излучения. Как и эмиссия позитронов, захват электронов происходит для «богатых протонами» ядер, находящихся ниже зоны стабильности. Захват электрона оказывает на ядро тот же эффект, что и испускание позитрона: атомный номер уменьшается на единицу, а массовое число не изменяется.Это увеличивает соотношение n: p, и дочерний нуклид находится ближе к полосе стабильности, чем родительский нуклид. Трудно предсказать, произойдет ли захват электронов или испускание позитронов. Выбор в первую очередь обусловлен кинетическими факторами, причем тот, который требует меньшей энергии активации, является более вероятным. Рисунок 3.4 суммирует эти типы распада вместе с их уравнениями и изменениями атомных и массовых чисел. Рисунок 3.4. Краткое изложение типа, ядерного уравнения, представления и любых изменений массы или атомных номеров для различных типов распада. Иногда ядро атома распадается на более мелкие части в результате радиоактивного процесса, называемого спонтанным делением (или делением). Обычно дочерние изотопы, образующиеся при делении, представляют собой разнообразную смесь продуктов, а не определенный изотоп, как при испускании альфа- и бета-частиц. Часто при делении образуются избыточные нейтроны, которые иногда захватываются другими ядрами, что может вызвать дополнительные радиоактивные события.Уран-235 подвергается самопроизвольному делению в небольшой степени. Одна типичная реакция — , где 0 1 n нейтрон. Как и в случае любого ядерного процесса, суммы атомных номеров и массовых чисел должны быть одинаковыми с обеих сторон уравнения. Спонтанное деление обнаруживается только в крупных ядрах. Самым маленьким ядром, демонстрирующим спонтанное деление, является свинец-208. (Деление — это радиоактивный процесс, используемый на атомных электростанциях и одном из типов ядерных бомб.) Каждый радиоактивный нуклид имеет характеристический постоянный период полураспада ( t 1/2 ), время, необходимое для распада половины атомов в образце. Период полураспада изотопа позволяет нам определить, как долго образец полезного изотопа будет доступен и как долго образец нежелательного или опасного изотопа должен храниться, прежде чем он распадется до достаточно низкого уровня излучения, который больше не является допустимым. проблема. Например, кобальт-60, изотоп, излучающий гамма-лучи, используемый для лечения рака, имеет период полураспада 5,27 года (рис. 3.5). В данном источнике кобальта-60, поскольку половина ядер распадается каждые 5,27 года, как количество материала, так и интенсивность испускаемого излучения сокращаются вдвое каждые 5,27 года. Обратите внимание, что для данного вещества интенсивность излучения, которое оно производит, прямо пропорциональна скорости распада вещества и количеству вещества. Таким образом, источник кобальта-60, который используется для лечения рака, необходимо регулярно заменять, чтобы он оставался эффективным. Рисунок 3.5. Распад кобальта-60. Для кобальта-60, период полураспада которого составляет 5,27 года, 50% остается через 5,27 года (один период полураспада), 25% остается через 10,54 года (два периода полураспада), 12,5% остается через 15,81 года (три период полураспада) и так далее. Обратите внимание, что каждый период полураспада имеет одинаковую продолжительность. Поскольку каждый период полураспада радионуклида имеет одинаковый период времени, мы можем использовать следующее уравнение для расчета, сколько радиоактивного нуклида остается после прохождения любого числа (n) периодов полураспада: Вопрос: Период полураспада Zn-71 равен 2.4 минуты. Если бы в начале было 100,0 г, сколько граммов осталось бы по истечении 7,2 минут? Решение: Шаг 1. Определите количество прошедших периодов полураспада: количество периодов полураспада = прошедшее время, разделенное на период полураспада (убедитесь, что единицы времени совпадают !!) Шаг 2. Используйте уравнение «Остаточный изотоп», чтобы определить, сколько изотопа останется после того, как пройдет период полураспада, определенный на шаге 1. Существует большая разница в величине биологического воздействия неионизирующего излучения (например, света и микроволн) и ионизирующего излучения , излучения, достаточно мощного, чтобы выбивать электроны из молекул (например, α- и β-частицы, γ-лучи, рентгеновские лучи и высокоэнергетическое ультрафиолетовое излучение) (Рисунок 3.6). Рисунок 3.6. Повреждающее действие ионизирующего излучения. Низкочастотное электромагнитное излучение с меньшей энергией является неионизирующим, а электромагнитное излучение с более высокой частотой и большей энергией является ионизирующим. Энергия, поглощенная неионизирующим излучением, ускоряет движение атомов и молекул, что эквивалентно нагреву образца. Хотя биологические системы чувствительны к теплу (о чем мы можем узнать, прикоснувшись к горячей плите или проведя день на пляже на солнце), для достижения опасного уровня необходимо большое количество неионизирующего излучения.Ионизирующее излучение, однако, может вызвать гораздо более серьезные повреждения, разрывая связи или удаляя электроны в биологических молекулах, нарушая их структуру и функцию (рис. 3.7). Рисунок 3.7. Биологические эффекты ионизирующего излучения. Ионизирующее излучение может напрямую повредить биомолекулу, ионизируя ее или разрывая связи Радиация может нанести вред всему телу (соматическое повреждение) или яйцеклеткам и сперме (генетическое повреждение).Его эффекты более выражены в клетках, которые быстро воспроизводятся, таких как слизистая оболочка желудка, волосяные фолликулы, костный мозг и эмбрионы. Вот почему пациенты, проходящие лучевую терапию, часто чувствуют тошноту или тошноту в животе, теряют волосы, болят кости и т. Д., И почему необходимо соблюдать особую осторожность при прохождении лучевой терапии во время беременности. Радиоактивные изотопы имеют те же химические свойства, что и стабильные изотопы того же элемента, но излучают излучение, которое можно обнаружить.Если мы заменим один (или несколько) атом (ов) радиоизотопом (ами) в соединении, мы сможем отслеживать их, отслеживая их радиоактивные выбросы. Этот тип соединения называется радиоактивным индикатором (или радиоактивным индикатором ). Радиоизотопы используются для отслеживания биохимических реакций или для определения того, как вещество распределяется в организме. Радиоактивные индикаторы также используются во многих медицинских приложениях, включая диагностику и лечение. Они также используются во многих других отраслях промышленности для измерения износа двигателя, анализа геологических образований вокруг нефтяных скважин и многого другого. Радиоизотопы произвели революцию в медицинской практике, где они широко используются. Ежегодно в Соединенных Штатах проводится более 10 миллионов процедур ядерной медицины и более 100 миллионов испытаний ядерной медицины. Четыре типичных примера радиоактивных индикаторов, используемых в медицине, — это технеций-99, таллий-201, йод-131 и натрий-24. Поврежденные ткани сердца, печени и легких преимущественно поглощают определенные соединения технеция-99. После инъекции местоположение соединения технеция и, следовательно, поврежденной ткани может быть определено путем обнаружения γ-лучей, испускаемых изотопом Tc-99.Таллий-201 (рис. 3.8) концентрируется в здоровой сердечной ткани, поэтому два изотопа, Tc-99 и Tl-201, используются вместе для исследования сердечной ткани. Йод-131 концентрируется в щитовидной железе, печени и некоторых частях мозга. Поэтому его можно использовать для контроля зоба и лечения заболеваний щитовидной железы, таких как болезнь Грейвса, а также опухолей печени и головного мозга. Солевые растворы, содержащие соединения натрия-24, вводятся в кровоток, чтобы помочь найти препятствия для кровотока. Рисунок 3.8. Введение таллия-201 пациенту и последующее выполнение стресс-теста дает медицинским работникам возможность визуально анализировать работу сердца и кровоток. (кредит: модификация работы «Blue0ctane» / Wikimedia Commons) Радиоизотопы, используемые в медицине, обычно имеют короткий период полураспада — например, Tc-99 имеет период полураспада 6,01 часа. Это делает Tc-99 практически невозможным для хранения и чрезмерно дорогим для транспортировки, поэтому его вместо этого производят на месте.Больницы и другие медицинские учреждения используют Mo-99 (который в основном извлекается из продуктов деления U-235) для производства Tc-99. Mo-99 подвергается β-распаду с периодом полураспада 66 часов, а затем Tc-99 извлекается химически (рис. 3.9). Исходный нуклид Mo-99 является частью иона молибдата; при распаде образует ион пертехнетата. Эти два водорастворимых иона разделяют с помощью колоночной хроматографии, причем ион молибдата с более высоким зарядом адсорбируется на оксиде алюминия в колонке, а ион пертехнетата с более низким зарядом проходит через колонку в растворе.Несколько микрограммов Mo-99 могут произвести достаточно Tc-99 для проведения до 10 000 тестов. Рисунок 3.9. (a) Первый генератор Tc-99m (около 1958 г.) используется для отделения Tc-99 от Mo-99. MoO 4 2- сохраняется в матрице в столбце, тогда как TcO 4 —. проходит и собирается. (b) Tc-99 использовался в этом сканировании шеи пациента с болезнью Грейвса. Сканирование показывает расположение высоких концентраций Tc-99.(кредит а: модификация работы Министерства энергетики; кредит b: модификация работы «MBq» / Wikimedia Commons) используется излучение для диагностики и отслеживания состояния здоровья, а также для мониторинга лечения путем выявления функций частей тела пациента (рис. 3.10). Для выполнения ПЭТ-сканирования радиоизотоп, излучающий позитроны, производится в циклотроне, а затем присоединяется к веществу, которое используется исследуемой частью тела.Это «меченое» соединение, или радиоактивный индикатор , затем вводится пациенту (вводится внутривенно или вдыхается в виде газа), и то, как оно используется тканью, показывает, как функционирует этот орган или другая область тела. Рисунок 3.10. Сканер ПЭТ (а) использует излучение для получения изображения того, как функционирует часть тела пациента. Сканирование, которое он производит, можно использовать для визуализации здорового мозга (b) или для диагностики заболеваний, таких как болезнь Альцгеймера (c).(кредит а: модификация работы Йенса Мауса) Например, F-18 продуцируется протонной бомбардировкой 18 O () и включается в аналог глюкозы, называемый флудезоксиглюкозой (FDG). То, как ФДГ используется организмом, дает важную диагностическую информацию; например, поскольку рак использует глюкозу иначе, чем нормальные ткани, ФДГ может выявить рак. 18 F испускает позитроны, которые взаимодействуют с соседними электронами, создавая всплеск гамма-излучения. Эта энергия обнаруживается сканером и преобразуется в подробное трехмерное цветное изображение, которое показывает, как функционирует эта часть тела пациента.Разные уровни гамма-излучения создают различную яркость и цвета изображения, которые затем могут быть интерпретированы радиологом, чтобы выявить, что происходит. Сканирование с помощью ПЭТ может обнаружить повреждение сердца и сердечные заболевания, помочь диагностировать болезнь Альцгеймера, указать часть мозга, пораженную эпилепсией, выявить рак, показать, на какой стадии он находится и насколько он распространился, и насколько эффективны методы лечения. В отличие от магнитно-резонансной томографии и рентгеновских лучей, которые показывают только то, как что-то выглядит, большое преимущество ПЭТ-сканирования заключается в том, что они показывают, как что-то функционирует.В настоящее время ПЭТ-сканирование обычно выполняется в сочетании с компьютерной томографией. Радиоизотопы также можно использовать, обычно в более высоких дозах, чем в качестве индикатора, в качестве лечения. Лучевая терапия — это использование излучения высокой энергии для повреждения ДНК раковых клеток, которое убивает их или препятствует их делению (рис. 3.11). Больной раком может получить внешнюю лучевую терапию , доставленную аппаратом вне тела, или внутреннюю лучевую терапию (брахитерапию) с радиоактивным веществом, которое было введено в тело.Обратите внимание, что химиотерапия похожа на внутреннюю лучевую терапию тем, что средство для лечения рака вводится в организм, но отличается тем, что химиотерапия использует химические, а не радиоактивные вещества для уничтожения раковых клеток. Рисунок 3.11. На рисунке (а) показан аппарат с кобальтом-60, используемый для лечения рака. На диаграмме (b) показано, как портал машины Co-60 вращается по дуге, фокусируя излучение на целевой области (опухоль) и сводя к минимуму количество излучения, проходящего через близлежащие области. Кобальт-60 — это синтетический радиоактивный изотоп, получаемый нейтронной активацией Co-59, который затем подвергается β-распаду с образованием Ni-60 вместе с испусканием γ-излучения. Общий процесс: Общая схема распада для этого графически показана на Рисунке 3.12. Рисунок 3.12. Co-60 подвергается серии радиоактивных распадов. Γ-излучения используются для лучевой терапии. Радиоизотопы используются по-разному для изучения механизмов химических реакций у растений и животных.К ним относятся маркировка удобрений при изучении поглощения питательных веществ растениями и ростом сельскохозяйственных культур, исследования процессов пищеварения и производства молока у коров, а также исследования роста и метаболизма животных и растений. Например, радиоизотоп C-14 был использован для выяснения деталей того, как происходит фотосинтез. Общая реакция: , но этот процесс намного сложнее, он состоит из ряда этапов, на которых образуются различные органические соединения. При изучении пути этой реакции растения подвергались воздействию CO 2 , содержащего высокую концентрацию.Через регулярные промежутки времени растения анализировали, чтобы определить, какие органические соединения содержат углерод-14 и сколько присутствует каждого соединения. По временной последовательности, в которой появляются соединения, и количеству каждого из них в заданные промежутки времени, ученые узнали больше о пути реакции. Коммерческое применение радиоактивных материалов также разнообразно (рис. 3.13). Они включают определение толщины пленок и тонких металлических листов с использованием проникающей способности различных типов излучения.Дефекты в металлах, используемых для структурных целей, могут быть обнаружены с помощью высокоэнергетического гамма-излучения кобальта-60 аналогично тому, как рентгеновские лучи используются для исследования человеческого тела. В одной из форм борьбы с вредителями мухи контролируются путем стерилизации самцов мух гамма-излучением, чтобы самки, размножающиеся с ними, не давали потомства. Многие продукты сохраняются за счет радиации, которая убивает микроорганизмы, вызывающие порчу продуктов. Рисунок 3.13. Обычное коммерческое использование радиации включает (а) рентгеновское обследование багажа в аэропорту и (б) хранение продуктов питания.(кредит а: модификация работы Министерства военно-морского флота; кредит b: модификация работы Министерства сельского хозяйства США) Америций-241, α-излучатель с периодом полураспада 458 лет, в небольших количествах используется в детекторах дыма ионизационного типа (рис. 3.14). Эмиссия α от Am-241 ионизирует воздух между двумя электродными пластинами в ионизационной камере. Батарея обеспечивает потенциал, который вызывает движение ионов, создавая небольшой электрический ток. Когда дым попадает в камеру, движение ионов затрудняется, что снижает проводимость воздуха.Это вызывает заметное падение тока, вызывая тревогу. Рисунок 3.14. Внутри дымового извещателя Am-241 испускает α-частицы, которые ионизируют воздух, создавая небольшой электрический ток. Во время пожара частицы дыма препятствуют потоку ионов, уменьшая ток и вызывая тревогу. (кредит а: модификация работы «Маффет» / Wikimedia Commons) Радиоактивность определяется как испускание частиц и электромагнитных лучей из ядра нестабильного атома.В этой главе были представлены шесть типов излучения, образующегося во время ядерного распада, включая: Каждый радиоактивный нуклид имеет характеристический постоянный период полураспада ( t 1/2 ), время, необходимое для распада половины атомов в образце. Приведенное ниже уравнение можно использовать для определения того, сколько изотопа останется после прохождения заданного числа периодов полураспада Радиоактивные выбросы могут вызвать повреждение биологических систем, вызывая распад белков и ДНК.Это может привести к клеточному и генетическому повреждению и повысить риск заболевания, например, рака. Однако при использовании в небольших количествах и в контролируемых условиях радиоактивных индикаторов и методы лечения оказались революционными для области медицины. Например, Лучевая терапия — это использование высокоэнергетического излучения для повреждения ДНК раковых клеток, которое убивает их или не дает им делиться. Радиоактивные индикаторы также были очень полезны при оценке сердечных заболеваний, дисфункции щитовидной железы и других заболеваний крови. Позитронно-эмиссионная томография (ПЭТ) При сканировании используется излучение для диагностики и отслеживания состояния здоровья, а также для мониторинга лечения, показывая, как части тела пациента функционируют, а рентгеновские лучи уже давно используются для визуализации переломов костей и полостей в зубах. Если не указано иное, ресурсы для этой главы были изменены из следующих ресурсов Creative Commons: |



 Пример:
Пример:  Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции:
Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты. Задание 5: Определите среду и вещества в каждой реакции:



Leave A Comment