Строение атома серы и схема электронной оболочки
4.6
Средняя оценка: 4.6
Всего получено оценок: 265.
4.6
Средняя оценка: 4.6
Всего получено оценок: 265.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
Взаимодействие | Продукты реакции | Пример |
С металлами | Сульфиды | Cu + S → CuS |
С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
С водородом при нагревании | Сероводород | H2 + S → H2S |
С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
С фтором | Фторид серы | S + 3F2 → SF6 |
С углеродом | Сероуглерод | 2S + C → CS2 |
С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков.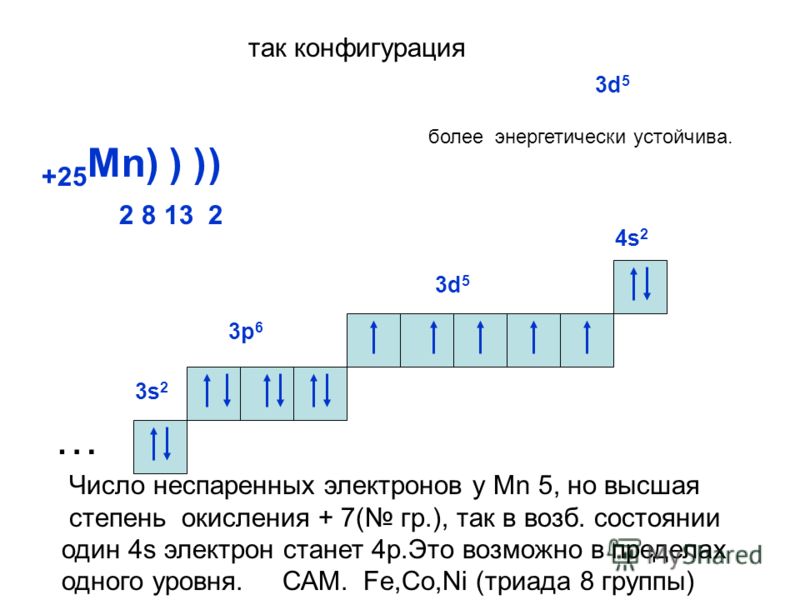 Большое количество серы накапливается в волосах.
Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 265.
А какая ваша оценка?
Строение атома
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Строение электронных оболочек атомов элементов первых четырех периодов: s- и p- и d- элементы. Электронная конфигурация атома. Основное и возбужденное состояние атома.
Электронная конфигурация атома. Основное и возбужденное состояние атома.
Для решение задания А1 нужно знать как находить
количество протонов, электронов в атоме и ионе, знать как распределяются электроны по электронным уровням и подуровням, уметь записывать электронную конфигурацию атома и иона, находить количество неспаренных электронов в атоме и ионе, знать как связана электронная конфигурация и валентность химического элемента
1. Количество электронов в атоме равно
1) | числу протонов |
2) | числу нейтронов |
3) | числу энергетических уровней |
4) | относительной атомной массе |
2 .
1) +4 2) -2 3) +2 4) -4
3. Внешний энергетический уровень атома элемента, образующего высший оксид состава ЭОз, имеет формулу
1) ns2np1 2) ns2nр2 3) nз2nр3 4) ns2nр4
4. Конфигурация внешнего электронного слоя атома серы в невозбужденном состоянии
1) 4s2 2) 3s23р6 3) 3s23р4 4) 4s24р4
5. Электронную конфигурацию 1s
1) лития
2) натрия
3) калия
4) кальция
6. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
7. Двухэлектронную внешнюю оболочку имеет ион
Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn
8. Число электронов в ионе железа Fe2+ равно
1) 54 2) 28 3) 58 4) 24
9. Электронная конфигурация 1s22s22p63s23p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2+
10. В основном состоянии три неспаренных электрона имеет атом
1) кремния
2) фосфора
3) серы
4) хлора
11. Элемент с электронной конфигурацией внешнего уровня … 3s23p3 образует водородное соединение состава
1) ЭН4 2) ЭН 3) ЭН3 4) ЭН2
12. Электронная конфигурация Is22s22p63s23p6 соответствует иону
Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl— 2) N3- 3) Br— 4) О2-
13. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr
14. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Аr 3) Ва 4) F—
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
1) ns2пр1 2) ns2пр2 3) ns2np3 4) ns2nps
16. Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
Элемент, которому соответствует высший оксид состава R2O7 имеет электронную конфигурацию внешнего уровня:
1) ns2np3 2)ns2np5 3) ns2np1 4) ns2np2
17. Высший оксид состава R2O7 образует химический элемент, в атоме которого заполнение электронами энергетических уровней соответствует ряду чисел:
1) 2, 8, 1 2) 2, 8, 7 3) 2, 8, 8, 1 4) 2, 5
18. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
1)4 и + 16 2)6 и + 32 3)6 и + 16 4)4 и + 32
19. Число валентных электронов у марганца равно
1) 1 2) 3 3) 5 4) 7
20. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F— 4) Cr2+ и Сr3+
21. Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
Высший оксид состава ЭО3 образует элемент с электронной конфигурацией внешнего электронного слоя
1) ns2np1 2) ns2np3 3) ns2np4 4) ns2np6
22. Число энергетических слоев и число электронов во внешнем энергетическом слое атомов мышьяка равны соответственно
1) | 4, 6 |
2) | 2, 5 |
3) | 3, 7 |
4) | 4, 5 |
23 Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6; 2) 1s22s22p63s1; 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
24. Иону Zn2+ отвечает электронная конфигурация:
Иону Zn2+ отвечает электронная конфигурация:
1) 1s22s22p63s23p63d84s2 2) 1s22s22p63s23p63d104s24p6 3 ) 1s22s22p63s23p63d10 4) Is22s22p63s23p64s1
25. Химическому элементу соответствует летучее водородное соединение состава RH3. Электронная конфигурация внешнего уровня этого элемента
1) | 3s23p1 |
2) | 3s23p2 |
3) | 3s23p3 |
4) | 3s23p5 |
26. Атомы серы и кислорода имеют
Атомы серы и кислорода имеют
1) | одинаковое число электронных слоев |
2) | одинаковое число электронов внешнего электронного слоя |
3) | одинаковое число протонов в ядре |
4) | одинаковые радиусы |
27. Электронная конфигурация атома фтора
1) | 1s22s22p5 |
2) | 1s22s22p4 |
3) | 1s22s22p6 |
4) | 1s22s22p3 |
28. Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
Сколько неспаренных электронов имеет атом углерода в состоянии sp3-гибридизации?
1) | 1 |
2) | 2 |
3) | 3 |
4) | 4 |
29. У атома хлора на третьем электронном уровне имеется одна s-орбиталь, три p-орбитали и пять d-орбиталей. Максимальная валентность хлора равна
1) | четырем |
2) | семи |
3) | восьми |
4) | девяти |
30. Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное соединение
Элемент, электронная конфигурация атома которого 1s22s22p63s23p2 образует водородное соединение
1) СН4 2) SiH4 3) H2O 4) H2S
31. Какую электронную конфигурацию внешнего уровня имеют атомы IVA группы?
1) ns2np5 2) ns2np2 3) ns2np4 2) ns2np6
32. Одинаковое число валентных электронов имеют атомы калия и
1) углерода 2) магния 3) фосфора 4) натрия
Ответы: 1-1, 2-2,3-4,4-3,5-3,6-2,7-3,8-4,9-2, 10-2, 11-3, 12-1, 13-1, 14-1, 15-1, 16-2, 17-2, 18-3, 19-4, 20-3, 21-3, 22-4, 23-1, 24-3, 25-4, 26-2, 27-1, 28-4, 29-2, 30-2, 31-2, 32-4.
Правила Хунда — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 659
В разделе Ауфбау обсуждалось, как электроны сначала заполняют орбитали с самой низкой энергией, а затем перемещаются на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией заполнены. Однако с этим правилом есть проблема. Конечно, 1s-орбитали должны быть заполнены до 2s-орбиталей, потому что 1s-орбитали имеют более низкое значение \(n\) и, следовательно, более низкую энергию. Как насчет заполнения трех разных 2p-орбиталей? В каком порядке они должны быть заполнены? Ответ на этот вопрос связан с правилом Хунда.
Однако с этим правилом есть проблема. Конечно, 1s-орбитали должны быть заполнены до 2s-орбиталей, потому что 1s-орбитали имеют более низкое значение \(n\) и, следовательно, более низкую энергию. Как насчет заполнения трех разных 2p-орбиталей? В каком порядке они должны быть заполнены? Ответ на этот вопрос связан с правилом Хунда.
Правило Хунда утверждает, что:
- Каждая орбиталь на подуровне занята однократно до того, как любая орбиталь занята дважды.
- Все электроны на однократно занятых орбиталях имеют одинаковый спин (чтобы максимизировать общий спин).
При назначении электронов орбиталям электрон сначала стремится заполнить все орбитали с одинаковой энергией (также называемые вырожденными орбиталями), прежде чем спариться с другим электроном на наполовину заполненной орбитали. Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя этот процесс, рассмотрите, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.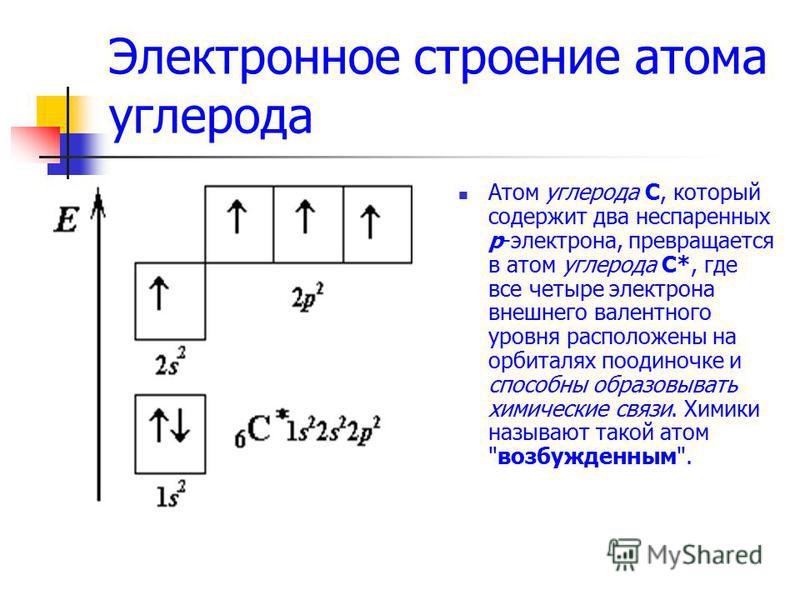
Пример \(\PageIndex{1}\): Атомы азота
Рассмотрим правильную электронную конфигурацию атома азота (Z = 7): 1s 2 2s 2 2p 3
p-орбитали заполнены наполовину; три электрона и три р-орбитали. Это связано с тем, что три электрона в подоболочке 2p сначала заполнят все пустые орбитали, прежде чем спариться с электронами на них.
Имейте в виду, что элементарный азот обычно встречается в природе в виде молекулярного азота \(\ce{N2}\), для которого требуются молекулярные орбитали вместо атомных орбиталей, как показано выше.
Пример \(\PageIndex{2}\): Атомы кислорода
Далее рассмотрим атом кислорода (Z = 8), элемент после азота в тот же период; его электронная конфигурация: 1s 2 2s 2 2p 4
У кислорода на один электрон больше, чем у азота; поскольку все орбитали заполнены наполовину, новый электрон должен спариться. Имейте в виду, что элементарный кислород обычно встречается в природе в виде молекулярного кислорода \(\ce{O_2}\), который имеет молекулярные орбитали вместо атомных орбиталей, как показано выше.
Объяснение правила Хунда
Согласно первому правилу, электроны всегда выходят на пустую орбиталь, прежде чем спариться. Электроны заряжены отрицательно и в результате отталкиваются друг от друга. Электроны имеют тенденцию минимизировать отталкивание, занимая свои собственные орбитали, а не разделяя орбиталь с другим электроном. Кроме того, квантово-механические расчеты показали, что электроны на однократно занятых орбиталях менее эффективно экранированы или экранированы от ядра. Электронное экранирование обсуждается далее в следующем разделе.
Согласно второму правилу, неспаренные электроны на однократно занятых орбиталях имеют одинаковые спины. С технической точки зрения, первый электрон на подуровне может иметь как «спин вверх», так и «спин вниз». Однако после выбора спина первого электрона на подуровне спины всех остальных электронов на этом подуровне зависят от этого первого спина. Чтобы избежать путаницы, ученые обычно изображают первый электрон и любой другой неспаренный электрон на орбитали как «спин вверх».
Пример \(\PageIndex{3}\): углерод и кислород
Рассмотрим электронную конфигурацию атомов углерода: 1s 2 2s 2 2p 2 : Два 2s-электрона будут занимать одну и ту же орбиталь, тогда как два 2p-электрона будут находиться на разных орбитах (и выровнены в одном направлении). в соответствии с правилом Хунда.
Рассмотрим также электронную конфигурацию кислорода. У кислорода 8 электронов. Электронная конфигурация может быть записана как 1s 2 2s 2 2p 4 . Чтобы нарисовать орбитальную диаграмму, начните со следующих наблюдений: первые два электрона образуют пары на 1s-орбитали; следующие два электрона объединятся в пары на 2s-орбитали. Остаются 4 электрона, которые должны быть размещены на 2р-орбиталях. Согласно правилу Хунда, все орбитали будут заняты однократно, прежде чем любая из них будет занята дважды. Следовательно, две p-орбитали получат один электрон, а одна будет иметь два электрона. Правило Хунда также гласит, что все неспаренные электроны должны иметь одинаковый спин. В соответствии с соглашением, неспаренные электроны изображены как «спин вверх», что дает (рис. 1).
В соответствии с соглашением, неспаренные электроны изображены как «спин вверх», что дает (рис. 1).
Назначение электронных конфигураций
Когда атомы вступают в контакт друг с другом, первыми взаимодействуют внешние электроны этих атомов, или валентная оболочка. Атом наименее стабилен (и, следовательно, наиболее реактивен), когда его валентная оболочка не заполнена. Валентные электроны в значительной степени ответственны за химическое поведение элемента. Элементы с одинаковым числом валентных электронов часто имеют схожие химические свойства.
Электронные конфигурации также могут предсказать стабильность. Атом наиболее стабилен (и, следовательно, неактивен), когда все его орбитали заполнены. Наиболее стабильными являются конфигурации с полными энергетическими уровнями. Эти конфигурации встречаются в благородных газах. Благородные газы — очень стабильные элементы, которые не реагируют легко ни с какими другими элементами. Конфигурации электронов могут помочь в предсказании того, как определенные элементы будут реагировать, а также химических соединений или молекул, которые будут образовывать различные элементы.
Hund’s Rules распространяется под лицензией CC BY-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Правило Хунда
Квантовые числа и электронная структура
Квантовые числа и электронная структураКвантовые числа и электронная структура
Таблица квантовых чисел | Слайд-шоу «Структура атома» | Тесты по квантовой химии
Для объяснения поведения электрона в атоме недостаточно
описать электрон просто как отрицательно заряженную частицу; его волнообразный
свойства тоже надо учитывать. Первое такое описание электрона
пришла в 1926 году с развитием волнового уравнения Шредингера. Филиал
наука, занимающаяся решением волновых уравнений, называется квантовой
механика (или волновая механика). Каждое решение волнового уравнения характеризуется
тремя целыми числами, называемыми квантовыми числами. Каждое решение соответствует
дискретной энергии и определяет область пространства вокруг ядра (называемую
орбиталь), где обычно находится электрон с такой энергией. Четвертый
квантовое число также необходимо для уникального описания уравнения.
Первое такое описание электрона
пришла в 1926 году с развитием волнового уравнения Шредингера. Филиал
наука, занимающаяся решением волновых уравнений, называется квантовой
механика (или волновая механика). Каждое решение волнового уравнения характеризуется
тремя целыми числами, называемыми квантовыми числами. Каждое решение соответствует
дискретной энергии и определяет область пространства вокруг ядра (называемую
орбиталь), где обычно находится электрон с такой энергией. Четвертый
квантовое число также необходимо для уникального описания уравнения.
Согласно квантово-механической модели разрешенные энергетические уровни
электрон состоит из одной или нескольких орбиталей, и распределение электронов
относительно ядра определяется количеством и видами энергетических уровней
что заняты. Поэтому, чтобы понять, как электроны
распределены, мы должны сначала изучить энергетические уровни. Это лучше всего удается
через обсуждение четырех квантовых чисел. Наиболее важные аспекты
каждого квантового числа представлены ниже.
Главное квантовое число, n . Электронные энергетические уровни в атоме примерно организованы в основные уровни (или оболочки), как указано по н. Значение n дает представление о положении электрона в уровень энергии относительно ядра; чем больше значение n, тем чем больше среднее расстояние электрона от ядра, тем выше его энергия. Главное квантовое число может иметь следующие значения: n = 1, 2, 3, 4, ..
Азимутальное квантовое число (также называемое вспомогательным или вторичным), л . Каждый главный энергетический уровень может быть разбит на близко расположенные
подуровни (или подуровни), как указано в l . Это квантовое число может
правильнее назвать квантовым числом формы орбиты, поскольку каждая орбиталь
в данном типе подуровня (т. е. заданное значение l ) имеет то же самое
форму «электронного облака». Например, когда l = 0, орбиталь сферическая.
Для каждого основного энергетического уровня (обозначенного цифрой n ) есть n подуровней (т. е. n значений l ): l =0,1,2,3,( № -1). Подуровни обычно обозначаются буквами. л = 0,1,2,3,4,5, подуровни обозначаются как s , p , г , ф , г ,. подуровней соответственно. Для известных элементов
значение l выше 3 (подуровень f ) не требуется.
е. n значений l ): l =0,1,2,3,( № -1). Подуровни обычно обозначаются буквами. л = 0,1,2,3,4,5, подуровни обозначаются как s , p , г , ф , г ,. подуровней соответственно. Для известных элементов
значение l выше 3 (подуровень f ) не требуется.
Два квантовых числа ( n и l ) необходимо указать конкретное энергетический подуровень.
Магнитное квантовое число, m l . Каждая орбиталь внутри тот или иной подуровень отличается своим значением м л . Это квантовое число может быть более точно названо орбитальным ориентационное квантовое число. В каждом энергетическом подуровне (обозначается l ) существует 2 l +1 возможных независимых ориентаций электронного облака. Каждая ориентация определяется значением ml и называется орбиталью.
м л = л , ( л -1), ( л -2), 0 -( л -2), -( л -1), — л или м л = 0, ±1, ±2, ±3, ± 1
Все орбитали данного подуровня имеют одинаковую энергию (они вырождены). В присутствии магнитного поля их различная ориентация заставляет их
иметь разные энергии.
В присутствии магнитного поля их различная ориентация заставляет их
иметь разные энергии.
Три квантовых числа ( n , l и м л ) есть необходимо указать конкретную орбиталь.
Спиновое квантовое число, м с . Электрон вращается
его собственная ось характеризуется м с . Есть два возможных
направления вращения: м с = +1/2 или -1/2. Поскольку спиннинг
заряд создает магнитное поле, электрон имеет магнитное поле, связанное
с этим. Два электрона на одной орбитали наиболее стабильны, когда они
противоположные спины (+1/2 и -1/2) из-за магнитного притяжения. Такие электроны
называются спаренными электронами или магнитными полями друг друга, но неспаренные
электрон может быть обнаружен магнитными измерениями. На самом деле элементы с
неспаренный электрон притягивается магнитными полями; такие элементы называются
парамагнитный. Магнитные измерения показали, что электроны распределены
среди орбиталей подуровня таким образом, чтобы получить максимальное число
неспаренные электроны с параллельными спинами (все м с значения имеют
тот же знак).
Четыре квантовых числа ( n , l , m l и m s ) необходимы для указания конкретного электрона.
Следующий список представляет собой сжатие наиболее полезной информации. относящиеся к квантовым числам и электронной структуре.
- Четыре квантовых числа:
- n = 1, 2, 3,
- л = 0, 1, 2, 3, . ( н -1)
- м л = 0, ±1, ±2, ±3, ± л
- м с = +1/2 или -1/2
Типы подуровней
QN л
Тип
Орбиты
Всего электронов
QN л Тип Орбиты Всего электронов 0
с
1
2
3 ф 7 14 1
р
3
6
4 г 9 18 2
д
5
10
5 ч 11 22 - Главный энергетический уровень n содержит: (а) n подуровней (б) n 2 орбиталей (в) 2 n 2 электронов максимум
(см.
 таблицу выше)
таблицу выше) - Подуровень l содержит: (а) 2 l +1 орбиталей (б) 2(2 l +1) электронов максимум
- В основном состоянии электроны заполняют орбитали так, что полная энергия атом сведен к минимуму.
- Энергии подуровней увеличиваются по мере: а) увеличения n: 1 с <2 с <3 с ; 2 p <3 p <4 p .. и т. д. (b) l увеличивается: 2 с <2 p ; 3 с <3 р <3 д ; 4 с <4 р <4 д <4 ф ; и т. д.
- Каждая орбиталь может содержать максимум два электрона; они должны быть в паре.
- На данном подуровне электроны распределяются по орбиталям так, как что дает максимальное количество неспаренных электронов с параллельными спинами.
- Для данного значения l форма орбиты остается прежней. Например,
орбитали с l = 0 (1 s , 2 s , 3 s и т.
 д. подуровни)
все сферические.
д. подуровни)
все сферические. - Заданное значение n обозначает определенный главный уровень энергии. Данный значения n и l обозначают определенный энергетический подуровень. Данный значения n , l и m l обозначают конкретное орбитальный. Данные значения n , l , m l , и m s обозначают конкретный электрон.
Чтобы рассмотреть определения и взаимосвязи 4 квантовых чисел, изучить эту таблицу. Тщательное изучение покажет, что таблица соответствует заявления, перечисленные выше.
Количество орбиталей | электронов в подоболочке | ||||
|---|---|---|---|---|---|
| 1 | 0 | 0 | 1с | 1 | 2 |
| 2 | 0 | 0 | 2 с | 1 | 2 |
| 2 | 1 | -1, 0, +1 | 2р | 3 | 6 |
| 3 | 0 | 0 | 3 с | 1 | 2 |
| 3 | 1 | -1, 0, +1 | 3р | 3 | 6 |
| 3 | 2 | -2, -1, 0, +1, +2 | 3д | 5 | 10 |
| 4 | 0 | 0 | 4с | 1 | 2 |
| 4 | 1 | -1, 0, +1 | 4р | 3 | 6 |
| 4 | 2 | -2, -1, 0, +1, +2 | 4д | 5 | 10 |
| 4 | 3 | -3, -2, -1, 0, +1, +2, +3 | 4ф | 7 | 14 |
Существует два распространенных метода указания расположения электронов в
атом. Если не указано иное, состояние с наименьшей энергией (основное состояние)
дано. Этими методами являются электронные конфигурации и диаграммы атомных орбит.
Если не указано иное, состояние с наименьшей энергией (основное состояние)
дано. Этими методами являются электронные конфигурации и диаграммы атомных орбит.
Электронная конфигурация показывает распределение электронов по подуровням с использованием квантовые числа n и l, где l обозначается буквой обозначение ( с , р , д , ф и т. д.). Например, обозначение 3 d 4 указывает на 4 электрона в d подуровень ( l =2) n =3 главного энергетического уровня. Ты ссылается на главу 7 в учебнике, где полное обсуждение электрона конфигурацию можно найти.
Атомная орбитальная диаграмма показывает распределение электронов в атоме с помощью диаграммы, учитывающей распределение по всем четырем квантовым числам.
- Орбиталь изображается прямоугольником, кружком или линией.
- Электрон показан стрелкой.
- Стрелки также показывают спин электрона, так что когда два электрона
находятся на одной орбитали, стрелки указывают в противоположных направлениях, чтобы представить
их противоположные вращения.

- Подуровни показаны обозначением под соответствующими орбиталями (см. примеры ниже).
На рисунке ниже атомная орбитальная диаграмма используется для иллюстрации порядок заполнения первых десяти электронов, как показано введенными числами в коробках. В качестве примера рассмотрим электронную структуру серы.
Поскольку сера имеет 16 электронов, ее электронная конфигурация 1 с 2 2 с 2 2 с 6 3 s 2 3 p 4
| Атомная орбитальная диаграмма серы с двумя неспаренными электронами: |
На приведенной ниже диаграмме показан порядок заполнения орбиты электронами. Помнить
что электроны помещаются на самую низкую доступную энергетическую орбиталь, прежде чем заполнить
на орбиту с более высокой энергией. Кроме того, вы всегда ставите один электрон
на каждой из вырожденных орбиталей определенного энергетического уровня, прежде чем положить
второй электрон на любой из орбиталей той же энергии (правило Хунда).

Leave A Comment