7 фактов, которые вы должны знать! —
By Сарнали Мукерджи
Установлено, что электронная конфигурация фтора означает расположение электронов на атомных орбиталях фтора. Найдем электронную конфигурацию фтора ниже:
Установлено, что фтор является наиболее электроотрицательный элемент в периодической таблице. Он принадлежит к группе 17 и периоду 2. Атомный номер атома фтора равен 9. Электронное расположение в оболочке выполнено в соответствии с атомным номером. Оболочки являются представителями разных энергетических уровней.
Есть несколько конкретных правил, таких как принцип Ауфбау, правило расширения Паули и правило Хунда, которым следуют для представления электронной конфигурации атомов. В случае фтора в этой статье будет обсуждаться следующее правило и диаграмма атомной орбитали.
Как написать электронную конфигурацию фтора?
В соответствии с принципом Ауфбау пошаговый процесс записи электронной конфигурации выглядит следующим образом:
- Шаг 1: На первом шаге записываются номера оболочки.

- Установлено, что один атом фтора имеет 3-электронную оболочку.
- Последовательность написания номеров оболочки будет 1, 2 и 3.
- Шаг 2: На втором шаге орбитали записываются после номеров оболочек.
- Атом фтора имеет только s- и p-орбитали. Согласно с Принцип ауфбау, способ записи орбиталей: 1s, 2s, 2p, 3s, 3p и так далее.
- Шаг 3: Далее мы должны поставить индекс с именем орбитали.
- Нижние индексы будут относиться к числу электронов на каждой орбитали.
- На первой орбитали, равной 1s, в атоме фтора находятся 2 электрона.
- На 2s-орбитали в атоме находятся 2 электрона.
- На следующей орбитали 2p в атоме фтора присутствует 5 электронов.
- Шаг 5: Написание названия благородного газа является последним шагом.
- Наконец, соответствующий благородный газ должен быть помещен перед всей электронной конфигурацией.

- Написание как Fluorine завершается написанием [He] для гелий.
Диаграмма электронной конфигурации фтора
Диаграмма электронной конфигурации фтора показывает тот факт, что две s-орбитали атома заполнены с максимальной емкостью 2 электрона, но p-орбиталь не заполнена полными 6 электронами, она имеет только 5 электронов.
Схема выглядит следующим образом:
Диаграмма электронной конфигурации фтораОбозначение электронной конфигурации фтора
Обозначение электронной конфигурации фтора находится как
[Он] 1с2 2s2 2p5
В электронной конфигурации фтора обозначения электронных оболочек используются общими числами, такими как 1, 2 и 3 и так далее. Орбитали обозначаются буквами s и p. Число электронов, равное 9, разделено на орбитали нижними индексами.Обозначение электронной конфигурации фтора
Полная электронная конфигурация фтора
Полная электронная конфигурация: фтор 1s.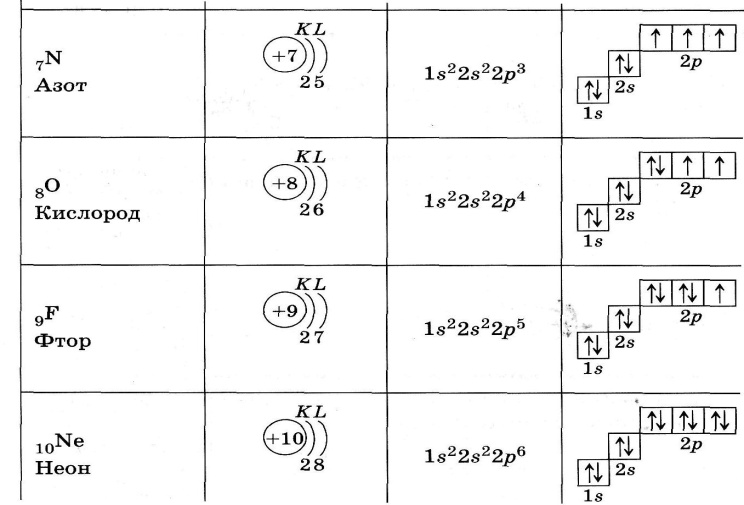 2 2s2 2p5 что означает, что
2 2s2 2p5 что означает, что
- На 1s-орбитали находится 2 электрона
- На 2s-орбитали находится 2 электрона
- На 2р-орбитали всего 5 электронов.
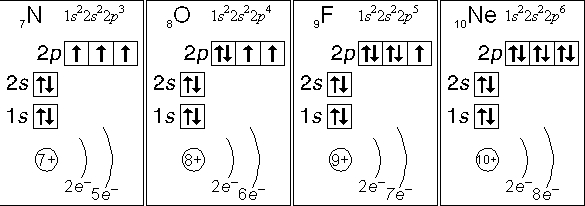
Электронная конфигурация фтора в основном состоянии
Электронные конфигурации основного состояния фтора [Он] 1с2 2s2 2p5.
Возбужденное состояние электронной конфигурации фтора
In возбужденное состояние электронная конфигурация фтора находится как [Он] 1с2 2s2 2p4 3s1. В возбужденном состоянии последний электрон 2p-орбитали переходит на следующую орбиталь, то есть 3s.
Орбитальная диаграмма фтора в основном состоянии
На орбитальной диаграмме фтора видно, что орбиталь заполнена двумя электронами, один из которых вращается по часовой стрелке, а другой — против часовой стрелки. На p-орбитали видны два спаренных электрона и один неспаренный электрон, завершающие диаграмму.
На p-орбитали видны два спаренных электрона и один неспаренный электрон, завершающие диаграмму.
Схема приведена ниже:
Орбитальная диаграмма основного состояния атома фтораЗаключение
Эта статья значительно привлекла внимание к неполной электронной конфигурации атома фтора, где один неспаренный электрон остается одиноко выигрывающим р-орбиталь. Принцип Ауфбау использовался для обозначения расположения электронов на s- и p-орбиталях, обозначая атомный номер фтора.
Подробнее о следующих конфигурациях:
Нормальное и возбужденное состояния атомов. Графическое изображение электронных формул атомов элементов — Студопедия
Поделись с друзьями:
Квантовое состояние с наименьшей энергией атома называется нормальным, или основным; остальные квантовые состояния с бóльшими уровнями энергии называются возбужденными. Электрон в нормальном состоянии связан с ядром наиболее прочно. В возбужденном состоянии атома связь электрона с ядром ослабевает (вплоть до отрыва электрона от атома).
В нормальном состоянии атом может существовать неограниченное время, в возбужденном же состоянии – ничтожные доли секунды (~10−8 с).
Возбуждение атома происходит при нагревании, электроразряде, поглощении света и т.д., и в любом случае атом поглощает лишь определенные порции – кванты энергии.
Возможные энергетические состояния атомов элементов можно наглядно представить с помощью графических формул. Обычно учитывают только валентные электроны, так как именно они обусловливают химические свойства и возможные превращения атомов элементов. Рассмотрим на конкретном примере.
Возьмем два р –элемента VII группы – фтор и хлор. Сокращенные формулы их атомов имеют вид: F …2 s 22 p 5; Cl …3 s 23 p 5. Распределим эти электроны по атомным орбиталям уровня, представляя электроны в виде стрелочек.
F … n =2; Cl … n =3
s p s p d
Как мы видим, и атому фтора, и атому хлора достаточно принять один электрон до завершения р -подуровня и приобретения устойчивой восьмиэлектронной оболочки инертного газа … ns
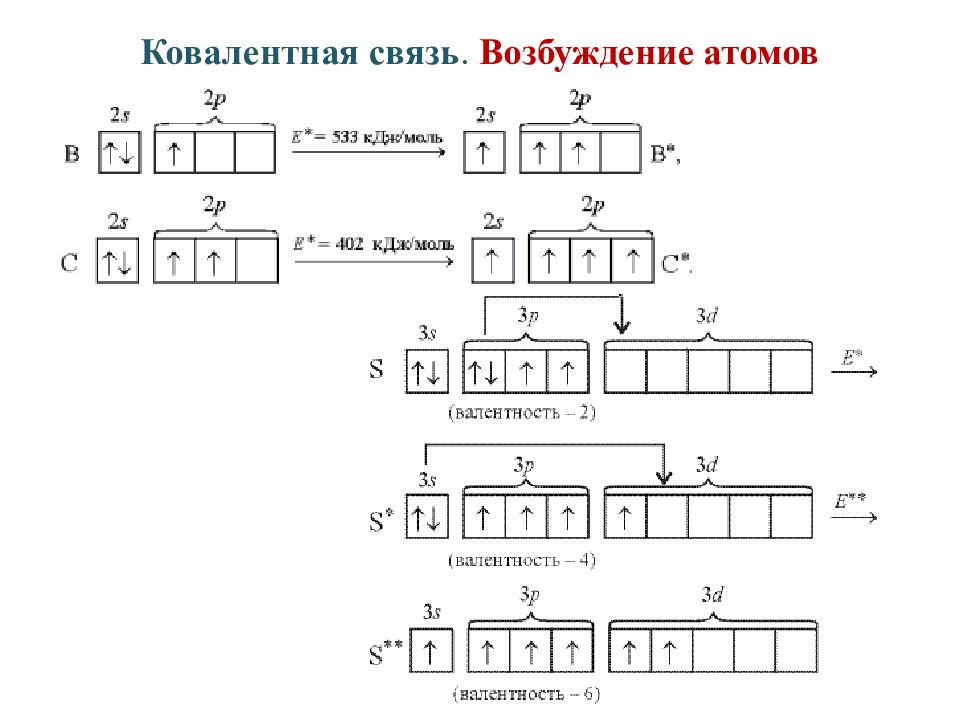 Принимая электрон, атомы приобретают степень окисления, равную −1. Степень окисления – это условный заряд атома элемента в соединении, который подсчитывают, исходя из предположения, что вещества состоят из простых ионов. Степень окисления равна числу условно принятых атомом электронов (со знаком «−») или числу условно отданных атомом электронов (со знаком «+»).
Принимая электрон, атомы приобретают степень окисления, равную −1. Степень окисления – это условный заряд атома элемента в соединении, который подсчитывают, исходя из предположения, что вещества состоят из простых ионов. Степень окисления равна числу условно принятых атомом электронов (со знаком «−») или числу условно отданных атомом электронов (со знаком «+»).В атоме хлора заполняется электронами третий уровень, в пределах которого энергетически возможен d -подуровень. Энергия его достаточно велика, поэтому заполнение его возможно лишь для элементов 4-го периода (мы это ранее объясняли). Однако, если атому хлора сообщить дополнительную энергию, он может перейти в возбужденное состояние, которое сопровождается постепенным распариванием
Cl …3 s 23 p 5Cl *…3 s 23 p 43 d 1
s p d
Cl **…3 s 23 p 33 d 2
s p d
Cl ***…3 s 13 p 33 d 3
s p d
Атомы хлора в возбужденном состоянии приобретают положительную степень окисления, равную +3, +5, +7 (высшая степень окисления), соответственно.
Валентность, обусловленная числом неспаренных электронов, также различна у этих элементов. Фтор может быть только одновалентным, в то время как хлор за счет возможного перехода в возбужденное состояние может проявлять еще валентность, равную трем, пяти и семи. Так, исходя из электронного строения атомов, мы можем объяснить различные возможности этих элементов в химических превращениях. Более подробно зависимость химических свойств элементов и их соединений от электронного строения атомов элементов разберем ниже.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
7 фактов, которые вы должны знать! —
Сарнали Мукерджи
Установлено, что электронная конфигурация фтора означает расположение электронов на атомных орбиталях фтора. Давайте найдем электронную конфигурацию фтора ниже:
Фтор оказался самым электроотрицательным элементом в периодической таблице. Он принадлежит к группе 17 и периоду 2. Атомный номер атома фтора равен 9. Электронное расположение в оболочке выполнено в соответствии с атомным номером. Оболочки являются представителями разных энергетических уровней.
Атомный номер атома фтора равен 9. Электронное расположение в оболочке выполнено в соответствии с атомным номером. Оболочки являются представителями разных энергетических уровней.
Существуют определенные правила, такие как принцип Ауфбау, правило расширения Паули и правило Хунда, которым следуют для представления электронной конфигурации атомов. В случае фтора в этой статье будет обсуждаться следующее правило и диаграмма атомной орбитали.
Как написать электронную конфигурацию фтора?
В соответствии с принципом Ауфбау пошаговый процесс записи электронной конфигурации выглядит следующим образом:
- Шаг 1: Номера оболочки записываются на первом шаге.
- Установлено, что один атом фтора имеет 3-электронную оболочку.
- Последовательность написания номеров оболочек будет 1, 2 и 3.
- Шаг 2: На втором этапе орбитали записываются после номеров оболочек.
- Атом фтора имеет только s- и p-орбитали.
 Согласно принципу Ауфбау, порядок записи орбиталей: 1s, 2s, 2p, 3s, 3p и так далее.
Согласно принципу Ауфбау, порядок записи орбиталей: 1s, 2s, 2p, 3s, 3p и так далее. - Шаг 3: Далее мы должны поставить индекс с именем орбитали.
- Нижние индексы будут относиться к числу электронов на каждой орбитали.
- На первой орбитали, равной 1s, в атоме фтора присутствуют 2 электрона
- На 2s-орбитали в атоме присутствуют 2 электрона.
- На следующей орбите 2p в атоме фтора присутствует 5 электронов
- Шаг 5: Написание названия благородного газа является последним шагом.
- Наконец, соответствующий благородный газ должен быть помещен перед всей электронной конфигурацией
- Написание фтора завершается записью [He] для гелия.
Диаграмма электронной конфигурации фтора
Диаграмма электронной конфигурации фтора предполагает тот факт, что две s-орбитали атома заполнены максимальной емкостью 2 электрона, но p-орбиталь не заполнена полными 6 электронами, это имеет только 5 электронов.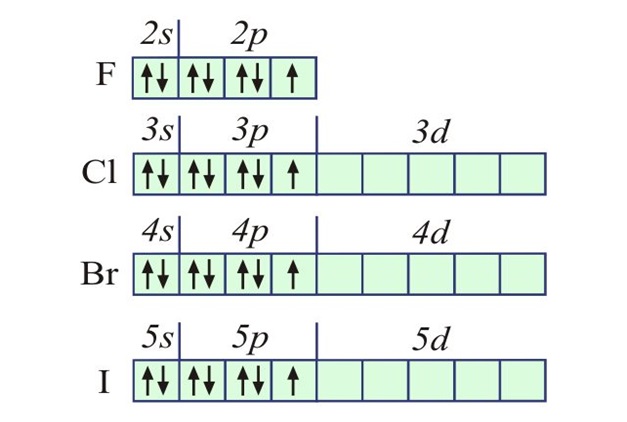
Диаграмма выглядит следующим образом:
Диаграмма электронной конфигурации фтораОбозначение электронной конфигурации фтора
Обозначение электронной конфигурации фтора находится как
900 02 [Не] 1с 2 2с 2 2p 5В электронной конфигурации фтора обозначения электронных оболочек используются общими числами, такими как 1, 2 и 3 и так далее. Орбитали обозначаются буквами s и p. число электронов равно 9делится на орбитали индексами. Обозначение электронной конфигурации фтора
Полная электронная конфигурация фтора
Полная электронная конфигурация фтора 1s 2 2s 2 2p 5 , что означает, что
- На 1s-орбитали находится 2 электрона
- На 2s-орбитали 2 электрона
- На 2p-орбитали только 5 электронов
Электронная конфигурация фтора в основном состоянии
Электронная конфигурация фтора в основном состоянии [He] 1s 2 2s 2 90 091 2р 5 .
Электронная конфигурация фтора в возбужденном состоянии
В возбужденном состоянии электронная конфигурация фтора определяется как [He] 1s 2 2s 2 2p 4 90 091 3с 1 . В возбужденном состоянии последний электрон 2p-орбитали переходит на следующую орбиталь, то есть 3s.
Орбитальная диаграмма фтора в основном состоянии
На орбитальной диаграмме фтора видно, что s-орбитали заполнены двумя электронами, один из которых вращается по часовой стрелке, а другой — против часовой стрелки. На p-орбитали видны два спаренных электрона и один неспаренный электрон, завершающие диаграмму.
Диаграмма приведена ниже:
Диаграмма основного состояния атома фтораЗаключение
Эта статья привлекла внимание к неполной электронной конфигурации атома фтора, где один неспаренный электрон остается одиноким на p-орбитали.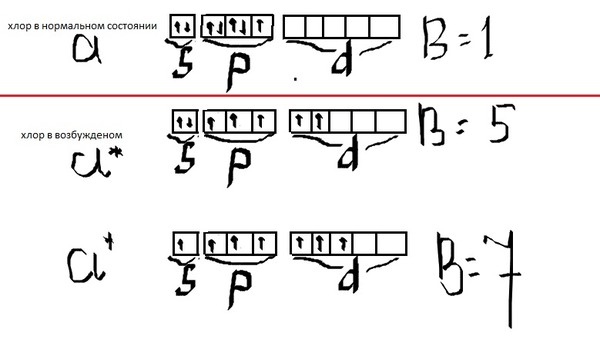 Принцип Ауфбау использовался для обозначения расположения электронов на s- и p-орбиталях, обозначая атомный номер фтора.
Принцип Ауфбау использовался для обозначения расположения электронов на s- и p-орбиталях, обозначая атомный номер фтора.
Подробнее о следующих конфигурациях:
Орбитальная диаграмма фтора, конфигурация электронов и валентный электрон
Главная > Химия > Орбитальная диаграмма фтора, конфигурация электронов и валентные электроны
Фтор имеет атомный номер 9 и принадлежит к группе 17, также известный как семейство галогенов. Он расположен в P-блоке периодической таблицы. Фтор имеет символ F и занимает «24-е место по универсальному изобилию и 13-е место по земному изобилию».
В этой статье мы подробно обсудим – Орбитальная диаграмма фтора, конфигурация электронов и валентные электроны.
Орбитальная диаграмма:- Орбитальная диаграмма представляет собой просто графическое изображение расположения электронов на орбите атома, она показывает электроны в виде стрелок, а также указывает спин электронов.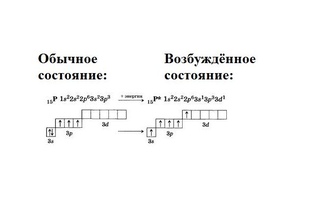
Электронная конфигурация:- Электронная конфигурация — это расположение электронов на атомных орбиталях. Он показывает электроны в цифрах. Он не показывает детали спина электронов, как орбитальная диаграмма.
Валентные электроны:- Валентные электроны — это просто самый внешний электрон атома, расположенный в самой внешней оболочке, окружающей атомное ядро. Они могут участвовать в образовании химических связей.
Как найти электронную конфигурацию фтора (F)?Электронная конфигурация фтора может быть найдена с использованием принципа Ауфбау.
Aufbau Принцип:
- Слово «Aufbau» в переводе с немецкого означает «наращивание».
- Правило Ауфбау просто дает порядок электронов, заполняющих орбиталь атома в его основном состоянии.
- В нем говорится, что орбиталь с самым низким энергетическим уровнем будет заполнена раньше, чем орбиталь с высоким энергетическим уровнем.
 Короче говоря, электроны будут заполняться на орбитали в порядке возрастания их энергии.
Короче говоря, электроны будут заполняться на орбитали в порядке возрастания их энергии. - Например, 1s-орбиталь будет сначала заполнена электронами перед 2s-орбиталью.
Просто поймите, что обычно существует четыре различных типа подоболочек — s, p, d и f.
Эти подоболочки могут содержать максимальное количество электронов на основе формулы 2(2l + 1) , где l — азимутальное квантовое число.
Значение «l» для разных подоболочек.
| Подоболочки | Значение l | Максимальное число электронов, 2(2l + 1) | Количество орбиталей в подоболочке |
| с | 0 | 2 | 1 |
| р | 1 | 6 | 3 |
| д | 2 | 9 0237 105 | |
| f | 3 | 14 | 7 |
Так Короче говоря, подоболочка s может содержать максимум 2 электрона (1 орбиталь), подоболочка p может содержать 6 электронов (3 орбитали), подоболочка d может содержать 10 электронов (5 орбиталей), а подоболочка f может содержать большинство 14 электронов (7 орбиталей).
Теперь электронная конфигурация атома может быть построена путем заполнения электронами подоболочки с более низкой энергией сначала, а затем выше, выше и выше.
Обычно правило (n + l) используется для предсказания энергетического уровня подоболочек.
n = главное квантовое число
l = азимутальное квантовое число
⇒ Чем меньше значение (n + l) для подоболочки, тем ниже ее энергия, следовательно, она будет заполнена электронами в первую очередь.
⇒ Для двух разных подоболочек с одинаковым (n + l) значением подоболочка с меньшим значением n имеет меньшую энергию.
Итак, все это основы того, как будет происходить заполнение электронами разных подоболочек, очевидно, у вас не так много времени для записи электронной конфигурации с использованием такого количества правил.
Следовательно, у нас есть диагональное правило для порядка заполнения электронами различных подоболочек с использованием принципа Ауфбау.
Итак, порядок заполнения орбиталей электронами от более низкой энергии к более высокой энергии: – 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p и так далее.
Конфигурация электронов фтора с использованием принципа Ауфбау- Атом фтора — это нейтральный атом, который имеет 9 атомных номеров, что означает, что он имеет в общей сложности 9 электронов.
- Согласно правилу Ауфбау, электроны будут сначала заполнены на 1s-орбитали, затем на 2s, затем на 2p… и так далее.
- Теперь, для электронной конфигурации фтора, первые 2 электрона будут находиться на орбите 1s, поскольку подоболочка s может содержать максимум 2 электрона.
- Следующие два электрона отправятся на 2s-орбиталь, после этого у нас останется 5 электронов, они перейдут на 2p-орбиталь, так как подоболочка p может содержать максимум 6 электронов.
- Следовательно, электронная конфигурация фтора будет 1s 2 2s 2 2p 5 .

Орбитальная диаграмма для фтораCheck – Калькулятор электронной конфигурации для подсчета электронной конфигурации для любого атома
Орбитальная диаграмма просто представляет расположение электронов на разных орбиталях атома, он использует стрелку для обозначения электронов, каждая орбиталь (одна ячейка) содержит максимум 2 электрона.
Существуют три правила построения орбитальной диаграммы атома.
(1). Принцип Ауфбау:- Это правило гласит, что орбиталь с более низкой энергией будет заполнена раньше, чем орбиталь с более высокой энергией, например – орбиталь 1s заполнится до орбитали 2s.
(2). Правило Хунда:- Это правило гласит, что каждая орбиталь данной подоболочки должна быть заполнена одним электроном, прежде чем соединить их. Это означает, что «каждая орбиталь сначала получает один электрон, прежде чем добавить второй электрон к орбитали».
(3). Принцип исключения Паули:- Это правило гласит, что никакие два электрона не могут занимать одну и ту же орбиталь с одинаковым спином. Это означает, что «один должен вращаться вверх (↑), а другой должен вращаться вниз (↓)».
Если вы понимаете приведенные выше правила, то построить орбитальную диаграмму или обозначение орбиты для фтора очень просто.
Основы орбитальной диаграммы:-
Существуют различные типы орбиталей – s, p, d и, f. Эти орбитали содержат ряд ящиков, которые могут содержать некоторое количество электронов. Давайте посмотрим.
Каждая коробка может содержать максимум 2 электрона с противоположным спином.
- S-орбиталь содержит 1 ящик, который может содержать максимум 2 электрона.
- P-орбиталь содержит 3 ячейки, которые могут содержать максимум 6 электронов.
- D-орбиталь содержит 5 ячеек, которые могут содержать максимум 10 электронов.
- F-орбиталь содержит 7 ячеек, которые могут содержать максимум 14 электронов.

Орбитальная диаграмма также будет заполнена в том же порядке, что и принцип Ауфбау. (1s < 2s < 2p < 3s…… и т. д.)
Что такое орбитальная диаграмма для фтора?Также проверьте – Калькулятор орбитальной диаграммы
. Правило исключения Паули.
- Орбитальная диаграмма фтора содержит 1s-орбиталь, 2s-орбиталь и 2p-орбиталь. 1s-орбиталь содержит 1 ящик, 2s-орбиталь также содержит 1 ящик, а 2p-орбиталь содержит 3 ящика.
- Фтор имеет в общей сложности 9 электронов, и один ящик может удерживать до двух электронов.
- Следовательно, первые два электрона пойдут по 1s-орбитали, а следующие два пойдут по 2s-орбитали, теперь у нас осталось 5 электронов.
- Эти 5 электронов отправятся на 2p-орбиталь, так как 2p-орбиталь имеет 3 ячейки, поэтому эти электроны будут заполнены по правилу Хунда. (Каждый ящик сначала получает один электрон, а затем начинает спаривание).

Основное различие между орбитальной диаграммой и электронной конфигурацией заключается в том, что на орбитальной диаграмме электроны показаны в виде стрелок, тогда как на электронной конфигурации электроны показаны в виде чисел. Кроме того, орбитальная диаграмма показывает детали спина электронов, тогда как электронная конфигурация этого не показывает.
Оба они следуют принципу Ауфбау (правилу диагонали).
Электронная конфигурация для фтора с помощью модели Бора (орбита)Читайте также:–
- Как написать конфигурацию Электрона для любых элементов?
- Как нарисовать орбитальную диаграмму атома?
Модель Бора описывает визуальное представление электронов, вращающихся вокруг малого ядра. В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее.
Эти электронные оболочки содержат определенное количество электронов, которое можно рассчитать с помощью 2n 2 формула где n представляет номер оболочки.
| Электронные оболочки | Номер оболочки (n) | Макс. число электронов (2n 2 ) |
| K | 1 | 2 |
| L | 2 | 8 |
| М | 3 | 18 |
| С | 4 | 32 |
Итак, K — это первая оболочка или орбита, которая может содержать до 2 электронов, L — это 2-я оболочка, которая может содержать до 8 электронов, M — третья оболочка, которая может содержать до 18 электронов, а N — это четвертая оболочка, которая может содержать до 32 электронов.
Фтор имеет атомный номер 9 и содержит 9 электронов. Следовательно, 2 электрона перейдут на первую оболочку (K) и 7 электронов перейдут на вторую оболочку (L).
Следовательно, электронов на оболочку для фтора 2, 7, следовательно, мы можем сказать, исходя из оболочки, электронная конфигурация атома фтора [2, 7].
Валентные электроны фтора во внешней оболочке атома. У них больше энергии, следовательно, они участвуют в большинстве химических реакций.Также проверьте – Как нарисовать Боровскую модель атома фтора
Мы можем найти валентные электроны атома, зная номер его периодической группы или его электронную конфигурацию. Оба эти способа очень просты.
Нахождение фтора Валентные электроны по номеру группыДля нейтральных атомов валентные электроны атома будут равны номеру его основной периодической группы. Однако для переходных металлов процесс нахождения валентных электронов сложен.
Теперь, чтобы определить валентный электрон для атома фтора, посмотрите в периодическую таблицу и найдите его номер группы. Номер группы можно узнать из ее столбца в периодической таблице.
Номер группы можно узнать из ее столбца в периодической таблице.
Итак, количество валентных электронов во фторе равно 7. Поскольку он принадлежит к 17-й группе (также называемой 7А) в периодической таблице.
Эта электронная конфигурация фтора показывает, что внешняя оболочка фтора имеет 7 электронов (2s 2 2p 5 ), следовательно, число валентных электронов в атоме фтора равно 7.
Также известно, что электронная конфигурация фтора на основе оболочек такова [2, 7], что означает , что два электрона присутствуют на первой оболочке, а семь электронов присутствуют на 2-й оболочке или внешней оболочке.
Следовательно, электроны, обнаруженные во 2-й оболочке атома фтора, являются его валентными электронами, поскольку это самая внешняя оболочка, также называемая валентной оболочкой.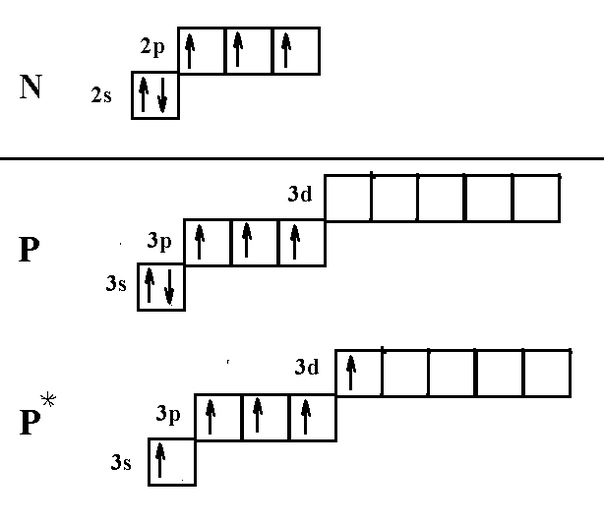
2-я оболочка или внешняя оболочка атома фтора содержит 7 электронов, следовательно, число валентных электронов в атоме фтора равно 7. электроны для любого атома
Электронная конфигурация, валентные электроны и орбитальная диаграмма фтора в табличной форме| Название атома | Фтор (F) |
| Число электронов | 9 |
| Число электронов на оболочке | [2, 7] | 90 253
| Количество валентных электронов | 7 |
| Электронная конфигурация | 1s 2 2s 2 2p 5 или [He] 2s 2 2p 5 |
| Состоит из трех орбиталей – 1s, 2s и 2p |
Читайте также:
- Орбитальная схема азота и электронная конфигурация
- Орбитальная схема кислорода и электронная конфигурация
- Орбитальная схема углерода и электронная конфигурация диаграмма и электронная конфигурация
- Орбитальная диаграмма бора и электронная конфигурация
- Орбитальная схема натрия и электронная конфигурация
- Орбитальная схема магния и электронная конфигурация
- Орбитальная диаграмма алюминия и электронная конфигурация
- Орбитальная диаграмма кремния и электронная конфигурация
- Орбитальная диаграмма фосфора и электронная конфигурация
- Орбитальная диаграмма серы и электронная конфигурация
- Орбитальная диаграмма хлора и электронная конфигурация
- Орбитальная диаграмма аргона и электронная конфигурация конфигурация
- Орбитальная схема калия и электронная конфигурация
- Орбитальная схема кальция и электронная конфигурация
- Орбитальная схема бериллия и электронная конфигурация
- Орбитальная схема лития и электронная конфигурация
| Что такое основное состояние и взрыв процитированные электронные конфигурации фтора? Существует простая разница между конфигурацией основного состояния и возбужденного состояния. Конфигурация основного состояния атома такая же, как и его обычная электронная конфигурация, в которой электроны остаются с минимально возможной энергией. Таким образом, электронная конфигурация атома фтора в основном состоянии имеет вид 1s 2 2s 2 2p 5 . Конфигурация атома в возбужденном состоянии отличается от обычной конфигурации атома, это происходит, когда электрон возбуждается и перескакивает на более высокую орбиталь. Электронная конфигурация в возбужденном состоянии для фтора: 1s 2 2s 2 2p 4 3s 1 . |
| Какова сокращенная электронная конфигурация фтора? Сокращенная электронная конфигурация атома фтора: [He] 2s 2 2p 5 . ∴ Электронная конфигурация [He] равна 1s 2 . |
| Какой элемент имеет 1s 2 2s 2 2p 5 Электро н конфигурация? Элемент с электронной конфигурацией 1s 2 2s 2 2p 5 Фтор (F), имеющий атомный номер 9. |
| Сколько валентных электронов у фтора? Атом фтора имеет 7 валентных электронов на внешней или валентной оболочке. Фтор принадлежит к 17-й группе и имеет атомный номер 9. |
| Какова орбитальная диаграмма фтора (F)? Орбитальная диаграмма фтора представлена тремя орбиталями. Орбитали 1s, 2s и 2p. Орбитальная диаграмма фтора содержит 2 электрона на 1s-орбитали, 2 электрона на 2s-орбитали и остальные пять электронов на 2p-орбитали. Орбитальная диаграмма электронной конфигурации атома фтора в основном состоянии показана ниже:0090 – ион? В общем случае мы знаем, что электронная конфигурация фтора (F) равна 1s 2 2s 2 2p 5 . Теперь, в ионах F – отрицательный заряд означает, что фтор получил один дополнительный электрон. Следовательно, чтобы записать электронную конфигурацию иона F – , мы должны добавить один электрон к конфигурации фтора (F). ∴ Результирующая электронная конфигурация для иона фторида (F – ) ion будет 1s 2 2s 2 2p 6 . Он напоминает конфигурацию ближайшего инертного газа, то есть неона. |
Свойства и применение фтора
- При стандартных условиях он выглядит как бледно-желтый двухатомный газ.
- Это чрезвычайно реактивный и самый электроотрицательный химический элемент.
- Его электроотрицательность составляет 3,98 по шкале Полинга.
- Степень окисления варьируется от -1 до 0,
- Имеет кубическую кристаллическую структуру.
- Его значение электроотрицательности по шкале Полинга составляет 3,98.

- Это самый легкий галоген, очень токсичный по своей природе.
- Его температура кипения составляет 85,03 К, а его температура плавления составляет 53,48 К.
- Его магнитный порядок является диамагнитным.
- Фтор используется в различных медицинских целях, таких как стоматология, фармацевтика, ПЭТ-сканирование, переносчики кислорода и т. д.
- Он используется для производства агрохимикатов, полимеров, газообразных хладагентов и неорганических фторидов.
Реакции фтора
Фтор является единственным галогенным элементом, образующим наибольшее количество межгалогенных соединений.
⇒ IF 5 + F 2 → IF 7
⇒ I 2 + 5F 2 → 2IF 5
⇒ Cl 2 + F 2 → 2ClF
Когда фтор реагирует с элементами группы 13, такими как бор, алюминий и галлий, он образует галогенидные соединения.
- 2Б + 3Ф 2 → 2BF 3
- 2Al + 3F 2 → 2AlF 3
- 2Ga + 3F 2 → 2GaF 3
При взаимодействии фтора с водородом образуются соединения фтора.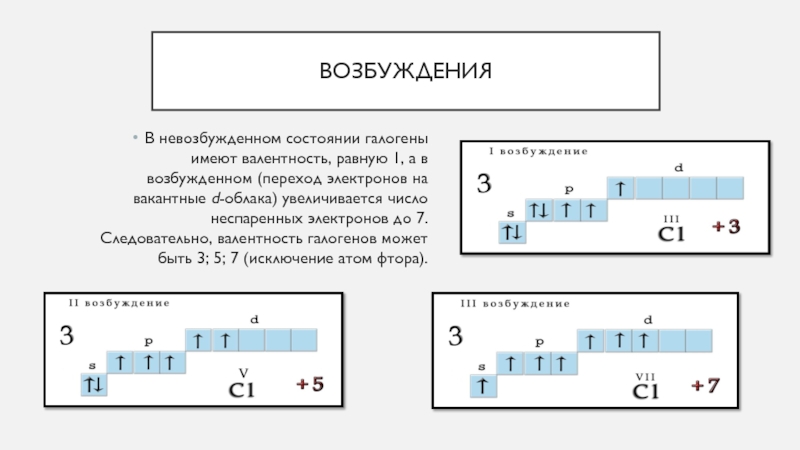
⇒ H 2 + F 2 → 2HF
Резюме- Электронная конфигурация фтора с точки зрения оболочки или орбиты [2, 7].
- Электронная конфигурация атома фтора (F) в основном состоянии равна 1с 2 2с 2 2п 5 . А для возбужденного состояния это 1s 2 2s 2 2p 4 3s 1 .
- Сокращенная электронная конфигурация для фтора: [He] 2s
- Электронная конфигурация иона фтора (F – ) иона: 1s 2 2s 2 2p 6 .
- Количество валентных электронов, доступных для атомов фтора, равно 7. Фтор расположен в 17-й группе и имеет атомный номер 9..
- Первая оболочка фтора имеет 2 электрона, а внешняя оболочка или валентная оболочка фтора имеет 7 электронов, следовательно, число валентных электронов в атоме фтора равно 7.
- Орбитальная диаграмма для фтора нарисована следующим образом.




 Согласно принципу Ауфбау, порядок записи орбиталей: 1s, 2s, 2p, 3s, 3p и так далее.
Согласно принципу Ауфбау, порядок записи орбиталей: 1s, 2s, 2p, 3s, 3p и так далее.  Короче говоря, электроны будут заполняться на орбитали в порядке возрастания их энергии.
Короче говоря, электроны будут заполняться на орбитали в порядке возрастания их энергии.




Leave A Comment