Оксид меди (II): способы получения и свойства
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Получение и химические реакции меди
Нахождение в природе.
Физические свойства.
Медь — металл красного цвета, плавится при температуре 1083°С, кипит при 2877°С. Чистая медь довольно мягка, легко поддается прокатке и вытягиванию.
Химические свойства.
Медь относится к числу малоактивных металлов. На холоду она очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой оксида, которая препятствует дальнейшему окислению меди. При нагревании медь окисляется полностью:
2Cu + O2 = 2СuО
Сухой хлор на холоду не взаимодействует с медью, однако в присутствии влаги реакция проходит довольно энергично:
При нагревании медь довольно энергично взаимодействует с серой:
Си + S = CuS.
Медь может растворятся только в кислотах-окислителях. В концентрированной серной кислоте она растворяется только при нагреваний, a в азотной — и на холоду:
Сu+ 2H2SO4 = CuSO4 + SO2 + 2Н2O,
ЗСu + 8HNO3(Разбавл.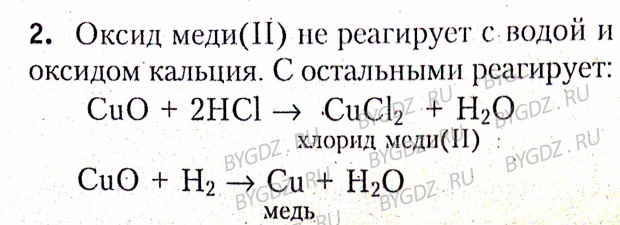 ) = 3Cu(NO3)2 + 2NO + 4Н2O,
) = 3Cu(NO3)2 + 2NO + 4Н2O,
Сu + 4HNO3(Конц .) = Cu(NO3)2+ 2NO + 2Н2O.
Получение.
4CuFeS2 + 13O2 = 4CuO + 2Fe203 + 8SO2.
Затем проводят плавку на штейн и получают сульфид меди (I). При этом к огарку прибавляют кокс и песок для образования шлака:
2CuO + FeS + С + SiO2 = Cu2S + FeSi03 + СО
или
CuO + FeO + CuS + С + SiO2 = Cu2S + FeSiO3+ CO.
Далее штейн подвергают конвертерной плавке:
9Cu2 S + 3O2 = 2Cu2 O + 2SO
2CuO2 + Cu2 S = 6Cu + SO2 .
Получаемая медь называется черновой. Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Очищают медь рафинированием. Электролитом служит раствор сульфата меди, анодом — медные болванки ,катодом — пластинка чистой меди. При пропускании электрического тока через электролит медь анода растворяется, а на катоде выделяется чистая медь.
Оксид меди
Обладает основными свойствами. Он может взаимодействовать с кислотами и кислотными оксидами:
CuO + H2SО4 = CuSО4 + Н2О,
CuO + SО
Оксид меди не растворим в воде. При нагревании оксида меди и присутствии восстановителя довольно легко происходит его восстановление:
CuO + Н2 = Сu + Н2O,
СuО + СО = Сu + СO2.
Оксид меди получают окислением меди при нагревании или прокаливанием гидроксида меди:
2Сu + O2 = 2СuО,
Cu(OH)2 = CuO + Н2O.
Оксид меди встречается в природе в продуктах выветривания некоторых медных руд. Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Он используется в производстве стекла и эмалей как зеленый и синий красители (медно-рубиновое стекло), как окислитель в органическом анализе и в медицине.
Гидроксид меди
Гидроксид меди Сu(ОН)2. Выпадает в виде осадка при действии на растворы солей меди (II) растворов щелочей (но не аммиака):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4.
При действии аммиака на соли меди (II) сначала выпадает гидроксид меди, который очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4Н2O
или
Cu(OH)2 + 4NH
Аммиакат меди окрашен в интенсивный сине-фиолетовый цвет, Поэтому он позволяет обнаружить малые количества ионов меди (П) в растворе. Эта реакция применяется в аналитической химии.
Гидроксид меди обладает очень слабо выраженными амфотерными свойствами. В кислотах он растворяется легко, в концентрированных растворах щелочей — с большим трудом. В первом случае образуются соли меди, во втором — гидроксокупраты:
Сu(ОH)2 + 2NaOH = Na2[Cu(OH)4].
Гидроксид меди может восстанавливаться до гемиоксида меди при нагревании С различными не очень сильными восстановителями: альдегидами, сахарами, гидразином, гидроксиламином и др.:
2Cu(OH)2 + R—СНО → Cu2O + R—COOH + 2H2O.
Гемиоксид, или оксид меди (I)
Гемиоксид, или оксид меди (I), Си20. Обладает только основными свойствами. Часть солей меди (I) хорошо растворима, но довольно неустойчива и легко окисляется кислородом воздуха. Устойчивыми соединениями меди (I) являются, как правило, либо нерастворимые соединения (Cu2S, Cu2O, Cu2I2), либо комплексные соединения (Cu(NH3)+2 и др.
При растворении гемиоксида меди в кислородсодержащих кислотах, например серной, образуются соли меди (II) и медь:
Cu2O + H2SO4 = CuSO4 + Сu + Н2O,
а при растворении в галогеноводородных кислотах — соли меди (I):
Cu20 + 2НС1 = 2СuС1 + Н2O.
Многие соли меди (II) хорошо растворимы в воде, но подвержены гидролизу, поэтому в растворе всегда должен быть небольшой избыток кислоты. Нерастворимыми солями меди (II) являются сульфид CuS, карбонат (основной карбонат) СuСO3• Сu(ОН)2 • 0,5Н2О, оксалат СuС2O4и фосфат Сu3(РO4)2.
Под действием восстановителей соли меди (II) в кислом растворе могут восстанавливаться до солей меди (I):
2CuSO4 + 4KI = 2K2SO4 + Cu2I2 + I2
Аммиачные растворы солей меди (I) могут взаимодействовать с ацетиленом, образуя ацетиленид меди;
СН≡СН + 2CuCl = Cu2C2 + 2НС1.
Типы химических реакций. Расчеты по химическим уравнениям — Вариант 2
ЗАДАНИЕ 1
1-й уровень. Даны схемы реакций:
1) гидроксид меди (II) → оксид меди (II) +вода;
2) хлорид бария+сульфат натрия → сульфат бария+хлорид натрия;
3) серная кислота+магний → сульфат магния+водород;
4) оксид серы (VI)+вода → серная кислота.
Укажите типы реакций, запишите одно из уравнений (по выбору).
2-й уровень. Даны схемы реакций:
1) гидроксид меди (II) → оксид меди (II)+вода;
2) хлорид бария+сульфат натрия → …;
3) серная кислота+магний → … ;
4) оксид серы (VI)+вода → серная кислота.
Укажите типы реакций, запишите одно из урвнений – реакции соединения или реакции разложения, — а также одно уравнение реакции, в котором не указаны продукты (по выбору).
3-й уровень. Даны схемы реакций:
1) гидроксид меди (II) → оксид меди (II) → +вода;
2) хлорид бария+сульфат натрия → … ;
3) серная кислота+магний → … ;
4) оксид серы (VI)+вода → серная кислота.
Запишите все уравенения реакций и укажите их типы.
ЗАДАНИЕ 2
1-й уровень. Сколько граммов осадка образуется при взаимодействии 120 г 10%-го раствора CuCl₂ с необходимым количеством KOH? Дополнительный вопрос. Рассчитайте количество вещества осадка.
2-й уровень. Какой объем водорода (н. у.) образуется при взаимодействии 240 мг Mg, содержащего 10% примесей, с необходимым количеством HCl? Рассчитайте количество вещества газа. Дополнительный вопрос. Сколько молекул водорода при этом получится?
Дополнительный вопрос. Сколько молекул водорода при этом получится?
3-й уровень. Какой объем углекислого газа (н. у.) образуется при растворении 500 кг мрамора, содержащего 30 % примесей, с необходимым количеством HCl? Рассчитайте количество вещества газа. Дополнительный вопрос. Сколько ионов каждого вида образуется в результате реакции?
ЗАДАНИЕ 3 (ДОПОЛНИТЕЛЬНОЕ)
Запишите уравнения реакций переходов:
P P₂O₅ H₃PO₄ Na₃PO₄.
Глава 2. Химические свойства меди и ее соединений
§1. Химические свойства простого вещества (ст. ок. = 0).
а) Отношение к кислороду.
В отличие от своих соседей по подгруппе – серебра и золота, — медь непосредственно реагирует с кислородом. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
Внешне
медь при этом не меняется, так как оксид
меди (I)
как и сама медь, розового цвета. К тому
же слой оксида настолько тонок, что
пропускает свет, т.е. просвечивает.
По-иному медь окисляется при нагревании,
например, при 600-800 0C.
В первые секунды окисление идет до
оксида меди (I),
которая с поверхности переходит в оксид
меди (II)
черного цвета. Образуется двухслойное
окисное покрытие.
К тому
же слой оксида настолько тонок, что
пропускает свет, т.е. просвечивает.
По-иному медь окисляется при нагревании,
например, при 600-800 0C.
В первые секунды окисление идет до
оксида меди (I),
которая с поверхности переходит в оксид
меди (II)
черного цвета. Образуется двухслойное
окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.
Рисунок 2. Строение оксидной пленки меди.
б) Взаимодействие с водой.
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
.
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
Молекулярный
водород вытесняет металлы подгруппы
меди с большим трудом. Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Объясняется это
тем, что связь между атомами водорода
прочная и на ее разрыв затрачивается
много энергии. Реакция же идет только
с атомами водорода.
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
в) Взаимодействие с кислотами.
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют.
Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
Исключение составляет только иодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I):
2Cu + 3HI → 2H[CuI2] +H2↑
Медь так же реагирует с кислотами – окислителями, например, с азотной:
Cu
+ 4HNO3(конц. ) →
Cu(NO3)2+2NO2↑+2H2O
) →
Cu(NO3)2+2NO2↑+2H2O
3Cu + 8HNO3(разбав.) → 3Cu(NO3)2+2NO↑+4H2O
А так же с концентрированной холодной серной кислотой:
Cu + H2SO4(конц.) → CuO + SO2↑ + H2O
C горячей концентрированной серной кислотой:
Cu + 2H2SO4(конц., горячая) → CuSO4 + SO2↑ + 2H2O
C безводной серной кислотой при температуре 2000С образуется сульфат меди (I):
2Cu
+ 2H2SO4(безводн. ) 200
°C→
Cu2SO4↓
+ SO2↑
+ 2H2O
) 200
°C→
Cu2SO4↓
+ SO2↑
+ 2H2O
г) Отношение к галогенам и некоторым другим неметаллам.
Qобразования (CuCl) = 134300 кДж
Qобразования (CuCl2) = 111700 кДж
Медь
хорошо реагирует с галогенами, дает два
вида галогенидов: CuX
и CuX2..
При действии галогенов при комнатной
температуре видимых изменений не
происходит, но на поверхности вначале
образуется слой адсорбированных молекул,
а затем и тончайший слой галогенидов.
При нагревании реакция с медью происходит
очень бурно. Нагреем медную проволочку
или фольги и опустим ее в горячем виде
в банку с хлором – около меди появятся
бурые пары, состоящие из хлорида меди
(II)
CuCl2 с
примесью хлорида меди (I)
CuCl.
Реакция происходит самопроизвольно за
счет выделяющейся теплоты. Одновалентные
галогениды меди получают при взаимодействии
металлической меди с раствором галогенида
двухвалентной меди, например:
Одновалентные
галогениды меди получают при взаимодействии
металлической меди с раствором галогенида
двухвалентной меди, например:
При этом монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Медь так же достаточно легко ступает в реакции с серой и селеном при нагревании (300—400 °C):
2Cu +S→Cu2S
2Cu +Se→Cu2Se
А вот с водородом, углеродом и азотом медь не реагирует даже при высоких температурах.
д) Взаимодействие с оксидами неметаллов
Медь при нагревании может вытеснять из некоторых оксидов неметаллов (например, оксид серы (IV) и оксиды азота (II, IV)) простые вещества, образуя при этом термодинамически более устойчивый оксид меди (II):
4Cu+SO2 600-800°C →2CuO + Cu2S
4Cu+2NO2 500-600°C →4CuO + N2↑
2Cu+2NO 500-600°C →2CuO + N2↑
§2. Химические свойства одновалентной меди
(ст.ок. = +1)
Химические свойства одновалентной меди
(ст.ок. = +1)
В водных растворах ион Cu+ очень неустойчив и диспропорционирует:
Cu+↔Cu0+Cu2+
Однако медь в степени окисления (+1) может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразовния [9].
а) Оксид меди (I) Cu2O
Амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта. Исскуственно может быть получен нагреванием раствора соли меди (II) с щелочью и каким-нибудь сильным восстановителем, например, формалином или глюкозой [11]. Оксид меди(I) не реагирует с водой. Оксид меди(I) переводится в раствор концентрированной соляной кислотой с образованием хлоридного комплекса:
Cu2O+4HCl→2H[CuCl2]+ H2O
Так же растворим в концентрированном растворе аммиака и солей аммония:
Cu2O+2NH4+→2[Cu(H2O)(NH3)]+
В разбавленной серной кислоте диспропорционирует на двухвалентную медь и металлическую медь:
Cu2O+H2SO4(разбав. ) →CuSO4+Cu0↓+H2O
) →CuSO4+Cu0↓+H2O
Также оксид меди(I) вступает в водных растворах в следующие реакции:
1. Медленно окисляется кислородом до гидроксида меди(II):
2Cu2O+4H2O+O2→4Cu(OH)2↓
2. Реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
Cu2O+2HГ→2CuГ↓ +H2O (Г=Cl, Br, J)
3.Восстанавливается до металлической меди типичными восстановителями, например, гидросульфитом натрия в концентрированном растворе:
2Cu2O+2NaSO3→4Cu↓+Na2SO4+H2SO4
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
1. При нагревании до 1800 °C (разложение):
При нагревании до 1800 °C (разложение):
2Cu2O —1800 °C →2Cu +O2
2. При нагревании в токе водорода, монооксида углерода, с алюминиеми прочими типичными восстановителями:
Cu2O + H2 —>250°C→2Cu +H2O
Cu2O + CO —250-300°C→2Cu +CO2
3Cu2O + 2Al —1000°C→6Cu +Al2O3
Также, при высоких температурах оксид меди(I) реагирует:
1. C аммиаком (образуется нитрид меди(I))
3Cu2O + 2NH3 —250°C→2Cu3N + 3H2O
2. С оксидами щелочных металлов:
С оксидами щелочных металлов:
Cu2O+M2O-600-800°C →2МCuO (M= Li, Na, K)
При этом образуются купраты меди (I).
Оксид меди (I) заметно реагирует с щелочами [9]:
Cu2O+2NaOH(конц.) +H2O↔2Na[Cu(OH)2]
б) Гидроксид меди (I) CuOH
Гидроксид меди(I) образует жёлтое вещество, не растворяется в воде.
Легко разлагается при нагревании или кипячении:
2CuOH → Cu2O + H2O
в) Галогениды CuF, CuСl, CuBr и CuJ
Все
эти соединения – белые кристаллические
вещества, плохо растворимые в воде, но
хорошо растворимые в избытке NH3,
цианидных ионов, тиосульфатных ионов
и иных сильных комплексообразователей. Иод образует только соединениеCu+1J.
В газообразном состоянии образуются
циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих
галогенводородных кислотах:
Иод образует только соединениеCu+1J.
В газообразном состоянии образуются
циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих
галогенводородных кислотах:
CuГ + HГ ↔ H[CuГ2] (Г=Cl, Br, J)
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4CuГ +2H2O +O2 →4Cu(OH)Г (Г=Cl, Br)
г) Прочие соединения меди (I)
1.
Ацетат меди (I) (СН3СООСu)
— соединение меди, имеет вид бесцветных
кристаллов. В воде медленно гидролизуется
до Сu2О,
на воздухе окисляется до ацетата
двухвалентной меди; Получают СН3СООСu
восстановлением (СН3СОО)2Сu
водородом или медью, сублимацией
(СН3СОО)2Сu
в вакууме или взаимодействием (NH3OH)SO4 с (СН3СОО)2Сu
в р-ре в присутствии Н3СООNH3. Вещество токсично.
Вещество токсично.
2. Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. Устойчивы во влажном состоянии. При детонации в отсутствие кислорода не образуется газообразных веществ. Под действием кислот разлагается. Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I):
С2H2 +2[Cu(NH3)2](OH) →Cu2C2↓ +2H2O+2NH3
Данная реакция используется для качественного обнаружения ацетилена.
3. Нитрид меди — неорганическое соединение с формулой Cu3N, тёмно-зелёные кристаллы.
Разлагается при нагревании:
2Cu3N —300°C→6Cu +N2↑
Бурно реагирует с кислотами:
2Cu3N +6HCl —300°C→3Cu↓ +3CuCl2 +2NH3↑
§3. Химические свойства двухвалентной меди
(ст.ок. = +2)
Химические свойства двухвалентной меди
(ст.ок. = +2)
Наиболее устойчивая степень окисления у меди и самая характерная для нее.
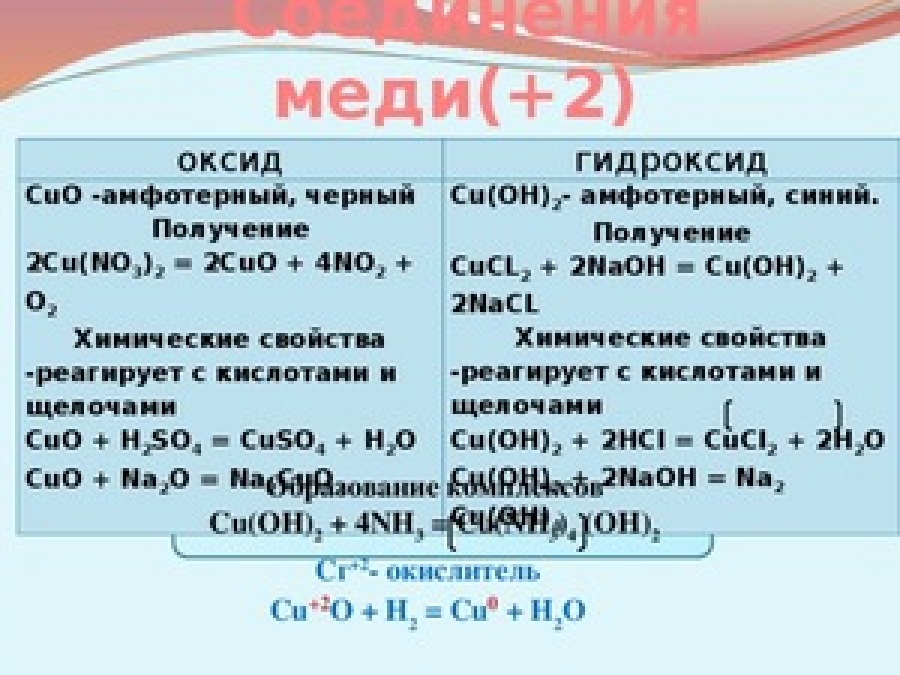
а) Оксид меди (II) CuO
CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета. Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3→Cu(NO3)2 +H2O
При сплавлении CuO со щелочами образуются купраты меди (II):
CuO+2KOH—t°→K2CuO2 +H2O
При нагревании до 1100 °C разлагается [9]:
4CuO-t°→2Cu2O + O2
б) Гидроксид меди (II) Cu(OH)2
Гидроксид
меди(II) — голубое аморфное или кристаллическое
вещество, практически не растворимое
в воде. При нагревании до 70-90 °C порошка
Cu(ОН)2 или его водных суспензий разлагается
до CuО и Н2О:
При нагревании до 70-90 °C порошка
Cu(ОН)2 или его водных суспензий разлагается
до CuО и Н2О:
Cu(OH)2 → CuO + H2O
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Гидроксид меди(II) со слабыми кислотами образует основные соли [11]. Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2+4NH4OH→[Cu(NH3)4](OH)2+4H2O
Аммиакат
меди имеет интенсивный сине-фиолетовый
цвет, поэтому его используют в аналитической
химии для определения малых количеств
ионов Cu2+ в
растворе.
в) Соли меди (II)
Простые соли меди (II) известны для большинства анионов, кроме цианида и иодида, которые при взаимодействии с катионом Cu2+ образуют ковалентные соединения меди (I), нерастворимые в воде.
Соли меди (+2), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Так, из водного раствора хлорида меди (II) ниже 150С кристаллизуется тетрагидрат, при 15-260С – тригидрат, свыше 260С – дигидрат. В водных растворах соли меди (II) в небольшой степени подвержены гидролизу, и из них часто осаждаются основные соли [9].
1. Пентагидрат сульфата меди (II) (медный купорос)
Наибольшее
практическое значение имеет CuSO4*5H2O,
называемый медным купоросом. Сухая соль
имеет голубую окраску, однако при
несильном нагревании (2000С)
она теряет кристаллизационную воду. Безводная соль белого цвета. При
дальнейшем нагревании до 7000С
она превращается в оксид меди, теряя
триоксид серы:
Безводная соль белого цвета. При
дальнейшем нагревании до 7000С
она превращается в оксид меди, теряя
триоксид серы:
CuSO4—t°→CuO+SO3↑
Готовят медный купорос растворением меди в концентрированной серной кислоте. Эта реакция описана в разделе «Химические свойства простого вещества». Медный купорос применяют при электролитическом получении меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, для получения других соединений меди [9].
2. Дигидрат хлорида меди (II).
Это темно-зеленые кристаллы, легкорастворимые в воде. Концентрированные растворы хлорида меди имеют зеленый цвет, а разбавленные – голубой. Это объясняется образованием хлоридного комплекса зеленого цвета:
Cu2++4Cl— →[CuCl4]2-
И
его дальнейшим разрушением и образованием
голубого аквакомплекса.
3. Тригидрат нитрата меди (II).
Кристаллическое вещество синего цвета. Получается при растворении меди в азотной кислоте. При нагревании кристаллы сначала теряют воду, затем разлагаются с выделением кислорода и диоксида азота, переходя в оксид меди (II):
2Cu(NO3)2—t°→2CuO+4NO2↑+O2↑
4. Карбонат гидроксомеди (II).
Карбонаты меди малоустойчивы и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди Cu2(OH)2CO3, который встречается в природе в виде минерала малахита. При нагревании легко разлагается с выделением воды, оксида углерода (IV) и оксида меди (II):
Cu2(OH)2CO3—t°→2CuO+H2O↑+CO2↑
§4. Химические свойства трехвалентной меди
(ст.ок. = +3)
Химические свойства трехвалентной меди
(ст.ок. = +3)
Эта степень окисления является наименее стабильной для меди, и поэтому соединения меди (III) являются скорее исключениями, чем «правилами». Тем не менее, некоторые соединения трехвалентной меди существуют.
а) Оксид меди (III) Cu2O3
Это кристаллическое вещество, темно-гранатового цвета. Не растворяется в воде.
Получается окислением гидроксида меди(II) пероксодисульфатом калия в щелочной среде при отрицательных температурах:
2Cu(OH)2 +K2S2O8+2KOH —-20°C→Cu2O3↓+2K2SO4+3H2O
Это вещество разлагается при температуре 4000С:
Cu2O3—t°→2CuO+O2↑
Окисид
меди (III)
– сильный окислитель. При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора [10]:
При взаимодействии
с хлороводородом хлор восстанавливается
до свободного хлора [10]:
Cu2O3+6HCl—t°→2CuCl2+Cl2↑+3H2O
б) Купраты меди (Ш)
Это черные или синие вещества, в воде не устойчивы, диамагнитны, анион – ленты квадратов (dsp2). Образуются при взаимодействии гидроксида меди(II) и гипохлорита щелочного металла в щелочной среде [10]:
2Cu(OH)2 + МClO + 2NaOH→2МCuO3 +NaCl +3H2O (M=Na—Cs)
в) Калия гексафторкупрат(III)
Зеленое
вещество, парамагнитно. Октаэдрическое
строение sp3d2.
Комплекс фторида меди CuF3,
который в свободном состоянии разлагается
при -600С.
Образуется нагреванием смеси хлоридов
калия и меди в атмосфере фтора:
Октаэдрическое
строение sp3d2.
Комплекс фторида меди CuF3,
который в свободном состоянии разлагается
при -600С.
Образуется нагреванием смеси хлоридов
калия и меди в атмосфере фтора:
3KCl + CuCl + 3F2 → K3[CuF6] + 2Cl2
Разлагает воду с образованием свободного фтора.
§5. Соединения меди в степени окисления (+4)
Пока науке известно лишь одно вещество, где медь в степени окисления +4, это гексафторкупрат(IV) цезия – Cs2Cu+4F6 — оранжевое кристаллическое вещество, стабильное в стеклянных ампулах при 00С. Бурно реагирует с водой. Получается фторированием при высоком давлении и температуре смеси хлоридов цезия и меди [10]:
CuCl2 +2CsCl +3F2 —t° р→ Cs2CuF6 +2Cl2
Новости школы -Подготовка к ЕГЭ по химии.
 Часть А-4
Часть А-4Классификация химических реакций.
Скорость химической реакции
Обязательный минимум знаний
Схема 5
Классификация химических реакций
Схема 6
Классификация реакций в органической химии
гидрирования (+ Н2)
галогенирования (+ Г2)
гидрогалогенирования (+ НГ)
· Реакции присоединения
гидратации (+Н2О)
полимеризации
дегидрирования ( — Н2)
дегалогенирования (- Г2)
дегидрогалогенирования ( — НГ)
· Реакции отщепления
дегидратации ( — Н2О)
деполимеризации
· Реакции замещения
· Реакции изомеризации
Частные случаи органических реакций:
· этерификации (кислота + спирт ↔ сложный эфир + вода) и обратный процесс – гидролиз (щелочной гидролиз – омыление),
· поликонденсации (образуются полимер и низкомолекулярный продукт, часто вода)
· ОВР
Технологические процессы, часто отождествляемые с типом химической реакции:
· пиролиз (разложение органического вещества без доступа воздуха)
· крекинг (разрыв углеродной цепи под действием высокой температуры)
· конверсия (разложение органического вещества под действием перегретого водяного пара)
Скорость химической реакции
Скорость химической реакции – изменение концентрации реагирующих веществ в единицу времени:
Δ С
v = —————— (моль/л∙с)
Δ t
Таблица 5
Факторы, влияющие на скорость химической реакции
Примечание. Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для ее увеличения твердые вещества измельчают, используют «кипящий слой» и др.)
Катализаторы:
· изменяют скорость химической реакции или направление ее протекания,
· по окончании реакции остаются неизмененными качественно и количественно,
· не смещают химическое равновесие (в равной мере изменяют скорость как прямой, так и обратной реакций).
Биологические катализаторы белковой природы называются ферментами (энзимами).
Примеры тестовых заданий и
рекомендации к их выполнению
1. Взаимодействием растворов сульфата калия и хлорида бария относится к реакциям
1) замещения 2) нейтрализации 3) ионного обмена 4) соединения
Так как исходные вещества являются электролитами, то определить верный ответ несложно. Ответ 3.
Ответ 3.
2. Взаимодействие кислоты и щелочи относится к реакциям
1) соединения, окислительно-восстановительным
2) обмена, нейтрализации
3) обмена, этерификации
4) обмена, эндотермическим
Сразу исключается ответ 1. Следовательно, взаимодействие кислоты и щелочи, как двух сложных веществ, относится к реакциям обмена. Остальные ответы можно даже не анализировать в целях экономии времени. Ответ 2.
3. Взаимодействие между глицерином и высшими карбоновыми кислотами относится к реакциям
1) изомеризации
2) дегидратации
3) нейтрализации
4) этерификации
Сразу исключается ответ 1, так как в условии даны два исходных вещества. Реакция дегидратации (отщепления воды) по этой же причине не удовлетворяет требованиям задания. Реакция нейтрализации – реакция между сильной кислотой и щелочью – ни одно, ни второе исходные вещества не являются таковыми.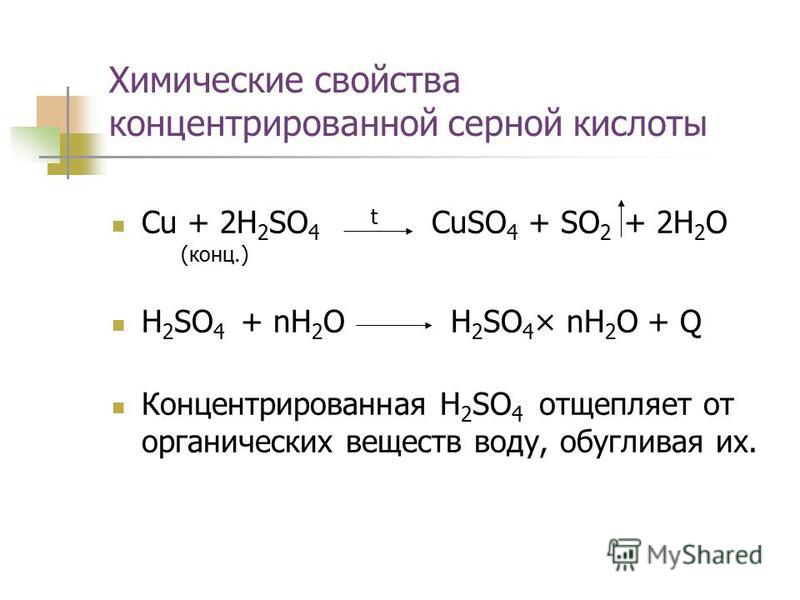 Ответ 4.
Ответ 4.
4. Соляная кислота вступает в реакцию замещения с
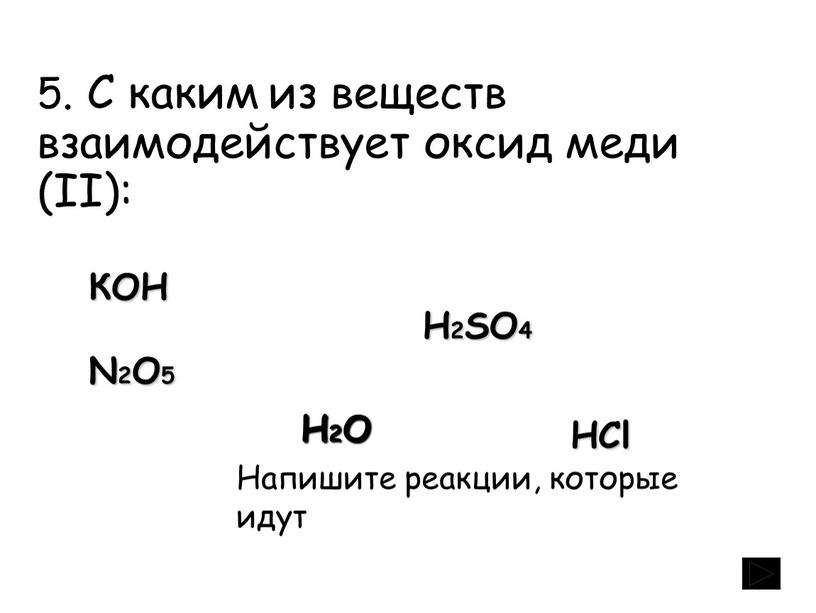
1) гидроксидом меди (II)
2) медью
3) оксидом железа (II)
4) железом
Элементарные сведения о реакции замещения как реакции простого и сложного веществ позволят исключить из числа возможных ответы 1 и 3, т.к. в них предложены сложные вещества. Ответ 2 неверен по своей химической сути – медь в ряду напряжений металлов находится после водорода. Ответ 4.
5. Реакцией замещения является взаимодействие
1) метана с бромом
2) этилена с бромом
3) ацетилена с кислородом
4) пропилена с водой
Для алканов (предельных углеводородов), родоначальником которых является метан, наиболее характерны реакции замещения с галогенами. Верный ответ – 1. Остальные ответы можно не рассматривать. Ответ 1.
6. В неорганической химии к окислительно-восстановительным реакциям относятся
В неорганической химии к окислительно-восстановительным реакциям относятся
1) реакции обмена
2) реакции гидролиза
3) реакции замещения
4) реакции нейтрализации
Реакции обмена не относятся к окислительно-восстановительным, следовательно, условию задания не отвечают задания 1, 2 и 4. Ответ 3.
7. К окислительно-восстановительным реакциям не относятся
1) реакции горения
2) реакции соединения с участием простых веществ
3) реакции разложения с участием простых веществ
4) реакции обмена
Реакции обмена не относятся к окислительно-восстановительным. Остальные ответы можно не анализировать. Ответ 4.
8. К реакциям с участием воды не относятся
1) реакции гидролиза
2) реакции гидрирования
3) реакции гидратации
4) реакции этерификации
Реакции гидролиза – это разложение веществ водой. Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
Реакции гидрирования – присоединение водорода – это и будет верный ответ. Остальные ответы можно не анализировать. Ответ 2
9. К экзотермическим реакциям не относится взаимодействие
1) оксида натрия с водой
2) фосфора с кислородом
3) оксида фосфора с водой
4) азота с кислородом
Все указанные в ответах реакции относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т.е. протекают с выделением теплоты. Одно из немногих исключений – взаимодействие азота с кислородом. Ответ 4.
10. К эндотермическим процессам относится
1) гашение извести
2) обжиг известняка
3) нейтрализация фосфорной кислоты известковым молоком
4) помутнение известковой воды
Очень сложное задание, требующее знаний тривиальных названий веществ и процессов, связанных с химией кальция. Гашением извести называется взаимодействие оксида кальция (негашеной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
Гашением извести называется взаимодействие оксида кальция (негашеной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений – экзотермические. Ответ 2.
К этому ответу можно прийти гораздо проще. Достаточно знать, что практически все реакции разложения относятся к эндотермическим, т.е. протекают с поглощением теплоты. Обжиг известняка – разложение карбоната кальция.
11. Верны ли следующие суждения применительно к реакции синтеза аммиака?
А) Это реакция соединения, гомогенная, каталитическая
Б) Это реакция окислительно-восстановительная, обратимая, экзотермическая
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Верный ответ – 3. К такому выводу позволяет прийти запись уравнения реакции:
kat
N2 + 3H2 ↔ 2NH3 + Q
12. Верны ли следующие суждения применительно к способам получения сульфата цинка?
Верны ли следующие суждения применительно к способам получения сульфата цинка?
А) Сульфат цинка можно получить реакциями замещения и обмена
Б) Сульфат цинка можно получить реакциями разложения и соединения
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
На школьном уровне экзаменующемуся будет несложно прийти к выводу о возможности получения сульфата цинка реакцией замещения (например, взаимодействием цинка и разбавленной серной кислоты), а также реакцией обмена (например, взаимодействием оксида, гидроксида или карбоната цинка и серной кислоты). Можно получить сульфат цинка и реакцией соединения оксида цинка с оксидом серы (VI). А вот получить такую соль реакцией разложения почти невозможно. Ответ – 1.
13. Химические свойства этилена не характеризуются реакциями
1) полимеризации
2) гидратации
3) поликонденсации
4) гидрирования
Этилен, как непредельное соединение вступает в реакции присоединения, а потому ответы 1,2 и 4 – не отвечают условию задания. Ответ 3.
Ответ 3.
14. Для фенола не характерны реакции
1) поликонденсации
2) замещения
3) галогенирования
4) гидролиза
Знание свойств фенола позволяет выбрать верный ответ: фенол не гидролизуется. Ответ 4.
15. Реакцией соединения и окислительно-восстановительной является взаимодействие между
1) хлором и водородом
2) хлором и водой
3) фтором и водой
4) хлороводородом и аммиаком
Получение сложного вещества из простых и отвечает условию задания. Остальные ответы можно не рассматривать в целях экономии времени. Ответ 1.
16. К реакциям замещения и соединения относятся соответственно взаимодействия
1) оксид алюминия + соляная кислота и оксид железа (III) + алюминий
2) алюминий + хлорид меди (II) и алюминий + хлор
3) гидроксид алюминия + серная кислота и алюминий + кислород
4) сульфат алюминия + хлорид бария и алюминий + иод
Так как по условию задания первой в верном ответе должна быть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
Это ответ – 2. Остальные ответы можно не анализировать. Ответ 2.
17. К реакциям обмена и замещения соответственно относятся взаимодействия
1) азотной кислоты с оксидом меди (II) и гидроксида кальция с оксидом углерода (IV)
2) этина с бромом и серной кислоты с оксидом магния
3) соляной кислоты с гидроксидом железа (III) и метана с хлором
4) фенола с натрием и с гидроксидом натрия
Достаточно сложное задание, так как требует знаний не только классификации химических реакций, но и номенклатуры органических и неорганический соединений. Однако его можно выполнить быстро на основании логики и знания о том, что реакция замещения – это, как правило, взаимодействие простого и сложного веществ. Эта реакция по условию задания должна быть предложена в условиях ответа второй. Ответ 3.
18. С наибольшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
Активность галогенов и их окислительные свойства уменьшаются в подгруппе сверху вниз. Ответ 1.
Ответ 1.
19. С наименьшей скоростью с водой реагирует
1) литий 2) натрий 3) калий 4) цезий
Активность щелочных металлов и их восстановительные свойства усиливаются в подгруппе сверху вниз. Ответ 1.
20. С наибольшей скоростью при комнатной температуре протекает реакция между
1) кислородом и водородом
2) железом и раствором серной кислоты
3) этиловым спиртом и натрием
4) растворами сульфата меди (II) и гидроксидом калия
В растворах электролитов реакции ионного обмена протекают почти мгновенно. Ответ 4.
21. Скорость химической реакции между цинком (в гранулах) и раствором серной кислоты не зависит от
1) концентрации серной кислоты
2) размера гранул цинка
3) давления
4) температуры
Скорость реакции зависит от концентрации веществ, температуры. Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
Скорость гетерогенной реакции зависит от поверхности соприкосновения веществ (в данном случае размеров гранул цинка). Поскольку взаимодействие протекает не в газовой фазе, а на границе раздела жидкость — твердое вещество, давление не оказывает влияния на скорость химической реакции. Ответ 3.
22. Одинаковые кусочки магния взаимодействуют с наибольшей скоростью с соляной кислотой, если
1) разбавить кислоту
2) увеличить концентрацию кислоты
3) увеличить давление
4) уменьшить температуру
Увеличение концентрации вещества в растворе увеличивает скорость протекания химической реакции. Ответ 2.
23. Для увеличения скорости химической реакции
Fe (тв.) + 2H+ (р-р) = Fe2+ (р-р) + H2 (г)
необходимо
1) увеличить концентрацию ионов железа
2) добавить несколько кусочков железа
3) уменьшить температуру
4) увеличить концентрацию кислоты
Скорость реакции зависит от концентрации реагирующих веществ. Ответ 4.
Ответ 4.
24. На скорость химической реакции между цинком и раствором сульфата меди (II) не оказывает влияния увеличение
1) площади соприкосновения реагирующих веществ
2) температуры
3) концентрации раствора сульфата меди (II)
4) давления
Очевидный ответ 4.
25. С увеличением давления возрастает скорость реакции между
1) растворами нитрата серебра и хлорида натрия
2) цинком и соляной кислотой
3) водородом и кислородом
4) этиловым спиртом и натрием
Давление существенно влияет на скорость гомогенной реакции, протекающей в газовой фазе. Ответ 3.
26. Для увеличения скорости химической реакции разложения аммиака на водород и азот необходимо
1) увеличить концентрацию водорода
2) уменьшить температуру
3) увеличить температуру
4) уменьшить концентрацию аммиака
Так как реакция разложения аммиака – это экзотермический процесс, повышение температуры способствует его протеканию. Ответ 3.
Ответ 3.
27. Применение технологии «кипящего слоя» на производстве способствует увеличению скорости промышленных процессов потому, что
1) увеличивается концентрация реагирующих веществ
2) увеличивается поверхность соприкосновения реагирующих веществ
3) возрастает энергия активации процесса
4) возрастают масса и объем реагирующих веществ
«Кипящий слой» — технологический прием, позволяющий увеличить поверхность соприкосновения реагирующих веществ путем измельчения твердого сырья с последующим пропусканием через него газа или паров жидкости, в результате чего создается иллюзия кипения. Ответ 2.
28. Верны ли следующие суждения о катализаторах?
А) Это вещества, которые изменяют скорость химической реакции и расходуются при этом
Б) Это вещества, которые изменяют скорость химической реакции и ее направление
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Так как катализаторы по завершению каталитической реакции не меняются качественно и количественно, то суждение А не верно. Ответ 2.
Ответ 2.
29. Верны ли следующие суждения о ферментах?
А) Это биологические катализаторы белковой природы
Б) Это биологические катализаторы, которые «работают» в узком интервале температур и pH среды, обладают высокой эффективностью и селективностью
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Для некоторых экзаменующихся небольшое затруднения вызовут термины «рН среды» и «селективность». Первый характеризует «работу» фермента в определенном значении кислотно-основных свойств среды, а второй – избирательное действие на конкретное вещество или группу сходных веществ. Ответ 3.
30. Верны ли следующие суждения о скорости химической реакции?
А) Это изменение концентрации реагирующих веществ
Б) Это изменение количества вещества реагента в единицу времени
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения не верны
Наиболее близко к истинному суждение А, но не содержит такой важнейшей характеристики скорости химической реакции, как отношение изменения концентрации реагирующих веществ ко времени, за которое оно произошло. Ответ 4.
Ответ 4.
Задания для самостоятельной работы
1. Взаимодействие алюминия с оксидом хрома (III) – это реакция
1) замещения 2) присоединения 3) разложения 4) обмена
2. Внутримолекулярная дегидратация спиртов – это реакция
1) замещения 2) присоединения 3) отщепления 4) изомеризации
3. При сливании растворов иодида калия и нитрата свинца (II) протекает реакция
1) замещения 2) присоединения 3) разложения 4) обмена
4. Хлор вступает в реакцию замещения с
1) хлоридом железа (II)
2) бромидом калия
3) оксидом углерода (II)
4) гидроксидом натрия
5. Не является окислительно-восстановительной реакция, схема которой
1) (CuOH)2CO3 ® CuO + H2O + CO2↑
2) KMnO4 ® K2MnO4 + O2↑ + MnO2
3) KClO3 ® KCl + O2↑
4) NH4NO3 ® N2O + H2O
6. К гомогенным реакциям относится
К гомогенным реакциям относится
1) обжиг сульфида меди (II)
2) алюминотермия
3) взаимодействие цинка с соляной кислотой
4) хлорирование метана
7. Окислительно-восстановительная реакция лежит в основе получения
1) сульфата аммония из аммиака и серной кислоты
2) кислорода разложением пероксида водорода
3) оксида бария разложением карбоната бария
4) гидроксида кальция из оксида кальция
8. Химическое взаимодействие отсутствует при получении
1) бензина каталитическим крекингом
2) кислорода фракционной перегонкой воздуха
3) синтез-газа конверсией метана
4) аммиака из азото-водородной смеси.
9. Эндотермическим процессом является
1) нейтрализация серной кислоты гидроксидом натрия
2) горение серы
3) разложение гидроксида кальция
4) взаимодействие алюминия с бромом
10. С уменьшением относительной молекулярной массы органического вещества протекает реакция
1) дегидрирования этана
2) изомеризации н-бутана
3) гидрирования бутаналя
4) хлорирования метана
11. С увеличением относительной молекулярной массы органического вещества протекает реакция
С увеличением относительной молекулярной массы органического вещества протекает реакция
1) гидролиза этилового эфира уксусной кислоты
2) дегидрирования этана
3) окисления пропанола-1 до пропаналя
4) гидратации ацетилена
12. К реакциям обмена относится взаимодействие между
1) оксидом меди (II) и соляной кислотой
2) оксидом натрия и водой
3) оксидом углерода (IV) и магнием
4) оксидом серы (VI) и оксидом цинка
13. К реакциям замещения не относится взаимодействие между хлором и
1) метаном
2) этиленом
3) этаном
4) уксусной кислотой
14. В реакцию соединения вступят вещества, формулы которых
1) СO и FeO
2) CO2 и Mg
3) CO и Сl2
4) СО и CuO
15. Окислительно-восстановительной является реакция, схема которой
1) CuO + H2SO4 ® CuSO4 + H2O
2) FeO + HNO3 ® Fe (NO3)3 + NO + H2O
3) NaHSO4 + NaOH ® Na2SO4 + H2O
4) NH4HCO3 ® NH3 + CO2 + H2O
16. Реакцией горения нельзя назвать процесс, уравнение которого
Реакцией горения нельзя назвать процесс, уравнение которого
1) S + O2 = SO2
2) C + O2 = CO2
3) N2 + О2 = 2 NO
4) 4 P + 5 O2 = 2 P2O5
17. С наибольшей скоростью с водой реагирует
1) калий 2) литий 3) кальций 4) железо
18. С наименьшей скоростью с водородом реагирует
1) фтор 2) хлор 3) бром 4) иод
19. С наибольшей скоростью при комнатной температуре протекает реакция между
1) водородом и азотом
2) уксусной кислотой и этиловым спиртом
3) цинком и соляной кислотой
4) растворами нитрата серебра и хлорида натрия
20. Скорость реакции разложения пероксида водорода увеличится при
1) разбавлении раствора
2) увеличении давления
3) внесении катализатора
4) охлаждении раствора
21. Увеличение давления повысит скорость реакции между
Увеличение давления повысит скорость реакции между
1) Mg и H2SO4
2) N2 и Н2
3) KI (р-р) и AgNO3 (р-р)
4) СаСО3 и HCl (р-р)
22. С наибольшей скоростью протекает реакция между водным раствором гидроксида натрия и
1) соляной кислотой
2) алюминием
3) хлорэтаном
4) оксидом кремния (IV)
23. Увеличение концентрации кислорода увеличит скорость реакции, схема которой
1) H2O2 ® H2O + O2
2) NO + O2 ® NO2
3) KClO3 ® KCl + O2
4) KMnO4 ® K2MnO4 + MnO2 + O2
24. Давление не влияет на скорость реакции между
1) H2 и Br2 2) CO2 и С 3) Fe и S 4) СО и О2
25. К каталитическим реакциям относится получение
К каталитическим реакциям относится получение
1) хлороводорода из хлора и водорода
2) фосфора из фосфата кальция
3) хрома алюминотермией
4) аммиака из азота и водорода
26. Увеличение температуры
1) увеличивает скорость любой реакции
2) уменьшает скорость любой реакции
3) увеличивает скорость только эндотермических реакций
4) не влияет на скорость реакции
27. Скорость реакции увеличивается при
1) повышении концентрации реагирующих веществ
2) повышении концентрации продуктов реакции
3) понижении температуры
4) понижении давления
28. Соли двухвалентной ртути используются в качестве катализатора реакции
1) окисления спиртов
2) гидрировния аренов
3) гидратации ацетилена
4) тримеризации ацетилена
29. Для увеличения скорости реакции синтеза аммиака из азота и водорода нужно:
1) понизить температуру
2) уменьшить давление
3) увеличить концентрацию аммиака
4) увеличить давление
30. Ингибитор – это вещество,
Ингибитор – это вещество,
1) ускоряющее химическую реакцию
2) замедляющее химическую реакцию
3) усиливающее действие катализатора
4) нейтрализующее каталитические яды
03 Октябрь 2011, 19991 просмотр.
Комментарии
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.
В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 — хромистый железняк, хромит
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит
Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3
Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑
Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III,
реагирует с кислотами, кислотными оксидами.
Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III,
реагирует с кислотами, кислотными оксидами.
CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.
К ним относятся оксид хрома III гидроксид хрома III.
Оксид хрома III реагирует как с щелочами (при прокаливании), образуя смешанные оксиды, так и с кислотами с образованием различных солей.
Cr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr+3)
Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» :)
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит
Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi
Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.
Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа III до II.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа II проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа II распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O
При хранении на открытом воздухе соли железа II приобретают коричневый цвет из-за окисления до железа III.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] —
гексацианоферратом III калия. В результате реакции образуется берлинская лазурь (прусский синий).
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа III проявляют амфотерные свойства. Оксид и гидроксид железа III реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа III — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.
Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа III с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl
И еще одна качественная реакция на ионы Fe3+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа VI — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O
Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит
Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами.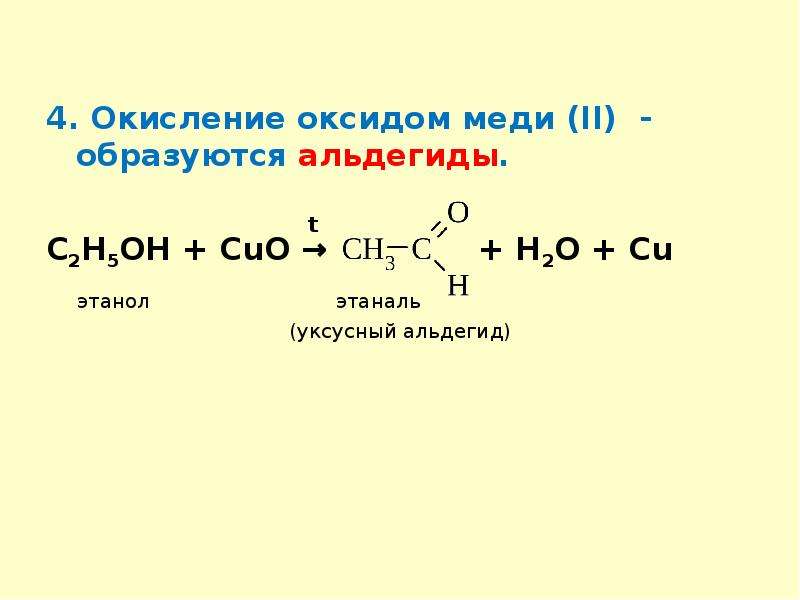 С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
С разбавленной серной не реагирует, с разбавленной азотной
— реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
Гидроксид меди II — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.
CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II — (CuOH)2CO3)
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Взаимодействие водорода с оксидом меди (II) CuO
1) Соберите прибор, как показано на рисунке 38, и проверьте его на герметичность.
2) Положите в пробирку 8-10 кусочков цинка и прилейте 5-6 мл раствора соляной кислоты.
3) Закройте пробирку пробкой с газоотводной трубкой и проверьте выделяющийся водород на чистоту. Конец газоотводной трубки поместите в пробирку с оксидом меди (II), как показано на рисунке. Пробирка с оксидом меди (II) должна быть закреплена в штативе немного наклонно, чтобы её отверстие находилось ниже дна.
4) Пробирку нагрейте в том месте, где находится оксид меди (II). Как только заметите появление порошка красного цвета, нагревание прекратите. Из чёрного порошка оксида меди (II) образовалось вещество красного цвета, а на стенках пробирки образовались капельки волы.
Как только заметите появление порошка красного цвета, нагревание прекратите. Из чёрного порошка оксида меди (II) образовалось вещество красного цвета, а на стенках пробирки образовались капельки волы.
Почему перед нагреванием оксида меди (II) в атмосфере водорода последний нужно проверить на чистоту?
Почему пробирку с оксидом меди (II) закрепляют в штативе с наклоном в сторону отверстия?
Почему нагревание требуется только до того момента, как оксид меди (II) начинает раскаляться?
Объясните, почему из чёрного порошка образовалось вещество красного цвета. Напишите уравнение реакции оксида меди (II) с водородом. К какому типу относится эта реакция?
Какие свойства водорода подтвердил этот опыт?
Водород необходимо проверить на чистоту, т. к. он может содержать примеси кислорода. При нагревании кислород реагирует с водородом со взрывом.
Пробирку с оксидом меди (II) закрепляют в штативе с наклоном в сторону отверстия для того, чтобы капельки воды, образующиеся в результате реакции, стекали через отверстие пробирки.
Реакция протекает с раскаленным оксидом меди (II), поэтому для протекания реакции дальнейший прогрев не требуется.
Водород взаимодействует с черным оксидом меди (II), восстанавливая его до меди, которая имеет красный цвет.
CuO + H2 t ⟶ Cu + H2O
Эта реакция относится к реакциям замещения (водород замещает медь в её оксиде).
Этот опыт подтвердил восстановительные свойства (способность восстанавливать металлы из их оксидов).
gomolog.ru1https://gomolog.ru/reshebniki/8-klass/rudzitis-i-feldman-2019/lab/lab-7.html
gomolog.ru11https://gomolog.ru/reshebniki/8-klass/rudzitis-i-feldman-2019/lab/lab-7.html
Оксид меди (II) — обзор
Методы разложения
Методы разложения включают окислительное и восстановительное разложение, гидролиз, различные типы облучения, пиролиз, биологическое разложение. Метод окислительной деструкции — один из наиболее полезных методов получения информации о химической структуре. Для окисления гуминовых веществ использовали несколько реагентов: в щелочных условиях перманганат калия, оксид меди (II), водный хлор; в кислых условиях — азотная кислота, надуксусная кислота, перекись водорода; и ультрафиолетовое (УФ) излучение.Щелочное перманганатное окисление кажется лучшим методом с точки зрения получения относительно больших количеств идентифицируемых продуктов переваривания и предоставления важной информации о химической структуре гуминовых веществ. Предварительное метилирование важно для получения хороших выходов. Во всех процессах окислительного разложения почвенные вещества в основном производят карбоновые кислоты (моно-, ди-, три- и тетра-), фенольные кислоты и бензолкарбоновые кислоты. Есть указания на то, что в то время как почвенные гуминовые кислоты и почвенные фульвокислоты дают схожие количества алифатических соединений при окислении, окисление почвенных фульвокислот дает больше фенольных кислот, но меньше бензолкарбоновых кислот, чем почвенных гуминовых кислот.
Метод окислительной деструкции — один из наиболее полезных методов получения информации о химической структуре. Для окисления гуминовых веществ использовали несколько реагентов: в щелочных условиях перманганат калия, оксид меди (II), водный хлор; в кислых условиях — азотная кислота, надуксусная кислота, перекись водорода; и ультрафиолетовое (УФ) излучение.Щелочное перманганатное окисление кажется лучшим методом с точки зрения получения относительно больших количеств идентифицируемых продуктов переваривания и предоставления важной информации о химической структуре гуминовых веществ. Предварительное метилирование важно для получения хороших выходов. Во всех процессах окислительного разложения почвенные вещества в основном производят карбоновые кислоты (моно-, ди-, три- и тетра-), фенольные кислоты и бензолкарбоновые кислоты. Есть указания на то, что в то время как почвенные гуминовые кислоты и почвенные фульвокислоты дают схожие количества алифатических соединений при окислении, окисление почвенных фульвокислот дает больше фенольных кислот, но меньше бензолкарбоновых кислот, чем почвенных гуминовых кислот.
Наиболее широко применяемыми методами восстановительного разложения являются дистилляция цинка и восстановление амальгамы натрия. Конденсированные ароматические структуры (метилзамещенный нафталин, антрацен, пирен и перилен) являются основными продуктами переваривания этого восстановления гуминовых веществ.
В настоящее время широко применяется аналитический пиролиз. В последнее время произошли значительные улучшения в процедуре пиролиза, и, сочетая пиролиз с газовой хроматографией (ГХ) и масс-спектрометрией (МС), можно получить значительный объем структурной информации о гуминовых веществах.Однако количественное определение пиролиза ГХ-МС ограничено матричными эффектами, которые искажают детектируемые сигналы, а высокие температуры, используемые во время пиролиза, вызывают вторичные реакции (перегруппировку, крекинг, гидрирование и полимеризацию). Поэтому выводы относительно структурного состава исходных образцов следует делать с осторожностью. Другой современный метод — термохимический анализ гидроксида тетраметиламмония в сочетании с масс-спектрометрией. Его преимущество состоит в том, что могут быть обнаружены многочисленные полярные функциональные возможности, связанные с гуминовыми веществами, которые не обнаруживаются другими методами, например.g., пропильные боковые цепи.
Его преимущество состоит в том, что могут быть обнаружены многочисленные полярные функциональные возможности, связанные с гуминовыми веществами, которые не обнаруживаются другими методами, например.g., пропильные боковые цепи.
В последнее десятилетие наблюдается быстрый прогресс в области масс-спектрометрии с использованием методов мягкой ионизации, таких как масс-спектрометрия с ионизацией электрораспылением (ESI-MS), масс-спектрометрия с ионным циклотронным резонансом с преобразованием Фурье (FT-ICR-MS) и матричная масс-спектрометрия с лазерной десорбцией и ионизацией (MALDI) -MS. Эти инструменты предоставляют информацию на молекулярном уровне о гуминовых веществах.
Взаимодействие оксидов цинка и меди (II) | Эксперимент
Оксид меди (II) и металлический цинк вступают в экзотермическую реакцию с образованием оксида цинка и меди.Наблюдая за этой реакцией и ее продуктами и отмечая разницу в реакционной способности между цинком и медью, студенты могут познакомиться с идеей конкурентных реакций.
Оборудование
Аппарат
- Защита глаз
- Горелка Бунзена
- Крышка олова на штативе (или полоске керамической бумаги)
- Стакан, 100 см 3
- Тестер цепей (аккумулятор, лампа и провода) (опция)
- Защитные экраны (опция)
- Пробирки x2 (необязательно — см. Процедуру, шаг 7)
- Штатив для пробирок
- Доступ к весам с точностью до нуля.1 г
Химическая промышленность
- Порошок оксида меди (II) (ВРЕДНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), 2 г
- Цинковый порошок (легковоспламеняющийся, опасный для окружающей среды), 1,6 г
- Разбавленная соляная кислота, примерно 2 M (РАЗДРАЖАЮЩИЙ), 20 см 3
- Оксид цинка (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ), несколько граммов
- Медный порошок, несколько граммов
- Концентрированная азотная кислота (КОРРОЗИОННАЯ, ОКИСЛЯЮЩАЯ), 5 см 3 (необязательно — см.
 Процедуру, шаг 7)
Процедуру, шаг 7)
Примечания по технике безопасности, охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Во всем пользовании защитными очками. Рассмотрите возможность установки защитных экранов вокруг эксперимента (образцы цинка могут значительно различаться по реакционной способности, в зависимости от размера частиц и степени окисления поверхности).
- Порошок оксида меди (II), CuO (s), (ВРЕДНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. Карту CLEAPSS Hazcard HC026.
- Цинковый порошок, Zn (s), (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — СМОТРИТЕ CLEAPSS Hazcard HC107.
- Разбавленная соляная кислота, HCl (водный), (РАЗДРАЖАЮЩИЙ) — см. CLEAPSS Hazcard HC047a и книгу рецептов CLEAPSS RB043.
- Концентрированная азотная кислота, HNO 3 (водн.), (КОРРОЗИОННОЕ, ОКИСЛЯЮЩЕЕ) — см. CLEAPSS Hazcard HC067.
- Медный порошок, Cu (s) — см. CLEAPSS Hazcard HC026.

- Оксид цинка, ZnO (s), (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC108b.
Процедура
- Отвесить 2 г (0,025 моль) оксида меди (II) и 1,6 г (0,025 моль) цинкового порошка.
- Тщательно перемешать до однородного серого порошка.
- Вылейте смесь в форме «сосиски» длиной около 5 см на чистую жестяную крышку, установленную на треноге (или на полоску керамической бумаги, сложенную вдоль V-образной формы).
- Нагрейте один конец «колбасы» сверху ревущим пламенем Бунзена, пока он не начнет светиться, затем погасите пламя. Свечение будет распространяться по «колбасе», пока она полностью не прореагирует. Останется бело-серая смесь.
- Нагрейте его, чтобы показать, что белый порошок (оксид цинка) становится желтым в горячем состоянии и белым в холодном состоянии.
- Вылейте холодный остаток в химический стакан 100 см. 3 и добавьте немного разбавленной соляной кислоты для растворения оксида цинка (а также непрореагировавших оксидов цинка и меди), при необходимости нагревая.
 Останется красно-коричневая медь. Его можно промыть водой и передать всему классу для наблюдения. Покажите, что порошок проводит электричество, с помощью тестера цепей.
Останется красно-коричневая медь. Его можно промыть водой и передать всему классу для наблюдения. Покажите, что порошок проводит электричество, с помощью тестера цепей. - Если требуется дополнительное подтверждение личности, обработайте небольшое количество красно-коричневого порошка несколькими каплями концентрированной азотной кислоты в пробирке в вытяжном шкафу. Коричневый газ, диоксид азота, NO 2 (г) (ОЧЕНЬ ТОКСИЧНЫЙ) выделяется, когда медь вступает в реакцию и растворяется. После реакции добавление небольшого количества воды делает видимым синий раствор нитрата меди (II).
Учебные заметки
Глубина обсуждения зависит от уровня учащихся. По сути, это конкуренция между металлом (1) и металлом (2) за кислород в реакции, представленной:
Металл (1) + Металл (2) оксид → Металл (1) оксид + Металл (2)
Более химически активный металл вытесняет менее химически активный металл из своего оксида, как в случае оксидов цинка и меди (II), например:
Zn (тв) + CuO (тв) → ZnO (тв) + Cu (тв)
Продемонстрируйте, что оксид цинка становится желтым при нагревании и снова становится белым при охлаждении, чтобы подтвердить идентичность этого продукта. (Это явление вызвано изменением кристаллической структуры — реальный пример физического изменения.)
(Это явление вызвано изменением кристаллической структуры — реальный пример физического изменения.)
В соответствующих случаях можно указать, что эти реакции являются окислительно-восстановительными реакциями, при этом более химически активный металл действует как восстанавливающий агент, а оксид металла действует как окислитель. Это можно было бы расширить, чтобы рассмотреть эти окислительно-восстановительные реакции с точки зрения потери и получения электронов металлами.
Можно использовать и другие металлы, но будьте осторожны, сравнивая подобное с подобным.Например, крупнозернистый порошок магния дает менее бурную реакцию, чем порошкообразный цинк. Тонкоизмельченный магний дает очень бурную реакцию, и ее следует использовать с большой осторожностью. Реакция между алюминиевым порошком и оксидом меди почти взрывоопасна, и ее не следует предпринимать.
Дополнительная информация
Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов.Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические примечания и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов.Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические примечания и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
Эксперимент также является частью курса непрерывного профессионального развития Королевского химического общества: химия для неспециалистов.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
Окисление воды комплексом меди (ii): новые открытия, вопросы, проблемы и новая гипотеза
Комплексы меди ( II ) — очень перспективные катализаторы окисления воды.Здесь представлены новые данные о водоокислительной активности некоторых комплексов меди ( II ) в условиях водного окисления. Соединения меди в данном исследовании представляют собой тетранатриевую соль тетрасульфоновой кислоты ( 1 ), фталоцианин-3,4 ′, 4 ′ ′, 4 ′ ′ ′ меди ( II ), продукт гидролиза Cu ( II ). tptz (H 2 O) (CH 3 COO) 2 (tptz: 2,4,6-трис (2-пиридил) — s -триазин) ( 2 ), Cu ( II ) (phen) (CH 3 CN) 2 (ClO 4 ) 2 ( 3 ), Cu ( II ) (phen) 2 (CH 3 CN) (ClO 4 ) 2 ( 4 ) и пентагидрат сульфата меди ( II ) (Cu ( II ) соль), которые были исследованы в контексте реакции окисления воды электрохимическими и родственными методами.
Соединения меди в данном исследовании представляют собой тетранатриевую соль тетрасульфоновой кислоты ( 1 ), фталоцианин-3,4 ′, 4 ′ ′, 4 ′ ′ ′ меди ( II ), продукт гидролиза Cu ( II ). tptz (H 2 O) (CH 3 COO) 2 (tptz: 2,4,6-трис (2-пиридил) — s -триазин) ( 2 ), Cu ( II ) (phen) (CH 3 CN) 2 (ClO 4 ) 2 ( 3 ), Cu ( II ) (phen) 2 (CH 3 CN) (ClO 4 ) 2 ( 4 ) и пентагидрат сульфата меди ( II ) (Cu ( II ) соль), которые были исследованы в контексте реакции окисления воды электрохимическими и родственными методами. Эксперименты показали, что среди этих соединений при pH = 11 только соль Cu ( II ) и 3 приводили к немедленному окислению воды. С другой стороны, для стабильных комплексов 1 , 2 и 4 даже через несколько минут наблюдались низкие скорости окисления воды. Исследована роль наноразмерных частиц оксида Cu или ионов Cu в электрохимическом окислении воды. В условиях водного окисления были изучены электрод, комплексы Cu ( II ) и соль Cu ( II ) и предложена связь между стабильностью комплекса Cu ( II ) и скоростью окисления воды.Предполагается, что ионы или кластеры Cu ( II ), а не исходный комплекс меди ( II ) или оксид меди ( II ), являются истинными катализаторами для исследуемого процесса окисления воды в краткосрочной амперометрии. Для 3 и при длительной амперометрии был обнаружен CuO x .
Эксперименты показали, что среди этих соединений при pH = 11 только соль Cu ( II ) и 3 приводили к немедленному окислению воды. С другой стороны, для стабильных комплексов 1 , 2 и 4 даже через несколько минут наблюдались низкие скорости окисления воды. Исследована роль наноразмерных частиц оксида Cu или ионов Cu в электрохимическом окислении воды. В условиях водного окисления были изучены электрод, комплексы Cu ( II ) и соль Cu ( II ) и предложена связь между стабильностью комплекса Cu ( II ) и скоростью окисления воды.Предполагается, что ионы или кластеры Cu ( II ), а не исходный комплекс меди ( II ) или оксид меди ( II ), являются истинными катализаторами для исследуемого процесса окисления воды в краткосрочной амперометрии. Для 3 и при длительной амперометрии был обнаружен CuO x . Эксперименты показали, что молекулярный механизм реакции окисления воды в присутствии комплексов меди ( II ) должен быть тщательно проанализирован, чтобы проверить роль ионов меди или образования кластеров в реакции окисления воды.
Эксперименты показали, что молекулярный механизм реакции окисления воды в присутствии комплексов меди ( II ) должен быть тщательно проанализирован, чтобы проверить роль ионов меди или образования кластеров в реакции окисления воды.
Растворимость оксидов меди в воде и паре
Изучена геохимия микроэлементов в поверхностных геотермальных флюидах в Исландии. Отобранные жидкости включали горячие источники, грязевые котлы, паровые каналы и почвенные растворы с температурами от 4 до 100 ° C, pH от 2,01 до 9,10 и общим количеством растворенных твердых веществ от 86 до 4375 ppm. Поверхностные геотермальные воды можно разделить на три группы в зависимости от их химического состава: воды с NaCl, кислые сульфатные воды, нагретые паром, и смешанные воды.Воды NaCl с pH> 8 считаются геотермальными флюидами водоносного горизонта, которые подверглись кипению в восходящем потоке. Они содержали только низкие концентрации большинства металлов, <0,1 частей на миллиард Cd и Co, <1 частей на миллиард Ni, Pb, Cr и Cu и <10 частей на миллиард Zr, V и Zn, тогда как несколько более высокие концентрации Ba (0,06-15 частей на миллиард ), Sr (1,2–107 частей на млрд), Cs (0,08–19 частей на млрд), Rb (7,1–163 частей на млрд), Li (18–380 частей на млрд), As (<0,2–252 частей на млрд), Sb (0,05–40 частей на млрд) , Mo (0,16–50 частей на миллиард), W (2,4–88 частей на миллиард), Mn (0,1–163 частей на миллиард), Fe (1. 8–157 частей на миллиард) и Al (21-1510 частей на миллиард). Кислотно-сульфатные воды, нагретые паром, обычно имели pH <4. Они образуются путем конденсации и смешивания пара в неглубокой нетермальной воде. По сравнению с водами NaCl, кислотно-сульфатные воды, нагретые паром, обычно имеют высокие концентрации Al (0,02–267 частей на миллион), Fe (0,66–360 частей на миллион), Mn (44–4231 частей на миллиард), V (1,1–1120 частей на миллиард), Cr (0,15-660 частей на миллиард), Zn (3,1-633 частей на миллиард), Ni (0,20-192 частей на миллиард), Cu (0,09-121 частей на миллиард), Co (0,02-90 частей на миллиард), Ba (1,0-60 частей на миллиард) и Sr (2,8 –316 ppb), тогда как концентрации Li (<0.03–57 ppb), Cs (<0,01–0,77 ppb), Rb (0,12–24 ppb), As (<0,1–61 ppb), Mo (<0,01–14 ppb), Sb (<0,01–25 ppb) и W (<0,01–6,9 частей на миллиард) были ниже. Смешанные воды представляют собой смеси между водами NaCl, кислотно-сульфатными водами, нагретыми паром, и нетермальными водами, и обладают химическими характеристиками этих конечных вод.
8–157 частей на миллиард) и Al (21-1510 частей на миллиард). Кислотно-сульфатные воды, нагретые паром, обычно имели pH <4. Они образуются путем конденсации и смешивания пара в неглубокой нетермальной воде. По сравнению с водами NaCl, кислотно-сульфатные воды, нагретые паром, обычно имеют высокие концентрации Al (0,02–267 частей на миллион), Fe (0,66–360 частей на миллион), Mn (44–4231 частей на миллиард), V (1,1–1120 частей на миллиард), Cr (0,15-660 частей на миллиард), Zn (3,1-633 частей на миллиард), Ni (0,20-192 частей на миллиард), Cu (0,09-121 частей на миллиард), Co (0,02-90 частей на миллиард), Ba (1,0-60 частей на миллиард) и Sr (2,8 –316 ppb), тогда как концентрации Li (<0.03–57 ppb), Cs (<0,01–0,77 ppb), Rb (0,12–24 ppb), As (<0,1–61 ppb), Mo (<0,01–14 ppb), Sb (<0,01–25 ppb) и W (<0,01–6,9 частей на миллиард) были ниже. Смешанные воды представляют собой смеси между водами NaCl, кислотно-сульфатными водами, нагретыми паром, и нетермальными водами, и обладают химическими характеристиками этих конечных вод. Было обнаружено, что пар, выпускаемый через выпускные отверстия для пара, содержит микроэлементы, включая B, As, Cu и Cd, в диапазоне концентраций от ppt до ppb. В геохимии Li, Cs, Rb, As, Mo, Sb и W в поверхностных геотермальных водах преобладали выщелачивание горных пород вместе со смешиванием конденсированного пара и нетермических поверхностных вод при низком pH и включением во вторичные минералы, включая алюминий. силикаты и сульфиды в щелочных условиях.Напротив, на водные концентрации Ba и Sr в значительной степени повлияло образование вторичных минералов, включая сульфаты, карбонаты и Са-минералы во всех типах воды. При низком pH поведение Al, Fe, Mn, Co, Ni, Zn, Cd, Cu, Pb, Cr и V, как правило, определялось выщелачиванием горных пород, хотя иногда и осаждением минералов в случае Fe, Al, Cu. , Co и Zr. При повышении pH эти металлы становились неподвижными из-за их включения во вторичный сульфид (Fe, Co, Ni, Zn, Cd, Cu, Pb), (гидр) оксид (Al, Fe, Cr, V, Zr) и силикат алюминия. (Al) минералы, ограничивающие их водные концентрации.
Было обнаружено, что пар, выпускаемый через выпускные отверстия для пара, содержит микроэлементы, включая B, As, Cu и Cd, в диапазоне концентраций от ppt до ppb. В геохимии Li, Cs, Rb, As, Mo, Sb и W в поверхностных геотермальных водах преобладали выщелачивание горных пород вместе со смешиванием конденсированного пара и нетермических поверхностных вод при низком pH и включением во вторичные минералы, включая алюминий. силикаты и сульфиды в щелочных условиях.Напротив, на водные концентрации Ba и Sr в значительной степени повлияло образование вторичных минералов, включая сульфаты, карбонаты и Са-минералы во всех типах воды. При низком pH поведение Al, Fe, Mn, Co, Ni, Zn, Cd, Cu, Pb, Cr и V, как правило, определялось выщелачиванием горных пород, хотя иногда и осаждением минералов в случае Fe, Al, Cu. , Co и Zr. При повышении pH эти металлы становились неподвижными из-за их включения во вторичный сульфид (Fe, Co, Ni, Zn, Cd, Cu, Pb), (гидр) оксид (Al, Fe, Cr, V, Zr) и силикат алюминия. (Al) минералы, ограничивающие их водные концентрации.
Реакционная способность меди — реакции с окружающей средой и химия патинирования
Реакционная способность
Металлы могут быть перечислены в соответствии с их реакционной способностью. Некоторые из них, например натрий, настолько реактивны, что взрываются при контакте с водой. Некоторые из них, такие как золото, настолько инертны, что кажутся неизменными после того, как их хоронили в течение тысяч лет. Медь в этой шкале низка. Он будет реагировать, но медленно. Эта низкая реактивность в сочетании с пластичностью делает его идеальным для использования в архитектуре.Его можно вырезать и забивать молотком, придавая ему декоративные формы, и он защитит себя бледно-зеленым налетом солей меди, называемым патиной. Примечание: это не следует путать с вердигрисом, названием зеленого цвета, полученного обработкой уксусной кислотой с образованием ацетата меди. Вердигрис растворим и не так прочен, как натуральная патина.
(Любезно предоставлено Королевской обсерваторией Эдинбурга. ) На восстановленных куполах видна новая медь, которой потребуются многие десятилетия, чтобы развить патину первоначальной меди. (С любезного разрешения Королевской обсерватории Эдинбурга.) Этот вид внутри купола показывает, насколько тонка конструкция. (Любезно предоставлено Эриком Бегби.)
) На восстановленных куполах видна новая медь, которой потребуются многие десятилетия, чтобы развить патину первоначальной меди. (С любезного разрешения Королевской обсерватории Эдинбурга.) Этот вид внутри купола показывает, насколько тонка конструкция. (Любезно предоставлено Эриком Бегби.)Это два купола телескопов Королевской обсерватории в Эдинбурге. Фотография сделана до реставрации в 2010 году. Медная облицовка покрыта слоем зеленой «патины», которая образовалась с момента постройки куполов в 1894 году. Патина представляет собой комбинацию солей меди, которые не реагируют и защищают медь дальнейшая коррозия.
Купола — это довольно легкие конструкции, которые вращаются на круговой направляющей, позволяя телескопам указывать в любом направлении через панель, которая открывается.Они также подвержены сильным ветрам.
Проблема была не в коррозии меди. Тонкие купольные конструкции сотрясались и сотрясались более века и просто разваливались.
(Любезно предоставлено национальными парками. )
)Эта знаменитая статуя почти не подверглась коррозии. Он почти ровесник обсерватории. Медные листы, видимые на фотографии, имеют толщину всего 2,5 мм, а с 1886 года они потеряли всего 0,1 мм в толщине.
(С любезного разрешения Make Architects.)3000 м 2 медного листа на медном ящике в Олимпийском парке Лондона предварительно окисляют на медном заводе. Шоколадно-коричневая пленка оксида меди продвигает процесс патинирования и предоставляет архитекторам вариант цвета, отличный от новой яркой меди. В конце концов поверх оксидного слоя появится пленка зеленых солей меди. На это уйдет до двадцати лет и более.
(Wikimedia Commons.)Вершина июльской колонны на площади Бастилии в Париже.Памятник сделан из бронзы (медь и олово), но бронзовая фигура наверху (Дух свободы) позолочена золотой фольгой.
Химия патинирования
Первым шагом в развитии патины является окисление с образованием оксида меди (I) (Cu 2 O), который имеет красный или розовый цвет (уравнение 1), когда атомы меди первоначально вступают в реакцию с молекулами кислорода в воздухе. . Оксид меди (I) дополнительно окисляется до оксида меди (II) (CuO), который имеет черный цвет (уравнение 2).Если воздух загрязнен серой, например, в результате сжигания ископаемого топлива, то также образуется черный сульфид меди (II) (CuS) (уравнение 3).
. Оксид меди (I) дополнительно окисляется до оксида меди (II) (CuO), который имеет черный цвет (уравнение 2).Если воздух загрязнен серой, например, в результате сжигания ископаемого топлива, то также образуется черный сульфид меди (II) (CuS) (уравнение 3).
Уравнение 1 4Cu + O 2 → 2Cu 2 O
Уравнение 2 2Cu 2 O + O2 → 4CuO
Уравнение 3 Cu + S → CuS
С течением времени CuO и CuS медленно реагируют с диоксидом углерода (CO 2 ) и гидроксид-ионами (OH-) в воде из воздуха с образованием Cu 2 CO 3 (OH) 2 (уравнение 4), Cu 3 (CO 3 ) 2 (OH) 2 (уравнение 5) и Cu 4 SO 4 (OH) 6 (уравнение 6), которые составляют патину .Степень влажности и уровень загрязнения воздуха, связанного с серой, оказывают значительное влияние на скорость развития патины, а также на относительное соотношение трех компонентов.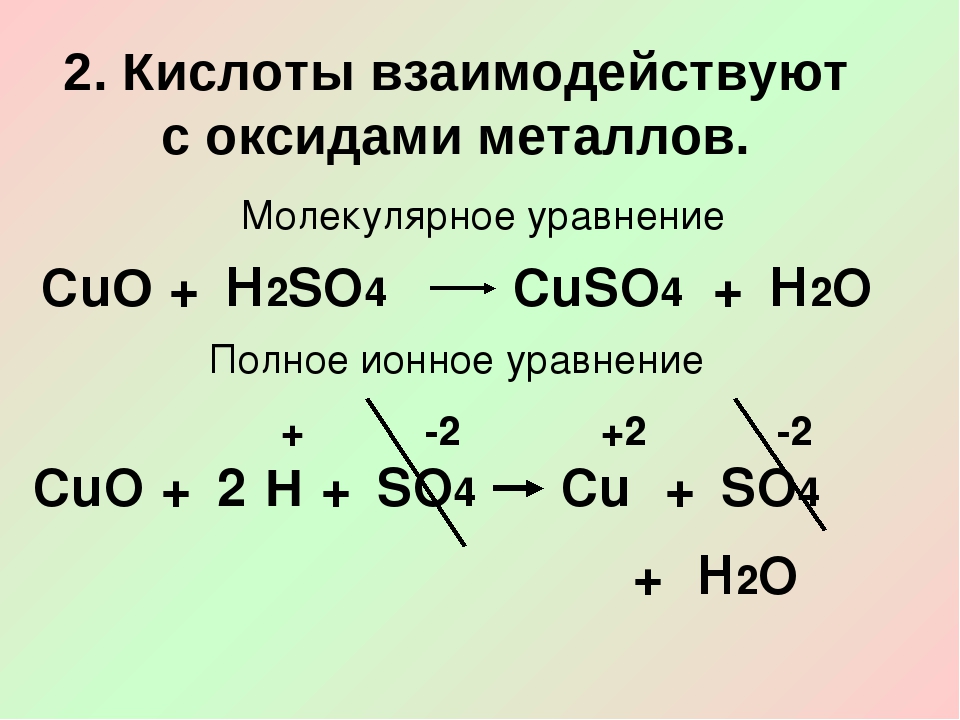
Уравнение 4 2CuO + CO 2 + H 2 O → Cu 2 CO 3 (OH) 2
Уравнение 5 3CuO + 2CO 2 + H 2 O → Cu 3 (CO 3 ) 2 (OH) 2
Уравнение 6 4CuO + SO 3 + 3H 2 O → Cu 4 SO 4 (OH) 6
В серии реактивности металлы перечислены в порядке их реакционной способности.Пятерка лидеров крайне опасна. Форма клина показывает, насколько они реактивны. Медь — единственный металл, кроме драгоценных металлов, который не вступает в реакцию с водой или разбавленными кислотами. Он очень медленно реагирует с кислородом.
Окисление воды комплексом меди (ii): новые открытия, вопросы, проблемы и новая гипотеза
Комплексы меди ( II ) — очень перспективные катализаторы окисления воды. Здесь представлены новые данные о водоокислительной активности некоторых комплексов меди ( II ) в условиях водного окисления.Соединения меди в данном исследовании представляют собой тетранатриевую соль тетрасульфоновой кислоты ( 1 ), фталоцианин-3,4 ′, 4 ′ ′, 4 ′ ′ ′ меди ( II ), продукт гидролиза Cu ( II ). tptz (H 2 O) (CH 3 COO) 2 (tptz: 2,4,6-трис (2-пиридил) — s -триазин) ( 2 ), Cu ( II ) (phen) (CH 3 CN) 2 (ClO 4 ) 2 ( 3 ), Cu ( II ) (phen) 2 (CH 3 CN) (ClO 4 ) 2 ( 4 ) и пентагидрат сульфата меди ( II ) (Cu ( II ) соль), которые были исследованы в контексте реакции окисления воды электрохимическими и родственными методами.Эксперименты показали, что среди этих соединений при pH = 11 только соль Cu ( II ) и 3 приводили к немедленному окислению воды. С другой стороны, для стабильных комплексов 1 , 2 и 4 даже через несколько минут наблюдались низкие скорости окисления воды. Исследована роль наноразмерных частиц оксида Cu или ионов Cu в электрохимическом окислении воды. В условиях водного окисления были изучены электрод, комплексы Cu ( II ) и соль Cu ( II ) и предложена связь между стабильностью комплекса Cu ( II ) и скоростью окисления воды.Предполагается, что ионы или кластеры Cu ( II ), а не исходный комплекс меди ( II ) или оксид меди ( II ), являются истинными катализаторами для исследуемого процесса окисления воды в краткосрочной амперометрии. Для 3 и при длительной амперометрии был обнаружен CuO x . Эксперименты показали, что молекулярный механизм реакции окисления воды в присутствии комплексов меди ( II ) должен быть тщательно проанализирован, чтобы проверить роль ионов меди или образования кластеров в реакции окисления воды.
Здесь представлены новые данные о водоокислительной активности некоторых комплексов меди ( II ) в условиях водного окисления.Соединения меди в данном исследовании представляют собой тетранатриевую соль тетрасульфоновой кислоты ( 1 ), фталоцианин-3,4 ′, 4 ′ ′, 4 ′ ′ ′ меди ( II ), продукт гидролиза Cu ( II ). tptz (H 2 O) (CH 3 COO) 2 (tptz: 2,4,6-трис (2-пиридил) — s -триазин) ( 2 ), Cu ( II ) (phen) (CH 3 CN) 2 (ClO 4 ) 2 ( 3 ), Cu ( II ) (phen) 2 (CH 3 CN) (ClO 4 ) 2 ( 4 ) и пентагидрат сульфата меди ( II ) (Cu ( II ) соль), которые были исследованы в контексте реакции окисления воды электрохимическими и родственными методами.Эксперименты показали, что среди этих соединений при pH = 11 только соль Cu ( II ) и 3 приводили к немедленному окислению воды. С другой стороны, для стабильных комплексов 1 , 2 и 4 даже через несколько минут наблюдались низкие скорости окисления воды. Исследована роль наноразмерных частиц оксида Cu или ионов Cu в электрохимическом окислении воды. В условиях водного окисления были изучены электрод, комплексы Cu ( II ) и соль Cu ( II ) и предложена связь между стабильностью комплекса Cu ( II ) и скоростью окисления воды.Предполагается, что ионы или кластеры Cu ( II ), а не исходный комплекс меди ( II ) или оксид меди ( II ), являются истинными катализаторами для исследуемого процесса окисления воды в краткосрочной амперометрии. Для 3 и при длительной амперометрии был обнаружен CuO x . Эксперименты показали, что молекулярный механизм реакции окисления воды в присутствии комплексов меди ( II ) должен быть тщательно проанализирован, чтобы проверить роль ионов меди или образования кластеров в реакции окисления воды.
Лаборатория 36: окислительно-восстановительные реакции — процедура
Оксид меди, полученный в предыдущем разделе лаборатории, не растворяется в воде, но может растворяться в серной кислоте. Когда это происходит, катионы меди (2+) и сульфат-анионы повторно вводятся посредством реакции двойного замещения. Когда цинк добавляется на заключительном этапе, ионы меди (2+) восстанавливаются до твердой меди за счет единственной реакции замещения.
Наденьте соответствующее защитное снаряжение, например лабораторный халат, перчатки и очки для защиты от брызг химикатов.
Возьмите высушенный оксид меди, который был приготовлен в последнем лабораторном упражнении, и удалите как можно больше оксида меди с фильтровальной бумаги с помощью резинового полицейского. Поместите твердое вещество и фильтровальную бумагу обратно в тот же стакан емкостью 400 мл, в котором оно хранилось.
Отметьте мерный цилиндр объемом 10 мл как «5,93 M серная кислота» и получите у инструктора 8 мл серной кислоты. Накройте градуированный цилиндр часовым стеклом и осторожно перенесите серную кислоту к капюшону. Примечание: Следующий этап эксперимента выполните в вытяжке.
Используйте пластиковую пипетку, чтобы добавить около 5 мл серной кислоты непосредственно на фильтровальную бумагу в химическом стакане.
Затем возьмитесь за фильтровальную бумагу пинцетом и с помощью металлического шпателя соскребите как можно больше твердого вещества, не разрывая фильтровальную бумагу. Используйте как можно меньше серной кислоты, чтобы промыть оксид меди, так как избыток серной кислоты потребует больше цинка позже.
Промойте оксид меди с фильтровальной бумаги 2 мл деионизированной воды и добавьте еще немного деионизированной воды в стакан. После удаления оксида меди с фильтровальной бумаги утилизируйте фильтровальную бумагу как твердые отходы.
Перемешивайте раствор до полного растворения оксида меди. Если твердое вещество не растворяется, поместите стакан на плиту и нагрейте его примерно до 60 ° C.
Добавьте 3-5 мл воды и перемешайте до растворения.Будьте осторожны, не превышайте эту температуру, так как жидкость может испариться, оставив осадок сульфата меди.
Взвесьте 1,2 г цинка и запишите точную массу в лабораторный блокнот.
Медленно добавьте в раствор половину цинка. Измельчите и перемешайте цинк с помощью палочки для перемешивания, чтобы полностью растворить все частицы. Раствор должен быть бесцветным. Если цвет все еще присутствует, добавьте еще цинка, пока цвет не исчезнет.
Когда цвет полностью исчезнет, взвесьте оставшийся цинк на чашке весов и вычтите его из исходной массы, чтобы получить массу использованного цинка.Здесь цинк прореагировал с сульфатом меди с образованием сульфата цинка и твердой меди.
Слейте супернатант из раствора в контейнер с надписью «водные отходы». Затем разогрейте конфорку до 40 ° C. Получите от инструктора 10 мл 6 M соляной кислоты в маркированном градуированном цилиндре. Закройте отверстие цилиндра часовым стеклом и верните кислоту обратно в капюшон.
Добавьте 5 мл соляной кислоты к оставшемуся осадку для растворения цинка, присутствующего в твердой меди.
Поставьте стакан на предварительно разогретую плиту и нагрейте раствор в течение 2 мин. Наблюдаемое здесь образование пузырьков — это реакция нейтрализации, протекающая с растворением цинка. Следите, чтобы реакция не закипела. Затем выключите нагреватель на конфорке.
Как только пузырьки утихнут, добавьте еще 2–3 мл соляной кислоты. Продолжайте добавлять кислоту порциями по 1 мл до полного прекращения выделения пузырьков.
Слейте супернатант, промойте осадок 5–10 мл воды и слейте оставшийся супернатант. Примечание: Если частицы меди слишком малы для декантации жидкости без их потери, установите воронку Бюхнера с фильтровальной бумагой и без вакуума. Вылейте раствор через воронку, чтобы частицы оставались на фильтровальной бумаге, затем верните частицы в стакан. Повторите этапы промывки и декантации еще два раза.
Замените фильтровальную бумагу в воронке Бюхнера на новую и слегка смочите ее водой. Затем включите на мгновение вакуум, чтобы фильтр встал на место.
Добавьте примерно 5 мл воды к медному осадку, а затем вылейте его в воронку в центре фильтровальной бумаги. Аккуратно перемешайте медь, чтобы удалить загрязнения, стараясь не порвать фильтровальную бумагу.
Включите вакуум и дайте ему поработать 2 мин.
Закройте вакуум и отсоедините трубку от колбы. Снимите воронку и слейте жидкость в контейнер для водных отходов.
Снова подсоедините воронку Бюхнера и снова присоедините вакуумную трубку.
Получите около 10 мл метанола и налейте 3 мл на медь в воронке. Затем включите вакуум и дайте меди высохнуть в течение 2 минут.
Сушат осадок метанолом еще два раза, вакуумируя после каждой промывки. Во время последней фазы сушки поместите большую резиновую пробку на воронку Бюхнера и дайте вакуумированию поработать 5 мин.Затем закройте вакуум и отсоедините вакуумную трубку.
Удалите большую пробку и дайте меди высохнуть на воздухе в течение 30 мин.
Обозначьте пустой стакан как «органические отходы» и вылейте жидкость из фильтровальной колбы в контейнер для органических отходов.
Тарируют пустую чашу весов и переносят на нее как можно больше меди с фильтровальной бумаги.

 Процедуру, шаг 7)
Процедуру, шаг 7)
 Останется красно-коричневая медь. Его можно промыть водой и передать всему классу для наблюдения. Покажите, что порошок проводит электричество, с помощью тестера цепей.
Останется красно-коричневая медь. Его можно промыть водой и передать всему классу для наблюдения. Покажите, что порошок проводит электричество, с помощью тестера цепей.
Leave A Comment