Оксид углерода (IV), Угольная кислота и ее соли — Кислородные соединения
10 января 2007
Оксид углерода (IV) (диоксид углерода, углекислый газ) — газ без цвета и запаха, не поддерживающий дыхания и горения, тяжелее воздуха. Он растворим в воде (88 объемов СО2 в 100 объемах Н2О при 20°С). При обычных давлениях твердый диоксид углерода переходит в газообразное состояние (сублимируется), минуя жидкое состояние. При обычной температуре под давлением 60 атм переходит в жидкость.
При большой концентрации оксида углерода (IV) люди и животные задыхаются. При его концентрации в воздухе до 3% у человека наблюдается учащенное дыхание, более 10% — потеря сознания и даже смерть.
Оксид углерода (IV) является ангидридом угольной кислоты Н2СО3 и обладает всеми свойствами кислотных оксидов.
При растворении СО2 в воде частично образуется угольная кислота, при этом в растворе существует следующее равновесие:
Существование равновесия объясняется тем, что угольная кислота является очень слабой кислотой (K Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли — карбонаты и кислые — гидрокарбонаты. Качественная реакция на эти соли — действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
Даже такая слабая кислота, как уксусная, намного сильнее угольной. В свободном виде угольная кислота неизвестна, так как она неустойчива и легко разлагается. Как двухосновная кислота она образует средние соли — карбонаты и кислые — гидрокарбонаты. Качественная реакция на эти соли — действие на них сильных кислот, при котором кислота вытесняется и разлагается с выделением СО2:
СО32-+ 2Н+ Н2СО3 Н2О + СО2↑,
НСО3
При пропускании выделяющегося СО2 в известковую воду выпадает белый нерастворимый осадок; этой реакцией пользуются также для обнаружения оксида углерода (IV):
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Из всех карбонатов в воде растворимы карбонаты только щелочных металлов и аммония. Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Гидрокарбонаты большинства металлов хорошо растворимы в воде.
Под действием избытка оксида углерода (IV) нерастворимые в воде карбонаты превращаются в растворимые гидрокарбонаты:
СаСО3 | + | H2O | + | CO2 | = | Са(НСО3)2 |
| взвесь в воде | избыток | |||||
Гидрокарбонаты при нагревании распадаются на карбонаты, углекислый газ и воду:
2NаНСО3 = Nа2СО3 + Н2О + СО2↑.
Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются на оксид металла и диоксид углерода:
МgСО3 = МgО + СО2
Из солей угольной кислоты наибольшее практическое значение имеет сода; известны различные кристаллогидраты соды Nа2СО3∙10Н2О, Nа2СО3. 7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называют кристаллической содой. При прокаливании получают безводную, или кальцинированную соду Nа2СО3. Широко используется также питьевая сода NаНСО3. Из других солей важное значение имеют К
7Н2О или Na2СО3.Н2О; наиболее устойчивым кристаллогидратом является Nа2СО3.10Н2О, который обычно называют кристаллической содой. При прокаливании получают безводную, или кальцинированную соду Nа2СО3. Широко используется также питьевая сода NаНСО3. Из других солей важное значение имеют К
Основные количества соды получают получают по аммиачному способу, часто его называют также методом Сольвэ.
Суть метода заключается в насыщении концентрированного раствора поваренной соли (точнее, насыщенного раствора NаСl) аммиаком при охлаждении и последующем пропускании через этот раствор СО2 под давлением. При этом идут следующие реакции:
NН3 + СО2 + Н2О = NН4НСО3,
NН4НСО3 + NаСl = NаНСО3↓ + NН4Сl.
Питьевая сода NaНСО
2NаНСО3 = Na2СО3 + СО3 + Н2О.
Нагревая раствор, содержащий хлорид аммония с известью, выделяют обратно аммиак:
2NН4Сl + Са(ОН)2 = 2NН3 + СаСl2 + 2Н2О.
Таким образом, при аммиачном способе получения соды единственным «отходом» является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Поташ К2СО
КСl + NН4НСО3 КНСО3 + NН4Сl
будет полностью обратимой (ни один из продуктов не удается выделить из сферы реакции в индивидуальном виде). Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
Поэтому карбонат калия получают действием СО2 на раствор едкого калия:
КОН + СО2 = КНСО3,
Производство соды является одним из крупнейших среди производств неорганических веществ; в настоящее время ее мировое производство составляет десятки млн. тонн.
9 класс. Химия. Неорганические соединения углерода — Неорганические соединения углерода
Комментарии преподавателяОксид углерода (II)
Оксид углерода (II), или, как его еще можно назвать, монооксид углерода, а также угарный газ – это несолеобразующий оксид. По своим физическим свойствам оксид углерода (II) – бесцветный газ, без запаха, плохо растворимый в воде. Угарным газом это вещество называют потому, что оно очень ядовито.
Монооксид углерода образуется при неполном сгорании угля или органических веществ:
2С + О2 = 2СО.
В лаборатории его легче всего получить, действуя на муравьиную кислоту концентрированной серной кислотой, которая связывает воду:
h3SO4, t
НСООН → СО↑ + Н2О
Оксид углерода (II) – сильный восстановитель, его широко используют в металлургии для восстановления металлов из их оксидов:
СО + CuO = Cu + CO2
В кислороде и на воздухе оксид углерода (II) горит голубоватым пламенем, выделяя много теплоты, при этом образуется оксид углерода (IV):
2СО + О2 = 2СО2 + 577 кДж
Оксид углерода (IV)
Оксид углерода (IV), или диоксид углерода, а также углекислый газ является типично кислотным оксидом, в котором углерод находится в степени окисления +4. Этот оксид способен взаимодействовать с водой с образованием угольной кислоты, с основными оксидами и щелочами.
Углекислый газ не имеет цвета и запаха, в 1,5 раза тяжелее воздуха и неплохо растворим в воде. Всем известная газированная вода – это раствор оксида углерода (IV) в воде. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Угольная кислота
При растворении оксида углерода (IV) в воде образуется угольная кислота:
СО2 + Н2О ↔ Н2СО3
Эта кислота относится к слабым кислотам и в водном растворе подвергается ступенчатой диссоциации:
Для угольной кислоты характерно образование кислых солей.
ОПЫТ 1. Пропустим через раствор гидроксида кальция углекислый газ, получаем нерастворимый карбонат кальция (Рис. 2).
Пропустим через раствор гидроксида кальция углекислый газ, получаем нерастворимый карбонат кальция (Рис. 2).
Ca(OH)2 + CO2 = CaCO3 ↓ + h3O
Рис. 2. Карбонат кальция
Карбонаты – соли угольной кислоты, в которых замещены оба иона водорода. Когда замещен только один ион водорода, получаются гидрокарбонаты. Большинство карбонатов – нерастворимые соединения, все гидрокарбонаты – растворимые. Нерастворимый карбонат превращается в растворимый гидрокарбонат при пропускании через раствор с осадком углекислого газа.
CaCO3 + CO2 + h3O ↔ Ca(HCO3)2
При нагревании раствора гидрокарбоната выделяется углекислый газ, и вновь образуется нерастворимый карбонат кальция.
Ca(HCO3)2 = CaCO3↓ + CO2 + h3O
Разложение гидрокарбонатов при небольшом нагревании нашло свое применение. Например, гидрокарбонат натрия (в быту он называется пищевой содой) начинает разлагаться уже при 50°С:
2NaHCO3 = Na2CO3 + h3O + CO2↑
Пищевую соду используют, например, при выпечке хлеба. При нагревании она разлагается с образованием диоксида углерода, благодаря чему хлеб становится пышным.
Для всех солей угольной кислоты характерна обменная реакция с кислотами, признаком которой является выделение углекислого газа, так как в результате этой реакции образуется угольная кислота, которая сразу разлагается на воду и углекислый газ. Например, при взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция, вода и углекислый газ:
СаСО3 + 2HCl = CaCl2 + h3O + CO2↑
Источник
http://www. youtube.com/watch?v=GSpjM5XSxwE
youtube.com/watch?v=GSpjM5XSxwE
источник презентации — http://journal-bipt.info/load/127-1-0-2331
Реакция углекислого газа с водой | Эксперимент
В этом эксперименте учащиеся используют собственный выдыхаемый воздух для исследования реакции между углекислым газом и водой. Они наблюдают образование слабой кислоты по изменению цвета кислотно-щелочного индикатора
Это относительно краткое и прямое исследование реакции углекислого газа и воды на простом уровне, которое должно занять не более 15 минут.
При реакции углекислого газа с водой образуется слабая кислота. Углекислый газ, присутствующий в выдыхаемом воздухе, вдувают в колбу, содержащую индикатор, чувствительный к небольшим изменениям рН в соответствующем диапазоне шкалы рН, и последующее изменение цвета наблюдают и регистрируют. Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Для соответствующих учащихся можно представить уравнение реакции между углекислым газом и водой.
Если учащиеся еще не знакомы с составом вдыхаемого и выдыхаемого воздуха, этот эксперимент может служить частью последовательности изучения темы дыхания и дыхания во вводном курсе естественных наук с использованием соответствующего элементарного подхода к соответствующей химии.
Для учащихся, которые уже рассмотрели тему дыхания и дыхания и знают, что двуокись углерода является важным компонентом выдыхаемого воздуха, основное внимание в этом эксперименте можно перенести на характер химической реакции (другими связанными темами могут быть кислотные дождь, газожидкостные реакции или индикаторы).
Уравнение реакции между углекислым газом и водой может быть введено для соответствующих учащихся.
Оборудование
Аппарат
- Защита глаз
- Коническая колба, 250 см 3 , 2 шт.
- Индикаторные флаконы с пипетками, 3 шт.

Химикаты
- Этанол (IDA – Промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ)
- Индикаторный раствор тимолфталеина (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Индикаторный раствор фенолового красного (ЛЕГКО ОГНЕОПАСНЫЙ), доступ к маленькому флакону с пипеткой
- Раствор гидроксида натрия, 0,4 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), маленький флакон с пипеткой
- Дистиллированная (или деионизированная) вода, 125 см 3 , 2 шт.
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Красный индикатор фенола – см. CLEAPSS Hazcard HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA).

- Тимолфталеиновый индикатор – см. карточку опасности CLEAPSS HC032. Индикатор можно приобрести в виде твердого реагента или в виде готового раствора в этаноле. Раствор можно приготовить из твердых реагентов, приготовив 5% вес./об. раствор в этаноле (IDA). Если 30 см 3 или 60 см 3 доступны флаконы-капельницы со встроенными пипетками, которые идеально подходят для дозирования растворов индикатора. Хотя сам тимолфталеин не воспламеняется, его раствор в этаноле легко воспламеняется.
- Этанол (IDA – Промышленный денатурированный спирт), CH 3 CH 2 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) – см. CLEAPSS Hazcard HC040A.
- Раствор гидроксида натрия, NaOH (водн.
 ), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
Процедура
Источник: Королевское химическое общество
Деятельность 1- Место около 125 см 23 л воды в 250 см 3 коническую колбу.
- Добавьте в воду пять или шесть капель индикатора тимолфталеина.
- Добавьте ровно столько раствора гидроксида натрия (около двух или трех капель), чтобы получился синий цвет.
- Аккуратно поговорите или подуйте в колбу, т.е. добавьте углекислый газ.
- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
- Поместите примерно 125 см 3 воды в 250 см 3 коническую колбу.
- Добавьте в воду одну или две капли фенолового красного.
- Добавьте две капли раствора гидроксида натрия, чтобы получить красный раствор.

- Продолжайте добавлять углекислый газ, пока не заметите изменение цвета.
Вопросы к классу
- Почему изменение цвета не происходит мгновенно?
- По какой причине перед каждым экспериментом добавляют несколько капель раствора гидроксида натрия (NaOH)?
Ответы на вопросы
- Количество углекислого газа в каждом вдохе невелико, поэтому для реакции со щелочью требуется много вдохов.
- Для обеспечения слабой щелочности раствора в начале и для нейтрализации любого CO 2 или любой другой изначально присутствующей кислоты.
Учебные заметки
Соломинки не нужны для вдувания выдыхаемого воздуха в колбу; достаточно просто дышать или говорить в колбу, чтобы индикатор изменил цвет.
Индикатор феноловый красный меняет цвет с желтого на красный в диапазоне рН 6,8–8,4. Тимолфталеин (также можно использовать альтернативный бромтимоловый синий) меняет цвет с синего (щелочной) на бесцветный (кислотный) в диапазоне рН 9. .3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
.3–10,5. См. Книгу рецептов CLAPSS RB000, в которой также рассматривается раствор бикарбонатного индикатора.
Со временем достаточное количество углекислого газа из дыхания учащихся растворяется и образует в растворе достаточно кислоты, чтобы изменить цвет индикатора:
CO 2 (водн.) + H 2 O(л) ⇌ H + (водн.) + HCO 3 – (водн.)
CO 2 также реагирует с NaOH. Эта реакция дает менее щелочной Na 2 CO 3 :
2NaOH(водн.) + CO 2 (г) → Na 2 CO 3 (водн.) + H 2 O(ж)
Равновесие между углекислым газом и водой можно обратить вспять нагревание слабокислого раствора чуть ниже температуры кипения. С повышением температуры растворимость углекислого газа в воде уменьшается, и он уносится в атмосферу. Поэтому концентрация растворенного диоксида углерода падает, что приводит к смещению равновесия влево и изменению цвета индикатора обратно на красный. При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
При охлаждении раствора и повторном вдувании выдыхаемого воздуха в колбу последовательность действий можно повторить.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
Теплота и свободная энергия образования воды и монооксида углерода
%PDF-1.4 % 117 0 объект > эндообъект 112 0 объект >поток application/pdf
 Документы находятся в общественном достоянии и не защищены авторским правом в США. Тем не менее, обратите особое внимание на отдельные работы, чтобы убедиться, что не указаны ограничения авторского права. Для отдельных произведений может потребоваться получение других разрешений от первоначального правообладателя.
Документы находятся в общественном достоянии и не защищены авторским правом в США. Тем не менее, обратите особое внимание на отдельные работы, чтобы убедиться, что не указаны ограничения авторского права. Для отдельных произведений может потребоваться получение других разрешений от первоначального правообладателя.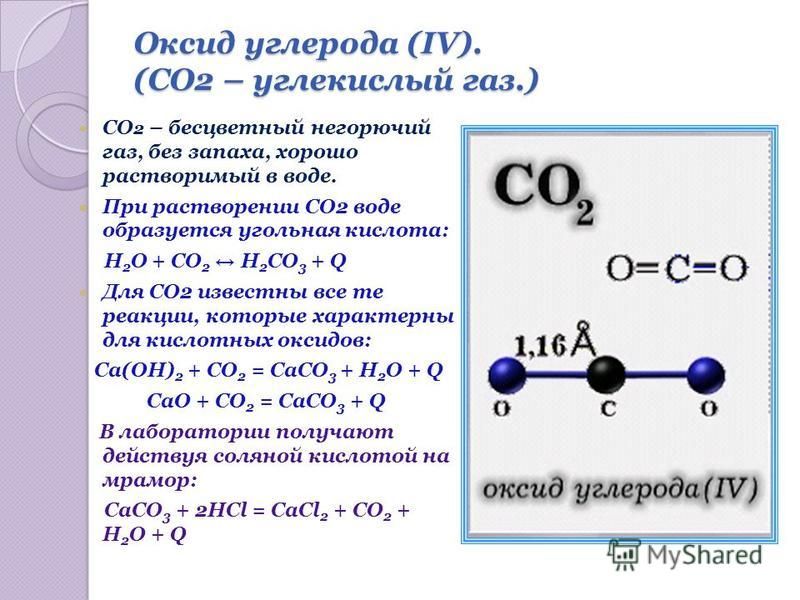



 ), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
), (РАЗДРАЖАЮЩЕЕ при используемой концентрации) – см. CLEAPSS Hazcard HC091a и книгу рецептов CLEAPSS RB085.
Leave A Comment