Строение атома кальция и схема электронной оболочки
4.4
Средняя оценка: 4.4
Всего получено оценок: 194.
4.4
Средняя оценка: 4.4
Всего получено оценок: 194.
Кальций (Ca) – щелочноземельный металл, входящий в состав минералов. Из-за строения атома кальций проявляет активные восстановительные свойства. Играет важную роль в метаболизме и постройке организма.
Строение
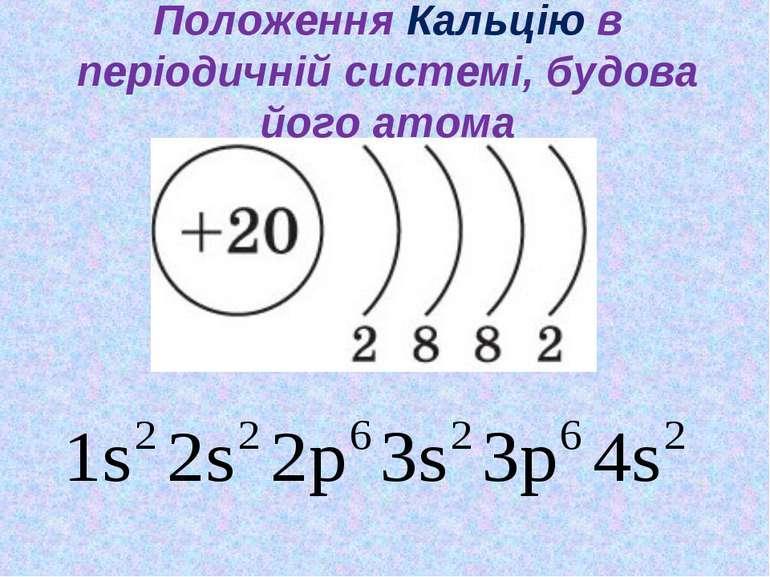
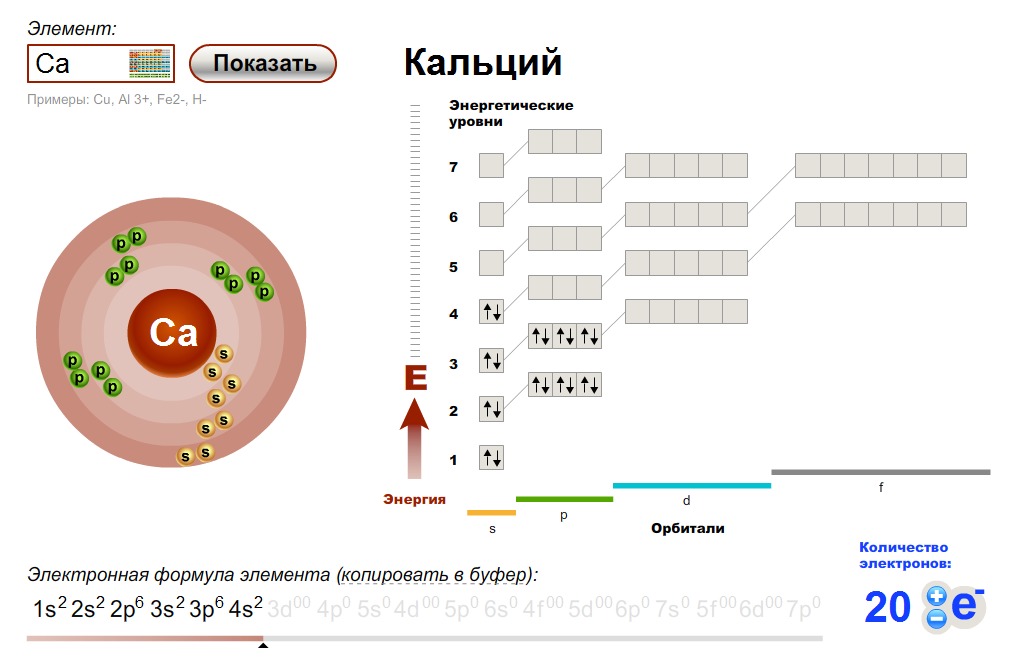
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Рис. 1. Кальций в таблице Менделеева.Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
Рис. 2. Строение атома.Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция – CaCO3, который является главным соединением известняка, мела, мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Кальций – металл серебристого цвета с температурой плавления 854°С. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Рис. 3. Кальций.Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
 Основные реакции кальция с элементами и соединения приведены в таблице.
Основные реакции кальция с элементами и соединения приведены в таблице.Взаимодействие | Продукты | Уравнение |
С кислородом при нагревании (реакция горения) | Оксид кальция (негашёная известь) | 2Ca + O2 → 2CaO |
С большинством неметаллов при нагревании | Соли | – Ca + S → CaS; – Ca + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Ca + 2C → CaC2; – 2Ca + Si → Ca2Si; – Ca + Cl2 → CaCl2 |
С фтором даже на холоде | Фторид кальция | Ca + F2 → CaF2 |
С водой | Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, выделяется водород | Ca + 2H2O → Ca(OH)2↓ + H2↑ |
С кислотами | Соли | Ca + 2HCl → CaCl2 + H2↑ |
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Кальций – активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами. Оксид кальция называется негашёной известью, гидроксид – гашёной известью. Большинство солей кальция плохо растворяются в воде. Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
5/5
Алексей Беляев
4/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 194.
А какая ваша оценка?
Строение атома кальция — Ektpol
Кальций (Ca) представляет собой щелочноземельный металл, содержащийся в минералах. Благодаря строению атома кальций проявляет активные восстановительные свойства. Он играет важную роль в метаболизме и построении тела.
Содержание
- 1 Строение
- 2 Общее описание
- 3 Химические свойства
Строение
Кальций — двадцатый элемент периодической таблицы. Он во второй группе, четвертый период. Относится к элементам s-семейства. Электронная структура атома кальция 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Рис. 1. Кальций в периодической таблице.
Ядро атома содержит 20 протонов и 20 нейронов и имеет положительный заряд +20. Вокруг ядра по четырем орбитам движется 20 электронов. На последнем s энергетическом уровне находятся два спаренных электрона, поэтому валентная константа кальция равна II.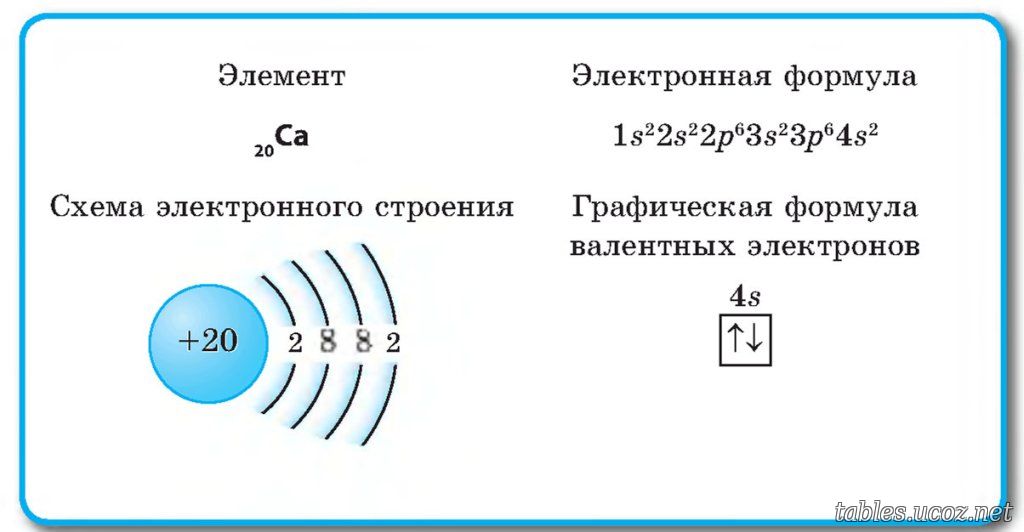
В соединениях атом кальция отдает два электрона, действуя как восстановитель. Степень окисления кальция +2.
Рис. 2. Строение атома.
Кальций не может перейти в возбужденное состояние.
Общее описание
Основным источником кальция является карбонат кальция — CaCO3, который является основным соединением в известняке, меле и мраморе. Кальций также входит в состав доломита, гипса, апатита, шпата и других полезных ископаемых.
Кальций — серебристый металл с температурой плавления 854°C. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Рис. 3. Кальций.
Кальций получают электролизом расплавленного хлорида кальция — CaCl2.
Химические свойства
Строение атома определяет химические свойства элемента. Кальций активно реагирует с простыми и сложными веществами. Благодаря способности быстро связывать кислород, образуя на поверхности оксидную пленку, кальций хранят под слоем парафина или керосина в герметично закрытой таре. Основные реакции кальция с элементами и соединениями приведены в таблице.
Основные реакции кальция с элементами и соединениями приведены в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом при нагревании (реакция горения) | оксид кальция (негашеная известь) | 2Са + О2 → 2СаО |
С большинством неметаллов при нагревании | Соль | – Ca+S → CaS; – Са + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Са+2С → СаС2; – 2Ca + Si → Ca2Si; – Са + Cl2 → CaCl2 |
С фтором даже на морозе | Фторид кальция | Са + F2 → CaF2 |
С водой | Гидроксид кальция (гашеная или каустическая известь) выпадает в осадок, выделяется водород | Ca + 2h3O → Ca(OH)2↓ + h3↑ |
С кислотами | Соль | Ca + 2HCl → CaCl2 + h3↑ |
Большинство солей кальция (фторид, сульфат, карбонат кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Сколько валентных электронов у кальция?
Ответ
Проверено
260.4k+ views
Подсказка Атомный номер Ca равен 20. Валентные электроны — это те электроны, которые присутствуют в валентной оболочке или самой внешней оболочке атома.
Полный ответ:
В вопросе спрашивается, сколько валентных электронов присутствует в атоме кальция (Ca). Из низших классов мы имеем дело с другим элементом и его положением в таблице Менделеева. Мы знаем, что элементы в периодической таблице расположены в порядке возрастания атомного номера. Таким образом, с увеличением атомного номера количество электронов в атоме также увеличивается.
Атомный номер элемента равен количеству электронов, присутствующих в атоме.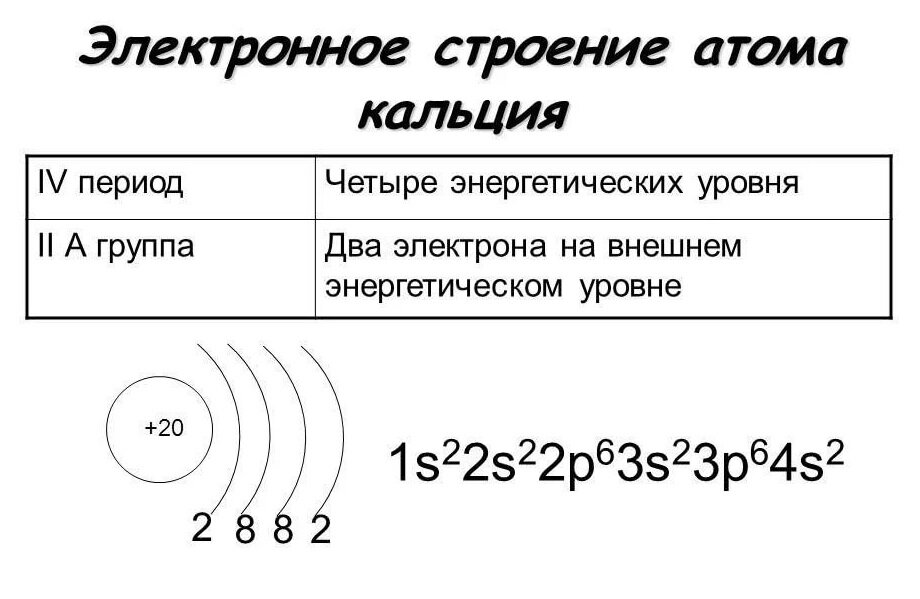 Итак, теперь давайте обсудим положение атома Ca в периодической таблице, атомный номер и валентность кальция.
Итак, теперь давайте обсудим положение атома Ca в периодической таблице, атомный номер и валентность кальция.
Кальций присутствует в левой части периодической таблицы вместе с группами щелочноземельных металлов, т.е. элементами группы 2, и присутствует в четвертом периоде группы.
Изучая периодическую таблицу, мы изучали оболочки и орбитали и знаем, что в группе по мере продвижения вниз вводится новая оболочка. Номер периода будет равен общему количеству оболочек, присутствующих в атоме. 9{2}}$
Мы знаем, что валентные электроны — это те, которые присутствуют в самой внешней оболочке атома. Из электронной конфигурации мы знаем, что самая внешняя оболочка Са — это четвертая оболочка, а количество электронов в этой оболочке — это валентные электроны. Здесь есть два валентных электрона на самой внешней оболочке.
Таким образом, число валентных электронов в Ca равно 2.
Примечание: Валентные электроны определяют валентность атома, т.е. химическая реакция с образованием химических связей. Эти электроны на самых внешних оболочках являются электронами, которые активно участвуют в образовании связи. Валентность Са равна +2, т.е. два электрона могут быть отданы атомом для химической реакции.
Эти электроны на самых внешних оболочках являются электронами, которые активно участвуют в образовании связи. Валентность Са равна +2, т.е. два электрона могут быть отданы атомом для химической реакции.
Дата последнего обновления: 22 апреля 2023
•
Всего просмотров: 260.4k
•
Просмотров сегодня: 5.58k
Недавно обновленные страницы 90 003
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю браков фейерверки 12 класса химии JEE_Main
Щелочные земляные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
900 00 Как нарисовать точечную и перекрестную диаграмму ионного оксида кальция соединение [онлайн-видео] — O Level Secondary Chemistry Tuition youtube.com/embed/3LwkcJ3h59E?version=3&rel=1&showsearch=0&showinfo=1&iv_load_policy=1&fs=1&hl=en&autohide=2&wmode=transparent» allowfullscreen=»true» sandbox=»allow-scripts allow-same-origin allow-popups allow-presentation»>В этом видео мы сосредоточимся на точечном и перекрестном рисовании ионного соединения оксида кальция CaO.
Периодическая таблица
Мы можем определить количество электронов в каждом атоме из периодической таблицы. Обратитесь к ключу в периодической таблице. Число вверху говорит нам о количестве протонов в атоме. Поскольку количество протонов и электронов в атоме одинаково, это число также говорит нам, сколько электронов имеет каждый атом. Число внизу говорит нам о количестве протонов и нейтронов в каждом атоме.
Кальций
Кальций имеет 20 электронов. Мы будем использовать точку для обозначения электронов кальция. На первой оболочке по 2 электрона, на второй и третьей по 8 электронов. Последние 2 электрона находятся на четвертой оболочке. Атом кальция хотел бы пожертвовать эти 2 электрона атому неметалла, чтобы он мог достичь конфигурации октета.
Последние 2 электрона находятся на четвертой оболочке. Атом кальция хотел бы пожертвовать эти 2 электрона атому неметалла, чтобы он мог достичь конфигурации октета.
Кислород
Неметаллом в этом соединении является кислород. У кислорода 8 электронов. Давайте использовать крест для обозначения электронов кислорода. На первой оболочке 2 электрона, на второй — 6. У кислорода только 6 электронов на самой внешней оболочке. Чтобы достичь конфигурации октета, ему нужно принять еще 2 электрона.
Итак, сейчас произойдет то, что атом кальция отдаст оба электрона кислороду, образуя ион кальция и ион оксида. Рассчитаем заряды ионов.
Ион кальция
Кальций имеет 20 протонов, что придает ему заряд +20, и 20 электронов, что придает ему заряд -20. Следовательно, общий заряд этого атома равен 0. Когда кальций отдает свой электрон неметаллу, число протонов остается неизменным. Следовательно, положительный заряд по-прежнему равен +20. Однако осталось всего 18 электронов.
Оксид-ион
Для кислорода атом имеет 8 протонов, что дает ему заряд +8, и 8 электронов, что дает ему заряд -8. Общий заряд этого атома равен 0. Когда кислород принимает электрон от кальция, число протонов остается неизменным. Следовательно, положительный заряд по-прежнему равен +8. Однако теперь есть 10 электронов. Следовательно, отрицательный заряд равен -10. Суммарный заряд оксид-иона равен -2. Поместите скобу и заряд на точечную и крестовую диаграмму.
Иногда в экзаменационных вопросах просят нарисовать только самые дальние электроны. Следовательно, мы можем опустить внутренние оболочки, и это то, что вы должны нарисовать.
В двух словах, металл теряет свои внешние электроны, образуя положительный ион, в то время как неметалл приобретает электроны, образуя отрицательный ион.

Leave A Comment