Блог Олега Кривошеина: Смеси и сплавы
Задачи из открытого банка заданий ФИПИ.
Задача 1. В сосуд, содержащий 10 литров 24-процентного водного раствора некоторого вещества, добавили 5 литров воды. Сколько процентов составит концентрация получившегося раствора?
Решение. В 10 литрах 24-процентного раствора содержится 0,24*10 = 2,4 литра вещества. В новом растворе вещества останется столько же, в объём раствора станет 15 литров.
2,4 : 15 *100% = 16%.
Ответ 16.
Задача 2. Имеется два
сплава. Первый содержит 10% никеля, второй — 35%
никеля.
Из этих двух сплавов получили третий сплав массой 150 кг, содержащий
25% никеля. На сколько килограммов масса первого сплава была меньше массы
второго?
Решение.
Обозначим через х – массу первого сплава, тогда масса второго 150 – х.
Масса
чистого никеля в первом сплаве 0,1х,
а во втором 0,35(150 – х).
0,1х+0,35(150 – х)=0,25*150, раскроем скобки и перемножим числа.
0,1х+52,5 –0,35 х = 37,5. Приведём подобные члены.
–0,25 х = -15. Умножив обе части уравнения на -4 получим х=60. Тогда масса второго сплава 1540-60=90. Масса второго сплава больше массы первого на 30 кг.
Ответ 30.
Задача 3. Смешав 24-процентный и 67-процентный растворы кислоты и добавив 10 кг чистой воды, получили 41-процентный раствор кислоты. Если бы вместо 10 кг воды добавили 10 кг 50-процентного раствора той же кислоты, то получили бы 45-процентный раствор кислоты. Сколько килограммов 24-процентного раствора использовали для получения смеси?
Решение.
Обозначим через х – количество 24-процентного раствора кислоты,
y — количество 67-процентного раствора кислоты, тогда
кислоты в первом растворе 0,24х,
кислоты во втором растворе 0,67y,
кислоты
в третьем растворе 0,41(х + y + 10), получаем
первое уравнение 0,24х+0,67y=0,41(х + y
+ 10).
кислоты в четвёртом растворе 0,45(х + y + 10),
получаем второе уравнение 0,24х+0,67y +10*0,5=0,45(х + y + 10). Раскроем скобки
0,24х+0,67y = 0,41х + 0,41y + 4,1
0,67y – 0,41y =0,41х – 0,24х +4,1
0,67y – 0,45y =0,45х – 0,24х +4,5 – 5, приводим подобные члены
0,26y =0,17х +4,1
0,22y =0,21х — 0,5, умножив оба уравнения на 10 получим
26y =17х +41
22y =21х – 5, вычтем из первого уравнения второе
4y =-4х +46, отсюда y =-х +11,5. Подставим во второе уравнение
22(-х +11,5) =21х – 5, -22х +253 =21х – 5, 258 =43х, х = 6.
Ответ 6.
Задачи для самостоятельного решения.
- В сосуд, содержащий 8 литров 15-процентного водного раствора некоторого вещества, добавили 7 литров воды. Сколько процентов составит концентрация получившегося раствора?
- В сосуд, содержащий 7 литров 15-процентного водного раствора некоторого вещества, добавили 8 литров воды. Сколько процентов составит концентрация получившегося раствора?
- В сосуд, содержащий 10 литров 14-процентного водного раствора некоторого вещества, добавили 4 литра воды. Сколько процентов составит концентрация получившегося раствора?
- Смешав 43-процентный и 89-процентный растворы кислоты и добавив 10 кг чистой воды, получили 69-процентный раствор кислоты. Если бы вместо 10 кг воды добавили 10 кг 50-процентного раствора той же кислоты, то получили бы 73-процентный раствор кислоты. Сколько килограммов 43-процентного раствора использовали для получения смеси?
- Смешав
38-процентный и 52-процентный растворы кислоты и добавив 10 кг чистой
воды, получили 36-процентный раствор кислоты.
 Если бы вместо 10 кг воды
добавили 10 кг 50-процентного раствора той же кислоты, то получили бы
46-процентный раствор кислоты. Сколько килограммов 38-процентного раствора
использовали для получения смеси?
Если бы вместо 10 кг воды
добавили 10 кг 50-процентного раствора той же кислоты, то получили бы
46-процентный раствор кислоты. Сколько килограммов 38-процентного раствора
использовали для получения смеси?
Задачи ЕГЭ на сплавы, смеси, растворы.
Задачи на сплавы, смеси, растворы встречаются и в математике, и в химии. У химиков сложнее – там вещества еще и взаимодействуют, превращаясь во что-то новое. А в задачах по математике мы просто смешиваем растворы различной концентрации. Покажем правила решения на примере задач на растворы. Для сплавов и смесей – действуем аналогично.
. В сосуд, содержащий литров -процентного водного раствора некоторого вещества, добавили литров воды. Сколько процентов составляет концентрация получившегося раствора?
В решении подобных задач помогает картинка. Изобразим сосуд с раствором схематично — так, как будто вещество и вода в нем не перемешаны между собой, а отделены друг от друга, как в коктейле. И подпишем, сколько литров содержат сосуды и сколько в них процентов вещества.
Первый сосуд содержал литра вещества. Во втором сосуде была только вода. Значит, в третьем сосуде столько же литров вещества, сколько и в первом:
.
. Смешали некоторое количество -процентного раствора некоторого вещества с таким же количеством -процентного раствора этого вещества. Сколько процентов составляет концентрация получившегося раствора?
Получаем:
Ответ: .
. Виноград содержит влаги, а изюм — . Сколько килограммов винограда требуется для получения килограммов изюма?
Внимание! Если вам встретилась задача «о продуктах», то есть такая, где из винограда получается изюм, из абрикосов урюк, из хлеба сухари или из молока творог — знайте, что на самом деле это задача на растворы. Виноград мы тоже можем условно изобразить как раствор. В нем есть вода и «сухое вещество». У «сухого вещества» сложный химический состав, а по его вкусу, цвету и запаху мы могли бы понять, что это именно виноград, а не картошка. Изюм получается, когда из винограда испаряется вода. При этом количество «сухого вещества» остается постоянным. В винограде содержалось воды, значит, «сухого вещества» было . В изюме воды и «сухого вещества». Пусть из кг винограда получилось кг изюма. Тогда
У «сухого вещества» сложный химический состав, а по его вкусу, цвету и запаху мы могли бы понять, что это именно виноград, а не картошка. Изюм получается, когда из винограда испаряется вода. При этом количество «сухого вещества» остается постоянным. В винограде содержалось воды, значит, «сухого вещества» было . В изюме воды и «сухого вещества». Пусть из кг винограда получилось кг изюма. Тогда
от от
Составим уравнение:
и найдем .
Ответ: .
. Имеется два сплава. Первый сплав содержит никеля, второй — никеля. Из этих двух сплавов получили третий сплав массой кг, содержащий никеля. На сколько килограммов масса первого сплава меньше массы второго?
Пусть масса первого сплава равна x, а масса второго равна y. В результате получили сплав массой .
Запишем простую систему уравнений:
Первое уравнение — масса получившегося сплава, второе — масса никеля.
Решая, получим, что .
Ответ: .
. Смешав -процентный и -процентный растворы кислоты и добавив кг чистой воды, получили -процентный раствор кислоты. Если бы вместо кг воды добавили кг -процентного раствора той же кислоты, то получили бы -процентный раствор кислоты. Сколько килограммов -процентного раствора использовали для получения смеси?
Если бы вместо кг воды добавили кг -процентного раствора той же кислоты, то получили бы -процентный раствор кислоты. Сколько килограммов -процентного раствора использовали для получения смеси?
Пусть масса первого раствора , масса второго равна . Масса получившегося раствора равна . Запишем два уравнения, для количества кислоты.
Решаем получившуюся систему. Сразу умножим обе части уравнений на , поскольку с целыми коэффициентами удобнее работать, чем с дробными. Раскроем скобки.
Ответ: .
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Задачи ЕГЭ на сплавы, смеси, растворы.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена: 09.03.2023
3 простых шага для решения задач на смеси
Пытаетесь понять свои задания по алгебре? Разбивка проблем на управляемые этапы может значительно облегчить их решение. Здесь учитель Tucson Blake C. делится своим простым трехэтапным процессом для решения смешанных задач с легкостью:
или более компонентов. Вам необходимо определить результат смешивания — количество, такое как цена или процент.
Это задачи, которые задают вам такие вопросы, как: если вы смешаете 10 фунтов арахиса стоимостью 1,50 доллара США за фунт с кешью стоимостью 2,50 доллара США за фунт, сколько фунтов орехов кешью вам нужно добавить, чтобы полученная смесь имела стоимость за фунт 1,95 доллара? Или, если смешать 10 литров чистой воды с 15 литрами 30-процентного спиртового раствора, какой концентрации получится смесь?
Не позволяйте путанице помешать вам найти ответ! Выполнив несколько простых шагов, вы в мгновение ока почувствуете себя знатоком задач по алгебре!
Как решать математические задачи Смеси ? При чтении проблем со смесью вы можете почесать голову, но на самом деле для поиска ответа требуется всего несколько шагов. Это видео дает хороший обзор, затем мы объясним каждый шаг ниже.
Это видео дает хороший обзор, затем мы объясним каждый шаг ниже.
https://youtu.be/MuQKUCoOpOkВидео не может быть загружено, так как отключен JavaScript: Mixture Word Problem (https://youtu.be/MuQKUCoOpOk)
Спасибо Кэрол Дель Веккио за использование этого видео !
3 шага для решения Проблемы со смесямиЭти шаги обобщают то, что вы только что посмотрели в видео. Если у вас есть определенные проблемы со смесью алгебры, которые вы пытаетесь решить, это может помочь решить их, читая каждый шаг ниже.
Если вы родитель и пытаетесь помочь своему ребенку с математикой, узнайте больше о том, как вы можете помочь, когда не знаете, с чего начать !
Шаг 1: Установите проблему Проблемы со смесями имеют три суммы или количества. Два из них — количество смешиваемых веществ, а третье — количество полученной смеси. Каждая сумма имеет свой собственный % силы или стоимости. Итак, установка следует именно этой логике. Я приведу по одному примеру для каждого из двух типов.
Я приведу по одному примеру для каждого из двух типов.
Проблемы решения:
(% 1) (сумма 1) + (% 2)(сумма 2)= (конечный %)(общая сумма)
Проблемы со смесью:
(стоимость 1)(сумма 1 ) + (стоимость 2) (сумма 2) = (конечная стоимость) (общая сумма)
Теперь важно понимать, что в этих задачах любая из этих шести частей информации может быть неизвестной. Ваша задача — заполнить всю предоставленную информацию, выяснить неизвестное и заменить его на «x».
Полезные советы по настройке:
- Хотя не имеет значения, используете ли вы 22 или 0,22 для 22% для решения задач, вы должны придерживаться своего выбора для всей задачи.
- Концентрация чистой кислоты составляет 100%.
- Концентрация чистой воды 0%.
Все задачи на смеси требуют нахождения «x», чтобы получить ответ. Давайте рассмотрим сложный пример, чтобы показать вам, как это работает на практике.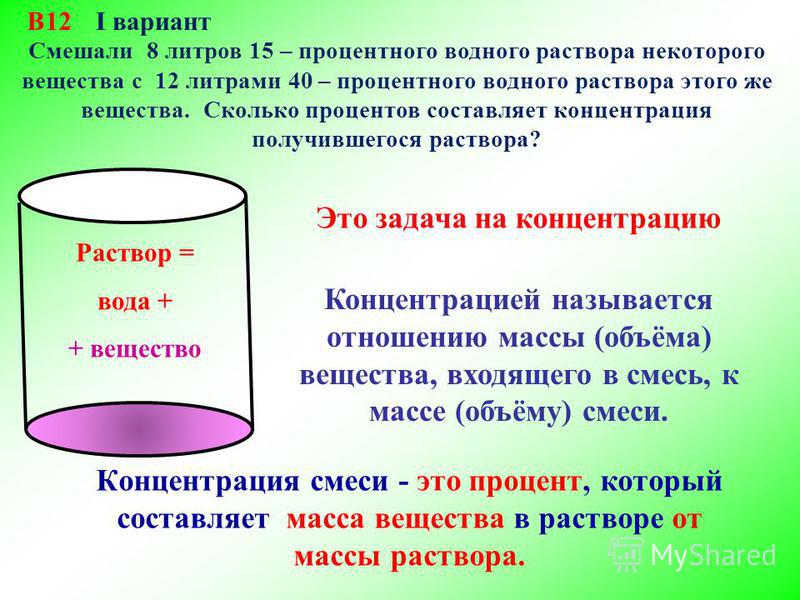
«Вам нужен 15% раствор кислоты для определенного теста, но ваш поставщик поставляет только 10% раствор и 30% раствор. Вместо того, чтобы доплачивать за то, чтобы он сделал 15% раствор, вы решаете смешать 10% раствор с 30% раствором, чтобы сделать свой собственный 15% раствор. Вам понадобится 10 литров 15% раствора кислоты. Сколько литров 10% раствора и 30% раствора нужно использовать?»
Итак, у этого есть дополнительная маленькая хитрость, которая может часто встречаться в таких проблемах. Вы можете заметить, что нам дали числовое значение только одного количества (10 литров). В этой задаче у нас есть два неизвестных: количество в литрах, необходимое как для 10-процентного, так и для 30-процентного растворов.
Это может показаться проблемой, но есть простое решение. Подумайте об этом так. В сумме мы должны получить 10 литров. Обозначим количество литров, необходимое для нашего 10%-ного раствора, как «х». Итак, сколько литров нам нужно для 30% раствора? Ну и всего литров 10. Х литров было сказано, так что то, что осталось от наших выделенных 10 литров, то 10-х.
Х литров было сказано, так что то, что осталось от наших выделенных 10 литров, то 10-х.
Используя этот простой прием, мы можем выразить обе наши неизвестные через одну переменную. Даже не имеет значения, какую из сумм мы называем х, а какую 10-х, при условии, что мы отслеживаем, какая из них есть какая.
Шаг 3: Решите задачуДавайте возьмем тот же пример задачи, перечислив только самые важные ее части.
«Вы решили смешать 10% раствор с 30% раствором, чтобы сделать свой собственный 15% раствор. Вам понадобится 10 литров 15% раствора кислоты. Сколько литров 10% раствора и 30% раствора нужно использовать?»
Хорошо, давайте поместим это в нашу установку для решения проблемы. Я буду указывать проценты в десятичной форме, так как это мое предпочтение.
0,10(неизвестная сумма) + 0,30(неизвестная сумма 2) = 0,15(10)
Теперь мы говорили об определении x выше. Мы выяснили, что надо назвать одну из неизвестных х, а другую 10-х. Итак, теперь давайте подставим это.
Итак, теперь давайте подставим это.
.10(x)+.30(10-x) = .15(10).
Теперь решим!
Шаг 1: Фольга
.10x+3-.3x= 1,5
Шаг 2: X с одной стороны путем вычитания 3 с обеих сторон
.1x-.3x= -1,5
-.2x= -1.5
Шаг 4: Разделить на -.2
x= 7.5
Шаг 5: Найти другие неизвестные
Шаг 6: Интерпретация результата
Так как x был использован для заполнения неизвестного количества 10% раствора, у нас есть 7,5 литров 10% раствора и 2,5 литра 30% раствора, чтобы в итоге получить 10 литров наш желаемый 15% раствор.
Шаг 7: Проверьте свою работу
0,10 (7,5) + 0,30 (2,5) = 0,15 (10)
0,75+0,75 = 1,5
Это верное утверждение
Вот и все. Попрактикуйтесь в этом методе, и, прежде чем вы это узнаете, решение проблем со смесями станет пустяком!
Вас также может заинтересовать: Рекомендации приложения Math Tutor для всех уровней навыков
Удачи Решение Проблемы со смесью ! Как и в случае с любой новой задачей, требуется практика, чтобы понять, как решать задачи на смеси. После того, как вы выполните эти простые шаги несколько раз, вы сможете делать это более естественно и быстро.
После того, как вы выполните эти простые шаги несколько раз, вы сможете делать это более естественно и быстро.
Работа с репетитором по алгебре может быть полезна при изучении нового навыка. Это позволяет вам совершенствовать свое мастерство с профессионалом, который поможет вам наилучшим образом соответствовать вашему стилю обучения!
Блейк С. репетиторы по различным предметам, включая математику, чтение и подготовку к SAT, в Тусоне, Аризона, и онлайн. Стипендиат Флинна, Блейк С. окончил Аризонский университет со степенью в области управления бизнесом в 2007 году, а затем вернулся, чтобы получить вторую степень бакалавра в области музыкальной теории, истории и критики, которая была присуждена в декабре 2013 года. Узнайте больше о Блейке здесь!
Фото Роберта Кадмора
Сьюзи С.
Различные проблемы с законом о газе 26-50
ChemTeam: Различные задачи по газовому праву 26–50Различные задачи по газовому праву
#26 — 50
Проблемы 1-10
Проблемы 11-25
Вернуться в меню KMT & Gas Laws
Задача №26: Контейнер, наполненный 2,780 моль N 2 , 3,990 моль O 2 и 13,42 моль CO 2 , имеет давление 1,252 атм.
а) Какова молярная доля каждого газа?
(б) Каково парциальное давление каждого газа?
(c) Насколько большой контейнер вам понадобится, чтобы вместить эти газы, если вы находитесь при температуре 32,0 °C?
Решение:
1) Складываем родинки:
2,780 + 3,990 + 13,42 = 20,19 моль
2) Рассчитайте каждую мольную долю:
азот —> 1 — (0,1976 + 0,6647) = 0,1377
кислород —> 3,990/20,19 = 0,1976
углекислый газ —> 13,42 / 20,19 = 0,6647
3) Рассчитайте каждое давление:
азот —> 1,252 — (0,2473 + 0,8322) = 0,1725 атм.
кислород —> (0,1976) (1,252 атм) = 0,2473 атм
углекислый газ —> (0,6647) (1,252 атм) = 0,8322 атм
4) Рассчитать объем:
PV = нРТ(1,252 атм) (V) = (20,19 моль) (0,08206 л атм/моль К) (305 К)
В = 403,6 л
Задача №27: При какой температуре в градусах Цельсия образец неона весом 1,00 г будет оказывать давление 500 торр в контейнере объемом 5,01 л?
Решение:
1) Определить моль присутствующего неона:
1,00 г / 20,18 г/моль = 0,049554 моль
2) Используйте PV = nRT для определения температуры в Кельвинах:
(500 торр/760 торр/атм) (5,01 л) = (0,049554 моль) (0,08206 л атм/моль К) (T)3) Преобразовать в градусы Цельсия:Т = 810.
К
Я преобразовал из торр в атм, потому что я запомнил R в «L атм / моль K». Я не хотел искать (или вычислять) R в «л Торр/моль К»9.0015
810. − 273 = 537 °С
Задача № 28: Если атом аргона имеет радиус 1,54 Å, какой процент образца аргона в STP на самом деле является пустым пространством?
Решение:
1) Предположим, что присутствует 1,00 моль аргона. В STP этот образец занимает следующий объем:
22,414 лВы можете узнать это как молярный объем.
2) Я переведу 1,54 Å в см:
(1,54 Å) (10¯ 8 см / Å) = 1,54 х 10¯ 8 см
3) Используя формулу объема шара, определим объем одного атома Ar:
В = (4/3) (3,14159) (1,54 x 10¯ 8 см) 3В = 1,5298 x 10¯ 23 см 3 5
4) Определить объем (в литрах), занимаемый 1,00 моль атомов Ar:
(1,5298 x 10¯ 23 см 3 / атом) (6,022 x 10 23 атом¯ 1 = 9,2124556 см 39,2124556 см 3 = 0,0092124556 л
5) Определить долю пространства, занимаемого атомами Ar:
0,0092124556 / 22,414 = 0,000411 (не процент, а десятичная сумма)6) Определяем процент незанятого пространства:
1 — 0,000411 = 0,99958999,9589% (решил не округлять)
Проблема № 29: Контейнер объемом 2,5 л, наполненный H 2 при 468 мм рт.
ст. соединяется с 3,5-литровым контейнером, содержащим Cl 2 при 264 мм рт.ст. Два контейнера имеют одинаковую температуру. Величина (незначительного объема) между двумя контейнерами открывается, и газы необратимо реагируют, следуя этой реакции:
H 2 (г) + Cl 2 (г) —> 2HCl(г)Предположим, что реакция идет до конца и температура в конце такая же, как и в начале. Каково общее давление внутри двух емкостей в конце реакции?
Решение:
Ключевым фактором является то, что общее количество молекул не меняется в результате реакции. На каждый водород, реагирующий с одним хлором, образуется два HCl. Общее количество частиц не меняется. Другой способ выразить это состоит в том, что общее количество молей газа не меняется.
Поскольку моли и температура остаются постоянными, эта задача теперь сводится к задаче по закону Бойля, включающей только давление и объем. Контейнер для водорода увеличивается с 2,5 л (до 6,0 л), а контейнер для хлора увеличивается с 3,5 л (до 6,0 л).
Общее давление внутри 6,0 л находится с помощью расчета закона Бойля:
P 1 V 1 + P 2 V 2 = P 3 V 3(468 мм рт. (6,0 л)
х = 349 мм рт.ст.
Вы также можете сделать это с помощью двух вычислений по закону Бойля, а затем сложить результаты:
(468 мм рт. ст.) (2,5 л) = (x) (6,0 л)
(264 мм рт.ст.) (3,5 л) = (у) (6,0 л)Затем вы должны добавить x и y, чтобы получить 349 мм рт.ст.
Проблема №30: Контейнер объемом 1,00 л содержит 0,20 г H 2 . Контейнер объемом 2,00 л содержит 8,0 г X. Два контейнера находятся при одинаковом давлении и температуре. Определить молекулярную массу Х.
Решение:
1) Для обоих газов P, R и T постоянны. Давайте переставим:
PV = нРТВ = n (RT/P)
Пусть RT/P обозначается K
В = нК
2) Решите V = nK для K, используя H 2 :
1,00 л = (0,10 моль) (К)К = 10 л/моль
3) Решите V = nK для n, используя газ X:
2,00 л = (n) (10, л/моль)n = 0,20 моль
4) Определить молекулярную массу X:
молекулярная масса = масса / п8,0 г/0,20 моль = 40, г/моль
Задача № 31: Как влияет следующее изменение на объем 1 моль идеального газа? Начальное давление 722 торр, конечное давление 0,950 атм, начальная температура 32 °F, конечная температура 273 К.
Решение:
Получается, что 722 торр и 0,95 атм — это одно и то же давление. Кроме того, 32 ° F — это та же температура, что и ноль по Цельсию, а 273 K — это та же температура по шкале Кельвина.Поскольку давление и температура не изменяются, объем не изменяется.
Задача №32: Газ имеет объем 2,80 л при 1,17 атм и 0 °C. При какой температуре он имеет объем 7,50 л при 517 мм рт.ст.?
Решение:
1) Единицы должны совпадать. Преобразовать атм в мм рт.ст.:
1,17 атм умножить на 760. мм рт.ст. / атм = 889,2 мм рт.ст.2) Используйте комбинированный газовый закон:
P 1 V 1 T 2 = P 2 V 2 T 1(889,2 мм рт. ) (273 К)
Т 2 = 425 К
Это 152 °C
Задача №33: Чтобы идентифицировать двухатомный газ (X 2 ) исследователь провела следующий эксперимент: она взвесила пустую 4,60-литровую колбу, затем наполнила ее газом при 1,80 атм и 22,0 °C и снова взвесила.
Разница в массе составила 9,50 г. Определите газ.
Решение:
В = 4,60 л, P = 1,80 атм, T = 295 К, m = 9,50 гНайдите молярную массу
PV = nRT —> уравнение идеального газа
PV = mRT/M —> n = m/M, где m = масса, M = молярная масса
М = мРТ / (PV)
М = [(9,50 г) (0,08206 л атм/моль К) (295 К)] / [(1,80 атм) (4,60 л)]
M = 27,77 г/моль …. округлить до двух значащих цифр …. 28 г/моль
Газ азот, N 2 .
Задача №34: Смесь газов азота и неона содержит одинаковое количество молей каждого газа и имеет общую массу 10,0 г. Какова плотность этой газовой смеси при 500 К и 15,0 атм? Предположим, что поведение идеального газа.
Решение №1:
1) Начните с определения количества молей каждого газа в вашей смеси. Поскольку они оба равны (но имеют разные молярные массы), вы можете написать:
10 = 28,014x + 20,18xx = 10/48,194 = 0,2075 моль каждого газа
и 0,4150 молей всего.
2) Используйте V = nRT/P:
В = [(0,4150 моль) (0,08206 л атм / моль К) (500, К)] / 15,0 атмВ = 1,13516 л
3) Поскольку плотность = масса/объем:
d = 10,0 г / 1,13516 л = 8,81 г/лРешение №2:
1) Будем манипулировать PV = nRT. Пусть m = масса газа в задаче, а M = молярная масса этого газа. Следовательно, n = m / M, и мы имеем следующее:
PV = нРТPV = мРТ/М
2) Переставьте, чтобы получить m/V, то есть плотность газа:
ПМ = мРТ/В3) Пусть d = плотность, и поскольку m/V равно плотности, замените m/V на «d»:
ПМ = дРТ4) Переставить, чтобы выделить плотность:
д = PM/RT5) Пусть M = 24,097, подставьте значения в символьное уравнение и решите:d = [(15,0 атм) (24,097 г/моль)] / [(0,08206 л атм/моль К) (500, К)]d = 8,81 г/л
24,097 происходит из-за того, что количество молей азота и неона равно.
Это означает, что количество молекул азота и атомов неона одинаково, поэтому 24,097 — это среднее между 28,014 и 20,18.
Задача №35: Плотность газообразного соединения, содержащего углерод и водород, равна 0,716 г/л при нормальных условиях. Какова молярная масса соединения? Предположите относительно идентичности соединения.
Решение:
1) Переставить PV = nRT следующим образом:
PV = (m/M)RT (m = масса; M = молярная масса)PM = (м/В)RT (м/В — плотность газа, обозначенная буквой «d»)
d = PM / RT
Так как нам нужна молярная масса:
М = дРТ/П
2) Подставьте значения и решите:
х = [(0,716 г/моль) (0,08206 л атм / моль К) (273 К)] / 1,00 атмх = 16,0 г/моль
Метан, CH 4 , имеет эту молярную массу.
Задача №36: Этиленоксид получают реакцией этилена и кислорода при 270-290°С и 8-20 атм. Для предотвращения потенциально опасных скачков давления емкость, в которой происходит эта реакция, имеет предохранительный клапан, предназначенный для выпуска газа при достижении давления 25,0 атм.
Если в реакционном сосуде объемом 15,0 м 3 содержится 7,80 х 10 3 молей газа, то при какой температуре давление достигнет 25,0 атм? (Есть 1000 л на кубический метр.)
Решение:
1) Определить литры:
15,0 м 3 умножить на 1000 л/м 3 = 1,50 x 10 4 л2) Используйте PV = nRT:
(25,0 атм) (15000 л) = (7800 моль) (0,08206 л атм/моль К) (x)х = 586 К
Это 313 °C.
Задача №37: Одна колба содержит 2,00 л H 2 при давлении 409 торр и соединена с 1,00 л колбой N 2 при неизвестном давлении. Две колбы соединены друг с другом трубкой и клапаном (оба незначительного объема). Общее давление в колбах составляет 340 торр после открытия клапана между двумя колбами. Определить начальное давление N 2 в колбе 1,00 л.
Решение:
P 1 В 1 + P 2 В 2 = P 3 В 3(409) (2) + (3) (0) = (3)
818 + х = 1020
x = 202 торр
Задача №38: Гелий-кислородные смеси используются водолазами, чтобы избежать поворотов, и используются в медицине для лечения некоторых респираторных заболеваний.
Какой процент (в молях) Не содержится в гелий-кислородной смеси с плотностью 0,5380 г/л при 25,0 °С и 721,0 мм рт.ст.?
Решение:
1) Определить общее количество молей газа в смеси:
PV = нРТ(721,0 мм рт.ст. / 760,0 мм рт.ст./атм) (1,00 л) = (n) (0,08206 л атм/моль К) (298 К)
n = 0,038795 моль
2) Пусть x = масса He и y = масса O 2 . Используйте два одновременных уравнения с двумя неизвестными:
х + у = 0,5380 г(х/4,0026) + (у/31,9988) = 0,038795 моль
3) Замена y на y = 0,538 − x
(х / 4,0026) + [(0,5380 — х) / 31,9988)] = 0,0387954) Очистите дроби, умножив каждый член на (4,0026) * (31,9988):
(4,0026) (31,9988) (х / 4,0026) + (4,0026) (31,9988) [(0,5380 — х) / 31,9988)] = (0,038795) (4,0026) (31,9988)(31,9988) (х) + (4,0026) (0,5380 — х) = 4,968957
5) И продолжаем:
31,9988x + 2,153399 — 4,0026x) = 4,96895727,9962х = 2,815558
х = 0,1006 г гелия
Следовательно, 0,4374 г кислорода
6) Преобразовать в моли:
He —> 0,1006 г / 4,0026 г/моль = 0,02513 моль
O 2 —> 0,4374 г / 31,9988 г/моль = 0,01367 моль7) Рассчитайте мольную долю, затем мольные проценты гелия:
0,02513 / (0,02513 + 0,01367) = 0,6477мольных процента —> 0,6477 * 100 = 64,77% (по молям)
Вот краткое руководство по молярным процентам.
Проблема №39: Жесткая камера из нержавеющей стали содержит CH 4 при давлении 140 торр и избытке кислорода, O 2 , при 170,0 °С. Внутри камеры зажигается искра, полностью сжигающая метан. Как изменится общее давление в камере после реакции? Примите постоянную температуру в течение всего процесса.
Решение:
CH 4 (г) + 2O 2 (г) —> CO 2 (г) + 2H 2 O(г)1) Вот краткое объяснение:
на каждые три моля реагентов (один CH 4 и два O 2 ) израсходованы, образуются три моля продуктов (один CO 2 и два H 2 O). Отсутствие изменения общего количества газообразного вещества означает отсутствие изменения давления в конце реакции.2) Вот более подробное объяснение:
140. торр давления CH 4 означает давление не менее 280 торр O 2 .Так как оно избыточное, назовем давление O 2 280 + x.
Давайте рассмотрим молярное отношение CH 4 к CO 2 , равное 1 к 1. Поскольку это происходит при постоянном объеме и постоянной температуре, давление напрямую связано с использованными и произведенными молями. Таким образом, мы заключаем, что создается давление 140 торр CO 2 .
Поскольку мы находимся при температуре 170 °C, производимая вода является газообразной. Давайте рассмотрим молярное отношение CH 4 к H 2 O, равное 1:2. Это сообщает нам, что создается давление водяного пара 280 торр.
Поскольку O 2 находится в избытке, мы знаем, что величина давления «x» остается после того, как 280 торр O 2 израсходованы.
Заключение: давление в камере в конце реакции не изменилось.
Задача №40: Чтобы наполненный газом воздушный шар поднялся в воздух, плотность газа в воздушном шаре должна быть меньше плотности воздуха.
Считайте, что воздух при 25,0 ° C и 1,00 атм имеет молярную массу 28,96 г / моль. Определите минимальную температуру, до которой шар, наполненный кислородом при 1,00 атм, должен был бы нагреться, прежде чем он мог бы начать подниматься в воздух. (Не обращайте внимания на массу самого воздушного шара.)
Решение:
1) Я собираюсь манипулировать PV = nRT, чтобы получить выражение, равное плотности газа — (м/В) ниже:
PV = нРТn = масса / молярная масса = m / M r
PV = (m/M r ) (RT) = mRT/M r
P = (1/V) (mRT/M r ) = (м/В) (RT/M r )
м/В = (P) (M r /RT) = PM r /RT
2) Воздушный шар начнет подниматься при температуре чуть выше этого условия:
плотность воздуха = плотность кислорода(м/об) воздуха = (м/об) кислорода
3) Для этого подставим в приведенное выше уравнение следующее:
(с AIR ) (M R, AIR )/(RT AIR ) = (P O 2 ) (M R, O 2 ) (M R, O 2 ) (M R, O 2 ) (M R, O 2 ) (M R, O 2 ) (M R, O 2 )) 2 )M r, воздух / T воздух = M r, O 2 / T O 2
Обратите внимание, как выпадают P и R.
T O 2 = T воздух раза [M r, O 2 / M r, воздух ]
4) Численное решение:
T O 2 = 298,15 раз (31,9994/28,96)T O 2 = 329,44 К = 56,29 °С
Как только наполненный кислородом баллон превысит 56,29 °C, он начнет подниматься.
Задача №41: 6,87 г газа занимают 3,45 л при 25,0 °C и 88,8 кПа. Сколько молей газа? Какова молекулярная масса газа?
Решение:
1) Используйте PV = nRT
(88,8 кПа) (3,45 л) = (n) (8,31447 л кПа/моль К) (298 К)n = 0,123646 моль (я сохранил некоторые сторожевые цифры)
2) Определите молекулярную массу:
6,87 г / 0,123646 моль = 55,6 г/моль (до трех цифр)Комментарий: я использую значение R, полученное с этой страницы. Он находится во второй таблице, примерно посередине второго столбца.
Иногда встречается учитель, который НАСТАИВАЕТ, чтобы вы использовали значение R, равное 0,08206 л атм / моль К. В этом случае преобразуйте единицу измерения кПа в атм следующим образом:
88,8 кПа / 101,325 кПа/атм = 0,876388 атмЗадача №42: 17,3 грамма газа занимают 1096 мл при 85,0 °C и 192 кПа. Какова молекулярная масса газа?
Решение:
1) Используйте PV = nRT
(192 кПа / 101,325 кПа/атм) (1,096 л) = (n) (0,08206 л атм/моль К) (358 К)n = 0,0706937 моль (я сохранил некоторые сторожевые цифры)
2) Определите молекулярную массу:
17,3 г / 0,0706937 моль = 245 г/моль (до трех цифр)Комментарий: в этой задаче я использовал 0,08206 л атм/моль К для значения R и этого коэффициента:
(192 кПа / 101,325 кПа/атм)преобразует давление из кПа в атм.
Задача № 43: Какова молекулярная масса газа с плотностью 2,78 г/л при 75,0 °C и 940,0 мм рт.
ст.?
Решение:
1) Мы будем использовать PV = nRT для определения количества молей газа в 1,00 л:
(940,0 мм рт. ст. / 760,0 мм рт. ст./атм) (1,00 л) = (n) (0,08206 л атм/моль К) (348 К)n = 0,0433115 моль
Я использовал 1,00 л, потому что плотность газа измеряется в граммах на литр, то есть в граммах на 1,00 л.
2) Определите молекулярную массу:
2,78 г / 0,0433115 моль = 64,2 г/моль3) Несколько иной подход манипулирует уравнением идеального газа до того, как будут вставлены числа, следующим образом:
PV = нРТPV = mRT/M —> n = m/M, где m = масса, M = молярная масса
М = мРТ / (PV)
М = [(2,78 г) (0,08206 л атм/моль К) (348 К)] / [(1,23684 атм) (1,00 л)]
М = 64,2 г/моль
Обратите внимание, что перед расчетом я изменил давление на атм. Если бы вы хотели сохранить значение 940 мм рт. ст., вам понадобился бы R с единицами измерения «л мм рт.
Задача № 44: Какова плотность газа этана, C 2 H 6 , при стандартной температуре?
Решение:
1) Определить количество молей в 1,00 л этана при нормальных условиях:
(1,00 атм) (1,00 л) = (n) (0,08206 л атм/моль К) (273 К)n = 0,044638 моль
2) Определить плотность в г/л:
30,0694 г/моль умножить на 0,044638 моль/л = 1,43 г/л (до трех цифр)30,0694 г/моль — молекулярная масса этана.
Задача № 45: Рассмотрим два стальных резервуара, наполненных двумя разными газами одинаковой массы при одинаковых давлении и температуре. Один баллон заполнен аргоном и имеет объем 10 литров. Другой контейнер наполнен другим газом и имеет объем 20 литров. Что из перечисленного может быть другим газом? (а) № 2 , (б) He, (в) Ne, (г) Cl 2 , (д) CO 2
Раствор:
1) Мы будем использовать Гипотезу Авогадро, чтобы решить эту проблему:
равные объемы газа при одинаковых температуре и давлении содержат одинаковое число молекул.2) Указаны равные температура и одинаковое давление. Теперь рассмотрим объемы. Если бы они были равными объемами, мы бы сказали, что было равное количество молекул газа. Однако один объем вдвое больше другого. Это означает, что объем 20 л содержит в два раза больше частиц, чем объем 10 л. (Если это поможет, представьте, что 20-литровый объем — это два 10-литровых объема, а затем проведите сравнение.)
3) Мы знаем, что два объема имеют одинаковую массу и что один заполнен Ar (молярная масса = 40 г/моль). Чтобы 20 л (с удвоенным количеством молекул газа) имели ту же массу, что и 10 л, масса каждой отдельной молекулы газа (в 20 л) должна быть вдвое меньше массы аргона.
4) Неон в концентрации 20 г/моль – правильный ответ.
Задача №46: При горении 20 см 3 газообразного алкена в избытке кислорода, 60 см 3 углекислого газа. Когда оба объема измеряются при RTP, какова формула алкена?
Решение:
1) Поскольку все происходит при одинаковых температуре и давлении (это RTP), в игру вступает гипотеза Авогадро:
Равные объемы при равных T и P содержат одинаковое количество молекул.Это означает, что 2 моля алкена дают 6 молей CO 2
Это означает следующее уравнение:
C n H 2n + O 2 —> 3CO 2 + H 2 On должно равняться 3, поэтому:
С 3 Н 6Задача №47: Верно или неверно: Три шара одинакового объема наполнены газами одинаковой температуры и давления. Газ в сфере А — чистый водород, газ в сфере В — чистый монооксид углерода, а газ в сфере С — смесь водорода и монооксида углерода. Согласно газовым законам и молекулярным формулам, все три сферы содержат одинаковое количество молекул.
Решение:
1) Государство Гипотеза Авогадро:
Равные объемы при одинаковых температуре и давлении содержат одинаковое количество молекул2) Нам сообщает проблема, что объемы равны. Кроме того, нам также сообщают, что температура и давление равны между тремя сферами.
3) Следовательно, три сферы имеют одинаковое количество молекул, и утверждение верно.
Задача № 48: Будут ли три воздушных шара, каждый из которых содержит одинаковое количество молекул разного газа при STP, иметь одинаковую массу или одинаковый объем?
Решение:
1) Присутствуют три из четырех факторов Гипотезы Авогадро:
одинаковая температура? Проверять.
такое же давление? Проверять.
такое же количество молекул? Проверять.2) Значит, присутствует и четвертый фактор:
тот же томПроблема №49: Образец газа содержит 40,1% серы и 59,9% кислорода. В ходе лабораторного эксперимента вы получаете следующие данные:
P = 1,00 атм; V = 500,0 мл; Т = 298К, а образец имел массу 1,635 г. Определите молекулярную формулу газа.
Решение:
1) Определить эмпирическую формулу газа:
сера —> 40,1 г / 32,06 г/моль = 1,251 моль
кислород —> 59,9 г/16,00 г.моль = 3,744 моль
сера —> 1,251 моль / 1,251 моль = 1
кислород —> 3,744 моль/1,251 моль = 2,99 = 3Эмпирическая формула SO 3 .
2) Переставьте PV = nRT, чтобы определить количество молей присутствующего газа:
n = PV/RTn = [(1,00 атм) (0,5000 л)] / (0,08206 л атм/моль К) (298 К)]
n = 0,020447 моль
3) Определите молекулярную массу газа:
1,635 г / 0,020447 моль = 79,96 г/моль4) Определите молекулярную формулу:
Масса эмпирической формулы (SO 3 ) составляет 80,062 г.79,96 / 80,062 = 0,9987 = 1
Молекулярная формула также SO 3
Задача №50: Азот может реагировать с паром с образованием аммиака и монооксида азота. Образец азота объемом 20,0 л при 173 °C и 772 мм рт. ст. подвергают реакции с избытком водяного пара. Продукты собирают при комнатной температуре (25,0 °С) в вакуумированную колбу объемом 15,0 л.

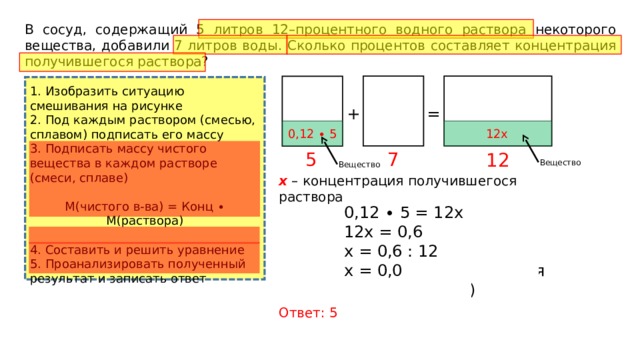 Если бы вместо 10 кг воды
добавили 10 кг 50-процентного раствора той же кислоты, то получили бы
46-процентный раствор кислоты. Сколько килограммов 38-процентного раствора
использовали для получения смеси?
Если бы вместо 10 кг воды
добавили 10 кг 50-процентного раствора той же кислоты, то получили бы
46-процентный раствор кислоты. Сколько килограммов 38-процентного раствора
использовали для получения смеси?
Leave A Comment