В ряду o s se te уменьшается. Характеристика соединений элементов главной подгруппы VI группы
Словари. Энциклопедии. История. Литература. Русский язык » Русский язык » В ряду o s se te уменьшается. Характеристика соединений элементов главной подгруппы VI группы
химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить. и получил лучший ответ
Ответ от Џна Александровна Ткаченко[активный]
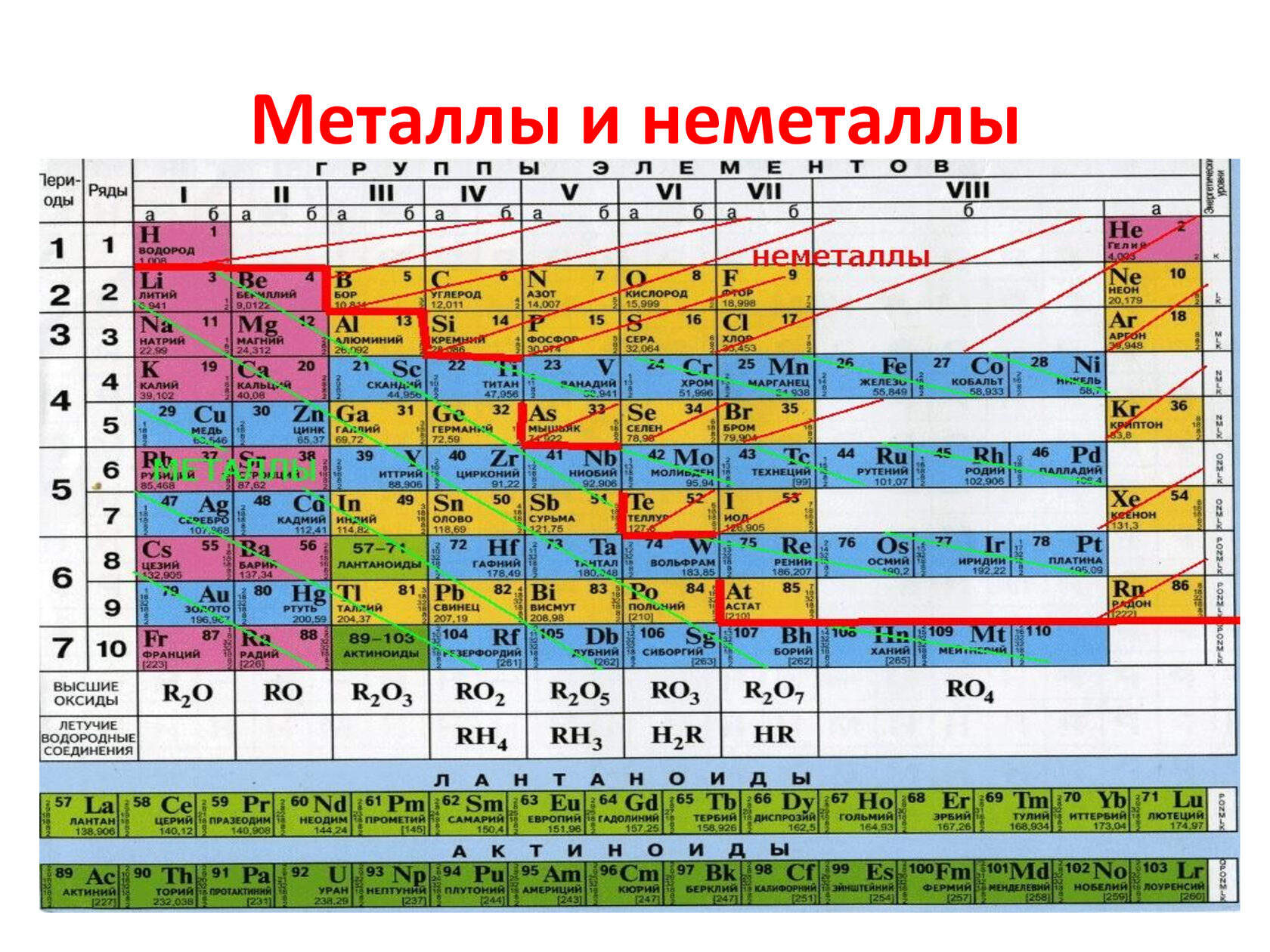
В подгруппе кислорода с возрастанием атомного номера увеличивается радиус атомов, уменьшается энергия ионизации, характеризующая металлические свойства элементов. Поэтому в ряду 0—S—Se—Te—Ро свойства элементов изменяются от неметаллических к металлическим. В обычных условиях кислород — типичный неметалл (газ) , а полоний — металл, похожий на свинец.
С увеличением атомного, номера элементов значение электроотрицательности элементов в подгруппе уменьшается. Отрицательная степень окисления становится все менее характерной. Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
Окислительная степень окисления становится все менее характерной. Окислительная активность простых веществ в ряду 02—S-Se—Те снижается. Так, если сера и значительно слабее, селен непосредственно взаимодействует с водородом, то теллур с ним в реакцию не вступает.
Возможные валентности и степени окисления элементов шестой группы главной подгруппы с точки зрения строения атома.
Ответ от 2 ответа [гуру]
Привет! Вот подборка тем с ответами на Ваш вопрос: химия, очень надо! как изменяются окислительные свойства в ряду элементов S—Se—Te—Po? ответ пояснить.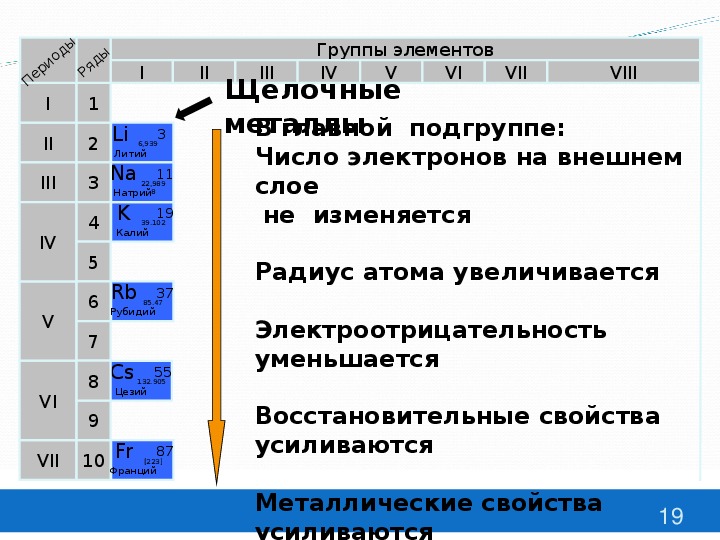
в ряду элементов O- S- Se с увеличением порядкового номера химического элемента электроотрицательность 1)увелич. 2)умен.
С-N-O-F — увеличивается
Фтор — самый электроотрицательный элемент.
Задача 840.
Исходя из строения атомов серы, селена и теллура, указать, какие валентные состояния и степени окисленности характерны для этих элементов. Каковы формулы их высших гидроксидов? Ответ пояснить.
Решение:
Атомы S, Se и Te на внешнем энергетическом уровне содержат по шесть электронов (ns
2 р
4 )
– два на s-орбитали и четыре на р-орбитали. Графически это можно представить так:
Поэтому в стационарном состоянии эти элементы, имея по два неспаренных р-электрона, проявляют ковалентность
 Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность равную 4. Графически это можно представить так:
Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность равную 4. Графически это можно представить так:путём перевода, при возбуждении атома, р- и s-электронов на d-подуровень внешнего слоя, что приводит к образованию шести неспаренных электронов у атома во внешнем электронном слое. В связи с этим, указанные элементы проявляю ковалентность равную 6. Графически это можно представить так:
Таким образом, S, Se и Te в своих соединениях могут проявлять как отрицательную (-2), так и положительную степень окисления (+2, +4 и 6). В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами – она может быть +4 и +6. Поэтому в соединениях с кислородом данные элементы могут проявлять степень окисления равную как +4, так и +6, при этом образуются два вида оксидов с формулой.
Задача 841.
Дать сравнительную характеристику водородных соединений элементов главной подгруппы VI группы, указав и объяснив характер изменения: а) термической устойчивости; б) температур плавления и кипения; в) кислотно-основных и окислительно-восстановительных свойств. Какие из этих соединений могут быть получены взаимодействием водорода с соответствующим простым веществом?
Решение:
а) Прочность химической связи в молекулах водородных соединений элементов главной подгруппы VI группы падает в ряду
H 2 O — H 2 S — H 2 Se — H 2 Te , что проявляется изменении энтальпии диссоциации молекул на атомы. Причины этого заключаются в том, что с увеличением размеров внешних электронных облаков атомов степень их перекрывания уменьшается. Поэтому при переходе от Н 2 О к Н 2 Те уменьшается степень перекрывания электронных облаков атомов водорода и атома элемента главной подгруппы VI группы, а область перекрывания располагается на большем расстоянии от ядра атома элемента (О, S, Se, Te) и сильнее экранируется возросшим числом промежуточных электронных слоёв.

б) В ряду H 2 O — H 2 S — H 2 Se — H 2 Te температуры кипения и плавления изменяются весьма закономерно, они в данном ряду плавно возрастают, тогда как при переходе к Н 2 О – они резко возрастают. Это обусловлено ассоциацией молекул воды в результате возникновения между ними водородных связей.
Закономерное возрастание температур плавления и кипения в ряду H
2 O — H
2 S — H
2 Se — H
2 Te
объясняется увеличением радиусов атомов с возрастанием порядкового номера элемента. При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса ), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н 2 О).
При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса ), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н 2 О).
в) Кислотные свойства в ряду H 2 O — H 2 S — H 2 Se — H 2 Te закономерно усиливаются. Вода имеет очень маленькую степень диссоциации, потому что молекулы её образуют ассоциаты за счёт водородных связей, так что диссоциация молекулы Н 2 О требует значительной затраты в энергии. Поэтому вода типичный слабый
Н 2 О ↔ Н + + ОН —
H 2 O, H 2 S, H 2 Se, H 2 Te – типичные кислоты. Кислотные свойства в ряду закономерно усиливаются. Объясняется это тем, что в пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра.

Вода и сероводород могут быть получены непосредственным взаимодействием водорода с кислородом или серой при достаточно высоких температурах. H 2 Se и H 2 Te получают косвенным путём, например, действием на селениды или теллуриды сильными кислотами:
Na 2 Se + H 2 SO 4 = Na 2 SO 4 + H 2 Se;
Na 2 Te + H 2 SO 4 = Na 2 SO 4 + H 2 Te.
Задача 842.
Какое вещество легче окисляется: сульфид натрия или теллурид натрия? Ответ пояснить.
Решение:
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. Поэтому ион Те 2- будет легче отдавать электроны, чем ион S 2- . Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем. Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем. Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В — исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na 2 O→K 2 O→Rb 2 O
Б. Na 2 O→MgO→Al 2 O 3
В. BeO→BaO→CaO
Г. SO 3 →P 2 O 5 →SiO 2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
что это, их характеристики и свойства, примеры / Справочник :: Бингоскул
Галогены в химии: что это, их характеристики и свойства, примеры добавить в закладки удалить из закладокСодержание:
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
- фтор F;
- хлор Cl;
- бром Br;
- йод I;
- астат At.

Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
- KCl—;
- NaCl—;
- CaCl2— и др.
В некоторых соединениях для них характерна положительная степень окисления:
- Cl2+1O;
- Cl2+7O7;
- KCl+5O3 и др.
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
Для получения галогенов в свободном состоянии, необходимо оценить способность ионов к окислению. В ряду F-Cl-Br-I увеличивается атомный радиус. Значит, иону сложнее удерживать электроны и, таким образом, окислительные свойства в ряду уменьшаются.
В ряду F-Cl-Br-I увеличивается атомный радиус. Значит, иону сложнее удерживать электроны и, таким образом, окислительные свойства в ряду уменьшаются. В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
Для галогенов характерна молекулярная решетка. С этим связаны низкие температуры плавления и кипения, которые по мере увеличения атомной массы повышаются.В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
- фтор – светло-желтый газ;
- хлор – желто-зеленый газ;
- бром – оранжевая жидкость;
- йод – темно-фиолетовые кристаллы.
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
2F2 + 2H2O → 4HF + O2
Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
- Электролиз расплава хлорида натрия
- 2 NaCl → 2Na + Cl2
- К (-): Na+ + 1 e → Na0
- А (+): 2 Cl- — 1 e → Cl20
- Электролиз раствора хлорида натрия
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
- К (-): 2H2O + 2 e → H20 + 2OH—
- А (+): 2Cl— — 1 e → Cl20
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Получение фтора
Фтор получают с помощью электролиза расплава.
2KHF2 → 2K + H2 + 2F2
Получение брома
Бром получают с помощью окисления.
2HBr + Cl2 → Br2 + 2HCl
Получение йода
Йод получают с помощью окисления.
2KI + Cl2 → I2 + 2KCl
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
- С серой
- S + Cl2 → SCl2
- С фосфором
- 2Р + 3Cl2 → 2РCl3
- 2Р + 5Cl2 → 2РCl5
- С углеродом
- 2F2 + C → CF4
- С металлами
- 2Fe + 3Cl2 → 2FeCl3 Для ряда химических элементов F-Cl-Br характерно образование галогенидов железа (III), а для йода — железа (II). При реакциях с медью продукты аналогичны.
- С водородом
- F2 + Н2 → 2НF
- С галогенами (более активные вытесняют менее активные галогены)
- Cl2 + F2 → 2ClF
В реакциях со сложными веществами галогены ведут себя как окислители.
- С водой
- Cl2 + H2O ↔ HCl + HClO
- Cl2 + 6H2O ↔ 5HCl + HClO3
- Со щелочами
- Cl2 + 2NaOHхолодная → NaCl + NaClO + H2O
- 3Cl2 + 6NaOHгорячая → 5NaCl + NaClO3 + 3H2O
- С солями
- Cl2 + 2NaI → 2NaCl + I2
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
Поделитесь в социальных сетях:
14 октября 2021, 21:13
Could not load xLike class!
Галоген | Элементы, примеры, свойства, использование и факты
Таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Жан-Батист-Андре Дюма
- Похожие темы:
- галогенорганическое соединение йод фтор хлор бром
Просмотреть весь связанный контент →
Популярные вопросы
Что такое галогенные элементы?
Галогенные элементы представляют собой шесть элементов 17-й группы периодической таблицы.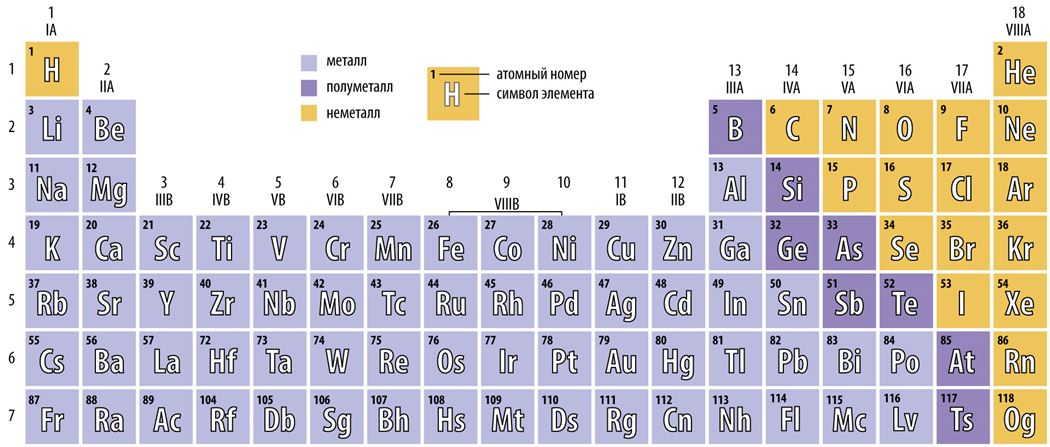 Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Группа 17 занимает вторую колонку справа в периодической таблице и содержит фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Астат и теннессин являются радиоактивными элементами с очень коротким периодом полураспада и поэтому не встречаются в природе.
Каковы основные свойства галогенных элементов?
Галогенные элементы очень реакционноспособны. С натрием они производят соли, из которых наиболее известна поваренная соль (хлорид натрия, NaCl). Каждый атом галогена имеет семь валентных электронов на внешней электронной оболочке. Поэтому, когда атом галогена может получить электрон от атома другого элемента, два атома образуют очень стабильное соединение, потому что тогда самая внешняя электронная оболочка атома галогена заполнена.
В каких случаях используются галогеновые элементы?
Хлор используется для очистки воды. Кроме того, хлор входит в состав поваренной соли, хлорида натрия, который является одним из наиболее широко используемых химических соединений. Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Фтор используется во фторидах, которые добавляют в воду для предотвращения кариеса. Йод используется как антисептик.
Почему эти элементы называются галогенами?
При взаимодействии этих элементов с натрием образуются соли. Наиболее известным из них является хлорид натрия или обычная поваренная соль (также называемая галитом). Слово галоген происходит от греческих корней hal-, что означает «соль», и -gen , что означает «производить».
галоген , любой из шести неметаллических элементов, составляющих группу 17 (группа VIIa) периодической таблицы. Галогенсодержащие элементы: фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Им дали название галоген , от греческих корней hal — («соль») и — gen («производить»), потому что все они продуцируют близкие по свойствам натриевые соли, из которых хлорид натрия — табл. соль или галит — наиболее известны.
Из-за их большой реакционной способности свободные галогенные элементы не встречаются в природе. В комбинированной форме фтор является самым распространенным из галогенов в земной коре. Процентное содержание галогенов в изверженных породах земной коры: фтора 0,06, хлора 0,031, брома 0,00016, йода 0,00003. Астатин и теннессин не встречаются в природе, так как состоят только из короткоживущих радиоактивных изотопов.
Галогенные элементы имеют большое сходство друг с другом по своему общему химическому поведению и свойствам их соединений с другими элементами. Однако наблюдается прогрессивное изменение свойств от фтора через хлор, бром и йод к астату — разница между двумя последовательными элементами наиболее заметна для фтора и хлора. Фтор является наиболее реакционноспособным из галогенов и, фактически, из всех элементов, и у него есть некоторые другие свойства, которые отличают его от других галогенов.
Хлор является наиболее известным из галогенных элементов. Свободный элемент широко используется в качестве агента для очистки воды и используется в ряде химических процессов. Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Поваренная соль, хлорид натрия, безусловно, является одним из самых привычных химических соединений. Фториды известны главным образом тем, что их добавляют в воду для предотвращения кариеса, но органические фториды также используются в качестве хладагентов и смазочных материалов. Йод наиболее известен как антисептик, а бром используется в основном для получения соединений брома, которые используются в антипиренах и в качестве пестицидов общего назначения. В прошлом дибромид этилена широко использовался в качестве присадки к этилированному бензину.
Britannica Quiz
Периодическая таблица элементов
Вероятно, самое важное обобщение, которое можно сделать о галогенных элементах, состоит в том, что все они являются окислителями; то есть они повышают степень окисления или степень окисления других элементов — свойство, которое раньше приравнивалось к соединению с кислородом, но теперь интерпретируется в терминах переноса электронов от одного атома к другому. При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
При окислении другого элемента восстанавливается сам галоген; т. е. степень окисления 0 свободного элемента снижается до -1. Галогены могут соединяться с другими элементами, образуя соединения, известные как галогениды, а именно фториды, хлориды, бромиды, йодиды и астатиды. Многие из галогенидов можно рассматривать как соли соответствующих галогеноводородов, которые при комнатной температуре и атмосферном давлении представляют собой бесцветные газы и (за исключением фтороводорода) образуют в водном растворе сильные кислоты. Действительно, общий термин 9Соль 0045 получают из каменной или поваренной соли (хлорида натрия). Склонность галогенных элементов к образованию солеобразных (т. е. высокоионных) соединений возрастает в следующем порядке: астат < йод < бром < хлор < фтор. Фториды обычно более стабильны, чем соответствующие хлориды, бромиды или иодиды. (Часто астат опускают из общих рассуждений о галогенах, потому что о нем известно меньше, чем о других элементах.)
Окислительная сила галогенов возрастает в том же порядке, т. е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
е. от астата к фтору. Поэтому из галогенных элементов с наибольшим трудом получается элементарный фтор, с наименьшим — йод. Галогенные элементы как класс относятся к неметаллам, но астат проявляет определенные свойства, напоминающие свойства металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас Химическое поведение галогенных элементов удобнее всего обсуждать с точки зрения их положения в периодической таблице элементов. В периодической таблице галогены составляют группу 17 (согласно системе нумерации, принятой Международным союзом теоретической и прикладной химии), группу, непосредственно предшествующую благородным газам. Атомы галогенов несут семь валентных электронов на внешней электронной оболочке. Эти семь крайних электронов находятся на двух различных орбиталях, обозначенных как 9.0045 s (с двумя электронами) и p (с пятью). Потенциально атом галогена может содержать еще один электрон (на орбитали p ), что придаст образующемуся иону галогенида такое же расположение (конфигурацию), что и благородный газ рядом с ним в периодической таблице. Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
Эти электронные конфигурации исключительно стабильны. Эта ярко выраженная склонность галогенов приобретать дополнительный электрон делает их сильными окислителями.
При комнатной температуре и атмосферном давлении галогенные элементы в свободном состоянии существуют в виде двухатомных молекул. В молекулярном фторе (F 2 ) атомы удерживаются вместе связью, состоящей из объединения p орбиталей каждого атома, при этом такая связь классифицируется как сигма-связь. Следует отметить, что энергия диссоциации фтора (энергия, необходимая для разрыва связи F—F) более чем на 30 % меньше, чем у хлора, но аналогична энергии йода (I 2 ). Слабость одинарной связи F—F по сравнению с хлором можно объяснить небольшим размером фтора, что приводит к уменьшению перекрывания связывающих орбиталей и увеличению отталкивания несвязывающих орбиталей. Однако в йоде p орбитали более размыты, что означает, что связь становится слабее, чем в хлоре или броме.
Группа 17: Галогены — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 574
Галогены расположены слева от инертных газов в периодической таблице. Эти пять токсичных неметаллических элементов составляют группу 17 периодической таблицы и состоят из: фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At). Хотя астат является радиоактивным и имеет только короткоживущие изотопы, он ведет себя подобно йоду и часто включается в группу галогенов. Поскольку галогенные элементы имеют семь валентных электронов, им требуется только один дополнительный электрон для формирования полного октета. Эта характеристика делает их более реакционноспособными, чем другие группы неметаллов.
Эти пять токсичных неметаллических элементов составляют группу 17 периодической таблицы и состоят из: фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At). Хотя астат является радиоактивным и имеет только короткоживущие изотопы, он ведет себя подобно йоду и часто включается в группу галогенов. Поскольку галогенные элементы имеют семь валентных электронов, им требуется только один дополнительный электрон для формирования полного октета. Эта характеристика делает их более реакционноспособными, чем другие группы неметаллов.
- Группа 17: Физические свойства галогенов
- Можно видеть, что существует закономерный рост многих свойств галогенов, спускающихся по группе 17 от фтора к йоду. Это включает их температуры плавления, температуры кипения, интенсивность их цвета, радиус соответствующего галогенид-иона и плотность элемента. С другой стороны, наблюдается закономерное уменьшение первой энергии ионизации по мере продвижения вниз по этой группе.
 В результате наблюдается закономерное увеличение способности к образованию высоких степеней окисления.
В результате наблюдается закономерное увеличение способности к образованию высоких степеней окисления. - Атомные и физические свойства галогенов
- Группа 17: общие свойства галогенов
- Группа галогенов (группа 17) Тенденции
- Физические свойства элементов группы 17
- Группа 17: Химические свойства Галогены
- Охватывает галогены группы 17: фтор (F), хлор (Cl), бром (Br) и йод (I). Включает тенденции атомных и физических свойств, окислительно-восстановительные свойства галогенов и их ионов, кислотность галогеноводородов и тесты для ионов галогенидов.
- Галогенид-ионы как восстановители
- Галогены как окислители
- Интергалогены
- Дополнительные реакции галогенов
- Окислительная способность элементов группы 17
- Тестирование на наличие ионов галогенидов
- Кислотность галогенидов водорода
- Химия фтора (Z=9)
- Фтор (F) является первым элементом в группе галогенов (группа 17) в периодической таблице.
 Его атомный номер 9и его атомный вес равен 19, и это газ при комнатной температуре. Это самый электроотрицательный элемент, учитывая, что он является высшим элементом в группе галогенов, и поэтому очень реактивен. Это неметалл и один из немногих элементов, которые могут образовывать двухатомные молекулы (F2).
Его атомный номер 9и его атомный вес равен 19, и это газ при комнатной температуре. Это самый электроотрицательный элемент, учитывая, что он является высшим элементом в группе галогенов, и поэтому очень реактивен. Это неметалл и один из немногих элементов, которые могут образовывать двухатомные молекулы (F2).
- Химия хлора (Z=17)
- Хлор является галогеном группы 17 и периода 3. Он очень реакционноспособен и широко используется для многих целей, например, в качестве дезинфицирующего средства. Из-за своей высокой реакционной способности он обычно встречается в природе в связи со многими различными элементами.
- Производство хлора
- Химия брома (Z=35)
- Бром – красновато-коричневая дымящаяся жидкость при комнатной температуры с очень неприятным запахом хлора. На самом деле его название происходит от греческого bromos или «вонь».
 Впервые он был выделен в чистом виде Балардом в 1826 году. Это единственный неметалл, который является жидкостью при нормальных комнатных условиях. Бром на коже вызывает болезненные ожоги, которые заживают очень медленно. К этому элементу в лаборатории следует относиться с величайшим уважением.
Впервые он был выделен в чистом виде Балардом в 1826 году. Это единственный неметалл, который является жидкостью при нормальных комнатных условиях. Бром на коже вызывает болезненные ожоги, которые заживают очень медленно. К этому элементу в лаборатории следует относиться с величайшим уважением.
- Химия йода (Z=53)
- Элементарный йод представляет собой темно-серое твердое вещество со слабым металлическим блеском. При нагревании при обычном давлении воздуха сублимируется до фиолетового газа. Название йод происходит от греческого ioeides, что означает «фиолетовый». Он был открыт в 1811 году Куртуа.
- Химия астата (Z=85)
- Астат — последний из известных галогенов, синтезированный в 1940 году Корсоном и другими в Калифорнийском университете. Он радиоактивный, и его название от греческого astatos означает «нестабильный». Элемент можно получить путем бомбардировки мишеней из висмута-209.



 В результате наблюдается закономерное увеличение способности к образованию высоких степеней окисления.
В результате наблюдается закономерное увеличение способности к образованию высоких степеней окисления. Его атомный номер 9и его атомный вес равен 19, и это газ при комнатной температуре. Это самый электроотрицательный элемент, учитывая, что он является высшим элементом в группе галогенов, и поэтому очень реактивен. Это неметалл и один из немногих элементов, которые могут образовывать двухатомные молекулы (F2).
Его атомный номер 9и его атомный вес равен 19, и это газ при комнатной температуре. Это самый электроотрицательный элемент, учитывая, что он является высшим элементом в группе галогенов, и поэтому очень реактивен. Это неметалл и один из немногих элементов, которые могут образовывать двухатомные молекулы (F2). Впервые он был выделен в чистом виде Балардом в 1826 году. Это единственный неметалл, который является жидкостью при нормальных комнатных условиях. Бром на коже вызывает болезненные ожоги, которые заживают очень медленно. К этому элементу в лаборатории следует относиться с величайшим уважением.
Впервые он был выделен в чистом виде Балардом в 1826 году. Это единственный неметалл, который является жидкостью при нормальных комнатных условиях. Бром на коже вызывает болезненные ожоги, которые заживают очень медленно. К этому элементу в лаборатории следует относиться с величайшим уважением.
Leave A Comment