Урок «Методы исследования белковой молекулы. Структуры белка.»
Задачи: рассмотреть методы исследования белковой молекулы, выяснить химические связи отдельных структур белка;
продолжить формирование знаний учащихся по химическому составу клетки; воспитывать у учащихся познавательный интерес к биологической науке, применять полученные знания в окружающей жизни.
Просмотр содержимого документа
«Урок «Методы исследования белковой молекулы. Структуры белка.»»
Тема: Методы исследования белковой молекулы. Структуры белка.
Задачи: рассмотреть методы исследования белковой молекулы, выяснить химические связи отдельных структур белка;
продолжить формирование знаний учащихся по химическому составу клетки; воспитывать у учащихся познавательный интерес к биологической науке, применять полученные знания в окружающей жизни.
Лекция, беседа
Исследовательский метод
Оборудование:
Структура урока:
Орг.момент, цель урока
Тестовый контроль по химическому составу клетки.
Изучение новой темы.
Изучить методы исследования белковой молекулы.
Э.Фишер в начале 20 века внес большой вклад в изучение белковой молекулы, он доказал, что ферменты пепсин и трипсин не ращепляются на пептоны, а при нагревании в присутствии кислот распадаются на аминокислоты. Фишер также подтвердил, что белки состоят из аминогрупп, молекулы которых связаны между собой пептидными связями.
В нвчале 20 века шведский химик Т.Сведберг изобрел центрифугу, сила ускорения которой в 250 тысяч раз превышает силу земного притяжения. Когда в сосуд с жидкостью налили белковый раствор и включили центрифугу, то белковые молекулы осели на дно. Таким образом Т.Сведберг установил молекулярную массу белка.
Таким образом Т.Сведберг установил молекулярную массу белка.
В 1951 Л.Полинг рентгеноструктурным методом сделал важное открытие, он установил, что заболевание «серповидно-клеточная анемия» у людей, связана с изменением глутаминовой кислоты на валиновую, путем вытеснения первой.
Полинг пришел к выводу, что прочность и устойчивость пептидных молекул обусловлена тем, что входящие в их состав атомы кислорода и азота связаны между собой водородными связями. В1954 году он был удостоен Нобелеской премии.
Рассмотреть структуры белковой молекулы.
А) Первичная – определяется порядком чередования аминокислот в цепи, которые не повторяются в другой белковой молекуле.

В) Третичная структура белка.
Полипептидная цепь, сворачиваясь, принимает форму шара. В результате взаимодействия различных остатков аминокислот спирализованная молекула образует клубок — третичную структуру, или соединения S – S.
Г) Четвертичная структура белка.
Обобщение и закрепление новой темы. Выписать в тетради выводы по теме: структура белка. Заполнить таблицу по вкладу ученых в открытие и изучение белковой молекулы на стр.28 учебника.
Дом.задание: презентация по строению белка
Рефлексия (синквейн)
Урок на тему «Органические вещества клетки. Белки, их строение и функции»
Урок биологии в 10 классе
Тема урока «Белки, особенности их строения, структурной организации, свойства и биологические функции».
Образовательные задачи урока: создание условий для полного усвоения знаний учащихся о строении аминокислот и полипептидов, о пространственной структуре белков; сформировать понятия денатурация и ренатурация; научить характеризовать основные биологические функции белков.
Развивающие задачи урока: развитие навыков самостоятельной работы с информацией при её отборе и анализе; развитие учебно-интеллектуальных умений внимательно воспринимать информацию и запоминать её; совершенствование навыков работы на компьютере.
Воспитательные задачи урока: содействовать формированию научного мировоззрения; воспитывать чувство ответственности за результаты учебного труда.
Тип урока – урок изучения новых знаний.
Ход урока
- I. Организационно-мотивационный этап.
- Сегодня на уроке мы попробуем рассмотреть со всех сторон органические вещества белки, а также попытаемся связать воедино факты и сведения об этих удивительных веществах.
- «Открытия приходят лишь к тем, кто подготовлен к их пониманию» — говорил Луи Пастер.
 Надеюсь, что вы готовы познавать и действовать, активно мыслить и делать выводы.
Надеюсь, что вы готовы познавать и действовать, активно мыслить и делать выводы.
Демонстрация слайда №1
- II. Постановка познавательной задачи.
Проблемный вопрос. С какими, на ваш взгляд, материальными объектами связаны свойства жизни?
— ответы учащихся
Уже довольно давно ученые поняли, что важную, а может быть, и главную роль во всех жизненных процессах играют белки.
Сформулируйте задачи сегодняшнего урока.
— ответы учащихся.
Демонстрация слайда № 2.
Изучение темы подчиним следующему плану.
Демонстрация слайда № 3.
- III. Решение познавательной задачи
Изложение теоретического материала по плану учебной лекции.
1.Белки – непериодические полимеры. Строение и свойства аминокислот.
Демонстрация слайда № 4
Схема строения аминокислоты |
По своей химической природе белки являются непериодическими полимерами. Мономерами белковых молекул являются аминокислоты. Вообще аминокислотой можно назвать любое соединение, содержащее одновременно аминогруппу (– NH2) и группировку органических кислот – карбоксильную группу (– СООН). Аминокислоты отличаются своими радикалами (R), в роли которых могут быть самые разные соединения. Это обусловливает большое разнообразие аминокислот.
Мономерами белковых молекул являются аминокислоты. Вообще аминокислотой можно назвать любое соединение, содержащее одновременно аминогруппу (– NH2) и группировку органических кислот – карбоксильную группу (– СООН). Аминокислоты отличаются своими радикалами (R), в роли которых могут быть самые разные соединения. Это обусловливает большое разнообразие аминокислот.
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления пищеварительными ферментами белков пищи или распада собственных запасных белков. В зависимости от аминокислотного состава белки бывают полноценными, содержащими весь набор аминокислот, и неполноценными, в составе которых отсутствуют какие-то аминокислоты.
Примеры формул аминокислот изображены на слайде № 5.
Демонстрация слайда № 5
Группа –NH2 имеет основные свойства, группа – СООН – кислотные свойства.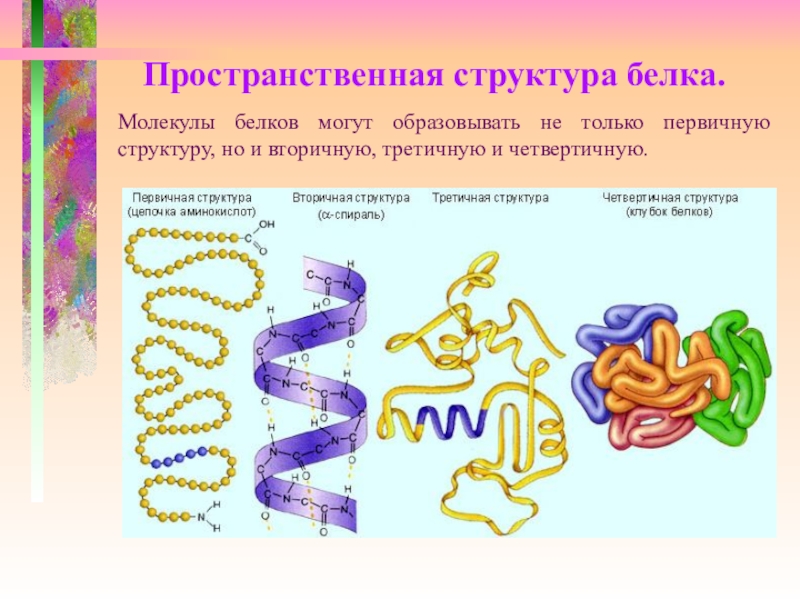 Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Амфотерными свойствами аминокислот обусловлена их способность взаимодействовать другс другом. Две аминокислоты соединяются за счет реакции конденсации в одну молекулу путем установления связи между углеродом кислотной и азотом основной групп с выделением молекулы воды.
Демонстрация слайда № 6.
Образование пептидной связи
Связь, изображенная на слайде, называется пептидной (от греч. пепсис – пищеварение). Этот термин напоминает нам о том, что эта связь гидролизуется пищеварительным ферментом желудочного сока пепсином. По природе пептидная связь является ковалентной.
Число возможных аминокислот очень велико, но белки образуют только 20 так называемых золотых, или стандартных, аминокислот (8 из них являются незаменимыми, т.к. не синтезируются в организмах животных и человека). Именно сочетание этих 20 аминокислот и дает все многообразие белков.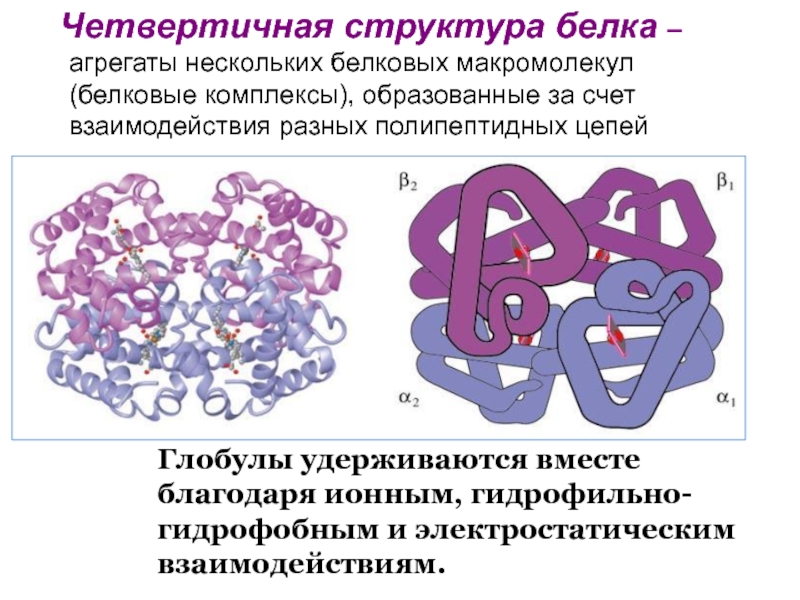 После того как молекула белка собрана, некоторые аминокислотные остатки в ее составе могут подвергаться химическим изменениям, так что в «зрелых» белках можно обнаружить до 30 различных аминокислотных остатков (но строятся все белки исходно все равно только из 20!).
После того как молекула белка собрана, некоторые аминокислотные остатки в ее составе могут подвергаться химическим изменениям, так что в «зрелых» белках можно обнаружить до 30 различных аминокислотных остатков (но строятся все белки исходно все равно только из 20!).
Демонстрация слайда № 7
Проблемный вопрос. В этом кроется источник бесконечного разнообразия белковых молекул, что является важной предпосылкой эволюционного процесса?
Пептиды различаются числом (n), природой, порядком или последовательностью своих аминокислотных остатков. Их можно сравнить со словами разной длины, в написании которых использован алфавит, состоящий из 20 букв. Из 20 аминокислот можно теоретически получить 1020 возможных вариантов цепей, длиной каждая не менее чем 10 аминокислотных остатков. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков.
2.Первичная, вторичная, третичная и четвертичная структуры белка.
Демонстрация слайда № 8.
Демонстрация слайда № 9.
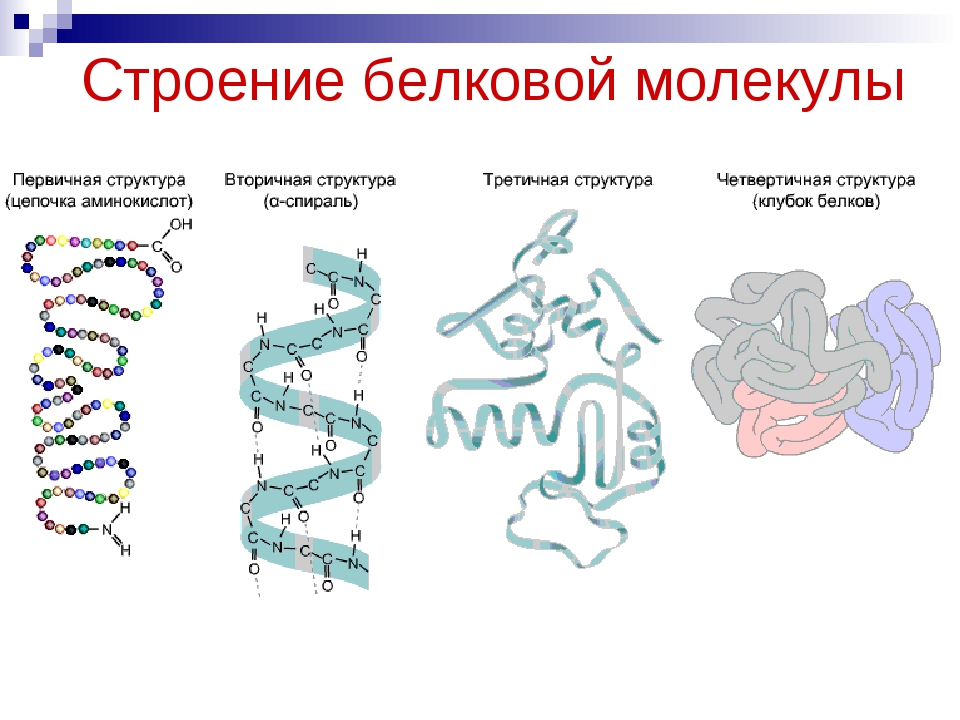
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи.
Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными. Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д. В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками.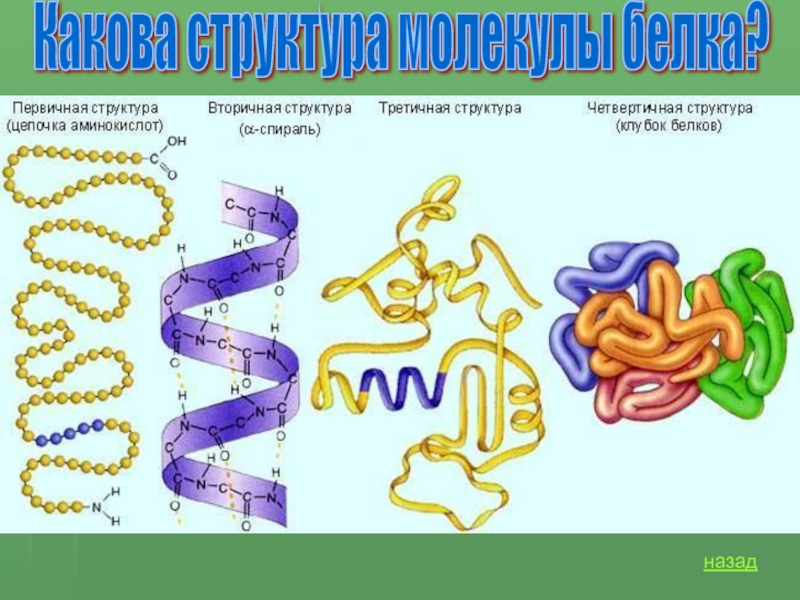
Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров.
Демонстрация слайда № 10.
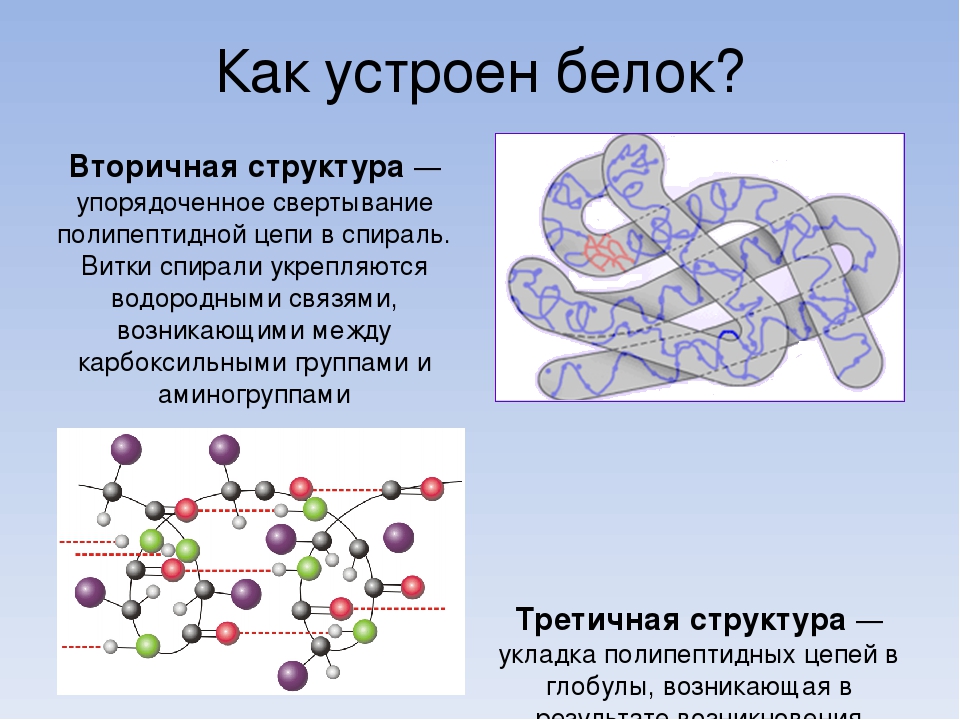
Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
Кислород группы С=О может образовывать водородные связи с водородом группы N–H (разумеется, расположенной в другой пептидной связи).
Одной из разновидностей вторичной структуры является —спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.
— спираль
Любопытно, что эта сложная красивая структура сперва была предсказана известным биохимиком Л. Полингом теоретически и лишь потом обнаружена экспериментально.
Полингом теоретически и лишь потом обнаружена экспериментально.
Демонстрация слайда № 11.
Третичная структура белка представляет собой сложную трехмерную пространственную упаковку
-спиралей и -слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов:
1) ионные, возникающие за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами;
2) гидрофобные («не любящие воду»), устанавливающиеся за счет стремления неполярных радикалов объединяться друг с другом, а не смешиваться с окружающей их водной средой;
3) дисульфидные, которые образуются между атомами серы SH-групп двух остатков аминокислоты цистеина. Эти S–S связи по своей природе являются ковалентными;
4) водородные, которые также возникают за счет взаимодействия между атомами радикалов.
Третичная структура белка не является конечной. Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции.
Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции.
Демонстрация слайда № 12
Четвертичная структура представлена ассоциантом, состоящим из нескольких полипептидных цепей. Например, сложная молекула гемоглобина состоит из двух -субъединиц (141 аминокислотный остаток) и двух -субъединиц (146 аминокислотных остатков). Каждая субъединица связана с молекулой железосодержащего гема. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, то есть способен переносить кислород. Четвертичная структура стабилизируется теми же связями, что и третичная.
Пространственная конфигурация белка, т.е. третичная и четвертичная структуры, называется конформацией. Конформация белка определяется его первичной структурой: белковая цепочка с определенной последовательностью аминокислот самопроизвольно укладывается с образованием природной пространственной конфигурации. Это получило название «самосборка белковой молекулы». Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида.
Это получило название «самосборка белковой молекулы». Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида.
Проблемный вопрос.Что произойдет, если изменить всего лишь одну аминокислоту в каком-либо полипептиде? (Мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами).
3. Свойства белков.
Белки чрезвычайно разнообразны по своим физическим и химическим свойствам. Чем это обусловлено? (Ответы учащихся)
Приведем примеры разнообразия свойств белков.
1. Есть белки растворимые (например, фибриноген) и нерастворимые (например, фибрин) в воде.
2. Есть белки очень устойчивые (например, кератин) и неустойчивые (например, фермент каталаза с легко изменяющейся структурой).
3. У белков встречается разнообразная форма молекул – от нитей (миозин – белок мышечных волокон) до шариков (гемоглобин) и т. д.
д.
Но всегда структура и свойства белка соответствуют выполняемой им функции.
Демонстрация слайда № 13.
В основе важнейшего свойства всех живых систем – раздражимости, лежит способность белков к обратимому изменению структуры в ответ на действие физических и химических факторов. Поскольку вторичная, третичная и четвертичная структуры белка создаются, в общем, более слабыми связями, чем первичная, то они оказываются менее стабильными. Например, при нагревании они легко разрушаются. При этом хотя у белка и сохраняется в целости первичная структура, он не может выполнять свои биологические функции, становится неактивным. Процесс разрушения природной конформации белка, сопровождающийся потерей активности, называется денатурацией. Разрыв части слабых связей, изменения конформации и свойств происходят и под действием физиологических факторов (например, под действием гормонов). Таким образом регулируются свойства белков – ферментов, рецепторов, транспортеров.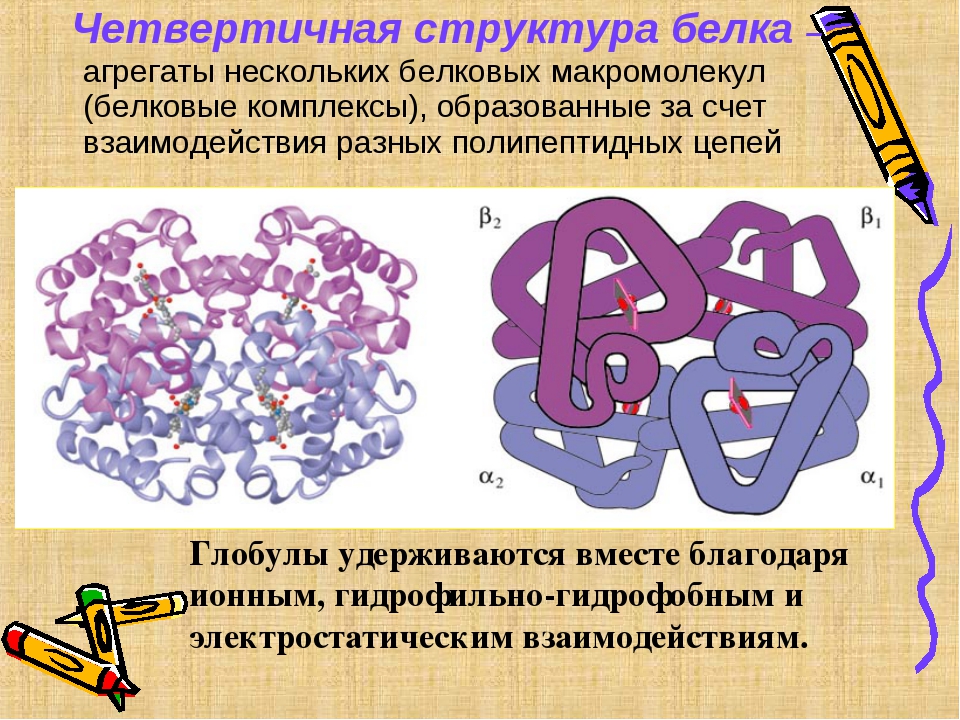
Эти изменения структуры обычно легко обратимы. Обратный денатурации процесс называется ренатурацией. Это свойство белков широко используется в медицинской и пищевой промышленности для приготовления некоторых медицинских препаратов, например, антибиотиков, вакцин, сывороток, ферментов; для получения пищевых концентратов, сохраняющих длительное время в высушенном виде свои питательные свойства.
Если восстановление пространственной конфигурации белка невозможно, то денатурация считается необратимой. Обычно это происходит при разрыве большого количества связей, например, при варке яиц.
3.Классификация белков по составу.
Демонстрация слайда №14.
Простые белки (протеины) – состоят только из аминокислот (альбумины, глобулины, гистоны, склеропротеины).
Сложные белки (протеиды) – состоят из глобулярных белков и небелкового материала.
Демонстрация слайда № 15.
Небелковую часть называют простетической группой (фосфопротеиды, гликопротеиды, нуклеопротеиды, хромопротеиды, липопротеиды, металлопротеиды, флавопротеиды).
4.Биологические функции белков.
Демонстрация слайда № 16.
Структурные – входят в различные структуры клетки и организма.
Демонстрация слайда№ 17.
Запасные – служат резервными веществами клетки и организма.
Демонстрация слайда№ 18.
Сигнальные – являются рецепторами.
Демонстрация слайда№ 1 9.
Токсины – являются ядами, используемыми живыми существами в целях защиты или нападения.
Демонстрация слайда№ 20.
Защитные – обеспечивают иммунные реакции организма.
Демонстрация слайда№ 21.
Транспортные – переносят различные вещества.
Демонстрация слайда№ 22.
Сократительные – участвуют в сокращении мышечных волокон.
Демонстрация слайда№ 23.
Ферменты – являются биологическими катализаторами.
Гормоны – являются регуляторами биологических функций.
IV. Закрепление материала.
Закрепление материала.
1. Юный биохимик, определяя содержание азота в чистом препарате белка, получил величину 39,9%. Как вы можете прокомментировать этот результат?
2. Как по молекулярной массе определить число возможных аминокислот в белке? От чего зависит возможная погрешность этой оценки?
3. Сколько может существовать вариантов полипептидных цепей, включающих 20 аминокислот и состоящих из 50 аминокислотных остатков? Из 200 остатков?
4. Заполните пропуски в тексте: «В результате взаимодействия различных … и образования … связей спирализованная молекула белка образует … структуру, которая, в свою очередь, зависит от … структуры белка, то есть от … аминокислот в молекуле полипептида. Субъединицы некоторых белков образуют … структуру. Примером такого белка является …».
5. Ионы тяжелых металлов (ртути, свинца) и мышьяка, легко связываются с сульфидными группировками белков. Зная свойства сульфидов этих металлов, объясните, что произойдет с белком при соединении с этими металлами. Почему тяжелые металла являются ядами для организма?
Почему тяжелые металла являются ядами для организма?
6. Установлено, что при достаточной калорийности пищи, но при отсутствии в ней белка у животных наблюдаются патологические явления: останавливается рост, изменяется состав крови и т.д. С чем это связано?
7. Почему белки называют «носителями и организаторами жизни»?
8. Какие особенности строения белковой молекулы обеспечивают ей выполнение многих функций, например, транспортной, защитной, энергетической?
9. Заполните пропуски в тексте: «Защитные белки называются … Они связываются с …, попадающими в организм и называемыми … Среди тысяч разнообразных белков … узнают только один … и с ним реагируют. Такой механизм сопротивления возбудителям заболеваний называется …».
V. Домашнее задание.
Демонстрация слайда № 24
VI.Подведение итогов. Рефлексия.
Демонстрация слайда № 25.
Конспект -лекция.
БЕЛКИ – сложные органические соединения (полимеры), состоящие из мономеров аминокислот.
Аминокислоты в химическом отношении представляют собой производные органических кислот, в которых водород в α-положении (при углероде, ближайшем к СООН-группе) замещен на аминогруппу (-NH2):
Все известные аминокислоты различаются между собой только радикалами. В природных белках содержится 20 аминокислот.№ п/п | Аминокислоты | Сокращенное обозначение | Примечание |
1 | Аланин | Ала | |
2 | Аргинин | Арг | Основная аминокислота; для детей незаменимая |
3 | Аспарагин | Асн | R содержит амидогруппу |
4 | Аспарагиновая кислота | Асп | Кислая аминокислота |
5 | Цистеин | Цис | R cодержит серу |
6 | Глутамин | Глн | R содержит амидогруппу |
7 | Глутаминовая кислота | Глу | Кислая аминокислота |
8 | Глицин | Гли | |
9 | Гистидин | Гис | Основная аминокислота; для детей незаменимая |
10 | Изолейцин | Иле | Незаменимая аминокислота |
11 | Лейцин | Лей | Незаменимая аминокислота |
12 | Лизин | Лиз | Основная аминокислота; незаменимая |
13 | Метионин | Мет | Незаменимая аминокислота; R содержит серу |
14 | Фенилаланин | Фен | Незаменимая аминокислота; R содержит ароматическое кольцо |
15 | Пролин | Про | Иминокислота (=NH вместо -Nh3). |
16 | Серин | Сер | |
17 | Треонин | Тре | Незаменимая аминокислота |
18 | Триптофан | Три | R содержит ароматическое кольцо; незаменимая аминокислота |
19 | Тирозин | Тир | R содержит ароматическое кольцо |
20 | Валин | Вал | Незаменимая аминокислота |
Большинство аминокислот имеет одну кислотную (карбоксильную) группу и одну основную (аминогруппу), т. е. одновременно являются и кислотами, и основаниями (нейтральные аминокислоты). Существуют основные аминокислоты (имеют 2 и более аминогрупп) и кислые аминокислоты (имеют 2 и более карбоксильных групп).
Существуют основные аминокислоты (имеют 2 и более аминогрупп) и кислые аминокислоты (имеют 2 и более карбоксильных групп).
При взаимодействии двух аминокислот возникает пептидная связь:
Образование дипептида
Огромное разнообразие белков определяется последовательностью расположения и количеством входящих в них аминокислотных остатков. Хотя четкого разграничения не существует, короткие цепи принято называть пептидами или олигопептидами, а под полипептидами (белками) понимают обычно цепи, состоящие из 50 и более аминокислот. Наиболее часто встречаются белки, включающие 100-400 аминокислотных остатков, но известны и такие, молекула которых образована 1000 и более остатками. Белки могут состоять из нескольких полипептидных цепей. В таких белках каждая полипептидная цепь носит название субъединицы.
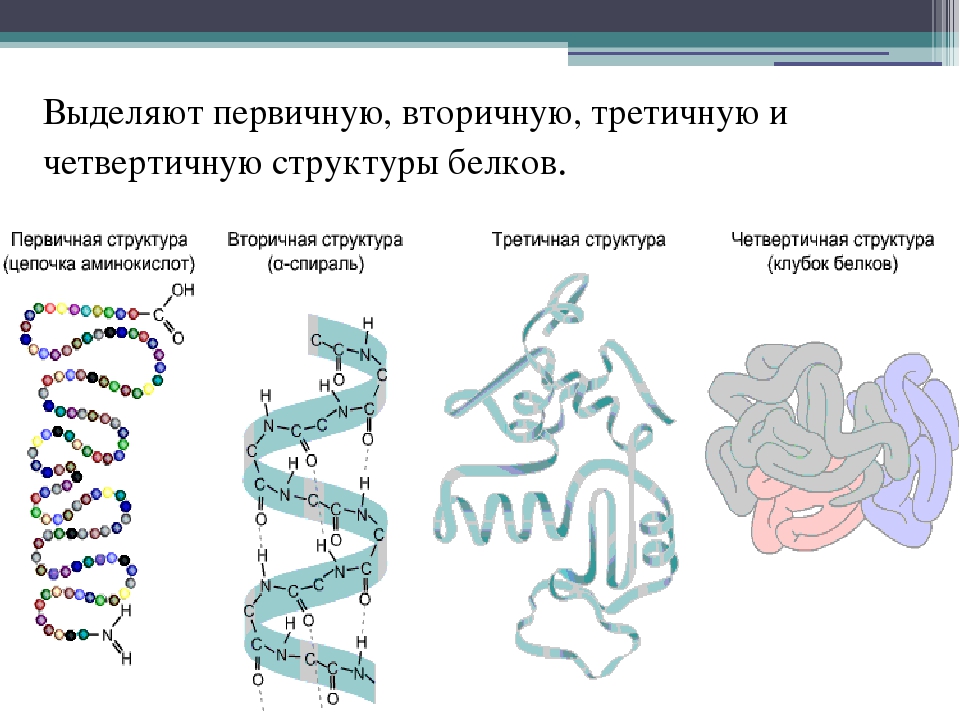
Белки имеют четыре уровня организации.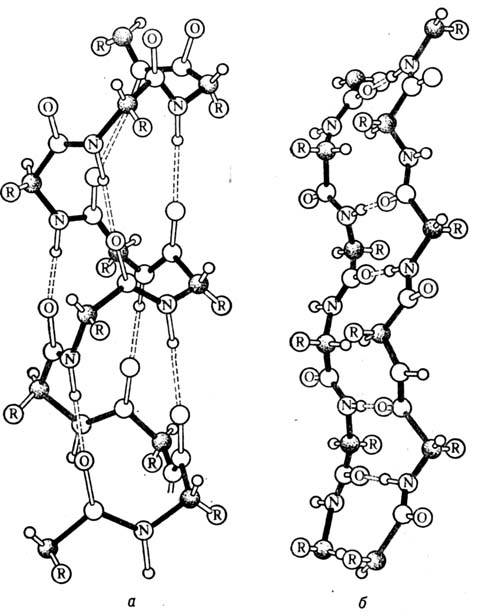
Таблица «Уровни пространственной организации белков».
Структура | Морфологические особенности структуры | Связи и силы, участвующие в образовании структуры |
Первичная | Линейная последовательность аминокислот в полипептидной цепи | Ковалентные пептидные связи. |
Вторичная | 1. α- спираль 2. β-структура | 1. Водородные связи между остатками карбоксильной группы одной аминокислоты и остатком аминогруппы другой аминокислоты, удаленной от первой на 4 аминокислотных остатка; 2. водородные связи между остатками карбоксильных и аминогрупп одной цепи и остатками одноименных групп другой цепи. |
Третичная | 1. 2. Фибрулла — β-структуры, уложенные параллельными слоями, либо суперспираль – несколько спиралей скрученных вместе (наподобие каната). | 1. ионные, водородные, ковалентные (дисульфидные мостики –S-S-), гидрофобные взаимодействия; 2. между β-структурами – в основном водородные. В суперспиралях – водородные и ковалентные (дисульфидные мостики). |
Четвертичная | Агрегат из нескольких глобул или фибрулл. | В основном силы межмолекулярного взаимодействия (в меньшей степени – водородные и ионные). |
Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной структур белка, легко разрушаются, что сопровождается потерей его биологической активности. Разрушение исходной (нативной) структуры белка, называемое денатурацией, происходит в присутствии кислот и оснований, при нагревании, изменении ионной силы и других воздействиях. Как правило, денатурированные белки плохо или совсем не растворяются в воде. Денатурация может быть обратимая, при условии сохранения первичной структуры белка. Необратимая денатурация сопровождается разрушением первичной структуры, т. е. разрушаются пептидные связи.
Как правило, денатурированные белки плохо или совсем не растворяются в воде. Денатурация может быть обратимая, при условии сохранения первичной структуры белка. Необратимая денатурация сопровождается разрушением первичной структуры, т. е. разрушаются пептидные связи.
При непродолжительном действии и быстром устранении денатурирующих факторов возможна ренатурация белка с полным или частичным восстановлением исходной структурыи биологических свойств.
СОСТАВ БЕЛКОВ.
І. Простые белки – состоят только из аминокислот (альбумины, глобулины, гистоны и др.)
ІІ. Сложные белки – состоят из глобулярных белков и небелкового материала (простетической группы).
Таблица 7 «Сложные белки».
№ п/п | Название сложных белков | Простетическая группа | Примеры |
1. 2. 3. 4. 5. | Фосфопротеиды Гликопротеиды Нуклеопротеиды Хромопротеиды Липопротеиды | Фосфорная кислота Углевод Нуклеиновая кислота Пигмент Липид | Казеин молока Гепарин, тиреотропин Белки хроматина ядра Гемоглобин, цитохром, фитохром Белки компоненты клеточных мембран |
ФУНКЦИИ БЕЛКОВ.
1. Структурная: коллаген – компонент соединительной ткани, склеротин – входит в состав наружного скелета насекомых.
2. Запасающая:яичный альбумин — белок яйца, казеин – белок молока.
3. Ферментативная: трипсин – катализирует гидролиз белков, рибулозодифосфаткарбоксилаза – катализирует карбоксилирование (присоединение СО2) рибулозодифосфата при фотосинтезе.
4. Гормональная: инсулин, глюкагон – гормоны, регулирующие уровень глюкозы в крови.
5. Транспортная: гемоглобин – переносит О2 в крови позвоночных, сывороточный альбумин – обеспечивает транспорт жирных кислот, липидов.
6. Защитная: тромбин – участвует в процессе свертывания крови, антитела (γ-глобулины) – образуют комплексы с инородными телами, обеспечивая иммунный ответ.
7. Сократительная: миозин и актин – обеспечивают сократимость мышечных волокон.
8. Токсическая: змеиный яд – участвует в составе ферментов, бактериальные токсины – синтезируются бактериями.
9. Энергетическая: 1г белка дает 17,6 Кдж энергии.
10. Рецепторная: опсин палочек и колбочек сетчатки глаза является фоторецептором.
Белки и ферменты (Реферат) — TopRef.
 ru
ru«Воронежский государственный аграрный университет
им. К. Д. Глинки»
Кафедра агроэкологии
Реферат на тему:
Белки и ферменты
Выполнил: студентка Э – 1 – 1а
Жаркова Э.Ю.
Проверил: доцент
Кольцова О.М.
Воронеж 2006
Содержание
Белки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1
Ферменты . . . . . . . . . . . . . . . . . . . . . . . . . . .
 . . . . . . 13
. . . . . . 13
Заключение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
Список использованной литературы . . . . . . . . . . . .22
1.Белки
Белки
(протеины) – высоко молекулярные,
азотосодержащие природные органические
вещества, молекулы которых построены
из аминокислот. Они являются основной
структурной и функциональной основой
жизнедеятельности всех организмов, они
обеспечивают рост, развитие и нормальное
протекание всех обменных процессов в
организме. Это мускулы, кровь, сердце,
кожа, кости… в природе существует
примерно 1010 – 1012 различных белков,
обеспечивающих жизнедеятельность
организмов всех степеней сложности: от
вирусов до человека.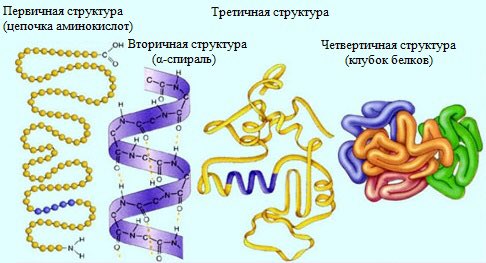
Деятельность
белков во многом связана с разными
веществами, из которых наибольшее
биологическое значение имеют нуклеиновые
кислоты. Однако решающим фактором
молекулярных механизмов всех активных
проявлений жизнедеятельности являются
белки.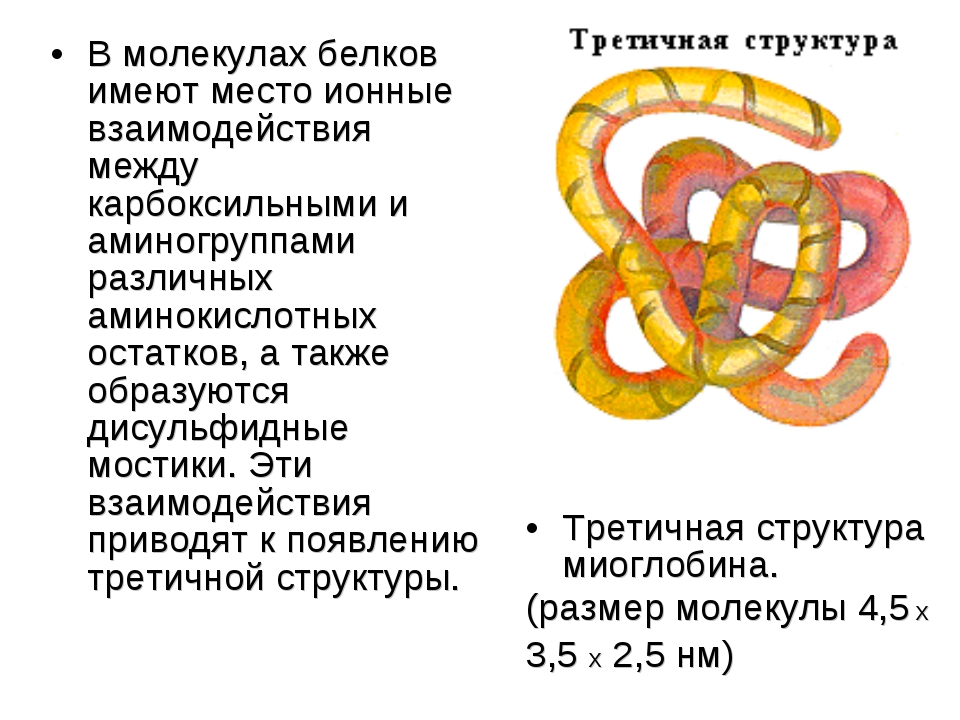 В этом смысле подтверждено и
детализировано известное положение Ф.
Энгельса о белках, как основе биологической
формы движения материи.
В этом смысле подтверждено и
детализировано известное положение Ф.
Энгельса о белках, как основе биологической
формы движения материи.
В структурном отношении молекулы белков бесконечно разнообразны – жесткость и точность уникальной организации сочетаются в них с гибкостью и пластичностью. Все это создает необозримые функциональные потенции: поэтому белки и явились тем исключительным материалом, который и послужил основой возникновения жизни на земле.
Белок – один из основных продуктов питания, как человека, так и животных. Они служат источником восстановления и обновления цитоплазмы клеток, образования ферментов и гормонов.
Строение белков:
Выделяют первичную, вторичную, третичную и четвертичную структуру белков.
Первичная структура: определяется порядком чередования аминокислот в полипептидной цепи. 20 разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены «слова» длиной в 300 – 500 букв.
 С помощью 20 букв можно написать
бесконечное множество таких длинных
слов. Известно, что замена даже одного
аминокислотного звена другим в белковой
молекуле изменяет ее свойства. В каждой
клетке содержится несколько тысяч
разных видов белковых молекул, и для
каждого из них характерна строго
определенная последовательность
аминокислот. Именно порядок чередования
аминокислот в данной белковой молекуле
определяет ее особые физико-химические
и биологические свойства.
С помощью 20 букв можно написать
бесконечное множество таких длинных
слов. Известно, что замена даже одного
аминокислотного звена другим в белковой
молекуле изменяет ее свойства. В каждой
клетке содержится несколько тысяч
разных видов белковых молекул, и для
каждого из них характерна строго
определенная последовательность
аминокислот. Именно порядок чередования
аминокислот в данной белковой молекуле
определяет ее особые физико-химические
и биологические свойства.Вторичная структура: в живой клетке многие молекулы белков или их отдельные участки представляют собой не вытянутую нить, а спираль с одинаковыми расстояниями между витками. Спираль обычно свернута в клубок. Этот клубок образован закономерным переплетением участков белковой цепи.
Положительные
и отрицательно заряженные R-группы
аминокислот притягиваются и сближают
даже далеко отстоящие друг от друга
участки белковой цепи. Сближаются и
другие участки белковой молекулы,
несущие, например «водоотталкивающие»
радикалы.
Третичная структура: в результате взаимодействия различных остатков аминокислот спирализованная молекула белка образует клубок – третичную структуру. Для каждого вида белка характерна своя форма клубка с изгибами и петлями. Третичная структура зависит от первичной, т. е. от порядка расположения аминокислот в цепи.
Четвертичная структура: некоторые белки, например гемоглобин, состоят из нескольких цепей, различающихся по первичной структуре. Объединяясь вместе они создают сложный белок, который обладает не только третичной, но и четвертичной структурой.
Классификация белков:
До сих пор нет единого принципа классификации белков. При делении всех известных белков на группы учитывают их состав (строение), физико-химические свойства (растворимость, щелочность), происхождение и роль в организме.
Белки делят на:
простые – протеины, состоящие только из аминокислот.
 К ним относятся альбумины,
глобулины, гистоны, глутелины, проламины,
протамины и протеиноиды.
К ним относятся альбумины,
глобулины, гистоны, глутелины, проламины,
протамины и протеиноиды.сложные – протеины в состав молекулы которых входят, кроме аминокислот, и другие соединения. К ним относят гликопротеиды (содержащие кроме аминокислот углеводы), липопротеиды (содержащие липиды, нуклеопротеиды (в их состав входят и нуклеиновые кислоты), фосфопротеиды (содержащие фосфорные кислоты) и хромопротеиды (имеющие пигментные металлосодержащие группы).
Физико-химические свойства белков:
Молекулы белка имеют массу от десятков тысяч до 1 миллиона и выше моль, так фермент рибонуклеаза имеет молярную массу 12700 моль, дыхательный пигмент улитки гемоцианин – 6600000 моль.
Элементарный состав большинства белков: 50,6 – 54,5% углерод, 6,5 – 7,3% водород, 21,5 – 23,5% кислород, 15 – 17,6% азот,
0,3 – 2,5% сера.
В состав ряда белков входит и фосфор.
Сведения о молекулярной массе и ряде свойств молекул белка можно получить, исследуя их осаждение в ультрацентрифуге, диффузию, вязкость, растворимость и светорассеяние. Все белки с очень большой молярной массой состоят из более мелких частиц – субъединиц.
Растворимые белки это гидрофильные коллоиды, активно связывающие воду, их растворы обладают значительной вязкостью. Их растворимость варьирует не меньше, чем другие их свойства. Одни белки легко растворяются в воде, другие требуют для растворения небольших концентраций солей, третьи переходят в раствор только под воздействием сильных щелочей и т.д.
Молекулы белка не проходят через полупроницаемые мембраны, обладают слабой способностью к диффузии. Это амфотерные электролиты, так как они имеют свободные карбоксильные (кислотные) и аминные (основные) группы.
Белки имеют
электрический заряд, изменяющийся в
зависимости от структуры белка и реакции
среды.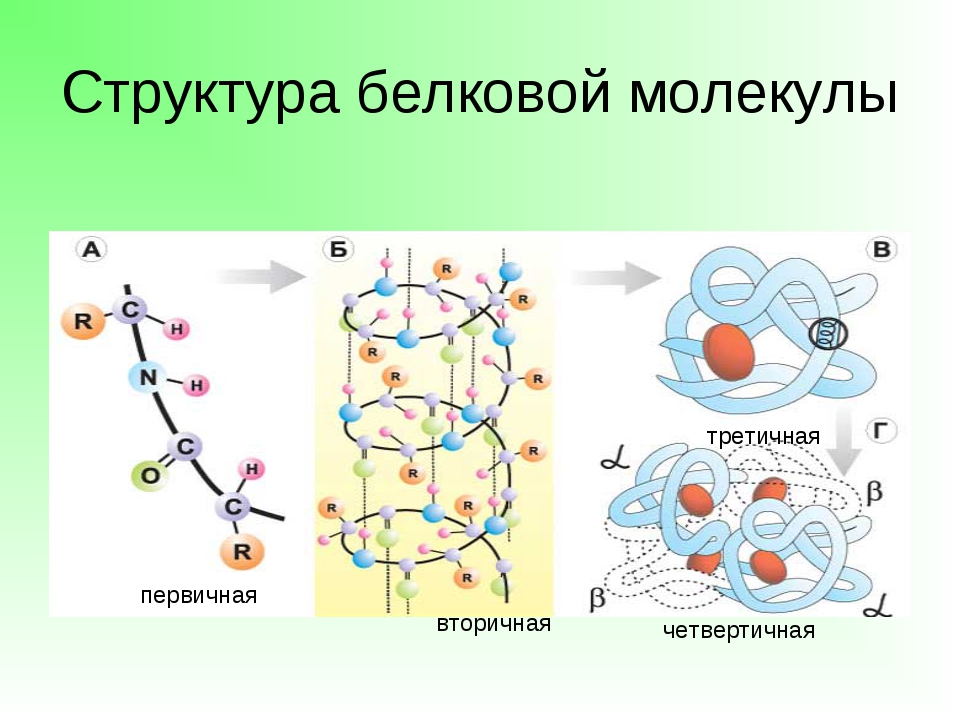 В электрическом поле растворенные
белки движутся (электрофорез), причем
направление и скорость движения
неодинаковы для различных белков.
В электрическом поле растворенные
белки движутся (электрофорез), причем
направление и скорость движения
неодинаковы для различных белков.
Биополимеры. Белки, их строение — презентация онлайн
Биополимеры. Белки, их строение1.
2.
3.
4.
5.
6.
7.
Состав белков.
Строение белков.
Белки — строительные материалы.
Белки-ферменты.
Регуляторные белки.
Белки — средства защиты.
Белки — источник энергии.
1. Состав белков.
Белки — обязательная составная часть всех
клеток.
В состав биополимеров белка входят
мономеры 20 типов – аминокислоты.
Каждая аминокислота содержит аминогруппу
(—Nh3), и кислотную карбоксильную группу
(—СООН)
Образование линейных молекул белков
происходит в результате соединения
аминокислот друг с другом.
Карбоксильная группа одной аминокислоты
сближается (—СООН) с аминогруппой другой
(—Nh3), и при отщеплении молекулы воды
между аминокислотными остатками возникает
прочная ковалентная связь, называемая
пептидной
Соединение, состоящее из большого числа
аминокислот, называется полипептидом.

Белки по своему химическому строению
является полипептидом.
В составе большинства белков находится в
среднем 300—500 остатков аминокислот.
Известно несколько очень коротких природных
белков, длиной в 3—8 аминокислот, и очень
длинных биополимеров, длиной более чем в
1500 аминокислот.
2. Строение белков.
Выделяют первичную, вторичную, третичную
и четвертичную структуры белков.
Первичная структура определяется порядком
чередования аминокислот в полипептидной
цепи.
Двадцать разных аминокислот можно
уподобить 20 буквам химического алфавита,
из которых составлены «слова» длиной в
300—500 букв. С помощью 20 букв можно
написать безграничное множество таких
длинных слов. Если считать, что замена или
перестановка хотя бы одной буквы в слове
придает ему новый смысл, то число
комбинаций в слове длиной в 500 букв
составит 20500.
Известно, что замена даже одного
аминокислотного звена другим в белковой
молекуле изменяет ее свойства.
В каждой клетке содержится несколько тысяч
разных видов белковых молекул, и для каждого
из них характерна строго определенная
последовательность
аминокислот.
Именно
порядок чередования аминокислот в данной
белковой молекуле определяет ее особые
физико-химические и биологические свойства.
Вторичная структура белковой молекулы
В живой клетке многие молекулы белков или
их отдельные участки представляют собой
спираль с одинаковыми расстояниями
между витками.
Между группами N—Н и С=0,
расположенными на соседних витках,
возникают водородные связи.
Третичная структура белка
В результате взаимодействия различных
остатков аминокислот (положительно и
отрицательно заряженные R-группы аминокислот
притягиваются и сближают даже далеко
отстоящие друг от друга участки белковой цепи)
спирализованная молекула белка образует
клубок.
Третичная структура белка
Гем – небелковая
часть
Четвертичная структура
Некоторые белки, например гемоглобин,
состоят из нескольких цепей, различающихся
по первичной структуре.
 Объединяясь
Объединяясьвместе, они создают сложный белок,
обладающий не только третичной, но и
четвертичной структурой.
Под действием ионизирующей радиации,
высокой температуры, сильного взбалтывания,
экстремальных значений pH, а также ряда
органических растворителей, таких, как спирт
или ацетон, белки изменяют свое естественное
состояние. Нарушение природной (нативной)
структуры белка называют денатурацией.
Необратимая денатурация – при нагревании
жидкого и прозрачного белка куриного яйца:
он становится плотным и непрозрачным.
Обратимая денатурация — после устранения
денатурирующего фактора многие белки
способны вернуть естественную форму, т. е.
ренатурироватъ.
Способность белков к обратимому изменению
пространственной структуры в ответ на
действие физических или химических факторов
лежит в основе раздражимости — важнейшего
свойства всех живых существ.
3. Белки — строительные материалы.
Некоторые бактерии и все растения способны
синтезировать все аминокислоты, из которых
строятся белки, используя для этого
неорганические вещества: азот и углекислый газ
воздуха, водород, полученный при расщеплении
воды (за счет энергии света), неорганические
вещества почвы.
Животные в процессе эволюции утратили
способность осуществлять синтез десяти
особенно сложных аминокислот, называемых
незаменимыми.
В клетках из готовых аминокислот строятся собственные белки,
характерные для данного организма.
4. Белки-ферменты.
Быстрое протекание метаболических реакций
(обмена веществ) обеспечивают биологические
катализаторы, или ускорители реакций, —
ферменты. Известно более тысячи разных
ферментов. Все они белки.
Процесс расщепления или синтеза любого вещества в клетке, как правило,
разделен на ряд химических операций. Каждую операцию выполняет
отдельный фермент. Группа таких ферментов составляет своего рода
биохимический конвейер.

Например, жиры в пищеварительном тракте (а также внутри клеток) расщепляются специальным ферментом,
который не действует на полисахариды (крахмал, гликоген) или на белки. В свою очередь, фермент,
расщепляющий только крахмал или гликоген, не действует на жиры. Каждая молекула фермента способна
осуществлять от нескольких тысяч до нескольких миллионов одинаковых операций в минуту. В ходе этих реакций
фермент не расходуется. Он соединяется с реагирующими веществами, ускоряет их превращения и выходит из
реакции неизмененным.
фермент,
расщепляю
щий белки
в кислой
среде
глобулярный белок
синтезируется в
поджелудочной
железе
белок
построены из двух и более
остатков аминокислот
фибриллярный
белок, один из
главных
компонентов
сократительных
волокон мышц —
миофибрилл. И как
структурный
элемент
сократительной
системы мышц
5. Регуляторные белки.
Известно, что в специализированных клетках
животных и растений производятся
специальные регуляторы физиологических
процессов — гормоны.
Часть гормонов (но не все) животных и человека
являются белками.
Гормоны выполняют важнейшую функцию в
организме, управляя активностью ферментов. Так,
инсулин активирует в клетках печени фермент,
синтезирующий из глюкозы другое органическое
вещество — гликоген, и ряд других ферментов.
Часть гормонов (но не все) животных и человека являются
белками.
Так,
белковый
гормон
инсулин
(гормон
поджелудочной железы) активирует захват клетками молекул
глюкозы и расщепление или запасание их внутри клетки. Если
не хватает инсулина, то глюкоза накапливается в крови в
избытке. Клетки без помощи инсулина не способны ее
захватить — они голодают. Именно в этом причина развития
диабета — болезни, вызываемой недостатком инсулина в
организме.
6. Белки — средства защиты.
На попадание бактерий или вирусов в кровь
животных и человека организм реагирует
выработкой специальных защитных белков —
антител.

На каждый чужеродный
белок — антиген организм
вырабатывает специальные
«антибелки» — антитела.
ИЛЬЯ ИЛЬИЧ МЕЧНИКОВ (1845—1916) —
русский биолог, один из основоположников
сравнительной патологии, эволюционной
эмбриологии. Открыл явление фагоцитоза.
Создал клеточную теорию иммунитета. Лауреат
Нобелевской премии.
Антитела обладают
удивительным свойством: среди
тысяч разнообразных белков
они узнают только свой антиген
и только с ним реагируют. Такой
механизм сопротивления
возбудителям заболеваний
называют — иммунитетом.
Помимо антител, растворенных в крови, имеются антитела на поверхности
специальных клеток, которые узнают и захватывают чужеродные клетки. Это
клеточный иммунитет, обеспечивающий в большинстве случаев и уничтожение
вновь возникающих раковых клеток.
Чтобы предупредить заболевание, людям и животным вводят
ослабленные или убитые бактерии либо вирусы (вакцины),
которые не вызывают болезнь, но заставляют специальные
клетки организма производить антитела против этих
возбудителей.

Если через некоторое время
болезнетворная
неослабленная бактерия или
вирус попадают в такой
организм, они встречают
прочный защитный барьер
из антител.
7. Белки — источник энергии.
Белки могут служить источником энергии
для клетки. При недостатке углеводов или
жиров окисляются молекулы аминокислот.
Освободившаяся при этом энергия
используется на поддержание процессов
жизнедеятельности организма.
Вариант 1 Какое из названных химических соединений не является биополимером? Вариант2 Какой из указанных схематических полимеров является нерегулярным?
7Дополнительный материал к уроку
Биополимеры. Углеводы, липиды.
Вариант 1
Какое из названных химических соединений не является биополимером?
А) белок
Б) глюкоза
В) дезоксирибонуклеиновая кислота
Г) целлюлоза
Из каких соединений синтезируются углеводы при фотосинтезе?
А) из. О2 и Н2О
Б) из СО2 и Н2
В) из СО2 и Н2О
Г) из СО2 и Н2СО3
Какой из продуктов целесообразнее давать уставшему марафонцу на дистанции для поддержания сил?
А) кусочек сахара
Б) немного сливочного масла
В) кусок мяса
Г) немного минеральной воды
В клетках животных запасным углеводом является:
А) целлюлоза
Б) крахмал
В) глюкоза
Г) гликоген
5. Какое из утверждений является правильным?
Какое из утверждений является правильным?
А) все углеводы растворимы в воде, а липиды нерастворимы
Б) некоторые углеводы растворимы в воде, а липиды нерастворимы
В) все углеводы и липиды – неполярные соединения
Г) все углеводы и липиды – полярные соединения
Вариант2
Какой из указанных схематических полимеров является нерегулярным?
А) БББББББББББББББББББББББББББ
Б) ОДОДОДОДОДОДОДОДОДОДО
В) АБВАБВАБВАБВАБВАБВАБВ
Г) АГБВВГААБГВВВАААБВГААГГГ
В каком из соединений химические связи между мономерами наиболее прочны?
А) в целлюлозе
Б) в гликогене
В) в крахмале
Способность верблюдов хорошо переносить жажду объясняется тем, что жиры:
А) сохраняют воду в организме
Б) выделяют воду при окислении
В) создают теплоизолирующий слой, уменьшающий испарение
Наибольшее количество энергии выделяется при расщеплении одного грамма:
А) жира
Б) глюкозы
В) белка
Какое из указанных соединений имеет липидную природу?
А) гемоглобин
Б) инсулин
В) тестостерон
Г) пенициллин
Биополимеры.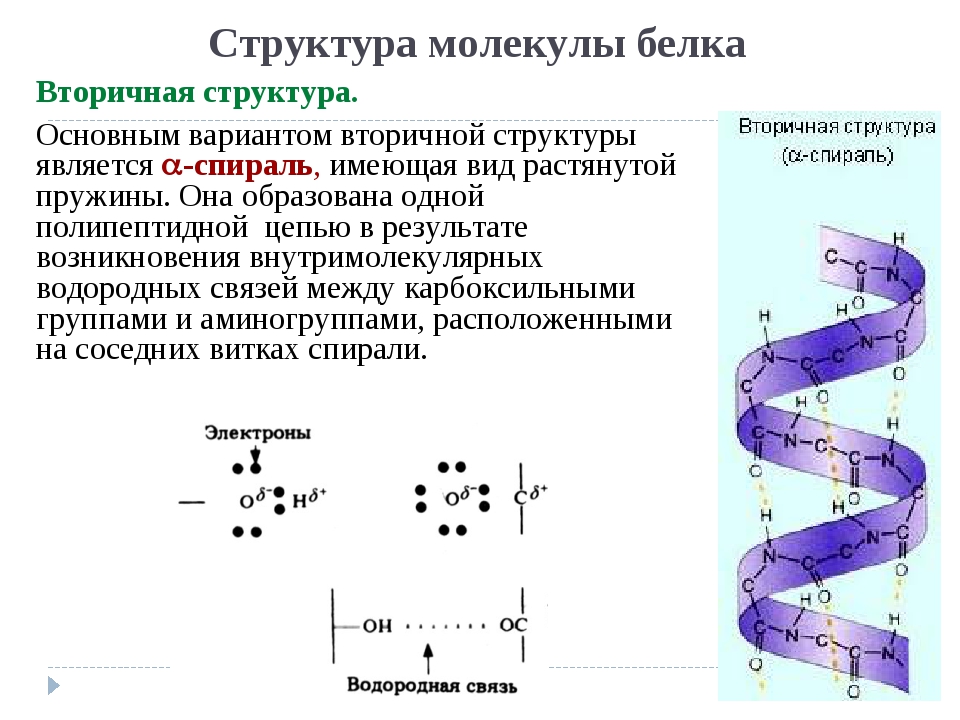 Белки и их функции
Белки и их функции
Вариант 1
В каком случае и правильно перечислены атомы, входящие в состав аминокислот?
А) С, Н, О, N, S.
Б) С, О, Н, S.
В) С, Н, О, Р., S.
Г) С, Н, О, N, Cl
Изменяемыми частями аминокислоты являются:
А) аминогруппа и карбоксильная группа
Б) радикал
В) карбоксильная группа
Г) Радикал и карбоксильная группа
Первичная структура белка удерживается:
А) водородными связями
Б) пептидными связями
В) гидрофобными связями
Г) дисульфидными связями
Молекулы белков отличаются друг от друга:
А) последовательностью чередования аминокислот
Б) количеством аминокислот в молекуле
В) формой третичной структуры
Г) всеми указанными особенностями
Какой из соединений не построено из аминокислот?
А) гемоглобин
Б) инсулин
В) гликоген
Г) альбумин
В каком случае правильно показана пептидная связь?
·
·
·
а) – C — N ; б) H – C – R; в) – C
· N; г) – O – H.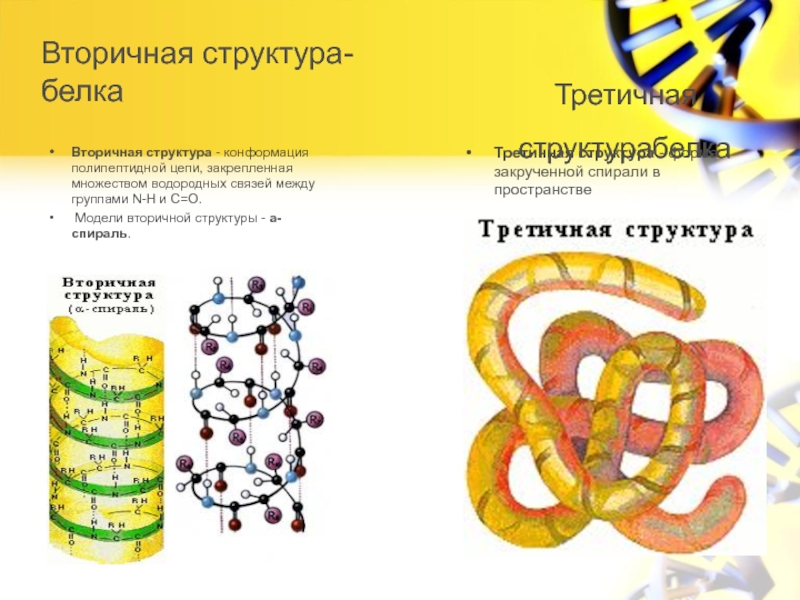
·
·
·
H
Вариант 2
Как поступают в клетки животных незаменимые аминокислоты?
А) синтезируются в самих клетках
Б) поступают вместе с пищей
В) поступают вместе с витаминами
Г) поступают всеми указанными путями
Какие белки способствуют отторжению органов и тканей при их пересадке от одного организма другому?
А) транспортные белки
Б) ферменты
В) иммуноглобулины
Г) строительные белки
В процессе биохимических реакций ферменты:
А) ускоряют реакции и сами при этом не изменяются
Б) ускоряют реакции и изменяются в результате реакции
В) замедляют химические реакции, не изменяясь
Г) замедляют химические реакции, изменяясь
Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
А) гемоглобин
Б) инсулин
В) антитела
Г) гликоген
От каких условий зависит действие ферментов в организме?
А) от температуры среды
Б) от рН среды
В) от концентрации реагирующих веществ и концентрации фермента
Г) от всех перечисленных условий
Вариант 3
Из предложенных ниже терминов выберите один, соответствующий по смыслу термину, стоящему впереди:
ПОЛИМЕР: радикал, мономер, нуклеотид, белок
Исключите лишнее понятие, зачеркнув его
Радикал, аминогруппа, карбоксильная группа, аминокислота
Заполните пропуски в тексте:
В результате взаимодействия различных ____________________________________ спирализованная молекула белка образует ___________________структуру, которая в свою очередь зависит от ______________________структуры, т. е. от ____________________ аминокислот в молекуле белка Субъединицы (отдельные цепи)
е. от ____________________ аминокислот в молекуле белка Субъединицы (отдельные цепи)
Некоторых белков образуют __________________ — структуру. Примером такого белка является ____________________.
Последовательную цепь превращения одного вещества в другое можно изобразить схематически так:
А В С Д
Сколько ферментов будет участвовать в этой реакции?
А) один
Б) два
В) три
Г) четыре
В каких форменных элементах крови синтезируется антитела?
А) эритроциты
Б) лимфоциты
В) фагоциты
Г) тромбоциты
15Абзац списка
Без интервала
Приложенные файлы
- 5036828
Размер файла: 35 kB Загрузок: 0
Презентация и рабочий лист по теме «БЕЛКИ» 10 класс
ЦЕЛЬ Для понимания и объяснения процессов, происходящих в клетке, выявить особенности строения, свойства и функции белков. На основании полученных знаний уметь проводить взаимосвязь между функциями и строением
- 1838г Жерар Мюльдер – открыл существование белковых тел и сформулировал теорию протеина
- 1888гДанилевский и Херт предложили строение белковой молекулы, но они считали, что «мономеры» представляют собой очень сложные образования — пептоны или «углеазотные комплексы».

- 1903г Фишер открыл пептидную связь и сформулировал пептидную теорию
30% Б – мыщцы
20% — в костях и сухожилиях
10% в коже
100.000 белков в организме человека
Элементарный химический состав белков
Белки, или протеины (от греч. протос – основной, первичный) занимают первое место по количеству и значению в клетке
Белки составляют 10–18%, т.е. половину сухого веса клетки.
В состав белков входят атомы С, Н, О, N, S, Р, иногда Fe, Сu, Zn.
Формула гемоглобина – C3032Н4816О872S8Fe4
Белки – это высокомолекулярные полимеры (макромолекулы )
По своей химической природе белки являются
непериодическими полимерами
Мономерами являются аминокислоты
Строение аминокислот
Аминогруппа –Nh3 имеет основные свойства
Карбоксильная группа –СООН — кислотные свойства
Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Амфотерными свойствами аминокислот обусловлена их способность взаимодействовать друг с другом. Две аминокислоты соединяются за счет реакции конденсации в одну молекулу путем установления связи между углеродом кислотной и азотом основной групп с выделением молекулы воды.
Аминокислот очень много (170)
НО : белки образуют только 20 так называемых золотых или стандартных, аминокислот
8 незаменимыми 12 заменимых
т.к. не синтезируются в организмах
животных и человека
- Лизин
- Лейцин
- Изолейцин
- Фенилаланин
- Метианин
- Валин
- Трианин
- триптофан
Именно сочетание
этих 20 аминокислот
и дает все многообразие
белков
Свойства А.К.
- Бесцветные кристал в –ва
- Растворяются в воде
- Сладковатый вкус
АМИНОКИСЛОТЫ
Неполноценные полноценные
R
R
R
+
+
HNH
HNH
C
C
NH 2
COO H
COO H
COO H
C
H
H
H
R
R
R
O
H
H
O
C
C
C
COO H
C
NH 2
N
n h3 O +
C
N
H
H
H
— C — N
O
H
D
F
T
A
S
K
G
N
G
A
S
Пептидная или амидная связь
Образование белковой молекулы
Уровни организации белковой молекулы
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи .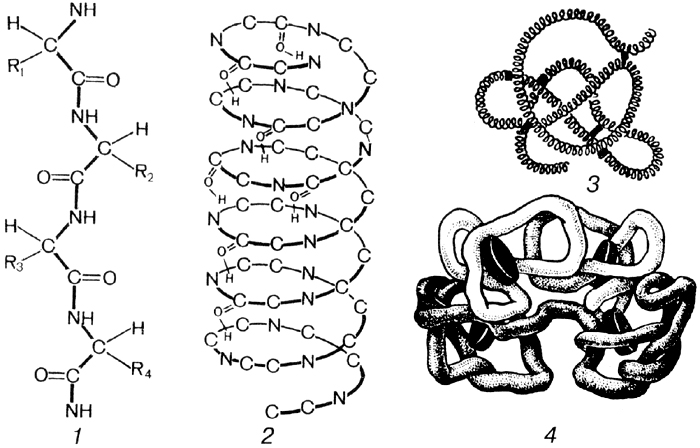
D
T
S
K
G
Структура – нить, связь амидная
N
G
A
S
Определяется генотипом, т.е. генами организма . В первичной структуре белка можно различить N-конец цепочки, содержащий свободную Nh3-группу, и С-конец, содержащий свободную СООН-группу. Молекула белка в виде цепи аминокислот не способна выполнять специфические функции
Вторичная структура белка представлена α -спиралью и β -слоями , в которую закручивается полипептидная цепь.
Связь амидная, водородная
-спираль,
-слой
Структура – глобула
Третичная структура
белка представляет собой сложную трехмерную пространственную упаковку α -спиралей и β -слоев. Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов ионные , гидрофобные , дисульфидные :
Четвертичная структура
представлена структурой, состоящей из нескольких полипептидных цепей
Агрегат из нескольких
глобул.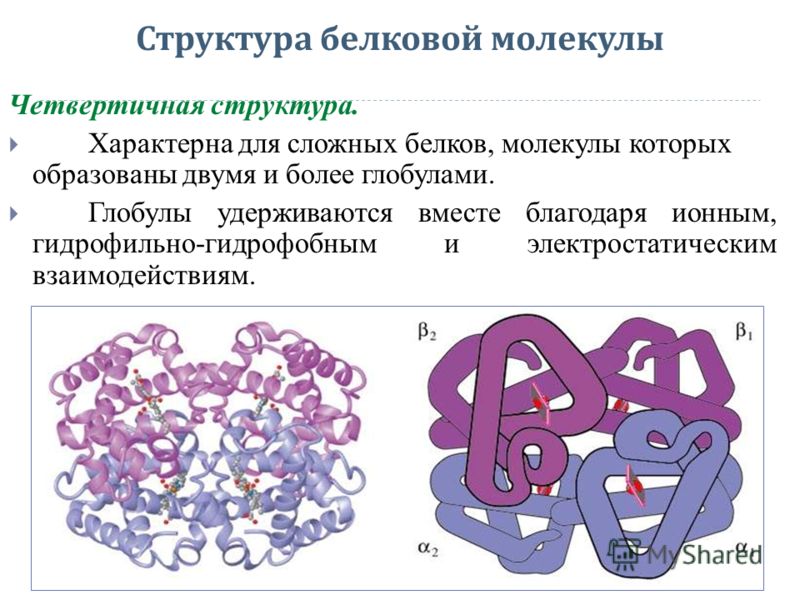 Свойственна
Свойственна
лишь белкам с особо
сложной структурой
В основном силы
межмолек притяж, в
меньшей степени –
водородные, ионные и ковалентные
Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией .
Конформация белка определяется его первичной структурой
Уровень организации
Признаки
Первичная
Вторичная
Линейная последоват
АК в полипептд. цепи
Связи, участвующие в образовании структуры
спираль
Третичная
Ковалентные (пептидные)
Глобула,
Водородные
Четвертичная
Ионные,дисульфид
мостики, гидрофобн,
водородные
Агрегат из нескольких
глобул.Свойственна
лишь белкам с особо
сложной структурой
В основном силы
межмолек притяж, в
меньшей степени –
водородные, ионные и ковалентные
Р
Е
Н
А
Т
У
Р
А
Ц
И
Я
ДЕНА
Т
У
Р
А
Ц
И
я
Процесс разрушения структуры белка, сопровождающийся потерей активности, называется денатурацией. 4 – 1
4 – 1
Обратный денатурации процесс называется ренатурацией ( 1-4 )
Денатурация
частичная
полная
Классификация белков по составу
Сложные белки
(протеиды)
состоят из глобулярных белков и небелкового материала.
Небелковую часть называют простетической группой
- фосфопротеиды
- гликопротеиды
- нуклеопротеиды
- хромопротеиды
- липопротеиды
- металлопротеиды
Простые белки
( протеины)
состоят только из аминокислот
- Альбумины
- Глобулины
- Гистоны
- склеропротеины
Классификация белков по их структуре
Фибриллярные – образуют длинные волокна или слоистые структуры (коллаген, миозин, фиброин, кератин). Они нерастворимы в воде.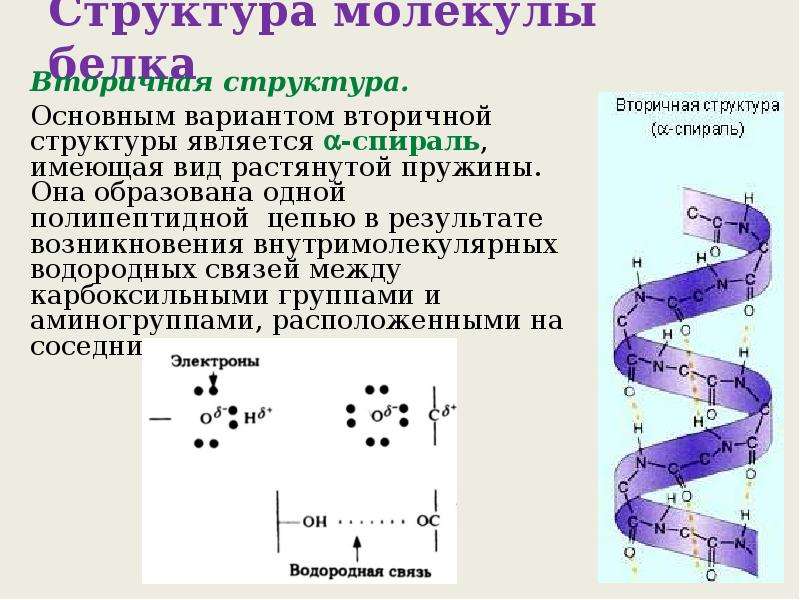
Глобулярные – их полипептидные цепи свернуты в компактные глобулы (ферменты, антитела, гормон инсулин).
Промежуточные – фибриллярной природы, но растворяются в воде (фибриноген).
Классификация белков по функциям .
Структурные – входят в различные структуры клетки и организма.
Ферменты – являются биологическими катализаторами
Гормоны – являются регуляторами биологических функций
Транспортные – переносят различные вещества.
Защитные – обеспечивают иммунные реакции организма.
Сократительные участвуют в сокращении мышечных волокон
Запасные служат резервными веществами клетки и организма.
Токсины являются ядами, используемыми живыми существами в целях защиты
Свойства белков
1. Есть белки растворимые (например, фибриноген) и нерастворимые (например, фибрин) в воде.
2. Есть белки очень устойчивые (например, кератин) и неустойчивые (например, фермент каталаза с легко изменяющейся структурой).
3. У белков встречается разнообразная форма молекул – от нитей (миозин – белок мышечных волокон) до шариков (гемоглобин) и т.д.
4 Ренатурация и денатурация
.
5. Высокий поверхностный заряд
6. Все белки строго специфичны
СПЕЦИФИЧНОСТЬ ЗАВИСИТ ОТ:
* от количества аминокислот
* от их расположения
* от конфигурации белковой молекулы
!
ФУНКЦИИ БЕЛКОВ
- Структурная (строительная). Белки входят в состав всех клеточных мембран и органоидов клетки, а также внеклеточных структур.
Например; кератин. Из этого белка состоят волосы, шерсть, рога, копыта, верхний отмерший слой кожи. В более глубоких слоях кожи расположены прокладки из белков коллагена и эластина . Именно эти белки обеспечивают прочность и упругость кожи. Они же содержатся в связках, соединяющих мышцы с суставами и суставы между собой.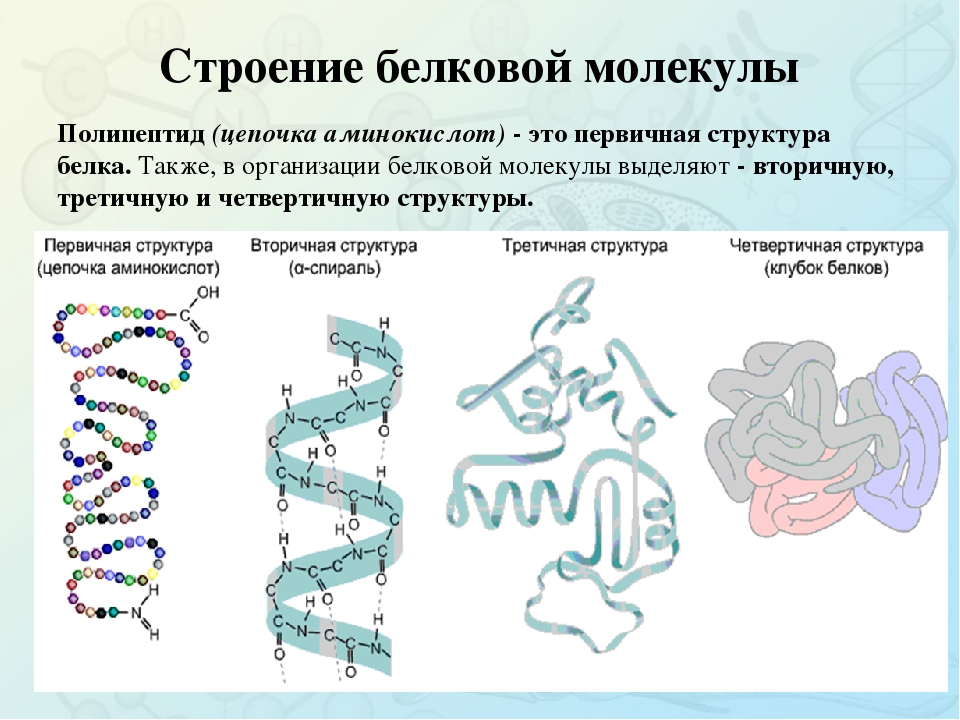
2 . Ферментативная. Белки являются биологическими катализаторами. Например, пепсин, трипсин и др.
3. Двигательная . Особые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др. Так, сокращение мышц обеспечивают мышечные белки актин и миозин.
Функции
Особенности
Примеры
4. Транспортная. В крови, в наружных клеточных мембранах, в цитоплазме и ядрах клеток есть различные транспортные белки. В крови имеются белки-транспортеры, которые узнают и связывают определенные гормоны и несут их к клеткам-мишеням. Известны белки, например гемоглобин и гемоцианин , переносящие кислород, и миоглобин, удерживающий кислород в мышцах .
5. Защитная. В ответ на проникновение в организм чужеродных белков или микроорганизмов, обладающих антигенными свойствами, лимфоциты крови образуют особые белки – антитела , способные связывать и обезвреживать их. В слюне и слезах содержится белок лизоцим – фермент, разрушающий клеточные стенки бактерий. Фибрин и тромбин способствуют остановке кровотечений .
6. Энергетическая (питательная). Белки можно расщепить, окислить и получить энергию, необходимую для жизни. Правда, это не очень выгодно: энергетическая ценность белков по сравнению с жирами невысока и составляет 17,6 кДж (4,1 ккал) энергии на 1 г белка. Обычно белки расходуются на энергетические нужды в крайних случаях , когда исчерпаны запасы жиров и углеводов.
7. Регуляторная. Многие (хотя далеко не все) гормоны являются белками – например все гормоны гипофиза, гипоталамуса, поджелудочной железы (инсулин, глюкагон ) и др. Гормоны действуют на клетку, связываясь со специфическими рецепторами. Каждый рецептор узнает только один гормон.
Гормоны действуют на клетку, связываясь со специфическими рецепторами. Каждый рецептор узнает только один гормон.
8.Сигнальная (рецепторная). В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
9. Запасающая. Благодаря белкам в организме могут откладываться в запас некоторые вещества. Яичный альбумин служит водозапасающим белком в яичном «белке», казеин молока является источником энергии, а белок ферритин удерживает железо в яичном желтке, селезенке и печени.
10. Токсическая . Некоторые белки являются токсинами: яд кобры содержит нейротоксин
! Белки многофункциональны, так как специфичны.
ДОМАШНЕЕ ЗАДАНИЕ
- записи в тетради учить
- Приготовить устный ответ
- заполнить таблицу «Функции белков»
- Подготовиться к тесту
. Заполните пропуски в тексте: «В результате взаимодействия различных … и образования … связей спирализованная молекула белка образует … структуру, которая, в свою очередь, зависит от … структуры белка, то есть от … аминокислот в молекуле полипептида. Субъединицы некоторых белков образуют … структуру. Примером такого белка является …».
Заполните пропуски в тексте: «В результате взаимодействия различных … и образования … связей спирализованная молекула белка образует … структуру, которая, в свою очередь, зависит от … структуры белка, то есть от … аминокислот в молекуле полипептида. Субъединицы некоторых белков образуют … структуру. Примером такого белка является …».
УСПЕХОВ !
Химический состав клеткиВ живых организмах содержится большое количество химических элементов. Они образуют два класса соединений — органические и неорганические. В организме человека обнаружено 86 постоянно присутствующих элементов периодической системы Менделеева. Из них 25 необходимы для поддержания жизнедеятельности, 18 из которых абсолютно необходимы, а 7 — полезны. На долю четырех химических элементов — кислорода, водорода, углерода и азота — приходится около 98% массы клетки. Основные вещества клетки включают молекулы нуклеиновых кислот, белков, жиров, углеводов, воды, кислорода и углекислого газа. В неживой природе эти вещества нигде не встречаются вместе. Основные вещества клетки = В составе клеток человеческого тела преобладают:
В состав живых клеток входят ряд относительно простых соединений, которые встречаются в неживой природе —
в минералах, природных водах. Вода — одно из самых распространённых веществ на земле. У человека содержание воды в различных тканях и органах варьирует от 20% (в костной ткани) до 85% (в головном мозге). Около 2/3 массы человека составляет вода. Свойства воды настолько важны для живых организмов, что нельзя представить себе жизни без этого соединения водорода с кислородом. В жидкой воде молекулы подвижны, что немаловажно для процессов обмена веществ. Молекулы воды легко проникают через клеточные мембраны. В воде растворяется больше веществ, чем в любой другой жидкости. Именно поэтому в водной среде клетки осуществляется множество химических реакций. Вода растворяет продукты обмена веществ и выводит их из клетки и организма в целом. Вода обладает высокой теплопроводностью. Химические соединения, основой которых являются атомы углерода, составляют отличительный признак живого. Эти соединения называются органическими. Органические соединения чрезвычайно многообразны, но только четыре класса их имеют всеобщее биологическое значение: белки, нуклеиновые кислоты, углеводы, липиды. Органическими веществами называют химические соединения, в состав которых входят атомы углерода. Атомы углерода способны вступать друг с другом в прочную ковалентную связь, образуя множество разнообразных цепочечных или кольцевых молекул. Самыми простыми углеродсодержащими соединениями являются углеводороды, соединения, которые содержат только углерод и водород. Однако в большинстве органических соединений содержатся и другие элементы (кислород, азот, фосфор, сера). Углеводы широко распространены в живых клетках. В состав молекулы углеводов входит углерод, водород и кислород. Общая формула углеводов Cn(H2O)m. Примером углеводов может служить глюкоза.
Структурная формула и модель молекулы глюкозы Глюкоза является простым сахаром. В состав молока входит дисахарид, который состоит из остатков двух простых сахаров. Тысячи остатков простых сахаров образуют молекулы полисахаридов. В составе живых организмов много полисахаридов. Полисахариды относятся к биополимерам («био» — жизнь, «поли» — много). Участок ветвящейся молекулы крахмала, где каждое звено — глюкоза. Липиды. Белки. Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной. Соединение, состоящее из большого числа аминокислот, называется полипептидом. Каждый белок по своему составу является полипептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура определяется порядком чередования аминокислот в полипептидной цепи. Двадцать аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены «слова» длиной в 300–500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Известно, что замена даже одного аминокислотного звена другим в белковой молекуле изменяет её свойства. В живой клетке многие молекулы белков или их отдельные участки представляют собой не вытянутую нить, а спираль с одинаковыми расстояниями между витками. Такая спираль представляет собой вторичную структуру белковой молекулы. Между группами N–H и C=O, расположенными на соседних витках, возникают водородные связи. Они намного слабее ковалентных, но, повторённые многократно, скрепляют регулярные витки спирали. В результате взаимодействия различных остатков аминокислот спирализованная молекула белка образует клубок — третичную структуру. Для каждого вида белка характерна своя форма клубка с изгибами и петлями. Третичная структура зависит от первичной структуры, т.е. от порядка расположения аминокислот в цепи. Наконец, некоторые белки, например гемоглобин, состоят из нескольких цепей, различающихся по первичной структуре. Объединяясь вместе, они создают сложный белок, обладающий не только третичной, но и четвертичной структурой. Нуклеиновые кислоты.
Модель молекулы ДНК Молекула ДНК представляет собой структуру, состоящую из нитей, которые по всей длине соединены друг с другом водородными связями. Порядок расположения нуклеотидов в молекулах ДНК определяет порядок расположения аминокислот в линейных молекулах белков, то есть их первичную структуру. Молекулы ДНК хранят сведения о свойствах белков и передают их поколениям потомков, то есть являются носителями информации. Основные виды РНК. Каждая молекула РНК в отличие от молекулы ДНК представлена одной нитью; вместо дезоксирибозы содержит рибозу и вместо тимина — урацил. Аденозинтрифосфорная кислота (АТФ). АТФ → АДФ + Ф + Е, где АДФ — аденозиндифосфорная кислота, Ф — фосфат, Е — освобождающаяся энергия. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производства тепла, нервных импульсов, то есть для всех процессов жизнедеятельности. АТФ — универсальный биологический аккумулятор энергии. Световая энергия Солнца и энергия, заключённая в потребляемой пище, запасаются в молекулах АТФ. Витамины.
| ||||
IJMS | Бесплатный полнотекстовый | Coiled-Coils: молекулярные молнии, которые самоорганизуются в белковые наноструктуры
3.1. Неограниченные наноструктуры
Как обсуждалось в разделе о принципах модульного проектирования, контроль над ориентацией спиральных катушек необходим для программирования соединений между строительными блоками в желаемой геометрии. В зависимости от ориентации элементов управления к неограниченным конструкциям может быть присоединено значительное количество строительных блоков. Примеры включают взаимосвязанные сети в форме гидрогелей [46,47], одномерные пучки, которые вырастают в волокна [27,31] и трубки [28], а также упорядоченные массивы в наномасштабе [39].Взаимосвязанные сети были построены из фрагментов спиральной спирали, соединенных растворимым и гибким полипептидным средним блоком [46,47]. Это синтетический пептидный сегмент из полиэлектролита, который окружен спиральными спиралями, которые олигомеризуют и опосредуют обратимое физическое сшивание (рис. 3а). Взаимосвязанные сети оказались листовыми наноструктурами в гидрогелях [40]. Физическим сшиванием можно управлять в ответ на изменения температуры или pH [46,47], денатурирующих агентов [47] или даже электрического тока [50], которые влияют на термическую стабильность и свойства самосборки гидрогелей.Программирование механических свойств было также достигнуто путем изменения молекулярных взаимодействий между слитыми белками, образующими сеть, спиральная спираль.
В зависимости от ориентации элементов управления к неограниченным конструкциям может быть присоединено значительное количество строительных блоков. Примеры включают взаимосвязанные сети в форме гидрогелей [46,47], одномерные пучки, которые вырастают в волокна [27,31] и трубки [28], а также упорядоченные массивы в наномасштабе [39].Взаимосвязанные сети были построены из фрагментов спиральной спирали, соединенных растворимым и гибким полипептидным средним блоком [46,47]. Это синтетический пептидный сегмент из полиэлектролита, который окружен спиральными спиралями, которые олигомеризуют и опосредуют обратимое физическое сшивание (рис. 3а). Взаимосвязанные сети оказались листовыми наноструктурами в гидрогелях [40]. Физическим сшиванием можно управлять в ответ на изменения температуры или pH [46,47], денатурирующих агентов [47] или даже электрического тока [50], которые влияют на термическую стабильность и свойства самосборки гидрогелей.Программирование механических свойств было также достигнуто путем изменения молекулярных взаимодействий между слитыми белками, образующими сеть, спиральная спираль. Например, скорость эрозии гидрогелей регулировалась путем конструирования аффинности, состояния олигомеризации и ориентации доменов спиральной спирали [51]. Кроме того, добавление ковалентного сшивания к белковым сетям привело к зависящим от времени ответам гидрогелей на механическую деформацию [52]. Односайтовые мутации в последовательностях coiled-coil дополнительно запрограммировали динамическое поведение белковой сети [53].Такие программируемые механические свойства предоставляют возможности для улучшения ударной вязкости и сопротивления разрушению [52]. Неограниченные одномерные наноструктуры были собраны путем сонаправленного выравнивания спиральных катушек (рис. 3b). Группа Вулфсона впервые разработала волокна типа coiled-coil, поместив гетеродимерные coiled-coil в шахматную конформацию [26]. В конструкции две спирали типа coiled-coil образуют димер с несвязанными липкими концами, а не тупыми. Таким образом, сборка через липкие концы выровняла объединенные поверхности раздела спираль-катушка сонаправленно, с последующим продольным ростом.
Например, скорость эрозии гидрогелей регулировалась путем конструирования аффинности, состояния олигомеризации и ориентации доменов спиральной спирали [51]. Кроме того, добавление ковалентного сшивания к белковым сетям привело к зависящим от времени ответам гидрогелей на механическую деформацию [52]. Односайтовые мутации в последовательностях coiled-coil дополнительно запрограммировали динамическое поведение белковой сети [53].Такие программируемые механические свойства предоставляют возможности для улучшения ударной вязкости и сопротивления разрушению [52]. Неограниченные одномерные наноструктуры были собраны путем сонаправленного выравнивания спиральных катушек (рис. 3b). Группа Вулфсона впервые разработала волокна типа coiled-coil, поместив гетеродимерные coiled-coil в шахматную конформацию [26]. В конструкции две спирали типа coiled-coil образуют димер с несвязанными липкими концами, а не тупыми. Таким образом, сборка через липкие концы выровняла объединенные поверхности раздела спираль-катушка сонаправленно, с последующим продольным ростом. Эти образующие волокна гетеродимерные спиральные спирали были дополнительно модифицированы рациональными мутациями, которые вводили заряженные остатки на внешние поверхности, что утолщало волокна [27]. Просвечивающая и электронная микроскопия и дифракция рентгеновских лучей на волокне выявили гексагональную упаковку с периодичностью длины одной спиральной катушки. Свернутые катушки были упакованы вдоль волокон нанометровой толщины (> 50 нм) и микрометровой длины (> 10 мкм). Спиральные спирали, образующие волокна, также были переработаны для создания гидрогелей [48].Заряженные аминокислотные остатки в характерных положениях b, c или f (описанные на рисунке 1a) были заменены остатками с более слабым взаимодействием, такими как аланин или глутамин, в результате чего образовались гибкие пучки более тонких и соединенных между собой волокон. Что касается стабильности этих волокон, недавно сообщалось о превращении спирали в лист в структурах при температурах от 20 до 40 ° C [54]. Спиральные катушки с тупыми концами также были переработаны для формирования одномерных наноструктур (рис.
Эти образующие волокна гетеродимерные спиральные спирали были дополнительно модифицированы рациональными мутациями, которые вводили заряженные остатки на внешние поверхности, что утолщало волокна [27]. Просвечивающая и электронная микроскопия и дифракция рентгеновских лучей на волокне выявили гексагональную упаковку с периодичностью длины одной спиральной катушки. Свернутые катушки были упакованы вдоль волокон нанометровой толщины (> 50 нм) и микрометровой длины (> 10 мкм). Спиральные спирали, образующие волокна, также были переработаны для создания гидрогелей [48].Заряженные аминокислотные остатки в характерных положениях b, c или f (описанные на рисунке 1a) были заменены остатками с более слабым взаимодействием, такими как аланин или глутамин, в результате чего образовались гибкие пучки более тонких и соединенных между собой волокон. Что касается стабильности этих волокон, недавно сообщалось о превращении спирали в лист в структурах при температурах от 20 до 40 ° C [54]. Спиральные катушки с тупыми концами также были переработаны для формирования одномерных наноструктур (рис.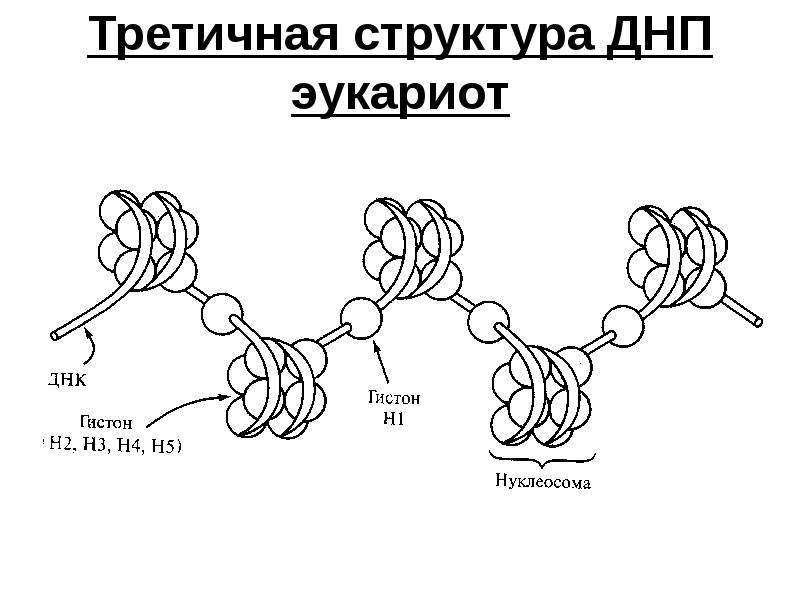 3b).Дополнительные заряды были введены в N- и C-концы гомотримерных или гомотетрамерных спиральных спиралей, и заряженные тупые концы способствовали продольной сборке в спиральные пучки [28]. В отличие от сборки через липкие концы, слабых зарядовых взаимодействий на тупых концах было достаточно для сборки волокна. Используя этот подход, пентамерные, гексамерные и гептамерные цилиндры спиральной спирали были переработаны для сборки нанотрубок [28,49]. В конструкциях симметрия спиральных катушек была критической для их упаковки в упорядоченные трубчатые супраструктуры.Точно так же полые трубки диаметром от нескольких сотен нанометров до микрона собирались из спиральных катушек с тупым концом [41]. Тримерная спиральная спираль, богатая изолейцином, была сконструирована путем мутаций природного димерного спирального кольца GCN4. Спиральная катушка была собрана в гексагональную упаковку, которая была уложена стопкой и закрыта в длинные полые супраструктуры. В другом подходе, heptameric спиральная-катушка с концевыми структурами в форме блокировки шайбы была разработана [29].
3b).Дополнительные заряды были введены в N- и C-концы гомотримерных или гомотетрамерных спиральных спиралей, и заряженные тупые концы способствовали продольной сборке в спиральные пучки [28]. В отличие от сборки через липкие концы, слабых зарядовых взаимодействий на тупых концах было достаточно для сборки волокна. Используя этот подход, пентамерные, гексамерные и гептамерные цилиндры спиральной спирали были переработаны для сборки нанотрубок [28,49]. В конструкциях симметрия спиральных катушек была критической для их упаковки в упорядоченные трубчатые супраструктуры.Точно так же полые трубки диаметром от нескольких сотен нанометров до микрона собирались из спиральных катушек с тупым концом [41]. Тримерная спиральная спираль, богатая изолейцином, была сконструирована путем мутаций природного димерного спирального кольца GCN4. Спиральная катушка была собрана в гексагональную упаковку, которая была уложена стопкой и закрыта в длинные полые супраструктуры. В другом подходе, heptameric спиральная-катушка с концевыми структурами в форме блокировки шайбы была разработана [29]. Зарядовые взаимодействия, дополняющие форму, опосредуют сквозную ассоциацию гептамеров, которые удлиняются в нанотрубки.Массивы белков с порядком в нанометровом масштабе были изготовлены с использованием строительных блоков, содержащих спиральные спирали. В то время как конъюгированные гибриды белков и поли (N-изопропилакриламида) (PNIPAM) были разработаны для сборки упорядоченных наноструктур [55,56], свойства конъюгированных белков были критическими для достижения сильного упорядочения [57]. Чтобы улучшить качество упорядочения, гетеродимерные спиральные спирали были слиты со слабо упорядочивающим белком с последующей конъюгацией с PNIPAM (рис. 3c) [39]. Белковые массивы, собранные из конъюгатов белок-полимер спиральной спирали, показали пластинчатые или гексагональные упорядоченные фазы, и было достигнуто улучшение качества упорядочения.Матрицы наноструктурированного белка показали повышение эффективности в качестве биосенсора. В другой стратегии упорядоченные массивы в форме трехмерных кристаллов были собраны с использованием coiled-coils, модифицированных лигандами, связывающими ионы металлов [58].
Зарядовые взаимодействия, дополняющие форму, опосредуют сквозную ассоциацию гептамеров, которые удлиняются в нанотрубки.Массивы белков с порядком в нанометровом масштабе были изготовлены с использованием строительных блоков, содержащих спиральные спирали. В то время как конъюгированные гибриды белков и поли (N-изопропилакриламида) (PNIPAM) были разработаны для сборки упорядоченных наноструктур [55,56], свойства конъюгированных белков были критическими для достижения сильного упорядочения [57]. Чтобы улучшить качество упорядочения, гетеродимерные спиральные спирали были слиты со слабо упорядочивающим белком с последующей конъюгацией с PNIPAM (рис. 3c) [39]. Белковые массивы, собранные из конъюгатов белок-полимер спиральной спирали, показали пластинчатые или гексагональные упорядоченные фазы, и было достигнуто улучшение качества упорядочения.Матрицы наноструктурированного белка показали повышение эффективности в качестве биосенсора. В другой стратегии упорядоченные массивы в форме трехмерных кристаллов были собраны с использованием coiled-coils, модифицированных лигандами, связывающими ионы металлов [58]. Сборка гексагональных массивов в диски или стержни опосредована связывающими взаимодействиями между ионами металлов и конъюгированными лигандами. Также было продемонстрировано сайт-специфическое включение гостевых молекул в кристаллы, упорядоченные спиральной спиралью.
Сборка гексагональных массивов в диски или стержни опосредована связывающими взаимодействиями между ионами металлов и конъюгированными лигандами. Также было продемонстрировано сайт-специфическое включение гостевых молекул в кристаллы, упорядоченные спиральной спиралью.3.2. Дискретные наночастицы
Когда относительная ориентация интерфейсов спиральная спираль в разработанных белковых строительных блоках контролируется в пределах определенного диапазона, может быть достигнуто замыкание сборок спиральной спирали на дискретные наночастицы (рис. 2).В такой системе, называемой самоорганизующимися клеточно-подобными частицами (SAGE), изогнутые мембранные структуры были собраны с помощью выровненных по бокам спиральных катушек (рис. 4a) [35]. В системе SAGE использовался набор гетеродимерных и гомотримерных спиральных спиралей, которые были сопряжены через дисульфидные связи. Стратегическое мостиковое сопряжение контролировало угол между соседними витками. Два мостиковых дополнительных строительных блока присутствовали в виде тримерных комплексов, которые при смешивании образовывали однослойные структуры с кривизной. Изогнутая пластинка превратилась в сферические частицы диаметром около 100 нм [35]. Расположение дисульфидных мостиков было посередине внешней поверхности спиральных катушек, но немного близко к С-концам. Под влиянием положительного заряда угол между интерфейсами в виде мостиковой спирали составляет около 33,9 ° ± 17,2 °, согласно моделированию молекулярной динамики. Комбинация тримерных и димерных спиральных спиралей образовывала гексагональные сети (рис. 4а), что подтверждается характеристикой с помощью микроскопии латеральных молекулярных сил [35].Дальнейшая структурная характеристика SAGE с модифицированным зарядом после силицификации с использованием SAGE-темплейта показала наличие как гексагональной, так и нерегулярной сетки на поверхности SiO 2 -SAGE [59]. Результаты моделирования также показали, что гексагонально расположенная упаковка не является самой стабильной формой [60]. Украшение SAGE для приложений было достигнуто путем генетического слияния с различными пептидами или природными белками.
Изогнутая пластинка превратилась в сферические частицы диаметром около 100 нм [35]. Расположение дисульфидных мостиков было посередине внешней поверхности спиральных катушек, но немного близко к С-концам. Под влиянием положительного заряда угол между интерфейсами в виде мостиковой спирали составляет около 33,9 ° ± 17,2 °, согласно моделированию молекулярной динамики. Комбинация тримерных и димерных спиральных спиралей образовывала гексагональные сети (рис. 4а), что подтверждается характеристикой с помощью микроскопии латеральных молекулярных сил [35].Дальнейшая структурная характеристика SAGE с модифицированным зарядом после силицификации с использованием SAGE-темплейта показала наличие как гексагональной, так и нерегулярной сетки на поверхности SiO 2 -SAGE [59]. Результаты моделирования также показали, что гексагонально расположенная упаковка не является самой стабильной формой [60]. Украшение SAGE для приложений было достигнуто путем генетического слияния с различными пептидами или природными белками. Для контролируемой доставки SAGEs в клетки гомотримерный узел coiled-coil был расширен короткими заряженными пептидами, что сделало возможным изменение клеточной интернализации [61].Дополнительные функциональные возможности были добавлены к SAGE путем модульного декора с помощью различных глобулярных белков [42]. Зеленый флуоресцентный белок (GFP), мономерный флуоресцентный белок вишни (mCherry), мальтозо-связывающий белок и фермент люцифераза были слиты с N- или C-концом тримерной спиральной катушки. В аналогичной конструкции антигенный эпитоп был включен в SAGE, который показал повышенную иммуногенность в качестве доставки вакцины из белковых наночастиц [62]. Полые белковые сферы, которые напоминают везикулы, были созданы путем генетического слияния спиральных спиралей с другими типами белковых мотивов [38]. .Гетеродимерная спиральная спираль Z E : Z R [12] (двоеточие обозначает димеризацию спиральной спирали) были слиты либо с эластиноподобным полипептидом (ELP), либо с доменами глобулярного белка, такими как mCherry или с усиленным GFP (рис.
Для контролируемой доставки SAGEs в клетки гомотримерный узел coiled-coil был расширен короткими заряженными пептидами, что сделало возможным изменение клеточной интернализации [61].Дополнительные функциональные возможности были добавлены к SAGE путем модульного декора с помощью различных глобулярных белков [42]. Зеленый флуоресцентный белок (GFP), мономерный флуоресцентный белок вишни (mCherry), мальтозо-связывающий белок и фермент люцифераза были слиты с N- или C-концом тримерной спиральной катушки. В аналогичной конструкции антигенный эпитоп был включен в SAGE, который показал повышенную иммуногенность в качестве доставки вакцины из белковых наночастиц [62]. Полые белковые сферы, которые напоминают везикулы, были созданы путем генетического слияния спиральных спиралей с другими типами белковых мотивов [38]. .Гетеродимерная спиральная спираль Z E : Z R [12] (двоеточие обозначает димеризацию спиральной спирали) были слиты либо с эластиноподобным полипептидом (ELP), либо с доменами глобулярного белка, такими как mCherry или с усиленным GFP (рис. 4б). ELP представляют собой неупорядоченные пептиды, которые претерпевают обратный фазовый переход от растворимой к нерастворимой конформации, которая служит чувствительным к температуре гидрофобным блоком. Глобулярные домены и спиральные спирали гидрофильны и свернуты в глобулярные или стержневые формы, которые контролируют геометрию гибридных белков и модулируют упаковку молекул.Поскольку Z R также образует гомодимер с более слабой аффинностью связывания, неэквимолярные смеси слитых белков приводили к амфифилам стержень-спираль и глобула-стержень-спираль. Запускается обратным фазовым переходом домена ELP, собираются полые белковые везикулы. Пустая полость, окруженная латерально собранными белковыми амфифилами, была охарактеризована с помощью конфокальной микроскопии, а также SEM [38]. Кривизна везикулярной мембраны точно контролировалась относительным соотношением белковых комплексов стержень-клубок и глобула-стержень-клубок.Малоугловое рассеяние нейтронов показало, что везикула является однослойной с толщиной ~ 10 нм, и были изучены дополнительные экспериментальные условия для перехода к биламеллярным структурам [43].
4б). ELP представляют собой неупорядоченные пептиды, которые претерпевают обратный фазовый переход от растворимой к нерастворимой конформации, которая служит чувствительным к температуре гидрофобным блоком. Глобулярные домены и спиральные спирали гидрофильны и свернуты в глобулярные или стержневые формы, которые контролируют геометрию гибридных белков и модулируют упаковку молекул.Поскольку Z R также образует гомодимер с более слабой аффинностью связывания, неэквимолярные смеси слитых белков приводили к амфифилам стержень-спираль и глобула-стержень-спираль. Запускается обратным фазовым переходом домена ELP, собираются полые белковые везикулы. Пустая полость, окруженная латерально собранными белковыми амфифилами, была охарактеризована с помощью конфокальной микроскопии, а также SEM [38]. Кривизна везикулярной мембраны точно контролировалась относительным соотношением белковых комплексов стержень-клубок и глобула-стержень-клубок.Малоугловое рассеяние нейтронов показало, что везикула является однослойной с толщиной ~ 10 нм, и были изучены дополнительные экспериментальные условия для перехода к биламеллярным структурам [43]. Полиэдрические наночастицы были созданы путем совмещения интерфейсов спиральная спираль в симметричную геометрию (рис. 4c). В системе, называемой самособирающейся пептидной наночастицей (SAPN), пентамерные и тримерные спиральные спирали были связаны друг с другом двойным глициновым линкером [36,63]. Внутримолекулярный дисульфидный мостик рядом с линкером определяет их относительную ориентацию в додекаэдрическую или икосаэдрическую геометрию.Эта система была дополнительно улучшена путем украшения различными антигенными эпитопами для разработки вакцин на основе белковых наночастиц. Вакцины SAPN были способны отображать повторяющиеся эпитопы [64, 65] или устранять необходимость в адъювантах [66]. Универсальность вакцин на основе SAPN была продемонстрирована против гриппа [67], ВИЧ [68,69] и малярии [66,70]. Выравнивание интерфейсов coiled-coil в симметричную геометрию было также достигнуто путем генетического слияния coiled-coils с симметричными олигомерными белковыми складками (Figure 4d).
Полиэдрические наночастицы были созданы путем совмещения интерфейсов спиральная спираль в симметричную геометрию (рис. 4c). В системе, называемой самособирающейся пептидной наночастицей (SAPN), пентамерные и тримерные спиральные спирали были связаны друг с другом двойным глициновым линкером [36,63]. Внутримолекулярный дисульфидный мостик рядом с линкером определяет их относительную ориентацию в додекаэдрическую или икосаэдрическую геометрию.Эта система была дополнительно улучшена путем украшения различными антигенными эпитопами для разработки вакцин на основе белковых наночастиц. Вакцины SAPN были способны отображать повторяющиеся эпитопы [64, 65] или устранять необходимость в адъювантах [66]. Универсальность вакцин на основе SAPN была продемонстрирована против гриппа [67], ВИЧ [68,69] и малярии [66,70]. Выравнивание интерфейсов coiled-coil в симметричную геометрию было также достигнуто путем генетического слияния coiled-coils с симметричными олигомерными белковыми складками (Figure 4d). C 3 -симметричная тримерная протеинэстераза была слита с тетрамерной спиралью, которая управляла сборкой четко определенной октаэдрической наноструктуры [37]. Между спиральными спиралями и эстеразой помещали короткие гибкие линкеры оптимальной длины из трех или четырех аминокислот. Кроме того, тетраэдрические [71] или икосаэдрические наноструктуры [44] были собраны путем слияния симметричной эстеразы с тримерными или пентамерными спиральными спиралями.
C 3 -симметричная тримерная протеинэстераза была слита с тетрамерной спиралью, которая управляла сборкой четко определенной октаэдрической наноструктуры [37]. Между спиральными спиралями и эстеразой помещали короткие гибкие линкеры оптимальной длины из трех или четырех аминокислот. Кроме того, тетраэдрические [71] или икосаэдрические наноструктуры [44] были собраны путем слияния симметричной эстеразы с тримерными или пентамерными спиральными спиралями.3.3. Origami Nanostructures
Концепция макромолекулярного оригами для создания четко определенных наноструктур была впервые реализована с использованием ДНК.ДНК-оригами, который относится к методу складывания и сборки фрагментов ДНК в наноструктуры, продемонстрировал ошеломляющий успех в создании наноархитектур с широкими возможностями настройки форм и размеров [72]. Исключительные возможности дизайна и надежность ДНК-оригами основаны на простой и высокоспецифической ассоциации комплементарных фрагментов ДНК.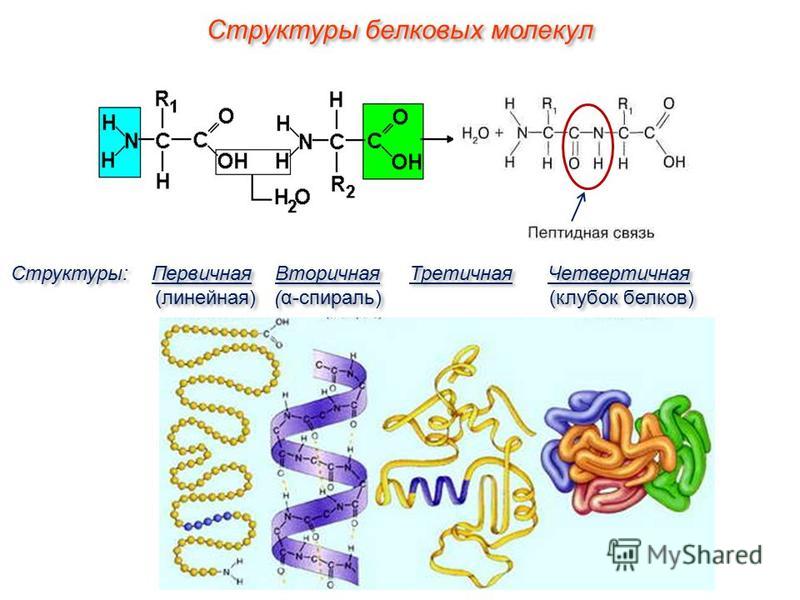 Подобно ДНК, спиральные спирали представляют собой относительно хорошо установленные отношения последовательность-структура, а также предполагаемую специфичность взаимодействия и сродство.Он отличается от характеристик других белковых мотивов или доменов, которые в целом участвуют в сложных и кооперативных межбелковых взаимодействиях. Эти уникальные характеристики спиральных катушек были использованы для прямого программирования четко определенной сборки наноструктур, которая называется CCPO [73]. Методы CCPO основаны на том, что ортогональные взаимодействия отдельных спиральных катушек могут быть модульно объединены для программирование взаимодействий рекомбинантных слитых белков (рис. 5).Систематическое упорядочение спиральных спиралей в цепи слитого белка контролирует топологию и пути сворачивания / сборки желаемых, четко определенных наноструктур. Первое поколение наноструктур CCPO было разработано группой Jerala [32]. Этот метод основан на соединении ортогональных димерных спиралей в одноцепочечный полипептид.
Подобно ДНК, спиральные спирали представляют собой относительно хорошо установленные отношения последовательность-структура, а также предполагаемую специфичность взаимодействия и сродство.Он отличается от характеристик других белковых мотивов или доменов, которые в целом участвуют в сложных и кооперативных межбелковых взаимодействиях. Эти уникальные характеристики спиральных катушек были использованы для прямого программирования четко определенной сборки наноструктур, которая называется CCPO [73]. Методы CCPO основаны на том, что ортогональные взаимодействия отдельных спиральных катушек могут быть модульно объединены для программирование взаимодействий рекомбинантных слитых белков (рис. 5).Систематическое упорядочение спиральных спиралей в цепи слитого белка контролирует топологию и пути сворачивания / сборки желаемых, четко определенных наноструктур. Первое поколение наноструктур CCPO было разработано группой Jerala [32]. Этот метод основан на соединении ортогональных димерных спиралей в одноцепочечный полипептид. Coiled-coil были расположены в топологии многогранника, который складывался ортогональной димеризацией отдельных пар coiled-coil, направляемой складыванием многогранника.В частности, одноцепочечный полипептид, состоящий из 12 сцепленных спиралей, был свернут в тетраэдр [32]. Короткий и неструктурированный гибкий линкер был помещен между гетеро- и гомодимерными спиральными спиралями. При сворачивании пары спиральных катушек образовывали шесть разных стержневидных ребер, которые были соединены в тетраэдр с полостью в ядре. Повторное сворачивание тетраэдра, первая конструкция наноструктуры CCPO, происходило медленно при наномолярных концентрациях белка из-за низкой растворимости. [32]. Эта проблема ограничивает процессы CCPO в физиологических условиях.По этой причине модули с ортогональной спиральной катушкой были модифицированы для наддува. Обоснованием было то, что модификации для снижения стабильности спиральной спирали без нарушения специфичности связывания могли бы избежать возможной неправильной укладки [33].
Coiled-coil были расположены в топологии многогранника, который складывался ортогональной димеризацией отдельных пар coiled-coil, направляемой складыванием многогранника.В частности, одноцепочечный полипептид, состоящий из 12 сцепленных спиралей, был свернут в тетраэдр [32]. Короткий и неструктурированный гибкий линкер был помещен между гетеро- и гомодимерными спиральными спиралями. При сворачивании пары спиральных катушек образовывали шесть разных стержневидных ребер, которые были соединены в тетраэдр с полостью в ядре. Повторное сворачивание тетраэдра, первая конструкция наноструктуры CCPO, происходило медленно при наномолярных концентрациях белка из-за низкой растворимости. [32]. Эта проблема ограничивает процессы CCPO в физиологических условиях.По этой причине модули с ортогональной спиральной катушкой были модифицированы для наддува. Обоснованием было то, что модификации для снижения стабильности спиральной спирали без нарушения специфичности связывания могли бы избежать возможной неправильной укладки [33]. Остатки в положениях b, c и f (проиллюстрированные на рисунке 1a) могут изменять стабильность спиральной катушки, в то время как ортогональное сродство набора спиральных катушек не изменяется [23]. В эти места вводили отрицательно заряженные остатки, чтобы снизить стабильность спиральных спиралей.Используя модули coiled-coil с наддувом, одноцепочечный гибридный белок coiled-coil, состоящий из параллельных и антипараллельных модулей, был разработан в тетраэдрической топологии (рис. 5a) [33]. Тетраэдры были экспрессированы в бактериях и получены как растворимые белки. Складывание тетраэдра также было достигнуто в клетках млекопитающих или мышей, демонстрируя биосовместимость, а также большой потенциал для доставки лекарств и вакцин. В одноцепочечном CCPO все димерные спиральные спирали должны быть систематически расположены для соединения краев спиральной спирали. в вершинах, соединенных в многогранную структуру.Обзор принципов построения одноцепочечных CCPO представлен в недавнем обзоре [73].
Остатки в положениях b, c и f (проиллюстрированные на рисунке 1a) могут изменять стабильность спиральной катушки, в то время как ортогональное сродство набора спиральных катушек не изменяется [23]. В эти места вводили отрицательно заряженные остатки, чтобы снизить стабильность спиральных спиралей.Используя модули coiled-coil с наддувом, одноцепочечный гибридный белок coiled-coil, состоящий из параллельных и антипараллельных модулей, был разработан в тетраэдрической топологии (рис. 5a) [33]. Тетраэдры были экспрессированы в бактериях и получены как растворимые белки. Складывание тетраэдра также было достигнуто в клетках млекопитающих или мышей, демонстрируя биосовместимость, а также большой потенциал для доставки лекарств и вакцин. В одноцепочечном CCPO все димерные спиральные спирали должны быть систематически расположены для соединения краев спиральной спирали. в вершинах, соединенных в многогранную структуру.Обзор принципов построения одноцепочечных CCPO представлен в недавнем обзоре [73].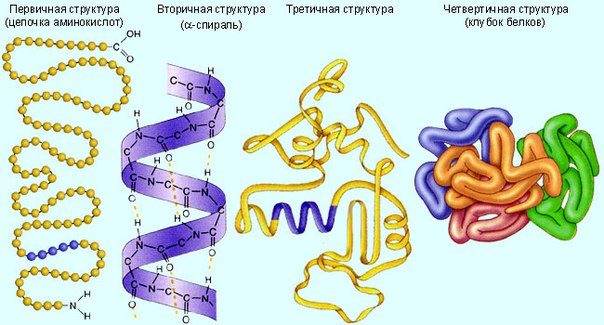 Вкратце, после выбора многогранной целевой структуры строится двойной эйлеров путь. Линейная цепочка создается из этого кругового пути путем выбора оптимального порядка сегментов с низким общим порядком контакта (TCO) из возможных круговых перестановок. TCO — это параметр оценки, который отражает среднее расстояние между сегментами сопряжения, а более низкая TCO увеличивает вероятность успеха проектирования. Затем ортогональные спиральные спирали соединяются в полипептидную цепь в соответствии с выбранным порядком сегментов.Эти шаги для проектирования CCPO с одной цепью были интегрированы в платформу вычислительного проектирования CoCoPOD (https://github.com/NIC-SBI/CC_protein_origami) [33]. Эта платформа может использоваться для разработки конструкции клетки CCPO, а также для построения модели атомистической структуры. Например, наноструктуры прямоугольной пирамиды и треугольной призмы были построены с использованием CoCoPOD (рис. 5b) [33]. Одноцепочечный гибридный белок, связывающий шесть параллельных и две антипараллельных пары спиральных спиралей (16 модулей), был разработан и сложен в четырехстороннюю пирамиду.
Вкратце, после выбора многогранной целевой структуры строится двойной эйлеров путь. Линейная цепочка создается из этого кругового пути путем выбора оптимального порядка сегментов с низким общим порядком контакта (TCO) из возможных круговых перестановок. TCO — это параметр оценки, который отражает среднее расстояние между сегментами сопряжения, а более низкая TCO увеличивает вероятность успеха проектирования. Затем ортогональные спиральные спирали соединяются в полипептидную цепь в соответствии с выбранным порядком сегментов.Эти шаги для проектирования CCPO с одной цепью были интегрированы в платформу вычислительного проектирования CoCoPOD (https://github.com/NIC-SBI/CC_protein_origami) [33]. Эта платформа может использоваться для разработки конструкции клетки CCPO, а также для построения модели атомистической структуры. Например, наноструктуры прямоугольной пирамиды и треугольной призмы были построены с использованием CoCoPOD (рис. 5b) [33]. Одноцепочечный гибридный белок, связывающий шесть параллельных и две антипараллельных пары спиральных спиралей (16 модулей), был разработан и сложен в четырехстороннюю пирамиду. Треугольная призма была также сконструирована путем построения цепи, содержащей шесть параллельных и три антипараллельных пары витых катушек (18 модулей). Эти две наноструктуры CCPO были экспрессированы в бактериях и продуцированы в виде растворимых белков. Другой метод CCPO, основанный на множественных цепях, был недавно разработан группой Китинга и сотрудниками [30]. Этот метод используется для создания нескольких цепочек гибридных белков, которые связывают ортогонально взаимодействующие спиральные спирали. В то время как метод одноцепочечного CCPO ограничивает множественные взаимодействия спиральных катушек внутри одной цепи, этот многоцепочечный метод CCPO упорядочивает спиральные витки для разработки и программирования точных межцепочечных взаимодействий.Этот подход был использован для программирования сборки треугольной наноструктуры, что было достигнуто путем конструирования трех белковых цепей из спиралей (рис. 5c) [30]. Сконструированные с помощью вычислений синтетические гетеродимерные спиральные спирали, названные SYNZIPs [16,17], были связаны в три отдельных гибридных белка.
Треугольная призма была также сконструирована путем построения цепи, содержащей шесть параллельных и три антипараллельных пары витых катушек (18 модулей). Эти две наноструктуры CCPO были экспрессированы в бактериях и продуцированы в виде растворимых белков. Другой метод CCPO, основанный на множественных цепях, был недавно разработан группой Китинга и сотрудниками [30]. Этот метод используется для создания нескольких цепочек гибридных белков, которые связывают ортогонально взаимодействующие спиральные спирали. В то время как метод одноцепочечного CCPO ограничивает множественные взаимодействия спиральных катушек внутри одной цепи, этот многоцепочечный метод CCPO упорядочивает спиральные витки для разработки и программирования точных межцепочечных взаимодействий.Этот подход был использован для программирования сборки треугольной наноструктуры, что было достигнуто путем конструирования трех белковых цепей из спиралей (рис. 5c) [30]. Сконструированные с помощью вычислений синтетические гетеродимерные спиральные спирали, названные SYNZIPs [16,17], были связаны в три отдельных гибридных белка. Когда три связанных белка слияния SYNZIP были смешаны и отожжены, ортогональная димеризация пар SYNZIP опосредовала сборку гетеротримерной треугольной белковой наноструктуры. Запрограммированная ассоциация связанных-SYNZIP была подтверждена гель-электрофорезом в естественных условиях с последующим анализом вторичной структуры с использованием спектроскопии кругового дихроизма.Структурные особенности в нанометровом масштабе или на атомном уровне были охарактеризованы с использованием АСМ и МУРР соответственно. Сходным образом были созданы треугольные и квадратные формы с использованием слитых белков, которые связывали однотипные гетеродимерные спиральные спирали [31]. Чтобы избежать повторной сборки в неограниченные структуры, такие как волокна или объемные фазы, длина линкеров между связанными спиральными катушками варьировалась для ограничения диапазона углов между краями спиральных катушек, что приводило к объединению 3 или 4 субъединиц (рисунок 3).Многоцепочечный CCPO относительно прост и гибок для проектирования и производства белковых наноструктур.
Когда три связанных белка слияния SYNZIP были смешаны и отожжены, ортогональная димеризация пар SYNZIP опосредовала сборку гетеротримерной треугольной белковой наноструктуры. Запрограммированная ассоциация связанных-SYNZIP была подтверждена гель-электрофорезом в естественных условиях с последующим анализом вторичной структуры с использованием спектроскопии кругового дихроизма.Структурные особенности в нанометровом масштабе или на атомном уровне были охарактеризованы с использованием АСМ и МУРР соответственно. Сходным образом были созданы треугольные и квадратные формы с использованием слитых белков, которые связывали однотипные гетеродимерные спиральные спирали [31]. Чтобы избежать повторной сборки в неограниченные структуры, такие как волокна или объемные фазы, длина линкеров между связанными спиральными катушками варьировалась для ограничения диапазона углов между краями спиральных катушек, что приводило к объединению 3 или 4 субъединиц (рисунок 3).Многоцепочечный CCPO относительно прост и гибок для проектирования и производства белковых наноструктур.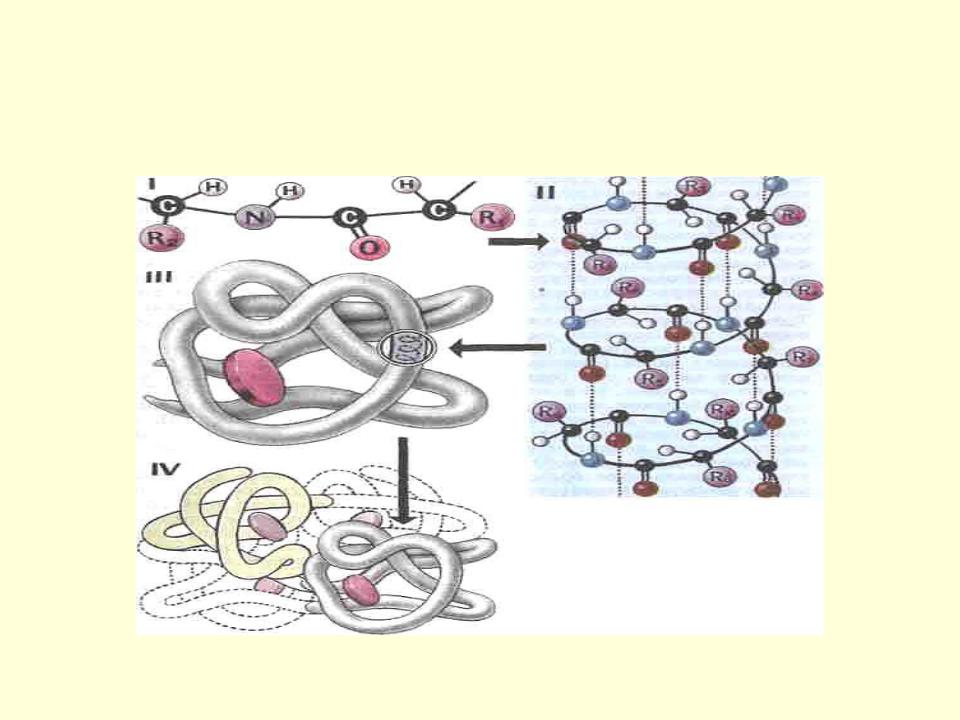 Во-первых, топологии целевой наноструктуры могут быть просто сгенерированы путем соединения фрагментов, образующих стержневидные края спиральной катушки. По две цепочки размещены на каждом ребре с учетом ряда возможных способов соединения ребер. Например, топологии, содержащие одну, две или три цепи, позволили создать треугольную наноструктуру (рис. 5d). Для выбранной трехцепочечной топологии модули SYNZIP были скомпонованы в выбранную топологию, после чего был выбран вариант проекта из 16 возможных [30].Выбор многообещающего кандидата на дизайн был сделан путем исключения кандидатов на дизайн, содержащих строительные блоки, которые могут образовывать нежелательные конкурирующие структуры, такие как гомодимеры или гетеродимеры связанных субъединиц SYNZIP. Во-вторых, такие нежелательные конкурирующие побочные продукты могут быть уменьшены путем настройки протоколов отжига или удалены с помощью эксклюзионной хроматографии (SEC). В конструкции треугольника образование гомодимера связанных SYNZIP было уменьшено путем изменения молярного соотношения субъединиц или изменения скорости охлаждения во время термического отжига.
Во-первых, топологии целевой наноструктуры могут быть просто сгенерированы путем соединения фрагментов, образующих стержневидные края спиральной катушки. По две цепочки размещены на каждом ребре с учетом ряда возможных способов соединения ребер. Например, топологии, содержащие одну, две или три цепи, позволили создать треугольную наноструктуру (рис. 5d). Для выбранной трехцепочечной топологии модули SYNZIP были скомпонованы в выбранную топологию, после чего был выбран вариант проекта из 16 возможных [30].Выбор многообещающего кандидата на дизайн был сделан путем исключения кандидатов на дизайн, содержащих строительные блоки, которые могут образовывать нежелательные конкурирующие структуры, такие как гомодимеры или гетеродимеры связанных субъединиц SYNZIP. Во-вторых, такие нежелательные конкурирующие побочные продукты могут быть уменьшены путем настройки протоколов отжига или удалены с помощью эксклюзионной хроматографии (SEC). В конструкции треугольника образование гомодимера связанных SYNZIP было уменьшено путем изменения молярного соотношения субъединиц или изменения скорости охлаждения во время термического отжига.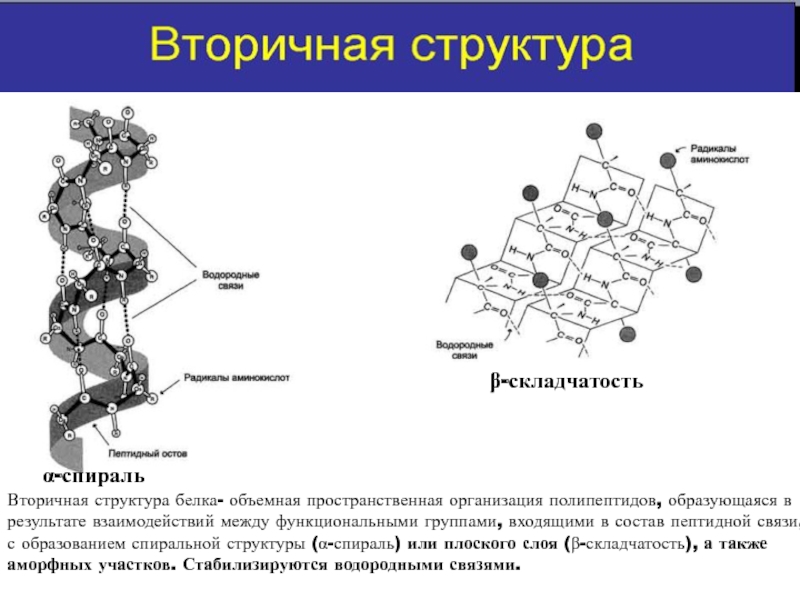 После отжига треугольники были отделены от смесей нежелательных побочных продуктов с помощью SEC [30]. Использование нескольких цепочек для проектирования CCPO обеспечивает большой потенциал для улучшения возможностей проектирования. В то время как одноцепочечная топология CCPO требует соответствия двойному эйлерову пути [73], использование нескольких цепочек для CCPO позволяет избежать таких ограничений и позволяет генерировать различные возможные топологии (рисунок 5d). Это преимущество может потенциально улучшить возможность создания более сложных наноструктур CCPO, чем многогранники или многоугольники.Однако необходимо внести некоторые существенные улучшения. Во-первых, необходимо точно контролировать углы в каждой вершине, чтобы собрать желаемые формы. Например, форма многоугольных наноструктур, состоящих из более чем трех краев, может быть искажена без использования линкеров, регулирующих угол. Конформационные ограничения путем размещения дисульфидных связей [36] или коротких линкеров оказались многообещающими [31].
После отжига треугольники были отделены от смесей нежелательных побочных продуктов с помощью SEC [30]. Использование нескольких цепочек для проектирования CCPO обеспечивает большой потенциал для улучшения возможностей проектирования. В то время как одноцепочечная топология CCPO требует соответствия двойному эйлерову пути [73], использование нескольких цепочек для CCPO позволяет избежать таких ограничений и позволяет генерировать различные возможные топологии (рисунок 5d). Это преимущество может потенциально улучшить возможность создания более сложных наноструктур CCPO, чем многогранники или многоугольники.Однако необходимо внести некоторые существенные улучшения. Во-первых, необходимо точно контролировать углы в каждой вершине, чтобы собрать желаемые формы. Например, форма многоугольных наноструктур, состоящих из более чем трех краев, может быть искажена без использования линкеров, регулирующих угол. Конформационные ограничения путем размещения дисульфидных связей [36] или коротких линкеров оказались многообещающими [31]. Кроме того, инженерные жесткие линкеры с четко определенными углами улучшат конструктивность. Во-вторых, необходимо больше наборов ортогонально взаимодействующих спиральных катушек.Более фундаментальные знания и наборы данных о специфичности и стабильности спиральных катушек позволят de novo проектировать большие наборы ортогональных спиральных катушек. Наконец, основы кооперативного взаимодействия между многими цепями, а также контролируемые пути сворачивания позволят эффективно проектировать сложные топологии с использованием множества цепей типа «спираль-катушка».
Кроме того, инженерные жесткие линкеры с четко определенными углами улучшат конструктивность. Во-вторых, необходимо больше наборов ортогонально взаимодействующих спиральных катушек.Более фундаментальные знания и наборы данных о специфичности и стабильности спиральных катушек позволят de novo проектировать большие наборы ортогональных спиральных катушек. Наконец, основы кооперативного взаимодействия между многими цепями, а также контролируемые пути сворачивания позволят эффективно проектировать сложные топологии с использованием множества цепей типа «спираль-катушка».белков спиральной спирали способствовали функциональному расширению центросомы
Цитирование: Кун М., Хайман А.А., Бейер А. (2014) Белки спиральной спирали способствовали функциональному расширению центросомы.PLoS Comput Biol 10 (6): e1003657. https://doi.org/10.1371/journal.pcbi.1003657
Редактор: Мона Сингх, Принстонский университет, США
Поступила: 6 января 2014 г . ; Принята к печати: 15 апреля 2014 г .; Опубликован: 5 июня 2014 г.
; Принята к печати: 15 апреля 2014 г .; Опубликован: 5 июня 2014 г.
Авторские права: © 2014 Kuhn et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: MK финансируется Deutsche Forschungsgemeinschaft (DFG KU 2796 / 2-1). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Переход от одноклеточности к многоклеточности произошел независимо во многих эукариотических клонах [1]. По сравнению с другими многоклеточными организмами, животные отличаются большим количеством типов клеток [1], [2], сложностью строения тела и необходимостью миграции клеток для развития [3]. Эволюции этих черт у животных способствовали свойства клеточной мембраны, подвижность клеток и деление клеток: животные сохранили наследственные способы подвижности клеток (амебоидную и подвижность жгутиков) и мягкую клеточную мембрану. У растений и грибов образовалась жесткая клеточная стенка, ограничивающая подвижность клеток. Однако мы мало знаем о том, как органеллы, необходимые для деления, подвижности и организации клеток, эволюционировали с увеличением сложности животных.
Эволюции этих черт у животных способствовали свойства клеточной мембраны, подвижность клеток и деление клеток: животные сохранили наследственные способы подвижности клеток (амебоидную и подвижность жгутиков) и мягкую клеточную мембрану. У растений и грибов образовалась жесткая клеточная стенка, ограничивающая подвижность клеток. Однако мы мало знаем о том, как органеллы, необходимые для деления, подвижности и организации клеток, эволюционировали с увеличением сложности животных.
Цитоскелет играет ключевую роль в организации, подвижности и делении клеток [4], [5].Одним из координаторов цитоскелета является центр организации микротрубочек (MTOC). У большинства животных и многих других эукариот базальное тело или центросома — это MTOC. Базальные тела являются предками эукариот и состоят из парных центриолей [6]. У животных центросома состоит из центриолей и окружающего их перицентриолярного материала (ПКМ). Центросома действует как узел передачи сигналов [7], [8], координируя многие функции многоклеточных организмов, например миграцию клеток или поддержание ориентации клеток во время деления [9] — [11].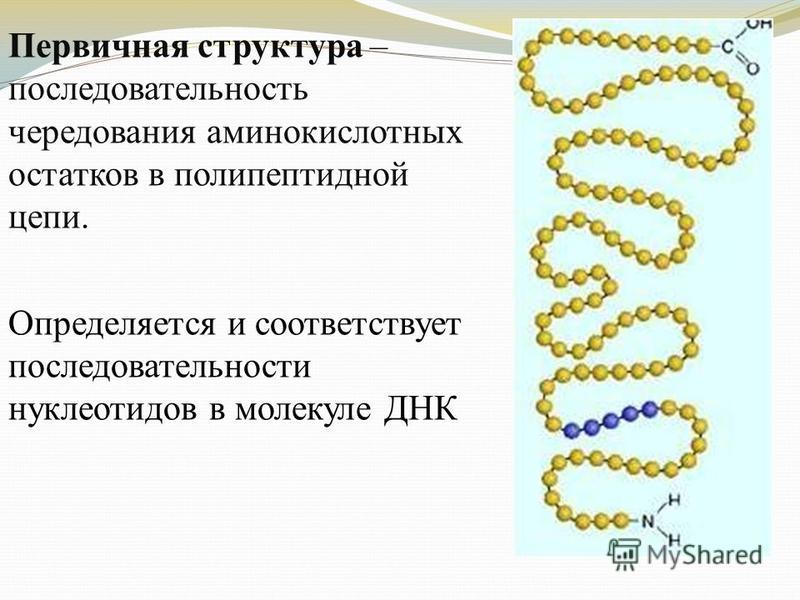 Грибки и слизевики независимо развили тела полюсов веретена, в то время как у растений существует большое разнообразие ацентриолярных MTOC [12]. Таким образом, расширение и потеря функций центросомы на протяжении эволюции можно проследить в различных эукариотических клонах. Признанные механизмы эволюции новых функций включают расширение семейств генов посредством дупликации, появление скоординированной регуляции и рождение гена de novo [13] — [16]. Другой механизм — это перестройка молекулярных сигнальных сетей с использованием существующих молекулярных компонентов клетки в новых условиях [17], [18].Однако неясно, какие механизмы участвуют в эволюции целых органелл.
Грибки и слизевики независимо развили тела полюсов веретена, в то время как у растений существует большое разнообразие ацентриолярных MTOC [12]. Таким образом, расширение и потеря функций центросомы на протяжении эволюции можно проследить в различных эукариотических клонах. Признанные механизмы эволюции новых функций включают расширение семейств генов посредством дупликации, появление скоординированной регуляции и рождение гена de novo [13] — [16]. Другой механизм — это перестройка молекулярных сигнальных сетей с использованием существующих молекулярных компонентов клетки в новых условиях [17], [18].Однако неясно, какие механизмы участвуют в эволюции целых органелл.
Мы использовали центросомы для изучения взаимодействия между макроскопической и клеточной эволюцией: центросома животных имеет расширенный PCM по сравнению с другими видами, но ее ядро восходит к последнему общему предку эукариот [6]. Предыдущие исследования, посвященные эволюции центриолей, показали, что многие компоненты центросомы животных впервые появились у животных [19], [20]. Однако многие из этих очевидно новых белков представляют собой спиральные белки.Спирали, образующие спиральные спирали, имеют регулярный повторяющийся узор из гидрофобных, заряженных и гидрофильных аминокислот [21]. Этот так называемый гептадный повтор из семи остатков заставляет традиционные алгоритмы выравнивания последовательностей переоценивать значимость наблюдаемого сходства последовательностей, что приводит к неверно предсказанным гомологичным белкам. Другими словами, очевидно похожие белки могут скрывать фактический гомологичный белок. Таким образом, предыдущие исследования замаскировали последовательности coiled-coil из поисков сходства [22], что увеличивает риск пропуска истинных ортологов.Т.о., полный обзор эволюционной истории центросомных белков должен быть основан на уточненном выравнивании белков coiled-coil. Мы разработали новый метод, который учитывает ограниченное пространство возможных замен, тем самым значительно сокращая количество ложных срабатываний. Наш метод различает спиральные и «нормальные» области и по-разному обрабатывает остатки в разных положениях гептадного повтора.
Однако многие из этих очевидно новых белков представляют собой спиральные белки.Спирали, образующие спиральные спирали, имеют регулярный повторяющийся узор из гидрофобных, заряженных и гидрофильных аминокислот [21]. Этот так называемый гептадный повтор из семи остатков заставляет традиционные алгоритмы выравнивания последовательностей переоценивать значимость наблюдаемого сходства последовательностей, что приводит к неверно предсказанным гомологичным белкам. Другими словами, очевидно похожие белки могут скрывать фактический гомологичный белок. Таким образом, предыдущие исследования замаскировали последовательности coiled-coil из поисков сходства [22], что увеличивает риск пропуска истинных ортологов.Т.о., полный обзор эволюционной истории центросомных белков должен быть основан на уточненном выравнивании белков coiled-coil. Мы разработали новый метод, который учитывает ограниченное пространство возможных замен, тем самым значительно сокращая количество ложных срабатываний. Наш метод различает спиральные и «нормальные» области и по-разному обрабатывает остатки в разных положениях гептадного повтора. Мы выполнили выравнивание «все против всех» для белков 108 видов эукариот, чтобы предсказать ортологи [23].Объединив наши прогнозы с прогнозами, основанными на поиске BLAST, мы создали набор данных по семействам белков, который можно использовать для точного определения создания семейства протеинов в процессе эволюции, подобно филостратиграфии [24]. Мы сопоставили появление белковых семейств, белковых сетей и функций, чтобы сделать вывод о важных участниках эволюции центросомы животных (см. Рис. S1 для обзора).
Мы выполнили выравнивание «все против всех» для белков 108 видов эукариот, чтобы предсказать ортологи [23].Объединив наши прогнозы с прогнозами, основанными на поиске BLAST, мы создали набор данных по семействам белков, который можно использовать для точного определения создания семейства протеинов в процессе эволюции, подобно филостратиграфии [24]. Мы сопоставили появление белковых семейств, белковых сетей и функций, чтобы сделать вывод о важных участниках эволюции центросомы животных (см. Рис. S1 для обзора).
Результаты
Улучшенный алгоритм выравнивания белков спиральной спирали
Недавнее дополнение к BLAST — это настройка матриц замещения на основе композиции [25].Этот подход изменяет матрицы замещения путем корректировки оценок замещения, чтобы отразить аминокислотный состав, наблюдаемый в белках запроса и базы данных, при сохранении постоянной энтропии матриц. Белки со смещенным составом последовательностей встречаются в определенных семействах белков или даже в целых организмах с геномами, богатыми AT или GC. В некоторой степени корректировка композиционной матрицы также может учитывать смещенный состав белков спиральной спирали, например наблюдая обилие гидрофильных остатков и уменьшая баллы замещения.Тем не менее, корректировка композиционной матрицы не принимает во внимание регулярную структуру повторов белков coiled-coil, и она также не может иметь дело с разными композиционными отклонениями, обнаруженными внутри и вне доменов coiled-coil.
В некоторой степени корректировка композиционной матрицы также может учитывать смещенный состав белков спиральной спирали, например наблюдая обилие гидрофильных остатков и уменьшая баллы замещения.Тем не менее, корректировка композиционной матрицы не принимает во внимание регулярную структуру повторов белков coiled-coil, и она также не может иметь дело с разными композиционными отклонениями, обнаруженными внутри и вне доменов coiled-coil.
Существуют различные подходы к созданию специализированных матриц замещения для частей белков с различным составом, например, для трансмембранных белков [26] или для различения гидрофобных и негидрофобных областей [27]. Первоначально мы также создали специализированные матрицы замещения для областей coiled-coil и non-coiled-coil белков.Хотя этот подход превзошел стандартную матрицу BLOSUM (данные не показаны), он не работал лучше, чем BLAST с корректировкой композиционной матрицы. Поэтому мы разработали два алгоритма, которые учитывают свойства последовательности структуры спиральной катушки.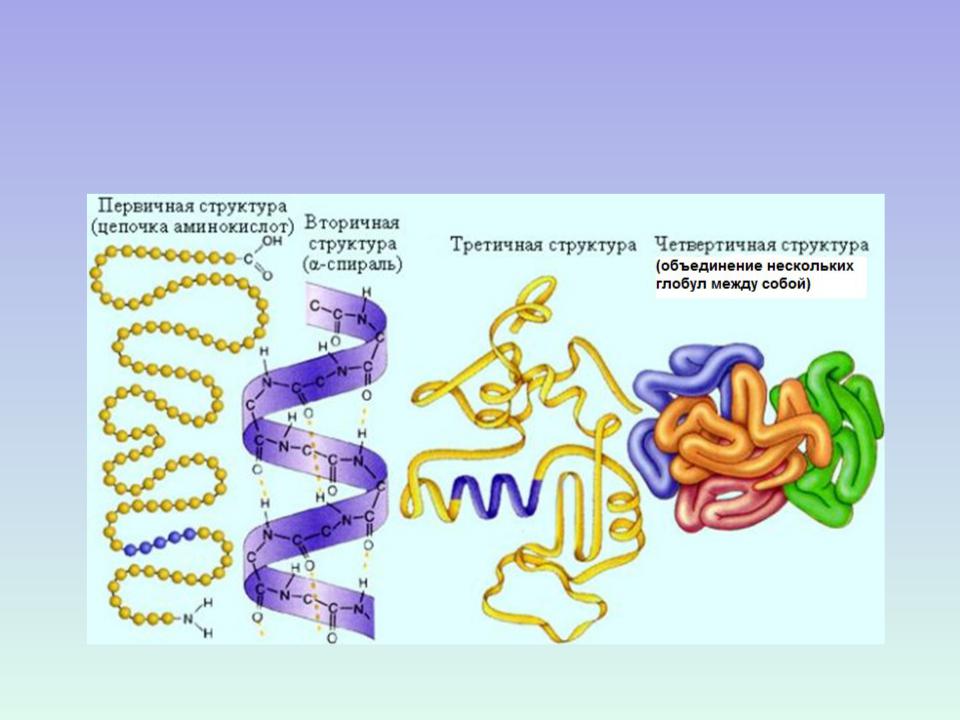 В обоих алгоритмах спиральные катушки предсказываются с помощью MultiCoil2 [28] с вероятностью отсечки 0,8. В первом алгоритме пара белков, подлежащих выравниванию, делится на подпоследовательности coiled-coil и non-coiled-coil. Эти подпоследовательности затем используются для корректировки композиционной матрицы.Затем выполняется полное выравнивание Смит-Уотерман-Гото. Матрица замещения выбирается в соответствии со статусом спиральной спирали рассматриваемых остатков (рис. 1, подробности см. В разделе «Методы»). Во втором алгоритме домены спиральной спирали дополнительно разделены на три части: гидрофобный интерфейс, заряженные промежуточные остатки и гидрофильный внешний слой.
В обоих алгоритмах спиральные катушки предсказываются с помощью MultiCoil2 [28] с вероятностью отсечки 0,8. В первом алгоритме пара белков, подлежащих выравниванию, делится на подпоследовательности coiled-coil и non-coiled-coil. Эти подпоследовательности затем используются для корректировки композиционной матрицы.Затем выполняется полное выравнивание Смит-Уотерман-Гото. Матрица замещения выбирается в соответствии со статусом спиральной спирали рассматриваемых остатков (рис. 1, подробности см. В разделе «Методы»). Во втором алгоритме домены спиральной спирали дополнительно разделены на три части: гидрофобный интерфейс, заряженные промежуточные остатки и гидрофильный внешний слой.
Рисунок 1. Новый алгоритм совмещения.
BLAST корректирует матрицы замен на основе полных последовательностей пары белков, которые необходимо выровнять.CCAlign вычисляет скорректированные, специфические матрицы для доменов coiled-coil и частей белков non-coiled-coil. Затем для выравнивания выбираются различные матрицы замещения в соответствии с состоянием спиральной спирали отдельных рассматриваемых остатков.
https://doi.org/10.1371/journal.pcbi.1003657.g001
Чтобы сравнить различные реализации друг с другом, мы приняли схему сравнительного анализа, основанную на аннотированных вручную KOG (эукариотические ортологические группы) и отдельном наборе из S.pombe — Гомологи S. cerevisiae [29], [30]. Чтобы смоделировать белки с высокой долей спиральных спиралей, мы взяли белки спиральной спирали из этих двух наборов данных и создали искусственные белки, вырезая предсказанные домены спиральной спирали вместе с линкером переменной длины. Подпоследовательности (т.е. все экземпляры линкер-спиральная спираль-линкер) объединяются и используются для выравнивания. Сначала мы использовали базу данных KOG, чтобы установить выбор параметров для наших алгоритмов выравнивания (рис. S2).Затем мы сравнили производительность наших алгоритмов с несколькими вариантами BLAST: стандартным BLAST, стандартным BLAST с полным выравниванием по Смиту-Ватерману (не оптимизированным и, следовательно, очень медленным), PSI-BLAST и, для справки, BLAST без корректировки композиционной матрицы и без пропусков.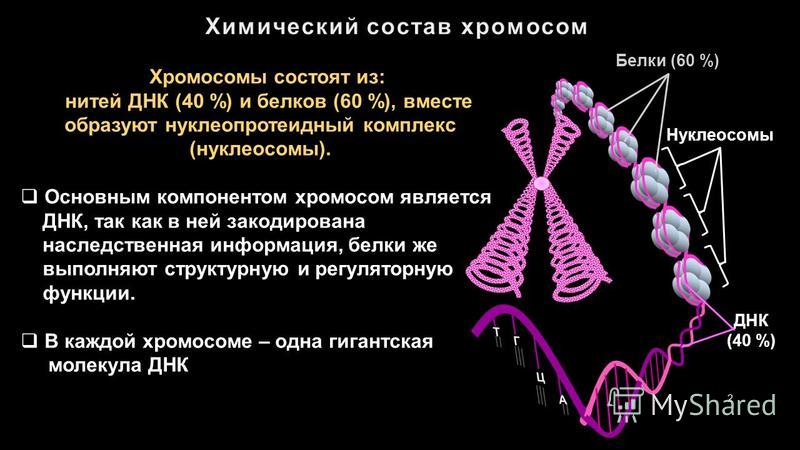 BLAST (который также использует фиксированную матрицу замещения). Результаты набора данных о дрожжах (рис. 2) согласуются с результатами набора данных KOG (рис. S3): CCAlign и CCAlignX работают лучше, чем другие методы. Например, по тесту дрожжей с длиной линкера 50 и 5% FDR CCAlign правильно идентифицирует 67.7% всех возможных взаимных лучших совпадений, CCAlignX определяет 68,4%, а BLAST 61,1%. BLAST также может выполняться с полным алгоритмом Смита-Уотермана, который не был оптимизирован по скорости и, следовательно, не может использоваться для крупномасштабных приложений. В этой конфигурации BLAST определяет 62,3% всех возможных взаимных наилучших совпадений. PSI-BLAST работает намного хуже, определяя только 48,8% (при трех итерациях и соответственно увеличенном времени выполнения). Построение оценочной матрицы, зависящей от должности (PSSM), отличительной чертой итеративного подхода, принятого PSI-BLAST, частично несовместимо с корректировкой композиционной матрицы.Модули PSSM улавливают сильный сигнал последовательности доменов спиральной катушки и, следовательно, обнаруживают множество ложных срабатываний.
BLAST (который также использует фиксированную матрицу замещения). Результаты набора данных о дрожжах (рис. 2) согласуются с результатами набора данных KOG (рис. S3): CCAlign и CCAlignX работают лучше, чем другие методы. Например, по тесту дрожжей с длиной линкера 50 и 5% FDR CCAlign правильно идентифицирует 67.7% всех возможных взаимных лучших совпадений, CCAlignX определяет 68,4%, а BLAST 61,1%. BLAST также может выполняться с полным алгоритмом Смита-Уотермана, который не был оптимизирован по скорости и, следовательно, не может использоваться для крупномасштабных приложений. В этой конфигурации BLAST определяет 62,3% всех возможных взаимных наилучших совпадений. PSI-BLAST работает намного хуже, определяя только 48,8% (при трех итерациях и соответственно увеличенном времени выполнения). Построение оценочной матрицы, зависящей от должности (PSSM), отличительной чертой итеративного подхода, принятого PSI-BLAST, частично несовместимо с корректировкой композиционной матрицы.Модули PSSM улавливают сильный сигнал последовательности доменов спиральной катушки и, следовательно, обнаруживают множество ложных срабатываний. По сути, PSI-BLAST нарушает поговорку «когда вы окажетесь в яме, прекратите копать», итеративно выстраивая профиль для обнаружения спиральных катушек, но не сходства последовательностей, которое связано с гомологией.
По сути, PSI-BLAST нарушает поговорку «когда вы окажетесь в яме, прекратите копать», итеративно выстраивая профиль для обнаружения спиральных катушек, но не сходства последовательностей, которое связано с гомологией.
Рисунок 2. Бенчмаркинг алгоритмов.
Алгоритмы выравнивания были применены к спиральным белкам из набора вручную аннотированных ортологов дрожжей. Затем для каждого белка определялось, действительно ли лучший результат был аннотирован как ортологичный.Части белков без спиральной спирали были уменьшены до соответствующей длины линкера (показанной справа на панелях), чтобы увеличить сложность обнаружения истинного гомолога. CCAlign и CCAlignX, два алгоритма, которые учитывают свойства последовательности спиральных катушек, работают лучше, чем стандартные алгоритмы. Пунктирные горизонтальные линии указывают на 5% ложное обнаружение. Для ясности данные менее чем для десяти прогнозов опущены. (S-W: алгоритм Смита-Уотермана).
https: // doi. org / 10.1371 / journal.pcbi.1003657.g002
org / 10.1371 / journal.pcbi.1003657.g002
Вне набора тестов мы сравнили производительность BLAST, CCAlign и CCAlignX на полном наборе белков в нашем наборе данных из 108 видов. Для белков, по крайней мере, 20% их остатков в спиральных спиралях, CCAlign обнаружил на 11,1% больше взаимных наилучших совпадений, чем BLAST (CCAlignX: 11,3%, отсечка битового ядра: 30). Большая часть этого улучшения связана с полным выравниванием по Смиту-Уотерману, выполненным даже для белков без спиральной спирали, где производительность увеличилась на 10.7% для CCAlign (CCAlignX: 10,5%). Влияние скорректированных матриц замещения становится более очевидным для белков с более высоким содержанием спиральной спирали: для белков, содержащих не менее 50% остатков спиральной спирали, производительность увеличилась на 13,1% для CCAlign и 13,5% для CCAlignX. Максимальное увеличение производительности достигается на уровне 17,3% для обоих методов при содержании спиральной спирали не менее 86% и 81% соответственно.
Прогнозируемые гомологи центросомных белков
Мы использовали CCAlign, CCAlignX и BLAST для выполнения выравнивания «все против всех» для белков 108 видов эукариот.Объединив данные всех трех выравниваний, мы предсказали гомологи для всех белков (см. Методы) независимо от содержания спиральной спирали или локализации центросомы, в результате чего была получена база данных ортологичных белков, доступ к которой можно получить по адресу http: //projects.biotec.tu-dresden. де / ортологи /. Чтобы подтвердить наши прогнозы, мы провели поиск в литературе гомологов центросомных белков, которые ранее были обнаружены путем ручного исследования отдельных белков. Мы подтвердили, например, гомологию между CDK5RAP2 (CEP215, fly: cnn) и S.pombe белков mto1 и pcp1 [31], [32] или наличие гомологов DISC1 в растениях [33]. Для многих других белков (см. Таблицу S1) мы обнаружили гомологи за пределами того, что было показано в предыдущих мелкомасштабных или крупномасштабных исследованиях. Например, наш подход идентифицировал гомологи AKAP9, PCNT и PCM1 у грибов. (См. Набор данных S1 для множественного выравнивания последовательностей.) Мы обнаружили гомологи белка spd-5 C. elegans у филяриальных нематод (например, Brugia malayi ) и Ascaris suum .Spd-5 необходим для образования центросом у C. elegans , но ранее сообщалось только у видов Caenorhabditis . Недавнее исследование обнаружило две новые субъединицы аугминного комплекса Arabidopsis thaliana , AUG7 и AUG8, и сообщило, что эти два белка уникальны для растений [34]. Основываясь на большем количестве видов и на более подходящем методе сопоставления, мы могли бы показать, что субъединицы аугмина человека HAUS7 и HAUS8 фактически гомологичны AUG7 и AUG8, соответственно (рис.3). В целом, мы обнаружили ровно 1000 семейств белков, связанных с центросомами у любых видов (см. Таблицы S2 и S3 для обзора). Из них 897 семейств белков также встречаются у человека, 610 из которых, как известно, имеют центросомную локализацию у человека или других млекопитающих (рис.
Например, наш подход идентифицировал гомологи AKAP9, PCNT и PCM1 у грибов. (См. Набор данных S1 для множественного выравнивания последовательностей.) Мы обнаружили гомологи белка spd-5 C. elegans у филяриальных нематод (например, Brugia malayi ) и Ascaris suum .Spd-5 необходим для образования центросом у C. elegans , но ранее сообщалось только у видов Caenorhabditis . Недавнее исследование обнаружило две новые субъединицы аугминного комплекса Arabidopsis thaliana , AUG7 и AUG8, и сообщило, что эти два белка уникальны для растений [34]. Основываясь на большем количестве видов и на более подходящем методе сопоставления, мы могли бы показать, что субъединицы аугмина человека HAUS7 и HAUS8 фактически гомологичны AUG7 и AUG8, соответственно (рис.3). В целом, мы обнаружили ровно 1000 семейств белков, связанных с центросомами у любых видов (см. Таблицы S2 и S3 для обзора). Из них 897 семейств белков также встречаются у человека, 610 из которых, как известно, имеют центросомную локализацию у человека или других млекопитающих (рис. 4).
4).
Рисунок 3. Отдаленные гомологи центросомных белков.
Вопреки предыдущим сообщениям, HAUS7 и AUG7 ( a ), а также HAUS8 и AUG8 ( b ) фактически являются гомологами, связанными белками других видов.Края соединяют пары белков, которые можно успешно выровнять как между видами, так и внутри них. Ширина края соответствует силе (битовой оценке) выравнивания. В обоих случаях хордовые белки наиболее похожи на человеческий белок. Белки других животных, в свою очередь, похожи на белки растений и хордовые белки и, следовательно, позволяют обнаруживать гомологию между человеческими и растительными белками.
https://doi.org/10.1371/journal.pcbi.1003657.g003
Рисунок 4.Филогенетическое распределение семейств белков.
Филогенетическое распределение показано для всех семейств белков, которые были аннотированы как компоненты центросомы, базального тельца или SPB и которые также встречаются у млекопитающих. Клетки, отмеченные черным цветом, обозначают виды, центросомное расположение которых известно, цветные клетки указывают на обнаружение гомолога. Объединены виды одного таксономического класса. (K&P: киназа и фосфатазы, C: цитоскелет и моторные белки)
Объединены виды одного таксономического класса. (K&P: киназа и фосфатазы, C: цитоскелет и моторные белки)
https: // doi.org / 10.1371 / journal.pcbi.1003657.g004
Эволюционный возраст семейств центросомных белков
В каждом семействе белков мы теперь можем проверить распределение видов и, например, найти виды, которые наиболее отдаленно связаны с человеком. Таким образом, мы обнаружили, что большинство семейств центросомных белков более древние, чем другие человеческие белки: 72% всех центросомных белков впервые появились до грибов-животных (опистоконтов), предков (рис. 5), по сравнению с 46% для всех семейств белков человека.Для дальнейшего анализа эволюции функций центросом мы разделили белки на категории на основе их известной функции у человека (см. Методы, рис. 5). Из белков без аннотации мы обозначили белки, по крайней мере, 20% их остатков которых находятся в спиральной спирали, как «спиральные белки». Другими словами, белки coiled-coil, которые имеют аннотированную функцию (например, моторные белки), были сгруппированы по соответствующему функциональному классу. Обратите внимание, что выбор порога спиральной катушки не влияет на результат сетевого анализа, как объясняется ниже.
Обратите внимание, что выбор порога спиральной катушки не влияет на результат сетевого анализа, как объясняется ниже.
Рисунок 5. Участие новых белков в биологических процессах.
Возраст семейств белков центросом зависит от категории белков. Каркасы имеют более позднее происхождение, чем другие белки, в то время как киназы, фосфатазы и ферменты более древние. Несмотря на это, киназы и фосфатазы имеют большое значение для развития многоклеточного организма. Значение p рассчитывается с помощью биномиального теста, сравнивающего долю белков, впервые появившихся у опистоконтов, с общей долей 28%.Последний столбец показывает долю белков, помеченных термином GO «развитие многоклеточного организма».
https://doi.org/10.1371/journal.pcbi.1003657.g005
Для белков, которые встречаются у млекопитающих, мы определили их эволюционный возраст, отыскивая наиболее отдаленные родственные виды. Таким образом, белок, также обнаруженный в Ciona , является хордат-специфичным, в то время как белок, также обнаруженный в хитридных грибах, является опистоконто-специфическим.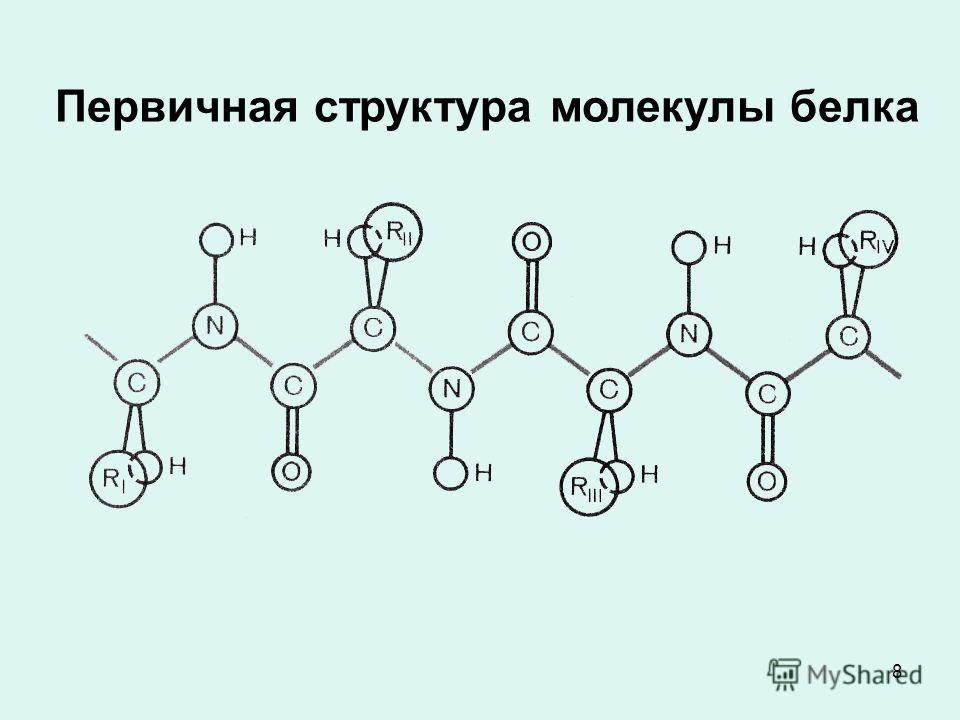 Наш анализ показал, что белки coiled-coil в среднем значительно моложе, чем большинство белков центросом, тогда как киназы и фосфатазы старше (рис.5). Например, 86% семейств киназ и фосфатаз впервые появились до предка опистоконта, по сравнению с 56% для белков coiled-coil. Таким образом, многие белки coiled-coil эволюционировали раньше, чем считалось ранее, но все же моложе других центросомных белков.
Наш анализ показал, что белки coiled-coil в среднем значительно моложе, чем большинство белков центросом, тогда как киназы и фосфатазы старше (рис.5). Например, 86% семейств киназ и фосфатаз впервые появились до предка опистоконта, по сравнению с 56% для белков coiled-coil. Таким образом, многие белки coiled-coil эволюционировали раньше, чем считалось ранее, но все же моложе других центросомных белков.
Интересно, что 76% всех семейств центросомных киназ, как было показано, участвуют в развитии многоклеточного организма, по сравнению с 55% всех киназ. Аналогичные закономерности мы обнаружили и для других функциональных категорий (рис.S4). Таким образом, ассоциированные с центросомами киназы и другие регуляторные белки (которые часто являются древними) обогащены функциями, связанными с многоклеточностью. У (одноклеточного) предка эукариотов киназы не могли обладать этими функциями и, следовательно, должны были приобретать их позже через другие механизмы. Новые функции, например, отражены в увеличенном размере PCM (Таблица S4).
Эволюция центросомы
Чтобы понять механизмы, с помощью которых древние белки были рекрутированы в центросомы, мы разработали стратегию моделирования изменений в сети взаимодействия белков центросомы во время эволюции.Сначала мы собрали сеть белок-белковых взаимодействий центросомы, чтобы идентифицировать те взаимодействия, которые вносят вклад в структурный каркас. Затем эта сеть использовалась для имитации хода эволюции путем итеративного удаления последних эволюционировавших белков. Используя этот метод, мы построили аппроксимацию структуры сети взаимодействия на разных этапах эволюции. В частности, мы проверили, сколько из оставшихся белков потеряли или изменили свой способ рекрутирования на центросому.У нас недостаточно данных о базальном теле предка эукариотов, чтобы количественно оценить влияние потери белка. Однако очевидное увеличение сложности и размера от базального тела к центросоме животных делает вероятным, что увеличение количества белков играет гораздо большую роль, чем их потеря.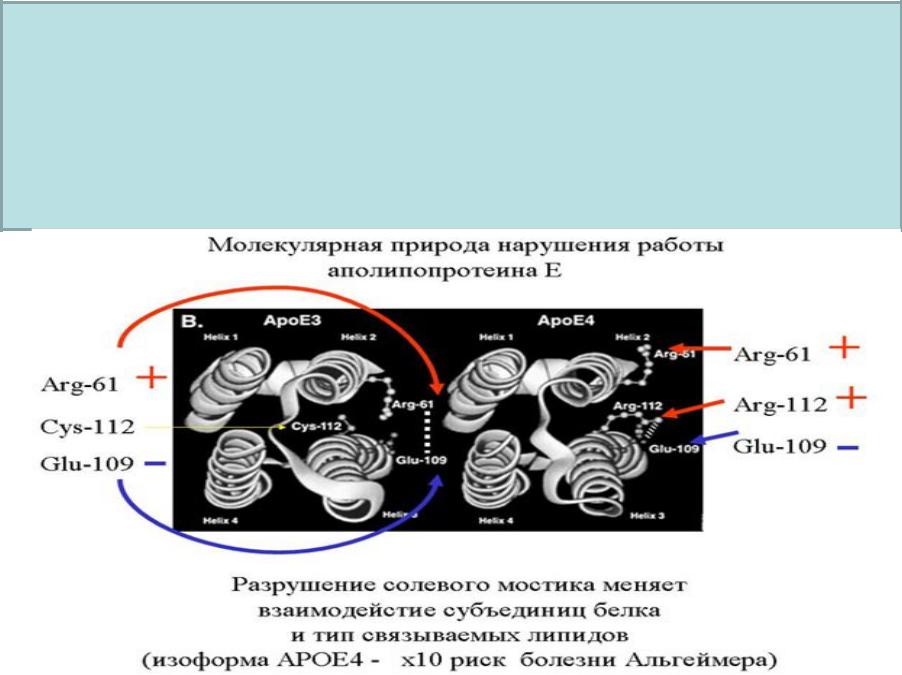 Однако потеря белков проявляется как в грибах, так и в растениях. В этих линиях базальное тело устарело, что привело к потере многих белков центриолей.
Однако потеря белков проявляется как в грибах, так и в растениях. В этих линиях базальное тело устарело, что привело к потере многих белков центриолей.
Сначала мы извлекли сеть взаимодействий из базы данных STRING [35], используя взаимодействия, полученные из экспериментальных данных и интеллектуального анализа текста (см. Методы).Эта сеть содержит как прямые, так и непрямые взаимодействия и представляет функциональные взаимодействия белков центросомы, даже если нет достаточно подробных структурных данных для полной центросомы. Эволюционным и структурным ядром центросомы является центриоль, служащая затравкой для формирования ПКМ. В частности, два консервативных белка, которые уже присутствовали у предка эукариот, важны для образования центриоли: SASS6 служит матрицей для бочкообразной центриоли [36].SAS-4, ортолог C. elegans CENPJ, контролирует размер центросомы [37]. Его ортолог Drosophila , sas-4, как было показано, рекрутирует цитоплазматические комплексы белков PCM [38]. Эти белки PCM могут затем, в свою очередь, рекрутировать др. Центросомные белки, формируя сеть межбелковых взаимодействий, в которой доминирует плотное ядро регуляторных белков, киназ, фосфатаз и их субстратов (Fig. S5). На периферии этого сигнального хаба цилиарные белки, комплекс гамма-тубулина и комплекс аугмин расположены в менее связанных областях сети.
Эти белки PCM могут затем, в свою очередь, рекрутировать др. Центросомные белки, формируя сеть межбелковых взаимодействий, в которой доминирует плотное ядро регуляторных белков, киназ, фосфатаз и их субстратов (Fig. S5). На периферии этого сигнального хаба цилиарные белки, комплекс гамма-тубулина и комплекс аугмин расположены в менее связанных областях сети.
Расстояние в сети между данным белком и центриолью можно рассчитать как количество шагов на кратчайшем пути между белком и центриолярными белками SASS6 и CENPJ. Мы упростили анализ, используя белки структурной основы в качестве промежуточных узлов (т.е. только белки со спиральной спиралью и некатегоризованные белки, см. Методы и рис. 6а). Эти белки, вероятно, опосредуют взаимодействия киназ и других белков с PCM. Чтобы имитировать эволюцию центросомы, мы итеративно удалили из сети самые недавно появившиеся белки (см.Методы, рис.6б). Наш анализ показал, что в полной сети взаимодействия 71% всех белков доступны в пределах трех шагов от центриоли.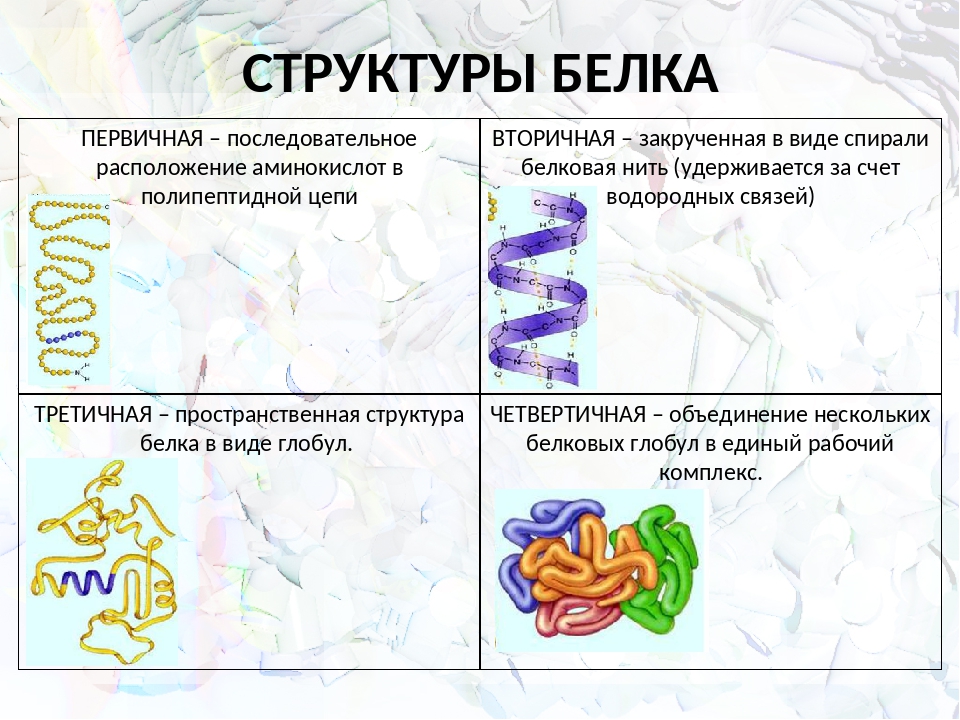 Эта фракция оставалась практически постоянной после удаления хордовых белков и белков, специфичных для животных. Однако, когда опистоконт-специфические белки были удалены, только 41% всех белков остался доступным в течение трех этапов. Мы выяснили значение этого, перетасовывая эволюционное происхождение белков 10 000 раз. Белки были разделены на пять бункеров в соответствии с их содержанием в виде спиральной спирали, и эволюционный возраст был перетасован в каждом из этих бункеров, чтобы контролировать возможные отклонения в обнаруженном возрасте белков.Действительно, мы обнаружили, что фактическое изменение доли белков в пределах трех ступеней центриоли является очень значительным (p = 0,007). Это означает, что когда белки coiled-coil, которые впервые возникли у опистоконтов, удаляются, более старые белки, которые были связаны с центриоли этими белками coiled-coil, теряют свою «главную связь» с центриоли. Таким образом, количество ступеней между центриолью и этими белками увеличивается.
Эта фракция оставалась практически постоянной после удаления хордовых белков и белков, специфичных для животных. Однако, когда опистоконт-специфические белки были удалены, только 41% всех белков остался доступным в течение трех этапов. Мы выяснили значение этого, перетасовывая эволюционное происхождение белков 10 000 раз. Белки были разделены на пять бункеров в соответствии с их содержанием в виде спиральной спирали, и эволюционный возраст был перетасован в каждом из этих бункеров, чтобы контролировать возможные отклонения в обнаруженном возрасте белков.Действительно, мы обнаружили, что фактическое изменение доли белков в пределах трех ступеней центриоли является очень значительным (p = 0,007). Это означает, что когда белки coiled-coil, которые впервые возникли у опистоконтов, удаляются, более старые белки, которые были связаны с центриоли этими белками coiled-coil, теряют свою «главную связь» с центриоли. Таким образом, количество ступеней между центриолью и этими белками увеличивается.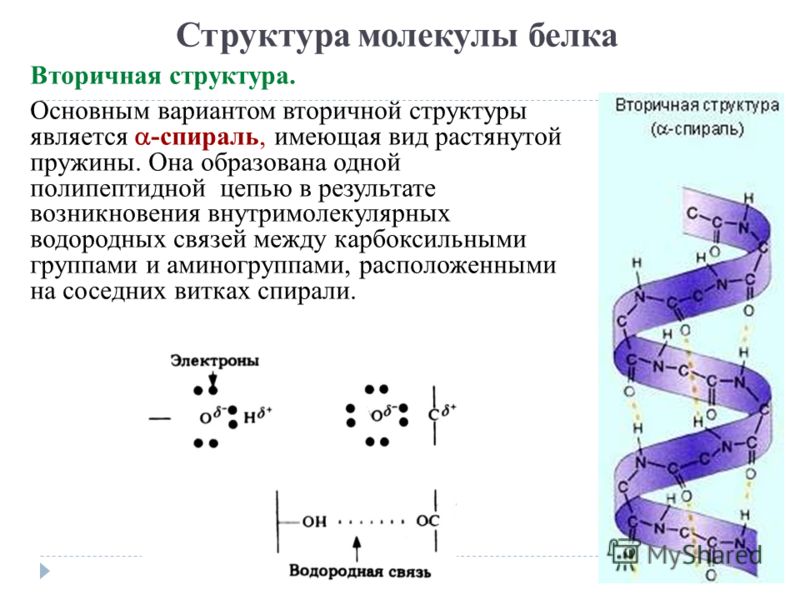 Никаких дальнейших изменений не наблюдалось, если рассматривать только белки, присутствующие в предке эукариот.Таким образом, структурные белки скелета, которые развились до или вскоре после последнего общего предка грибов и животных, имеют решающее значение для формирования сети взаимодействия центросомы. Фактически, ацентриолярные MTOCs в ооцитах мышей и мутантов Drosophila все еще содержат PCM coiled-coil белки, такие как PCNT и Cnn [39], [40]. Мы далее выделили эволюцию PCM по сравнению с уменьшенной сетью белков базального тельца, ресничек и центриолей (Fig. S6). Влияние удаления белков coiled-coil на сеть базального тела намного меньше, что согласуется с наблюдением, что PCM является более поздней разработкой.Мы оценили надежность модели, протестировав влияние удаления других категорий белков, и обнаружили, что белки типа coiled-coil уникальны по своему влиянию на сеть (см. Дополнительный текст и таблицу S5) и что изменения пороговых значений для STRING сеть и содержание витков не влияют на выводы (рис.
Никаких дальнейших изменений не наблюдалось, если рассматривать только белки, присутствующие в предке эукариот.Таким образом, структурные белки скелета, которые развились до или вскоре после последнего общего предка грибов и животных, имеют решающее значение для формирования сети взаимодействия центросомы. Фактически, ацентриолярные MTOCs в ооцитах мышей и мутантов Drosophila все еще содержат PCM coiled-coil белки, такие как PCNT и Cnn [39], [40]. Мы далее выделили эволюцию PCM по сравнению с уменьшенной сетью белков базального тельца, ресничек и центриолей (Fig. S6). Влияние удаления белков coiled-coil на сеть базального тела намного меньше, что согласуется с наблюдением, что PCM является более поздней разработкой.Мы оценили надежность модели, протестировав влияние удаления других категорий белков, и обнаружили, что белки типа coiled-coil уникальны по своему влиянию на сеть (см. Дополнительный текст и таблицу S5) и что изменения пороговых значений для STRING сеть и содержание витков не влияют на выводы (рис. S7).
S7).
Рис. 6. Белки каркаса, которые сначала встречаются у опистоконтов, привлекают другие белки к центросоме. a
Рассчитывается длина кратчайшего пути между центриолью (белки SASS6 и CENPJ) и каждым белком, проходя только через каркас и белки без категорий.Чтобы смоделировать топологические изменения этой сети на протяжении эволюции центросомы, новые белки итеративно удаляются. b Удаление опистоконт-специфических белков приводит к значительному увеличению длины кратчайшего пути. Для каждой длины кратчайшего пути мы показываем долю белков, которая может быть достигнута на этом расстоянии при итеративном удалении наиболее недавно образовавшихся белков. Заштрихованная область соответствует второму и третьему квартилю из 10000 рандомизаций.
https://doi.org/10.1371/journal.pcbi.1003657.g006
Надежность результатов
Выводы, представленные выше, основаны на точности предсказанного эволюционного возраста. Чтобы оценить чувствительность наших выводов об улучшенном методе выравнивания, мы повторили вышеупомянутый анализ с использованием стандартного BLAST. В то время как большинство результатов оставались качественно схожими, белки coiled-coil были предсказаны как более старые: с использованием нашей специальной процедуры выравнивания 44% белков coiled-coil были опистоконто-специфическими или моложе, по сравнению с 41% с BLAST (рис.S8a). Простое использование BLAST может переоценить гомологию между белками из-за высокого сходства последовательностей в областях спиральной спирали, что приводит к повышенной группировке удаленных белков в совместных семействах. При моделировании эволюции центросомы (Рис. S8b) изменение при удалении opisthokont-specific белков не было значительным (Suppl. Table S5), но удаление белков coiled-coil все еще оказывает сильнейшее влияние на сеть. Однако удаление преопистоконтовых белков (т.е. сохранение только универсальных белков) привело к значительному изменению (p = 0.029 для белков со спиральной спиралью и без категорий, по сравнению с p = 0,017 при использовании всех трех методов выравнивания).
В то время как большинство результатов оставались качественно схожими, белки coiled-coil были предсказаны как более старые: с использованием нашей специальной процедуры выравнивания 44% белков coiled-coil были опистоконто-специфическими или моложе, по сравнению с 41% с BLAST (рис.S8a). Простое использование BLAST может переоценить гомологию между белками из-за высокого сходства последовательностей в областях спиральной спирали, что приводит к повышенной группировке удаленных белков в совместных семействах. При моделировании эволюции центросомы (Рис. S8b) изменение при удалении opisthokont-specific белков не было значительным (Suppl. Table S5), но удаление белков coiled-coil все еще оказывает сильнейшее влияние на сеть. Однако удаление преопистоконтовых белков (т.е. сохранение только универсальных белков) привело к значительному изменению (p = 0.029 для белков со спиральной спиралью и без категорий, по сравнению с p = 0,017 при использовании всех трех методов выравнивания).
Наша работа показала, что белки coiled-coil на самом деле старше, чем считалось ранее. В крайнем случае, можно также предположить, что все белки спиральной спирали произошли от предка эукариотов. Чтобы еще больше подтвердить надежность наших результатов, мы провели дополнительные тесты, которые не зависят от эволюционного возраста белковых семейств: мы оценили важность узлов в сети по количеству кратчайших путей, которые проходят через узлы (текст S1, рис.S9 и Таблица S6). Этот тест зависит исключительно от топологии сети. Белки с наибольшим количеством проходящих через них кратчайших путей были обозначены как узкие места (отсечка: верхние 5% или 20 кратчайших путей). Нам пришлось контролировать влияние концентраторов, то есть белков с очень большим количеством партнеров по взаимодействию, которые с большей вероятностью будут участвовать в кратчайших путях (отсечка: верхние 5% или 39 ребер). Среди белков, которые не являются хабами, белки coiled-coil имеют наибольшее обогащение среди узких мест (P = 0.11, односторонний точный тест Фишера). Когда мы построили сеть, в которой ребра, ведущие к концентраторам, получают большее расстояние (то есть с меньшей вероятностью будут частью кратчайшего пути, см.
В крайнем случае, можно также предположить, что все белки спиральной спирали произошли от предка эукариотов. Чтобы еще больше подтвердить надежность наших результатов, мы провели дополнительные тесты, которые не зависят от эволюционного возраста белковых семейств: мы оценили важность узлов в сети по количеству кратчайших путей, которые проходят через узлы (текст S1, рис.S9 и Таблица S6). Этот тест зависит исключительно от топологии сети. Белки с наибольшим количеством проходящих через них кратчайших путей были обозначены как узкие места (отсечка: верхние 5% или 20 кратчайших путей). Нам пришлось контролировать влияние концентраторов, то есть белков с очень большим количеством партнеров по взаимодействию, которые с большей вероятностью будут участвовать в кратчайших путях (отсечка: верхние 5% или 39 ребер). Среди белков, которые не являются хабами, белки coiled-coil имеют наибольшее обогащение среди узких мест (P = 0.11, односторонний точный тест Фишера). Когда мы построили сеть, в которой ребра, ведущие к концентраторам, получают большее расстояние (то есть с меньшей вероятностью будут частью кратчайшего пути, см. Дополнительный текст), мы снова обнаружим, что белки со спиральной спиралью имеют самое большое количество узких мест (P = 0,03). Кроме того, мы оценили обоснованность эволюционных объяснений нашей модели в рамках, сформулированных Скривеном [41] (см. Текст S1 и рис. S10).
Дополнительный текст), мы снова обнаружим, что белки со спиральной спиралью имеют самое большое количество узких мест (P = 0,03). Кроме того, мы оценили обоснованность эволюционных объяснений нашей модели в рамках, сформулированных Скривеном [41] (см. Текст S1 и рис. S10).
Функциональное значение
На основании этих наблюдений мы разделили белки центросом на три класса (рис.7a) в соответствии с их изменением расстояния в сети после удаления белков, которые впервые встречаются у опистоконтов: ядерных белков (которые сохраняют расстояние до центриолей, например, AURKA, поло-подобных киназ и комплекса HAUS), периферических белков (расстояние между которыми увеличивается, например, CEP290, DISC1 и BBSome) и новые белки (которые впервые встречаются в белках опистоконтов, например PCNT, AKAP9 и PCM1). Хотя эта классификация является лишь приблизительным представлением порядка рекрутирования, мы обнаружили значительные функциональные различия при тестировании основных функций, выполняемых центросомой (рис. 7б). Универсальные функции, такие как клеточный цикл и деление, имеют значительно более высокую долю основных белков. Напротив, процессы, которые стали более важными для животных по сравнению с их одноклеточными предками, осуществляются меньшей долей ядерных белков. Напр., Сигнальные белки обогащаются (p = 0,07, используя точный критерий Фишера) на периферии, подчеркивая, что центросома становится все более важной в качестве сигнального узла при переходе к многоклеточности. Таким образом, центральная центросома отражает наследственные функции, связанные с отдельными клетками, тогда как новые белки и белки экспансии участвуют в новых функциях, связанных с многоклеточностью.Типичным представителем периферии является киназа GSK3B, член большого семейства сигнальных белков [42]. У S. pombe он участвует в цитокинезе и росте биполярных клеток [43], [44], в то время как у S. cerevisiae он участвует в стрессовой реакции [45]. Он участвует в дифференцировке клеток у Dictyostelium [23], [46].
7б). Универсальные функции, такие как клеточный цикл и деление, имеют значительно более высокую долю основных белков. Напротив, процессы, которые стали более важными для животных по сравнению с их одноклеточными предками, осуществляются меньшей долей ядерных белков. Напр., Сигнальные белки обогащаются (p = 0,07, используя точный критерий Фишера) на периферии, подчеркивая, что центросома становится все более важной в качестве сигнального узла при переходе к многоклеточности. Таким образом, центральная центросома отражает наследственные функции, связанные с отдельными клетками, тогда как новые белки и белки экспансии участвуют в новых функциях, связанных с многоклеточностью.Типичным представителем периферии является киназа GSK3B, член большого семейства сигнальных белков [42]. У S. pombe он участвует в цитокинезе и росте биполярных клеток [43], [44], в то время как у S. cerevisiae он участвует в стрессовой реакции [45]. Он участвует в дифференцировке клеток у Dictyostelium [23], [46].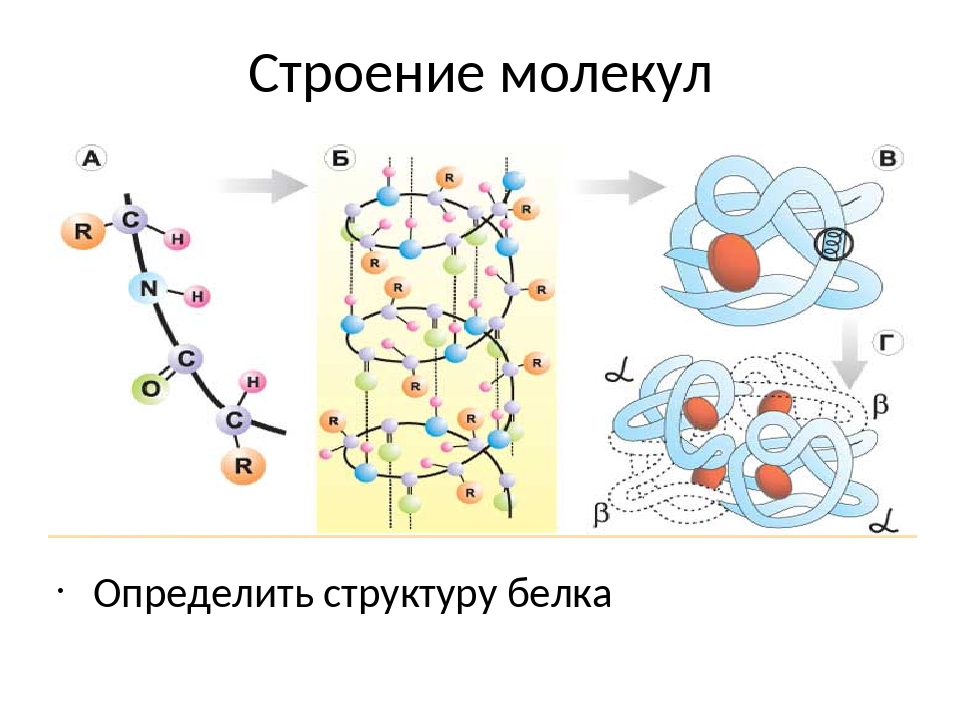 У животных белок локализуется в центросоме и принимает участие во многих процессах развития, например, в нервном развитии: он нацелен на центросомные белки, такие как девинин, и асимметричное наследование центросомы с материнской центриоли может быть механизмом регуляции дифференцировки нейронов [47 ].
У животных белок локализуется в центросоме и принимает участие во многих процессах развития, например, в нервном развитии: он нацелен на центросомные белки, такие как девинин, и асимметричное наследование центросомы с материнской центриоли может быть механизмом регуляции дифференцировки нейронов [47 ].
Рис. 7. Различия в наборе персонала соответствуют функциональным различиям. a
Когда новые белки удаляются из сети взаимодействия, белки, которые становятся более удаленными от центриолей, могут быть идентифицированы. b Пять терминов GO высокого уровня, соответствующих функциям центросомы, были протестированы на обогащение среди основных, новых или периферических белков. Основные белки, которые остаются на одном и том же расстоянии, больше участвуют в клеточном цикле и делении, чем в процессах, важных для животных, таких как развитие и передача сигналов.Пороговые значения уровней значимости (рассчитанные с помощью точного критерия Фишера): ** 0,01, * 0,05, • 0,1.
https://doi.org/10.1371/journal.pcbi.1003657.g007
Обсуждение
В этой работе мы расширили пространство известных гомологов центросомных белков по сравнению с предыдущими исследованиями, обнаружив, что белки, которые ранее считались ограниченными для животных, впервые появились на более раннем этапе эволюции. Тем не менее, быстрое расхождение белков coiled-coil приводит к пробелам в матрице гомологов (например,грамм. у нематод и насекомых, см. рис. 4). В будущем сравнительные структурные подходы могут позволить преодолеть эти пробелы, хотя высокопроизводительная экспрессия центросомных белков затруднена [48]. Хотя наши прогнозы показали, что многие центросомные белки со спиральной спиралью старше, чем считалось ранее, будущая разработка методов, а также структурные и функциональные анализы могут еще больше повысить оценки возраста этих белков. Однако, как показано выше, роль coiled-coil белков на эволюцию сети взаимодействия центросом также может быть продемонстрирована без предположений о возрасте белков.
Coiled-coil белки на центросоме давно признаны частью «центроматрицы» или центросомного матрикса [49] — [52]. В самом деле, многие предыдущие исследования показали, что центросомные белки coiled-coil функционируют как каркасы для рекрутирования др. Белков (Table S1). Это общая тенденция: в «Онтологии генов» 44 белка человека аннотированы как каркасы белкового комплекса, 12 из которых имеют спиральные секции. Эта фракция в 27% является значительным обогащением по сравнению с фоновой скоростью белков спиральной спирали, которая составляет 12% от всех белков человека (p-значение: 0.005 с использованием одностороннего точного теста Фишера). Следовательно, белки с высокой долей остатков в спиральных спиралях с большей вероятностью будут каркасными белками, чем белки без остатков спиральной спирали. Здесь мы смогли показать, что многие центросомные белки coiled-coil действительно действуют как каркасные белки, обеспечивая механизм для более ранних наблюдений. Например, на основе анализа только пяти видов животных и нецентросомных почкующихся дрожжей как чужой группы, Nido et al. наблюдали увеличение содержания coiled-coil и нарушение в центросомных белках по отношению к млекопитающим [53].Они связали это увеличение содержания coiled-coil со способностью этих белков изменять свои физические свойства при посттрансляционной модификации. В соответствии с этими находками мы обнаружили повышенную долю остатков в неупорядоченных областях для opisthokont-специфических белков. При сравнении ядер ядра и периферических белков (рис. 7a) мы не обнаружили изменений в беспорядке для белков coiled-coil. Однако доля остатков в неупорядоченных областях увеличивается в ядре для регуляторных белков (p-значение 0.054, двусторонний тест Колмогорова-Смирнова) и для неклассифицированных белков (p-значение 0,01), но не для других функциональных категорий. В целом центросомные белки имеют более высокое содержание нарушений, чем нецентросомные белки [53]. Дальнейшее разделение между центросомными белками, которое мы наблюдаем, согласуется с нашим выводом о том, что белки со спиральной спиралью способствовали эволюции центросомы, действуя как каркас, который привлекает древние белки для новых функций: периферические белки, возможно, были задействованы в центросоме совсем недавно, и таким образом, по своему содержанию нарушений более схожи с нецентросомными белками.
наблюдали увеличение содержания coiled-coil и нарушение в центросомных белках по отношению к млекопитающим [53].Они связали это увеличение содержания coiled-coil со способностью этих белков изменять свои физические свойства при посттрансляционной модификации. В соответствии с этими находками мы обнаружили повышенную долю остатков в неупорядоченных областях для opisthokont-специфических белков. При сравнении ядер ядра и периферических белков (рис. 7a) мы не обнаружили изменений в беспорядке для белков coiled-coil. Однако доля остатков в неупорядоченных областях увеличивается в ядре для регуляторных белков (p-значение 0.054, двусторонний тест Колмогорова-Смирнова) и для неклассифицированных белков (p-значение 0,01), но не для других функциональных категорий. В целом центросомные белки имеют более высокое содержание нарушений, чем нецентросомные белки [53]. Дальнейшее разделение между центросомными белками, которое мы наблюдаем, согласуется с нашим выводом о том, что белки со спиральной спиралью способствовали эволюции центросомы, действуя как каркас, который привлекает древние белки для новых функций: периферические белки, возможно, были задействованы в центросоме совсем недавно, и таким образом, по своему содержанию нарушений более схожи с нецентросомными белками.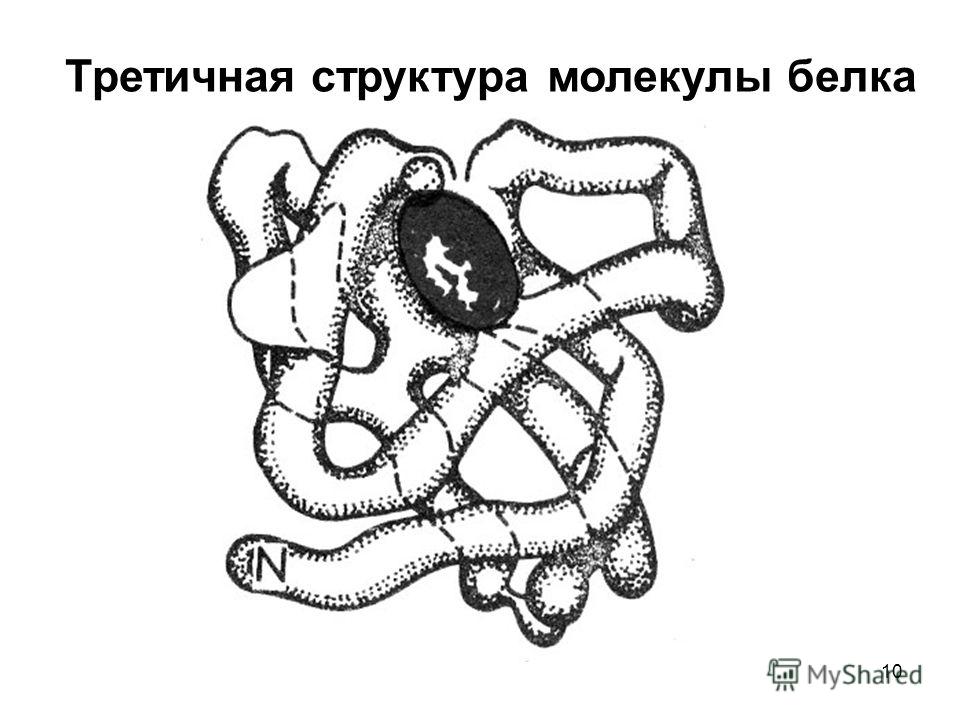
Нам удалось количественно оценить влияние каркасов на эволюцию центросомы из-за ее организации: у нее есть небольшое белковое ядро (центриоль), которое используется клеткой для контроля количества и локализации центросом. Другие органеллы, не связанные с мембраной, рекрутируются ДНК (например, кинетохоры и ядрышки) или не контролируются по количеству (например, гранулы P). В случае мембранных органелл мембраны обеспечивают большие поверхности для организации белковых комплексов.Таким образом, в этих органеллах могли действовать дополнительные способы рекрутирования белков. Тем не менее, мы обнаружили, что белки coiled-coil также значительно более новые, чем другие белки в случае кинетохор и аппарата Гольджи (Fig. S11). Таким образом, рекрутирование молекулярных функций посредством каркасов coiled-coil может не ограничиваться центросомами.
Методы
Уточненное выравнивание белков спиральной спирали
Есть три элемента, которые отличают наш подход от предыдущих алгоритмов: (1) Матрицы подсчета очков корректируются с учетом аминокислотного состава спиральных катушек. (2) Взвешивают оценки с разных позиций гептадного повтора. (3) Правильное выравнивание гептадного повтора между выровненными белками вознаграждается (только для второго алгоритма).
(2) Взвешивают оценки с разных позиций гептадного повтора. (3) Правильное выравнивание гептадного повтора между выровненными белками вознаграждается (только для второго алгоритма).
В первом алгоритме («CCAlign») белки делятся на секции coiled-coil и non-coiled-coil. Последовательности этих двух классов сцепляются отдельно, давая две искусственные последовательности на белок. Чтобы выровнять пару белков, матрицы замещения с корректировкой по составу рассчитываются для пары секций со спиральной спиралью, для пары секций без спиральной спирали и для полных белков.В расчетах используется алгоритм настройки матрицы BLAST, доступный в модифицированной версии, которая не выполняет выравнивания, а только вычисляет и возвращает скорректированную матрицу (рис. 8). Для согласования мы используем модифицированный алгоритм Смита-Ватермана-Гото [54], [55], основанный на реализации JAligner с открытым исходным кодом. При выравнивании двух белков по Смиту-Уотерману учитываются все возможные пары остатков.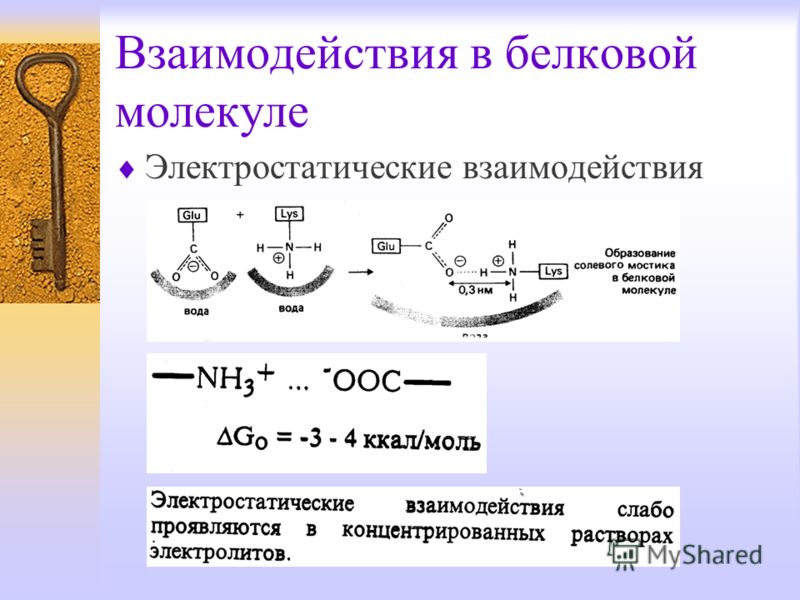 В традиционных алгоритмах для всех пар остатков используется одна и та же матрица подстановки (например, BLOSUM62).Для этого алгоритма матрица замещения выбирается в соответствии со статусом рассматриваемой пары остатков: матрица замещения спиральной катушки используется, когда оба остатка находятся в спиральной катушке. Матрица без спиральной катушки используется, если в спиральной катушке нет остатков. В смешанном случае используется матрица замещения на основе полноразмерных белков.
В традиционных алгоритмах для всех пар остатков используется одна и та же матрица подстановки (например, BLOSUM62).Для этого алгоритма матрица замещения выбирается в соответствии со статусом рассматриваемой пары остатков: матрица замещения спиральной катушки используется, когда оба остатка находятся в спиральной катушке. Матрица без спиральной катушки используется, если в спиральной катушке нет остатков. В смешанном случае используется матрица замещения на основе полноразмерных белков.
Рисунок 8. Настройка матрицы подстановки.
Матрицы замен были созданы для выравнивания человеческого белка CDK5RAP2 с его гомологом мух cnn.Показана разница между соответствующей матрицей и скорректированной матрицей для целых белков. Эту эталонную матрицу BLAST использует для выравнивания этих двух белков. Когда разница больше нуля (синий цвет), то в рассматриваемой части белка две аминокислоты встречаются реже. Например, известно, что пролин разрушает спирали и, следовательно, также спиральные спирали, поэтому показатели пролина в матрице спиральной спирали выше. В матрице замещения для гидрофобного интерфейса (регистры A / D) гидрофобные остатки встречаются чаще, что приводит к более низким оценкам.
В матрице замещения для гидрофобного интерфейса (регистры A / D) гидрофобные остатки встречаются чаще, что приводит к более низким оценкам.
https://doi.org/10.1371/journal.pcbi.1003657.g008
Интуитивно понятно, что регистры гептадного повтора должны содержать различные количества филогенетического сигнала, т.е. быть более или менее информативными в отношении потенциальной гомологии двух белков. . Чтобы оценить это, мы извлекли остатки спиральной спирали из базы данных Blocks [56], набора высококонсервативных последовательностей, которые использовались для создания матриц замен BLOSUM. Мы получили суббазы данных, которые соответствуют либо отдельным регистрам гептадного повтора, либо группам регистров.Используя энтропию матриц замещения в качестве заместителя для филогенетического сигнала, мы наблюдаем, что гидрофобные интерфейсные остатки более информативны (энтропия 0,45), чем промежуточные остатки (0,32) и гидрофильные внешние (0,28). Однако все положения гептадного повтора менее информативны, чем фон (BLOSUM62, 0,70). Мы протестировали различные схемы взвешивания для филогенетического сигнала, специфичного для регистра, с двумя степенями свободы: (1) Энтропии могут быть рассчитаны для групп регистров (a / d, e / g, b / c / f) или для отдельных регистров.(2) Энтропии могут быть нормированы энтропией BLOSUM62 или средней энтропией спиральной спирали. Из этих схем нормализация групповых энтропий с помощью медианной энтропии оказалась наиболее успешной в тестовой схеме (см. Ниже). Математически алгоритм определения баллов для пары остатков из последовательностей белков можно описать следующим образом: для второго алгоритма («CCAlignX») остатки спиральной спирали далее подразделяются по их положению в гептадном повторе: гидрофобный интерфейс (а, г), гидрофильный внешний (б, в, е) и промежуточные остатки (д, ж).На основе этих групп вычисляются дополнительные матрицы замещения. Когда два остатка витых катушек рассматриваются для выравнивания, используется матрица, соответствующая регистру более надежного предсказания MultiCoil2.
Мы протестировали различные схемы взвешивания для филогенетического сигнала, специфичного для регистра, с двумя степенями свободы: (1) Энтропии могут быть рассчитаны для групп регистров (a / d, e / g, b / c / f) или для отдельных регистров.(2) Энтропии могут быть нормированы энтропией BLOSUM62 или средней энтропией спиральной спирали. Из этих схем нормализация групповых энтропий с помощью медианной энтропии оказалась наиболее успешной в тестовой схеме (см. Ниже). Математически алгоритм определения баллов для пары остатков из последовательностей белков можно описать следующим образом: для второго алгоритма («CCAlignX») остатки спиральной спирали далее подразделяются по их положению в гептадном повторе: гидрофобный интерфейс (а, г), гидрофильный внешний (б, в, е) и промежуточные остатки (д, ж).На основе этих групп вычисляются дополнительные матрицы замещения. Когда два остатка витых катушек рассматриваются для выравнивания, используется матрица, соответствующая регистру более надежного предсказания MultiCoil2. Для этого алгоритма сравнительный анализ показывает, что добавление другого механизма оценки дает лучшие результаты: когда предсказанные регистры спиральной спирали перекрываются, рассматриваемой паре остатков присуждается дополнительная бонусная оценка. Подход к разделению белков на области с различными эволюционными ограничениями может быть применимо к другим классам белков, которые содержат области с различным эволюционным давлением и различным аминокислотным составом, например трансмембранные белки.Программное обеспечение, реализующее упомянутые выше алгоритмы, доступно на https://bitbucket.org/mkuhn/blast-matrix и https://bitbucket.org/mkuhn/ccalign.
Для этого алгоритма сравнительный анализ показывает, что добавление другого механизма оценки дает лучшие результаты: когда предсказанные регистры спиральной спирали перекрываются, рассматриваемой паре остатков присуждается дополнительная бонусная оценка. Подход к разделению белков на области с различными эволюционными ограничениями может быть применимо к другим классам белков, которые содержат области с различным эволюционным давлением и различным аминокислотным составом, например трансмембранные белки.Программное обеспечение, реализующее упомянутые выше алгоритмы, доступно на https://bitbucket.org/mkuhn/blast-matrix и https://bitbucket.org/mkuhn/ccalign.
Предсказание ортологов
геномов было собрано путем расширения эукариотических геномов в базе данных STRING 9 [35] с рядом других геномов, в результате чего получилось 108 геномов (см. Рис. S12 для филогенетического дерева [57], [58]). Для геномов интересующих нематод, где были доступны только нуклеотидные последовательности, гены были предсказаны с помощью Maker [59]. Если прогнозировалось, что в геноме будет более 50 000 генов, гены были сопоставлены с базой данных UniProt (с использованием набора данных UniRef90 для многоклеточных животных). Затем все гены были отсортированы по количеству битов, которые были наиболее популярны. Гены сохранялись, если они входили в число 50 000 лучших или имели битовый результат более 50.
Если прогнозировалось, что в геноме будет более 50 000 генов, гены были сопоставлены с базой данных UniProt (с использованием набора данных UniRef90 для многоклеточных животных). Затем все гены были отсортированы по количеству битов, которые были наиболее популярны. Гены сохранялись, если они входили в число 50 000 лучших или имели битовый результат более 50.
Выравнивание белков «все против всех» выполняли в несколько этапов: во-первых, выравнивание по Смиту-Уотерману с оптимизацией скорости вычислялось с использованием ParAlign [60]. Затем удары с первого шага были повторно выровнены с использованием алгоритмов выравнивания с учетом спиральной катушки.(Для белков без спиральной спирали этот этап добавляет корректировку состава матрицы.) В качестве оптимизации путем повторного выравнивания были определены только 50 лучших совпадений каждого белка в каждом другом виде. В дополнение к выравниванию с учетом спиральной катушки, полное выравнивание «все против всех» было выполнено с помощью BLAST.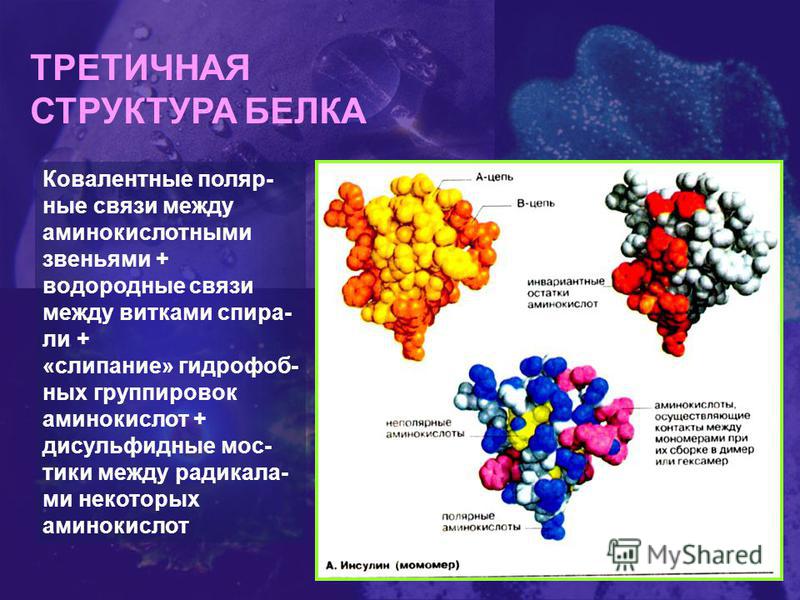 Таким образом, были рассчитаны три набора выравниваний: CCAlign, CCAlignX и BLAST. Для каждого набора группы гомологичных белков предсказываются с помощью конвейера eggNOG [23].
Таким образом, были рассчитаны три набора выравниваний: CCAlign, CCAlignX и BLAST. Для каждого набора группы гомологичных белков предсказываются с помощью конвейера eggNOG [23].
Чтобы отслеживать общее происхождение с большей чувствительностью, мы модифицировали конвейер eggNOG, чтобы обеспечить большее слияние похожих групп на последних этапах конвейера: конвейер eggNOG сначала ищет треугольники белков в разных видах, которые являются взаимно лучшими совпадениями ( RBH) друг от друга и добавляет другие RBH в эти исходные группы.Затем, с помощью нескольких итераций, ортологические группы объединяются (когда у них много RBHs между собой) и разделяются (когда набор белков становится слишком разнообразным). Мы добавили последний шаг, который использовал диагностические выходные данные последнего шага слияния, а именно набор пар OG и их оценку слияния. Применение порогового значения для оценки позволило получить отфильтрованный набор пар OG. Когда два OG содержали перекрывающиеся наборы видов (и, следовательно, белки, которые могут быть паралогичными), мы использовали более строгий порог, чтобы избежать слияния паралогов.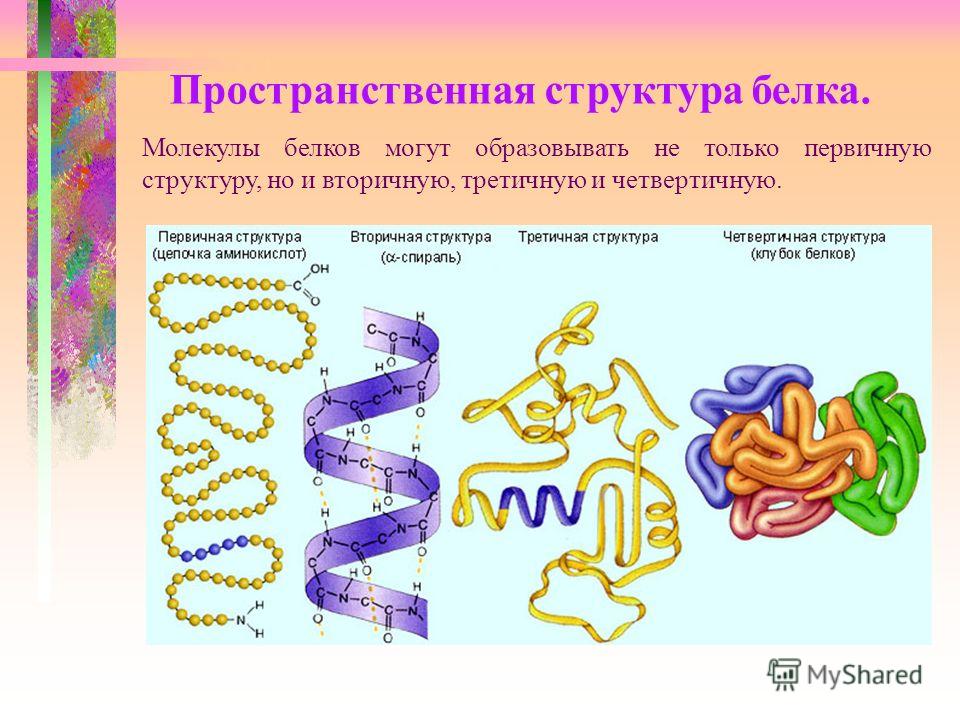 Затем отфильтрованный набор пар OG был преобразован в график. Затем в порядке убывания оценок подключенные OG были объединены в кластеры. В качестве меры предосторожности, чтобы избежать неопределенного роста кластеров, мы наложили ограничение на диаметр кластера: для каждой пары OG в кластере максимально допустимое расстояние составляет четыре ребра (т.е. между ними может быть до трех OG). С помощью этих модификаций мы можем обнаружить более далекие гомологи даже в случае большего расхождения последовательностей.
Затем отфильтрованный набор пар OG был преобразован в график. Затем в порядке убывания оценок подключенные OG были объединены в кластеры. В качестве меры предосторожности, чтобы избежать неопределенного роста кластеров, мы наложили ограничение на диаметр кластера: для каждой пары OG в кластере максимально допустимое расстояние составляет четыре ребра (т.е. между ними может быть до трех OG). С помощью этих модификаций мы можем обнаружить более далекие гомологи даже в случае большего расхождения последовательностей.
Как видно на рис.3 ортологичные группы соединяют белки через промежуточные белки. В исходном конвейере eggNOG проверяются положения выравнивания, чтобы избежать соединения негомологичных белков через общие домены [61]. На последнем этапе слияния, который мы добавили, строгое ограничение для предотвращения слияния паралогов также служит предосторожностью от таких ложных срабатываний. При ручной проверке выравниваний, в том числе для HAUS7 / 8 (рис. 3), мы всегда находили общие консервативные области у всех ортологов, за исключением случаев, когда дополнительные усеченные копии белка встречались у определенных видов вместе с полноразмерным белком.
Чтобы уменьшить количество ложных срабатываний, прогнозы BLAST, CCAlign и CCAlignX были затем объединены с использованием схемы голосования: если хотя бы два из трех методов согласны с тем, что два белка гомологичны, то они принимаются как гомологи в комбинированном прогнозе (рис. S13a). Однако в некоторых случаях отдельные белки вызывали ложные связи между неродственными группами гомологичных белков (рис. S13b). Чтобы избежать этих связей, мы определили центральность промежуточности белков для всех групп гомологов (используя пакет NetworkX для Python).Белки, которые генерируют ложные связи, имеют высокую промежуточную центральность, поскольку через них проходит множество кратчайших путей между другими белками. Эти белки предварительно удалены из объединенных групп гомологов. Если связь, опосредованная этими белками, была ложной, то группа гомологов распадается на подгруппы. Если ссылка действительна, то она будет подкреплена другими ссылками, и группа не распадется. Вновь сформированные подгруппы по очереди проверяются на наличие ложных ссылок.
Аннотация белков
Известные белки центросом были извлечены из различных источников: аннотаций Gene Ontology (GO) [62], базы данных MiCroKit [63] и протеомного скрининга у млекопитающих, Giardia lambia и Chlamydomonas reinhardtii [64] — [68] ].Белки были распределены по категориям на основе их GO-аннотации, доменов InterPro [69], номеров комиссии по ферментам [70] и ограниченного ручного аннотирования. Моторы назначаются на основе доменов InterPro (динеин, кинезин, миозин). Аннотации GO используются для этих классов: киназы (активность протеинкиназы , ), фосфатазы (активность фосфопротеинфосфатазы , активность ), цитоскелетные белки ( структурный компонент цитоскелета ), каркасы (каркас белкового комплекса ), регуляторы (регуляция ). сигнальной трансдукции , регуляции процесса модификации белка ) и факторов транскрипции ( последовательность-специфическая активность ДНК-связывающего фактора транскрипции ). Поскольку известно, что только семь факторов транскрипции локализуются в центросоме, мы добавили их к регуляторным белкам. Белки, которым присвоен номер комиссии по ферментам, относятся к ферментам. Наконец, белки, содержащие не менее 20% остатков спиральной спирали, также относятся к каркасу. Тридцать пять процентов белков центросом не подпадают ни под одну из этих категорий и обозначаются как «другие» белки. Порядок в этом абзаце отражает приоритет назначения функций, напримерROCK1 (киназа с доменом coiled-coil) аннотирована как киназа, а не каркас.
Поскольку известно, что только семь факторов транскрипции локализуются в центросоме, мы добавили их к регуляторным белкам. Белки, которым присвоен номер комиссии по ферментам, относятся к ферментам. Наконец, белки, содержащие не менее 20% остатков спиральной спирали, также относятся к каркасу. Тридцать пять процентов белков центросом не подпадают ни под одну из этих категорий и обозначаются как «другие» белки. Порядок в этом абзаце отражает приоритет назначения функций, напримерROCK1 (киназа с доменом coiled-coil) аннотирована как киназа, а не каркас.
Сетевой анализ
Сеть взаимодействия белков была извлечена из базы данных STRING 9 с использованием порогового значения достоверности 0,5. Были включены только каналы «эксперименты» и «анализ текста». В частности, края из канала «базы данных» не были включены, поскольку некоторые вручную аннотированные базы данных путей содержат центросому как один очень большой (неструктурированный) комплекс, что нежелательно для настоящего анализа.
Чтобы найти следы экспансии центросомы и ее развития в сигнальный узел, мы более подробно проанализировали роль каркасных белков и их взаимодействия с регуляторными белками. Только подмножество взаимодействий в сети принадлежит структурной основе. Например, белковые взаимодействия с участием киназ, фосфатаз и регуляторных белков, вероятно, будут временными взаимодействиями, тогда как взаимодействия, опосредованные каркасом и некатегоризованными белками, более вероятно, будут постоянными физическими взаимодействиями с более высокой специфичностью.Это также отражается количеством партнеров по взаимодействию: каркасы и некатегоризованные белки имеют меньше партнеров по взаимодействию, чем другие классы белков (Fig. S9). Чтобы зафиксировать большинство постоянных взаимодействий, мы обозначаем каркасы и неклассифицированные белки как структурную основу PCM.
Чтобы определить кратчайшие пути в сети взаимодействия белков, каркасные и некатегоризованные белки были использованы в качестве узловых звеньев.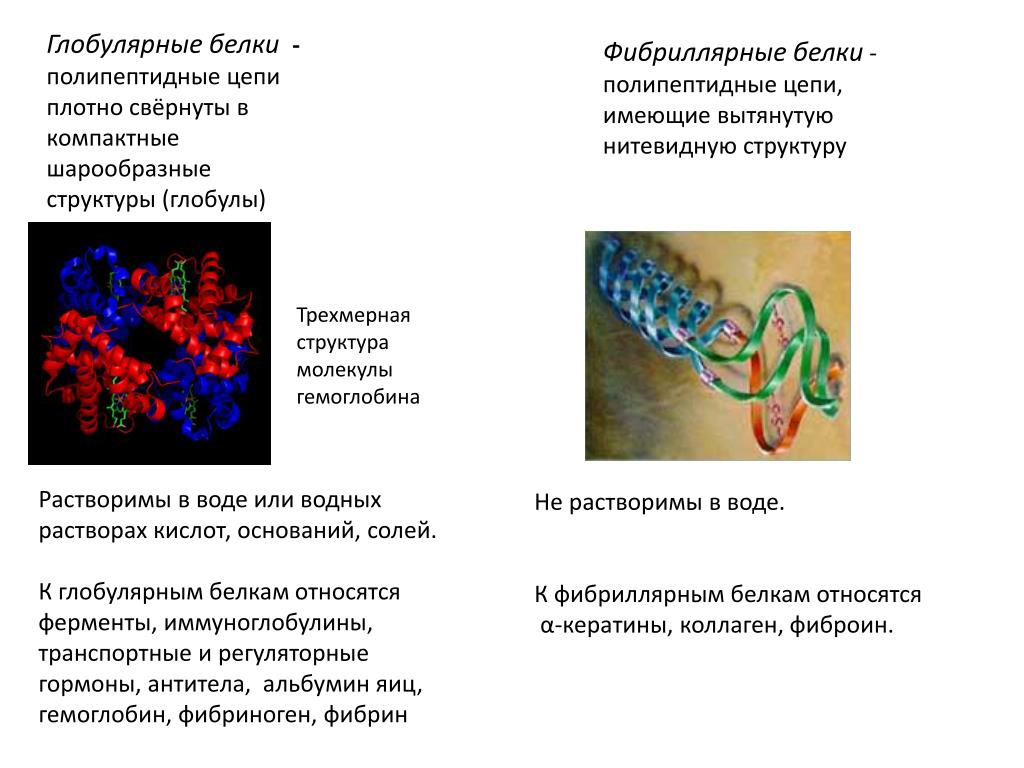 Вычислительно сеть была представлена в виде ориентированного графа с направленными ребрами, выходящими из узлов магистрали.Таким образом, неосновные белки, такие как киназы, являются стоками, то есть имеют только входящие края. Затем использовался пакет NetworkX для Python.
Вычислительно сеть была представлена в виде ориентированного графа с направленными ребрами, выходящими из узлов магистрали.Таким образом, неосновные белки, такие как киназы, являются стоками, то есть имеют только входящие края. Затем использовался пакет NetworkX для Python.
Анализ неупорядоченных остатков
Мы использовали DISOPRED2 [71] для предсказания неупорядоченных областей. Когда предсказывалось, что остаток находится как в домене спиральной спирали, так и в неупорядоченной области, мы рассматривали остаток как неупорядоченный.
Дополнительная информация
Рисунок S2.
Результаты бенчмаркинга. Для нескольких комбинаций параметров вычисляется доля правильно предсказанных гомологичных белков. Эта фракция сравнивается с эталонной фракцией с использованием только матрицы BLOSUM62 с использованием биномиального теста. В кружке: используемые фактические комбинации параметров (слева: CCAlignX, справа: CCAlign). SW-BLAST: ВЗРЫВ с использованием алгоритма Смита-Уотермана.
https://doi.org/10.1371/journal.pcbi.1003657.s002
(PDF)
Рисунок S4.
Функции центросомных белков. Доля семейств белков человека, аннотированных для различных процессов, показана для белков, специфичных для центросом, по сравнению с белками любой локализации. Мы исследовали роль центросом в четырех важных для организма животных функциях: развитие многоклеточного организма, клеточный ответ на раздражитель, клеточный цикл и подвижность клеток. Центросома очень важна для этих функций: по сравнению с белками любой локализации значительно большая часть центросомных белков участвует в этих функциях.Семейства белков дометазоа более важны для развития многоклеточного организма, чем семейства белков метазоа. То же верно и для клеточного ответа на стимул, и для подвижности клеток.
https://doi.org/10.1371/journal.pcbi.1003657.s004
(PDF)
Рисунок S6.
Эволюция центросомы по сравнению с базальным телом и эволюция ПКМ. Для сети базального тела мы объединили белки центриоли, реснички и базального тела. Чтобы изучить эволюцию PCM, мы выполнили процедуру эмуляции для всей центросомы, но рассмотрели только кратчайшие пути белков, которые не являются частью сети базального тела.Для каждой длины кратчайшего пути мы показываем долю белков, которая может быть достигнута на этом расстоянии при итеративном удалении наиболее недавно образовавшихся белков. Заштрихованная область соответствует второму и третьему квартилю из 10 000 рандомизаций, где справа показаны значения p для длины пути в три шага.
Для сети базального тела мы объединили белки центриоли, реснички и базального тела. Чтобы изучить эволюцию PCM, мы выполнили процедуру эмуляции для всей центросомы, но рассмотрели только кратчайшие пути белков, которые не являются частью сети базального тела.Для каждой длины кратчайшего пути мы показываем долю белков, которая может быть достигнута на этом расстоянии при итеративном удалении наиболее недавно образовавшихся белков. Заштрихованная область соответствует второму и третьему квартилю из 10 000 рандомизаций, где справа показаны значения p для длины пути в три шага.
https://doi.org/10.1371/journal.pcbi.1003657.s006
(PDF)
Рисунок S7.
Исследование различных сетей взаимодействия белков. P-значения для эффекта удаления белков показаны для различных сетей STRING, значений отсечки и пороговых значений спиральной спирали. Когда используются все каналы из STRING, более высокие значения отсечки приводят к сети, в которой преобладают доказательства из базы данных, что имеет тенденцию группировать центросомы в один большой комплекс. Используя комбинированные экспериментальные каналы и каналы интеллектуального анализа текста, значение p для удаления опистоконто-специфичных каркасов и некатегоризованных белков ниже 0,05 во всех случаях, кроме двух. Сеть, предназначенная только для экспериментов, более разреженная и не показывает значительных эффектов.Изменение минимальной доли остатков спиральной спирали при обозначении белков как каркасов не влияет на результаты.
Используя комбинированные экспериментальные каналы и каналы интеллектуального анализа текста, значение p для удаления опистоконто-специфичных каркасов и некатегоризованных белков ниже 0,05 во всех случаях, кроме двух. Сеть, предназначенная только для экспериментов, более разреженная и не показывает значительных эффектов.Изменение минимальной доли остатков спиральной спирали при обозначении белков как каркасов не влияет на результаты.
https://doi.org/10.1371/journal.pcbi.1003657.s007
(PDF)
Рисунок S8.
Использование только BLAST в качестве метода выравнивания. (a) Использование только BLAST для оценки возраста семейств белков приводит к тому, что белки coiled-coil кажутся старше (41% опистоконта-специфичных для BLAST против 44% для комбинации всех трех методов выравнивания).(b) Как следствие, только удаление белков, которые развились после последнего предка эукариотов, приводит к значительному изменению (на длине пути 3), хотя тенденции аналогичны (см. также дополнительную таблицу S5).
также дополнительную таблицу S5).
https://doi.org/10.1371/journal.pcbi.1003657.s008
(PDF)
Рисунок S9.
Анализ кратчайших путей. Для всей сети количество кратчайших путей, проходящих через узел, отображается в зависимости от степени (количества соединений) узла.Верхние 5% узлов по степени являются концентраторами, верхние 5% узлов по количеству кратчайших путей являются узкими местами. Когда несколько узлов имеют одинаковые значения, добавляется небольшое случайное смещение, чтобы уменьшить чрезмерное нанесение на график.
https://doi.org/10.1371/journal.pcbi.1003657.s009
(PDF)
Рисунок S10.
Количество взаимодействий на белок. Степень присутствия белков в сети взаимодействия белков центросомы человека показана как функция эволюционного возраста. Вверху: белки делятся на те, которые присутствовали у предка эукариотов, и на те, которые развились позже.P-значения были вычислены с помощью теста перестановки (пакет R «ExactRankTests»). Внизу: показаны все рассматриваемые клады, а также количество белков, впервые появившихся в этой кладе.
Внизу: показаны все рассматриваемые клады, а также количество белков, впервые появившихся в этой кладе.
https://doi.org/10.1371/journal.pcbi.1003657.s010
(PDF)
Таблица S3.
Центросомные белки у модельных видов. Идентификаторы гомологичных белков приведены для видов Homo sapiens, Caenorhabditis elegans, Drosophila melanogaster, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Dictyostelium discoideum, Giardia Кишечник и Arabidopsis thaliana .
https://doi.org/10.1371/journal.pcbi.1003657.s016
(XLSX)
Прогнозирование на основе данных и проектирование взаимодействий bZIP Coiled-Coil
Тестирование
Для тестирования методов прогнозирования мы взяли экспериментальные данные о взаимодействии bZIP Reinke et al. и разработали два теста прогнозирования. В одном из них мы сравнили экспериментально определенные значения K d для взаимодействий с 1 нМ  Мы сообщаем коэффициент корреляции Пирсона R для этого теста.С другой стороны, мы разделили данные на сильные взаимодействия (K d <250 нМ) и слабые / невзаимодействия (K d ≥ 5000 нМ) и измерили площадь под кривой для рабочей характеристики приемника (ROC ) кривая, показывающая способность каждого метода классифицировать пары bZIP в нужную категорию. Чтобы определить наилучшую производительность, которую мы могли ожидать от вычислительной модели в тесте корреляции, мы исследовали корреляцию между экспериментальными значениями K d , измеренными в дублирующих или очень похожих экспериментах в экспериментальной работе (см. Методы).Это дало R = 0,82–0,86, в зависимости от теста, что согласуется с ошибкой, оцененной в исходном отчете [18]. Мы считаем это максимально достижимой точностью прогноза для любого вычислительного метода в этом тесте.
Мы сообщаем коэффициент корреляции Пирсона R для этого теста.С другой стороны, мы разделили данные на сильные взаимодействия (K d <250 нМ) и слабые / невзаимодействия (K d ≥ 5000 нМ) и измерили площадь под кривой для рабочей характеристики приемника (ROC ) кривая, показывающая способность каждого метода классифицировать пары bZIP в нужную категорию. Чтобы определить наилучшую производительность, которую мы могли ожидать от вычислительной модели в тесте корреляции, мы исследовали корреляцию между экспериментальными значениями K d , измеренными в дублирующих или очень похожих экспериментах в экспериментальной работе (см. Методы).Это дало R = 0,82–0,86, в зависимости от теста, что согласуется с ошибкой, оцененной в исходном отчете [18]. Мы считаем это максимально достижимой точностью прогноза для любого вычислительного метода в этом тесте.
Мы протестировали четыре опубликованных вычислительных метода, разработанных для прогнозирования стабильности димера параллельной спиральной катушки (таблица 1). Модели, которые мы называем Vinson / CE [5,6,16], Fong / SVM [14] и bCIPA [15], принимают выровненные пары белковых последовательностей в качестве входных данных и не требуют моделирования белковых структур.Все три модели используют энергии связи, описывающие a i — a ‘ i и g i — e ‘ i + 1 взаимодействия, измеренные для остатков в системе модели спиральной спирали Винсоном и его коллегами (здесь нижний индекс представляет индекс гептады, а штрих указывает положение на противоположной спирали), а некоторые используют более обширные экспериментальные данные о взаимодействиях спиральной спирали.Таким образом, мы называем эти методы предикторами, основанными на данных [5,6]. Модель HP / S / C — это гибридная модель, в которой используются экспериментальные энергии связи Винсона в сочетании со структурным моделированием других взаимодействий остаток-остаток [16].
Модели, которые мы называем Vinson / CE [5,6,16], Fong / SVM [14] и bCIPA [15], принимают выровненные пары белковых последовательностей в качестве входных данных и не требуют моделирования белковых структур.Все три модели используют энергии связи, описывающие a i — a ‘ i и g i — e ‘ i + 1 взаимодействия, измеренные для остатков в системе модели спиральной спирали Винсоном и его коллегами (здесь нижний индекс представляет индекс гептады, а штрих указывает положение на противоположной спирали), а некоторые используют более обширные экспериментальные данные о взаимодействиях спиральной спирали.Таким образом, мы называем эти методы предикторами, основанными на данных [5,6]. Модель HP / S / C — это гибридная модель, в которой используются экспериментальные энергии связи Винсона в сочетании со структурным моделированием других взаимодействий остаток-остаток [16]. Мы также протестировали две функции оценки общего назначения, которые не были разработаны специально для спиральных катушек, но могут применяться для оценки смоделированных структур спиральных катушек: dDFIRE [19] и Rosetta [20]. Мы создали модели для каждого комплекса с помощью Rosetta, как описано в разделе «Методы».Есть много способов подсчета очков с помощью Rosetta, и, хотя мы не смогли опробовать все возможные протоколы, мы протестировали множество методов и сообщаем здесь о лучших полученных результатах.
Мы также протестировали две функции оценки общего назначения, которые не были разработаны специально для спиральных катушек, но могут применяться для оценки смоделированных структур спиральных катушек: dDFIRE [19] и Rosetta [20]. Мы создали модели для каждого комплекса с помощью Rosetta, как описано в разделе «Методы».Есть много способов подсчета очков с помощью Rosetta, и, хотя мы не смогли опробовать все возможные протоколы, мы протестировали множество методов и сообщаем здесь о лучших полученных результатах.
Из наших сравнительных исследований стало ясно, что модели, полученные на основе данных, которые включают экспериментальные знания о взаимодействиях типа «спираль-спираль», не включенные в Reinke et al. данные превзошли модели, основанные на структуре (Таблица 1). Машина опорных векторов, разработанная Фонгом и др. был одним из самых успешных предикторов как с точки зрения линейной корреляции (R = 0.47) и площадь под кривой (AUC = 0,83) для бинарной классификации сильного связывания / отсутствия связывания. Все модели, полученные на основе данных, включая Fong / SVM, в значительной степени полагаются на экспериментальные данные об энергии связи. Фактически, модель Винсона / СЕ, которая представляет собой простую сумму экспериментальных энергий связи, дополненных одним эмпирическим членом, обеспечивает впечатляющее различение высокоаффинных спиральных спиралей от невзаимодействующих пар белков (AUC = 0,86).
Все модели, полученные на основе данных, включая Fong / SVM, в значительной степени полагаются на экспериментальные данные об энергии связи. Фактически, модель Винсона / СЕ, которая представляет собой простую сумму экспериментальных энергий связи, дополненных одним эмпирическим членом, обеспечивает впечатляющее различение высокоаффинных спиральных спиралей от невзаимодействующих пар белков (AUC = 0,86).
Модель машинного обучения
Тестирование производительности, описанное выше, показало, что экспериментальные данные взаимодействия были важны для создания моделей с наивысшей точностью прогноза.Учитывая доступность большого количества новых данных, мы решили применить подход машинного обучения для создания улучшенного предиктора. Следуя стратегии Fong et al., Мы использовали консервативную структуру coiled-coil для предварительного определения наборов остатков, которые потенциально вносят вклад в межцепочечные взаимодействия в параллельных димерах coiled-coil (см. Методы; рис. 1). Тогда как Фонг и др. рассматривали только пары вычетов, рассматривали как пары, так и тройки вычетов. Каждой паре или тройке был присвоен вес, который был определен с использованием полуколичественной регрессии опорных векторов (SemiSVR) для оптимизации корреляции предсказанных оценок с экспериментальными данными.Наш подход был аналогичен подходу Shao et al. и описан в Методах [21]. Окончательная прогнозируемая оценка взаимодействия для пары спиральная спираль была рассчитана как сумма по весам парных и триплетных членов для взаимодействий, присутствующих в выровненной паре последовательностей bZIP.
1). Тогда как Фонг и др. рассматривали только пары вычетов, рассматривали как пары, так и тройки вычетов. Каждой паре или тройке был присвоен вес, который был определен с использованием полуколичественной регрессии опорных векторов (SemiSVR) для оптимизации корреляции предсказанных оценок с экспериментальными данными.Наш подход был аналогичен подходу Shao et al. и описан в Методах [21]. Окончательная прогнозируемая оценка взаимодействия для пары спиральная спираль была рассчитана как сумма по весам парных и триплетных членов для взаимодействий, присутствующих в выровненной паре последовательностей bZIP.
Рис. 1. Схематическое изображение протокола построения и проектирования модели, используемого для создания селективных взаимодействующих с bZIP пептидов.
(A) Экспериментально определенные константы диссоциации для 4549 пар взаимодействий bZIP были использованы в качестве входных данных для обучения скоринговой модели.(B) Веса, соответствующие вкладам от пар и троек остатков, были подогнаны к экспериментальным данным связывания с использованием метода регрессии.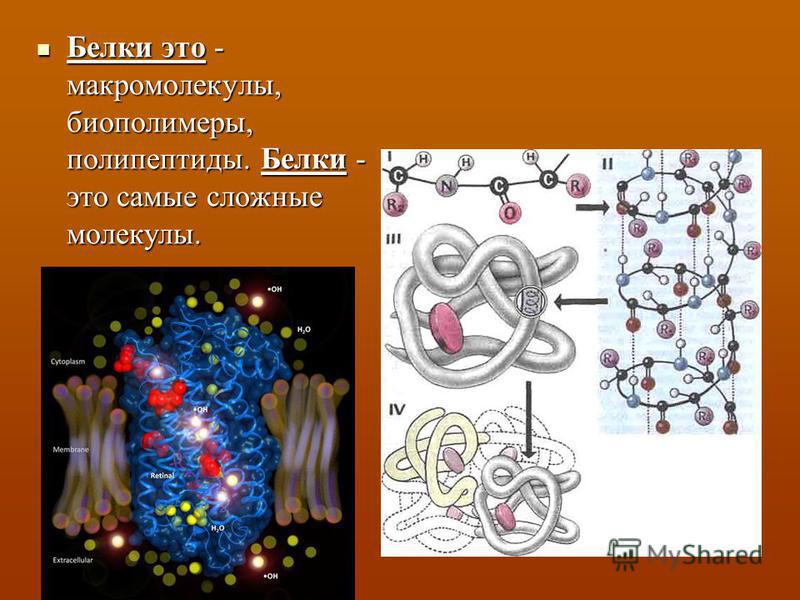 Подходящие оптимизированные веса могут быть суммированы, чтобы обеспечить прогнозируемую энергию связи для двух выровненных последовательностей bZIP coiled-coil. (C) Связующие были разработаны с использованием спиральных гептадов в качестве строительных блоков. Оптимальные комбинации гептад для построения плотно-связывающих и селективных дизайнов были определены с использованием целочисленного линейного программирования в сочетании с разработанной оценочной функцией.(D) Сконструированные последовательности демонстрируют прочное и избирательное связывание с целевыми спиральными спиралями bZIP. Каждый квадрат на рисунке соответствует нативной спиральной спирали bZIP человека, а клетки окрашены в зависимости от силы взаимодействия каждого bZIP с указанным сконструированным пептидом; более темные оттенки соответствуют более прочному связыванию. Названия белков bZIP, соответствующих каждой ячейке, приведены в таблице S5.
Подходящие оптимизированные веса могут быть суммированы, чтобы обеспечить прогнозируемую энергию связи для двух выровненных последовательностей bZIP coiled-coil. (C) Связующие были разработаны с использованием спиральных гептадов в качестве строительных блоков. Оптимальные комбинации гептад для построения плотно-связывающих и селективных дизайнов были определены с использованием целочисленного линейного программирования в сочетании с разработанной оценочной функцией.(D) Сконструированные последовательности демонстрируют прочное и избирательное связывание с целевыми спиральными спиралями bZIP. Каждый квадрат на рисунке соответствует нативной спиральной спирали bZIP человека, а клетки окрашены в зависимости от силы взаимодействия каждого bZIP с указанным сконструированным пептидом; более темные оттенки соответствуют более прочному связыванию. Названия белков bZIP, соответствующих каждой ячейке, приведены в таблице S5.
https://doi.org/10.1371/journal.pcbi.1004046.g001
Экспериментальные данные, использованные для обучения нашей модели, представлены в двух формах: данные связующего, где экспериментальные данные связывания подходят для определения констант диссоциации, и не связующего.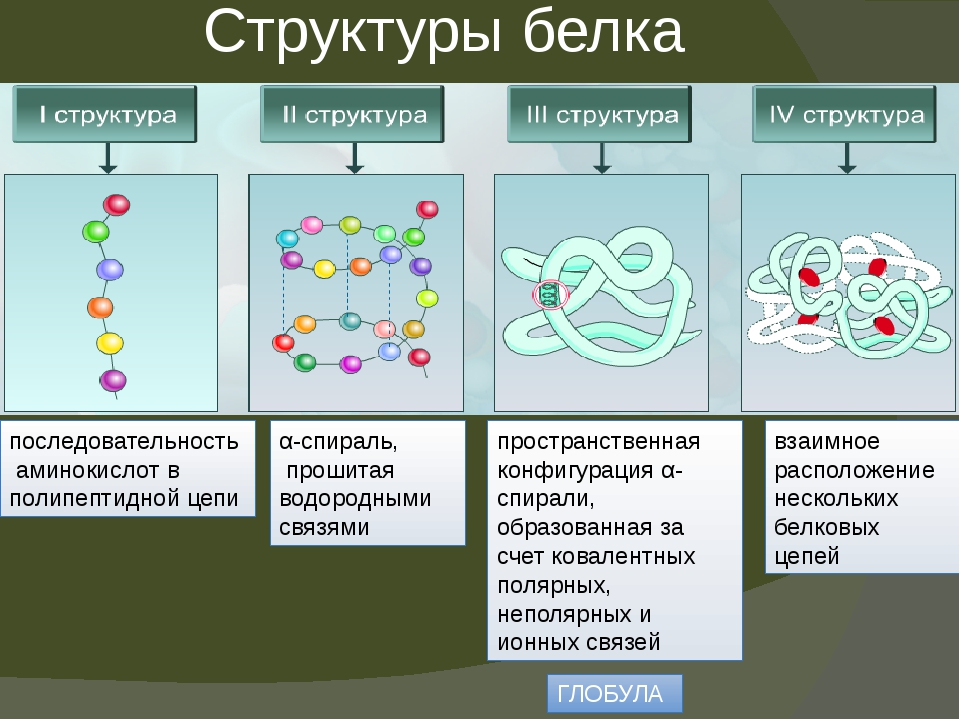 данные, где экспериментальные данные показывают, что два белка взаимодействуют слабо, если вообще взаимодействуют (K d ≥ 5000 нМ).Связующие и не связующие составляют 20% и 80% экспериментальных данных соответственно. Гибкая среда оптимизации позволила использовать оба типа данных при обучении модели, что, как сообщалось ранее, улучшает производительность прогнозирования взаимодействий домен PDZ-пептид [21].
данные, где экспериментальные данные показывают, что два белка взаимодействуют слабо, если вообще взаимодействуют (K d ≥ 5000 нМ).Связующие и не связующие составляют 20% и 80% экспериментальных данных соответственно. Гибкая среда оптимизации позволила использовать оба типа данных при обучении модели, что, как сообщалось ранее, улучшает производительность прогнозирования взаимодействий домен PDZ-пептид [21].
Мы проверили производительность нашей модели на комбинированных экспериментальных данных, используя строгий протокол вложенной перекрестной проверки для оценки ожидаемой производительности (см. Методы). Мы получили коэффициент корреляции Пирсона R = 0.68 и AUC 0,94 (Таблица 2). Отметив, что корреляция между экспериментальными значениями K d , измеренными дважды для одного и того же набора взаимодействий, находится в диапазоне R = 0,82–0,86, наша модель достигает хорошей точности прогноза, особенно с учетом того, что мы не рассматриваем какие-либо атомистические структурные детали. Мы также разделили все доступные экспериментальные данные на неперекрывающиеся и минимально похожие обучающие и тестовые наборы: 98% спиральных катушек в обучающем наборе имели менее 90% идентичности последовательности со спиральными катушками в тестовом наборе при рассмотрении остатков в a , d , e и g позиции.Для этого теста была получена точность прогноза, аналогичная той, что во вложенной оценке перекрестной проверки (таблица S1). Стоит отметить, что при перекрестной проверке 92% свернутых катушек в разделах верхнего уровня разделяют менее 90% идентичности последовательностей со свернутыми катушками в любых других разделах (подробности о разделении набора данных см. В разделе «Методы»). В качестве дополнительного вычислительного теста процедуры перекрестной проверки и оценки возможного переобучения мы случайным образом переставили значения K d , связанные со спиральными катушками, и повторно оптимизировали модель на рандомизированном наборе данных.Как и ожидалось, полученная модель имела нулевую корреляцию и AUC 0,5 во вложенной перекрестной проверке. Наконец, мы оценили 95% доверительный интервал для полученного коэффициента корреляции Пирсона как 0,68 ± 0,04 с помощью повторной выборки с заменой 1000 раз на предсказанные значения K d из вложенной перекрестной проверки.
Мы также разделили все доступные экспериментальные данные на неперекрывающиеся и минимально похожие обучающие и тестовые наборы: 98% спиральных катушек в обучающем наборе имели менее 90% идентичности последовательности со спиральными катушками в тестовом наборе при рассмотрении остатков в a , d , e и g позиции.Для этого теста была получена точность прогноза, аналогичная той, что во вложенной оценке перекрестной проверки (таблица S1). Стоит отметить, что при перекрестной проверке 92% свернутых катушек в разделах верхнего уровня разделяют менее 90% идентичности последовательностей со свернутыми катушками в любых других разделах (подробности о разделении набора данных см. В разделе «Методы»). В качестве дополнительного вычислительного теста процедуры перекрестной проверки и оценки возможного переобучения мы случайным образом переставили значения K d , связанные со спиральными катушками, и повторно оптимизировали модель на рандомизированном наборе данных.Как и ожидалось, полученная модель имела нулевую корреляцию и AUC 0,5 во вложенной перекрестной проверке. Наконец, мы оценили 95% доверительный интервал для полученного коэффициента корреляции Пирсона как 0,68 ± 0,04 с помощью повторной выборки с заменой 1000 раз на предсказанные значения K d из вложенной перекрестной проверки.
Строгая процедура перекрестной проверки, которую мы использовали в этом исследовании, была разработана для получения надежной оценки обобщенных характеристик модели, предполагающей, что все изученные белки попадают в одно и то же общее пространство последовательностей.Мы также оценили производительность, когда модель была обучена и протестирована на двух наборах данных с низкой идентичностью последовательностей. Мы разделили данные на больший набор (3182 взаимодействия; 70%) и меньший набор (1367 взаимодействий; 30%) таким образом, чтобы ни один из двух белков в двух наборах не имел идентичности последовательностей более чем на 50%. Производительность модели, обученной на большем наборе и протестированной на меньшем, снизилась по сравнению с тестами перекрестной проверки. Коэффициент Пирсона для связующих составлял R = 0,50. Более простой тест на двоичную дискриминацию дал результаты, аналогичные результатам, полученным с помощью перекрестной проверки (AUC = 0.90). Ожидается снижение производительности теста корреляции. Когда белки в обучающем и тестовом наборах сильно различаются, модель имеет ограниченные знания о вкладе многих конкретных взаимодействий остаток-остаток. Этот результат имеет важное значение для разработки новых связывателей bZIP с использованием этого типа функции оценки: проектирование должно выполняться в пространстве последовательности, аналогичном пространству, которое использовалось для обучения модели.
Рассмотрение троек в дополнение к парам остатков улучшило производительность умеренно, с R = 0.65 до 0,68. Мы также рассмотрели модель, которая включала только a i — a ‘ i , d i — d ‘ i и g i — e ‘ i + 1 пар, аналогично моделям, основанным на экспериментальных энергиях связи. Упрощенная модель с 513 весами дала R = 0.58. Хотя добавление триплетов резко увеличило количество функций в модели, не все наборы пар и триплетов были одинаково важны для точного прогнозирования. Оптимизированные веса для многих комбинаций остатков были близки к нулю. Применение рекурсивного исключения признаков позволило нам прийти к модели с 829 парами и тройками остатков, которая давала такую же высокую производительность, как и полная модель (методы). В таблице 2 приведены характеристики различных моделей, полученных с помощью SemiSVR.
Веса в нашей линейной аддитивной модели можно интерпретировать как вклады определенных пар или троек остатков в предсказанную стабильность взаимодействия спираль-катушка. Интересно, что оптимизированные веса для многих пар остатков очень хорошо согласуются с ранее измеренными a i — a ‘ i и g i — e ‘ i + 1 энергии связи.Крылов и др. сообщили г i — e ‘ i + 1 энергии взаимодействия для остатков глутамата, глутамина, аргинина и лизина и соответствующих g i — e ‘ i + 1 веса модели сильно коррелируют с экспериментальными значениями (R = 0,94, n = 10, p = 5 x 10 –5 ; рис. 2) [5,22]. Энергии связи для взаимодействий a i — a ‘ i сообщили две группы, и наши веса показывают очень хорошую корреляцию со значениями, указанными Steinkruger et al.(R = 0,89, n = 10; p = 6 x 10 –4 ; рис. 2) [6,23]. Это контрастирует с трудностью предсказания этих весов с использованием простых структурных моделей [16]. Очевидная интерпретируемость весов, полученных с помощью метода SemiSVR, является преимуществом нашего простого кодирования задачи прогнозирования в виде линейной суммы характеристик белка.
Рис. 2. Расшифровка весов модели.
Оптимизированные веса коррелируют с экспериментально измеренными энергиями связи, указанными в литературе: (A) г — e ‘ R ge = 0.94 ( p = 5×10 –5 ) и (B) a — a ‘ R aa = 0,89 ( p = 6×10 –4 ) [5, 22,23]. (C, D) Примеры, иллюстрирующие триплеты остатков, которые, по прогнозам, будут стабилизировать (C) или дестабилизировать (D) в соответствии с производной моделью. PDB ID 4DMD использовался для иллюстрации триплетов; структура на панели (D) была получена путем моделирования глутаминовой кислоты в положении 20 с использованием программы предсказания боковой цепи SCWRL4 [57].
https://doi.org/10.1371/journal.pcbi.1004046.g002
Анализ триплетов, которые больше всего повлияли на производительность модели, выявил некоторые тенденции. В некоторых триплетах дополнительная стабилизация (дестабилизация) возникла в результате благоприятных (неблагоприятных) взаимодействий между остатками в соседних a i — a ‘ i и d i — d ‘ i слоев сердечника спиральной катушки, e.грамм. Leu-Leu-Ile и Leu-Val-Ile на d i — d ‘ i — a i + 1 и Ile-Ala-Leu at a i — a ‘ i — d i имели благоприятные веса триплетов. В других примерах гидрофобный остаток в положении гептады d образует благоприятные контакты с g i — e ‘ i + 1 пар остатков, которые могут образовывать солевые мостики (стабилизирующие взаимодействие; рис.2С). И наоборот, с двумя остатками с одинаковым зарядом в положениях g i и e ‘ i + 1 гидрофобный остаток в положении d дает сильно дестабилизирующий триплет, возможно потому, что в структурах с такой комбинацией остатков сайт d подвергается воздействию растворителя (рис. 2D).
Наша модель основана на большом наборе экспериментальных данных и показывает значительно улучшенные характеристики по сравнению с ранее разработанными моделями.Чтобы оценить, могут ли еще больше экспериментальных данных улучшить производительность прогнозирования, мы повторили оптимизацию SemiSVR, используя от 10% до 100% всех доступных экспериментальных данных, и проверили производительность с помощью перекрестной проверки. Точность модели резко повысилась до точки, после которой она вышла на плато (S1 рис.). Это говорит о том, что большее количество экспериментальных данных одного и того же типа вряд ли еще больше улучшит характеристики прогноза.
Shao et al. сообщили, что включение информации о невзаимодействующих парах улучшило точность предсказания метода SemiSVR, обученного предсказанию взаимодействий домен PDZ-пептид [21].В нашем наборе данных невзаимодействующие пары bZIP (пары с K d ≥ 5000 нМ) составили 80% экспериментальных данных, используемых для обучения. Мы проверили, улучшило ли включение этих пар наши результаты, обучив модель с использованием либо только связующих (948 взаимодействий), либо связующих и несвязующих вместе (всего 4549 взаимодействий). В обоих случаях сравнение экспериментальных значений K d с предсказанными оценками дало тот же результат: R = 0,67 при использовании только связующих веществ и R = 0,68 при использовании связующих и не связующих веществ.Таким образом, включение невзаимодействий в обучающую выборку не улучшило корреляцию с экспериментально измеренными аффинностями для сильно взаимодействующих bZIP (1 нМ ≤ K d <5000 нМ).
Чтобы понять, почему данные без связующего не улучшили прогнозы для связующих (коэффициент корреляции Пирсона), мы исследовали a i — a ‘ i , d i — d ‘ i и g i — e ‘ i + 1 парных взаимодействий в связующих по сравнению сне связующие вещества (S2 рис.). Наиболее заметная разница наблюдалась для взаимодействий a i — a ‘ i . В этих положениях пары Asn-Leu, Asn-Ile и Asn-Val очень часто встречались для не связующих, но редко для связующих. Кроме того, g i — e ‘ i + 1 пар в несвязывающих веществах, как правило, имеют большее количество отталкивающих заряженных взаимодействий (Arg-Arg, Arg-Lys, Glu- Glu) по сравнению со связующими.Вышеупомянутые пары Asn-Leu, Asn-Ile и Asn-Val, как известно, сильно дестабилизируют спиральные катушки bZIP, и это легко усваивается при обучении функции подсчета (этим парам присваиваются крайне неблагоприятные веса). Вероятно, что наличие этих сильных отрицательных элементов дизайна, которые упрощают бинарное различение сильных и слабых связующих, ограничивает полезность несвязующих веществ для улучшения ранжирования сродства связующих.
Использование данных без связующего значительно улучшило различение сильных взаимодействий по сравнению сслабые / невзаимодействия: AUC упала с 0,94 до 0,84, когда невзаимодействия были исключены из обучающей выборки. Этот результат важен, учитывая, что способность различать сильные и слабые / несвязывающие вещества имеет решающее значение для разработки специфических белковых взаимодействий, как мы опишем в следующем разделе.
Разработка специальных связующих
Привлекательные особенности нашей модели в сочетании с хорошей производительностью в тестах прогнозирования побудили нас протестировать ее при разработке вычислительного белка.Нашей целью было разработать новые пептиды со спиральной спиралью, которые могли бы избирательно связываться с доменами bZIP из белков человека. Поскольку наша линейная аддитивная модель не требует структурного моделирования комплексов, а вместо этого работает с последовательностями двух белков bZIP, оценка выполняется очень быстро. Это преимущество для исследования больших пространств последовательностей и для рассмотрения множества конкурирующих состояний взаимодействия, что необходимо при разработке селективных синтетических bZIP-подобных пептидов.
Дизайн пептидов, нацеленных на bZIP, ранее был выполнен с использованием модели оценки HP / S / C в сочетании с новым подходом к оптимизации для управления компромиссом между аффинностью взаимодействия и специфичностью взаимодействия в отношении нецелевых bZIP, которые мы называем «выключенными». -мишени »[2,24].Успешные конструкции были получены для ряда человеческих мишеней bZIP, о чем судили по качественным высокопроизводительным экспериментам с микрочипами со спиральной катушкой плюс анализам спектроскопии кругового дихроизма. В этой работе мы исследовали новую стратегию создания bZIP-связывающих пептидов, в которой использовалась наша улучшенная функция оценки. Мы разработали новые белки, собирая их из коротких фрагментов гептадной последовательности, полученных из природных белков bZIP (рис. 1). Мы рассудили, что ограничение наших проектов пространством последовательностей, которое очень похоже на пространство нативных белков, для которых наш алгоритм предсказания показал хорошую производительность, повысит наши шансы на успех.Более того, комбинации остатков, обнаруженные в нативных bZIPs, пережили эволюционный отбор по функциям и, таким образом, обеспечивают консервативный выбор дизайна в тех положениях, где наша модель неинформативна. Это особенно актуально для обращенных растворителем остатков положения b , c и f , которые не влияют на оценки, предсказанные нашей моделью. Работая в пространстве последовательностей, построенных из нативных гептад, мы оптимизировали предсказанное взаимодействие конструкции с целевой спиральной катушкой bZIP, одновременно учли и исключив до 51 другого возможного, но нежелательного конкурирующего комплекса.
Пространство последовательности, которое мы выбрали для дизайна, было очень большим. Наша библиотека фрагментов из 7 остатков включала 1303 гептады из 440 белков. Для мотива bZIP coiled-coil средней длины (42 остатка = 6 гептад) общее пространство поиска составляло ~ 5 x 10 18 возможных последовательностей. Невозможно было оценить каждую из этих возможных последовательностей на предмет взаимодействия с каждым из 51 природного белка bZIP человека даже с использованием нашего быстрого счетчика. Вместо этого в нашей методике проектирования использовалось целочисленное линейное программирование (ILP).ILP — это метод оптимизации, используемый для поиска минимума целевой функции с учетом набора ограничений. В нашем случае мы минимизировали оценку взаимодействия между целью и разработанной последовательностью. Переменными дизайна были гептады последовательностей. Во время минимизации мы наложили два типа ограничений: (1) оценка связывания разработанной последовательности с нецелевыми объектами должна была быть выше определенного значения, и (2) аминокислотный состав разработанной последовательности был ограничен, например мы ограничили количество полярных остатков, разрешенных в положениях ядра.Полная информация о протоколе оптимизации представлена в разделе «Методы».
Мы выбрали пять белков bZIP человека в качестве мишеней: X-бокс-связывающий белок 1 (XBP1), JUN, активирующий фактор транскрипции (ATF) 3, ATF4 и ATF5. Это белки, для которых партнер по взаимодействию был разработан в предыдущей работе, но либо сродство, либо специфичность конструкции оставляли место для улучшения [2,25]. XBP1 образует сильный гомодимер (K d = 8 нМ), он важен для регуляции развернутого белкового ответа и дифференцировки плазматических клеток, и был задействован как важный ген, вносящий вклад в прогрессирование рака груди [26-28].XBP1 может также образовывать гетеродимеры coiled-coil с CREBZF, ATF6 и ATF6B [18]. JUN, ATF3, ATF4 и ATF5 не сильно гомодимеризуются через свои области coiled-coil, но могут образовывать много сильных гетеродимеров с др. Факторами транскрипции bZIP [1,18,29]. Эти четыре белка играют важную роль в ответах на стресс, дифференцировке тканей и ответе развернутых белков. Разработка реагентов, которые могут избирательно нацеливаться на bZIP и, таким образом, ингибировать их функцию связывания ДНК, может быть полезной для дальнейшего выяснения биологической функции и для тестирования потенциала bZIP в качестве терапевтических мишеней [30–35].Мы разработали девять последовательностей длиной 42 остатка, нацеленных на области спиральной спирали XBP1, JUN, ATF3, ATF4 и ATF5, используя протокол, описанный в методах (таблица 3). Сконструированные пептиды были протестированы на связывание с человеческими конструкциями bZIP, которые включали ДНК-связывающий и спиральный домены каждой мишени [18].
Чтобы определить, могут ли сконструированные пептиды взаимодействовать со своими предполагаемыми партнерами, конструкции были помечены родамином на С-конце и протестированы в анализе FRET прямого связывания против их флуоресцеинированной на С-конце мишени bZIP [18].Восемь из девяти дизайнов привязаны к своей цели с K d <5000 нМ при одной или нескольких испытанных температурах (4, 23 или 37 ° C). Еще один дизайн, JUN-d3, не показал достаточной мощности для испытаний. После нескольких попыток улучшить экспрессию этот дизайн не получил дальнейшего развития. Конструкция XBP1-d2 не обнаруживала связывания с XBP1. Однако двойной мутант XBP1-d2, в котором серин по 4e и тирозин по 5a были мутированы в лизин и лейцин, соответственно, связывал XBP1 с K d , равным 269 нМ, при 23 ° C.Эти мутации были выбраны на основе остатков в эквивалентных положениях в успешной конструкции XBP1-d1. Лизин в позиции 4e, может потенциально благоприятно взаимодействовать с глутаминовой кислотой в позиции 4g, XBP1, а лейцин в позиции 5a, является часто наблюдаемым остатком в положениях a , которые могут образовывать стабилизирующие гидрофобные контакты с треонином в позиции 5a в XBP1. Прогнозируемая оценка взаимодействия для двойного мутанта была очень похожа на оценку для оригинального дизайна XBP1-d2.
Четыре пептида с наивысшей аффинностью связывания мишени были выбраны для дальнейшей характеристики (таблица 4). Конструкции против XBP1, JUN, ATF4 и ATF5 связали свои цели со значениями K d , равными 172 нМ, 6 нМ, 9 нМ и 1680 нМ, соответственно (рис. 3). Анализ смесей 1: 1 этих четырех разработанных пептидов с их мишенями с помощью аналитического ультрацентрифугирования дал молекулярные массы, соответствующие образованию гетеродимеров, а не частиц более высокого порядка (методы, таблица S2 и рис.). Во время процесса проектирования члены семейства мишеней не рассматривались как нецелевые, поскольку в большинстве случаев считалось, что взаимодействий с очень похожими белками трудно избежать. Действительно, в некоторых случаях мы наблюдали взаимодействия разработанных пептидов с целевыми членами семейства. Например, ATF5-d1 более плотно связывается с ATF4 (K d = 4,9 нМ), чем с ATF5. Связывание ATF5-d1 с ATF4 также было предсказано нашей моделью как более благоприятное, чем взаимодействие с ATF5 (оценка 0.75 против 0,40). ATF4 имеет 69% идентичности последовательности с ATF5 в позициях ядра , , d, , e и g, .
Рис. 3. Профили специфичности четырех конструкций, испытанных при 37 ° C.
Разработанные связующие сильно взаимодействуют со своими мишенями в виде пептидов, меченных родамином (жирные красные кружки). Тонкие красные кружки показывают взаимодействие с другими bZIP в том же семействе, что и цель. Конструкция ATF5-d1 сильнее связана с ATF4 (тонкий красный кружок), чем с ATF5.Сконструированные белки не образуют сильных гомодимеров (черные столбцы), и существуют большие пробелы в специфичности между взаимодействиями дизайн / мишень и взаимодействия дизайн / нецелевой (белые и серые столбцы, окрашенные в соответствии с идентичностью последовательности мишень-не-мишень на ). a , d , e и g позиции). Все значения K d перечислены в таблицах S5 – S12.
https://doi.org/10.1371/journal.pcbi.1004046.g003
Для определения специфичности взаимодействия конструкций, нацеленных на bZIP, пептиды, меченные как на N-, так и на C-конце, тестировали на связывание с 32 различными C-концевыми участками. флуоресцеинированные bZIP при трех температурах (рис.3 и S4 рис.). Эти белки были выбраны, чтобы представлять членов всех 18 семейств bZIP человека, как обсуждалось Reinke et al. Эта комбинация тестов потенциально позволяет обнаруживать параллельные или антипараллельные взаимодействия спиральной спирали между конструкцией и нецелевыми bZIP, даже если FRET неэффективен между красителями, расположенными на противоположных концах спиральной спирали. В протоколе вычислительного проектирования учитывались только параллельные взаимодействия, так как функция оценки была обучена и протестирована с использованием параллельных взаимодействий, и у нас не было эквивалентной функции оценки для антипараллельных взаимодействий.Тем не менее, любое нецелевое связывание нежелательно. На рис. 3 показано самое тесное взаимодействие не с целью для каждой конструкции при 37 ° C. Все конструкции наиболее тесно связаны с предполагаемым семейством bZIP, причем JUN-d1 демонстрирует 100-кратную специфичность для JUN, ATF4-d1 и XBP1-d1 демонстрирует 30-кратную специфичность для ATF4 и XBP1, а ATF5-d1 демонстрирует ~ 20-кратную специфичность для ATF4 при 37 ° C. Во всех четырех случаях более 75% нецелевых взаимодействий не были обнаружены или им был присвоен K d ≥ 5000 нМ при 37 ° C.
Для пяти взаимодействий дизайн-мишень (включая взаимодействие ATF5-d1 как с ATF4, так и с ATF5) эффективность FRET была выше, когда флуорофоры оба были расположены на С-конце пептида, а не один на N- и один на С-конец, поддерживающий параллельное расположение спиралей (таблица S3).Для некоторых нецелевых взаимодействий эффективность FRET для взаимодействия с дизайном с N-концом была выше, чем с дизайном с C-концом, что указывает на возможное антипараллельное взаимодействие, которое не учитывалось в вычислительном дизайне. Например, эффективность FRET взаимодействия между ATF5-d1 и BATF2 была больше, когда сконструированный пептид был помечен на N-конце, чем когда он был помечен на C-конце (0,65 против 0,31, соответственно, при 4 ° C. ). Анализ потенциальных взаимодействий с заряженными остатками e — g ‘ в последовательностях этих белков показал наличие одного чистого отталкивающего межспирального солевого мостика в модели параллельного гетеродимера и четырех чистых благоприятных солевых мостиков в модели антипараллельного взаимодействия. структура.Аналогичные аргументы применимы к 5 из 12 примеров, когда эффективность FRET соответствовала антипараллельному выравниванию спирали. Электростатические взаимодействия между остатками в положениях e и g , как известно, важны для определения специфичности ориентации спирали [36,37].
Для ATF4-d1, который образует сильный гомодимер (K d 36,3 нМ при 23 ° C), мы повторили 18 экспериментов по связыванию, титруя нативные bZIP, меченные акцептором FRET, в меченный донором сконструированный пептид, а не наоборот. [18].Это позволило нам сохранить фиксированную конструкцию на низкой концентрации, потенциально облегчая обнаружение комплексов, которые конкурируют с образованием гомодимеров конструкции. Эти эксперименты не выявили каких-либо новых взаимодействий, за исключением того, что для четырех человеческих bZIP, для которых связывание с ATF4-d1 ранее было слабо обнаружено (CREBZF, BATF, ATF3 и DBP), при 4 ° C наблюдался сложный сигнал, соответствующий увеличению флуоресценции донора. . Этот сигнал не может хорошо соответствовать нашей модели связывания, предполагая, что другая ориентация или состояние олигомеризации может формироваться при низких температурах.Не было доказательств взаимодействия при 23 или 37 ° C, когда донором был ATF4-d1. Для этих четырех человеческих bZIP, ATF4-d1 был протестирован в конкурентном эксперименте при 37 ° C, чтобы увидеть, может ли немеченый дизайн ингибировать комплекс FRET, содержащий кандидата на связывание, но никакого ингибирования обнаружено не было (S5 фиг.).
Для большинства пар bZIP связывание сконструированного пептида, меченного на N-конце, с меченой на C-конце мишенью давало очень слабый сигнал, и такие кривые редко могли быть пригодны для получения значений K d (таблицы S9 – S12).В нескольких случаях, когда взаимодействия можно было количественно оценить с помощью маркировки как N-, так и C-концевого красителя, мы наблюдали, что сродство меченных на N-конце конструкций к меченным на C-конце мишеням было несколько слабее, чем аффинность дизайнов, меченных на C-конце ( Таблицы S5 – S12). О повышенном сродстве, связанном с взаимодействием красителей, сообщалось ранее [18]. Чтобы оценить, могут ли разработанные спиральные катушки плотно связываться с намеченными целями без какого-либо вклада красителя, мы использовали конструкции в анализах ингибирования, где сигнал исходит от разрушения комплекса FRET между двумя человеческими bZIP (см. Методы).Этот тест имитирует приложения, в которых разработанные ингибиторы могут использоваться для блокировки функции димеризации bZIP. Мы протестировали JUN-d1, ингибирующий гетеродимер JUN / FOS, XBP1-d1, ингибирующий гетеродимер XBP1 / CREBZF, и ATF4-d1, ингибирующий гетеродимер ATF4 / FOS. Во всех случаях конструкции снижали сигнал FRET от целевого комплекса, со значениями IC 50 ~ 140–280 нМ (рис. 4). Мы также продемонстрировали, что немеченые ATF4-d1 и ATF5-d1 могут ингибировать комплексы между FITC-меченными версиями конструкций и TAMRA-меченным ATF4 (K i = 6 нМ для ATF5-d1, 48 нМ для ATF4-d1; Таблица S4 ).Следует отметить, что JUN-d1 был эффективен при блокировании образования гетеродимера JUN / FOS (также известного как фактор транскрипции AP1), функционально значимого комплекса, важного для регуляции пролиферации клеток. Неправильная регуляция AP1 приводит к онкогенной трансформации [31]. Константа диссоциации этого гетеродимера составляет менее 1 нМ [18], и конструкция ингибирует это взаимодействие с IC 50 около 245 нМ в условиях анализа.
Рис. 4. Созданные bZIP-связывающие пептиды ингибируют взаимодействия нативных димеров bZIP.
(A) JUN-d1 ингибирует взаимодействие 10 нМ JUN с 50 нМ FOS с IC 50 245 нМ при 37 ° C. (B) XBP1-d1 ингибирует взаимодействие 10 нМ XBP1 с 50 нМ CREBZF с IC 50 136 нМ при 23 ° C. (C) ATF4-d1 ингибирует взаимодействие 10 нМ ATF4 с 200 нМ FOS с IC 50 279 нМ при 37 ° C. Константы диссоциации при указанных температурах составляют K d ≤ 1 нМ для FOS-JUN, K d ≤1 нМ для XBP1-CREBZF и K d = 60 нМ для ATF4-FOS, согласно [18] .Интенсивность флуоресценции измеряли как при 37 ° C, так и при 23 ° C, и значение IC 50 подходило и сообщалось для самой высокой температуры, которая давала четко определенную более низкую базовую линию. Целевой bZIP в каждом комплексе был помечен донором FRET (флуоресцеин), партнер был помечен акцептором TAMRA FRET, а дизайн не помечен. Эмиссию флуоресценции контролировали при 525 нм и выражали в относительных единицах флуоресценции.
https://doi.org/10.1371/journal.pcbi.1004046.g004
Мы проанализировали гептады, составляющие четыре наших наиболее успешных проекта: XBP1-d1, JUN-d1, ATF4-d1 и ATF5-d1. Интересно, что ни одна из гептад не была получена из нативных партнеров целевых белков или даже из каких-либо белков человека (нативный партнер определялся как любой белок из того же вида с аффинностью связывания с мишенью K d <250 нМ). Например, XBP1-d1 состоит из гептадов из N . vectensis , С . elegans и C . Кишечник белков, и из ранее разработанных связующих bZIP. Мы также отмечаем, что наши четыре дизайна состояли из 24 отдельных неповторяющихся гептад. Таким образом, наш алгоритм проектирования не просто повторно использовал гептады, взятые из собственных подшивок, он скорее использовал различные модули из библиотеки. В этом исследовании мы вычислили идентичность последовательностей «все против всех» для нативных и разработанных белков (полная информация доступна в Data S1). При рассмотрении всех семи положений гептад, наши четыре наиболее успешных дизайна, XBP1-d1, JUN-d1, ATF4-d1 и ATF5-d1, имеют 48%, 45%, 33% и 34% идентичности последовательностей соответственно с нативным bZIP. спиральная катушка.При рассмотрении положений ядра a , d , e , g , одинаковые конструкции имеют не более 56%, 62%, 42% и 45% идентичности последовательностей. Таким образом, конструкции существенно отличаются от существующих белков. Тем не менее, интересно наблюдать за некоторыми тенденциями. ATF6 человека, который прочно связывается с XBP1 (K d = 1 нМ), имеет наибольшее сходство (56%) с нашим дизайном XBP1-d1 [18] и человеческим FOS, который прочно связывается с JUN (K d ). = 1 нМ), наиболее похож на нашу конструкцию JUN-d1 (62%).Однако ATF6B, наиболее близкий человеческий белок к ATF4-d1 (42%), не взаимодействует с ATF4 (K d ≥ 5000 нМ). ATF5-d1 имел максимум 38% идентичности последовательности с любым человеческим bZIP. Из пяти белков, которые обладают такой степенью идентичности последовательностей, только CEBPG прочно связывается с ATF5.
Несмотря на то, что некоторые конструкции имеют общие черты последовательности с человеческими белками, которые связывают одну и ту же мишень, профили взаимодействия нативных и разработанных связывающих белков сильно различаются. Если рассматривать только сильные связующие с K d <250 нМ при 21 ° C, ATF6 взаимодействует с XBP1 и ATF6B, а также образует гомодимер.В тех же условиях XBP1-d1 связывал только свою мишень, XBP1, и не обнаруживал детектируемой гомодимеризации. FOS связывает 11 человеческих bZIP, включая JUN, тогда как JUN-d1 связывает только JUN, его близкий гомолог JUNB, ATF2 и ATF4. При более высокой температуре JUN-d1 обнаружимо взаимодействовал только с JUN и JUNB. CEBPG взаимодействует с 13 белками человека, включая ATF4 и ATF5, тогда как ATF5-d1 взаимодействует с ATF4, близкородственным ATF5 и, возможно, с ATF6B. Наконец, ATF6B связывает XBP1 и ATF6 и образует гомодимер, тогда как наша конструкция ATF4-d1 связывает свою мишень и CREB3L1 и образует гомодимер.Следовательно, разработанные нами пептиды более селективны, чем нативные спиральные спирали bZIP, которые связывают одни и те же мишени, что соответствует основным целям нашего протокола разработки.
Зная, что нативные белки bZIP демонстрируют ограниченную изменчивость в положениях ядра a , d , e и g , неудивительно, что нативные партнеры и вычислительные конструкции имеют общие некоторые особенности. Например, для мишеней, для которых позиции d преимущественно заняты Leu, самые плотные связывающие вещества потребуют совпадающего Leu в их положениях d .Существует еще более сильная тенденция к спариванию остатков Asn с другими остатками Asn или иногда остатками Lys в положениях и . Таким образом, XBP1 с тремя остатками Asn в положениях и потребует трех совпадающих остатков Asn или Lys для любого прочного связующего. Несмотря на некоторые основные требования к прочным связующим, остается много способов достижения плотного и специфического связывания.
| |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Тема 3 | Hodges Lab
Передача информации о стабильности по двухцепочечной α-спиральной спиральной спирали
Тропомиозин (Tm) наиболее широко известен своей ролью в сокращении мышц; его кальций-зависимое взаимодействие с тропониновым комплексом в регулировании взаимодействия миозина и актина, необходимого для генерирования силового удара в саркомерах мышц клетки.Tm экспрессируется во всех типах эукариотических клеток более чем в 40 изоформах, которые широко распространены в отдельных клетках. Следовательно, Tm играет решающую роль во многих биологически значимых процессах и связан с несколькими заболеваниями, включая кардиомиопатию и рак.
Tm представляет собой двухцепочечную α-спиральную спиральную спираль из 284 остатков на полипептидную цепь. Как передаются сигналы по этой палочковидной молекуле размером более 400 A o , остается серьезной проблемой для химиков-протеинов.Мы сделали первую идентификацию области контроля стабильности (SCR) остатков 97-118 в последовательности тропомиозина из 284 остатков, которая контролирует общую стабильность белка, но не требуется для фолдинга. Мы показали, что одна мутация L110A дестабилизирует всю молекулу Tm (1-131), показывая, что эффект этой мутации передается 165 A o вдоль спиральной спирали в N-концевом направлении. Единственная мутация A109L не позволяет SCR передавать стабилизирующую информацию и разделяет спиральную катушку на две части. Один домен на ~ 9 o ° C более стабилен, чем дикий тип, а другой на ~ 16 o ° C менее стабилен.Изучение того, как информация о стабильности передается по стержнеобразным молекулам, имеет решающее значение для понимания функции и передачи сигналов.
Список избранных публикаций.
Kirwan, J.P. и R.S. Ходжес. Передача информации о стабильности через N-домен тропомиозина прерывается стабилизирующей мутацией (A109L) в гидрофобном ядре области контроля стабильности (97-118). J. Biol. Chem. 389: 4356-4366 (2014).
Кирван, Дж. П. и Р.С. Ходжес. Критические взаимодействия в области контроля стабильности тропомиозина. J. Структурная биология 170: 294-306 (2010). PMC2856757 PMID20144718
Ходжес, Р.С., Дж. Миллс, С. Макрейнольдс, Дж. П. Кирван, Б. Трипет и Д. Осгуторп. Идентификация уникального «участка контроля стабильности», который контролирует стабильность белка тропомиозина: двухцепочечной a-спиральной спиральной спирали. J. Mol. Биол. 392: 747-762 (2009). PMC2756485 PMID19627992
Квок, С.C. и R.S. Ходжес. Стабилизирующие и дестабилизирующие кластеры в гидрофобном ядре длинных двухцепочечных a-спиральных спиралей. J. Biol. Chem . 279: 21576-21588 (2004).
Комбинированное молекулярное / континуальное моделирование раскрывает роль трения во время быстрого развертывания спиральных белков
Coiled-coils — это нитчатые белки, которые образуют основной строительный блок важных силовых клеточных элементов, таких как промежуточные филаменты и миозиновые двигатели.Помимо своего биологического значения, белки спиральной спирали все чаще используются в новых биоматериалах, включая волокна, нанотрубки или гидрогели. Спиральные спирали претерпевают структурный переход от α-спиральной спирали в развернутое состояние при растяжении, что позволяет им выдерживать большие деформации и имеет решающее значение для их биологической функции. Выполняя моделирование равновесной и неравновесной полностью атомной молекулярной динамики (МД) спиральных спиралей в явном растворителе, мы показываем, что модели с двумя состояниями, основанные на теориях Крамерса или Белла, не могут предсказать скорость развертывания при высоком натяжении. тарифы.Мы также показываем, что атомистически информированная модель стержня континуума, учитывающая фазовые превращения и гидродинамические взаимодействия с растворителем, может согласовать модели двух состояний с нашими результатами МД. Наши результаты показывают, что силы трения, которыми обычно пренебрегают в теориях разворачивания волокнистых белков, уменьшают термодинамическую силу, действующую на границу раздела, и, таким образом, контролируют динамику разворачивания при различных скоростях растяжения. Наши результаты могут помочь в интерпретации МД-моделирования при высоких скоростях вытягивания и могут иметь отношение к цитоскелетным сетям или искусственным материалам на основе белков, подвергшимся ударам или взрывам.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент.
 Надеюсь, что вы готовы познавать и действовать, активно мыслить и делать выводы.
Надеюсь, что вы готовы познавать и действовать, активно мыслить и делать выводы.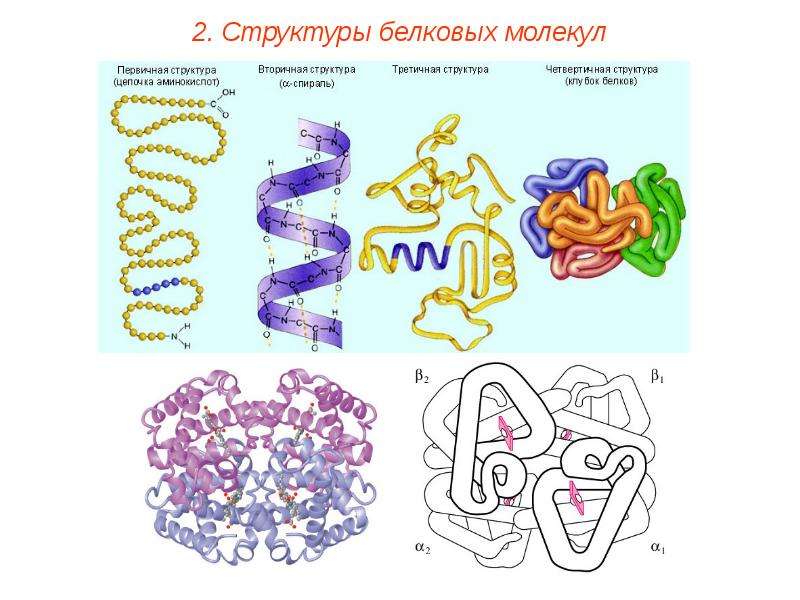
 Глобула, образующаяся в результате компактной укладки α- спирали.
Глобула, образующаяся в результате компактной укладки α- спирали.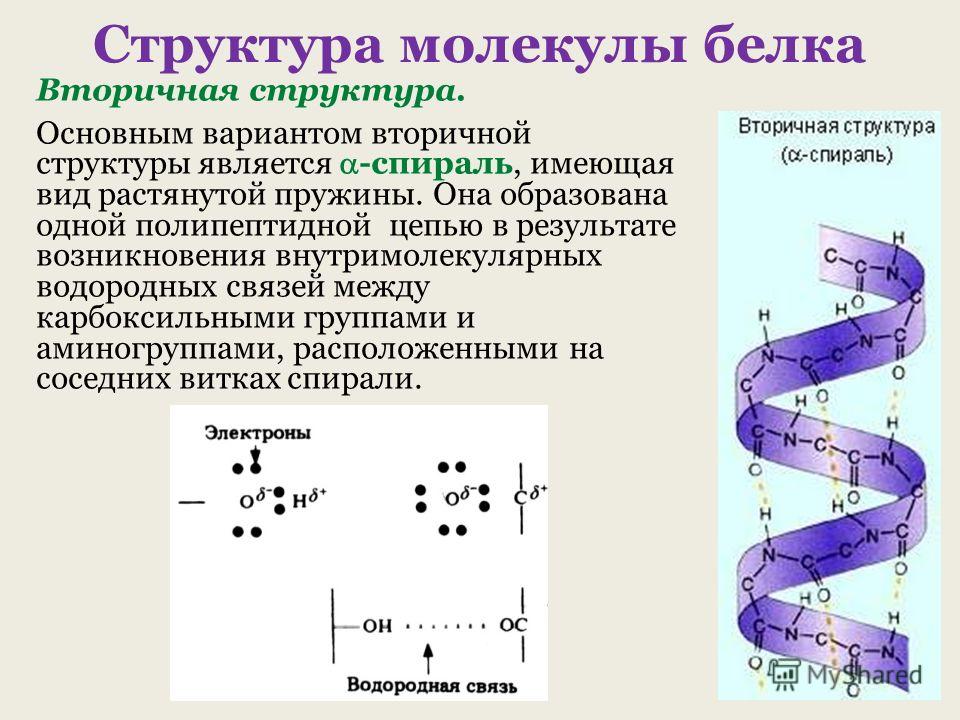
 . . . . . . 13
. . . . . . 13 С помощью 20 букв можно написать
бесконечное множество таких длинных
слов. Известно, что замена даже одного
аминокислотного звена другим в белковой
молекуле изменяет ее свойства. В каждой
клетке содержится несколько тысяч
разных видов белковых молекул, и для
каждого из них характерна строго
определенная последовательность
аминокислот. Именно порядок чередования
аминокислот в данной белковой молекуле
определяет ее особые физико-химические
и биологические свойства.
С помощью 20 букв можно написать
бесконечное множество таких длинных
слов. Известно, что замена даже одного
аминокислотного звена другим в белковой
молекуле изменяет ее свойства. В каждой
клетке содержится несколько тысяч
разных видов белковых молекул, и для
каждого из них характерна строго
определенная последовательность
аминокислот. Именно порядок чередования
аминокислот в данной белковой молекуле
определяет ее особые физико-химические
и биологические свойства. К ним относятся альбумины,
глобулины, гистоны, глутелины, проламины,
протамины и протеиноиды.
К ним относятся альбумины,
глобулины, гистоны, глутелины, проламины,
протамины и протеиноиды.
 Другие элементы присутствуют в ней в незначительных количествах: серы 0,15-0,2%, цинка 0,003%, а йода — всего 0,000001%.
Другие элементы присутствуют в ней в незначительных количествах: серы 0,15-0,2%, цинка 0,003%, а йода — всего 0,000001%. Это неорганические соединения.
Это неорганические соединения. Такое свойство создаёт возможность равномерного распределения теплоты между тканями тела.
Такое свойство создаёт возможность равномерного распределения теплоты между тканями тела.
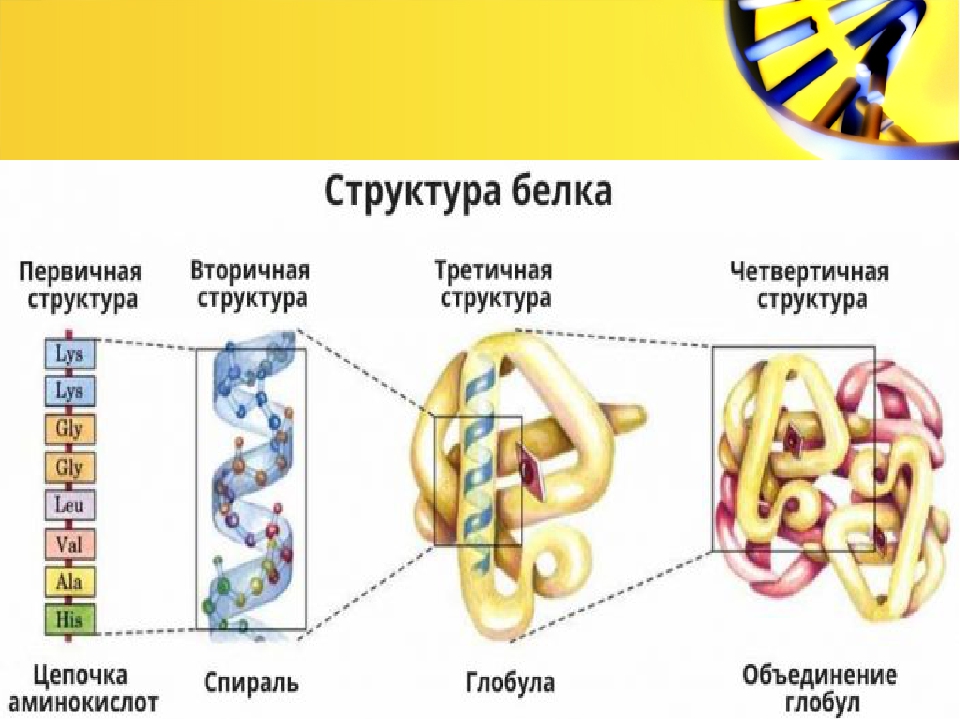 Они состоят из тысяч молекул глюкозы.
Они состоят из тысяч молекул глюкозы.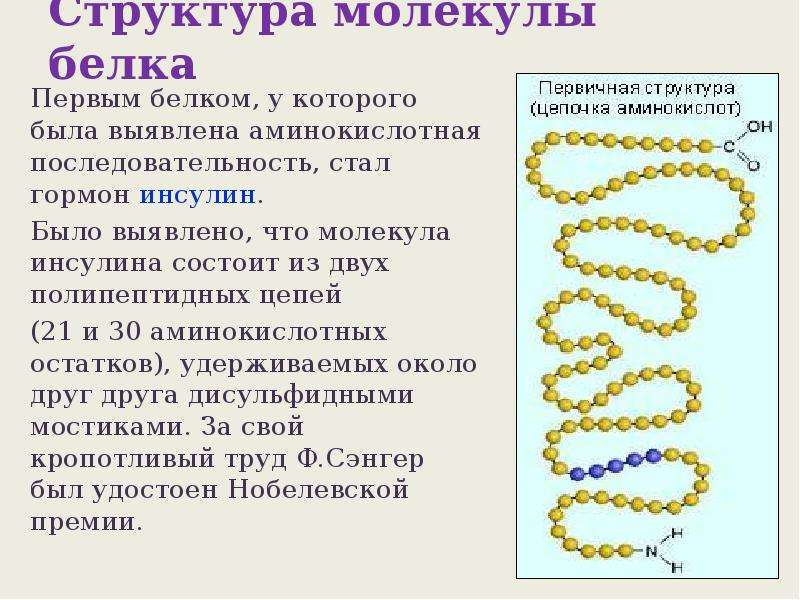
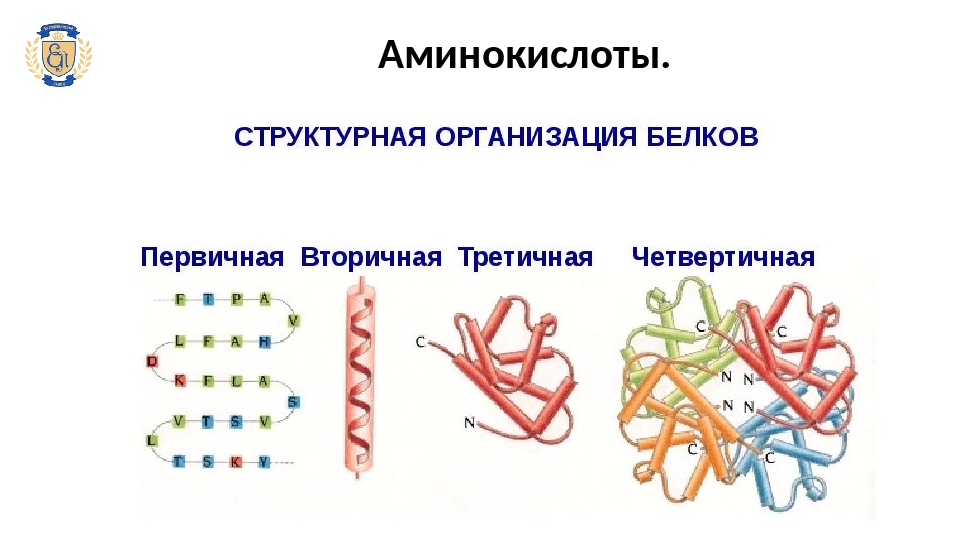
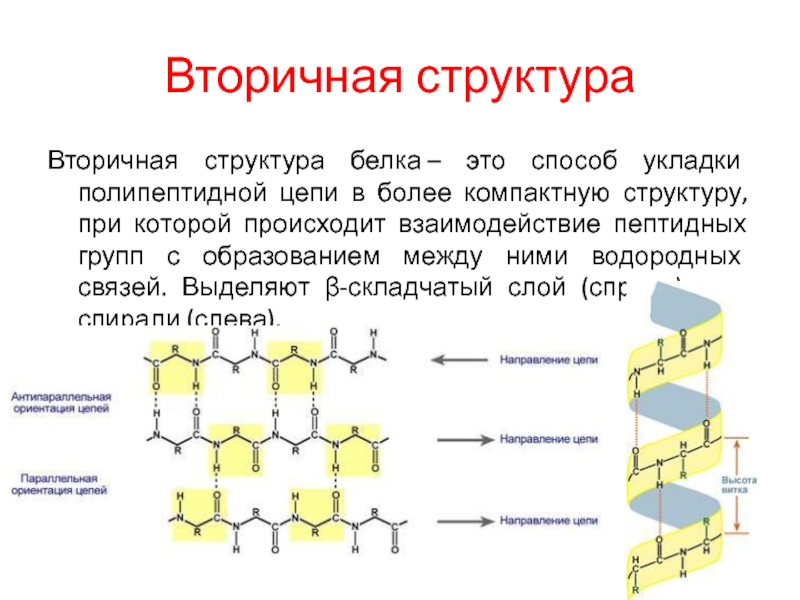
 Такую структуру, свойственную только молекулам ДНК, называют двойной спиралью.
Такую структуру, свойственную только молекулам ДНК, называют двойной спиралью. 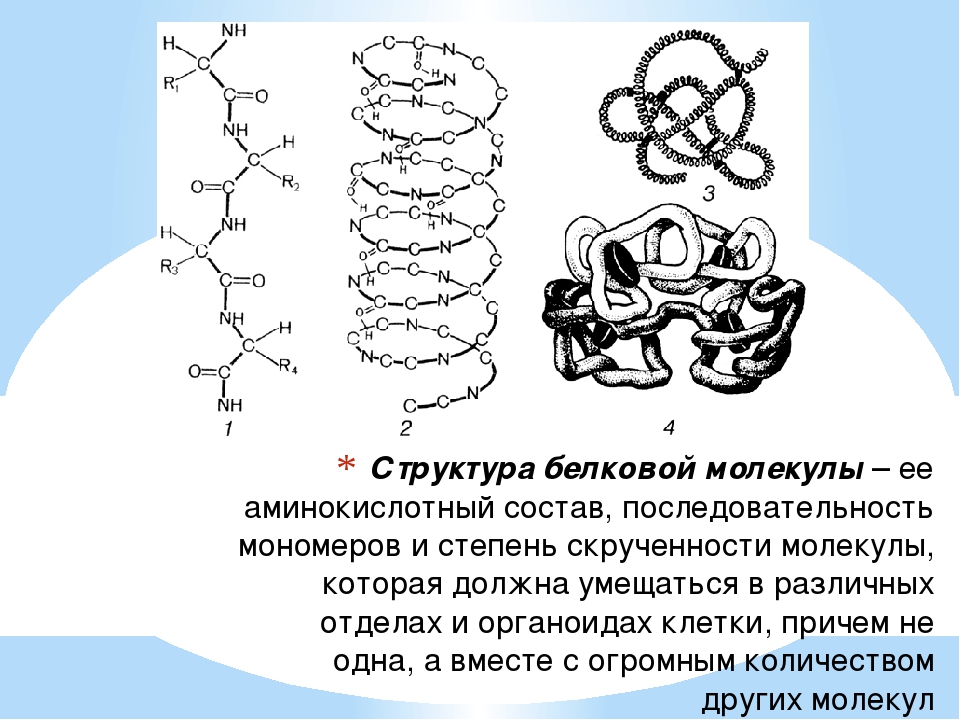 Информация о строении белка передаётся в цитоплазму особыми молекулами РНК, которые называются информационными РНК (иРНК).
Информация о строении белка передаётся в цитоплазму особыми молекулами РНК, которые называются информационными РНК (иРНК). 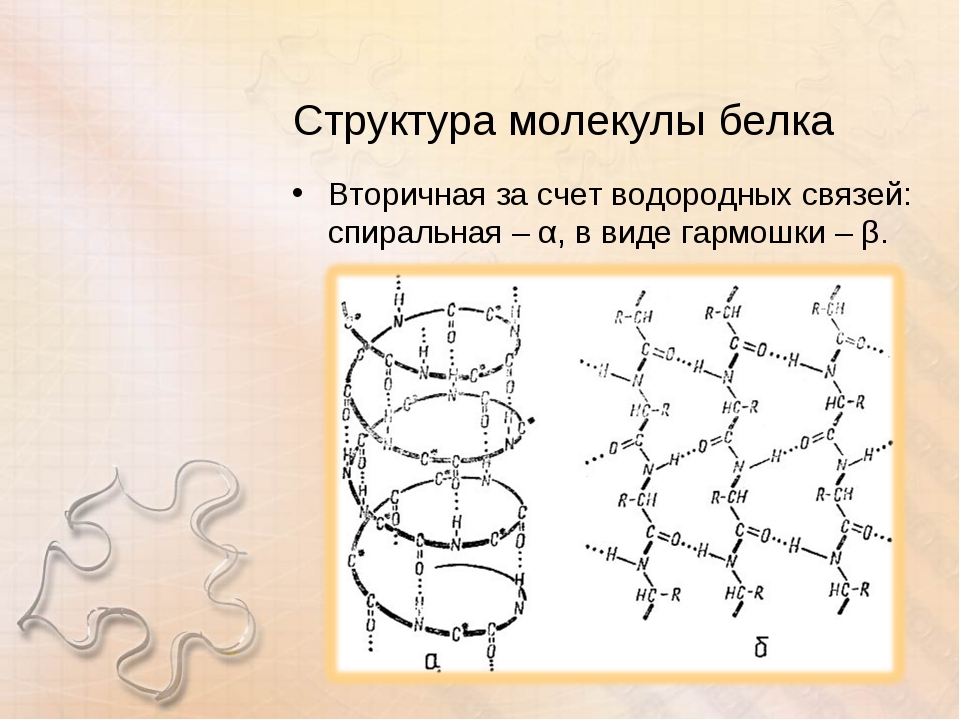 Различные виды РНК принимают участие в реализации наследственной информации через синтез белка.
Различные виды РНК принимают участие в реализации наследственной информации через синтез белка.

Leave A Comment