Теории и модели свертывания крови
Теории и модели свертывания крови – от Шмидта до Монро
Основными функциями гемостаза являются поддержание жидкого состояния крови и быстрое купирование кровоточивости из места повреждения сосудистой стенки. В этом процессе принимают участие клетки крови, эндотелий сосудов и циркулирующие в крови белки – факторы свертывания крови и фибринолиза, активаторы и ингибиторы. Нарушение тонкого баланса взаимодействия всех этих компонентов, в том числе из-за врожденной недостаточности некоторых из них, приводит к развитию различных заболеваний (тромбоэмболических синдромов, диссеминированного внутрисосудистого свертывания, ишемии и инфарктов органов, гемофилии), нередко фатальных. Нарушение гемостаза происходит при таких видах патологии, как атеросклероз, иммунные и онкологические заболевания, акушерские осложнения и многие другие.
Создание первой научной теории свертывания крови в 1872 г. принадлежит русскому ученому Шмидту А. А., позже была дополнена, модифицирована и сформулирована как классическая ферментативная теория свертывания крови, которая в литературе получила название теории Шмидта-Моравица. До разработки современной клеточной теории свертывания крови для понимания механизмов гемостаза использовали «каскадную» модель свертывания крови (Davie E.W., Ratnoff O.D.; Macfarlane R.G., 1964 г.), где процесс свертывания крови подразделяется на первичный и вторичный гемостаз, с выделением «внешнего», «внутреннего» путей активации тромбина и «общего пути» (см. схему свертывания крови). Условным третьим этапом свертывания крови является процесс лизиса кровяного сгустка (фибринового тромба) — фибринолиз.
А., позже была дополнена, модифицирована и сформулирована как классическая ферментативная теория свертывания крови, которая в литературе получила название теории Шмидта-Моравица. До разработки современной клеточной теории свертывания крови для понимания механизмов гемостаза использовали «каскадную» модель свертывания крови (Davie E.W., Ratnoff O.D.; Macfarlane R.G., 1964 г.), где процесс свертывания крови подразделяется на первичный и вторичный гемостаз, с выделением «внешнего», «внутреннего» путей активации тромбина и «общего пути» (см. схему свертывания крови). Условным третьим этапом свертывания крови является процесс лизиса кровяного сгустка (фибринового тромба) — фибринолиз.
Итак, согласно классической каскадной модели свертывания крови, активация коагуляционных факторов, приводящая к образованию фибрина, осуществляется двумя путями: внешним (тканевым) и внутренним (тромбоцитарно-сосудистым), в зависимости от характера активирующей поверхности на начальных этапах процесса свертывания крови.
Для внешнего пути такой поверхностью является тканевой фактор (ТФ), который выделяется из поврежденного эндотелия и активирует фактор (ф.) VII при участии ионов кальция.
Внутренний путь рассматривается как процесс, который начинается с активации ф.XII при контакте крови с поврежденной сосудистой стенкой (субэндотелиальными компонентами сосудистой стенки, в частности с коллагеном), и проходит цепь последовательных реакций активации факторов XI, IX и VIII.
Оба пути приводят к активации ф.Х, и с этого момента процесс свертывания крови протекает по общему пути свертывания. Фактор Ха со своим кофактором Va образует протромбиназный ферментативный комплекс, который на поверхности тромбоцитов активирует протромбин с образованием тромбина. Образовавшийся тромбин поступает в ток крови и превращает фибриноген в фибрин-мономеры. Последние спонтанно соединяются, образуя полимеры фибрина.
Несмотря на то, что каскадная модель не совсем верно отражает суть функционирования системы гемостаза, ее до сих пор с успехом используют для интерпретации базовых (скрининговых) коагуляционных тестов, в которых искусственно воспроизведены условия активации ф. X по внешнему пути (протромбиновый тест) или внутреннему пути (активированное частичное тромбопластиновое время, АЧТВ).
X по внешнему пути (протромбиновый тест) или внутреннему пути (активированное частичное тромбопластиновое время, АЧТВ).
Примечательно, что слово « каскад» не совсем верно отражал суть функционирования системы гемостаза, так как в процессе коагуляции имеется множество перекрёстных реакций, а «каскад» подразумевает лишь последовательную цепочку процессов. Цепочки реакций внутреннего, внешнего и общего путей гемостаза in vivo работают не изолированно, а в тесном взаимодействии друг с другом и с тромбоцитами. Как оказалось, взаимосвязь путей свертывания подтверждается способностью комплекса ТФ-ф.VIIa активировать фактор IX, а также способностью факторов XIIa и Ха активировать фактор VII.
Несмотря на сходную структуру мембранных липидов, клетки, несущие тканевой фактор, и активированные тромбоциты экспрессируют рецепторы, которые локализуют на их поверхности различные компоненты свертывающей системы крови.
Именно факт локализации различных коагуляционных факторов на поверхностях субэндотелиальных клеток и тромбоцитов позволил по-новому пересмотреть последовательность включения их в процесс формирования фибринового сгустка.
Классическая теория свертывания крови оставляла слишком много вопросов. Например, с одной стороны, было неясно, какая поверхность в физиологических условиях является активатором. С другой стороны, было не понятно, почему возможность образования протромбиназного комплекса (ф.Xa и ф.Va) по одному пути не компенсирует поломку в другом. А именно, почему активация фактора X внешним путем через комплекс ТФ-ф.VIIa не компенсирует недостаток факторов VIII или IX у больного гемофилией.
Аналогичный вопрос возникает и в отношении пациентов с дефицитом фактора VII, у которых при отсутствии нарушений во внутреннем пути развиваются тяжелые проявления кровоточивости. Если внутренний путь начинается с активации фактора XII, то почему его дефицит не вызывает тенденции к кровоточивости. Почему дефицит факторов внутреннего пути (ф.VIII, ф.IX, ф.XI) приводит к выраженной кровоточивости при нормальной активности факторов внешнего пути, а глубокий дефицит факторов внешнего пути не сопровождается геморрагическим синдромом. В современной теории гемостаза предпринята попытка разрешить данные противоречия.
В современной теории гемостаза предпринята попытка разрешить данные противоречия.
Современная модель гемостаза – клеточная или клеточно-ассоциированная (Hoffman M, Monroe D., 2001 — Hoffman M., Monroe D.M. A cell-based model of hemostasis. Thromb Haemost. 2001; 85: 958-965). Согласно ей активацию, локализацию и концентрацию коагуляционных белков обеспечивают анионные фосфолипиды мембран, рецепторы и места связывания клеток (тромбоцитов, эндотелиоцитов, лейкоцитов). Клеточная модель свертывания описывает гемостатический процесс, происходящий по современным представлениям in vivo.
Клеточная модель свертывания не отрицает реакции взаимодействия и свойства факторов свёртывающей, противосвёртывающей и фибринолитической систем, представленных в каскадной модели свертывания. Она признает наличие внешнего и внутреннего пути свертывания, но существенно их модифицирует.
С учетом данных о локализации и контроле коагуляционных реакций на различных клеточных поверхностях, процесс свертывания крови в настоящее время представляют в виде трех перекрывающих друг друга фаз: инициации (initiation), усиления (amplification) и распространения (propagation).
1 фаза – инициация процесса свертывания крови, которая развивается за счет образования комплекса ТФ-ф.VIIa на поверхности субэндотелиальных клеток в месте повреждения сосудистой стенки и приводит к образованию незначительного стартового количества тромбина.
2 фаза – усиление процесса свертывания крови за счет активации тромбоцитов и целого ряда коагуляционных факторов тромбином, который образуется под влиянием комплекса ТФ-ф.VIIa.
3 фаза – распространение процесса свертывания крови с формированием теназного (ф.VIIIa/ф.IXa) и протромбиназного ф.Vа/ф.Xа/кальций/фактор III тромбоцитов) комплексов на поверхности активированных тромбоцитов. В результате образуется значительное количество тромбина («тромбиновый взрыв»), способного сформировать сгусток фибрина.
Инициация
Повреждение сосудистой стенки и/или внутрисосудистая активация клеток, экспрессирующих тканевой фактор, обеспечивает его контакт с ф. VII крови. Поскольку ТФ – интегральный мембранный белок, комплекс ТФ-ф.VIIa всегда связан с мембранной поверхностью клеток. Это важный момент, который объясняет локализацию коагуляционного каскада в зоне повреждения сосуда, то есть именно в том месте, где он необходим для остановки кровотечения.
VII крови. Поскольку ТФ – интегральный мембранный белок, комплекс ТФ-ф.VIIa всегда связан с мембранной поверхностью клеток. Это важный момент, который объясняет локализацию коагуляционного каскада в зоне повреждения сосуда, то есть именно в том месте, где он необходим для остановки кровотечения.
Активный комплекс ТФ-ф.VIIa путем ограниченного протеолиза активирует факторы X и IX. При этом образовавшийся фактор IХа мигрирует с поверхности субэндотелиальных клеток, несущих ТФ, и связывается со специфическим рецептором на активированных тромбоцитах, которые находятся в непосредственной близости в зоне повреждения сосуда. Фактор Ха, оставаясь на поверхности субэндотелиальных клеток, вместе со своим кофактором – фактором Va расщепляет протромбин с образованием небольшого количества тромбина (ф.IIа).
Таким образом, в ходе инициации происходит активное взаимодействие эндотелия, тромбоцитов и факторов свёртывания крови. Повреждение (и/или дисфункция) эндотелия сосудов вызывает адгезию и агрегацию тромбоцитов и инициирует свёртывание крови. Активированные тромбоциты способствуют образованию тромбина. В свою очередь тромбин – мощный стимулятор агрегации тромбоцитов.
Активированные тромбоциты способствуют образованию тромбина. В свою очередь тромбин – мощный стимулятор агрегации тромбоцитов.
Усиление
Небольшое количество тромбина, образовавшегося в фазу инициации, активирует тромбоциты, факторы V, VIII и XI. Тромбин способствует высвобождению фактора VIII из комплекса с фактором Виллебранда, в результате образуется ф.VIIIa. Ф.XIa приобретает способность связываться с поверхностью тромбоцитов. Активированные небольшим количеством образовавшегося в фазу инициации тромбина факторы в следующую фазу (фазу распространения) обеспечивают формирование на тромбоцитарной матрице огромного количества тромбина, которое способно перевести фибриноген в фибрин. Таким образом, вышедший из фазы инициации тромбин выступает в качестве мощного усилителя коагуляции.
Распространение
В фазу распространения на поверхности активированных тромбоцитов происходит сборка, концентрация, активация факторов свёртывания и формируется теназный (ф. VIIIa/ф.IXa) комплекс. Теназный комплекс на поверхности тромбоцитов активирует ф.X, связанный со своим кофактором ф.Va, что ведет к образованию протромбиназного (ф.Va/ф.Xa) комплекса. Образовавшийся протромбиназный комплекс, в свою очередь, обеспечивает лавинообразное нарастание уровня тромбина. Тромбин вызывает гидролиз фибриногена до фибрина, а также активирует ф.ХIII, обеспечивающий стабилизацию фибриновых нитей и образование множества ковалентных перекрёстных связей между ними; такие прочные фибриновые волокна способны удерживать тромбоцитарную массу на месте повреждения. Затем происходит ретракция кровяного сгустка. Одновременно активируется фибринолитическая система.
VIIIa/ф.IXa) комплекс. Теназный комплекс на поверхности тромбоцитов активирует ф.X, связанный со своим кофактором ф.Va, что ведет к образованию протромбиназного (ф.Va/ф.Xa) комплекса. Образовавшийся протромбиназный комплекс, в свою очередь, обеспечивает лавинообразное нарастание уровня тромбина. Тромбин вызывает гидролиз фибриногена до фибрина, а также активирует ф.ХIII, обеспечивающий стабилизацию фибриновых нитей и образование множества ковалентных перекрёстных связей между ними; такие прочные фибриновые волокна способны удерживать тромбоцитарную массу на месте повреждения. Затем происходит ретракция кровяного сгустка. Одновременно активируется фибринолитическая система.
Таким образом, по современным представлениям in vivo процесс свертывания крови является единым и связан с гемостатическими реакциями тромбоцитов. Благодаря их сложному рецепторному аппарату они не только участвуют в активации коагуляционных факторов, но и выполняют функцию регуляции всего процесса свертывания крови. Взаимосвязь тромбоцитов, факторов свертывания крови и сосудистой стенки постоянно уточняется.
Взаимосвязь тромбоцитов, факторов свертывания крови и сосудистой стенки постоянно уточняется.
любовь или ненависть – Наука – Коммерсантъ
Реакция нашего организма на появившуюся в кровотоке бактериальную инфекцию — комплексный ответ, в котором участвуют клетки и компоненты иммунной системы, системы свертывания крови, обязательно подключаются клетки эндотелия, выстилающие кровеносные сосуды, и все это дополняется ответами печени и эндокринной системы.
Фото: Виталий Волобуев, Коммерсантъ / купить фото
Фото: Виталий Волобуев, Коммерсантъ / купить фото
Даже реакция одной из перечисленных систем — системы свертывания крови — многосторонняя. Система свертывания крови традиционно делится на два взаимосвязанных звена — тромбоцитарное и плазменное. Тромбоцитарное свертывание — это активация, адгезия (прилипание) к поверхности и агрегация (слипание друг с другом) клеток — тромбоцитов.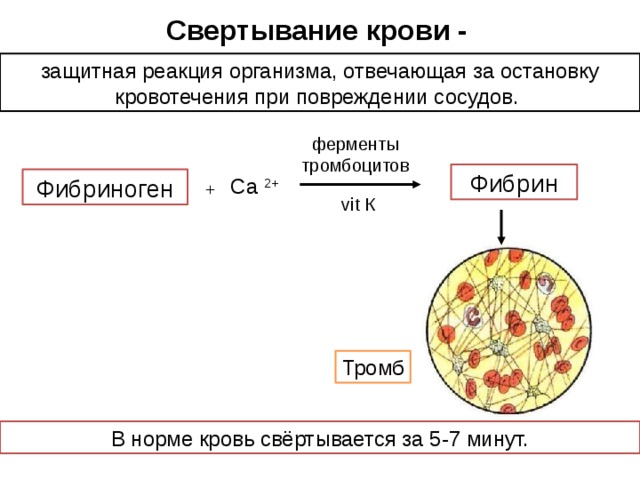 Плазменное свертывание — это последовательная активация белков-протеаз (ферменты, расщепляющие другие белки), приводящая к полимеризации белка плазмы крови фибриногена в длинные разветвленные нити фибрина и образованию сгустка (этот процесс напоминает образование желе).
Плазменное свертывание — это последовательная активация белков-протеаз (ферменты, расщепляющие другие белки), приводящая к полимеризации белка плазмы крови фибриногена в длинные разветвленные нити фибрина и образованию сгустка (этот процесс напоминает образование желе).
На бактериальную инфекцию реагирует оба звена свертывания крови. Тромбоциты образуют агрегаты вокруг бактерий и могут их поглощать (фагоцитоз). Также тромбоциты «узнают» бактериальные паттерны и выпускают тромбоцитарные антимикробные вещества. Во всех перечисленных случаях тромбоциты запускают активацию иммунной системы организма. В свою очередь, бактерии образуют колонии на тромбоцитах и тромбах, таким образом закрепляясь в кровотоке. Свертывание плазмы не менее сложно взаимодействует с бактериальной инфекцией: кроме запуска от чужеродной поверхности — бактериальной стенки, образование фибринового сгустка запускается специфическими бактериальными протеазами, также подавляющими фибринолиз — физиологический процесс деградации тромбов.
Наша команда, базирующаяся в Национальном медицинском исследовательском центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, исследует все аспекты активации системы свертывания крови как при физиологических процессах, так и при патологии. Один из проектов, который мы вели несколько лет, был посвящен вопросам ответа системы свертывания крови на липополисахариды (ЛПС) — компоненты клеточной стенки грамотрицательных бактерий (например, кишечной палочки). Уровень этого ответа оказывается жизненно важным при острых бактериальных инфекциях, вызывающих спонтанную коагуляцию крови — диссеминированное внутрисосудистое свертывание (ДВС), когда слишком бурная реакция системы приводит к резкому снижению концентрации белков и тромбоцитов и, как следствие, геморрагии в сочетании с нарушением микроциркуляции в органах. В настоящее время в клинической практике лечение ДВС в зависимости от фазы проводится антиагрегантами (такими как аспирин), антикоагулянтами (производные гепарина), компонентами плазмы и тромбоконцентратами, то есть лечение не нормализует свертывание, а сдвигает баланс в сторону его ослабления или усиления (подробнее — «Практическая коагулология», ред.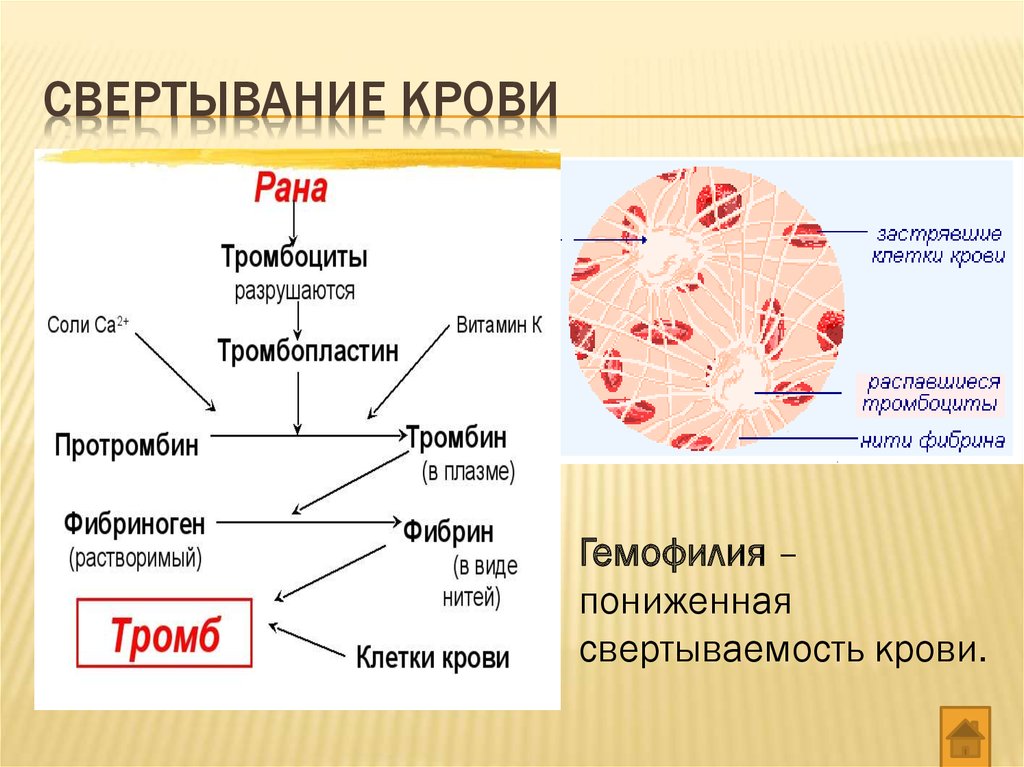
В этом проекте мы стартовали с взаимодействия плазменного звена свертывания крови с ЛПС. После нескольких серий экспериментов мы пришли к выводу, что воздействие ЛПС является достаточно слабым и сильно зависит от донора. При анализе данных с помощью компьютерного моделирования был сделан вывод, что свертывание крови может «стартовать» с образованных (в результате работы иммунной системы) агрегатов ЛПС, однако одиночные молекулы ЛПС, связываясь с белками-протеазами, скорее подавляют свертывание крови.
Отдельно рассматривались механизмы активации свертывания крови в результате вызванного бактериями воспаления, когда либо сами клетки эндотелия, либо клетки иммунной системы на своей поверхности выставляют белок — тканевый фактор, запускающий всю систему свертывания крови. С помощью компьютерного моделирования мы показали, что при гибели таких клеток, когда образуется множество мембранных везикул — «пузырьков» размером 10–100 нм, свертывание плазмы крови запускается наиболее интенсивно из-за повышенной аффинности («любви») протеаз свертывания к искривленной поверхности.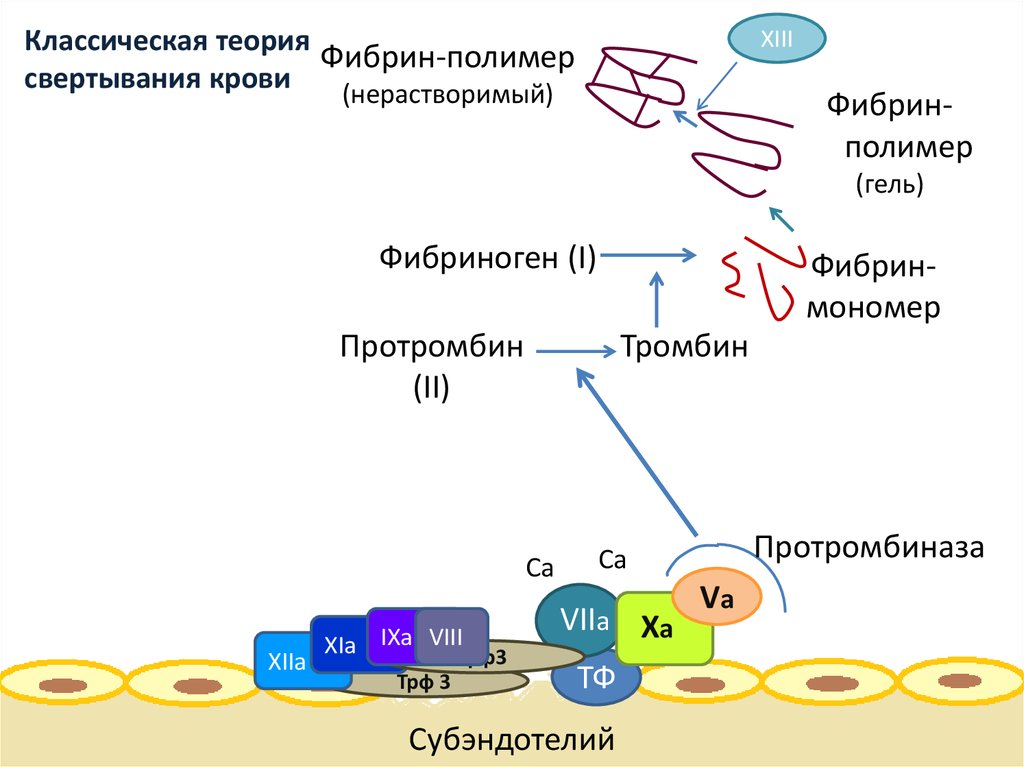
Клетки крови, тромбоциты, могут взаимодействовать с ЛПС через специальные белки-рецепторы на своей поверхности, так называемые Toll-подобные рецепторы. Кстати, такие же рецепторы отвечают за активацию ЛПС клеток иммунной системы и приводят к развитию воспаления. Однако, к нашему удивлению, для тромбоцитов прямой активации ЛПС мы не смогли идентифицировать, несмотря на наличие функциональных Toll-подобных рецепторов. После множества экспериментов в коллаборации с группой профессора С. П. Гамбаряна из Института эволюционной физиологии и биохимии им. И. М. Сеченова (Санкт-Петербург) мы показали, что ЛПС даже вызывают небольшое подавление активации тромбоцитов.
Таким образом, мы получили, что компоненты бактериальной клеточной стенки, липополисахариды, сами по себе либо не воздействуют на систему свертывания крови, либо вызывают подавление активации свертывания. Такое поведение — подавление свертывания крови — характерно для многих бактерий, ведь образование тромба вокруг бактерии может помешать ее распространению в организме.
Результаты получены в рамках проекта «Выявление мишеней для фармакологического воздействия на свертывание крови при бактериальной инфекции», поддержанного совместно РФФИ и правительством Москвы.
Анастасия Свешникова, руководитель проекта, д.ф.-м.н., в.н.с. лаборатории клеточного гемостаза и тромбоза НМИЦ ДГОИ
Сгустки крови — Hematology.org
Свертывание крови или коагуляция — это важный процесс, который предотвращает чрезмерное кровотечение при повреждении кровеносного сосуда. Тромбоциты (разновидность клеток крови) и белки в плазме (жидкой части крови) работают вместе, чтобы остановить кровотечение, образуя сгусток на месте повреждения.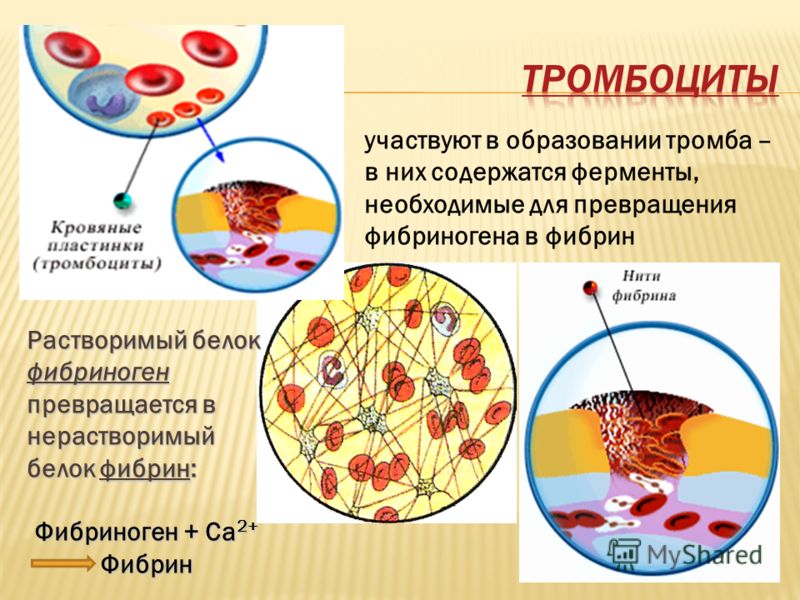 Как правило, ваше тело естественным образом растворяет сгусток крови после заживления травмы. Однако иногда сгустки образуются на внутренней стороне сосудов без явного повреждения или не растворяются естественным путем. Эти ситуации могут быть опасными и требуют точной диагностики и соответствующего лечения.
Как правило, ваше тело естественным образом растворяет сгусток крови после заживления травмы. Однако иногда сгустки образуются на внутренней стороне сосудов без явного повреждения или не растворяются естественным путем. Эти ситуации могут быть опасными и требуют точной диагностики и соответствующего лечения.
Сгустки могут образовываться в венах или артериях, которые являются сосудами, входящими в систему кровообращения организма. Хотя оба типа сосудов помогают переносить кровь по всему телу, каждый из них функционирует по-разному. Вены — это сосуды с низким давлением, которые переносят деоксигенированную кровь от органов тела обратно к сердцу. Аномальный сгусток, который образуется в вене, может ограничивать возврат крови к сердцу и может вызывать боль и отек, когда кровь собирается позади сгустка. Тромбоз глубоких вен (ТГВ) — это тип тромба, который образуется в крупной вене ноги или, реже, в руке, тазу или других крупных венах тела. В некоторых случаях сгусток в вене может отделиться от точки своего происхождения и пройти через сердце в легкие, где он заклинивается, препятствуя адекватному кровотоку. Это называется легочной (легочной) эмболией (ТЭЛА) и может быть чрезвычайно опасным.
Это называется легочной (легочной) эмболией (ТЭЛА) и может быть чрезвычайно опасным.
Подсчитано, что каждый год ТГВ поражает до 900 000 1 человек в Соединенных Штатах и убивает до 100 000 человек. 2 Несмотря на распространенность этого состояния, население практически не осведомлено о факторах риска и симптомах ТГВ/ТЭЛА. Вы понимаете свой риск? Ознакомьтесь с пятью распространенными мифами ASH о ТГВ.
Как ТГВ может привести к легочной эмболии
Артерии, с другой стороны, представляют собой мышечные сосуды с высоким давлением, которые переносят богатую кислородом и питательными веществами кровь от сердца к другим частям тела. Когда ваш врач измеряет ваше кровяное давление, результаты теста являются индикатором давления в ваших артериях. Свертывание, возникающее в артериях, обычно связано с атеросклерозом (уплотнением артерий), отложением бляшек, которые сужают внутреннюю часть сосуда. По мере сужения артериального прохода сильные артериальные мышцы продолжают проталкивать кровь через отверстие, а высокое давление может привести к разрыву бляшки. Молекулы, высвобождаемые при разрыве, вызывают чрезмерную реакцию организма и образование ненужного тромба в артерии, что может привести к сердечному приступу или инсульту. Когда кровоснабжение сердца или мозга полностью блокируется тромбом, часть этих органов может быть повреждена в результате лишения крови и ее питательных веществ.
По мере сужения артериального прохода сильные артериальные мышцы продолжают проталкивать кровь через отверстие, а высокое давление может привести к разрыву бляшки. Молекулы, высвобождаемые при разрыве, вызывают чрезмерную реакцию организма и образование ненужного тромба в артерии, что может привести к сердечному приступу или инсульту. Когда кровоснабжение сердца или мозга полностью блокируется тромбом, часть этих органов может быть повреждена в результате лишения крови и ее питательных веществ.
Сгустки крови: путешествие пациента
Я в опасности?
Факторы риска развития венозного тромба отличаются от факторов риска артериального тромба, и люди, подверженные риску образования одного из них, не обязательно подвержены риску возникновения другого. Различные факторы риска или события могут вызвать неестественное свертывание крови; однако каждый фактор может инициировать свертывание по-разному. В вашей системе есть молекулы, которые сигнализируют вашему телу, чтобы сообщить ему, когда, где и как быстро сформировать тромб, и генетика играет роль в том, как быстро ваше тело реагирует на эти сигналы. Некоторые факторы риска, такие как ожирение, замедляют ток крови в венах, в то время как другие, например возраст, могут повышать естественную способность организма к свертыванию крови. Даже некоторые лекарства могут повлиять на скорость свертывания крови.
В вашей системе есть молекулы, которые сигнализируют вашему телу, чтобы сообщить ему, когда, где и как быстро сформировать тромб, и генетика играет роль в том, как быстро ваше тело реагирует на эти сигналы. Некоторые факторы риска, такие как ожирение, замедляют ток крови в венах, в то время как другие, например возраст, могут повышать естественную способность организма к свертыванию крови. Даже некоторые лекарства могут повлиять на скорость свертывания крови.
Следующие факторы повышают риск образования тромба:
- Ожирение
- Беременность
- Неподвижность (включая длительное бездействие, длительные поездки на самолете или автомобиле)
- Курение
- Оральные контрацептивы
- Некоторые виды рака
- Травма
- Некоторые операции
- Возраст (повышенный риск для людей старше 60 лет)
- Тромбоз в семейном анамнезе
- Хронические воспалительные заболевания
- Диабет
- Высокое кровяное давление
- Высокий уровень холестерина
- Предварительное размещение центральной линии
Каковы симптомы тромба?
В дополнение к знанию своих факторов риска также важно знать о симптомах тромбов, которые различаются в зависимости от того, где находится тромб:
- Сердце – тяжесть или боль в груди, дискомфорт в других областях верхняя часть тела, одышка, потливость, тошнота, головокружение
- Мозг — слабость лица, рук или ног, трудности с речью, проблемы со зрением, внезапная и сильная головная боль, головокружение
- Рука или нога — внезапная или постепенная боль, отек, болезненность и повышение температуры
- Легкие — острая боль в груди, учащенное сердцебиение, одышка, потливость, лихорадка, кашель с кровью
- Живот — сильная боль в животе, рвота, диарея
Как лечат тромбы?
Сгустки крови обрабатываются по-разному в зависимости от местоположения сгустка и состояния вашего здоровья.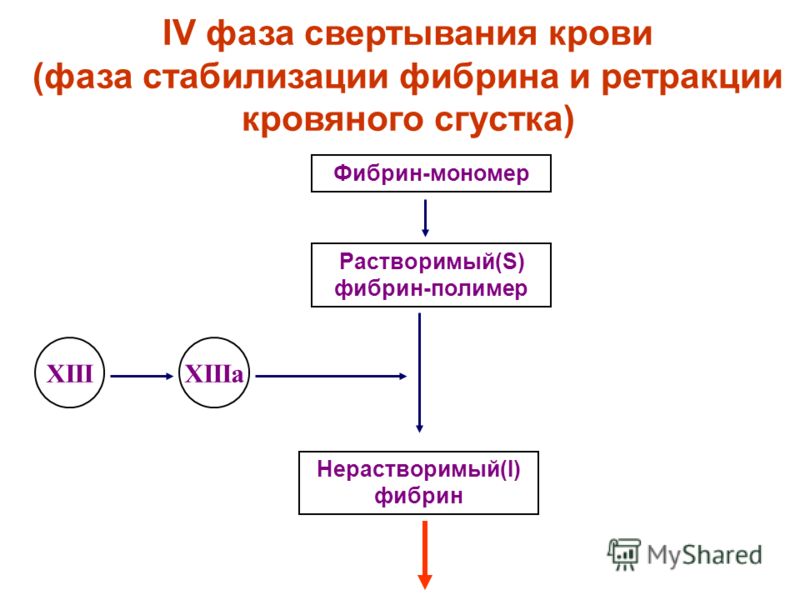 Если вы испытываете симптомы и подозреваете, что у вас может быть тромб, немедленно обратитесь к врачу.
Если вы испытываете симптомы и подозреваете, что у вас может быть тромб, немедленно обратитесь к врачу.
Было достигнуто множество научных достижений, которые улучшили профилактику и лечение тромбов. Некоторые современные методы лечения включают:
- Антикоагулянты – лекарства, препятствующие образованию тромбов
- Тромболитики — лекарства, растворяющие тромбы
- Тромболизис под катетером — процедура, при которой длинная трубка, называемая катетером, вводится хирургическим путем и направляется к тромбу, где по нему доставляется лекарство, растворяющее тромб
- Тромбэктомия – хирургическое удаление тромба
Если у вас диагностирован венозный тромб, врач может направить вас к гематологу, врачу, специализирующемуся на лечении заболеваний крови. Людям с диагнозом артериального заболевания, которые подвержены риску образования тромбов в артериях, могут оказывать помощь несколько врачей, в том числе кардиолог (врач, специализирующийся на заболеваниях сердца), невролог и, возможно, гематолог.
Для некоторых пациентов участие в клинических испытаниях открывает доступ к новым методам лечения. Если вам поставили диагноз, вы можете поговорить со своим врачом о том, подходит ли вам участие в клиническом испытании.
Можно ли предотвратить образование тромбов?
Тромбы относятся к наиболее предотвратимым заболеваниям крови. Есть несколько способов снизить вероятность образования тромба, например, по возможности контролировать факторы риска. Если вы считаете, что можете подвергаться риску из-за генетических или поведенческих факторов, поговорите со своим врачом. Кроме того, убедитесь, что ваш врач знает обо всех лекарствах, которые вы принимаете, и о любых семейных историях нарушений свертываемости крови.
Тромботическая тромбоцитопеническая пурпура: история пациента
Где я могу найти дополнительную информацию?
Если вы обнаружите, что вам интересно узнать больше о заболеваниях и расстройствах крови, вот несколько других ресурсов, которые могут вам помочь:
Результаты клинических исследований, опубликованные в официальный журнал ASH, для результатов последних исследований крови.
 В то время как последние статьи обычно требуют входа в систему подписчика, пациенты, заинтересованные в просмотре статьи с ограниченным доступом в Blood может получить копию, отправив запрос по электронной почте в Blood Publishing Office.
В то время как последние статьи обычно требуют входа в систему подписчика, пациенты, заинтересованные в просмотре статьи с ограниченным доступом в Blood может получить копию, отправив запрос по электронной почте в Blood Publishing Office.Группы пациентов
Список веб-ссылок на группы пациентов и другие организации, предоставляющие информацию.
Ссылки
- Beckman et al. Венозная тромбоэмболия: проблема общественного здравоохранения. AJPM, апрель 2010 г.
- Раскоб и др. Наблюдение за тромбозом глубоких вен и легочной эмболией: рекомендации национального семинара. AJPM, апрель 2010 г.
Связанный контент
- ТГВ: мифы и факты
Тромбоз глубоких вен (ТГВ) ежегодно поражает тысячи людей в Соединенных Штатах, но, несмотря на распространенность этого состояния, население в значительной степени не осведомлено о факторах риска и симптомах ТГВ/ТЭЛА. Вы понимаете свой риск? Ознакомьтесь с пятью распространенными мифами ASH о ТГВ.

Процесс свертывания крови
- Скачать PDF Копировать
Анжела Бетсайда Б. Лагуипо, BSN Рецензент Суша Чериедат, M.Sc.
Кровь течет по кровеносным сосудам, доставляя необходимый кислород и питательные вещества к различным клеткам организма. Процесс свертывания крови или коагуляция является важным процессом, который предотвращает чрезмерное наращивание в случае повреждения кровеносного сосуда. Он играет решающую роль в восстановлении кровеносных сосудов.
Что такое свертывание крови?
Коагуляция, также известная как свертывание крови, играет ключевую роль в восстановлении кровеносных сосудов. Сердце перекачивает кровь по всему телу с помощью артерий, а кровь, в свою очередь, возвращается к сердцу по венам. Когда кровеносные сосуды повреждаются, это запускает процесс свертывания крови. Таким образом, тело восстановит повреждение, чтобы остановить кровоизлияние или кровотечение.
Например, повреждение происходит в слизистой оболочке кровеносных сосудов, тромбоциты образуют начальную пробку на пораженном участке. Они инициируют процесс свертывания с помощью определенных факторов свертывания крови, вырабатываемых в организме.
Медицинская концепция закупорки артерий и атеросклероза с трехмерной человеческой артерией с клетками крови, которая блокируется накоплением бляшек холестерина как символ сосудистых заболеваний. Изображение предоставлено: Lightspring / Shutterstock
Что такое факторы свертывания крови?
Похожие статьи
- Новое приложение для смартфонов может распознавать распространенные симптомы инсульта в режиме реального времени
- Примерно у 1 из 5 перенесших инсульт обнаруживаются нерегулярные сердечные ритмы
- Новое исследование по изучению эффективности лечения инсульта у пациентов с ограниченными возможностями
Факторы свертывания крови — это компоненты плазмы, которые связаны с процессом свертывания крови. Эти факторы названы и пронумерованы на основе их открытия. Хотя всего 13 цифр, факторов свертывания всего 2. Было обнаружено, что фактор VI является частью другого фактора.
Эти факторы названы и пронумерованы на основе их открытия. Хотя всего 13 цифр, факторов свертывания всего 2. Было обнаружено, что фактор VI является частью другого фактора.
Факторами свертывания крови являются фактор I (фибриноген), фактор II (протромбин), фактор III (тканевой тромбопластин или тканевой фактор), фактор IV (ионизированный кальций), фактор V (лабильный фактор или проакцелерин), фактор VII (стабильный фактор или проконвертин) и фактор VIII (антигемофильный фактор). Кроме того, факторы свертывания также включают фактор IX (компонент тромбопластина плазмы или фактор Кристмаса), фактор X (фактор Стюарта-Пруэра), фактор XI (предшественник тромбопластина плазмы), фактор XII (фактор Хагемана) и фактор XIII (стабилизирующий фибрин). фактор).
Печень использует витамин К для производства некоторых факторов, таких как факторы II, VII, IX и X. Обычно витамин К может поступать с пищей из растительных и животных источников. Нормальная флора кишечника также вырабатывает витамин К.
Процесс свертывания крови
Гемостаз — это способ организма остановить кровотечение из поврежденных кровеносных сосудов. Одним из важнейших звеньев гемостаза является свертывание крови. Впоследствии организму необходимо контролировать механизмы контроля и ограничения свертывания крови. К ним относятся растворение избыточных сгустков, которые больше не нужны. Когда есть аномалия в любой части системы, контролирующей кровотечение, это может привести к кровотечению или чрезмерному свертыванию крови. Они потенциально опасны для жизни.
Чрезмерное свертывание крови может привести к инсульту и сердечным приступам, поскольку сгустки крови могут перемещаться и закупоривать сосуды. С другой стороны, плохая свертываемость может привести к сильной кровопотере даже при незначительном повреждении кровеносных сосудов.
Гемостаз включает три основных процесса, а именно сужение кровеносных сосудов, активность тромбоцитов и активность белков, содержащихся в крови (факторов свертывания крови).
Травма
Первой фазой процесса свертывания крови является травма или повреждение кровеносного сосуда. Это может быть небольшой разрыв в стенке кровеносного сосуда, который может привести к кровотечению.
Сужение кровеносных сосудов
Тело сужает кровеносные сосуды, чтобы контролировать кровопотерю. Это ограничит приток крови к пораженному участку.
Пробка для тромбоцитов
В ответ на травму организм активирует тромбоциты. В то же время из небольших мешочков в тромбоцитах высвобождаются химические сигналы, привлекающие в эту область другие клетки. Они образуют тромбоцитарную пробку, образуя сгусток вместе. Белок, называемый фактором фон Виллебранда (VWF), помогает тромбоцитам склеиваться.
Сгусток фибрина
При повреждении кровеносного сосуда активируются факторы свертывания или факторы свертывания крови. Белки фактора свертывания крови стимулируют выработку фибрина, который представляет собой прочное нитевидное вещество, образующее фибриновый сгусток. В течение нескольких дней или недель этот фибриновый сгусток укрепляется, а затем растворяется, когда стенки поврежденных кровеносных сосудов закрываются и заживают.
В течение нескольких дней или недель этот фибриновый сгусток укрепляется, а затем растворяется, когда стенки поврежденных кровеносных сосудов закрываются и заживают.
Свертывание крови является важным процессом, который может помочь предотвратить потерю крови из-за травмы. Если есть аномалия в какой-либо части процесса, это может привести к опасным осложнениям, таким как сильная кровопотеря. Обычно люди с нарушениями свертываемости крови находятся под пристальным наблюдением, чтобы предотвратить травмы и кровотечения.
Источники:
- http://www.hematology.org/Patients/Clots/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4260295/
- https://www.cdc.gov/ncbddd/hemophilia/facts.html
- web.duke.edu/…/02.15.1_Thrombosis_I_or_Hemostasis_FINAL.pdf
Дополнительная литература
- Все содержимое тромба
- Что такое тромб?
- Лечение тромбов
- Прогноз тромбообразования
- Риск образования тромбов и оральные противозачаточные таблетки
Последнее обновление: 26 июля 2021 г.


Leave A Comment