Тест по биологии «Плоские черви»
Тесты для проверки знаний по теме «Плоские черви».
Задание 1
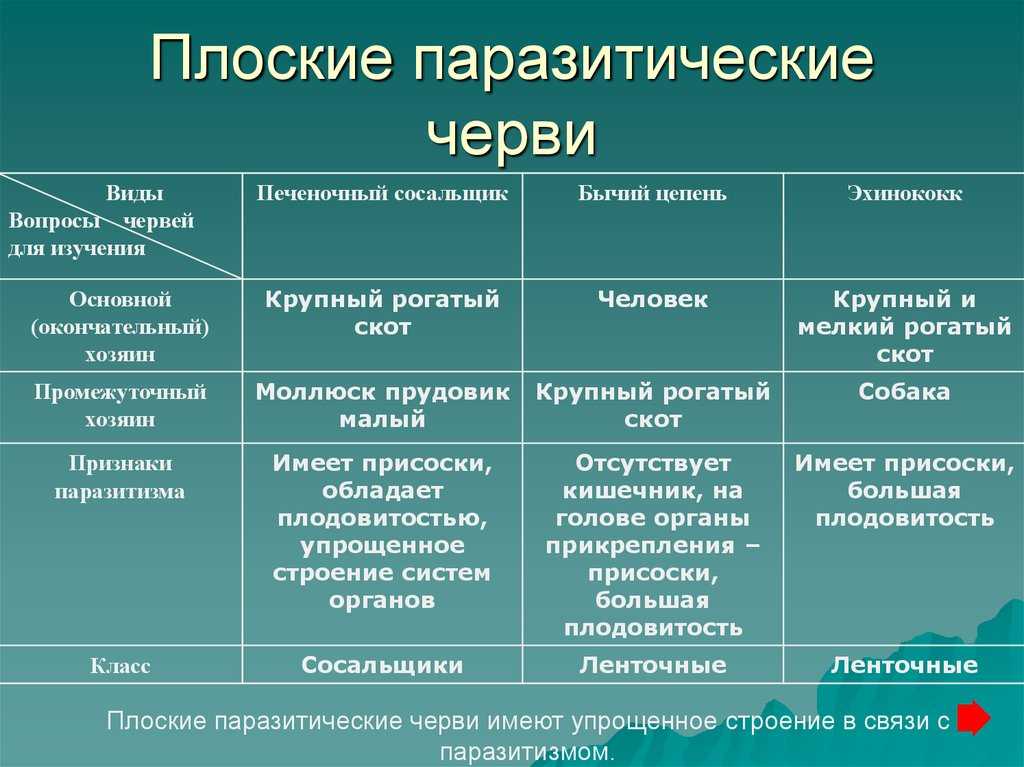
У животных-паразитов, по сравнению со свободноживущими, в процессе эволюции произошло
1) усложнение строения и жизнедеятельности
2) упрощение строения и жизнедеятельности
3) усложнение строения, но упрощение жизнедеятельности
4) упрощение строения, но усложнение жизнедеятельности
Показать пояснение
Задание 2
Заражение человека бычьим цепнем может произойти при употреблении
1) в пищу немытых овощей
2) воды из стоячего водоема
3) мяса, зараженного его личинками
4) плохо вымытой посуды, которой пользовался больной
Задание 3.
У червей-паразитов со сменой хозяев половое размножение происходит в
1) организме основного хозяина
2) организме промежуточного хозяина
3) наземно-воздушной среде
4) почве и водной среде
Задание 4
Какое животное является промежуточным хозяином печеночного сосальщика
1) собака
2) человек
3) корова
4) малый прудовик
Задание 5.
Белая планария отличается от медузы аурелии
1) способностью к половому размножению
2) многоклеточностью
3) наличием нервных клеток
4) типом симметрии
Задание 6.
В процессе эволюции три слоя клеток впервые возникли у червей
1) круглых
2) плоских
3) малощетинковых
4) многощетинковых
Задание 7.
Какую функцию выполняют органы бычьего цепня, обозначенные
на рисунке вопросительным знаком?
1) прикрепление червя к стенке кишечника хозяина
2) всасывание питательных веществ из кишечника хозяина
3) поглощение частиц пищи и их переваривание
4) выделение веществ, защищающих тело от переваривания
Задание 8.
Основным хозяином паразита называют организм,
1) для которого характерно бесполое размножение
2) в котором происходит половое размножение паразита
3) которому паразит приносит наибольший вред
4) в котором поселяется личинка паразита
Задание 9.
У свободноживущего плоского червя белой планарии, в отличие от печёночного сосальщика,
1) тело имеет двустороннюю симметрию
2) жизненный цикл происходит со сменой хозяев
3) имеется выделительная система
4) нервная система и органы чувств лучше развиты
Задание 10 .
Чей цикл развития представлен на рисунке?
1) печеночного сосальщика
2) бычьего цепня
3) гидроидного полипа
4) яйца акулы
Задание 11 . Какое из перечисленных животных не имеет анального отверстия
1) аскарида
2) ланцетник
3) белая планария
4) дождевой червь
Задание 12 .
Личинка широкого лентеца развивается в теле
1) собаки
2) человека
3) малого прудовика
4) циклопа и рыбы
Задание 13
Финны эхинококка образуются
1) в головном мозге
2) в лёгких
3) в печени
4) во всех перечисленных органах
Задание 14
Взаимодействие человека и бычьего цепня называется
1) симбиозом
2) хищничеством
3) паразитизмом
4) протокооперацией
Задание 15
Стенка тела плоских червей представлена
1) только кожей
2) наружным хитиновым скелетом
3) раковиной
4) кожно-мускульным мешком
Задание 16
Свободноживущим видом является
1) планария
2) широкий лентец
3) эхинококк
4) двуустка
Задание 17
. Внутренние органы белой планарии помещаются
Внутренние органы белой планарии помещаются
1) в первичной полости тела
2) во вторичной полости тела
3) в рыхлой паренхиме
4) в кишечной полости
Задание 18
Дыхание планарии происходит
1) диффузно через покровы тела
2) с помощью наружных выростов – жабр
3) с помощью внутренних жабр
4) с помощью лёгочных мешков
Задание 19
. Нервная система плоских червей
1) диффузного типа
2) лестничного типа
3) трубчатого типа
4) отсутствует
Задание 20
Основным хозяином бычьего цепня является
1) бык
2) человек
3) овца
4) лошадь
Задание 21
Финна бычьего цепня обычно развивается
1) во внешней среде
2) в мышцах и внутренних органах человека
3) в мышцах и внутренних органах коровы
4) в мышцах и внутренних органах собаки
Показать пояснение
Последние публикации в коллективном блоге:Интернет-порталы, которые помогут вам успешно сдать ЕГЭ. 1 / Автор: Miriada 1 / Автор: MiriadaЕсли бы вы инвестировали 00 в Amazon 10 лет назад, вот сколько у вас было бы сейчас 2 / Автор: admin Методические рекомендации для выпускников по самостоятельной подготовке к ЕГЭ 2 / Автор: admin В Минпросвещения допустили повторный перенос даты сдачи ЕГЭ 1 / Автор: admin ЕГЭ не отменят из-за коронавируса, но проведут позже 1 / Автор: admin Рособрнадзор будет выявлять нарушения во время ЕГЭ 2020 с помощью нейросетей 1 / Автор: admin ФИПИ опубликовал проекты контрольных измерительных материалов ЕГЭ-2020, существенных изменений нет 4 / Автор: admin Рособрнадзор проанализировал поступившие предложения по совершенствованию ЕГЭ 2 / Автор: admin Посещаемые разделы форума: Последние обсуждаемые темы на форуме:Детские игровые комплексы 0 / Раздел: Помогаем друг другуМягкая кровать без изголовья 2 / Раздел: Помогаем друг другу Очень нужно купить права на трактор 0 / Раздел: Помогаем друг другу кто знает бактерицидные лампы где можно приобрести? 2 / Раздел: Помогаем друг другу мне нужен магазин со стройматериалами 3 / Раздел: Помогаем друг другу Можно ли накрутить голосование в конкурсе? 4 / Раздел: Помогаем друг другу Управление медиафайлами 0 / Раздел: Помогаем друг другу Скажите, пожалуйста, вот в маршрутках в которых мы ездим 3 / Раздел: ВУЗЫ РОССИИ Изучение итальянского языка 5 / Раздел: Помогаем друг другу |
|
Об обратимости паразитизма: приспособление к свободному образу жизни путем приобретения генов у дипломонад Trepomonas sp. PC1
1. Пулин Р. Эволюционная экология паразитов. Принстон: Издательство Принстонского университета; 2007. [Google Scholar]
2. Poulin R, Randhawa HS. Эволюция паразитизма по конвергентным линиям: от экологии к геномике. Паразитология. 2015;142:S6–15. doi: 10.1017/S0031182013001674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Heinz E, Williams TA, Nakjang S, Noel CJ, Swan DC, Goldberg AV, et al. Геном облигатного внутриклеточного паразита Trachipleistophora hominis : новый взгляд на динамику генома микроспоридий и редуктивную эволюцию. PLoS Патог. 2012;8:e1002979. doi: 10.1371/journal.ppat.1002979. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Патог. 2012;8:e1002979. doi: 10.1371/journal.ppat.1002979. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Rohmer L, Hocquet D, Miller SI. Болезнетворные бактерии просто ищут пищу? Метаболизм и микробный патогенез. Тенденции микробиол. 2011;19: 341–8. doi: 10.1016/j.tim.2011.04.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Джексон А., Отто Т., Аслетт М., Армстронг С., Бринго Ф., Шлахт А. и др. Филогеномика кинетопластид выявляет эволюционные новшества, связанные с истоками паразитизма. Карр Биол. 2016;26:161–72. doi: 10.1016/j.cub.2015.11.055. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Woo YH, Ansari H, Otto TD, Klinger CM, Kolisko M, Michálek J, et al. Геномы хромрид раскрывают эволюционный путь от фотосинтезирующих водорослей к облигатным внутриклеточным паразитам. электронная жизнь. 2015;4:e06974. doi: 10.7554/eLife.06974. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Gould SJ. Долло о законе Долло: необратимость и статус эволюционных законов. Журнал истории биологии. 1970; 3: 189–212. doi: 10.1007/BF00137351. [PubMed] [CrossRef] [Google Scholar]
Gould SJ. Долло о законе Долло: необратимость и статус эволюционных законов. Журнал истории биологии. 1970; 3: 189–212. doi: 10.1007/BF00137351. [PubMed] [CrossRef] [Google Scholar]
8. Cruickshank RH, Paterson AM. Великий побег: нарушают ли паразиты закон Долло? Тенденции Паразитол. 2006; 22: 509–15. doi: 10.1016/j.pt.2006.08.014. [PubMed] [CrossRef] [Google Scholar]
9. Доррис М., Вини М.Э., Блакстер М.Л. Молекулярно-филогенетический анализ рода Strongyloides и родственные нематоды. Int J Паразитол. 2002; 32: 1507–17. doi: 10.1016/S0020-7519(02)00156-X. [PubMed] [CrossRef] [Google Scholar]
10. Климов П.Б., О.Коннор Б. Обратим ли перманентный паразитизм? – важные доказательства ранней эволюции клещей домашней пыли. Сист биол. 2013;62:411–23. doi: 10.1093/sysbio/syt008. [PubMed] [CrossRef] [Google Scholar]
11. Siddall ME, Brooks DR, Desser SS. Филогения и обратимость паразитизма. Эволюция. 1993; 47: 308–13. дои: 10.2307/2410138. [PubMed] [CrossRef] [Академия Google]
12. Брюгеролл Г., Ли Дж.Дж. Заказать Дипломонадида. В: Lee JJ, Leedale GF, Bradbury P, редакторы. Иллюстрированный справочник по простейшим. 2-е изд. Лоуренс: Общество протозоологов; 2002. с. 1125–35.
Брюгеролл Г., Ли Дж.Дж. Заказать Дипломонадида. В: Lee JJ, Leedale GF, Bradbury P, редакторы. Иллюстрированный справочник по простейшим. 2-е изд. Лоуренс: Общество протозоологов; 2002. с. 1125–35.
13. Adl SM, Simpson AG, Lane CE, Lukes J, Bass D, Bowser SS, et al. Пересмотренная классификация эукариот. Дж Эукариот микробиол. 2012; 59: 429–514. doi: 10.1111/j.1550-7408.2012.00644.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Monis PT, Caccio SM, Thompson RC. Вариация на Giardia : к таксономической ревизии рода. Тенденции Паразитол. 2009; 25:93–100. doi: 10.1016/j.pt.2008.11.006. [PubMed] [CrossRef] [Google Scholar]
15. Caccio SM, Ryan U. Молекулярная эпидемиология лямблиоза. Мол Биохим Паразитол. 2008; 160:75–80. doi: 10.1016/j.molbiopara.2008.04.006. [PubMed] [CrossRef] [Google Scholar]
16. Jørgensen A, Sterud E. Морской патогенный генотип Spironucleus barkhanus из выращиваемых лососевых, переописанный как Spironucleus salmonicida н. сп. Дж Эукариот микробиол. 2006; 53: 531–41. doi: 10.1111/j.1550-7408.2006.00144.x. [PubMed] [CrossRef] [Google Scholar]
сп. Дж Эукариот микробиол. 2006; 53: 531–41. doi: 10.1111/j.1550-7408.2006.00144.x. [PubMed] [CrossRef] [Google Scholar]
17. Стеруд Э., Мо Т.А., Поппе Т.Т. Системный спиронуклеоз у разводимого в море атлантического лосося Salmo salar , вызванный Spironucleus barkhanus , передающимся от диких арктических гольцов Salvelinus alpinus ? Орган «Дис Аква». 1998; 33: 63–6. doi: 10.3354/dao033063. [PubMed] [CrossRef] [Google Scholar]
18. Sterud E, Poppe TT, Bornø G. Внутриклеточная инфекция с Spironucleus barkhanus (Diplomonadida, Hexamitidae) в выращиваемом арктическом гольце Salvelinus alpinus . Дис Аква Орг. 2003; 56: 155–61. doi: 10.3354/dao056155. [PubMed] [CrossRef] [Google Scholar]
19. Morrison HG, McArthur AG, Gillin FD, Aley SB, Adam RD, Olsen GJ, et al. Геномный минимализм у раннего дивергирующего кишечного паразита Giardia lamblia . Наука. 2007; 317:1921–6. doi: 10.1126/science.1143837. [PubMed] [CrossRef] [Google Scholar]
20. Xu F, Jerlström-Hultqvist J, Einarsson E, Astvaldsson A, Svärd SG, Andersson JO. Геном Spironucleus salmonicida выделяет рыбный патоген, адаптированный к изменчивой среде. Генетика PLoS. 2014;10:e1004053. doi: 10.1371/journal.pgen.1004053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Xu F, Jerlström-Hultqvist J, Einarsson E, Astvaldsson A, Svärd SG, Andersson JO. Геном Spironucleus salmonicida выделяет рыбный патоген, адаптированный к изменчивой среде. Генетика PLoS. 2014;10:e1004053. doi: 10.1371/journal.pgen.1004053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Lundin D, Torrents E, Poole AM, Sjoberg BM. RNRdb, курируемая база данных универсального семейства ферментов рибонуклеотидредуктазы, показывает высокий уровень ошибочных аннотаций в последовательностях, депонированных в Genbank. Геномика BMC. 2009;10:589. дои: 10.1186/1471-2164-10-589. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Колиско М., Зильберман Дж. Д., Чепицка И., Юбуки Н., Такисита К., Ябуки А. и соавт. Большое разнообразие ранее не выявленных свободноживущих родственников дипломонад, выделенных из морских/соленых местообитаний. Окружающая среда микробиол. 2010;12:2700–10. [PubMed] [Google Scholar]
23. Takishita K, Kolisko M, Komatsuzaki H, Yabuki A, Inagaki Y, Cepicka I, et al. Мультигенные филогении разнообразных Carpediemonas -подобных организмов определяют ближайших родственников «амитохондриальных» дипломонад и ретортамонад. Протист. 2012; 163:344–55. doi: 10.1016/j.protis.2011.12.007. [PubMed] [CrossRef] [Академия Google]
Мультигенные филогении разнообразных Carpediemonas -подобных организмов определяют ближайших родственников «амитохондриальных» дипломонад и ретортамонад. Протист. 2012; 163:344–55. doi: 10.1016/j.protis.2011.12.007. [PubMed] [CrossRef] [Академия Google]
24. Адам Р.Д. Биология Giardia lamblia . Clin Microbiol Rev. 2001; 14:447–75. doi: 10.1128/CMR.14.3.447-475.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Ankarklev J, Jerlström-Hultqvist J, Ringqvist E, Troell K, Svärd SG. За улыбкой: клеточная биология и механизмы заболеваний видов Giardia . Nat Rev Microbiol. 2010;8:413–22. [PubMed] [Google Scholar]
26. Williams CF, Lloyd D, Poynton SL, Jorgensen A, Millet COM, Cable J. Spironucleus видов: экономически важные патогены рыб и загадочные одноклеточные эукариоты. J Aquac Res Devel. 2011; С2: 002. http://www.omicsonline.org/spironucleus-species-economically-important-fish-pathogens-and-enigmatic-single-celled-eukaryotes-2155-9546. S2-002.php?aid=2762.
S2-002.php?aid=2762.
27. Пойнтон С.Л., Фрейзер В., Фрэнсис-Флойд Р., Рутледж П., Рид П., Нерад Т.А. Spironucleus vortens n. сп. из пресноводной рыбы-ангела Pterophyllum scalare . Морфология и культура. Дж Эукариот микробиол. 1995;42:731–42. doi: 10.1111/j.1550-7408.1995.tb01625.x. [CrossRef] [Google Scholar]
28. Полл Г.К., Мэтьюз Р.А. Spironucleus vortens , возможная причина болезни дырок в голове у цихлид. Орган «Дис Аква». 2001;45:197–202. doi: 10.3354/dao045197. [PubMed] [CrossRef] [Google Scholar]
29. Стеруд Э., Мо Т.А., Поппе Т.Т. Ультраструктура Spironucleus barkhanus n. сп. (Diplomonadida: Hexamitidae) из хариуса Thymallus thymallus (L.) (Salmonidae) и атлантического лосося Salmo salar L (Salmonidae) J Eukaryot Microbiol. 1997; 44: 399–407. doi: 10.1111/j.1550-7408.1997.tb05715.x. [CrossRef] [Google Scholar]
30. Poynton SL, Fard MRS, Jenkins J, Ferguson HW. Ультраструктура Spironucleus salmonis n. гребень. (ранее Octomitus salmonis sensu Moore 1922, Davis 1926 и Hexamita salmonis sensu Ferguson 1979) с указанием видов Spironucleus . Орган «Дис Аква». 2004; 60:49–64. дои: 10.3354/dao060049. [PubMed] [CrossRef] [Google Scholar]
гребень. (ранее Octomitus salmonis sensu Moore 1922, Davis 1926 и Hexamita salmonis sensu Ferguson 1979) с указанием видов Spironucleus . Орган «Дис Аква». 2004; 60:49–64. дои: 10.3354/dao060049. [PubMed] [CrossRef] [Google Scholar]
31. Fard MRS, Jorgensen A, Sterud E, Bleiss W, Poynton SL. Ультраструктура и молекулярная диагностика Spironucleus salmonis (Diplomonadida) радужной форели Oncorhynchus mykiss в Германии. Орган «Дис Аква». 2007; 75: 37–50. doi: 10.3354/dao075037. [PubMed] [CrossRef] [Google Scholar]
32. Poynton SL, Morrison CM. Морфология жгутиковых дипломонад: Spironucleus torosa n. сп. из атлантической трески G adus morhua L. и пикша Melanogrammus aeglefinus (L.) и Hexamita salmonis Moore из речной форели Salvelinus fontinalis (Mitchill) J Protozool. 1990; 37: 369–83. doi: 10.1111/j.1550-7408.1990.tb01160.x. [PubMed] [CrossRef] [Google Scholar]
33. Brett SJ, Cox FEG. Иммунологические аспекты инфекции Giardia muris и Spironucleus muris у инбредных и аутбредных линий лабораторных мышей: сравнительное исследование. Паразитология. 1982;85:85–99. doi: 10.1017/S0031182000054172. [PubMed] [CrossRef] [Google Scholar]
Brett SJ, Cox FEG. Иммунологические аспекты инфекции Giardia muris и Spironucleus muris у инбредных и аутбредных линий лабораторных мышей: сравнительное исследование. Паразитология. 1982;85:85–99. doi: 10.1017/S0031182000054172. [PubMed] [CrossRef] [Google Scholar]
34. Siddall ME, Hong H, Desser SS. Филогенетический анализ Diplomonadida (Wenyon, 1926) Brugerolle, 1975: свидетельство гетерохронии у простейших и против Giardia lamblia как «недостающего звена» J Protozool. 1992; 39: 361–7. doi: 10.1111/j.1550-7408.1992.tb01465.x. [PubMed] [CrossRef] [Google Scholar]
35. Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, et al. Сборка полноразмерного транскриптома из данных RNA-Seq без эталонного генома. Нац биотехнолог. 2011;29: 644–52. doi: 10.1038/nbt.1883. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Keeling PJ, Doolittle WF. Неканонический генетический код в ранней расходящейся эукариотической линии. EMBO J. 1996; 15: 2285–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
EMBO J. 1996; 15: 2285–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Kolisko M, Cepicka I, Hampl V, Leigh J, Roger AJ, Kulda J, et al. Молекулярная филогения дипломонад и энтеромонад на основе SSU рРНК, генов альфа-тубулина и HSP90: последствия для эволюционной истории двойного кариомастигона дипломонад. БМС Эвол Биол. 2008; 8:205. дои: 10.1186/1471-2148-8-205. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Лозупоне К.А., Рыцарь Р.Д., Ландвебер Л.Ф. Молекулярные основы изменения ядерного генетического кода у инфузорий. Карр Биол. 2001; 11: 65–74. doi: 10.1016/S0960-9822(01)00028-8. [PubMed] [CrossRef] [Google Scholar]
39. Симао Ф.А., Уотерхаус Р.М., Иоаннидис П., Кривенцева Е.В., Здобнов Е.М. BUSCO: оценка сборки генома и полноты аннотации с помощью однокопийных ортологов. Биоинформатика. 2015;31:3210–2. doi: 10.1093/биоинформатика/btv351. [PubMed] [CrossRef] [Академия Google]
40. Андерссон Дж.О. Перенос генов и диверсификация микробных эукариот. Анну Рев Микробиол. 2009; 63: 177–93. doi: 10.1146/annurev.micro.091208.073203. [PubMed] [CrossRef] [Google Scholar]
Анну Рев Микробиол. 2009; 63: 177–93. doi: 10.1146/annurev.micro.091208.073203. [PubMed] [CrossRef] [Google Scholar]
41. Hirt RP, Alsmark C, Embley TM. Боковой перенос генов и происхождение протеома эукариот: взгляд с микробных паразитов. Curr Opin Microbiol. 2014; 23C:155–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Soucy SM, Huang J, Gogarten JP. Горизонтальный перенос генов: создание сети жизни. Нат Рев Жене. 2015; 16: 472–82. дои: 10.1038/nrg3962. [PubMed] [CrossRef] [Google Scholar]
43. Yue J, Hu X, Sun H, Yang Y, Huang J. Распространенное влияние горизонтального переноса генов на колонизацию земли растениями. Нац коммун. 2012;3:1152. doi: 10.1038/ncomms2148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Ropars J, Rodríguez dela Vega Ricardo C, López-Villavicencio M, Gouzy J, Sallet E, Dumas É, et al. Адаптивный горизонтальный перенос генов между несколькими грибами, связанными с сыром. Карр Биол. 2015;25:2562–9. doi: 10. 1016/j.cub.2015.08.025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1016/j.cub.2015.08.025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Андерссон Дж.О., Шегрен А.М., Хорнер Д.С., Мерфи К.А., Дьял П.Л., Свярд С.Г. и соавт. Геномное исследование паразита рыб Spironucleus salmonicida указывает на пластичность генома среди дипломонад и значительный латеральный перенос генов в эволюции генома эукариот. Геномика BMC. 2007; 8:51. дои: 10.1186/1471-2164-8-51. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Franzén O, Jerlström-Hultqvist J, Castro E, Sherwood E, Ankarklev J, Reiner D, et al. Проект секвенирования генома Giardia кишечная сборка B изолят GS: вызывается ли лямблиоз человека двумя разными видами? PLoS Патог. 2009;5(8):e1000560. doi: 10.1371/journal.ppat.1000560. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Frickey T, Lupas AN. PhyloGenie: автоматическое создание и анализ филомов. Нуклеиновые Кислоты Res. 2004; 32: 5231–8. doi: 10.1093/nar/gkh867. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Podell S, Gaasterland T. DarkHorse: метод полногеномного предсказания горизонтального переноса генов. Геном биол. 2007;8:R16. doi: 10.1186/gb-2007-8-2-r16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Elsbach P, Weiss J. Роль бактерицидного/увеличивающего проницаемость белка в защите хозяина. Курр Опин Иммунол. 1998; 10:45–9. doi: 10.1016/S0952-7915(98)80030-7. [PubMed] [CrossRef] [Google Scholar]
50. Balakrishnan A, Marathe SA, Joglekar M, Chakravortty D. Белок, повышающий бактерицидность/проницаемость: многогранный белок, функции которого не ограничиваются нейтрализацией LPS. Врожденный иммун. 2013;19:339–47. doi: 10.1177/1753425912465098. [PubMed] [CrossRef] [Академия Google]
51. Макарова К.С., Аравинд Л., Кунин Е.В. Надсемейство архейных, бактериальных и эукариотических белков, гомологичных трансглютаминазам животных. Белковая наука. 1999; 8: 1714–9. doi: 10.1110/ps. 8.8.1714. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8.8.1714. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Wang Z, Wilhelmsson C, Hyrsl P, Loof TG, Dobes P, Klupp M, et al. Захват патогена трансглютаминазой — законсервированный ранний врожденный иммунный механизм. PLoS Патог. 2010;6:e1000763. doi: 10.1371/journal.ppat.1000763. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Анантараман В., Аравинд Л. Эволюционная история, структурные особенности и биохимическое разнообразие ферментов суперсемейства NlpC/P60. Геном биол. 2003;4:R11. doi: 10.1186/gb-2003-4-2-r11. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Фирчук М., Бохтлер М. Складки и активность амидаз пептидогликана. FEMS Microbiol Rev. 2007; 31:676–91. doi: 10.1111/j.1574-6976.2007.00084.x. [PubMed] [CrossRef] [Google Scholar]
55. Vollmer W, Joris B, Charlier P, Foster S. Бактериальные пептидогликановые (муреиновые) гидролазы. FEMS Microbiol Rev. 2008; 32:259–86. doi: 10.1111/j.1574-6976.2007. 00099.x. [PubMed] [CrossRef] [Google Scholar]
00099.x. [PubMed] [CrossRef] [Google Scholar]
56. Собханифар С., Кинг Д.Т., Стрынадка Н.С. Укрепление стенки: синтез, регуляция и деградация бактериального пептидогликана. Curr Opin Struct Biol. 2013; 23: 695–703. doi: 10.1016/j.sbi.2013.07.008. [PubMed] [CrossRef] [Google Scholar]
57. Kashyap DR, Wang M, Liu L-H, Boons GJ, Gupta D, Dziarski R. Белки, распознающие пептидогликаны, убивают бактерии, активируя двухкомпонентные системы, чувствительные к белкам. Нат Мед. 2011; 17: 676–83. doi: 10.1038/nm.2357. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Baum KF, Berens RL, Marr JJ, Harrington JA, Spector T. Спасение пуриновых дезоксинуклеозидов в Giardia lamblia . Дж. Биол. Хим. 1989; 264:21087–90. [PubMed] [Google Scholar]
59. Двиведи Б., Сюэ Б., Лундин Д., Эдвардс Р., Брейтбарт М. Биоинформатический анализ генов рибонуклеотидредуктазы в фаговых геномах и метагеномах. БМС Эвол Биол. 2013;13:33. дои: 10.1186/1471-2148-13-33. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Sillo A, Bloomfield G, Balest A, Balbo A, Pergolizzi B, Peracino B, et al. Полногеномные транскрипционные изменения, вызванные фагоцитозом или ростом бактерий в Диктиостелиум . Геномика BMC. 2008; 9:291. дои: 10.1186/1471-2164-9-291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Sillo A, Bloomfield G, Balest A, Balbo A, Pergolizzi B, Peracino B, et al. Полногеномные транскрипционные изменения, вызванные фагоцитозом или ростом бактерий в Диктиостелиум . Геномика BMC. 2008; 9:291. дои: 10.1186/1471-2164-9-291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Castoreno AB, Wang Y, Stockinger W, Jarzylo LA, Du H, Pagnon JC, et al. Транскрипционная регуляция биогенеза мембран, индуцированного фагоцитозом, белками, связывающими регуляторный элемент стерола. Proc Natl Acad Sci U S A. 2005; 102:13129–34. doi: 10.1073/pnas.0506716102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Summons RE, Bradley AS, Janke LL, Waldbauer JR. Стероиды, тритерпеноиды и молекулярный кислород. Philos Trans R Soc B. 2006; 361: 951–68. doi: 10.1098/rstb.2006.1837. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Мэллори Ф.Б., Гордон Дж.Т., Коннер Р.Л. Выделение пентациклического тритерпеноидного спирта из простейших. J Am Chem Soc. 1963; 85: 1362–3. doi: 10.1021/ja00892a042. [CrossRef] [Google Scholar]
J Am Chem Soc. 1963; 85: 1362–3. doi: 10.1021/ja00892a042. [CrossRef] [Google Scholar]
64. Takishita K, Chikaraishi Y, Leger MM, Kim E, Yabuki A, Ohkouchi N, et al. Боковой перенос генов, синтезирующих тетрагиманол, позволил нескольким различным линиям эукариот независимо адаптироваться к среде без кислорода. Биол Директ. 2012;7:5. дои: 10.1186/1745-6150-7-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, et al. Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Нуклеиновые Кислоты Res. 2013;41:D590–6. doi: 10.1093/nar/gks1219. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Alsmark C, Foster PG, Sicheritz-Ponten T, Nakjang S, Martin Embley T, Hirt RP. Паттерны прокариотического латерального переноса генов, затрагивающие паразитических микробных эукариот. Геном биол. 2013;14:Р19. doi: 10.1186/gb-2013-14-2-r19. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Paganini J, Campan-Fournier A, Da Rocha M, Gouret P, Pontarotti P, Wajnberg E, et al. Вклад латеральных переносов генов в состав генома и паразитарную способность галловых нематод. ПЛОС Один. 2012;7:e50875. doi: 10.1371/journal.pone.0050875. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Paganini J, Campan-Fournier A, Da Rocha M, Gouret P, Pontarotti P, Wajnberg E, et al. Вклад латеральных переносов генов в состав генома и паразитарную способность галловых нематод. ПЛОС Один. 2012;7:e50875. doi: 10.1371/journal.pone.0050875. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Бото Л. Горизонтальный перенос генов при приобретении новых признаков метазоями. Proc R Soc B. 2014; 281:20132450. дои: 10.1098/рспб.2013.2450. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Wijayawardena BK, Minchella DJ, DeWoody JA. Хозяева, паразиты и горизонтальный перенос генов. Тенденции Паразитол. 2013;29:329–38. doi: 10.1016/j.pt.2013.05.001. [PubMed] [CrossRef] [Google Scholar]
70. Stensvold CR, Lebbad M, Victory EL, Verweij JJ, Tannich E, Alfellani M, et al. Расширение выборки выявляет новые линии Entamoeba: последствия генетического разнообразия и специфичности хозяина для таксономии и молекулярного обнаружения. Протист. 2011; 162: 525–41.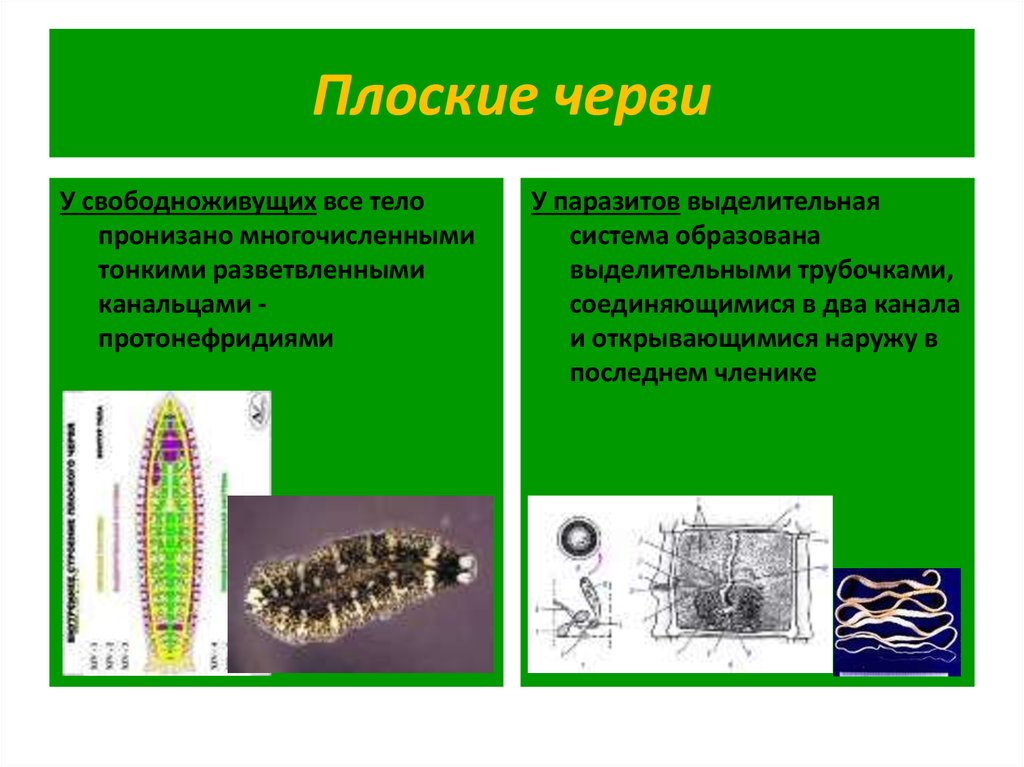 doi: 10.1016/j.protis.2010.11.002. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.protis.2010.11.002. [PubMed] [CrossRef] [Академия Google]
71. Кларк К.Г., Даймонд Л.С. Внутривидовая изменчивость и филогенетические отношения в роде Entamoeba по данным рибопечати. Дж Эукариот микробиол. 1997; 44: 142–54. doi: 10.1111/j.1550-7408.1997.tb05951.x. [PubMed] [CrossRef] [Google Scholar]
72. Yubuki N, Ceza V, Cepicka I, Yabuki A, Inagaki Y, Nakayama T, et al. Загадочное разнообразие свободноживущих парабазалид, Pseudotrichomonas keilini и Lacusteria cypriaca n. г., н. sp., судя по последовательностям рДНК малых субъединиц. Дж Эукариот микробиол. 2010;57:554–61. doi: 10.1111/j.1550-7408.2010.00509.Икс. [PubMed] [CrossRef] [Google Scholar]
73. Blaxter M, Koutsovoulos G. Эволюция паразитизма у нематод. Паразитология. 2015;142:S26–39. doi: 10.1017/S0031182014000791. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Wu B, Novelli J, Jiang D, Dailey HA, Landmann F, Ford L, et al. Междоменный латеральный перенос гена важнейшего гена феррохелатазы у паразитических нематод человека. Proc Natl Acad Sci U S A. 2013;110:7748–53. doi: 10.1073/pnas.1304049110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Proc Natl Acad Sci U S A. 2013;110:7748–53. doi: 10.1073/pnas.1304049110. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Юинг Б., Хиллиер Л., Вендл М.С., Грин П. Базовый вызов трасс автоматического секвенсора с использованием phred. I. Оценка точности. Геном Res. 1998; 8: 175–85. doi: 10.1101/gr.8.3.175. [PubMed] [CrossRef] [Google Scholar]
76. Gordon D, Abajian C, Green P. Consed: графический инструмент для завершения последовательности. Геном Res. 1998; 8: 195–202. doi: 10.1101/gr.8.3.195. [PubMed] [CrossRef] [Google Scholar]
77. Martin M. Cutadapt удаляет последовательности адаптеров из ридов высокопроизводительного секвенирования. EMBnet J. 2011; 17:10–2. doi: 10.14806/ej.17.1.200. [Перекрестная ссылка] [Академия Google]
78. Шмидер Р., Эдвардс Р. Контроль качества и предварительная обработка наборов метагеномных данных. Биоинформатика. 2011; 27:863–4. doi: 10.1093/биоинформатика/btr026. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. UniProt C. Реорганизация белкового пространства в Universal Protein Resource (UniProt) Nucleic Acids Res. 2012;40:D71–5. doi: 10.1093/nar/gkr981. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
UniProt C. Реорганизация белкового пространства в Universal Protein Resource (UniProt) Nucleic Acids Res. 2012;40:D71–5. doi: 10.1093/nar/gkr981. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Finn RD, Bateman A, Clements J, Coggill P, Eberhardt RY, Eddy SR, et al. Pfam: база данных семейств белков. Нуклеиновые Кислоты Res. 2013;42:D222–30. дои: 10.1093/нар/гкт1223. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Eddy SR. Ускоренный поиск профилей HMM. PLoS Comput Biol. 2011;7:e1002195. doi: 10.1371/journal.pcbi.1002195. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Li L, Stoeckert CJ, Jr, Roos DS. OrthoMCL: идентификация групп ортологов для эукариотических геномов. Геном Res. 2003; 13: 2178–89. doi: 10.1101/gr.1224503. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS: сервер автоматической аннотации генома и реконструкции пути. Нуклеиновые Кислоты Res. 2007; 35:W182–5. дои: 10.1093/нар/гкм321. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нуклеиновые Кислоты Res. 2007; 35:W182–5. дои: 10.1093/нар/гкм321. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. HMMER: анализ биопоследовательности с использованием скрытых в профиле марковских моделей. 2016. http://hmmer.org/. По состоянию на 3 февраля 2016 г.
85. Стаматакис А. RAxML, версия 8: инструмент для филогенетического анализа и постанализа крупных филогений. Биоинформатика. 2014;30:1312–3. doi: 10.1093/биоинформатика/btu033. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Katoh K, Standley DM. Программное обеспечение MAFFT для множественного выравнивания последовательностей, версия 7: улучшения производительности и удобства использования. Мол Биол Эвол. 2013;30:772–80. дои: 10.1093/молбев/mst010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Criscuolo A, Gribaldo S. BMGE (Block Mapping and Gathering with Entropy): новое программное обеспечение для выбора филогенетических информативных областей из множественных выравниваний последовательностей.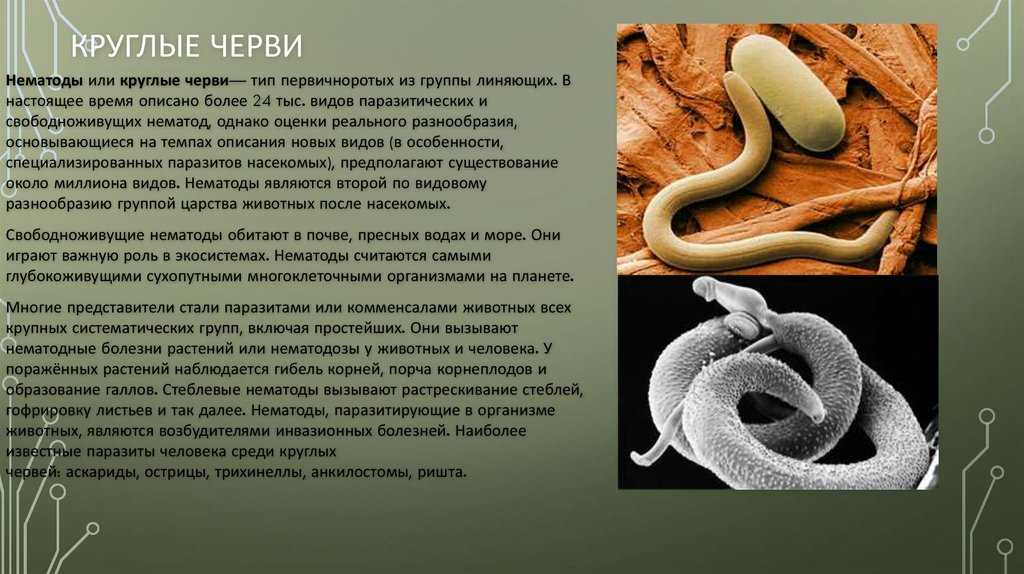 БМС Эвол Биол. 2010;10:210. дои: 10.1186/1471-2148-10-210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
БМС Эвол Биол. 2010;10:210. дои: 10.1186/1471-2148-10-210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эволюция паразитов: вот как некоторые животные стали халявщиками
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Лямблии, простейшие паразиты, передающиеся через неочищенную питьевую воду, вызывают лямблиоз, диарейное заболевание, сопровождающееся тошнотой и утомляемостью. (Изображение предоставлено CDC/д-ром Стэном Эрландсеном)Никто не любит халявщиков, но новое исследование показало, что обман других является разумной эволюционной стратегией.
Согласно исследованию, опубликованному 19 июля, паразитизм — стратегия выживания, заключающаяся в захвате питательных веществ хозяина для собственной выгоды — появлялся в животном мире не менее 223 раз.в журнале Biology Letters. И хотя паразитизм иногда считают эволюционным тупиком, потому что он требует положить все свои яйца в корзину хозяина, паразитические виды столь же разнообразны, как и непаразитические виды, что позволяет предположить, что паразиты прекрасно себя чувствуют.
Оценка 223 независимых источников паразитизма почти в четыре раза выше, чем предыдущая оценка около 60. Это потому, что никто не изучал этот вопрос систематически, говорит ведущий автор исследования Сара Вайнштейн, аспирант кафедры экологии, эволюции и морских исследований. биологии в Калифорнийском университете в Санта-Барбаре. И многие исследования паразитизма были сосредоточены на организмах, которые имеют отношение к людям, таких как ленточный червь, живущий в кишечнике, и упускали из виду членистоногих, таких как клещи и мухи.
«Мы потратили много времени на изучение этих групп, которые обычно не включаются в эти оценки», — сказал Вайнштейн Live Science. [См. фотографии паразитов человека под микроскопом]
Больше, чем ожидалось, но редкость
На отслеживание происхождения паразитизма ушло шесть лет исследований паразитических животных и их ближайших родственников, сказал Вайнштейн. Некоторые исследования, которые она использовала, датируются еще 1800-ми годами. Сравнивая паразитические виды с их ближайшими непаразитарными родственниками, Вайнштейн смог определить моменты времени, когда новый паразитический вид отделился от свободноживущего предка. Она сосредоточилась на животном мире — включить в исследование вирусы, бактерии и грибы было бы непосильной задачей.
Сравнивая паразитические виды с их ближайшими непаразитарными родственниками, Вайнштейн смог определить моменты времени, когда новый паразитический вид отделился от свободноживущего предка. Она сосредоточилась на животном мире — включить в исследование вирусы, бактерии и грибы было бы непосильной задачей.
Существуют миллионы видов паразитов, сказал Вайнштейн. Фактически, в статье 1998 года, опубликованной в Международном журнале паразитологии, утверждалось, что большая часть жизни на Земле является паразитической. По другим оценкам, это число составляет около 40 процентов животных. По словам Вайнштейна, число независимых примеров паразитов, которые развились в ходе эволюции, может показаться большим, но, учитывая, что в настоящее время живет более 7 миллионов видов животных, 223 — это относительно небольшое число.
«На самом деле это довольно редкий переход», сказала она.
Развивающиеся паразиты
Большинство групп паразитов эволюционировали до мезозойской эры, более 250 миллионов лет назад. Эти старые группы также, как правило, самые большие и, как таковые, содержат наибольшее количество видов.
Эти старые группы также, как правило, самые большие и, как таковые, содержат наибольшее количество видов.
«10 крупнейших групп паразитов на самом деле содержат 90 процентов видов паразитов», — сказал Вайнштейн.
Поскольку эти группы очень старые, трудно найти свободноживущих родственников, от которых произошли паразитические виды. По словам Вайнштейна, гораздо более показательными являются оставшиеся 10 процентов паразитов, особенно малоизученные клещи и мухи.
«Они либо относительно недавно перешли к паразитизму, либо уже находятся в этом процессе», — сказала она. Некоторые из них являются «факультативными паразитами», то есть организмами, которые могут стать паразитами при подходящих условиях окружающей среды, но также могут жить независимо.
Многие паразиты имеют только одну паразитическую стадию в своем жизненном цикле или проводят по крайней мере часть своей жизни в качестве свободноживущих организмов. Одним из примеров является паразит Schistosoma , который вылупляется внутри пресноводных улиток. Затем личинки плавают по воде, пока не найдут животное-хозяина (включая человека). Когда у них есть хозяин, свободно плавающие личинки возвращаются к паразитической стадии, извиваясь через кожу и развиваясь во взрослую жизнь внутри кровеносных сосудов. Затем они откладывают яйца, которые выделяются при мочеиспускании или дефекации, чтобы — надеюсь, с точки зрения червей — вернуться к улитке-хозяину. Человек-хозяин, инфицированный вирусом 9Паразит 0007 Schistosoma
Одним из примеров является паразит Schistosoma , который вылупляется внутри пресноводных улиток. Затем личинки плавают по воде, пока не найдут животное-хозяина (включая человека). Когда у них есть хозяин, свободно плавающие личинки возвращаются к паразитической стадии, извиваясь через кожу и развиваясь во взрослую жизнь внутри кровеносных сосудов. Затем они откладывают яйца, которые выделяются при мочеиспускании или дефекации, чтобы — надеюсь, с точки зрения червей — вернуться к улитке-хозяину. Человек-хозяин, инфицированный вирусом 9Паразит 0007 Schistosoma
Оригинальная статья о Live Science.
Стефани Паппас — автор статей для журнала Live Science, освещающего самые разные темы — от геонаук до археологии, человеческого мозга и поведения. Ранее она была старшим автором журнала Live Science, но теперь работает внештатным сотрудником в Денвере, штат Колорадо, и регулярно публикует статьи в журналах Scientific American и The Monitor, ежемесячном журнале Американской психологической ассоциации.

 Многообразие паразитов, особенности их питания. Влияние на организм хозяина. Паразиты — организмы, использующие другие организмы в качестве места обитания и источника пищи, питаются органическими веществами организма-хозяина или его пищей либо заглатывая и переваривая твердые частицы пищи (аскарида), либо всасывая жидкие органические вещества всей поверхностью тела (бычий цепень) или с помощью специальных органов (клещи, клопы). Примеры паразитов: вирусы, многие бактерии, грибы (головня, спорынья, трутовик), простейшие (малярийный паразит, лямблии), плоские и круглые черви (аскарида, острица, печеночный сосальщик, бычий и свиной цепни, кошачья двуустка, эхинококк), клещи (чесоточный, таежный), насекомые (клопы, блохи, вши). Явление паразитизма среди растений (петров крест, заразиха), позвоночных животных (гнездовой паразитизм у кукушки).
Многообразие паразитов, особенности их питания. Влияние на организм хозяина. Паразиты — организмы, использующие другие организмы в качестве места обитания и источника пищи, питаются органическими веществами организма-хозяина или его пищей либо заглатывая и переваривая твердые частицы пищи (аскарида), либо всасывая жидкие органические вещества всей поверхностью тела (бычий цепень) или с помощью специальных органов (клещи, клопы). Примеры паразитов: вирусы, многие бактерии, грибы (головня, спорынья, трутовик), простейшие (малярийный паразит, лямблии), плоские и круглые черви (аскарида, острица, печеночный сосальщик, бычий и свиной цепни, кошачья двуустка, эхинококк), клещи (чесоточный, таежный), насекомые (клопы, блохи, вши). Явление паразитизма среди растений (петров крест, заразиха), позвоночных животных (гнездовой паразитизм у кукушки).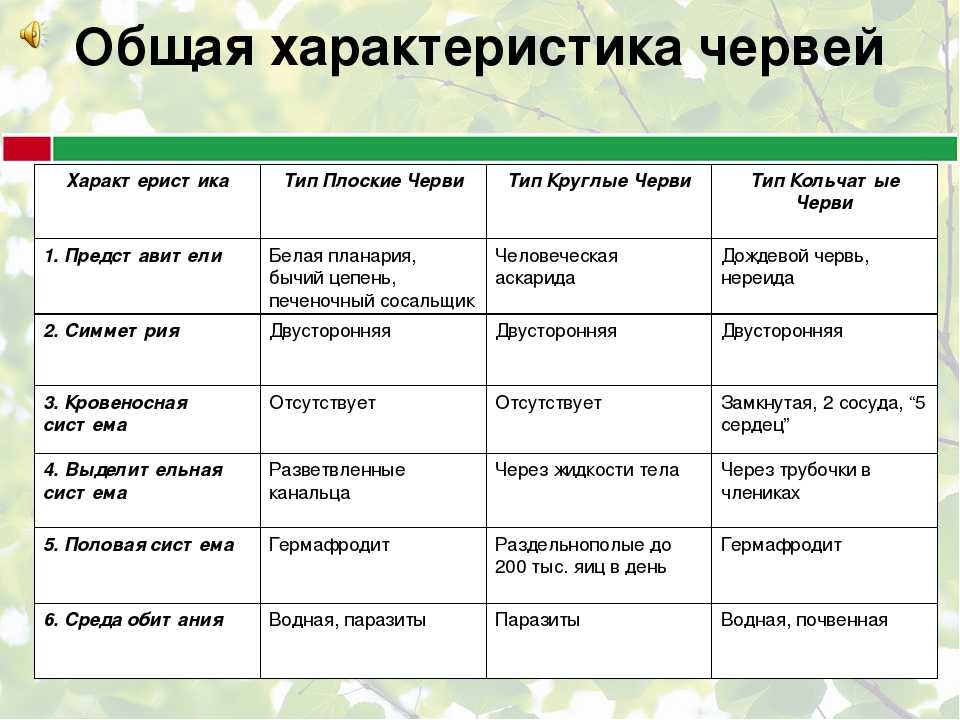

 Чтобы не заразиться бычьим цепнем, необходимо уничтожать зараженное мясо, хорошо проваривать или прожаривать говядину перед употреблением в пищу.
Чтобы не заразиться бычьим цепнем, необходимо уничтожать зараженное мясо, хорошо проваривать или прожаривать говядину перед употреблением в пищу.
Leave A Comment