Воздействие радиации на ткани живого организма
В органах и тканях биологических объектов как и в любой
среде при облучении в результате поглощения энергии идут процессы ионизации и
возбуждения атомов. Эти процессы лежат в основе биологического действия
излучений. Его мерой служит количество поглощенной в организме энергии. Описанные процессы первых трех фаз являются первичными и определяют дальнейшее развитие лучевого поражения. В следующей за ними четвертой, биологической фазе химические изменения молекул преобразуются в клеточные изменения. Наиболее чувствительным к облучению является ядро клетки, а наибольшие последствия вызывает повреждение ДНК, содержащей наследственную информацию. В результате облучения в зависимости от величины поглощенной дозы клетка гибнет или становится неполноценной в функциональном отношении. Время протекания четвертой фазы очень различно и в зависимости от условий может растянуться на годы или даже на всю жизнь. 
Таблица 9.
Альфа-излучение имеет малую длину пробега частиц и
характеризуется слабой проникающей способностью. Оно не может проникнуть сквозь
кожные покровы. Пробег альфа-частиц с энергией 4 Мэв в воздухе составляет 2.5
см, а в биологической ткани лишь 31 мкм. Альфа-излучающие нуклиды представляют
большую опасность при поступлении внутрь организма через органы дыхания и
пищеварения, открытые раны и ожоговые поверхности.  Так пробег электронов с энергией 4 Мэв в воздухе
составляет 17.8 м, а в биологической ткани 2.6 см. Так пробег электронов с энергией 4 Мэв в воздухе
составляет 17.8 м, а в биологической ткани 2.6 см.Гамма-излучение имеет еще более высокую проникающую способность. Под его действием происходит облучение всего организма. Н(n,)2H и l4N(n,p)l4C Сечения этих реакций составляют соответственно 0.33 и 1.76 барн. Основной эффект воздействия на биологическую ткань происходит под действием протонов, образующихся в реакции (n,р) и теряющих всю свою энергию в месте рождения. Для медленных нейтронов сечения захвата нейтронов малы. Большая часть энергии расходуется на возбуждение и расщепление молекул ткани. Для быстрых нейтронов до 90% энергии в ткани теряется при упругом взаимодействии. При этом решающее значение имеет рассеяние нейтронов на протонах. Дальнейшее выделение энергии происходит в результате ионизации среды протонами отдачи.  | |||||||||||||||||||||||||||||||||||||||||||||||||||
Что такое радиация и как она влияет на здоровье
Ольга Бадрина
26 953
Высокие дозы радиации могут разрушать клетки, ткани и органы и приводить к тяжёлым последствиям: ожогам, лучевой болезни, онкологическим заболеваниям. В статье разбираемся, существует ли безопасная доза облучения, какие могут быть последствия для здоровья от воздействия радиации и возможно ли от неё защититься.
СОДЕРЖАНИЕ
Что такое радиация и как она влияет на здоровье
Последствия облучения
Последствия облучения для женщин
Последствия облучения для мужчин
Последствия облучения для детей
Радиация в медицине
Чем грозит авария на АЭС или ядерный взрыв
Как защититься от радиации
Что такое радиация и как она влияет на здоровье
Радиация — это ионизирующее излучение, которое образуется при распаде радиоактивных частиц.
Человек ежедневно контактирует с радиацией. В зависимости от происхождения её источники делят на естественные, искусственные и техногенные.
Естественный радиационный фон окружает человека повсюду: фонит почва, вода, воздух и даже космос. Каждый день люди вдыхают с воздухом или употребляют с водой и продуктами некоторое количество радиоактивных молекул.
Искусственный радиационный фон в основном представлен медицинскими источниками излучения: рентгеновскими аппаратами, томографами, аппаратами для флюорографии, радиофармацевтическими препаратами, применяемыми для диагностики и лучевой терапии.
Примерно 80% ежегодной дозы облучения человек получает из окружающей среды, остальные 20% приходятся на медицинские процедуры: рентген, компьютерную томографию и другие.
Существуют и так называемые техногенные источники радиации. К ним относят работу крупных производств, например тепловых электростанций (ТЭЦ). Кроме того, иногда техногенными источниками выступают крупные аварии на атомных электростанциях (АЭС).
Кроме того, иногда техногенными источниками выступают крупные аварии на атомных электростанциях (АЭС).
В зависимости от того, как, когда и в каком объёме радиация воздействует на человека, она может быть нейтральной, полезной или губительной.
Малые дозы радиации, которым ежедневно подвергается человек, никак не отражаются на здоровье, высокие — могут помочь вылечить онкологическое заболевание (лучевая терапия), провести операцию на глубоколежащих тканях (стереотаксическая хирургия) или, напротив, разрушить здоровые ткани.
Факторы, влияющие на масштаб потенциального вреда радиации
Какое влияние ионизирующее излучение окажет на организм, зависит от многих факторов: типа излучения и радиоактивных изотопов, восприимчивости тканей, продолжительности облучения и некоторых индивидуальных характеристик.
Тип излучения
Альфа-частицы — ядра, которые не проникают глубже 0,1 мм (примерно такую толщину имеет лист бумаги). Наиболее опасны при прямом попадании в организм с продуктами или водой, но не могут проникнуть извне через кожу.

Бета-частицы — высокоэнергетические электроны, которые могут проникать на глубину до 2 см. Менее опасны, чем альфа-частицы, но из-за большей проникающей способности могут разрушать верхний слой кожи и подкожную клетчатку, приводя к серьёзным ожогам.
Гамма-излучение — высокоэнергетические частицы, которые могут проникать глубоко в ткани. Временно задержать их способен слой свинца. Приводят к массивному разрушению клеток и тканей. Именно этот тип излучения наиболее опасен при ядерном взрыве.
Восприимчивость клеток к облучению
Наиболее чувствительны к разрушающему воздействию радиации клетки костного мозга и половые клетки, наименее — мышц и костей.
Доза и продолжительность облучения
Высокая быстрая однократная доза наносит больший вред, чем такая же, полученная за неделю или месяц.
Индивидуальные характеристики
Тяжесть последствий облучения зависит также от возраста и некоторых сопутствующих заболеваний. Так, дети более восприимчивы к воздействию радиации, чем взрослые. Кроме того, диабет и болезни соединительной ткани (ревматоидный артрит, системная красная волчанка и другие) могут увеличивать чувствительность клеток к радиационному поражению.
Так, дети более восприимчивы к воздействию радиации, чем взрослые. Кроме того, диабет и болезни соединительной ткани (ревматоидный артрит, системная красная волчанка и другие) могут увеличивать чувствительность клеток к радиационному поражению.
Безопасная доза радиации
Воздействие радиации на человека называют облучением.
Для измерения полученной дозы используют разные единицы. В медицине это, как правило, зиверт (Зв) или миллизиверт (мЗв) — эффективная эквивалентная доза, полученная всем организмом за определённый промежуток времени (обычно за час).
В России по СанПиН безопасной дозой облучения считается 1 мЗв в год, а максимальной — 5 мЗв в год.
Для сравнения:
- После взрыва на Чернобыльской АЭС уровень радиации доходил до 2–3 мЗв в час.
- Уровень радиации в 20 км от японской АЭС «Фукусима—1» в момент аварии составил 0,161 мЗв в час.
- За время 2—3-часового авиаперелёта человек получает облучение в среднем в 0,02 мЗв.
 Ту же дозу можно получить, если сделать 10–15 рентгеновских снимков за день.
Ту же дозу можно получить, если сделать 10–15 рентгеновских снимков за день.
Высокие дозы радиации (например, выше 50 мЗв в день) могут приводить к мгновенному разрушению клеток, тканей и органов. Такое облучение можно заработать, если находиться недалеко от места взрыва ядерной бомбы, или в момент аварии на АЭС.
Последствия облучения
Радиация может быть нейтральной, полезной или губительной. Всё зависит от дозы и площади облучения.
Так, малые дозы — до 5 мЗв в год — никак не отражаются на здоровье.
Перелёт из Хабаровска в Москву будет «стоить» человеку около 0,04 мЗв облучения. Это меньше, чем от одного рентгеновского снимка грудной клетки.
Более высокие дозы могут помочь вылечить онкологическое заболевание, если применяются локально и кратковременно. Их используют при лучевой терапии рака. Польза для здоровья в этом случае перевешивает потенциальный вред от облучения.
Высокие дозы облучения могут разрушать клетки, ткани и органы и приводить к тяжёлым последствиям.
Так, доза облучения в 1 000 мЗв может привести к лучевой болезни, в 2 000 мЗв — увеличивает риск развития онкологических заболеваний, а в 3 000 мЗв — угрожает жизни облучённого.
Местное лучевое поражение
Как правило, местные поражения появляются при прямом контакте с источником радиации, в том числе в результате лучевой терапии при лечении онкологических заболеваний. Симптомы зависят от полученной дозы.
Так, при локальном облучении у человека могут выпасть волосы на месте воздействия, шелушится кожа, на ней формируются язвы.
Обычно симптомы местного лучевого поражения бесследно проходят, как только человек заканчивает лечение.
Лучевые ожоги
Ожоги в результате воздействия радиации могут быть лёгкими — I или II степени: в месте облучения кожа может покраснеть, на ней появляются пузыри, наполненные прозрачным содержимым. Такие ожоги, как правило, сопровождаются сильной жгучей болью.
Очень большие дозы радиации могут привести к отмиранию кожи в месте облучения, вплоть до повреждения мышц и костей.
Лучевая болезнь
Лучевая болезнь развивается при однократном облучении в 1 000 мЗв. Такую дозу можно получить, если находиться недалеко от места взрыва ядерного реактора или сделать 25 000 флюорографий или 1 000 рентгенов за день.
Как правило, лучевая болезнь — следствие ядерных катастроф, её невозможно получить в обычной жизни, даже если регулярно делать рентген или флюорографию.
Лучевую болезнь диагностировали у большинства людей, заставших ядерную бомбардировку Хиросимы и Нагасаки и аварию на Чернобыльской АЭС.
В зависимости от поглощённой дозы радиации, выделяют три типа, или синдрома, острой лучевой болезни: костномозговой, кишечный и церебральный.
Гематопоэтический (костномозговой) синдром развивается при воздействии дозы облучения от 700 мЗв. В результате разрушается костный мозг, нарушается выработка клеток крови, из-за чего иммунной системе тяжелее справляться даже с безобидными инфекциями, а кровь не может свёртываться как надо.
Гастроинтестинальный (кишечный) синдром возникает при облучении около 10 000 мЗв. Кроме костного мозга, поражается и пищеварительный тракт. В результате возникает обезвоживание, нарушается электролитный баланс, развиваются тяжёлые инфекционные заболевания. Смерть обычно наступает в течение 2 недель после облучения.
Цереброваскулярный (церебральный) синдром начинается от облучения в 20 000 мЗв. Нарушается выработка клеток крови, увеличивается внутричерепное давление, развивается поражение головного и спинного мозга. Смерть наступает в течение 3 дней.
Вне зависимости от типа лучевой болезни, она проходит три последовательные стадии.
Стадии лучевой болезни:
- Начальная — первичные симптомы (тошнота, потеря аппетита, рвота, усталость, диарея), которые могут возникнуть как через несколько минут, так и через несколько дней после облучения.
- Бессимптомная — скрытый период. На этой стадии человеку резко становится лучше, он может выглядеть здоровым на протяжении нескольких часов или даже недель.

- Стадия разгара (ярких клинических проявлений) — развиваются специфические симптомы, характерные для конкретного синдрома лучевой болезни. Так, при костномозговом синдроме наблюдаются массивные плохо купируемые кровотечения и лихорадка, а при кишечном — головокружение, потеря сознания и даже кома.
После периода ярких клинических проявлений человек может либо выздороветь, либо умереть. Всё зависит от дозы облучения и состояния здоровья пострадавшего.
Стохастические эффекты
Стохастические, или так называемые вероятные эффекты, — последствия облучения, которые не имеют точного дозового порога и могут проявиться спустя годы после воздействия радиации.
Распространённые стохастические эффекты:
- онкологические заболевания,
- генетические мутации.
Под воздействием радиации в организме образуются потенциально канцерогенные частицы — свободные радикалы, которые могут повреждать генетический материал клеток. В результате клетки могут начать бесконтрольно делиться и расти, формируя опухоли.
Известно, что через 10 лет после ядерной бомбардировки Хиросимы и Нагасаки участились случаи рака щитовидной железы, молочной железы и кишечника.
Учитывая, что онкологические заболевания относятся к стохастическим эффектам радиации, сложно выявить прямую взаимосвязь между дозой облучения и возникновением рака (однако исследования, подтверждающие её, есть). Кроме того, при анализе причин онкологии невозможно разделить влияние собственно облучения и образа жизни, наследственности, вирусов и других факторов внешней среды.
Последствия облучения для женщин
У женщин, которые подверглись воздействию радиации, чаще регистрируют хронические воспалительные заболевания органов малого таза, а также акушерские осложнения (внематочная беременность, плацентарная недостаточность, гестоз, преждевременные роды, выкидыши, мертворождение).
Кроме того, воздействие радиации на 8–25-й неделе беременности может приводить к нарушению умственного развития плода и порокам его развития.
При дозах ниже 0,1 мЗв, которые, как правило, применяются в ходе обычных профилактических обследований во время вынашивания ребёнка, риск возникновения таких осложнений не повышается.
Последствия облучения для мужчин
У мужчин, которые подверглись воздействию радиации, чаще регистрируют воспалительные и функциональные заболевания репродуктивной системы:
- варикоцеле — варикозное расширение вен яичка и семенного канатика;
- орхит — воспаление яичка;
- простатит — воспаление предстательной железы;
- эректильную дисфункцию.
Последствия облучения для детей
Головной мозг, хрусталик глаза и щитовидная железа у детей более чувствительны к воздействию радиации, чем у взрослых. Причины этого до конца не изучены, но врачи считают, что повышенная чувствительность некоторых тканей у детей обусловлена высокой скоростью роста и деления клеток.
Теоретически возможны и генетические эффекты, однако даже среди 78 тысяч японских детей, переживших атомную бомбардировку Хиросимы и Нагасаки, не обнаружили увеличения числа случаев наследственных болезней.
Радиация в медицине
Согласно требованиям, изложенным в СанПиН 2.6.1.1192-03, при проведении профилактических медицинских визуализирующих процедур, к которым относится рентген, компьютерная томография, флюорография и другие, доза радиации не должна превышать 1 мЗв в год.
Такую дозу радиации можно получить, если сделать за год:
- 500 рентгеновских снимков руки или ноги,
- 80 рентгеновских снимков челюсти,
- 20 компьютерных томограмм.
Даже если весь год ежедневно делать по одному рентгеновскому снимку руки, добавить к этому 2 компьютерные томографии и 2 рентгеновских снимка челюсти, облучение всё равно не превысит разрешённых безопасных доз.
Методы медицинской визуализации
К методам медицинской визуализации относятся: рентгенография, компьютерная томография, флюорография, маммография, позитронно-эмиссионная томография, сцинтиграфия.
Рентгенография — метод исследование внутренних органов и костей с помощью рентгеновских лучей. В результате рентгенографии на специальную плёнку или бумагу проецируется точное изображение снимаемого объекта.
В результате рентгенографии на специальную плёнку или бумагу проецируется точное изображение снимаемого объекта.
Простой рентгеновский снимок руки или ноги подвергает человека дозе облучения, равной в среднем 0,01 мЗв
Доза радиации, которой человек подвергается во время рентгенографии, эквивалентна нескольким дням или нескольким годам воздействия естественного излучения из окружающей среды. Точная доза зависит от метода исследования и участка тела.
Флюорография — разновидность рентгенографии. В ходе исследования специалист делает рентгеновский снимок грудной клетки и лёгких.
Доза радиации, которой человек подвергается во время процедуры, выше, чем при рентгенографии, но не приносит вреда здоровью.
За одну процедуру флюорографии человек получает дозу облучения не более 0,1 мЗв
Маммография — это рентгенологический метод исследования опухолей молочной железы.
Доза радиации, которой человек подвергается при маммографии, выше, чем при рентгенографии и флюорографии, но всё равно безопасна для здоровья.
Как правило, за одну процедуру маммографии со сканированием двух молочных желёз человек получает дозу облучения, равную 0,4 мЗв
Сцинтиграфия, компьютерная и позитронно-эмиссионная томография — это так называемые продвинутые рентгенологические исследования, потому что в результате врач получает не плоское изображение, а объёмную модель.
Сцинтиграфия — метод исследования, позволяющий получать двухмерные изображения. Компьютерная и позитронно-эмиссионная томография — комбинированные исследования, при которых компьютер обрабатывает сразу несколько рентгеновских снимков и получает трёхмерную картинку.
Излучение от компьютерной томографии составляет от 0,4 до 0,7 мЗв при обследовании грудной клетки и несколько выше при сканировании брюшной полости
Во время компьютерной томографии пациент лежит на столе, который заезжает внутрь томографа — аппарата, похожего на кольцо или туннель. По корпусу томографа проложена рентгеновская трубка, лучи из которой проходят сквозь мягкие ткани, а полученные изображения передаются на компьютер. Компьютер обрабатывает снимки, в результате получаются объёмные послойные изображения.
Компьютер обрабатывает снимки, в результате получаются объёмные послойные изображения.
Лучевая терапия
Лучевая терапия, или радиотерапия, — это метод лечения, который используют для терапии злокачественных опухолей. В ходе лучевой терапии с помощью излучения прицельно разрушают опухолевые клетки.
Излучение повреждает ДНК клеток, после чего они теряют способность делиться и погибают. Курс лечения состоит из нескольких сеансов, которые длятся от 5 до 15 минут.
Доза облучения при лучевой терапии зависит от локализации опухоли и стадии рака
Лучевая терапия воздействует не только на злокачественные, но и на здоровые клетки, которые расположены рядом с опухолью, а также на здоровые ткани, через которые проходит луч. Как правило, после лечения поражённые ткани самостоятельно восстанавливаются.
Кому нельзя облучаться
Высокие дозы облучения опасны для всех людей, но некоторым людям запрещены даже допустимые дозы облучения при медицинских процедурах.
Рентгенография строго запрещена в первой половине беременности.
Так, рентгенография строго запрещена в первой половине беременности, за исключением случаев, когда риск для матери превышает пользу для ребёнка. Например, когда решается вопрос об аборте или беременной требуется неотложная помощь.
Чем грозит авария на АЭС или ядерный взрыв
Последствия таких аварий будут сильно зависеть от многих факторов, например от того, включён или отключён реактор АЭС, от мощности станции или ядерной бомбы, погодных условий.
Главную опасность представляет выброс радиоактивных элементов: йода, цезия, стронция, плутония и продуктов их распада.
Йод — это наиболее летучий элемент, с периодом полураспада до 8 дней. Всё это время он угрожает здоровью людей. Дело в том, что йод может накапливаться в щитовидной железе и приводить к формированию злокачественных опухолей.
Рак щитовидной железы может годами развиваться без симптомов, поэтому врачи рекомендуют регулярно проверять её состояние. Для этого подходят лабораторные исследования уровня гормонов щитовидной железы и гипоталамуса.
Для этого подходят лабораторные исследования уровня гормонов щитовидной железы и гипоталамуса.
Т3 общий
360 ₽
В корзину
Т3 свободный
370 ₽
В корзину
Т4 общий
360 ₽
В корзину
Т4 свободный
370 ₽
В корзину
350 ₽
В корзину
Радиоактивные цезий, стронций, плутоний и продукты их распада, в отличие от йода, накапливаются в организме человека в меньшем количестве и имеют больший период полураспада, поэтому считаются менее опасными. Но всё равно могут приводить к тяжёлым поверхностным поражениям, а при прямом попадании в организм с загрязнёнными продуктами или водой — к разрушению внутренних органов.
Как защититься от радиации
Согласно рекомендациям ВОЗ, есть три основных способа защиты от радиации:
- время,
- расстояние,
- экранирование.

Чем меньше по времени человек находится в зоне сильного облучения и чем дальше он от него, тем слабее потенциальный вред для здоровья. Экранирование предполагает использование особых защитных экранов, например бункеров из свинца, через которые не проникают радиоактивные частицы.
Если авария случится, о ней обязательно сообщат централизованно: по радио, телевидению и другим каналам связи. В некоторых случаях людей могут попросить экстренно принять препараты калия йодида.
Чтобы избежать поражения щитовидной железы во время чрезвычайной ситуации, ВОЗ рекомендует пить йодид калия в таблетках, раствор Люголя или 5%-ную настойку йода.
Йод заполняет щитовидную железу и не позволяет депонироваться радиоактивному йоду. В результате опасный элемент выводится из организма с мочой.
Йод защищает только щитовидную железу и не спасает от разрушающего воздействия радиоактивных элементов на кожу и внутренние органы.
Пить йод просто так для профилактики не стоит, это опасно для здоровья.
Почему нельзя пить препараты йода для профилактики?
Принимать препараты йода для предупреждения радиационного поражения ЩЖ следует только один раз и после объявления ЧС, а не заблаговременно. Дело в том, что такая «профилактика» может привести к воспалению щитовидной железы — тиреоидиту, развитию зоба и гипертиреозу, при котором щитовидная железа начинает выделять большое количество гормонов.
Однократный приём йодида калия защищает щитовидную железу примерно на сутки. Принимать препарат повторно можно только после рекомендации местных органов здравоохранения.
Информацию проверил
врач-эксперт
Справочник Заболевания
Оцените статью:
1
2
3
4
5
6
7
8
9
10
Полезная статья? Поделитесь в социальных сетях:
ВАЖНО
Информация из данного раздела не может служить достаточным основанием для постановки диагноза или назначения лечения. Решение об этом должен принимать врач на основании всех имеющихся у него данных.
Решение об этом должен принимать врач на основании всех имеющихся у него данных.
Вам может быть интересно
Язвенная болезнь желудка и двенадцатиперстной кишки
Тремор рук
Угри (акне)
Аутизм: расстройства аутистического спектра
Синдром дефицита внимания и гиперактивности (СДВГ)
Закажите
исследования
с выездом
на дом
Используйте
бонусы
в программе
лояльности
Получите
консультацию
специалиста
онлайн
Подпишитесь
на Telegram-
канал
Гемотест Live
нормальных тканевых реакций на хроническое облучение в Человек
1. Международная комиссия по радиологической защите. Ранние и поздние эффекты облучения в нормальных тканях и органах:
пороговые дозы для тканевых реакций в контексте радиационной защиты. МКРЗ
Публикация 118. Энн МКРЗ. 2012;41(1–2) [PubMed] [Google Scholar]
МКРЗ
Публикация 118. Энн МКРЗ. 2012;41(1–2) [PubMed] [Google Scholar]
2. Аклеев А.В. Синдром хронической лучевой болезни. Спрингер-Верлаг; Berlin Heidelberg: 2014. ISBN 978 3 642 45116 4. [Google Scholar]
3. Ikushima T, Aritomi H, Morisita J. Радиоадаптивный ответ: эффективное восстановление радиационно-индуцированной ДНК повреждения адаптированных клеток. Мутат Рез. 1996;358:193–198. [PubMed] [Google Scholar]
4. Ахмед К.М., Ли Дж.Дж. NF-kB-опосредованная адаптивная устойчивость к ионизирующим излучение. Свободнорадикальная биология и медицина. 2008; 44:1–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Nogami M, Huang JT, James SJ, Lubinski JM, Nakamura LT, Makinodan T. Мыши, хронически подвергающиеся воздействию низких доз ионизирующего излучения, обладают спленоциты с повышенным уровнем мРНК HSP70, HSC70 и HSP72 и с повышенная способность к размножению. Int J Radiat Biol. 1993;63(6):775–783. [PubMed] [Google Scholar]
6. Kojima S, Ischida Y, Tarahashi M, Yamaoka R. Повышение уровня глутатиона, вызванное гамма-лучами в низких дозах, и его
участие в повышенной активности естественных киллеров. Радиационное разрешение 2002;157(3):275–280. [PubMed] [Google Scholar]
Повышение уровня глутатиона, вызванное гамма-лучами в низких дозах, и его
участие в повышенной активности естественных киллеров. Радиационное разрешение 2002;157(3):275–280. [PubMed] [Google Scholar]
7. Feinendegen LE, Bond VP, Sondhaus CA, Muehlensiepen H. Радиационные эффекты, вызванные низкими дозами в сложных тканях и их связь с клеточными адаптивными реакциями. Мутат Рез. 1996; 358:199–205. [PubMed] [Академия Google]
8. Аклеев А.В., Алещенко А.В., Готлиб В.Я., Кудряшова О.В., Семенова Л.П., Серебкяны А.М., Худякова О.И., Пелевина И.И. Адаптационные возможности лимфоцитов у жителей Прибрежья Теча Хронически подвергается радиационному воздействию. Jpn J Health Phys. 2004;39(4):375–381. [Google Scholar]
9. Возилова А.В., Шагина Н.Б., Дегтева М.О., Аклеев А.В. Хроническое радиоизотопное воздействие на жителей реки Теча (Россия) регион: Цитогенетический анализ спустя более 50 лет после начала контакт. Мутат Рез. 2013; 756:115–118. [PubMed] [Академия Google]
10. Аклеев А.В. Хронический лучевой синдром у жителей Течи
прибрежные деревни. Радиат Прот Досим. 2012;151(4):689–696. [PubMed] [Google Scholar]
Аклеев А.В. Хронический лучевой синдром у жителей Течи
прибрежные деревни. Радиат Прот Досим. 2012;151(4):689–696. [PubMed] [Google Scholar]
11. Международная комиссия по радиологической защите. Рекомендации Международной комиссии по Радиологическая защита. Публикация МКРЗ 103. Энн МКРЗ. 2007;37(2–4) [PubMed] [Google Scholar]
12. Balenovic D, Stimac E. Радиационное воздействие. Источники, воздействие и стратегии сокращения. Новая звезда; 2012. ISBN 978-1-62100-869-9. [Google Scholar]
13. Ильин Л.А., редактор. Радиационная медицина V.2. ИздАТ. 2001 ISBN 5 866 56114 X. [Google Scholar]
14. Григорьев Ю.Г., Попов В.И., Шифиркин А.В., Антипенко Ж.Б. Соматические эффекты хронического гамма-облучения. Энергоатомиздат. 1986 [Google Scholar]
15. Муксинова К.Н., Мушкачева Г.С. Клеточно-молекулярные основы перестройки кроветворения у Длительное радиационное облучение. Энергоатомиздат. 1990 ISBN 5 283 030067. [Google Scholar]
16. Fliedner TM, Graessle D, Paulsen C, Reimers K. Структура и функция костномозгового кроветворения: механизмы
реакция на воздействие ионизирующего излучения. Рак Биотер Радиофарм. 2002; 17: 405–426. [PubMed] [Google Scholar]
Структура и функция костномозгового кроветворения: механизмы
реакция на воздействие ионизирующего излучения. Рак Биотер Радиофарм. 2002; 17: 405–426. [PubMed] [Google Scholar]
17. Seed TM, Fritz TE, Tolle DV, Jackson WE., 3rd Кроветворные реакции при длительном воздействии низких ежедневных дозы гамма-облучения. Adv Space Res. 2002; 30: 945–955. [PubMed] [Google Scholar]
18. Сафват А. Иммунобиология низких доз облучения всего тела: подробнее вопросы, чем ответы. Радиационное разрешение 2000;153(5):599–604. [PubMed] [Google Scholar]
19. Пандей Р., Шанкар Б.С., Шарма Д., Сайнис К.Б. Иммуномодуляция, индуцированная низкими дозами радиации: влияние на макрофаги и CD8+ Т-клетки. Int J Radiat Biol. 2005;81(11):801–812. [PubMed] [Google Scholar]
20. Кириллова Е.Н., Муксинова К.Н., Скуковская Т.Л. Влияние длительного непрерывного внешнего облучения на гуморальные показатели иммунитета мышей. Косм Биол Авиакосм Мед. 1988; 22: 62–65. [PubMed] [Google Scholar]
21. Chang WP, Hwang JS, Hung MC, Hu TH, Lee SD, Hwang BF. Хроническое облучение малыми дозами гамма-излучения и изменение
распределение субпопуляций лимфоцитов у жителей радиоактивных
здания. Int J Radiat Biol. 1999;75:1231–1239. [PubMed] [Google Scholar]
Chang WP, Hwang JS, Hung MC, Hu TH, Lee SD, Hwang BF. Хроническое облучение малыми дозами гамма-излучения и изменение
распределение субпопуляций лимфоцитов у жителей радиоактивных
здания. Int J Radiat Biol. 1999;75:1231–1239. [PubMed] [Google Scholar]
22. Аклеев А.В., Косенко М.М. Обобщение результатов исследований долговременного иммунитета к подвергающееся воздействию население. Иммунология. 1991; 6: 4–7. [Google Scholar]
23. Годекмердан А., Озден М., Аяр А., Гурсу М.Ф., Озан А.Т., Серхатлиоглу С. Снижение клеточного и гуморального иммунитета у рабочих. при профессиональном воздействии низких уровней ионизирующего излучения. Арх Мед Рез. 2004; 35: 324–328. [PubMed] [Google Scholar]
24. Артемьева О.В., Серова Л.Д., Семенков В.Ф., Когновицкая А.И., Шабалина В.Н. Влияние малых доз облучения на иммунную ответная реакция. Булл Эксп Биол Мед. 1997;124(11):556–558. [Google Scholar]
25. Асфандиярова Н.С., Ромадин А.Е., Колчева Н.Г., Гончаренко Л.В., Шатров В. В., Саямова Е.А., Шмелкова Н.Б., Шалкин В.Н. Иммунная система у жителей территорий, загрязненных
радионуклиды после аварии на Чернобыльской АЭС. Тер Арх. 1998; 70: 55–59. [PubMed] [Google Scholar]
В., Саямова Е.А., Шмелкова Н.Б., Шалкин В.Н. Иммунная система у жителей территорий, загрязненных
радионуклиды после аварии на Чернобыльской АЭС. Тер Арх. 1998; 70: 55–59. [PubMed] [Google Scholar]
26. Кириллова Е.Н. Показатели иммунитета мышей после длительного приема оксида трития или γ-облучение. Радиобиология. 1990;30(2):175–178. [PubMed] [Google Scholar]
27. Hicks AM, Willingham MC, Du W, Pang CS, Old LJ, Cui Z. Эффекторные механизмы противораковых иммунных реакций макрофаги у мышей SR/CR. Иммунитет к раку. 2006; 6: 11–20. [PubMed] [Академия Google]
28. Рис Г.С., Даниэль К.П., Моррис С.Д., Уайтхаус К.А., Бинкс К., МакГрегор Д.Х., Тон Э.Дж. Профессиональное воздействие ионизирующего излучения не влияет на T- и общее количество В-клеток или процент хелперных, цитотоксических и активированных Субпопуляции Т-клеток в периферической циркуляции мужского излучения рабочие. Int J Radiat Biol. 2004; 80: 493–498. [PubMed] [Google Scholar]
29. Courtade M, Caratero A, Jozan S, Pipy B, Caratero C. Влияние непрерывного гамма-облучения с очень низкими дозами на
иммунная система мыши. Int J Radiat Biol. 2001; 77: 587–59.2. [PubMed] [Google Scholar]
Влияние непрерывного гамма-облучения с очень низкими дозами на
иммунная система мыши. Int J Radiat Biol. 2001; 77: 587–59.2. [PubMed] [Google Scholar]
30. Бурлакова Е.Б., редактор. Последствия Чернобыльской катастрофы: здоровье человека. Издательство Россельхозакадемии; 1996. ISBN 5 885 870195. [Google Scholar]
31. Гелашвили К.Д., Османова В.Р., Хазарбегишвили Н.С., и др. Некоторые параметры иммунного статуса в мед. радиолог. Гигиена и санитария. 1990; 8: 57–59. [PubMed] [Google Scholar]
32. Chang WP, Hwang JS, Hung MC, Hu TH, Lee SD, Hwang BF. Хроническое облучение малыми дозами гамма-излучения и изменение распределение субпопуляций лимфоцитов у жителей радиоактивных здания. Int J Radiat Biol. 1999;75:1231–1239. [PubMed] [Google Scholar]
33. Tuschl H, Steger F, Kovac R. Профессиональное воздействие и его влияние на некоторые иммунные параметры. Физика здоровья. 1995;68(1):59–66. [PubMed] [Google Scholar]
34. Аклеев А.В., Киселев М.Ф., ред. Медико-биологические и экологические последствия радиоактивного загрязнения
реки Теча. Министерство здравоохранения Российской Федерации; Москва: 2001. ISBN 5 809
Министерство здравоохранения Российской Федерации; Москва: 2001. ISBN 5 809
35. Гиасси-нежад М., Мортазави С.М., Кэмерон Дж.Р., Нируоманд-рад А., Карам П.А. Районы с очень высоким радиационным фоном в Рамсаре, Иран: предварительные данные биологические исследования. Физика здоровья. 2002;82(1):87–93. [PubMed] [Google Scholar]
36. Гуськова А.К., Байсоголов Г.Д. Лучевая болезнь у людей. Издательство «Медицина»; 1971. [Google Scholar]
37. Constine LS, Konski A, Ekholm S, McDonald S, Rubin P. Побочные эффекты облучения головного мозга коррелируют с МРТ и КТ. визуализация. Int J Radiat Oncol Biol Phys. 1988; 15: 319–330. [PubMed] [Google Scholar]
38. Li YQ, Chen P, Jain V, Reilly RM, Wong CS. Ранняя радиационно-индуцированная потеря эндотелиальных клеток и спинномозговая разрушение пуповинного барьера в спинном мозге крысы. Радиационное разрешение 2004; 161:143–152. [PubMed] [Академия Google]
39. Manda K, Ueno M, Moritake T, Anzai K. Радиационно-индуцированная когнитивная дисфункция и окислительное окисление мозжечка.
стресс у мышей: защитный эффект альфа-липоевой кислоты. Поведение мозга Res. 2007;177(1):7–14. [PubMed] [Google Scholar]
Радиационно-индуцированная когнитивная дисфункция и окислительное окисление мозжечка.
стресс у мышей: защитный эффект альфа-липоевой кислоты. Поведение мозга Res. 2007;177(1):7–14. [PubMed] [Google Scholar]
40. Nordal RA, Wong CS. Молекулярные мишени в радиационно-индуцированном гематоэнцефалическом барьере нарушение. Int J Radiat Oncol Biol Phys. 2005;62(1):279–287. [PubMed] [Google Scholar]
41. Ван дер Когель А.Дж. Радиационное поражение центральной нервной системы: интерпретация ответов клеток-мишеней. Бр Дж Рак. 1986;7:207–217. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Sklar CA. Опухоли головного мозга у детей. J Pediatr Endocrinol Metab. 2002;15(2):669–673. [PubMed] [Google Scholar]
43. Brougham MF, Kelnar CJ, Wallace WH. Поздние эндокринные последствия рака у детей уход. Педиатр Реабилит. 2002;5(4):191–201. [PubMed] [Google Scholar]
44. Глисон Х.К., Шалет С.М. Влияние терапии рака на эндокринную систему у выживших
опухолей головного мозга у детей. Endocr Relat Рак. 2004;11:589–602. [PubMed] [Google Scholar]
Endocr Relat Рак. 2004;11:589–602. [PubMed] [Google Scholar]
45. Коэн Л.Э. Эндокринные отдаленные последствия лечения рака. Curr Opin Педиатр. 2003; 15:3–9. [PubMed] [Google Scholar]
46. Шведов В.Л., Аклеев А.В. Радиобиология стронция-90. Пегас; Челябинск: 2001. [Google Scholar]
47. Ливси Э.А., Брук К.Г. Дисфункция щитовидной железы после лучевой и химиотерапии головного мозга опухоли. Арч Дис Чайлд. 1990; 64: 593–595. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Cohen LE. Эндокринные отдаленные последствия лечения рака. Эндокринол Метаб Клин Норт Ам. 2005;34(3):769–789. [PubMed] [Google Scholar]
49. Ага А., Шерлок М., Бреннан С., О’Коннор С.А., О’Салливан Э., Роджерс Б., Фаул С., Ролук Д., Торми В., Томпсон С.Дж. Гипоталамо-гипофизарная дисфункция после облучения Негипофизарные опухоли головного мозга у взрослых. J Clin Endocrinol Metab. 2005;90:6355–6360. [PubMed] [Google Scholar]
50. Международная комиссия по радиологической защите. Энн МКРЗ. 3–4. Том. 29. Публикация МКРЗ 83; 1999. Оценка риска многофакторных заболеваний. [PubMed] [Академия Google]
Энн МКРЗ. 3–4. Том. 29. Публикация МКРЗ 83; 1999. Оценка риска многофакторных заболеваний. [PubMed] [Академия Google]
51. Ильин Л.А., редактор. Радиационная медицина V.1. ИздАТ.М. 2004 ISBN 5 866 561727. [Google Scholar]
52. Бакланов П.С., Окладникова Н.Д. Состояние половых и репродуктивных функций у мужчин, подвергшихся воздействию хроническое внешнее облучение. Бык Радиат Мед. 1977; 3: 43–48. [Google Scholar]
53. Ижевский П.В., Аветисов Г.М., Курбатов АВ. Состояние репродуктивной функции в семьях персонала завода по производству ядерных делящихся материалов. Мед Радиол Радиат Безопас. 1998;2:23–27. [Google Scholar]
54. Овчаренко ЕП. Влияние ионизирующего излучения на менструальный цикл. репродуктивные функции, гинекологические заболевания у женщин и состояние их потомство. Бык Радиат Мед. 1981; 1: 53–63. [Google Scholar]
55. Крауз В.С. Состояние функции яичников у женщин, страдающих
хроническая лучевая болезнь. Бык Радиат Мед. 1961; 1а: 138–143. [Google Scholar]
[Google Scholar]
56. Балога В.И., Холоша В.И., Евдин А.Н., Перепелятникова Л.В., Барьяхтар В.Г., Бебешко В.Г., Бурлак Г.Ф., Глыгало В.Н., Гродзинский Д.М., Гудков И.Н. Национальный доклад Украины. Двадцать лет Чернобыля катастрофа. Киев: Аттика; 2006. ISBN 9.663 26169 2. [Google Scholar]
57. Алесина МЮ. Формирование радиобиологических эффектов у экспериментальных животных при малые дозы хронического внутреннего и внешнего облучения. Int J Radiat Med. 1999;2(2):92–99. [Google Scholar]
58. Конопля Е.Ф., Верещако Г.Г., Ходосовская А.М., Рыбаков В.Н., Артеменко О.В. Морфофункциональное состояние репродуктивной системы самцов крыс после хронического низкодозового облучения 1,0 Гр. Радиат биол Радиоэкол. 2002;42(2):136–140. [Академия Google]
59. Рэкхэм Б.Д., Вудхед Д.С. Влияние хронического гамма-облучения на гонады взрослых амеков. splendens (Osteichthyes: Teleostei) Int J Radiat Biol Relat Stud Phys Chem Med. 1984;45(6):645–656. [PubMed] [Google Scholar]
60. Никитин А.И. Факторы окружающей среды и репродуктивная функция человека
система. Морфология. 1998; 6: 7–16. [PubMed] [Google Scholar]
Никитин А.И. Факторы окружающей среды и репродуктивная функция человека
система. Морфология. 1998; 6: 7–16. [PubMed] [Google Scholar]
61. Pinon-Latailade G, Vélez de la Calle JF, Viguier-Martinez MC, Garnier DH, Folliot R, Maas J, Jégou B. Влияние зародышевых клеток на клетки Сертоли во время непрерывного низкодозное гамма-облучение взрослых крыс. Мол Селл Эндокринол. 1988;58(1):51–63. [PubMed] [Google Scholar]
62. Дедов В.И., Норец Т.А. Система гипофиз-яички при длительном внутреннем облучение. Мед Радиол. 1981; 26: 26–29. [PubMed] [Google Scholar]
63. Окладникова Н.Д., Кабашева Н.Я., Шевкунов В.А., Гуськова А.К., Еманова Е.А. Локальное лучевое поражение: оценка последствий и результаты. Вопр Радиат Безопас. 2002; 2:36–43. [Google Scholar]
64. Ayoola A, Lee YJ. Радиационный дерматит с цефотетаном: случай изучать. Онколог. 2006;11(10):1118–1120. [PubMed] [Академия Google]
65. Schmuth M, Sztankay A, Weinlich G, Linder DM, Wimmer MA, Fritsch PO, Fritsch E.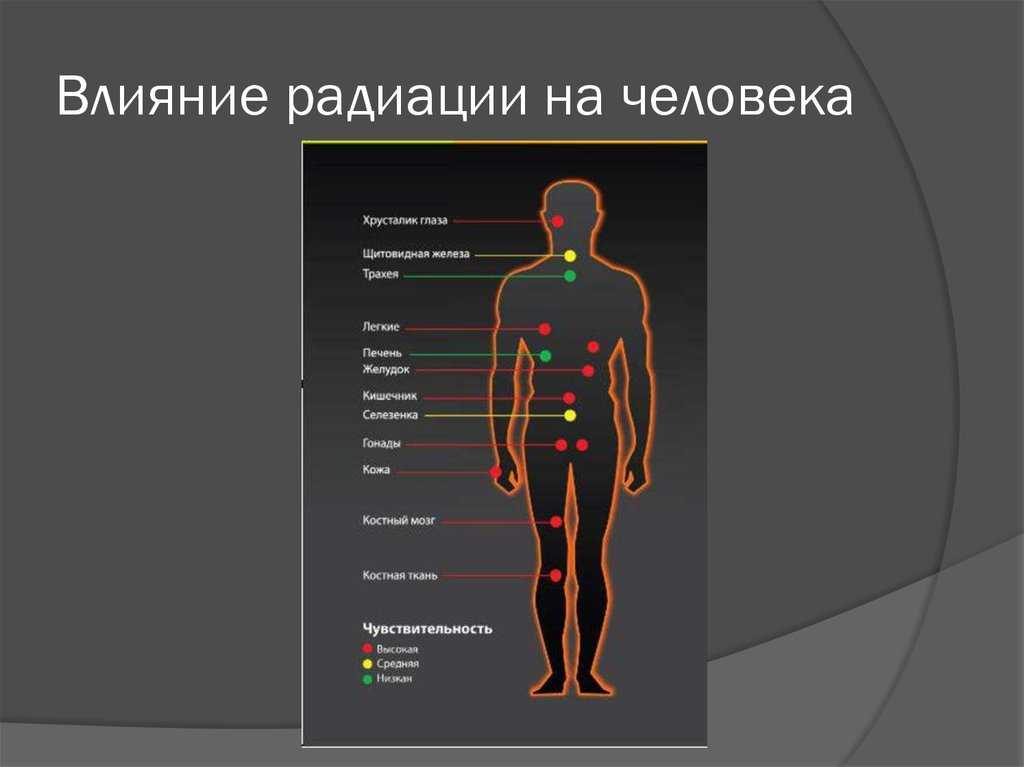 Проницаемость, барьерная функция кожи при воздействии ионизации
излучение. Арка Дерматол. 2001;137(8):1019–1023. [PubMed] [Google Scholar]
Проницаемость, барьерная функция кожи при воздействии ионизации
излучение. Арка Дерматол. 2001;137(8):1019–1023. [PubMed] [Google Scholar]
66. Резвани М., Росс Г.А., Уилкинсон Дж.Х., Байуотерс А. Доказательства гуморального воздействия на радиационную реакцию крыс. кожа стопы. Бр Дж Радиол. 2002; 75: 50–55. [PubMed] [Google Scholar]
67. Димитриевич-Бюссод М., Бальзаретти-Магги В.С., Гадбуа Д.М. Внеклеточный матрикс и радиационная остановка клеточного цикла G1 у человека фибробласты. Рак рез. 1999;59(19):4843–4847. [PubMed] [Google Scholar]
68. Flanders KC, Major CD, Arabshahi A, Aburime EE, Okada MH, Fujii M, Blalock TD, Schultz GS, Sowers A, Anzano MA, et al. Взаимодействие с трансформирующим фактором роста-β/Smad3 Сигнализация приводит к ускоренному заживлению ран у ранее облученных Кожа. Ам Джей Патол. 2003;163(6):2247–2257. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Tomei F, Papaleo B, Fantini S, Iavicoli S, Baccolo TP, Rosati MV. Сосудистые эффекты профессионального воздействия низких доз ионизирующих
излучение. Am J Industrial Med. 1996;30(1):72–77. [PubMed] [Google Scholar]
Am J Industrial Med. 1996;30(1):72–77. [PubMed] [Google Scholar]
70. Movsas B, Raffin TA, Epstein AH, Link CJ. Лучевое поражение легких. Грудь. 1997;111(4):1061–1076. [PubMed] [Google Scholar]
71. Morgan GW, Breit SN. Радиация и легкие: переоценка механизмов опосредованное поражение легких. Int J Radiat Oncol Biol Phys. 1995; 31: 361–369. [PubMed] [Google Scholar]
72. Arpin D, Perol D, Blay JY, Falchero L, Claude L, Vuillermoz-Blas S, Martel-Lafay I, Ginestet C, Alberti L, Nosov D, et al. Ранние варианты циркулирующих интерлейкина-6 и интерлейкина-10 уровни во время торакальной лучевой терапии являются прогностическими для радиации пневмонит. Дж. Клин Онкол. 2005; 23:8748–8756. [PubMed] [Академия Google]
73. Тада Т., Минакучи К., Мацуи К., Кавасэ И., Фукуда Х., Накадзима Т. Лучевой пневмонит после многопольного облучения терапия. Радиат Мед. 2000;18(1):59–61. [PubMed] [Google Scholar]
74. Wall RJ, Schnapp LM. Лучевой пневмонит. Уход за дыханием. 2006;51(11):1255–1260. [PubMed] [Google Scholar]
2006;51(11):1255–1260. [PubMed] [Google Scholar]
75. Абратт Р.П., Морган Г.В. Легочная токсичность после облучения грудной клетки у пациентов с поражением легких рак. Рак легких. 2002;35(2):103–109. [PubMed] [Google Scholar]
76. Muller G, Kiricuta IC, Stiess J, Bohndorf W. Лучевой пневмонит и легочный фиброз после запланированной КТ лучевая терапия рака бронхов. Стралентер Онкол. 1994;170(7):400–407. [PubMed] [Google Scholar]
77. Ньюман Л.С., Мроз М.М., Руттенбер А.Дж. Фиброз легких у плутониевых рабочих. Радиационное разрешение 2005; 164: 123–131. [PubMed] [Google Scholar]
78. Ильин Л.А. Радиационная безопасность. Издательство ИздАТ; 2005. Плутоний. ISBN 5 866 56176 X. [Google Scholar]
79. Coggle JE, Lambert BE, Moores SR. Радиационные эффекты в легких. Перспектива охраны окружающей среды. 1986; 70: 261–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Hill RP. Радиационное воздействие на органы дыхания. Приложение BJR. 2005; 27:75–81. [Академия Google]
[Академия Google]
Базовый обзор радиационной биологии и терминологии
Обзорная статьяНепрерывное образование
Норман Э. Болюс
Journal of Nuclear Medicine Technology, декабрь 2017 г., 45 (4) 259-264; Doi: https://doi.org/10.2967/jnmt.117.195230
- Статья
- Рисунки и данные
- Info & Metrics
 Прочитав эту статью, технолог ядерной медицины будет знаком с основными понятиями радиационной биологии; типы взаимодействия излучения с живой тканью и возможные последствия такого облучения; теоретические кривые доза-реакция и их использование в радиационной биологии; стохастические и нестохастические эффекты радиационного облучения и что означают эти термины в отношении как высоких, так и низких доз облучения; возможные последствия острого и хронического радиационного облучения.
Прочитав эту статью, технолог ядерной медицины будет знаком с основными понятиями радиационной биологии; типы взаимодействия излучения с живой тканью и возможные последствия такого облучения; теоретические кривые доза-реакция и их использование в радиационной биологии; стохастические и нестохастические эффекты радиационного облучения и что означают эти термины в отношении как высоких, так и низких доз облучения; возможные последствия острого и хронического радиационного облучения.- радиационная биология
- радиационное облучение
- стохастические радиационные эффекты
- нестохастические радиационные эффекты
- острые радиационные эффекты
- хронические радиационные эффекты любые незрелые, недифференцированные и активно делящиеся клетки (например, слизистая желудка, базальный слой кожи и стволовые клетки) более радиочувствительны. Они реагируют, проявляя некоторый эффект от радиационного облучения, который вызывает повреждение или гибель клеток.
 Зрелые, дифференцированные и не делящиеся активно клетки (например, нейроны) более радиорезистентны. Радиочувствительная клетка будет более склонна к гибели после воздействия ионизирующего излучения, чем радиорезистентная клетка (1). Хотя в настоящее время используются новые термины, такие как «более или менее радиочувствительный», основные принципы их гипотезы остаются верными для реакций живых тканей на ионизирующее излучение (2). Поэтому клетки, подвергающиеся активному митозу, с большей вероятностью подвержены действию ионизирующего излучения, а стволовые клетки (костный мозг, слизистая желудка, зародышевый слой кожи) гораздо более радиочувствительны, чем нейроны, которые либо никогда не реплицируются, либо делают это очень медленно. Эксперименты на плодовых мушках и мышах показали, что воздействие ионизирующего излучения может вызывать мутации в потомстве, но эти мутации не являются специфическими для радиации. Такие мутации подобны тем, которые уже были обнаружены спонтанно в природе.
Зрелые, дифференцированные и не делящиеся активно клетки (например, нейроны) более радиорезистентны. Радиочувствительная клетка будет более склонна к гибели после воздействия ионизирующего излучения, чем радиорезистентная клетка (1). Хотя в настоящее время используются новые термины, такие как «более или менее радиочувствительный», основные принципы их гипотезы остаются верными для реакций живых тканей на ионизирующее излучение (2). Поэтому клетки, подвергающиеся активному митозу, с большей вероятностью подвержены действию ионизирующего излучения, а стволовые клетки (костный мозг, слизистая желудка, зародышевый слой кожи) гораздо более радиочувствительны, чем нейроны, которые либо никогда не реплицируются, либо делают это очень медленно. Эксперименты на плодовых мушках и мышах показали, что воздействие ионизирующего излучения может вызывать мутации в потомстве, но эти мутации не являются специфическими для радиации. Такие мутации подобны тем, которые уже были обнаружены спонтанно в природе. Кроме того, эксперименты показали, что эффекты ионизирующего излучения зависят от общей дозы и мощности облучения. Большая доза, введенная за короткий промежуток времени, более опасна, чем та же доза, введенная в течение более длительного периода времени (3).
Кроме того, эксперименты показали, что эффекты ионизирующего излучения зависят от общей дозы и мощности облучения. Большая доза, введенная за короткий промежуток времени, более опасна, чем та же доза, введенная в течение более длительного периода времени (3).Взаимодействие радиации с клетками является функцией вероятности. Поскольку обычно имеет место восстановление клеток, необратимое повреждение не обязательно будет результатом взаимодействия ионизирующего излучения с живой тканью. Вклад энергии в клетку происходит очень быстро, примерно за 10 90 202 -18 90 203 с, при этом энергия выделяется в ячейке случайным образом. Все взаимодействия происходят на клеточном уровне, что, в свою очередь, может влиять на орган и всю систему. Кроме того, не существует уникального клеточного повреждения, связанного с радиацией. Любое повреждение клетки из-за воздействия радиации может также произойти из-за химического, термического или физического повреждения. После радиационного облучения клетки существует латентный период перед какой-либо наблюдаемой реакцией.
 Латентный период может составлять десятилетия для низких доз облучения и всего несколько минут или часов для высоких доз облучения. Эти основные обобщения составляют основу, на которой основана радиационная биология (4).
Латентный период может составлять десятилетия для низких доз облучения и всего несколько минут или часов для высоких доз облучения. Эти основные обобщения составляют основу, на которой основана радиационная биология (4).ВЗАИМОДЕЙСТВИЕ ИЗЛУЧЕНИЯ С КЛЕТКАМИ ЧЕЛОВЕКА
Что происходит в клетке при взаимодействии с ней ионизирующего излучения? На самом деле есть только две возможности: прямое взаимодействие или косвенное взаимодействие в клетке.
Прямое взаимодействие
При прямом взаимодействии макромолекулы клетки (белки или ДНК) подвергаются воздействию ионизирующего излучения, которое воздействует на клетку в целом, либо убивая клетку, либо вызывая мутацию ДНК (2). Существует множество исследований выживаемости мишеней и клеток, показывающих, что навсегда разрушить или разорвать двухцепочечную ДНК труднее, чем одноцепочечную ДНК. Хотя у людей 23 пары двухцепочечных хромосом, некоторые клетки реагируют так, как если бы они содержали одноцепочечные непарные хромосомы и были более радиочувствительными.
 Может произойти множество различных типов прямых попаданий, и тип возникающего повреждения определяет, сможет ли клетка восстановить себя. Как правило, если прямое попадание вызывает полный разрыв ДНК или какое-либо другое необратимое повреждение, клетка немедленно погибает или умрет в конце концов (5). Тем не менее, у людей много клеток, и соматическое клеточное размножение (митоз) всегда происходит для замены отмирающих клеток. Следовательно, только тогда, когда эта система замещения клеток дает сбои, можно наблюдать радиационные эффекты. Это происходит при более высоких дозах радиации.
Может произойти множество различных типов прямых попаданий, и тип возникающего повреждения определяет, сможет ли клетка восстановить себя. Как правило, если прямое попадание вызывает полный разрыв ДНК или какое-либо другое необратимое повреждение, клетка немедленно погибает или умрет в конце концов (5). Тем не менее, у людей много клеток, и соматическое клеточное размножение (митоз) всегда происходит для замены отмирающих клеток. Следовательно, только тогда, когда эта система замещения клеток дает сбои, можно наблюдать радиационные эффекты. Это происходит при более высоких дозах радиации.Активно делящиеся клетки более радиочувствительны, чем неделящиеся клетки. Различают 4 фазы митоза: М-фаза, в которой клетки делятся на две; фаза G 1 (пробел 1), в которой клетки готовятся к репликации ДНК; S-фаза, в которой ДНК удваивается за счет репликации; фаза G 2 (пробел 2), в которой клетки готовятся к митозу. Из них М-фаза, в которой хромосомы конденсированы и спарены, является наиболее радиочувствительной.
 В этот момент цикла в одной области присутствует больше ДНК, поэтому предполагается, что это время является наиболее радиочувствительным. Также считается, что повышенный уровень хроматина в раковых клетках является причиной того, что эти клетки с необычно высокой скоростью митоза более радиочувствительны, чем нормальные клетки (6).
В этот момент цикла в одной области присутствует больше ДНК, поэтому предполагается, что это время является наиболее радиочувствительным. Также считается, что повышенный уровень хроматина в раковых клетках является причиной того, что эти клетки с необычно высокой скоростью митоза более радиочувствительны, чем нормальные клетки (6).Непрямое взаимодействие
Другой тип взаимодействия — косвенное клеточное взаимодействие. Косвенное взаимодействие происходит, когда энергия излучения откладывается в клетке и взаимодействует с клеточной водой, а не с макромолекулами внутри клетки. Происходит реакция гидролиза молекулы воды с образованием молекулы водорода и молекулы гидроксила (свободного радикала). Если две гидроксильные молекулы рекомбинируют, они образуют перекись водорода, которая очень нестабильна в клетке. При этом образуется гидроксил перекиси, который легко соединяется с каким-либо органическим соединением, которое затем соединяется в клетке с образованием стабильной органической молекулы перекиси водорода.
 Это может привести к потере жизненно важного фермента в клетке, что может привести к гибели клетки или будущей мутации клетки (таблица 1) (5). Антиоксиданты, о которых было много исследований и публикаций, блокируют рекомбинацию гидроксила (свободного радикала) в перекись водорода, предотвращая появление стабильных органических соединений перекиси водорода. Это один из способов защиты организма от непрямых радиационных взаимодействий на клеточном уровне, и это одна из причин, по которой антиоксидантам уделяется так много внимания в качестве средств профилактики рака (7).
Это может привести к потере жизненно важного фермента в клетке, что может привести к гибели клетки или будущей мутации клетки (таблица 1) (5). Антиоксиданты, о которых было много исследований и публикаций, блокируют рекомбинацию гидроксила (свободного радикала) в перекись водорода, предотвращая появление стабильных органических соединений перекиси водорода. Это один из способов защиты организма от непрямых радиационных взаимодействий на клеточном уровне, и это одна из причин, по которой антиоксидантам уделяется так много внимания в качестве средств профилактики рака (7).ТАБЛИЦА 1
Гидролиз воды (5)
КЛЕТОЧНОЕ ПОВРЕЖДЕНИЕ
Существует 3 пути повреждения клеток после воздействия ионизирующего излучения: задержка деления с дозозависимой задержкой деления клеток; репродуктивная недостаточность, когда клетки не могут завершить митоз либо сразу, либо после одного или нескольких поколений; и интерфазная смерть, относительно быстрая смерть, вызванная механизмом апоптоза.
 Последнее чаще всего наблюдается с лимфоцитами, хотя некоторые раковые клетки обнаруживают апоптоз в ответ на облучение.
Последнее чаще всего наблюдается с лимфоцитами, хотя некоторые раковые клетки обнаруживают апоптоз в ответ на облучение.При задержке деления митотическое деление задерживается, но позже возвращается почти к норме по неизвестным причинам. Это наблюдается в дозах от 0,5 Гр (50 рад) до приблизительно 3 Гр (300 рад). Это первый наблюдаемый эффект воздействия ионизирующего излучения. При дозе более 3 Гр (300 рад) скорость митоза не восстанавливается, и деление может никогда не произойти, что приводит к гибели клетки.
Репродуктивная недостаточность клетки зависит от дозы. При уровнях 1,5 Гр (150 рад) или ниже репродуктивная недостаточность носит случайный и нелинейный характер. При дозах выше 1,5 Гр (150 рад) она носит линейный и неслучайный характер. По мере увеличения дозы увеличивается и репродуктивная смерть.
При интерфазной смерти гибель клеток может произойти через много поколений после первоначального радиационного облучения. Считается, что это либо естественный процесс старения клеток (апоптоз), либо изменен критический механизм репликации клеток.
 Это зависит от типа пораженной клетки и дозы облучения клетки. Как правило, быстро делящиеся недифференцированные клетки проявляют межфазную гибель при более низких дозах, чем неделящиеся дифференцированные клетки.
Это зависит от типа пораженной клетки и дозы облучения клетки. Как правило, быстро делящиеся недифференцированные клетки проявляют межфазную гибель при более низких дозах, чем неделящиеся дифференцированные клетки.Любой из этих типов повреждения клеток может произойти в результате прямого или косвенного взаимодействия клеток с радиацией (5).
МОДЕЛИ «ДОЗА-РЕАКЦИЯ»
Существует много различных теоретических типов моделей «доза-реакция», используемых для объяснения эффектов радиационного облучения. Разные модели предполагают разные возможности реакции на радиационное воздействие. Они варьируются от линейного без порога, что предполагает вредное воздействие любого облучения (даже фонового излучения), до возможности того, что радиационное облучение в малых дозах полезно (радиационный гормезис). В радиационной биологии используются три модели доза-реакция: линейная беспороговая, линейная пороговая и линейно-квадратичная. Эти модели доза-реакция используются для экстраполяции эффектов высоких доз (которые известны) на диапазон низких доз (которые достоверно не обнаружены) (рис.
 1).
1).РИСУНОК 1.
На этом рисунке показаны кривые дозы, которые соответствуют моделям дозы, описанным в тексте. Данные измеряются при высоких уровнях дозы, а затем с использованием методов аппроксимации кривой экстраполируются для оценки участка кривой с низкой дозой. Таким образом, точки данных для низких доз, показанные на этих кривых, оцениваются, а не измеряются.
Линейная беспороговая модель
Для любого известного канцерогена при любом уровне воздействия (например, бензол, асбест или высокая доза радиации) во всех отраслях промышленности используется линейная беспороговая модель доза-реакция. Эта модель утверждает, что любое радиационное воздействие, каким бы малым оно ни было, может вызвать рак. Хотя это возможно, обычно клинические эффекты не наблюдаются ниже примерно 0,5 Гр (50 рад). Линейная беспороговая модель доза-реакция используется в целях регулирования, когда ксенобиотик или другой канцерогенный агент известен при любом уровне дозы (8).

При высоких дозах или более 0,5 Гр (50 рад) начинают проявляться клинические симптомы облучения; при гораздо более высоких дозах радиационное воздействие является известным канцерогеном, в первую очередь из-за его мутагенного действия на клетки. Самая большая ассоциация с лейкемией (9). Однако трудно сказать, что какой-либо рак вызывается исключительно радиационным воздействием, так как рак может быть вызван комбинацией факторов. Поскольку лучше ошибиться в сторону осторожности, используется принцип «настолько низко, насколько это разумно достижимо» (ALARA) и линейная беспороговая модель доза-реакция.
Линейная пороговая модель
Линейная пороговая модель доза-реакция состоит из известного порога, ниже которого эффекты не наблюдаются. На пороговом уровне эффекты заметны и увеличиваются линейно по мере увеличения дозы. Это модель доза-реакция, которую может иметь наибольший смысл для использования, потому что общепринято, что не наблюдается никаких клинических эффектов при радиационном облучении в дозах 0,5 Гр (50 рад) или ниже.
 В 1996 г. Общество физики здоровья опубликовало следующее заявление о позиции по низкоуровневому излучению (10): «В соответствии с текущими знаниями о радиационных рисках для здоровья Общество физики здоровья рекомендует не проводить количественную оценку рисков для здоровья ниже индивидуальной дозы 0,05 Зв. (5 бэр) в год или пожизненная доза 0,1 Зв (10 бэр) в дополнение к радиационному фону. Оценка риска в этом диапазоне доз должна быть строго качественной, акцентируя внимание на ряде гипотетических последствий для здоровья с упором на вероятную возможность отсутствия неблагоприятных последствий для здоровья. Нынешняя философия радиационной защиты основана на предположении, что любая доза радиации, какой бы малой она ни была, может привести к таким последствиям для здоровья человека, как рак и наследственные генетические повреждения. Существуют существенные и убедительные научные данные о рисках для здоровья при высоких дозах. Ниже 0,1 Зв (10 бэр) (включая профессиональное облучение и воздействие окружающей среды) риски воздействия на здоровье либо слишком малы, чтобы их можно было наблюдать, либо вообще отсутствуют».
В 1996 г. Общество физики здоровья опубликовало следующее заявление о позиции по низкоуровневому излучению (10): «В соответствии с текущими знаниями о радиационных рисках для здоровья Общество физики здоровья рекомендует не проводить количественную оценку рисков для здоровья ниже индивидуальной дозы 0,05 Зв. (5 бэр) в год или пожизненная доза 0,1 Зв (10 бэр) в дополнение к радиационному фону. Оценка риска в этом диапазоне доз должна быть строго качественной, акцентируя внимание на ряде гипотетических последствий для здоровья с упором на вероятную возможность отсутствия неблагоприятных последствий для здоровья. Нынешняя философия радиационной защиты основана на предположении, что любая доза радиации, какой бы малой она ни была, может привести к таким последствиям для здоровья человека, как рак и наследственные генетические повреждения. Существуют существенные и убедительные научные данные о рисках для здоровья при высоких дозах. Ниже 0,1 Зв (10 бэр) (включая профессиональное облучение и воздействие окружающей среды) риски воздействия на здоровье либо слишком малы, чтобы их можно было наблюдать, либо вообще отсутствуют». Хотя это заявление о позиции предполагает уровни в 5 раз меньше для клинических эффектов, оно все же указывает на то, что в определенной степени существует порог радиационного облучения. Это утверждение говорит в пользу линейной модели пороговой доза-реакция с порогом 0,1 Зв (10 бэр).
Хотя это заявление о позиции предполагает уровни в 5 раз меньше для клинических эффектов, оно все же указывает на то, что в определенной степени существует порог радиационного облучения. Это утверждение говорит в пользу линейной модели пороговой доза-реакция с порогом 0,1 Зв (10 бэр).Линейно-квадратичная модель
Линейно-квадратичная модель доза-реакция используется для общей реакции человека на радиационное облучение. Реакция при низких уровнях радиационного облучения является линейной, а при более высоких дозах — квадратичной. В этой модели доза-реакция порога нет. В теориях выживания клеток линейно-квадратичная модель доза-реакция используется для представления теории множественных целей/однократного попадания. Эта теория лучше всего объясняет реакцию клеток человека на воздействие ионизирующего излучения.
Краткое изложение моделей доза-реакция
Важно помнить, что для всех моделей доза-реакция доза создает яд. Возможно, лучше всего об этом сказал Парацельс, которого считают отцом токсикологии: «Все вещества являются ядами; нет ничего, что не было бы ядом.
 Правильная доза отличает яд от лекарства» (11). Как правило, по мере увеличения дозы реакция возрастает до точки токсичности; другими словами, все в избытке может быть токсичным. Модели доза-реакция излучения различаются в зависимости от того, что анализируется. Важно помнить, что существуют данные, позволяющие предположить возможный порог радиационного облучения, который благоприятствовал бы линейной модели пороговой доза-реакция. Кроме того, любая модель доза-реакция для излучения на более низких уровнях экстраполируется на то, что известно для высоких уровней дозы. Таким образом, любая низкоуровневая реакция на радиацию является только теоретической, а не доказанной. Единственной моделью доза-реакция, принятой Комиссией по ядерному регулированию, является линейная беспороговая модель доза-реакция, которая предполагает, что любое радиационное воздействие может привести к индукции рака.
Правильная доза отличает яд от лекарства» (11). Как правило, по мере увеличения дозы реакция возрастает до точки токсичности; другими словами, все в избытке может быть токсичным. Модели доза-реакция излучения различаются в зависимости от того, что анализируется. Важно помнить, что существуют данные, позволяющие предположить возможный порог радиационного облучения, который благоприятствовал бы линейной модели пороговой доза-реакция. Кроме того, любая модель доза-реакция для излучения на более низких уровнях экстраполируется на то, что известно для высоких уровней дозы. Таким образом, любая низкоуровневая реакция на радиацию является только теоретической, а не доказанной. Единственной моделью доза-реакция, принятой Комиссией по ядерному регулированию, является линейная беспороговая модель доза-реакция, которая предполагает, что любое радиационное воздействие может привести к индукции рака.СТОХАСТИЧЕСКОЕ ПРОТИВ НЕСТОХАСТИЧЕСКОГО ВОЗДЕЙСТВИЯ РАДИАЦИОННОГО ОБЛУЧЕНИЯ
Стохастическое означает случайный характер.
 Существует статистический учет всех заболеваний, которые могут быть вызваны любым из нескольких различных ксенобиотиков или канцерогенов; любое случайное возникновение заболевания, которое нельзя отнести исключительно к радиации, является стохастическим. Что касается рака, чрезвычайно трудно сказать, связан ли тот или иной рак с конкретным воздействием, потому что у большинства видов рака латентный период от воздействия до проявления составляет 20 лет. Таким образом, эффекты хронического облучения в малых дозах рассматриваются как стохастические. На диагностических уровнях, где дозы малы, стохастические эффекты носят случайный характер, и шансы на какой-либо эффект чрезвычайно малы. Некоторые люди могут испытать эффект от радиационного облучения, но это невозможно предсказать. Радиационные риски от диагностической визуализации считаются стохастическими. Кроме того, эффекты наследственности и канцерогенеза считаются стохастическими (5).
Существует статистический учет всех заболеваний, которые могут быть вызваны любым из нескольких различных ксенобиотиков или канцерогенов; любое случайное возникновение заболевания, которое нельзя отнести исключительно к радиации, является стохастическим. Что касается рака, чрезвычайно трудно сказать, связан ли тот или иной рак с конкретным воздействием, потому что у большинства видов рака латентный период от воздействия до проявления составляет 20 лет. Таким образом, эффекты хронического облучения в малых дозах рассматриваются как стохастические. На диагностических уровнях, где дозы малы, стохастические эффекты носят случайный характер, и шансы на какой-либо эффект чрезвычайно малы. Некоторые люди могут испытать эффект от радиационного облучения, но это невозможно предсказать. Радиационные риски от диагностической визуализации считаются стохастическими. Кроме того, эффекты наследственности и канцерогенеза считаются стохастическими (5).Ионизирующее излучение в высоких дозах вызывает определенные специфические эффекты.
 Следовательно, при определенных дозах можно определить определенные предсказуемые результаты. Они называются нестохастическими или детерминированными эффектами. Эти эффекты очень предсказуемы и варьируются от аберраций крови и хромосом до лучевой болезни и верной смерти, в зависимости от дозы, мощности дозы, возраста, иммунной способности человека и типа радиационного облучения.
Следовательно, при определенных дозах можно определить определенные предсказуемые результаты. Они называются нестохастическими или детерминированными эффектами. Эти эффекты очень предсказуемы и варьируются от аберраций крови и хромосом до лучевой болезни и верной смерти, в зависимости от дозы, мощности дозы, возраста, иммунной способности человека и типа радиационного облучения.Для γ- и рентгеновского излучения экспозиция, измеренная в грей и зивертах (радах и бэрах), одинакова; однако это не относится к нейтронному излучению или когда добротность больше 1 для преобразования рад в бэр. Нестохастические (детерминированные) эффекты включают гематологический синдром (панцитопения), эритему, желудочно-кишечный синдром (лучевая болезнь) и синдром центральной нервной системы (таблица 2).
ТАБЛИЦА 2
Сводка нестохастических (детерминированных) эффектов (5)
Одной из концепций, используемых для оценки токсичности, является смертельная доза для 50% населения (LD 50 ), подвергшихся воздействию агента, наблюдаемая в конкретном время.
 LD 50 через 30 дней (LD 50/30 ) для человека из-за воздействия ионизирующего излучения составляет примерно 2,5–4,5 Гр (250–450 рад). Эта оценка для людей варьируется в зависимости от разных источников и в основном носит эмпирический характер. Поэтому конкретных данных нет. У других организмов LD 9Фактор 0214 50/30 был установлен опытным путем (табл. 3) (5). Таблица 3 на уровне высоких доз. При дозе приблизительно 0,5 Гр (50 рад) или выше острые эффекты предсказуемы и имеют линейный характер. Некоторые хромосомные аберрации можно увидеть под микроскопом при дозе 0,5 Гр (50 рад) или ниже, но при этом не было обнаружено никаких клинических симптомов. Однако его можно использовать в качестве метода биоанализа спустя годы после острого воздействия. В таблице 4 показаны общепринятые острые эффекты и симптомы, которые могут проявляться в этих диапазонах доз (8). Имеются последствия острого воздействия ионизирующего излучения, от которых можно ожидать определенных четко определенных синдромов (таблица 5) (5).
LD 50 через 30 дней (LD 50/30 ) для человека из-за воздействия ионизирующего излучения составляет примерно 2,5–4,5 Гр (250–450 рад). Эта оценка для людей варьируется в зависимости от разных источников и в основном носит эмпирический характер. Поэтому конкретных данных нет. У других организмов LD 9Фактор 0214 50/30 был установлен опытным путем (табл. 3) (5). Таблица 3 на уровне высоких доз. При дозе приблизительно 0,5 Гр (50 рад) или выше острые эффекты предсказуемы и имеют линейный характер. Некоторые хромосомные аберрации можно увидеть под микроскопом при дозе 0,5 Гр (50 рад) или ниже, но при этом не было обнаружено никаких клинических симптомов. Однако его можно использовать в качестве метода биоанализа спустя годы после острого воздействия. В таблице 4 показаны общепринятые острые эффекты и симптомы, которые могут проявляться в этих диапазонах доз (8). Имеются последствия острого воздействия ионизирующего излучения, от которых можно ожидать определенных четко определенных синдромов (таблица 5) (5).
ТАБЛИЦА 4
Резюме острых клинических эффектов ионизирующего излучения (9)
ТАБЛИЦА 5 обнажается нормальная легочная ткань. Другими тканями, на которые проявляются эффекты, являются почки, головной и спинной мозг. Поскольку известно, что при превышении определенного порога происходит повреждение тканей, в лучевой терапии существуют хорошо зарекомендовавшие себя рекомендации по недопущению превышения определенной дозы (12).
Хронические эффекты радиации
Хронические эффекты воздействия ионизирующего излучения в основном носят стохастический характер. Главной проблемой является возможная индукция рака. Однако возможны незлокачественные эффекты, такие как образование катаракты в глазу. Это был бы возможный стохастический хронический эффект, вероятность которого увеличивается с увеличением дозы. Дозы облучения 500–800 Р, направленные на хрусталик глаза, могут вызвать образование катаракты.
 При более низких дозах повреждение похоже на старческую катаракту, но менее серьезное. Другой возможный хронический стохастический эффект — сокращение продолжительности жизни. Хотя убедительных доказательств этого нет, в некоторой литературе это теоретизируется (8).
При более низких дозах повреждение похоже на старческую катаракту, но менее серьезное. Другой возможный хронический стохастический эффект — сокращение продолжительности жизни. Хотя убедительных доказательств этого нет, в некоторой литературе это теоретизируется (8).В качестве стохастического эффекта лейкемия была связана с хроническим радиационным облучением в дозах всего 50–100 сГр (50–100 рад). Между 100 и 500 сГр (100–500 рад) существует линейная корреляция между дозой и заболеваемостью лейкемией. Данные свидетельствуют о том, что в результате облучения заболеваемость лейкемией увеличивается со скоростью 1–2 случая на миллион в год на градус грей (1 рад). Средний латентный период составляет 14 лет от воздействия до начала заболевания. Более высокие дозы ионизирующего излучения также связаны с раком щитовидной железы, костей, легких и различными другими видами рака (8).
Интересно, что нет убедительных доказательств того, что хроническое радиационное облучение в низких дозах вызывает какие-либо долгосрочные последствия для здоровья у работников медицины (13).
 Кроме того, нет никаких доказательств того, что регулярное фоновое облучение вызывает какие-либо долгосрочные последствия. В таблице 6 указаны среднегодовые эквиваленты эффективной дозы ионизирующего излучения на одного жителя США. По сравнению с количеством радиации, которое вызывает известную реакцию, эти уровни низки. Точно так же дозы облучения всего тела, которые пациенты получают в результате различных процедур ядерной медицины, невелики, как видно из таблицы 7. Технологи должны следить за своими отчетами о дозиметрии радиации, чтобы отслеживать свое собственное профессиональное облучение. Тем не менее, технологи, которые остаются ниже принятых пределов профессионального облучения, не должны ожидать каких-либо побочных эффектов.
Кроме того, нет никаких доказательств того, что регулярное фоновое облучение вызывает какие-либо долгосрочные последствия. В таблице 6 указаны среднегодовые эквиваленты эффективной дозы ионизирующего излучения на одного жителя США. По сравнению с количеством радиации, которое вызывает известную реакцию, эти уровни низки. Точно так же дозы облучения всего тела, которые пациенты получают в результате различных процедур ядерной медицины, невелики, как видно из таблицы 7. Технологи должны следить за своими отчетами о дозиметрии радиации, чтобы отслеживать свое собственное профессиональное облучение. Тем не менее, технологи, которые остаются ниже принятых пределов профессионального облучения, не должны ожидать каких-либо побочных эффектов.ТАБЛИЦА 6
Среднегодовая эффективная доза, эквивалентная члену населения США (14,16)
ТАБЛИЦА 7 радиационная биология задумана как обзор терминологии и понятий. К сожалению, убедительная информация неуловима из-за низких уровней радиационного облучения, с которыми сталкиваются технологи.
 Стохастические эффекты радиационного облучения в малых дозах теоретизируются только на основе экстраполяции данных известных реакций на радиационное облучение в высоких дозах. Эффекты высоких доз облучения хорошо известны и следуют нестохастическим (детерминированным) реакциям. В сфере безопасности защита персонала, работающего с известными канцерогенами, имеет первостепенное значение. Радиационная промышленность ничем не отличается от других отраслей, которые имеют пороговые предельные значения и индексы биологического облучения для облучения рабочих. Эти допустимые пределы являются ориентиром для приемлемого воздействия, ниже которого не ожидается каких-либо побочных эффектов. В радиационной промышленности они известны как общие эквиваленты эффективной дозы (таблица 8).
Стохастические эффекты радиационного облучения в малых дозах теоретизируются только на основе экстраполяции данных известных реакций на радиационное облучение в высоких дозах. Эффекты высоких доз облучения хорошо известны и следуют нестохастическим (детерминированным) реакциям. В сфере безопасности защита персонала, работающего с известными канцерогенами, имеет первостепенное значение. Радиационная промышленность ничем не отличается от других отраслей, которые имеют пороговые предельные значения и индексы биологического облучения для облучения рабочих. Эти допустимые пределы являются ориентиром для приемлемого воздействия, ниже которого не ожидается каких-либо побочных эффектов. В радиационной промышленности они известны как общие эквиваленты эффективной дозы (таблица 8).ТАБЛИЦА 8
Предельные дозы профессионального облучения (пределы суммарной эффективной эквивалентной дозы) (15)
Радиационная биология — это разнообразная область, охватывающая многие области знаний, включая клеточную биологию, химию, радиационную физику, физиологию человека, радиационную безопасность, эпидемиологию биостатистики и токсикологии.
 Информация по этой теме продолжает развиваться по мере получения новых знаний о взаимодействии ионизирующего излучения с клетками. Углубление в радиационную биологию без понимания основных концепций, изложенных в этой статье, может сбить с толку. Имейте в виду, что в этом обзоре едва ли начинается обсуждение всей доступной информации о радиационной биологии.
Информация по этой теме продолжает развиваться по мере получения новых знаний о взаимодействии ионизирующего излучения с клетками. Углубление в радиационную биологию без понимания основных концепций, изложенных в этой статье, может сбить с толку. Имейте в виду, что в этом обзоре едва ли начинается обсуждение всей доступной информации о радиационной биологии.Сноски
↵* Эта основная обзорная статья была ранее опубликована в Journal of Nuclear Medicine Technology в июне 2001 г.
Кредит CE: а также дополнительные тесты JNMT CE, онлайн на https://www.snmmilearningcenter.org. Пройдите онлайн-тест не позднее декабря 2020 года. Ваш онлайн-тест будет оценен немедленно. Вы можете сделать 3 попытки пройти тест и должны правильно ответить на 80% вопросов, чтобы получить 1,0 кредита CEH (час непрерывного образования). Члены SNMMI будут автоматически добавлять свой кредит CEH к их расшифровке VOICE; лица, не являющиеся членами, смогут распечатать сертификат CE после успешного прохождения теста.
 Онлайн-тест бесплатен для членов SNMMI; лица, не являющиеся членами, должны заплатить 15 долларов США с помощью кредитной карты при входе на веб-сайт, чтобы пройти тест.
Онлайн-тест бесплатен для членов SNMMI; лица, не являющиеся членами, должны заплатить 15 долларов США с помощью кредитной карты при входе на веб-сайт, чтобы пройти тест.
РЕФЕРЕНЦИИ
- 1.↵
- Bergoni J,
- Tribondeau L
. De quelques resultsats радиотерапии и essai метода фиксации дюны rationelle. ЧР акад. 1906;143:983.
- 2.↵
- Ниас AHW
. Введение в радиобиологию. 2-е изд. Чичестер, Англия: Wiley; 1998; 4.
- 3.↵
- Muller HJ
. Искусственная трансмутация гена. Наука. 1927;66:84.
- 4.↵
- Сирам Э
. Радиационная защита. Филадельфия, Пенсильвания: Липпинкотт; 1997: 74–92.
- 5.↵
- Дауд С.
 Б.,
Б., - Тилсон ER
. Практическая радиационная защита и прикладная радиобиология. 2-е изд. Филадельфия, Пенсильвания: Сондерс; 1999: 118–120.
- Дауд С.
- 6.↵
- Чепмен Д.Д.,
- Stobbe CC,
- Gales T,
- и др.
. Конденсированный хроматин и инактивация клеток по кинетике одиночного удара. Рез. 1999; 151:433–41.
- 7.↵
- Ралофф Дж.
. Группа увеличивает RDA для некоторых антиоксидантов. Новости науки. 15 апреля 2000 г.: 244.
- 8.↵
Внедрение принципа разумно достижимого минимума (ALARA) для медицинского и стоматологического персонала. Bethesda, MD: Национальный совет по радиационной защите и измерениям; 1990.
- 9.↵
- Ладу Дж.
.
 Профессиональная медицина. Норуолк, Коннектикут: Appleton & Lange; 1990: 197–198.
Профессиональная медицина. Норуолк, Коннектикут: Appleton & Lange; 1990: 197–198. - 10.↵
- Mossman KL,
- Goldman M,
- Masse F,
- и др.
. Радиационный риск в перспективе: Заявление о позиции Общества физики здоровья. Веб-сайт факультета физики и физики здоровья Университета штата Айдахо. http://www.physics.isu.edu/radinf/hprisk.htm. Опубликовано 19 марта96. По состоянию на 14 марта 2017 г.
- 11.↵
- Klaassen CD
, изд. Токсикология Казаретта и Доулла: фундаментальная наука о ядах. Нью-Йорк, штат Нью-Йорк: McGraw-Hill; 1996:4.
- 12.↵
- Селман Дж.
. Элементы радиобиологии. Спрингфилд, Иллинойс: Чарльз С. Томас; 1983: 98.
- 13.↵
- Болюс NE
.



 3
3 5
5
 Ту же дозу можно получить, если сделать 10–15 рентгеновских снимков за день.
Ту же дозу можно получить, если сделать 10–15 рентгеновских снимков за день.


 Зрелые, дифференцированные и не делящиеся активно клетки (например, нейроны) более радиорезистентны. Радиочувствительная клетка будет более склонна к гибели после воздействия ионизирующего излучения, чем радиорезистентная клетка (1). Хотя в настоящее время используются новые термины, такие как «более или менее радиочувствительный», основные принципы их гипотезы остаются верными для реакций живых тканей на ионизирующее излучение (2). Поэтому клетки, подвергающиеся активному митозу, с большей вероятностью подвержены действию ионизирующего излучения, а стволовые клетки (костный мозг, слизистая желудка, зародышевый слой кожи) гораздо более радиочувствительны, чем нейроны, которые либо никогда не реплицируются, либо делают это очень медленно. Эксперименты на плодовых мушках и мышах показали, что воздействие ионизирующего излучения может вызывать мутации в потомстве, но эти мутации не являются специфическими для радиации. Такие мутации подобны тем, которые уже были обнаружены спонтанно в природе.
Зрелые, дифференцированные и не делящиеся активно клетки (например, нейроны) более радиорезистентны. Радиочувствительная клетка будет более склонна к гибели после воздействия ионизирующего излучения, чем радиорезистентная клетка (1). Хотя в настоящее время используются новые термины, такие как «более или менее радиочувствительный», основные принципы их гипотезы остаются верными для реакций живых тканей на ионизирующее излучение (2). Поэтому клетки, подвергающиеся активному митозу, с большей вероятностью подвержены действию ионизирующего излучения, а стволовые клетки (костный мозг, слизистая желудка, зародышевый слой кожи) гораздо более радиочувствительны, чем нейроны, которые либо никогда не реплицируются, либо делают это очень медленно. Эксперименты на плодовых мушках и мышах показали, что воздействие ионизирующего излучения может вызывать мутации в потомстве, но эти мутации не являются специфическими для радиации. Такие мутации подобны тем, которые уже были обнаружены спонтанно в природе.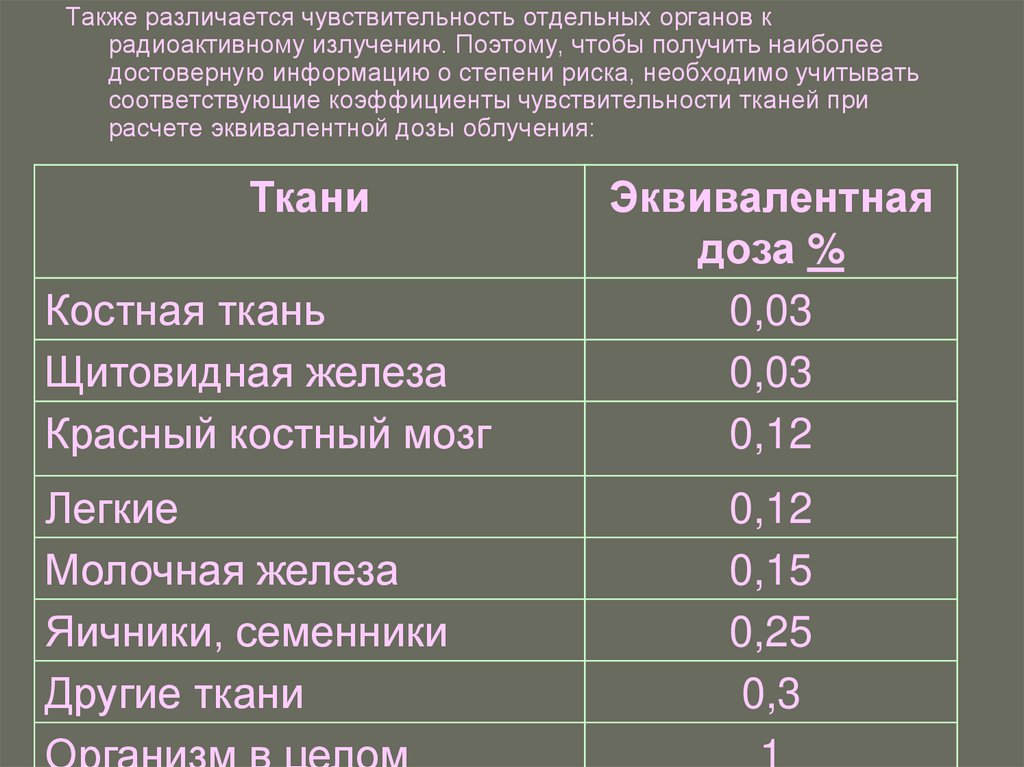 Кроме того, эксперименты показали, что эффекты ионизирующего излучения зависят от общей дозы и мощности облучения. Большая доза, введенная за короткий промежуток времени, более опасна, чем та же доза, введенная в течение более длительного периода времени (3).
Кроме того, эксперименты показали, что эффекты ионизирующего излучения зависят от общей дозы и мощности облучения. Большая доза, введенная за короткий промежуток времени, более опасна, чем та же доза, введенная в течение более длительного периода времени (3). Латентный период может составлять десятилетия для низких доз облучения и всего несколько минут или часов для высоких доз облучения. Эти основные обобщения составляют основу, на которой основана радиационная биология (4).
Латентный период может составлять десятилетия для низких доз облучения и всего несколько минут или часов для высоких доз облучения. Эти основные обобщения составляют основу, на которой основана радиационная биология (4). Может произойти множество различных типов прямых попаданий, и тип возникающего повреждения определяет, сможет ли клетка восстановить себя. Как правило, если прямое попадание вызывает полный разрыв ДНК или какое-либо другое необратимое повреждение, клетка немедленно погибает или умрет в конце концов (5). Тем не менее, у людей много клеток, и соматическое клеточное размножение (митоз) всегда происходит для замены отмирающих клеток. Следовательно, только тогда, когда эта система замещения клеток дает сбои, можно наблюдать радиационные эффекты. Это происходит при более высоких дозах радиации.
Может произойти множество различных типов прямых попаданий, и тип возникающего повреждения определяет, сможет ли клетка восстановить себя. Как правило, если прямое попадание вызывает полный разрыв ДНК или какое-либо другое необратимое повреждение, клетка немедленно погибает или умрет в конце концов (5). Тем не менее, у людей много клеток, и соматическое клеточное размножение (митоз) всегда происходит для замены отмирающих клеток. Следовательно, только тогда, когда эта система замещения клеток дает сбои, можно наблюдать радиационные эффекты. Это происходит при более высоких дозах радиации. В этот момент цикла в одной области присутствует больше ДНК, поэтому предполагается, что это время является наиболее радиочувствительным. Также считается, что повышенный уровень хроматина в раковых клетках является причиной того, что эти клетки с необычно высокой скоростью митоза более радиочувствительны, чем нормальные клетки (6).
В этот момент цикла в одной области присутствует больше ДНК, поэтому предполагается, что это время является наиболее радиочувствительным. Также считается, что повышенный уровень хроматина в раковых клетках является причиной того, что эти клетки с необычно высокой скоростью митоза более радиочувствительны, чем нормальные клетки (6). Это может привести к потере жизненно важного фермента в клетке, что может привести к гибели клетки или будущей мутации клетки (таблица 1) (5). Антиоксиданты, о которых было много исследований и публикаций, блокируют рекомбинацию гидроксила (свободного радикала) в перекись водорода, предотвращая появление стабильных органических соединений перекиси водорода. Это один из способов защиты организма от непрямых радиационных взаимодействий на клеточном уровне, и это одна из причин, по которой антиоксидантам уделяется так много внимания в качестве средств профилактики рака (7).
Это может привести к потере жизненно важного фермента в клетке, что может привести к гибели клетки или будущей мутации клетки (таблица 1) (5). Антиоксиданты, о которых было много исследований и публикаций, блокируют рекомбинацию гидроксила (свободного радикала) в перекись водорода, предотвращая появление стабильных органических соединений перекиси водорода. Это один из способов защиты организма от непрямых радиационных взаимодействий на клеточном уровне, и это одна из причин, по которой антиоксидантам уделяется так много внимания в качестве средств профилактики рака (7).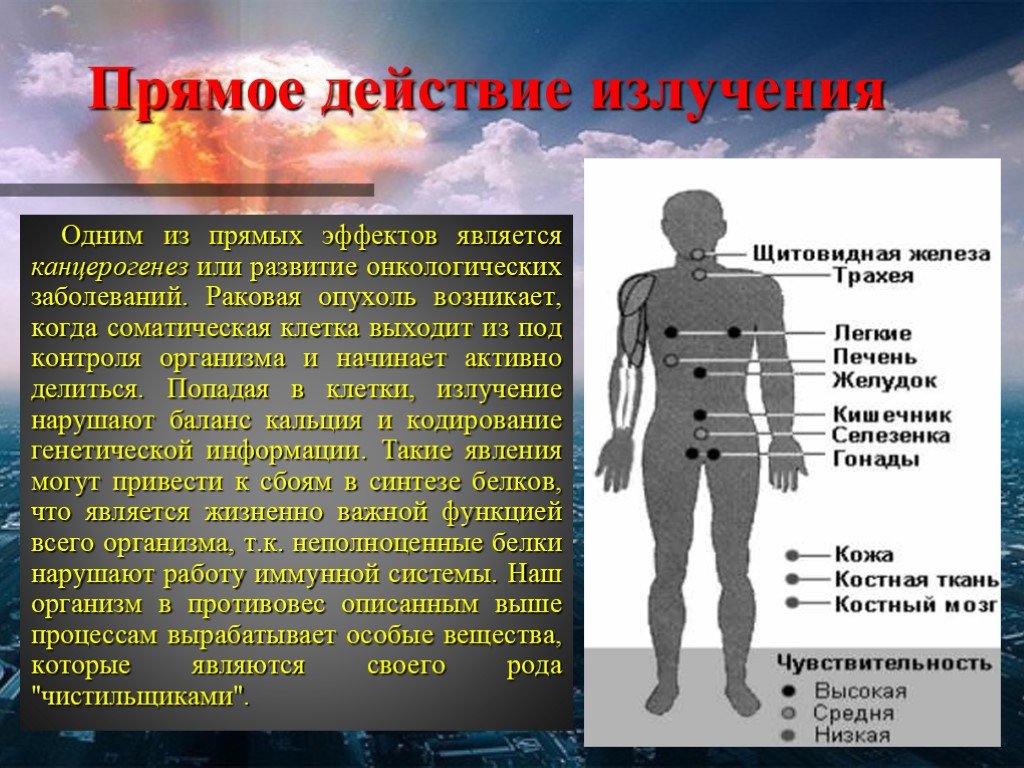 Последнее чаще всего наблюдается с лимфоцитами, хотя некоторые раковые клетки обнаруживают апоптоз в ответ на облучение.
Последнее чаще всего наблюдается с лимфоцитами, хотя некоторые раковые клетки обнаруживают апоптоз в ответ на облучение. Это зависит от типа пораженной клетки и дозы облучения клетки. Как правило, быстро делящиеся недифференцированные клетки проявляют межфазную гибель при более низких дозах, чем неделящиеся дифференцированные клетки.
Это зависит от типа пораженной клетки и дозы облучения клетки. Как правило, быстро делящиеся недифференцированные клетки проявляют межфазную гибель при более низких дозах, чем неделящиеся дифференцированные клетки. 1).
1).
 В 1996 г. Общество физики здоровья опубликовало следующее заявление о позиции по низкоуровневому излучению (10): «В соответствии с текущими знаниями о радиационных рисках для здоровья Общество физики здоровья рекомендует не проводить количественную оценку рисков для здоровья ниже индивидуальной дозы 0,05 Зв. (5 бэр) в год или пожизненная доза 0,1 Зв (10 бэр) в дополнение к радиационному фону. Оценка риска в этом диапазоне доз должна быть строго качественной, акцентируя внимание на ряде гипотетических последствий для здоровья с упором на вероятную возможность отсутствия неблагоприятных последствий для здоровья. Нынешняя философия радиационной защиты основана на предположении, что любая доза радиации, какой бы малой она ни была, может привести к таким последствиям для здоровья человека, как рак и наследственные генетические повреждения. Существуют существенные и убедительные научные данные о рисках для здоровья при высоких дозах. Ниже 0,1 Зв (10 бэр) (включая профессиональное облучение и воздействие окружающей среды) риски воздействия на здоровье либо слишком малы, чтобы их можно было наблюдать, либо вообще отсутствуют».
В 1996 г. Общество физики здоровья опубликовало следующее заявление о позиции по низкоуровневому излучению (10): «В соответствии с текущими знаниями о радиационных рисках для здоровья Общество физики здоровья рекомендует не проводить количественную оценку рисков для здоровья ниже индивидуальной дозы 0,05 Зв. (5 бэр) в год или пожизненная доза 0,1 Зв (10 бэр) в дополнение к радиационному фону. Оценка риска в этом диапазоне доз должна быть строго качественной, акцентируя внимание на ряде гипотетических последствий для здоровья с упором на вероятную возможность отсутствия неблагоприятных последствий для здоровья. Нынешняя философия радиационной защиты основана на предположении, что любая доза радиации, какой бы малой она ни была, может привести к таким последствиям для здоровья человека, как рак и наследственные генетические повреждения. Существуют существенные и убедительные научные данные о рисках для здоровья при высоких дозах. Ниже 0,1 Зв (10 бэр) (включая профессиональное облучение и воздействие окружающей среды) риски воздействия на здоровье либо слишком малы, чтобы их можно было наблюдать, либо вообще отсутствуют». Хотя это заявление о позиции предполагает уровни в 5 раз меньше для клинических эффектов, оно все же указывает на то, что в определенной степени существует порог радиационного облучения. Это утверждение говорит в пользу линейной модели пороговой доза-реакция с порогом 0,1 Зв (10 бэр).
Хотя это заявление о позиции предполагает уровни в 5 раз меньше для клинических эффектов, оно все же указывает на то, что в определенной степени существует порог радиационного облучения. Это утверждение говорит в пользу линейной модели пороговой доза-реакция с порогом 0,1 Зв (10 бэр). Правильная доза отличает яд от лекарства» (11). Как правило, по мере увеличения дозы реакция возрастает до точки токсичности; другими словами, все в избытке может быть токсичным. Модели доза-реакция излучения различаются в зависимости от того, что анализируется. Важно помнить, что существуют данные, позволяющие предположить возможный порог радиационного облучения, который благоприятствовал бы линейной модели пороговой доза-реакция. Кроме того, любая модель доза-реакция для излучения на более низких уровнях экстраполируется на то, что известно для высоких уровней дозы. Таким образом, любая низкоуровневая реакция на радиацию является только теоретической, а не доказанной. Единственной моделью доза-реакция, принятой Комиссией по ядерному регулированию, является линейная беспороговая модель доза-реакция, которая предполагает, что любое радиационное воздействие может привести к индукции рака.
Правильная доза отличает яд от лекарства» (11). Как правило, по мере увеличения дозы реакция возрастает до точки токсичности; другими словами, все в избытке может быть токсичным. Модели доза-реакция излучения различаются в зависимости от того, что анализируется. Важно помнить, что существуют данные, позволяющие предположить возможный порог радиационного облучения, который благоприятствовал бы линейной модели пороговой доза-реакция. Кроме того, любая модель доза-реакция для излучения на более низких уровнях экстраполируется на то, что известно для высоких уровней дозы. Таким образом, любая низкоуровневая реакция на радиацию является только теоретической, а не доказанной. Единственной моделью доза-реакция, принятой Комиссией по ядерному регулированию, является линейная беспороговая модель доза-реакция, которая предполагает, что любое радиационное воздействие может привести к индукции рака. Существует статистический учет всех заболеваний, которые могут быть вызваны любым из нескольких различных ксенобиотиков или канцерогенов; любое случайное возникновение заболевания, которое нельзя отнести исключительно к радиации, является стохастическим. Что касается рака, чрезвычайно трудно сказать, связан ли тот или иной рак с конкретным воздействием, потому что у большинства видов рака латентный период от воздействия до проявления составляет 20 лет. Таким образом, эффекты хронического облучения в малых дозах рассматриваются как стохастические. На диагностических уровнях, где дозы малы, стохастические эффекты носят случайный характер, и шансы на какой-либо эффект чрезвычайно малы. Некоторые люди могут испытать эффект от радиационного облучения, но это невозможно предсказать. Радиационные риски от диагностической визуализации считаются стохастическими. Кроме того, эффекты наследственности и канцерогенеза считаются стохастическими (5).
Существует статистический учет всех заболеваний, которые могут быть вызваны любым из нескольких различных ксенобиотиков или канцерогенов; любое случайное возникновение заболевания, которое нельзя отнести исключительно к радиации, является стохастическим. Что касается рака, чрезвычайно трудно сказать, связан ли тот или иной рак с конкретным воздействием, потому что у большинства видов рака латентный период от воздействия до проявления составляет 20 лет. Таким образом, эффекты хронического облучения в малых дозах рассматриваются как стохастические. На диагностических уровнях, где дозы малы, стохастические эффекты носят случайный характер, и шансы на какой-либо эффект чрезвычайно малы. Некоторые люди могут испытать эффект от радиационного облучения, но это невозможно предсказать. Радиационные риски от диагностической визуализации считаются стохастическими. Кроме того, эффекты наследственности и канцерогенеза считаются стохастическими (5). Следовательно, при определенных дозах можно определить определенные предсказуемые результаты. Они называются нестохастическими или детерминированными эффектами. Эти эффекты очень предсказуемы и варьируются от аберраций крови и хромосом до лучевой болезни и верной смерти, в зависимости от дозы, мощности дозы, возраста, иммунной способности человека и типа радиационного облучения.
Следовательно, при определенных дозах можно определить определенные предсказуемые результаты. Они называются нестохастическими или детерминированными эффектами. Эти эффекты очень предсказуемы и варьируются от аберраций крови и хромосом до лучевой болезни и верной смерти, в зависимости от дозы, мощности дозы, возраста, иммунной способности человека и типа радиационного облучения. LD 50 через 30 дней (LD 50/30 ) для человека из-за воздействия ионизирующего излучения составляет примерно 2,5–4,5 Гр (250–450 рад). Эта оценка для людей варьируется в зависимости от разных источников и в основном носит эмпирический характер. Поэтому конкретных данных нет. У других организмов LD 9Фактор 0214 50/30 был установлен опытным путем (табл. 3) (5). Таблица 3 на уровне высоких доз. При дозе приблизительно 0,5 Гр (50 рад) или выше острые эффекты предсказуемы и имеют линейный характер. Некоторые хромосомные аберрации можно увидеть под микроскопом при дозе 0,5 Гр (50 рад) или ниже, но при этом не было обнаружено никаких клинических симптомов. Однако его можно использовать в качестве метода биоанализа спустя годы после острого воздействия. В таблице 4 показаны общепринятые острые эффекты и симптомы, которые могут проявляться в этих диапазонах доз (8). Имеются последствия острого воздействия ионизирующего излучения, от которых можно ожидать определенных четко определенных синдромов (таблица 5) (5).
LD 50 через 30 дней (LD 50/30 ) для человека из-за воздействия ионизирующего излучения составляет примерно 2,5–4,5 Гр (250–450 рад). Эта оценка для людей варьируется в зависимости от разных источников и в основном носит эмпирический характер. Поэтому конкретных данных нет. У других организмов LD 9Фактор 0214 50/30 был установлен опытным путем (табл. 3) (5). Таблица 3 на уровне высоких доз. При дозе приблизительно 0,5 Гр (50 рад) или выше острые эффекты предсказуемы и имеют линейный характер. Некоторые хромосомные аберрации можно увидеть под микроскопом при дозе 0,5 Гр (50 рад) или ниже, но при этом не было обнаружено никаких клинических симптомов. Однако его можно использовать в качестве метода биоанализа спустя годы после острого воздействия. В таблице 4 показаны общепринятые острые эффекты и симптомы, которые могут проявляться в этих диапазонах доз (8). Имеются последствия острого воздействия ионизирующего излучения, от которых можно ожидать определенных четко определенных синдромов (таблица 5) (5).
 При более низких дозах повреждение похоже на старческую катаракту, но менее серьезное. Другой возможный хронический стохастический эффект — сокращение продолжительности жизни. Хотя убедительных доказательств этого нет, в некоторой литературе это теоретизируется (8).
При более низких дозах повреждение похоже на старческую катаракту, но менее серьезное. Другой возможный хронический стохастический эффект — сокращение продолжительности жизни. Хотя убедительных доказательств этого нет, в некоторой литературе это теоретизируется (8). Кроме того, нет никаких доказательств того, что регулярное фоновое облучение вызывает какие-либо долгосрочные последствия. В таблице 6 указаны среднегодовые эквиваленты эффективной дозы ионизирующего излучения на одного жителя США. По сравнению с количеством радиации, которое вызывает известную реакцию, эти уровни низки. Точно так же дозы облучения всего тела, которые пациенты получают в результате различных процедур ядерной медицины, невелики, как видно из таблицы 7. Технологи должны следить за своими отчетами о дозиметрии радиации, чтобы отслеживать свое собственное профессиональное облучение. Тем не менее, технологи, которые остаются ниже принятых пределов профессионального облучения, не должны ожидать каких-либо побочных эффектов.
Кроме того, нет никаких доказательств того, что регулярное фоновое облучение вызывает какие-либо долгосрочные последствия. В таблице 6 указаны среднегодовые эквиваленты эффективной дозы ионизирующего излучения на одного жителя США. По сравнению с количеством радиации, которое вызывает известную реакцию, эти уровни низки. Точно так же дозы облучения всего тела, которые пациенты получают в результате различных процедур ядерной медицины, невелики, как видно из таблицы 7. Технологи должны следить за своими отчетами о дозиметрии радиации, чтобы отслеживать свое собственное профессиональное облучение. Тем не менее, технологи, которые остаются ниже принятых пределов профессионального облучения, не должны ожидать каких-либо побочных эффектов. Стохастические эффекты радиационного облучения в малых дозах теоретизируются только на основе экстраполяции данных известных реакций на радиационное облучение в высоких дозах. Эффекты высоких доз облучения хорошо известны и следуют нестохастическим (детерминированным) реакциям. В сфере безопасности защита персонала, работающего с известными канцерогенами, имеет первостепенное значение. Радиационная промышленность ничем не отличается от других отраслей, которые имеют пороговые предельные значения и индексы биологического облучения для облучения рабочих. Эти допустимые пределы являются ориентиром для приемлемого воздействия, ниже которого не ожидается каких-либо побочных эффектов. В радиационной промышленности они известны как общие эквиваленты эффективной дозы (таблица 8).
Стохастические эффекты радиационного облучения в малых дозах теоретизируются только на основе экстраполяции данных известных реакций на радиационное облучение в высоких дозах. Эффекты высоких доз облучения хорошо известны и следуют нестохастическим (детерминированным) реакциям. В сфере безопасности защита персонала, работающего с известными канцерогенами, имеет первостепенное значение. Радиационная промышленность ничем не отличается от других отраслей, которые имеют пороговые предельные значения и индексы биологического облучения для облучения рабочих. Эти допустимые пределы являются ориентиром для приемлемого воздействия, ниже которого не ожидается каких-либо побочных эффектов. В радиационной промышленности они известны как общие эквиваленты эффективной дозы (таблица 8).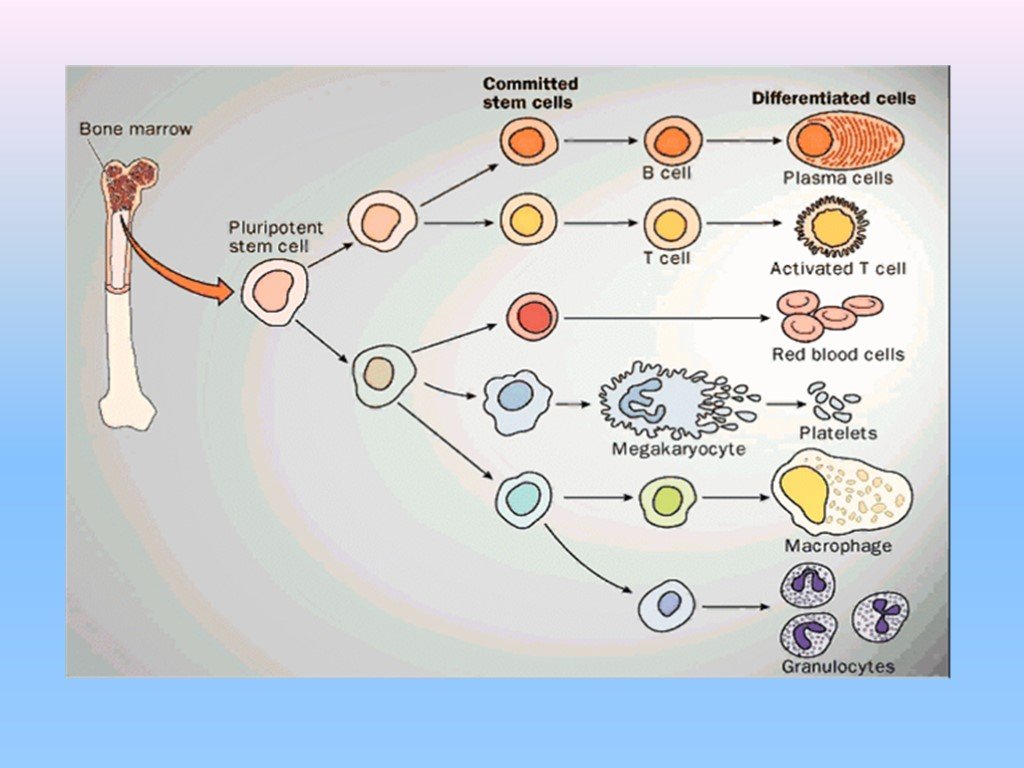 Информация по этой теме продолжает развиваться по мере получения новых знаний о взаимодействии ионизирующего излучения с клетками. Углубление в радиационную биологию без понимания основных концепций, изложенных в этой статье, может сбить с толку. Имейте в виду, что в этом обзоре едва ли начинается обсуждение всей доступной информации о радиационной биологии.
Информация по этой теме продолжает развиваться по мере получения новых знаний о взаимодействии ионизирующего излучения с клетками. Углубление в радиационную биологию без понимания основных концепций, изложенных в этой статье, может сбить с толку. Имейте в виду, что в этом обзоре едва ли начинается обсуждение всей доступной информации о радиационной биологии. Онлайн-тест бесплатен для членов SNMMI; лица, не являющиеся членами, должны заплатить 15 долларов США с помощью кредитной карты при входе на веб-сайт, чтобы пройти тест.
Онлайн-тест бесплатен для членов SNMMI; лица, не являющиеся членами, должны заплатить 15 долларов США с помощью кредитной карты при входе на веб-сайт, чтобы пройти тест. Б.,
Б., Профессиональная медицина. Норуолк, Коннектикут: Appleton & Lange; 1990: 197–198.
Профессиональная медицина. Норуолк, Коннектикут: Appleton & Lange; 1990: 197–198. 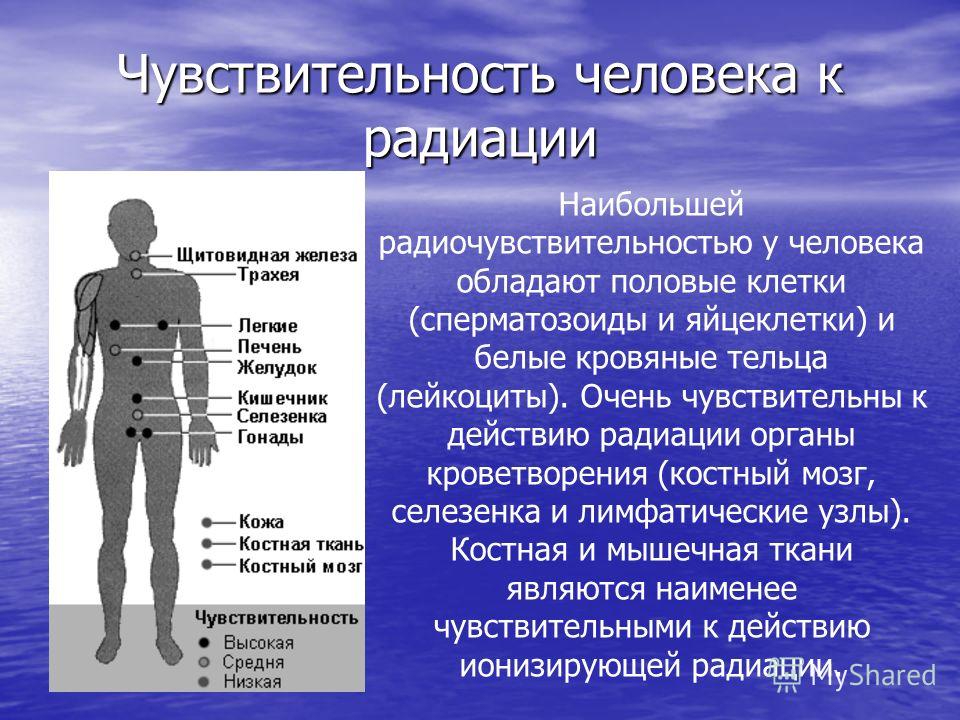
Leave A Comment