Химическая связь и строение молекул | Задания 61
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Молекула воды Н2О имеет дипольный момент, значит, она имеет нелинейное строение. В образовании связей между атомами кислорода и водорода участвуют один атом кислорода и два атома водорода. Кислород – цейтральный атом в молекуле воды, и он имеет четыре электронные пары, две пары неподелённые и две – поделённые, которые образованы одним s-электроном и одним р-электроном кислорода. Такая молекула имеет тетраэдрическое строение в центре тетраэдра находится атом кислорода, а по углам тетраэдра два атома водорода и две неподелённые электронные пары кислорода. В такой молекуле угол между связями должен быть равен 109,5
В образовании связей между атомами кислорода и водорода участвуют один атом кислорода и два атома водорода. Кислород – цейтральный атом в молекуле воды, и он имеет четыре электронные пары, две пары неподелённые и две – поделённые, которые образованы одним s-электроном и одним р-электроном кислорода. Такая молекула имеет тетраэдрическое строение в центре тетраэдра находится атом кислорода, а по углам тетраэдра два атома водорода и две неподелённые электронные пары кислорода. В такой молекуле угол между связями должен быть равен 109,5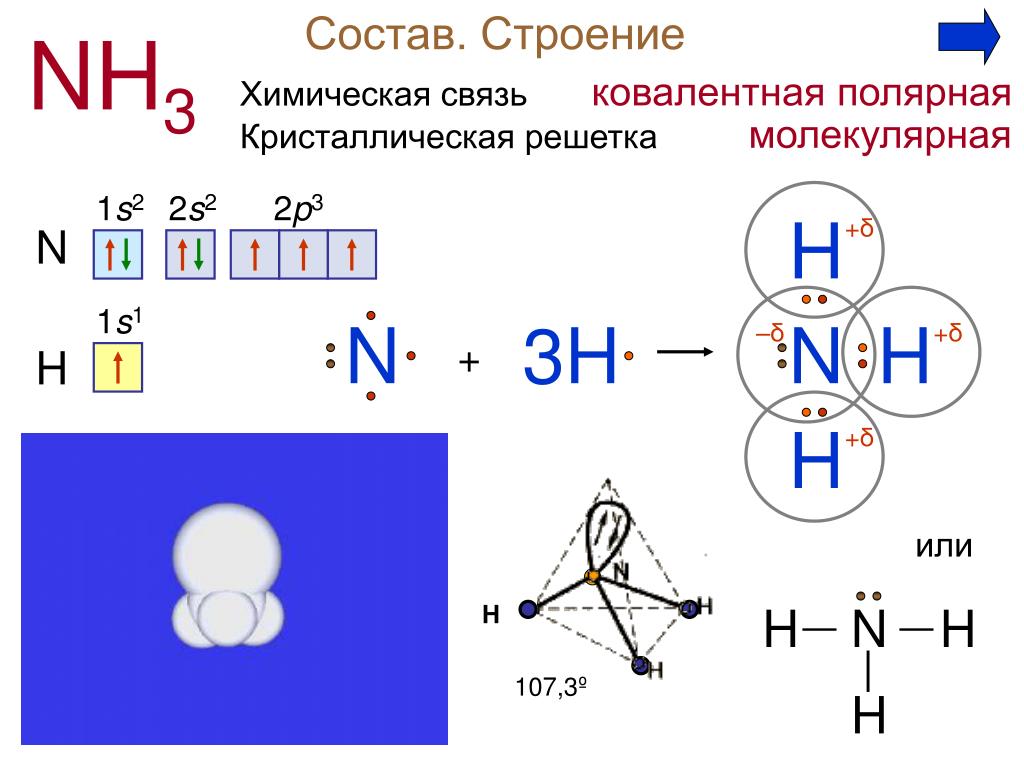 Из четырёх sp3-гибридных орбиталей две заняты s-орбиталями атома водорода. Разница между значениями валентного угла и тетраэдрическим углом объясняется тем, что отталкивание между неподелёнными электронными парами больше, чем между связывающими.
Из четырёх sp3-гибридных орбиталей две заняты s-орбиталями атома водорода. Разница между значениями валентного угла и тетраэдрическим углом объясняется тем, что отталкивание между неподелёнными электронными парами больше, чем между связывающими.
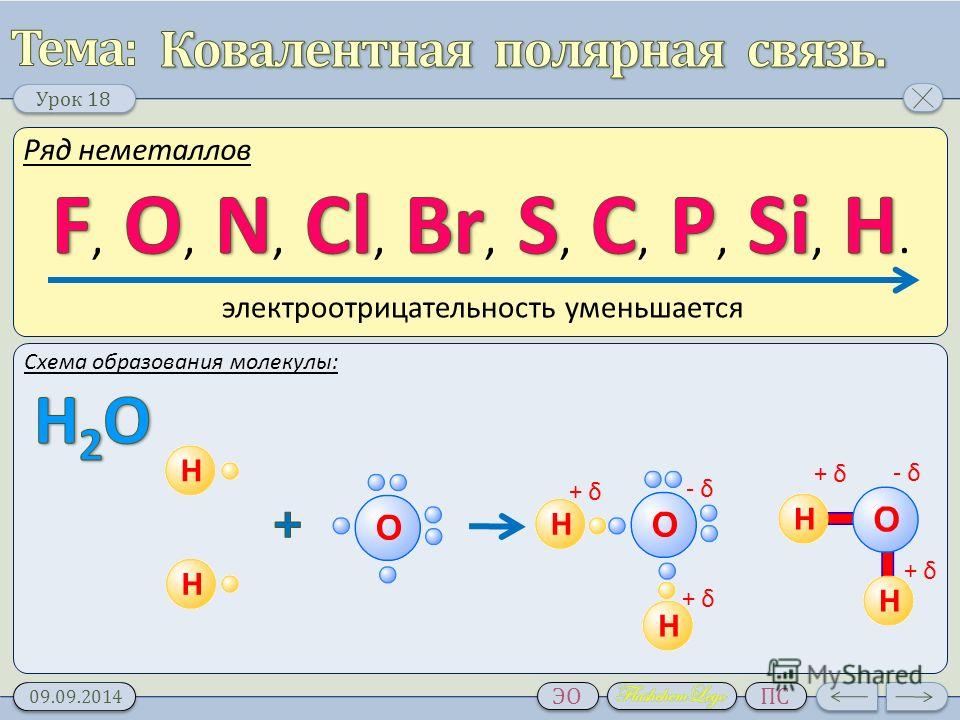
Полярная ковалентная связь
Задание 62.
Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HCl, IСl, ВгF наиболее полярна.
Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени.
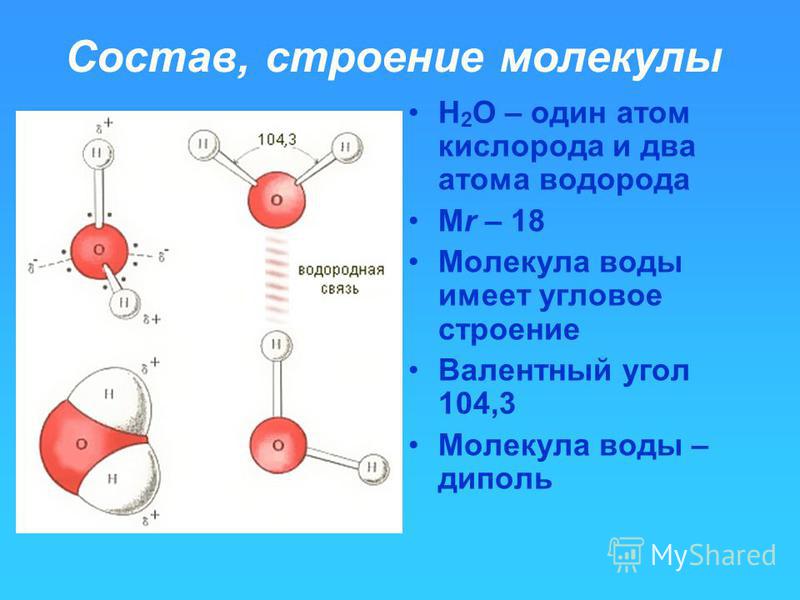
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Наряду с дипольным моментом , для оценки степени полярности связи используют характеристику, называемую электроотрицательностью элемента (ЭО). ЭО – это способность атома притягивать к себе валентные электроны других атомов.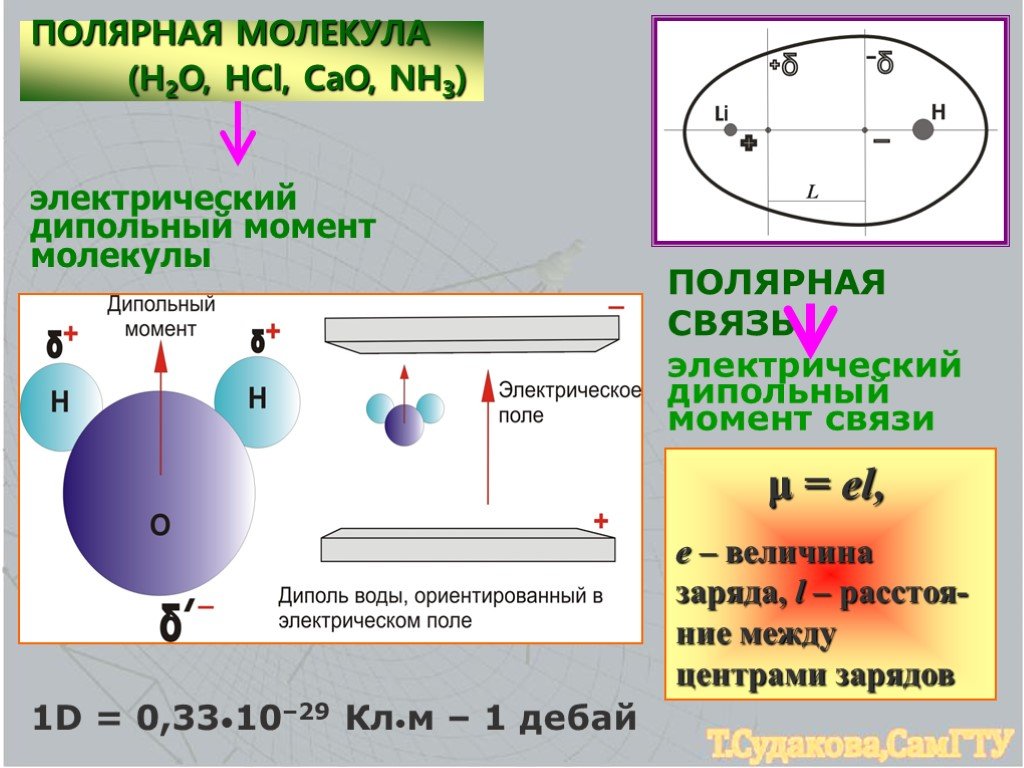
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
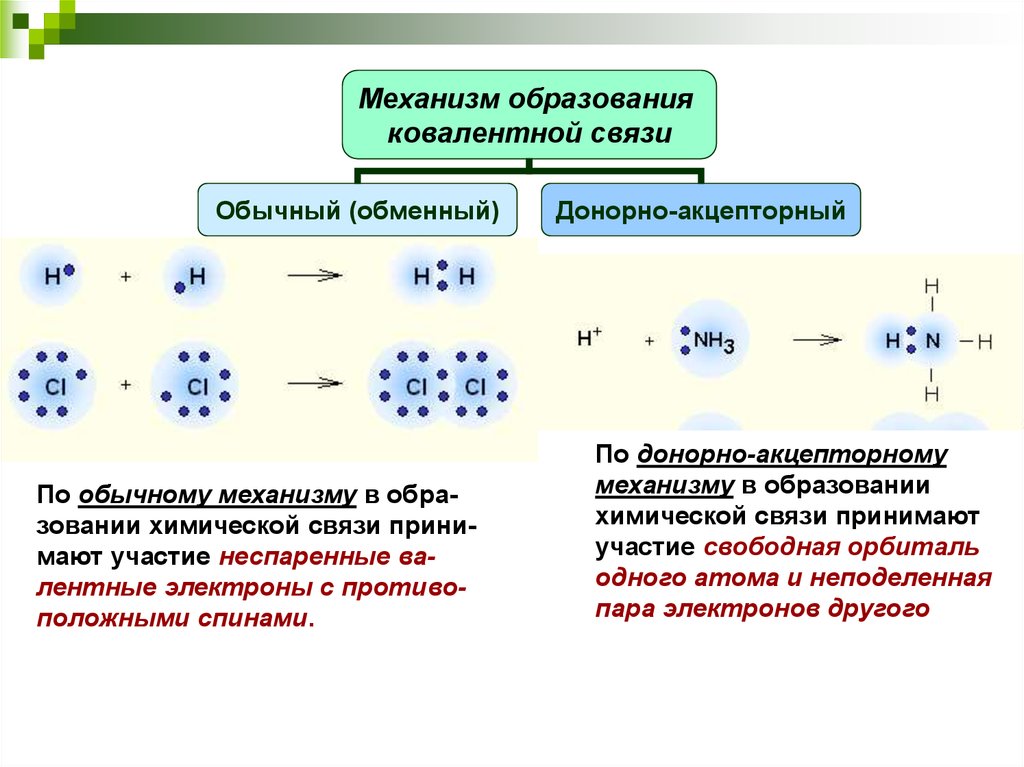
Донорно-акцепторная связь
Задание 63.
Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор.
Решение:
Донорно-акцепторная связь – это ковалентная связь, в которой обобществлённую пару электронов предоставляет только один из участвующих в связи атомов. При этом один из атомов является донором – поставщиком электронной пары, а другой – акцептором – поставщиком свободной квантовой орбитали.
Катион аммония NH4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму.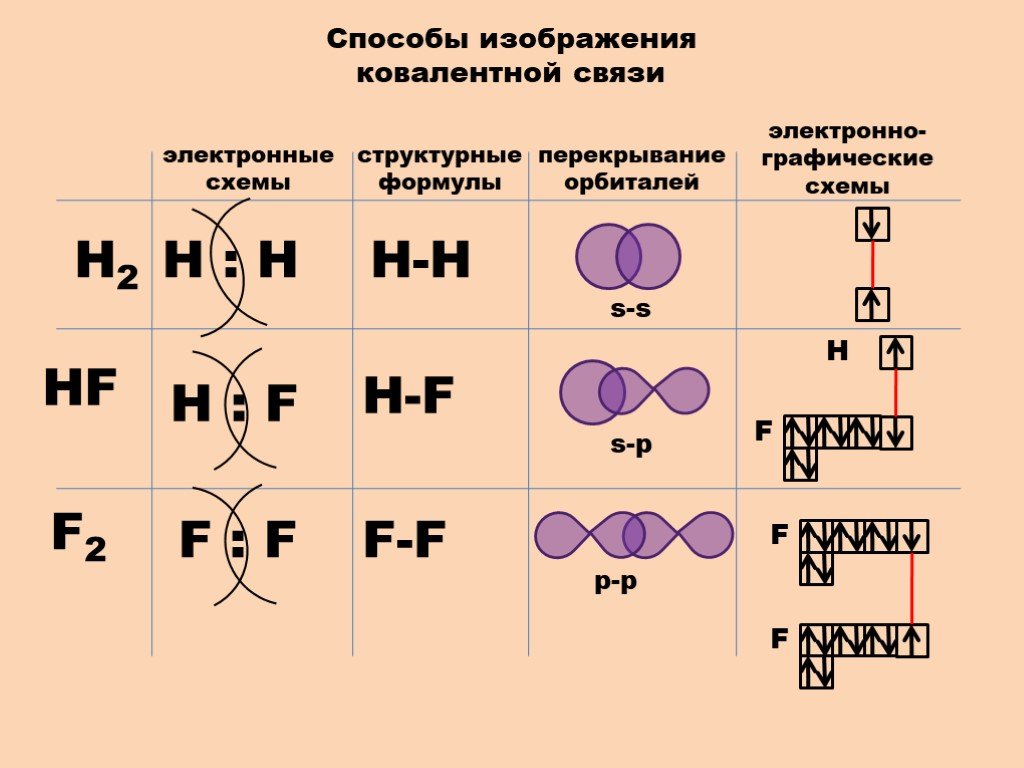 Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF
Донорно-акцепторная связь в структурных формулах изображается стрелкой которая направлена от донора к акцептору.
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул.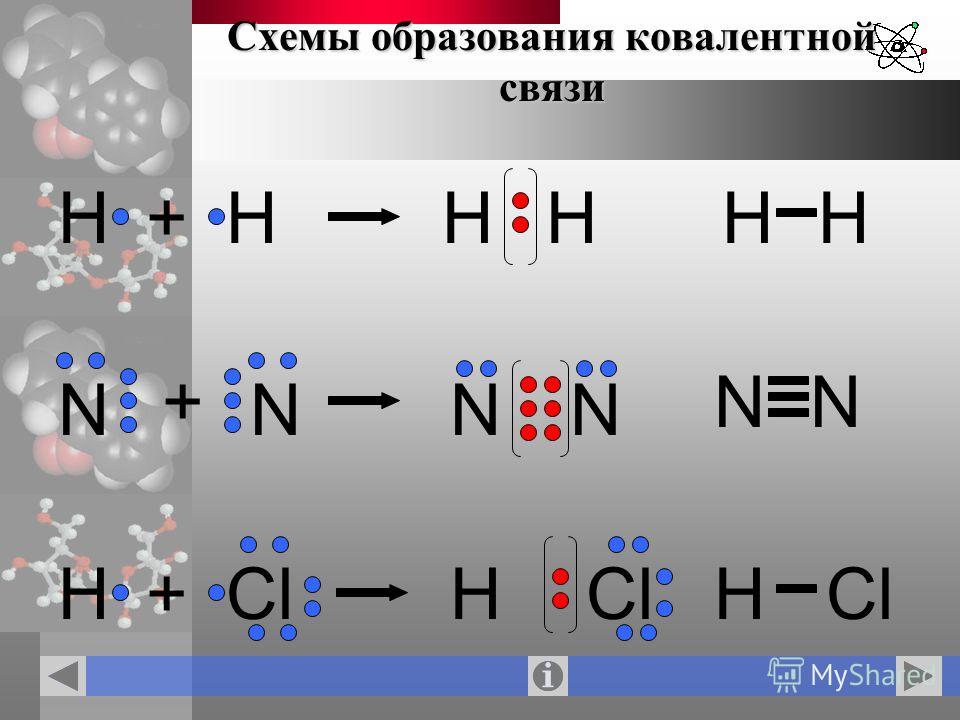 Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl
Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl
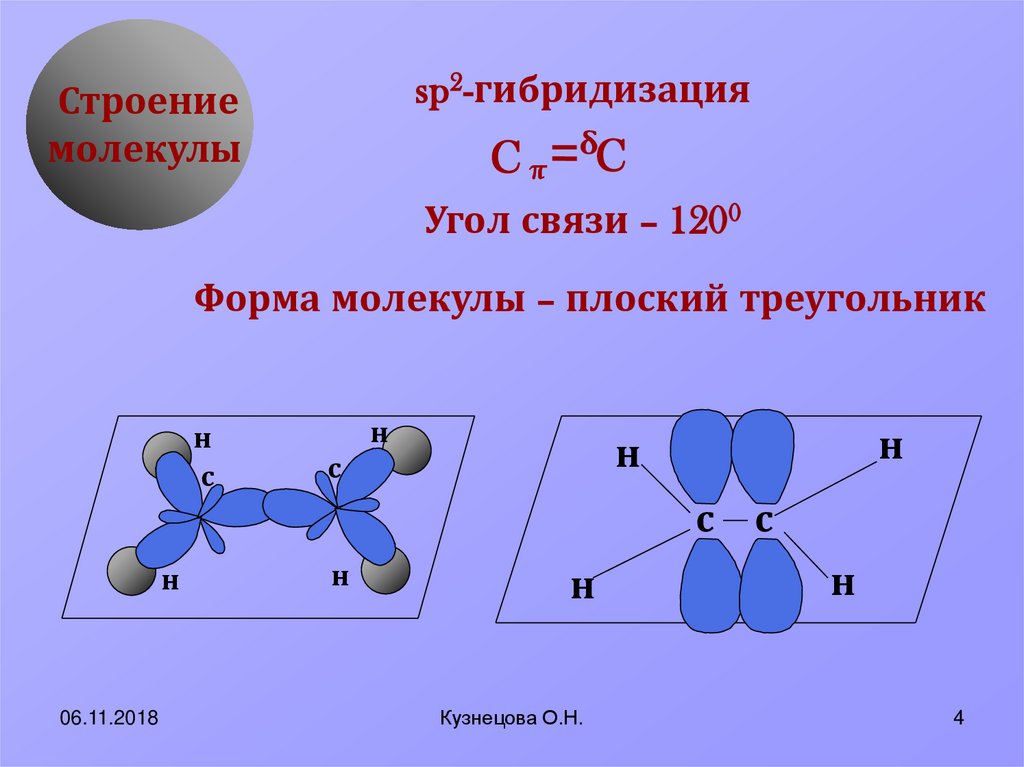
р — р связь и s — p могут располагаться друг относительно друга под углом, т. е. молекула BeCl2 должна быть угловой, но точно установлено, что молекула BeCl2 имеет линейное строение, причём обе — связи равны по энергии и по длине. Для объяснения геометрии молекулы BeCl Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. Так в атоме Ве s-орбиталь и р-орбиталь вступают во взаимодействие, их энергии выравниваются и образуются две одинаковые по форме sp-гибридные орбитали. Два образовавшихся sp-гибридных электронных облака имеют одинаковую энергию и ассиметричную форму, которая обеспечивает большее перекрывание р-электронными облаками атома хлора, чем перекрывание с участием чистых негибридизированных s- и р-облаков. Два гибридных sp-облака располагаются относительно друг друга и ядра атома под углом 180
Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. Так в атоме Ве s-орбиталь и р-орбиталь вступают во взаимодействие, их энергии выравниваются и образуются две одинаковые по форме sp-гибридные орбитали. Два образовавшихся sp-гибридных электронных облака имеют одинаковую энергию и ассиметричную форму, которая обеспечивает большее перекрывание р-электронными облаками атома хлора, чем перекрывание с участием чистых негибридизированных s- и р-облаков. Два гибридных sp-облака располагаются относительно друг друга и ядра атома под углом 180
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи.
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Из четырёх связей в молекуле СН4 должны быть одна s — s и три s — p связи, образованные за счёт перекрывания орбиталей атома углерода с s-орбиталью атомов водорода. В результате этого перекрывания должна образоваться связь 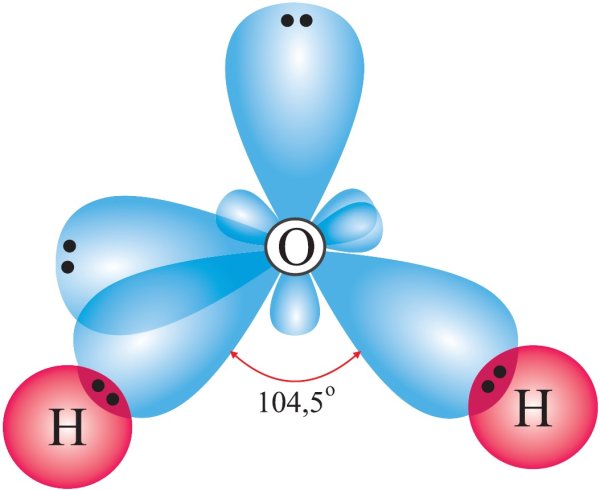 Атом углерода содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации s-орбитали и трёх p-орбиталей. Четыре sp3-гибридные орбитали располагаются друг относительно друга под углом 109,50. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 2.).
Атом углерода содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации s-орбитали и трёх p-орбиталей. Четыре sp3-гибридные орбитали располагаются друг относительно друга под углом 109,50. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 2.).
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Таким образом, в молекуле СН4 образуются четыре равноценные химические -связи за счёт перекрывания sp3-гибридных орбиталей атома углерода с s-орбиталями атомов углерода.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют -связью и какую -связью? Разберите на примере строения молекулы азота.
Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют -связью (любая простая связь) или «Если перекрывание атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь ( -связь). Сигма-связь образуется за счёт перекрывания двух s-орбиталей (s — s связь), одной s- и одной р-орбиталью (s — p связь), двумя р-орбиталями (р — р связь), одной s— и одной d-орбиталью (s — d связь), одной p— и одной d-орбиталью (p — d связь).
Сигма-связь образуется за счёт перекрывания двух s-орбиталей (s — s связь), одной s- и одной р-орбиталью (s — p связь), двумя р-орбиталями (р — р связь), одной s— и одной d-орбиталью (s — d связь), одной p— и одной d-орбиталью (p — d связь).
Варианты перекрывания атомных орбиталей, приводящие к образованию -связи (рис.1.):
Рис. 1.Схемы образования -связей
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется -связью. Вариантов образования -связи немного (рис. 2.):
Рис. 1.Схемы образования -связей
Она не так прочна как сигма-связь, поскольку перекрывание в -связи намного слабее. -связи никогда не образуются , если нет -связи. Иными словами, -связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну -связь и две -связи: .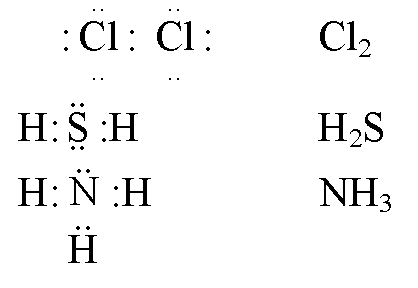 Атом азота на внешнем энергетическом уровне содержит пять электронов: два на s-орбитали и три неспаренных электрона на р-орбиталях. За счёт перекрывания р-электрона одного атома и р-электрона другого атома азота образуется
Атом азота на внешнем энергетическом уровне содержит пять электронов: два на s-орбитали и три неспаренных электрона на р-орбиталях. За счёт перекрывания р-электрона одного атома и р-электрона другого атома азота образуется
-связь. Две другие связи являются -связями, которые образовались за счёт перекрывания двух р-электронов одного атома и двух р-электронов другого ниже и выше и перпендикулярно друг другу по отношению плоскости -связи.
Почему вода необходима для жизни? EcoWater
Вода составляет 60-75% веса человеческого тела. Потеря всего 4% воды в организме приводит к обезвоживанию, а потеря 15% может быть смертельной. Поэтому, хотя человек может прожить месяц без еды, но без воды он обычно не может прожить больше 3 дней. Эта критическая зависимость от воды является ключевым регулятором всех форм жизни. Ясно, что вода необходима для выживания, но почему она так важна?
Вода с молекулярной точки зрения
Многие функции воды в поддержании жизни обусловлены ее молекулярной структурой и несколькими особыми свойствами.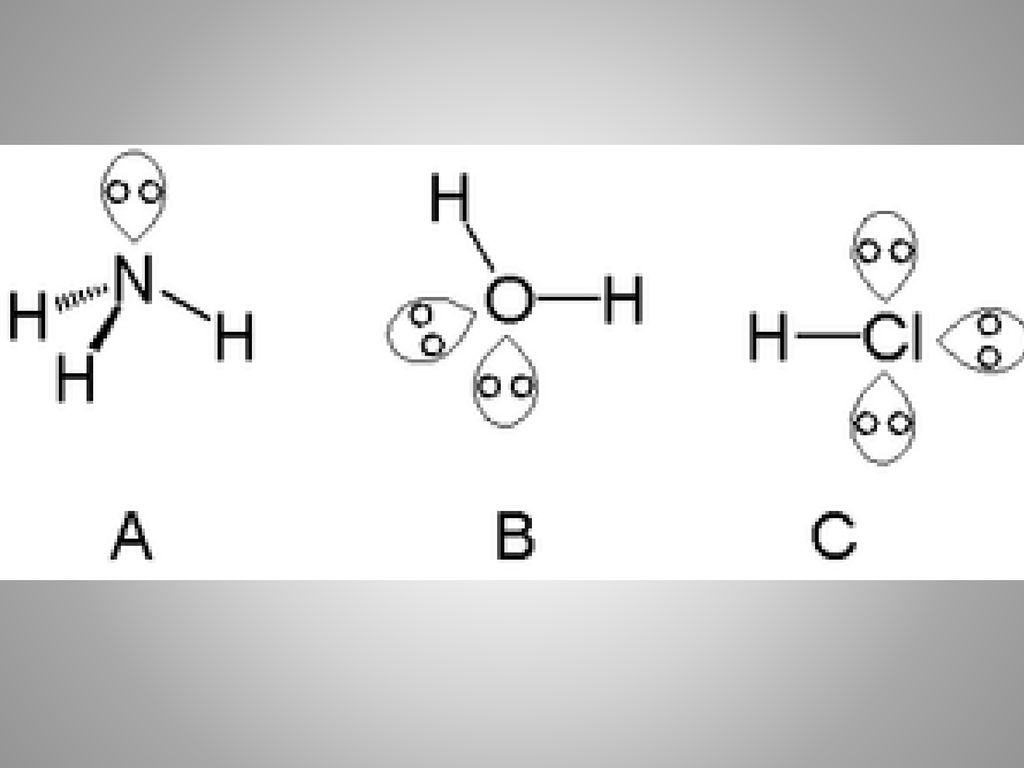 Вода — это простая молекула, состоящая из двух небольших положительно заряженных атомов водорода и одного большого отрицательно заряженного атома кислорода. Когда атомы водорода связываются с кислородом, образуется асимметричная молекула с положительным зарядом на одной стороне и отрицательным — на другой (рис. 1). Эта разница в зарядах называется полярностью, и она определяет способ взаимодействия воды с другими молекулами.
Вода — это простая молекула, состоящая из двух небольших положительно заряженных атомов водорода и одного большого отрицательно заряженного атома кислорода. Когда атомы водорода связываются с кислородом, образуется асимметричная молекула с положительным зарядом на одной стороне и отрицательным — на другой (рис. 1). Эта разница в зарядах называется полярностью, и она определяет способ взаимодействия воды с другими молекулами.
Рисунок 1: Химический состав воды. Молекулы воды состоят из двух атомов водорода и одного кислорода. Эти атомы различаются по размеру и заряду, что приводит к асимметрии в молекулярной структуре и к прочным связям между водой и другими полярными молекулами, включая саму воду.
Вода — универсальный растворитель
Как полярная молекула вода лучше всего взаимодействует с другими полярными молекулами, такими как она сама. Это происходит из-за явления, при котором противоположные заряды притягиваются друг к другу: поскольку каждая отдельная молекула воды имеет как отрицательную, так и положительную части, каждая сторона притягивается к молекулам с противоположным зарядом. Притяжение позволяет воде образовывать относительно прочные связи с другими полярными молекулами вокруг нее, включая другие молекулы воды. Затем положительный атом водорода одной из молекул воды объединится с отрицательным атомом кислорода соседней молекулы, собственные атомы водорода которой притягиваются к следующему атому кислороду, и так далее (рис. 1). Важно отметить, что эта связь приводит к тому, что молекулы воды объединяться. Такое свойство воды известно как когезия. Когезия воды помогает растениям «вытягивать» воду из корней. Когезия также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
Притяжение позволяет воде образовывать относительно прочные связи с другими полярными молекулами вокруг нее, включая другие молекулы воды. Затем положительный атом водорода одной из молекул воды объединится с отрицательным атомом кислорода соседней молекулы, собственные атомы водорода которой притягиваются к следующему атому кислороду, и так далее (рис. 1). Важно отметить, что эта связь приводит к тому, что молекулы воды объединяться. Такое свойство воды известно как когезия. Когезия воды помогает растениям «вытягивать» воду из корней. Когезия также способствует высокой температуре кипения воды, что помогает животным регулировать температуру тела.
Кроме того, поскольку большинство биологических молекул имеют некоторую асимметрию напряжения, они также полярны, и молекулы воды могут образовывать связи и окружать как их положительные, так и отрицательные части. Окружая полярные молекулы другого вещества, вода попадает в каждый уголок и щель между молекулами, эффективно разрушая и растворяя их.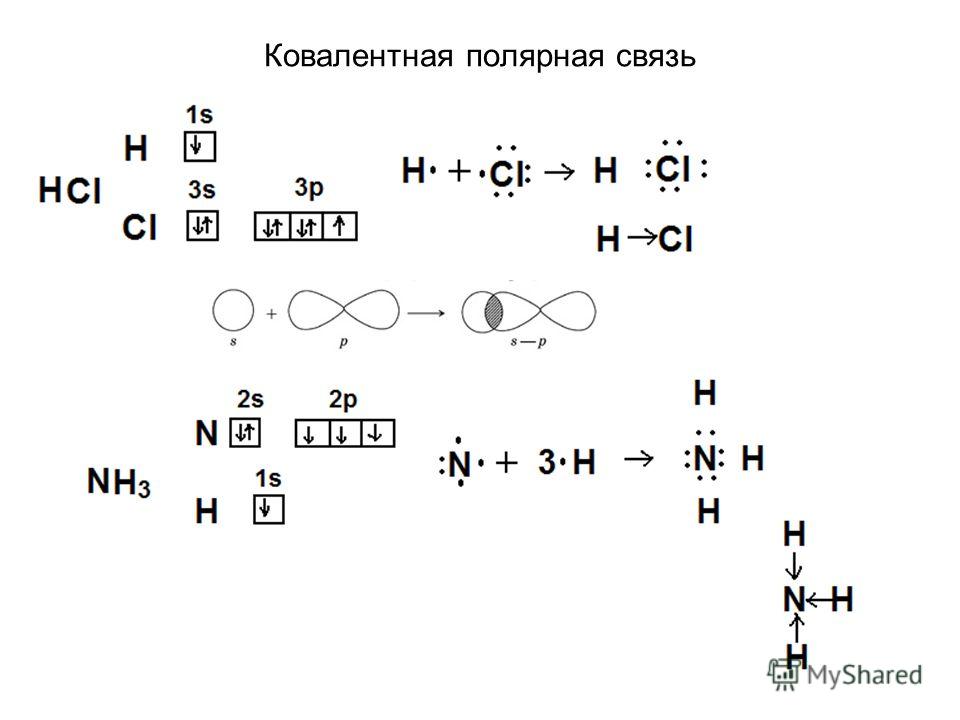 Вот что происходит, когда мы добавляем кристаллы сахара в воду: и вода, и сахар полярны, так что отдельные молекулы воды окружают каждую молекулу сахара, расщепляя сахар и растворяя его. Как и в случае с поляризацией, некоторые молекулы состоят из ионов или противоположно заряженных частиц. Вода также разрушает эти ионные частицы, взаимодействуя как с положительно, так и с отрицательно заряженными частями. Вот что происходит, когда мы добавляем соль в воду, потому что соль состоит из ионов натрия и хлора.
Вот что происходит, когда мы добавляем кристаллы сахара в воду: и вода, и сахар полярны, так что отдельные молекулы воды окружают каждую молекулу сахара, расщепляя сахар и растворяя его. Как и в случае с поляризацией, некоторые молекулы состоят из ионов или противоположно заряженных частиц. Вода также разрушает эти ионные частицы, взаимодействуя как с положительно, так и с отрицательно заряженными частями. Вот что происходит, когда мы добавляем соль в воду, потому что соль состоит из ионов натрия и хлора.
Благодаря сильной способности воды растворять различные молекулы, она стала известна как «универсальный растворитель», и именно эта способность делает воду такой бесценной силой поддержания жизни. На биологическом уровне вода как растворитель помогает клеткам переносить и использовать кислород и питательные вещества. Растворы на водной основе, такие как кровь, помогают перемещать вещества в нужные места. Таким образом, роль воды как растворителя облегчает транспортировку веществ, таких как кислород, для дыхания, и имеет большое влияние на способность лекарств достигать своих целей в организме.
Вода поддерживает клеточную структуру
Вода также играет важную структурную роль в биологии. Вода заполняет клетки, помогая сохранять их форму и структуру (рис. 2). Вода во многих клетках (включая те, что составляют человеческое тело) создает давление, противодействующее внешним силам, как воздух в воздушном шаре. Даже некоторым растениям, способным поддерживать свою клеточную структуру какое-то время без воды, для выживания все равно потом нужна вода. Вода способствует тому, что все внутри клеток сохраняет свою правильную форму на молекулярном уровне. Поскольку форма имеет решающее значение для биохимических процессов, это тоже является одной из самых важных ролей воды.
Рисунок 2: Вода влияет на форму клетки. Вода создает в клетке давление, которое помогает ей сохранять форму. В гидратированной клетке (слева) вода выталкивается наружу, и ячейка остается круглой. В обезвоженной клетке вытесняется меньше воды, поэтому клетка становится морщинистой.
Помимо влияния на общую форму клеток, вода также влияет на некоторые основные компоненты каждой клетки: ДНК и белки.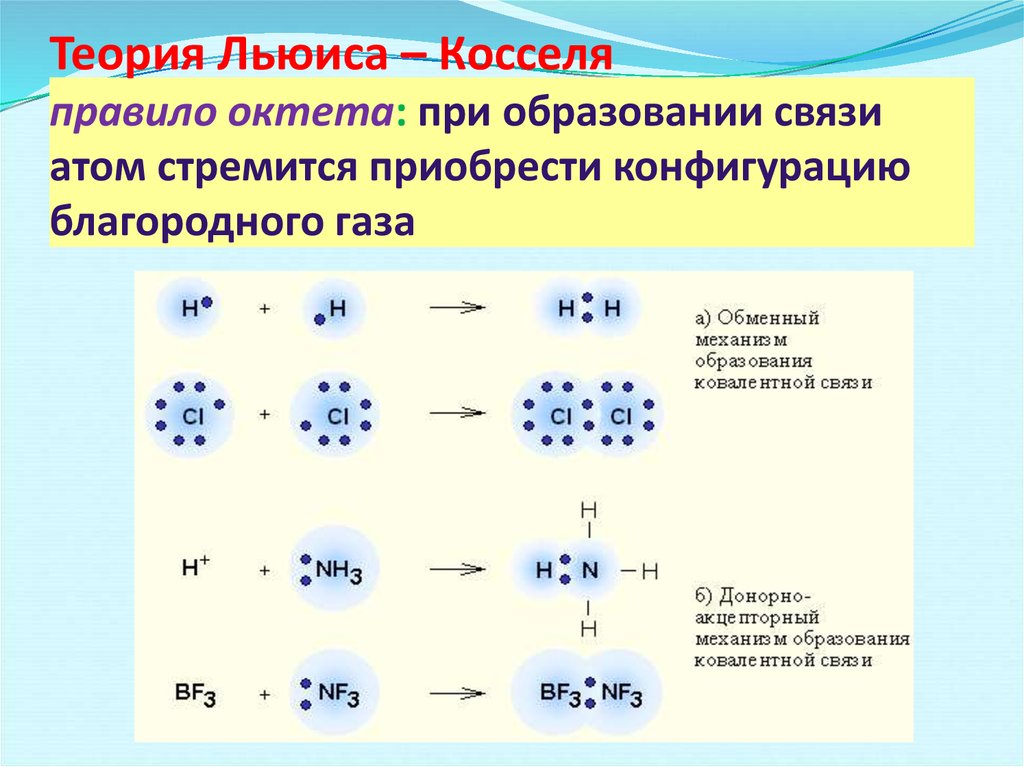 Белки производятся в виде длинной цепочки строительных блоков, называемых аминокислотами, и для правильного функционирования они должны иметь определенную форму. Вода направляет сборку аминокислотных цепей, поскольку разные типы аминокислот ищут и избегают взаимодействия с водой. Белки обеспечивают структуру, улавливают сигналы и катализируют химические реакции в клетке. В конечном итоге белки управляют сокращением мышц, коммуникацией, перевариванием питательных веществ и многими другими жизненно важными функциями. Без правильной формы белки не смогли бы выполнять эти функции, и клетка (не говоря уже обо всем теле человека) не смогла бы выжить. Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции были правильно расшифрованы. Белки, которые читают или копируют ДНК, могут связываться с ДНК только определенной формы.
Белки производятся в виде длинной цепочки строительных блоков, называемых аминокислотами, и для правильного функционирования они должны иметь определенную форму. Вода направляет сборку аминокислотных цепей, поскольку разные типы аминокислот ищут и избегают взаимодействия с водой. Белки обеспечивают структуру, улавливают сигналы и катализируют химические реакции в клетке. В конечном итоге белки управляют сокращением мышц, коммуникацией, перевариванием питательных веществ и многими другими жизненно важными функциями. Без правильной формы белки не смогли бы выполнять эти функции, и клетка (не говоря уже обо всем теле человека) не смогла бы выжить. Точно так же ДНК должна иметь определенную форму, чтобы ее инструкции были правильно расшифрованы. Белки, которые читают или копируют ДНК, могут связываться с ДНК только определенной формы.
Химические реакции воды
Вода принимает непосредственное участие во многих химических реакциях, предназначенных для создания и разрушения важных компонентов клетки. Фотосинтез, процесс, который происходит в растениях, который производит сахар для всех форм жизни, требует воды. Вода также участвует в создании более крупных молекул в клетках. Молекулы, такие как ДНК и белки, состоят из повторяющихся единиц более мелких молекул. Соединение этих маленьких молекул происходит в результате реакции с образованием воды. И наоборот, вода необходима для того, чтобы обратить вспять реакцию, которая разрушает эти молекулы, позволяя клеткам получать питательные вещества или повторно использовать части больших молекул.
Фотосинтез, процесс, который происходит в растениях, который производит сахар для всех форм жизни, требует воды. Вода также участвует в создании более крупных молекул в клетках. Молекулы, такие как ДНК и белки, состоят из повторяющихся единиц более мелких молекул. Соединение этих маленьких молекул происходит в результате реакции с образованием воды. И наоборот, вода необходима для того, чтобы обратить вспять реакцию, которая разрушает эти молекулы, позволяя клеткам получать питательные вещества или повторно использовать части больших молекул.
Кроме того вода защищает клетки от вредного воздействия кислот и щелочей. Сильно кислые или щелочные вещества, такие как отбеливатель или соляная кислота, являются едкими даже для самых прочных материалов. Это связано с тем, что кислоты и основания выделяют избыток водорода или забирают избыток водорода из окружающих материалов. Потеря или приобретение положительно заряженного водорода нарушает структуру молекул. Для правильного функционирования протеинам требуется определенная структура, поэтому важно защищать их от кислот и щелочей.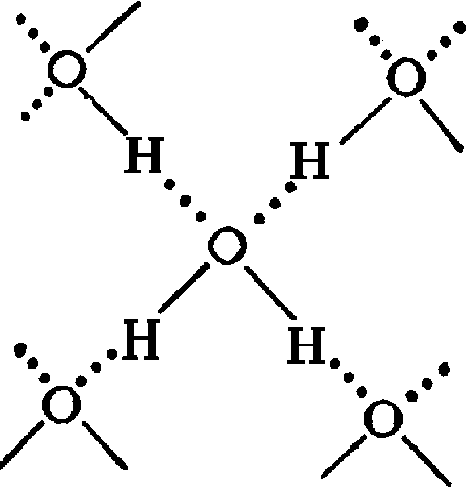 Вода делает это, действуя как кислота и основание (рис. 3). Хотя химические связи в молекуле воды очень стабильны, молекула воды может отдать водород и стать ОН-, таким образом действуя как основание, или принять другой водород и превратиться в h4O +, таким образом действуя как кислота. Эта адаптивная способность позволяет воде противодействовать резким изменениям pH, вызванным кислотными или щелочными веществами в организме, в процессе, называемом буферизацией. В конечном итоге это защищает белки и другие молекулы в клетке.
Вода делает это, действуя как кислота и основание (рис. 3). Хотя химические связи в молекуле воды очень стабильны, молекула воды может отдать водород и стать ОН-, таким образом действуя как основание, или принять другой водород и превратиться в h4O +, таким образом действуя как кислота. Эта адаптивная способность позволяет воде противодействовать резким изменениям pH, вызванным кислотными или щелочными веществами в организме, в процессе, называемом буферизацией. В конечном итоге это защищает белки и другие молекулы в клетке.
Рисунок 3: Вода действует как буфер, высвобождая или поглощая атомы водорода.
Вода необходима для любой жизни. Её универсальность и адаптируемость помогает проводить важные химические реакции. Никакая другая молекула не может сравниться с водой, с ее уникальными жизнеобеспечивающими свойствами. Интересно, что исследователи все еще выявляют новые свойства воды, такие как дополнительные преимущества ее асимметричной структуры. Ученым еще предстоит определить физиологические эффекты этих свойств. Удивительно, насколько простая молекула универсально важна для организмов с разными потребностями.
Удивительно, насколько простая молекула универсально важна для организмов с разными потребностями.
Оригинальная статья: https://sitn.hms.harvard.edu/uncategorized/2019/biological-roles-of-water-why-is-water-necessary-for-life/
Назад ко всем новостям
Вода — полярная молекула | Глава 5: Молекула воды и растворение
Вам это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 5.1
Ключевые понятия
- Молекула воды в целом имеет 10 протонов и 10 электронов, поэтому она нейтральна.
- В молекуле воды атом кислорода и атомы водорода имеют общие электроны в ковалентных связях, но их совместное использование не равно.
- В ковалентной связи между кислородом и водородом атом кислорода притягивает электроны несколько сильнее, чем атомы водорода.

- Неравное распределение электронов придает молекуле воды небольшой отрицательный заряд вблизи атома кислорода и небольшой положительный заряд вблизи атомов водорода.
- Когда нейтральная молекула имеет положительную область на одном конце и отрицательную область на другом, это полярная молекула.
- Молекулы воды притягиваются друг к другу за счет притяжения между положительным концом одной молекулы воды и отрицательным концом другой.
Резюме
Учащиеся познакомятся с идеей о том, что вода имеет небольшой положительный заряд на одном конце молекулы и небольшой отрицательный заряд на другом (полярная молекула). Учащиеся просматривают анимационные ролики, делают иллюстрации и используют свои собственные модели молекул воды, чтобы понять, как полярная природа молекул воды может помочь объяснить некоторые важные характеристики воды.
Задача
Учащиеся смогут объяснить на молекулярном уровне, что делает воду полярной молекулой.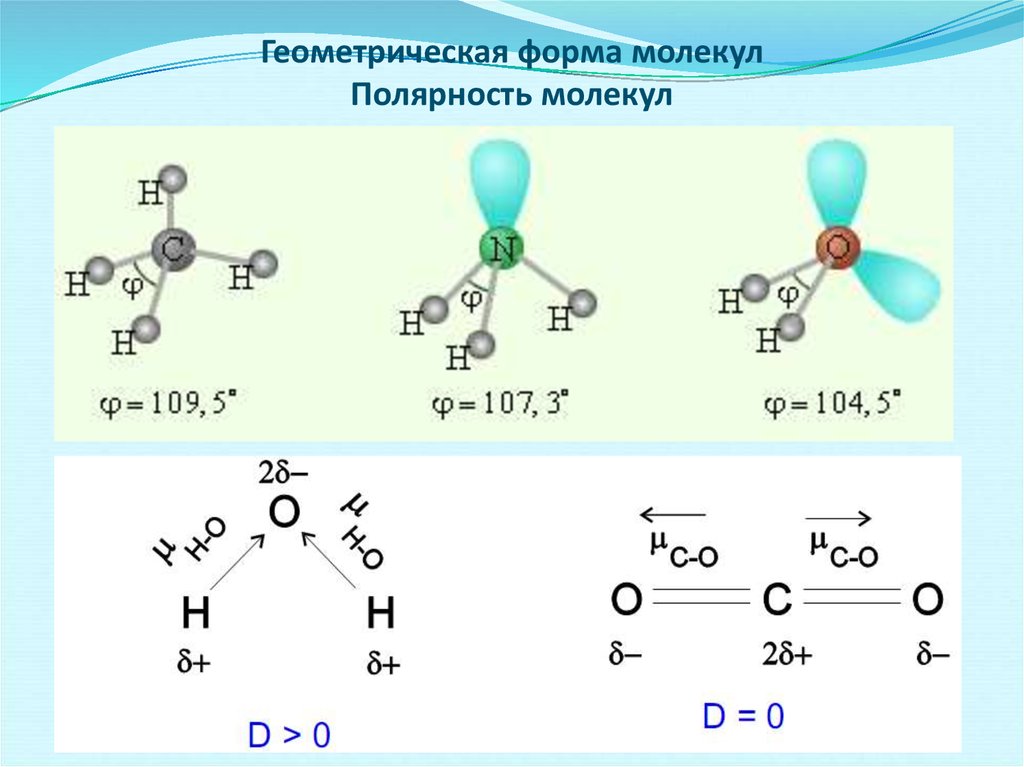 Студенты также смогут показать на рисунке, что полярная природа воды может объяснить некоторые интересные характеристики воды и помочь объяснить скорость ее испарения по сравнению с менее полярной жидкостью.
Студенты также смогут показать на рисунке, что полярная природа воды может объяснить некоторые интересные характеристики воды и помочь объяснить скорость ее испарения по сравнению с менее полярной жидкостью.
Оценка
Рабочий лист будет служить компонентом «Оценка» каждого плана урока 5-E. Рабочие листы представляют собой формирующую оценку успеваемости и понимания учащихся.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки. Изопропиловый спирт легко воспламеняется. Держите его подальше от пламени или источников искр. Прочтите и следуйте всем предупреждениям на этикетке. Использовать в хорошо проветриваемом помещении. Утилизируйте небольшие количества в канализацию или в соответствии с местным законодательством.
Материалы для каждой группы
- Модели молекул воды из пенополистирола из главы 2, урока 2 (по две на учащегося)
- Перманентные маркеры (синий и красный)
- Спирт изопропиловый (70% или выше)
- Вода
- Коричневое бумажное полотенце
- Капельницы
Заметка о материалах
Учащиеся сделали молекулярные модели молекулы воды, используя шарики из пенопласта и зубочистки в главе 2, урок 2. Дайте каждому учащемуся две такие модели молекулы воды для этого задания.
Дайте каждому учащемуся две такие модели молекулы воды для этого задания.
Покажите учащимся примеры притяжения молекул воды друг к другу.
Напомните учащимся, что в главах 1 и 2 они исследовали поведение воды при различных температурах и исследовали изменения состояния воды. Многие объяснения были основаны на идее, что молекулы воды притягиваются друг к другу. Напомните учащимся, что в главе 4 они рассматривали ковалентную связь между кислородом и водородом, которая создает молекулу воды. Теперь учащиеся более внимательно изучат детали ковалентных связей в молекуле воды, чтобы понять, почему молекулы воды притягиваются друг к другу.
Спроектируйте видео «Водяной шар».
Это видео было показано в главе 1, уроке 1, чтобы показать, что молекулы воды притягиваются друг к другу.
Спроектировать видео Фонтан с водой.
Укажите, что вода может оставаться вместе в этих дугах, потому что молекулы воды сильно притягиваются друг к другу.

Показать анимацию молекулярной модели, иллюстрирующую, почему молекулы воды притягиваются друг к другу.
Проект анимации Полярная молекула воды.
Первый кадр анимации
- Электроны распределяются между атомами в ковалентной связи.
- Напомните учащимся, как общие электроны в молекуле воды притягиваются к протонам в атомах кислорода и водорода. Эти притяжения удерживают атомы вместе.
- Молекулы воды нейтральны.
- Убедитесь, что учащиеся понимают, что ни протоны, ни электроны не приобретаются и не теряются. Молекула воды имеет в общей сложности 10 протонов и 10 электронов (8 от атома кислорода и по 1 от каждого из двух атомов водорода). Поскольку в ней одинаковое количество протонов и электронов, молекула воды нейтральна.
Нажмите «Играть»
- Модель электронного облака показывает, где находятся электроны в молекуле.
- Скажите учащимся, что еще один способ увидеть разницу в расположении электронов — использовать модель электронного облака.
 Напомните учащимся, что невозможно узнать точное местоположение электрона, поэтому иногда области, занятые электронами, изображаются в виде «облаков» вокруг ядра в атоме или молекуле.
Напомните учащимся, что невозможно узнать точное местоположение электрона, поэтому иногда области, занятые электронами, изображаются в виде «облаков» вокруг ядра в атоме или молекуле. - Неравное распределение электронов делает воду полярной молекулой.
- Скажите учащимся, что атом кислорода притягивает электроны немного сильнее, чем водород. Таким образом, хотя электроны от каждого атома притягиваются как кислородом, так и водородом, электроны немного сильнее притягиваются к кислороду. Это означает, что электроны проводят немного больше времени на кислородном конце молекулы. Это делает кислородный конец молекулы слегка отрицательным. Поскольку электроны не так близко к водородному концу, этот конец слегка положителен. Когда ковалентно связанная молекула имеет больше электронов в одной области, чем в другой, она называется полярной молекулой.
- Модель электронного облака может показать неравное распределение электронов.
- Укажите, что электронное облако вокруг кислорода темнее, чем электронное облако вокруг водорода.
 Это показывает, что электроны больше притягиваются к кислородному концу молекулы, чем к водородному концу, что делает молекулу воды полярной.
Это показывает, что электроны больше притягиваются к кислородному концу молекулы, чем к водородному концу, что делает молекулу воды полярной.
Нажмите «Далее»
- Можно добавить цвет к модели электронного облака, чтобы показать, где электроны более или менее вероятны.
- Скажите учащимся, что это еще одна модель молекулы воды. В этой модели цвет используется для обозначения полярных областей молекулы воды. Отрицательная область возле атома кислорода окрашена в красный цвет, а положительная область возле атомов водорода — в синий.
Вместе спроецируйте анимацию «Полярная вода».
Спросите студентов:
- Что вы заметили в том, как ориентируются молекулы воды?
- Красная (кислородная) область одной молекулы воды находится рядом с синим (водородным) концом другой молекулы воды.
- Почему молекулы воды так притягиваются друг к другу?
- Поскольку кислородный конец молекулы воды немного отрицателен, а водородный конец слегка положителен, молекулы воды притягиваются друг к другу.

Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Покажите учащимся, что связи между атомами в молекуле отличаются от полярного притяжения между молекулами.
Проецировать изображение Достопримечательности на разных уровнях.
Студенты могут быть сбиты с толку связями внутри молекулы воды и притяжением между молекулами воды.
Связи внутри молекул и полярное притяжение между молекулами.
Объясните учащимся, что взаимодействие между кислородом одной молекулы воды и водородом другой отличается от обмена электронами между кислородом и водородом внутри самой молекулы воды.

Все дело в притяжении положительного и отрицательного.
Укажите учащимся, что притяжение между положительным и отрицательным работает на трех разных уровнях.
- Один атом остается вместе из-за притяжения между положительно заряженными протонами и отрицательно заряженными электронами.
- В молекуле два или более атома остаются вместе из-за взаимного притяжения между положительно заряженными протонами одного атома и отрицательно заряженными электронами другого атома. Это вызывает ковалентную или ионную связь, которая удерживает атомы или ионы вместе.
- Две или более молекулы воды остаются вместе из-за того, что положительные и отрицательные части молекул притягиваются друг к другу.
Предложите учащимся отметить положительные и отрицательные участки молекулы воды, раскрасив их модели шариков из пенополистирола цветом.
Материалы для каждой группы
- Модели молекул воды из пенополистирола из главы 2, урока 2 (по две на учащегося)
- Перманентные маркеры (синий и красный)
Процедура
- Нарисуйте синий «+» на каждом из атомов водорода.

- Нарисуйте два красных «-» внизу атома кислорода.
- Повторите это для другой молекулы воды.
- Расположите молекулы воды так, чтобы противоположные заряды находились рядом друг с другом.
Спросите студентов:
- Как ваши модели молекул воды в шариках из пенополистирола соотносятся с моделью плотности заряда с цветовой кодировкой, показанной на анимации?
- Различные цвета показывают, что вода является полярной молекулой.
- Что обозначают красные знаки «-» у атома кислорода?
- Красные знаки «-» обозначают область, где больше электронов.
- Что обозначают синие знаки «+» у атомов водорода?
- Синие знаки «+» обозначают область, где меньше электронов.
- Поскольку молекулы воды полярны, как они располагаются в жидкой воде?
- Положительный участок одной молекулы воды притягивается к отрицательному участку другой молекулы воды.
Предложите учащимся разработать тест для сравнения скорости испарения воды и спирта.

Напомните учащимся, что молекулы воды очень полярны. Сильное притяжение между молекулами воды влияет на поверхностное натяжение воды, температуру кипения и скорость испарения. Скажите учащимся, что они проведут эксперимент, чтобы сравнить скорость испарения воды и другой жидкости, не такой полярной.
Спросите студентов:
- Как вы думаете, такое вещество, как вода, с полярными молекулами будет испаряться быстрее или медленнее, чем такое вещество, как спирт, молекулы которого не столь полярны?
- Более полярные молекулы будут больше слипаться и, вероятно, будут испаряться медленнее, чем менее полярные молекулы. Менее полярные молекулы должны испаряться быстрее, потому что они не так притягиваются друг к другу.
- Как можно разработать быстрый и простой тест на испарение для сравнения скорости испарения воды и спирта?
- Какие материалы вам понадобятся?
- Следует ли использовать одинаковое количество воды и спирта?
- Как узнать, испаряется ли одно быстрее другого?
- Есть ли способ сделать это так, чтобы это не занимало много времени?
Студенты должны сказать, что им потребуется такое же небольшое количество воды и спирта.
 Эти жидкости должны быть помещены одновременно на поверхность, например, на коричневое бумажное полотенце, чтобы учащиеся могли сказать, когда каждая жидкость испаряется.
Эти жидкости должны быть помещены одновременно на поверхность, например, на коричневое бумажное полотенце, чтобы учащиеся могли сказать, когда каждая жидкость испаряется.Предложите учащимся выполнить описанную ниже процедуру, чтобы сравнить скорость испарения воды и спирта.
Вопрос для расследования
Вода испаряется быстрее или медленнее, чем менее полярный спирт?
Материалы для каждой группы
- Изопропиловый спирт (70% или выше)
- Вода
- Коричневое бумажное полотенце
- Капельницы
Процедура
- Одновременно капните 1 каплю воды и 1 каплю спирта на коричневое бумажное полотенце. Наблюдать.
Ожидаемые результаты
Темное пятно на бумажном полотенце от спирта станет светлее быстрее, чем темное пятно от воды. Это указывает на то, что спирт испаряется быстрее, чем вода.
Подробнее о подсчете молекул читайте в разделе «Информация для учителя».

Примечание. Этот тест подходит для учащихся средней школы, но есть в нем что-то, что не делает его полностью справедливым. Молекул воды в капле воды намного больше, чем молекул спирта в капле спирта. Тест будет более честным, если на бумажную салфетку будет помещено одинаковое количество молекул воды и спирта. Для этого требуется способ «подсчета» молекул. Определение количества частиц в образце является базовой концепцией химии, но выходит за рамки курса химии в средней школе. Даже если бы в этом упражнении использовалось одинаковое количество молекул воды и спирта, спирт испарялся бы быстрее.
Обсудите наблюдения учащихся и опишите различия в полярности молекул воды и спирта.
Спросите студентов:
- Что испаряется быстрее, вода или спирт?
- Спирт испарился быстрее.
Спроецируйте изображение Молекулы воды и спирта.
Скажите учащимся, что понимание полярности может помочь объяснить, почему вода испаряется медленнее, чем спирт.

Напомните учащимся, что кислородно-водородные (О–Н) связи в воде делают ее полярной молекулой. Эта полярность заставляет молекулы воды притягиваться друг к другу.
Объясните, что связь кислород-водород (О–Н) в молекуле спирта также полярна. Но связи углерод-водород (С-Н) в остальной части молекулы спирта неполярны. В этих связях электроны распределяются более или менее равномерно.
Поскольку на молекуле спирта есть как полярные, так и неполярные области, они несколько меньше притягиваются друг к другу, чем молекулы воды друг к другу. Это облегчает молекулам спирта разделение и перемещение в воздух в виде газа. Вот почему спирт испаряется быстрее, чем вода.
Предложите учащимся подумать, как полярность может повлиять на температуру кипения воды и спирта.
Вы знаете, что вода и спирт имеют разные характеристики из-за молекул, из которых они состоят, и того, как эти молекулы взаимодействуют друг с другом.
Спроецировать изображение Кипение воды и спирта.

На этом рисунке показано, что спирт кипит при более низкой температуре, чем вода.
- Вода кипит при 100 °С
- Спирт кипит при 82,5 °С
Спросите студентов:
- Зная, что вы знаете о полярности воды и спирта, объясните, почему спирт кипит при более низкой температуре, чем вода.
- Полярная характеристика молекул воды заставляет их хорошо притягиваться друг к другу. Менее полярные молекулы спирта не притягиваются друг к другу так сильно, как молекулы воды. Для закипания воды требуется больше энергии, чем для закипания спирта. Другими словами, спирт кипит при более низкой температуре, чем вода.
Ковалентная связь — Простая англоязычная Википедия, свободная энциклопедия
Переключить оглавлениеИз простой английской Википедии, бесплатной энциклопедии
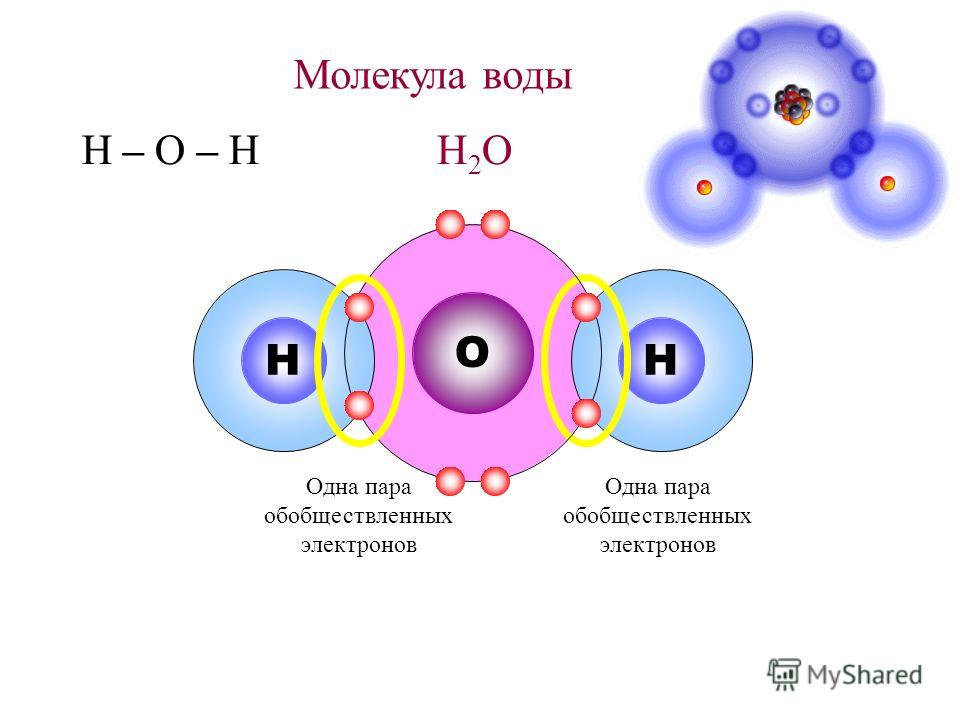
Ковалентные связи воды (h3O)
Ковалентная связь представляет собой химическую связь между двумя атомами неметаллов. Примером может служить вода, в которой водород (H) и кислород (O) связаны вместе, образуя (H 2 O).
Примером может служить вода, в которой водород (H) и кислород (O) связаны вместе, образуя (H 2 O).
Полная внешняя оболочка (или электронная оболочка) обычно имеет восемь электронов или два в случае водорода или гелия. Валентные электроны — это электроны, сравнительно свободно удерживаемые во внешней оболочке атома. (Структура электронных оболочек определяется квантовой механикой.)
Количество электронов в атоме определяется количеством протонов в атоме. Электроны вращаются вокруг атомных ядер, и они подобны нечетким орбитальным траекториям вокруг атомного ядра. Первый слой имеет до двух электронов. Последующие слои обычно содержат до восьми. Ковалентные связи образуются атомами, имеющими общие валентные электроны.
Если, например, у атома девять электронов, первые два вращаются очень близко к ядру, следующие семь вращаются немного дальше. Семь внешних электронов удерживаются менее прочно, чем два внутренних электрона, потому что они находятся дальше от положительно заряженного ядра.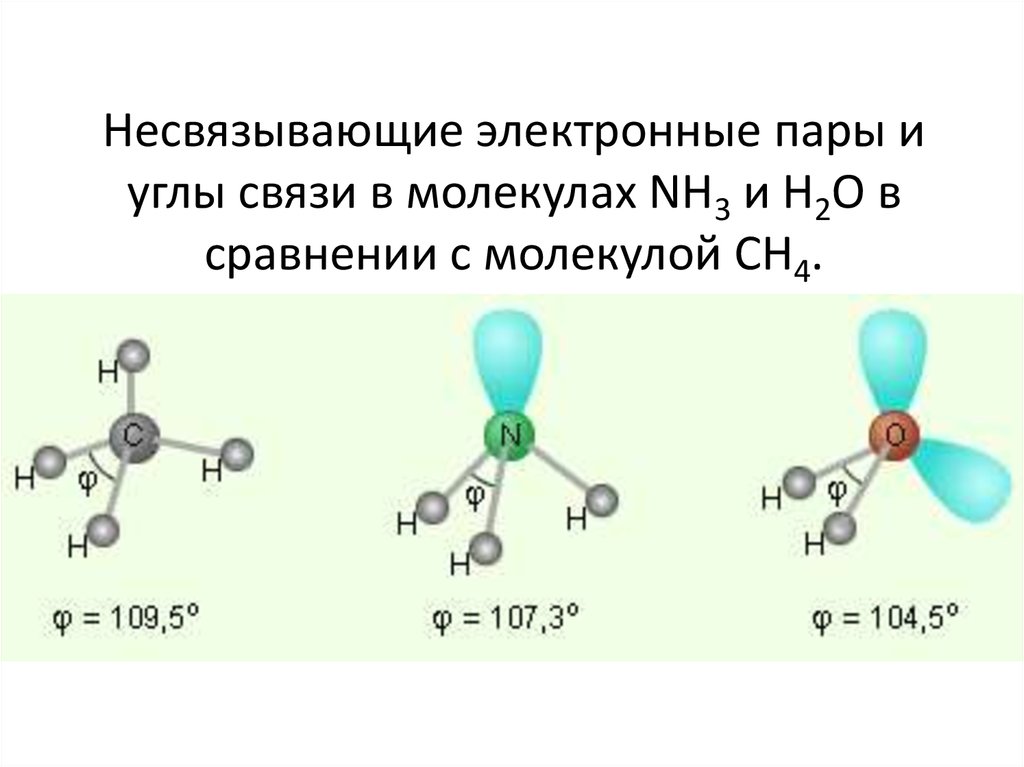 Если этот атом приблизится к другому атому со свободно удерживаемым электроном во внешней оболочке, то для свободно удерживаемого электрона станет доступна новая орбиталь. Эта новая электронная орбиталь связана с обоими атомными ядрами и имеет более низкий энергетический уровень, чем исходная электронная орбиталь. Электрон может спонтанно перескочить на него и испустить фотон с избыточной энергией. Теперь у нас есть электрон, вращающийся вокруг обоих атомов, что приводит к тому, что атом, предоставивший электрон, имеет небольшой суммарный положительный заряд, а другой атом имеет небольшой суммарный отрицательный заряд. Два атома теперь удерживаются вместе электромагнитной силой притяжения между положительными и отрицательными зарядами. Это называется ковалентной связью. Для разрыва этой связи требуется столько же энергии, сколько было высвобождено при ее образовании.
Если этот атом приблизится к другому атому со свободно удерживаемым электроном во внешней оболочке, то для свободно удерживаемого электрона станет доступна новая орбиталь. Эта новая электронная орбиталь связана с обоими атомными ядрами и имеет более низкий энергетический уровень, чем исходная электронная орбиталь. Электрон может спонтанно перескочить на него и испустить фотон с избыточной энергией. Теперь у нас есть электрон, вращающийся вокруг обоих атомов, что приводит к тому, что атом, предоставивший электрон, имеет небольшой суммарный положительный заряд, а другой атом имеет небольшой суммарный отрицательный заряд. Два атома теперь удерживаются вместе электромагнитной силой притяжения между положительными и отрицательными зарядами. Это называется ковалентной связью. Для разрыва этой связи требуется столько же энергии, сколько было высвобождено при ее образовании.
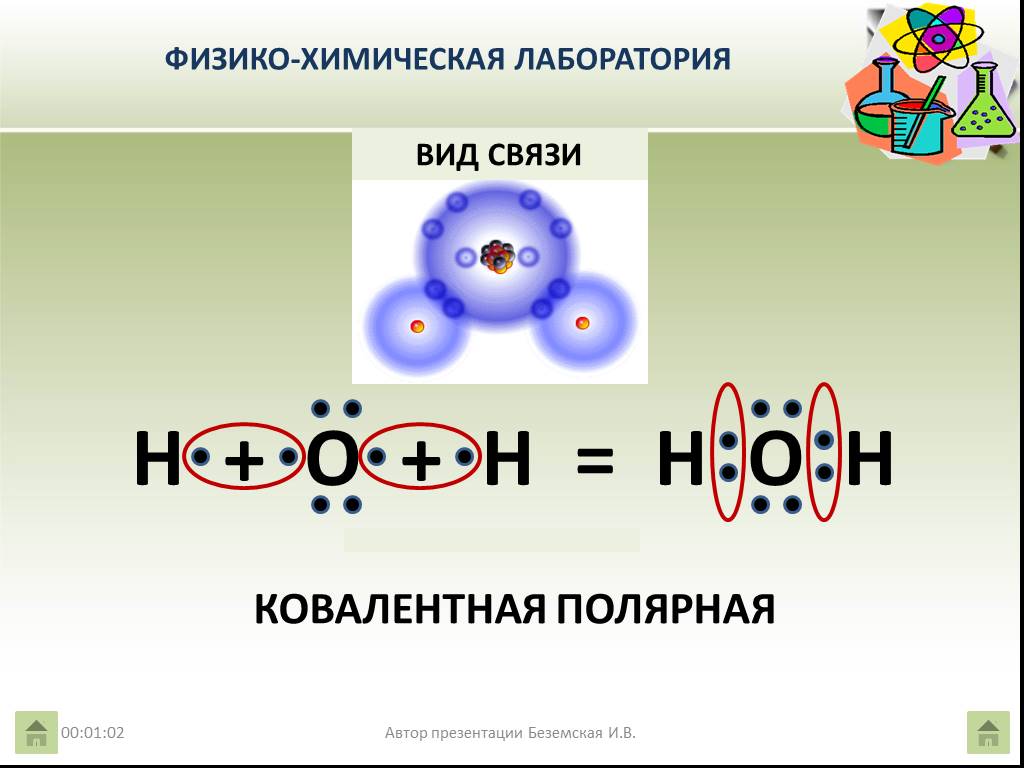
Молекула воды состоит из одного атома кислорода и двух атомов водорода, соединенных ковалентной связью. В этом случае атом кислорода делит один электрон с каждым атомом водорода.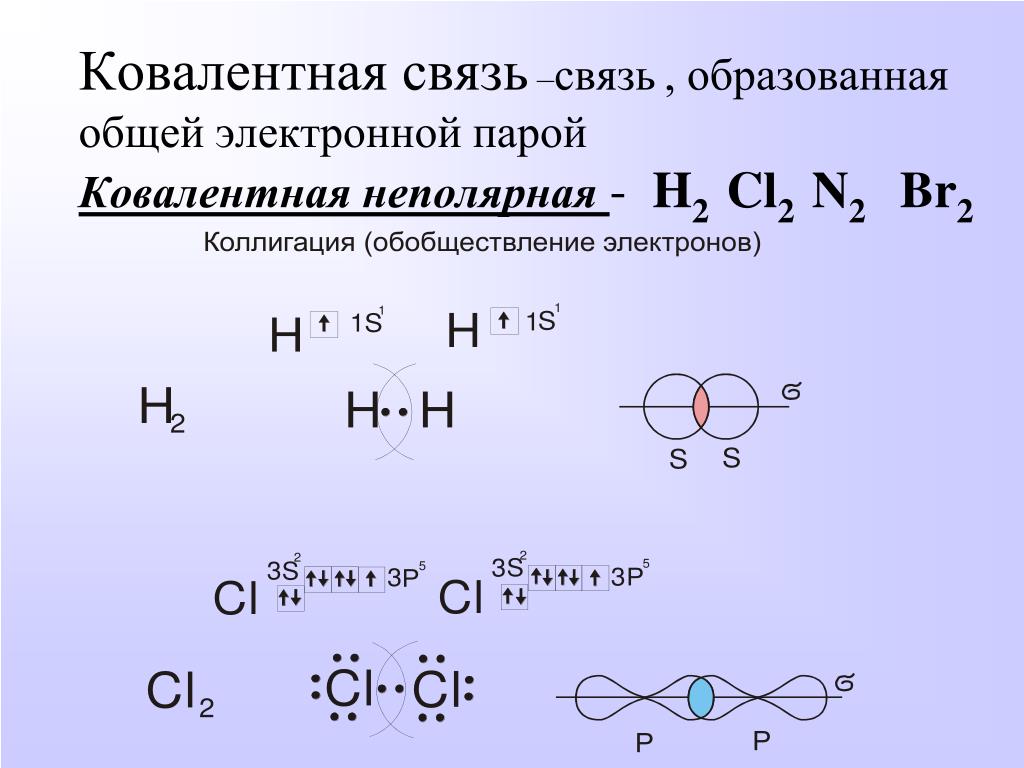 Это означает, что атомы кислорода имеют небольшой суммарный положительный заряд, а атом водорода имеет небольшой суммарный отрицательный заряд. В результате атомы кислорода и водорода притягиваются друг к другу за счет электромагнитной силы. Из-за этого молекула воды является полярной молекулой: ее заряд распределен неравномерно.
Это означает, что атомы кислорода имеют небольшой суммарный положительный заряд, а атом водорода имеет небольшой суммарный отрицательный заряд. В результате атомы кислорода и водорода притягиваются друг к другу за счет электромагнитной силы. Из-за этого молекула воды является полярной молекулой: ее заряд распределен неравномерно.
Атомные орбитали (кроме s-орбиталей) образуют различные типы ковалентных связей:
- Сигма (σ) связи являются самыми сильными ковалентными связями. У них лобовое перекрытие орбиталей двух разных атомов. Одинарная связь обычно представляет собой σ-связь. Связи
- Pi (π) слабее (и обусловлены латеральным перекрытием между p (или d) орбиталями).
- Двойная связь между двумя данными атомами имеет одну σ- и одну π-связь, и
- тройная связь имеет одну σ и две π связи.
Ковалентные связи слабее ионных и имеют более низкую температуру плавления. Они также, как правило, плохие проводники электричества и тепла.


 Напомните учащимся, что невозможно узнать точное местоположение электрона, поэтому иногда области, занятые электронами, изображаются в виде «облаков» вокруг ядра в атоме или молекуле.
Напомните учащимся, что невозможно узнать точное местоположение электрона, поэтому иногда области, занятые электронами, изображаются в виде «облаков» вокруг ядра в атоме или молекуле. Это показывает, что электроны больше притягиваются к кислородному концу молекулы, чем к водородному концу, что делает молекулу воды полярной.
Это показывает, что электроны больше притягиваются к кислородному концу молекулы, чем к водородному концу, что делает молекулу воды полярной.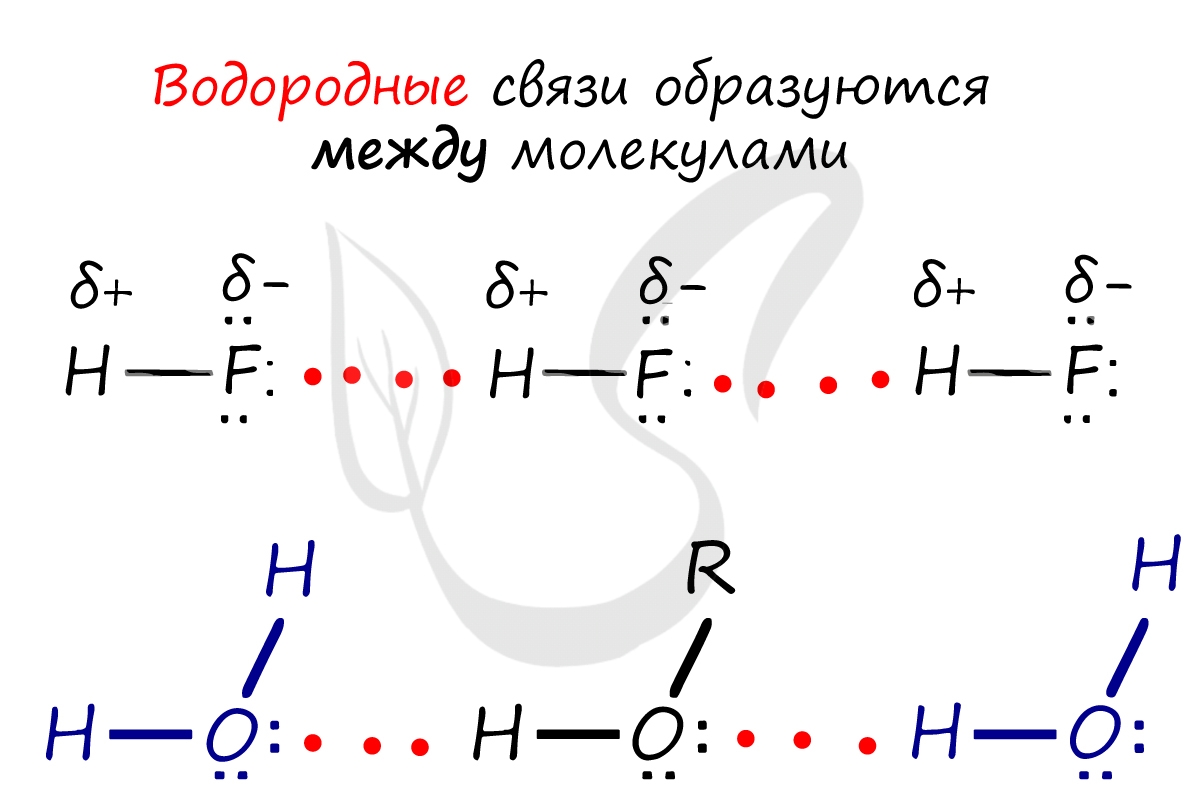

 Эти жидкости должны быть помещены одновременно на поверхность, например, на коричневое бумажное полотенце, чтобы учащиеся могли сказать, когда каждая жидкость испаряется.
Эти жидкости должны быть помещены одновременно на поверхность, например, на коричневое бумажное полотенце, чтобы учащиеся могли сказать, когда каждая жидкость испаряется.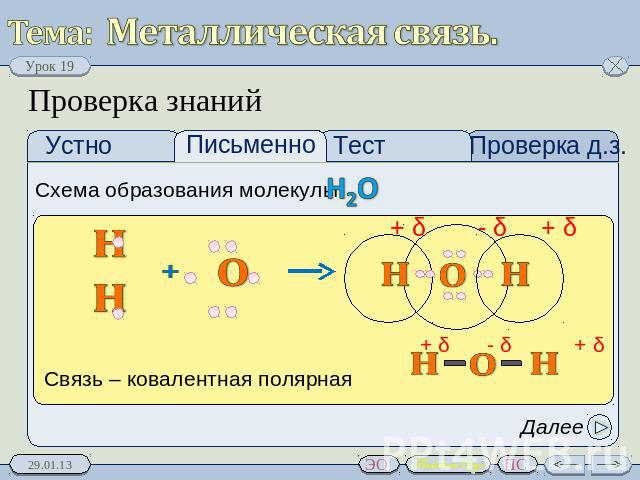

Leave A Comment