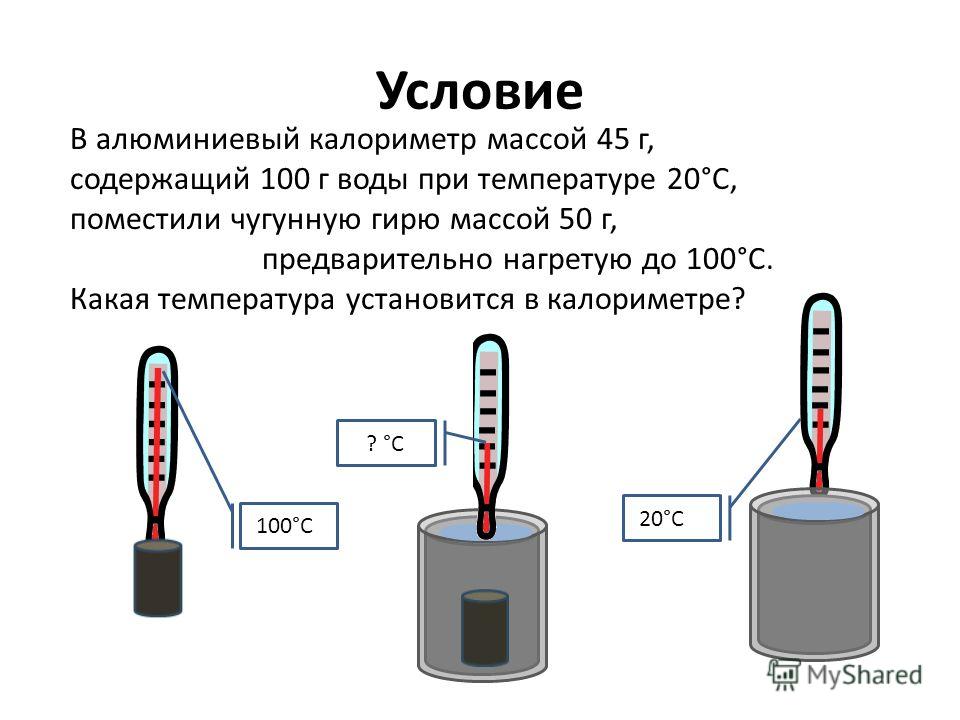
Экзамен-Технолаб
Научный руководитель: М.М. Юмашев, учитель физики МОУ «Лицей № 1» г. Подольска
Статья посвящена исследованию остывания воды в калориметрах, в результате которого было установлено, что во всех опытах остывание жидкости хорошо аппроксимируется экспоненциальной функцией, несмотря на условия процесса. По итогам работы предложен способ повышения эффективности школьных калориметров.
Вступление
В начале этого года мы начали изучать тепловые явления. Этот раздел физики показался нам очень интересным. Поэтому когда появилась возможность написать научную работу, мы выбрали именно эту тему. Мы решили разобрать несколько частных случаев, встречающихся в нашей обычной жизни и во время проведения физических опытов. Сюда входит и остывание жидкости в различных калориметрах, зависимость температуры тел от времени и многое другое.
А можно ли обойтись без калориметра?
Во всех опытах, в которых нужно сохранить теплоту, используются калориметры. Но так ли велика необходимость в них? Проверим это на опыте. Сравним свойства разных калориметров. За эталон мы взяли школьный калориметр.
Но так ли велика необходимость в них? Проверим это на опыте. Сравним свойства разных калориметров. За эталон мы взяли школьный калориметр.
ОБОРУДОВАНИЕ И МАТЕРИАЛЫ
Ноутбук, школьный калориметр, измерительный цилиндр, алюминиевый стакан, измерительный прибор LabQest (LabQest — устройство измерения и обработки данных), датчик температуры TMP-BTA, электрочайник, горячая вода (фото 1-2).
Фото 1. Оборудование и материалы
Фото 2. Измерительный прибор LabQest
При работе с LabQest можно обойтись без ноутбука, но удобней с ноутбуком, так как больше экран (фото 3).
Фото 3. Экран ноутбука с графиками температур
ХОД ОПЫТА
Ставим на некотором расстоянии друг от друга алюминиевый стакан и калориметр
Опускаем в стакан и калориметр датчики температуры
Заливаем горячую воду в стакан и калориметр
Запускаем фиксацию измерений на 15 мин
После окончания сбора данных выливаем воду в раковину
График 1
График 2
АНАЛИЗ ГРАФИКА
Температура 1 — калориметр, температура 2 — стакан.
График 1 — экспонента (C = 11,26×10-3).
График 2 — экспонента (C = 12,00×10-3).
С — показатель экспоненты, характеризующий скорость остывания жидкости.
ВЫВОД
Как видно из эксперимента, обычный школьный калориметр не дает значительного эффекта по сравнению с алюминиевым стаканом.Выясним физический смысл параметра «С»
Уравнение экспоненты (зависимости температуры остывания воды от времени) Т = А · exp(-C · t) + B задано в самом приборе при автоаппроксимации. Это уравнение можно увидеть в статье на втором графике в прямоугольнике, где В — конечная температура остывания воды (или температура окружающей среды), так как при t → ∞ Т = В. В этом опыте В = 22.
Выясним физический смысл параметра С, который в данном опыте равен 0,001050 с-1.
В таблице, соответствующей приведенному графику, первые 2 столбика — зависимость температуры от времени, 3-й — температура за вычетом конечной, 4-й — изменение температуры через каждые 100 с, 5-й — скорость остывания, которая уменьшается по мере остывания воды.
t,c | Т,град | T — 22 | ΔT | ΔT/Δt | (ΔT/Δt)/ /(T — 22) = С |
| 0 | 86,3 | 65,3 | |||
| 100 | 79,6 | 57,6 | 6,7 | 0,067 | 0,001163 |
| 200 | 73,6 | 51,6 | 6 | 0,06 | 0,001163 |
| 300 | 68,8 | 46,8 | 4,8 | 0,048 | 0,001026 |
| 400 | 64,7 | 42,7 | 4,1 | 0,041 | 0,00096 |
| 500 | 61 | 39 | 3,7 | 0,037 | 0,000949 |
| 600 | 67,3 | 35,3 | 3,7 | 0,037 | 0,001048 |
| 700 | 54 | 32 | 3,3 | 0,033 | 0,001031 |
| 800 | 51 | 29 | 3 | 0,03 | 0,001034 |
| 900 | 48,3 | 26,3 | 2,7 | 0,027 | 0,001027 |
| 1000 | 45,9 | 23,9 | 2,4 | 0,024 | 0,001004 |
| 1100 | 43,6 | 21,6 | 2,3 | 0,023 | 0,001065 |
| 1200 | 41,6 | 19,6 | 2 | 0,02 | 0,00102 |
| 1300 | 39,8 | 17,8 | 1,8 | 0,018 | 0,001011 |
| 1400 | 38 | 16 | 1,8 | 0,018 | 0,001125 |
| 1500 | 36,4 | 14,4 | 1,6 | 0,016 | 0,001111 |
| 1600 | 34,9 | 12,9 | 1,5 | 0,015 | 0,001163 |
| 1700 | 31,7 | 11,7 | 1,2 | 0,012 | 0,001026 |
| 32,7 | 10,7 | 1 | 0,01 | 0,000935 | |
| 31,8 | 9,8 | 0,9 | 0,009 | 0,000918 | |
| 31 | 9 | 0,8 | 0,008 | 0,000889 | |
| 30,3 | 8,3 | 0,7 | 0,007 | 0,000843 | |
| 29,5 | 7,5 | 0,8 | 0,008 | 0,001067 | |
| 28,8 | 6,8 | 0,7 | 0,007 | 0,001029 | |
| 28,2 | 6,2 | 0,6 | 0,006 | 0,000968 | |
| 0,001024 |
Как видим, скорость остывания убывает в зависимости от времени по экспоненте с учетом погрешностей и того, что Δt не стремиться к 0 при определении скорости остывания. А если мы 5-й столбик разделим на 3-й, то получим параметр С и его график, из которого видно, что С хорошо согласуется с автоаппроксимацией. Так как среднее арифметическое С по нашим расчетам 0,001024 с-1, а при автоаппроксимации 0,001050 с-1.
А если мы 5-й столбик разделим на 3-й, то получим параметр С и его график, из которого видно, что С хорошо согласуется с автоаппроксимацией. Так как среднее арифметическое С по нашим расчетам 0,001024 с-1, а при автоаппроксимации 0,001050 с-1.
При t = 1/С exp(-C · t) = 1/е, где е = 2,71…
Таким образом физический смысл имеет не сам параметр С, а величина обратная ему.
Возможно, целесообразно ввести постоянную времени остывания τ в каждом опыте: τ = 1/С, имеющую понятный физический смысл, и зависящую от условий протекания процесса остывания:
τ = 1/С — время, в течение которого скорость остывания падает в е = 2,71 раз.
Другими словами, это время, после которого процесс остывания воды в данном калориметре практически можно считать законченным.
В нашем случае τ = 1/0,001024 = 980 с.
Если смотреть на график, то как раз начальная скорость 0,067 за это время падает в е = 2,71 раз и становится равной 0,025.
График 3
График 4
Поиск лучшего калориметра Стакан с крышкой
Исходя из результатов предыдущего опыта, мы решили найти недостаток калориметра. Следующий опыт наглядно иллюстрирует преимущество закрытого крышкой стакана над открытым школьным калориметром.
ХОД РАБОТЫ
Накрываем стакан крышкой (в крышке заранее делается отверстие для датчика).
Наливаем воду в стакан, затем в калориметр.
Накрываем стакан крышкой, вставляем в отверстие крышки датчик, другой датчик опускаем в калориметр
График 5
АНАЛИЗ ГРАФИКА
Температура 1 — калориметр, температура 2 — стакан с крышкой.
График 1 — экспонента (C = 12,4×10-4).
График 2 — экспонента (C = 10,5×10-4).
ВЫВОД
Стакан с крышкой значительно эффективнее калориметра. Это говорит о том, что остывание происходит в основном через испарение с поверхности.
Пластиковый стакан
Сравним пластиковый стакан (толщина стенок 3 мм) с калориметром.
График 6
АНАЛИЗ ГРАФИКА
Температура 1 — калориметр, температура 2 — пластиковый стакан.
График 1 — экспонента (C = 9,7×10-4).
График 2 — экспонента (C = 8,3×10-4).
ВЫВОД
Калориметр незначительно лучше просто пластикового стакана
Калориметр с крышкой
Так как остывание происходит в основном через испарение с поверхности, сравним калориметры с крышкой и без крышки.
График 7
АНАЛИЗ ГРАФИКА
Температура 1 — калориметр с крышкой, температура 2 — калориметр.
График 1 — экспонента (C = 12,0×10-4).
График 2 — экспонента (C = 7,3×10-4).
ВЫВОД
Калориметр с крышкой значительно лучше открытого калориметра. Таким образом, выяснив, что в основном влияет на остывание воды, и, закрыв школьный калориметр пластмассовой крышкой от стеклянной банки, мы значительно увеличили его эффективность. По результатам опытов мы рекомендуем для уменьшения тепловых потерь при проведении лабораторных работ использовать наш опыт. Как выглядит усовершенствованный калориметр видно на фото 1. Пластмассовые крышки есть практически у всех, в них легко сделать отверстия для термометров и заливки воды.
Три калориметра
После проведения данной работы мы узнали, что для проведения ГИА будут применять новые калориметры и решили сравнить старый школьный, новый и наш усовершенствованный.
Температура 1 — калориметр, температура 2 — новый калориметр, температура 3 — калориметр с крышкой.
График 1 — экспонента (C = 5,72×10-4).
График 2 — экспонента (C = 3,32×10-4).
График 3 — экспонента (C = 3,38×10-4).
График 8
ВЫВОДЫ
В итоге можно сделать заключение, что модернизированный калориметр и новый по свойствам сохранения тепла практически не отличаются, но много лучше старого.
Мы считаем, что экономически выгодно для модернизации калориметров физических кабинетов — добавить к открытым школьным калориметрам крышки, так как наибольшие потери тепла происходят за счет испарения жидкости.
Во всех опытах остывание жидкости хорошо аппроксимируется экспоненциальной функцией, это дает возможность предсказывать температуру через определенный промежуток времени теоретически.
Калориметр со спираль-резистором (id 61265850)
1. Назначение пособия:
Назначение пособия:
Прибор предназначен для проведения фронтальных лабораторных работ и работ физического практикума в условиях типового кабинета физики общеобразовательной школы.
2. Комплект поставки:
В комплект изделия входят:
Прибор в сборе 1 шт.
Инструкция по эксплуатации 1 шт.
3. Устройство и принцип работы:
Прибор состоит из внешнего стакана, внутреннего стакана, крышки, колодки со спиралью, мешалки.
Внешний стакан выполнении в виде цилиндра высотой 140 мм. и диаметром 105 мм. В стакане закреплена теплоизолирующая вставка с полостью для размещения внутреннего стакана.
Внутренний стакан изготовлен из алюминия и имеет форму цилиндра высотой 70 мм. и диаметром 65 мм. Объем внутреннего стакана 200 мл.
Крышка служит для снижения теплообмена между телами, помещенными в калориметр, и внешней средой. В крышке имеется три отверстия, в которые вставляются колодка со спиралью, термометр и мешалка. Если во время опыт какой-то из названных предметов не используются, соответствующее отверстие закрывается пробкой.
Спираль, закрепленная на колодке, выполнена из проволоки с высоким удельным сопротивлением и используется в качестве нагревателя. Спираль крепится к колодке двумя металлическими стержнями. Стержни проходят сквозь колодку и заканчиваются зажимами для подключения соединительных проводов. Сопротивление спирали 1 Ом.
4. Методические рекомендации по использованию прибора на уроках физики
4.1 Фронтальная лабораторная работа:
Определение удельной теплоемкости вещества
Цель работы: отработать прием определения теплоемкости вещества, основанный на использовании уравнения теплового баланса.
Оборудование: весы с разновесами, калориметр, термометр, стакан с водой комнатной температуры, металлический брусок.
Пояснения к работе
В ходе опыта определяют удельную теплоемкость металла, из которого изготовлен брусок.
Брусок нагревают до высокой температуры и помещают в калориметр, где находится холодная вода. В результате теплообмена между бруском с одной стороны и водой и алюминиевым стаканом калориметра с другой температура этих тел станет одинаковой. Не учитывая нагревание воздуха, окружающего калориметр, можно утверждать, что сумма количеств теплоты, полученных водой Qв и алюминиевым стаканом калориметра Qал равна количеству теплоты выделенному бруском Qбр.
Не учитывая нагревание воздуха, окружающего калориметр, можно утверждать, что сумма количеств теплоты, полученных водой Qв и алюминиевым стаканом калориметра Qал равна количеству теплоты выделенному бруском Qбр.
-Q бр. = Q в + Q ал. (1).
Количество теплоты, поглощаемое телом, зависит от массы тела m, удельной теплоемкости вещества с, из которого оно изготовлено, и разности температур после t2 и до t2 теплообмена Q = cm(t2 — t1) (2).
Выразив в равенстве (1) все входящие в него величины с учетом формулы (2) получают расчетную формулу для определения удельной теплоемкости бруска:
C = (c ал.m ал. + c вm в)*(t p — t 0)/m бр.*(t бр. — t p) (3)
Порядок выполнения работы
1. Подготовьте таблицу для записи результатов измерений и вычислений:
m бр, кг m ал., кг m ал.в., кг m в, кг t 0, C t бр, C t p, C с, Дж/кг град
Где m бр. — масса бруска; m ал. — масса стакана калориметра; m ал.в. — масса стакана калориметра с водой; m в — масса воды в калориметре; t 0 — начальная температура воды и стакана калориметра; tбр — температура нагретого бруска; t p — температура воды после установления теплового равновесия; с — удельная теплоемкость материала бруска.
1. Измерьте массу бруска и поместите его в горячую воду для нагревания.
2. Измерьте массу внутреннего стакана калориметра.
3. Наполните стакан калориметра примерно на 2/3 водой комнатной температуры.
4. Измерьте массу стакана калориметра с водой.
5. Вычислите массу воды, налитой в калориметр.
6. Измерьте начальную температуру воды в калориметре.
7. Измерьте температуру нагретого бруска (для этого измеряют температуру воды, в которой он нагревался).
8. Поместите в калориметр нагретый брусок и термометр.
9. Наблюдайте за движением столбика жидкости термометра и измерьте температуру, при которой в калориметре будет достигнуто тепловое равновесие.
10. Вычислите по формуле (3) удельную теплоемкость бруска.
4.2 Работа физического практикума
5. Правила хранения:
Хранить прибор следует в сухом помещении с комнатной температурой (15- 25C) при относительной влажности воздуха 80 %.
Учебное пособие по физике
Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой. Теперь , что звучит очень хрестоматийно ; но в этой последней части Урока 2 мы попытаемся придать смысл этому определению калориметрии. На уроках физики (а для некоторых и на уроках химии) часто проводятся калориметрические лабораторные для определения теплоты реакции, теплоты плавления, теплоты растворения или даже удельной теплоемкости металла. Эти типы лабораторий довольно популярны, потому что оборудование относительно недорогое, а измерения обычно просты. В таких лабораториях используется калориметр. Калориметр — это устройство, используемое для измерения количества тепла, переданного объекту или от него. Большинство студентов, вероятно, не помнят, чтобы использовать такой необычный прибор
Теперь , что звучит очень хрестоматийно ; но в этой последней части Урока 2 мы попытаемся придать смысл этому определению калориметрии. На уроках физики (а для некоторых и на уроках химии) часто проводятся калориметрические лабораторные для определения теплоты реакции, теплоты плавления, теплоты растворения или даже удельной теплоемкости металла. Эти типы лабораторий довольно популярны, потому что оборудование относительно недорогое, а измерения обычно просты. В таких лабораториях используется калориметр. Калориметр — это устройство, используемое для измерения количества тепла, переданного объекту или от него. Большинство студентов, вероятно, не помнят, чтобы использовать такой необычный прибор
 Более сложные случаи включают в себя крышку на чашке со вставленным термометром и, возможно, даже мешалкой.
Более сложные случаи включают в себя крышку на чашке со вставленным термометром и, возможно, даже мешалкой.
Кофейная чашка Калориметрия
Так как же можно использовать такое простое оборудование для измерения количества тепла, полученного или потерянного системой? На предыдущей странице мы узнали, что вода меняет свою температуру, когда получает или теряет энергию. Фактически, количество полученной или потерянной энергии определяется уравнением
Q = m воды • C воды • ΔT воды
, где C воды равно 4,18 Дж/г/°C. Таким образом, если можно измерить массу воды и изменение температуры воды в калориметре кофейной чашки, можно рассчитать количество энергии, полученной или потерянной водой.
В основе науки калориметрии лежит предположение, что энергия, полученная или потерянная водой, равна энергии, потерянной или полученной изучаемым объектом. Так, если делается попытка определить удельную теплоту плавления льда с помощью калориметра кофейной чашки, то предполагается, что энергия, приобретаемая льдом при таянии, равна энергии, теряемой окружающей водой. Предполагается, что между льдом и водой в стакане происходит теплообмен и никакие другие объекты не участвуют в теплообмене. Это утверждение можно представить в виде уравнения как
Предполагается, что между льдом и водой в стакане происходит теплообмен и никакие другие объекты не участвуют в теплообмене. Это утверждение можно представить в виде уравнения как
Q лед = — Q окружающая среда = -Q калориметр
Роль пенополистирола в калориметре кофейной чашки заключается в том, что он уменьшает количество теплообмена между водой в кофейной чашке и окружающим воздухом. . Ценность крышки на кофейной чашке в том, что она также снижает теплообмен между водой и окружающим воздухом. Чем больше уменьшаются эти другие теплообмена, тем более верным будет приведенное выше математическое уравнение. Любой анализ ошибок калориметрического эксперимента должен учитывать поток тепла от системы к калориметру и к другим частям калориметра.0003 окружение . И любой план эксперимента с калориметром должен уделять внимание уменьшению теплообмена между содержимым калориметра и окружающей средой .
Бомбовая калориметрия
Калориметры для кофейных чашек, используемые в научных лабораториях старших классов, дают учащимся полезное упражнение в калориметрии.
 Тепло, выделяющееся из камеры, нагревает заполненную водой рубашку, что позволяет ученым определить количество энергии, выделяемой в результате реакции.
Тепло, выделяющееся из камеры, нагревает заполненную водой рубашку, что позволяет ученым определить количество энергии, выделяемой в результате реакции.
Источник: Wikimedia Commons; благодаря Lisdavid89.
Решение задач калориметрии
Теперь давайте рассмотрим несколько примеров того, как калориметр кофейной чашки можно использовать в качестве инструмента для ответа на некоторые типичные лабораторные вопросы. Следующие три примера основаны на лабораторных экспериментах с использованием калориметрии.
Пример задачи 1:
На уроке физики поставлена задача определить экспериментальное значение теплоты плавления льда. Anna Litical и Noah Formula высушивают и массируют 25,8 г льда и помещают его в кофейную чашку со 100,0 г воды при температуре 35,4°C. Они закрывают кофейную чашку крышкой и вставляют термометр. Через несколько минут лед полностью растаял, а температура воды снизилась до 18,1°С. Каково их экспериментальное значение для удельной теплоты плавления льда?
Основой решения этой проблемы является признание того, что количество энергии, теряемой водой при охлаждении, равно количеству энергии, необходимой для таяния льда. В форме уравнения это можно представить как
В форме уравнения это можно представить как
Q лед = -Q калориметр
(Знак минус указывает на то, что лед набирает энергию, а вода в калориметре теряет энергию.) Здесь калориметр (как в термине Q калориметр ) считается водой в кофейной чашке. Поскольку масса этой воды и изменение ее температуры известны, значение Q
Q калориметр = m•C•ΔT
Q калориметр = (100,0 г)•(4,18 Дж/г/°C)•(18,1°C — 35,4°C)
Q калориметр = -7231,4 Дж
Знак минус указывает на то, что вода потеряла энергию. Предполагается, что эта энергия, потерянная водой, равна количеству энергии, полученной льдом. Итак, Q ice = +7231,4 Дж. (Знак плюс указывает на прирост энергии.) Это значение можно использовать с уравнением с предыдущей страницы для определения теплоты плавления льда.
Q лед = m лед •ΔH плавящийся лед
+7231,4 Дж = (25,8 г)•ΔH расплавленный лед
ΔH расплавленный лед = 280,28 Дж/г
ΔH плавящийся лед = 2,80×10 2 Дж/г (округлено до двух значащих цифр)
Пример задачи 2:
Студент-химик растворяет 4,51 г гидроксида натрия в 100,0 мл воды при температуре 190,5°C (в чашке калориметра). По мере растворения гидроксида натрия температура окружающей воды повышается до 31,7°С. Определить теплоту растворения гидроксида натрия в Дж/г.
По мере растворения гидроксида натрия температура окружающей воды повышается до 31,7°С. Определить теплоту растворения гидроксида натрия в Дж/г.
Опять же, решение этой проблемы основано на признании того, что количество энергии, высвобождаемой при растворении гидроксида натрия, равно количеству энергии, поглощаемой водой в калориметре. В форме уравнения это может быть выражено как
Q Растворение NaOH = -Q калориметр
(Отрицательный знак указывает на то, что NaOH теряет энергию, а вода в калориметре набирает энергию.) Поскольку изменение массы и температуры воды было измерено, энергия, полученная водой (калориметром), может быть определяется.
Q калориметр = m•C•ΔT
Q калориметр = (100,0 г)•(4,18 Дж/г/°C)•(31,7°C — 19,5°C)
Q калориметр = 5099,6 Дж
Предполагается, что эта энергия, приобретаемая водой, равна количеству энергии, выделяемой гидроксидом натрия при растворении.
ΔH раствор = Q растворяющий NaOH / м NaOH
ΔH раствор = (-5099,6 Дж) / (4,51 г)
ΔH раствор = -1,13×10 3 Дж/г (с округлением до трех значащих цифр)
Пример задачи 3:
Большая парафиновая свеча имеет массу 96,83 грамма. Металлическая чашка со 100,0 мл воды при температуре 16,2°С поглощает тепло от горящей свечи и повышает ее температуру до 35,7°С. После прекращения горения температура воды составляла 35,7°С, а масса парафина составляла 96,14 грамма. Определить теплоту сгорания парафина в кДж/г. ДАННО: плотность воды = 1,0 г/мл.
Определить теплоту сгорания парафина в кДж/г. ДАННО: плотность воды = 1,0 г/мл.
Как всегда, калориметрия основана на предположении, что все тепло, теряемое
Q парафин = -Q вода
Поскольку известны масса и изменение температуры воды, можно определить энергию, полученную водой в калориметре.
Q калориметр = m•C•ΔT
Q калориметр = (100,0 г)•(4,18 Дж/г/°C)•(35,7°C — 16,2°C)
Q калориметр = 8151 Дж
При сгорании парафин выделил 8151 Дж или 8,151 кДж энергии. Это основано на сжигании 0,69 грамма (96,83 г — 96,14 г). Для определения теплоты сгорания в расчете на грамм необходимо значение Q
ΔH горение — парафин = (-8,151 кДж) / (0,69 г)
ΔH сжигание — парафин = -11,813 кДж/г
ΔH горение — парафин = -12 кДж/г (округлено до двух значащих цифр)
Проверьте свое понимание
1. Рассмотрим пример задачи 3 выше. Определите как можно больше источников ошибок. Для каждого источника укажите направление ошибки , которая могла бы возникнуть. То есть определите, могла ли ошибка привести к тому, что экспериментально полученное значение оказалось меньше или больше принятого значения.
Рассмотрим пример задачи 3 выше. Определите как можно больше источников ошибок. Для каждого источника укажите направление ошибки , которая могла бы возникнуть. То есть определите, могла ли ошибка привести к тому, что экспериментально полученное значение оказалось меньше или больше принятого значения.
2. Орех кешью весом 2,15 грамма сожжен. Выделившееся тепло повышает температуру 100,0-граммовой пробы воды с 18,2°С до 31,5°С. Масса ореха после опыта 1,78 грамма. Определить калорийность орехов в калориях/грамм. Предположим, что вода способна поглотить только 25% тепла, выделяемого горящим орехом. Учитывая 1,00 калорий = 4,18 кДж.
Как рассчитать постоянную калориметра
Как рассчитать постоянную калориметраКак рассчитать постоянную калориметра
Назад в меню термохимии
Пример #1: Когда 40,0 мл воды при 60,0 °C добавляют к 40,0 мл воды при 25,0 °C, уже находящейся в калориметре, температура повышается на 15,0 °C. Что такое постоянная калориметра?
Что такое постоянная калориметра?
Решение:
Нужно найти разницу между теплотой, отдаваемой горячей водой при понижении ее температуры с 60,0 до 40,0, и теплотой, приобретаемой холодной водой при ее нагревании до 40,0 с 25,0. Обратите внимание, что значения в задаче указаны в мл, а значения в решении — в граммах. Объем (мл) преобразуется в массу (граммы) с использованием плотности воды (1,00 г/мл).
1) Потери горячей воды:
q = m Δt C pq = (40,0 г) (20,0 °C) (4,184 Дж г¯ 1 °C¯ 1 )
q = 3347,2 Дж
2) Холодная вода досталась:
q = m Δt C pq = (40,0 г) (15,0 °C) (4,184 Дж г¯ 1 °C¯ 1 )
q = 2510,4 Дж
3) Остальное досталось калориметру:
3347,2 − 2510,4 = 836,8 Дж
4) Найдите теплоемкость калориметра:
836,8 Дж / 15,0 °С = 55,8 Дж / °С
Пример #2: Рассчитайте постоянную калориметра, если 25,0 г воды при 60,0 °C добавить к 25,0 г воды при 25,0 °C и получить температуру 35,0 °C?
Решение №1:
1) Потери энергии с горячей водой:
q = m Δt C pq = (25,0 г) (25,0 °C) (4,184 Дж г¯ 1 °C¯ 1 )
q = 2615,0 Дж
2) Энергия, полученная холодной водой:
q = m Δt C pq = (25,0 г) (10,0 °C) (4,184 Дж г¯ 1 °C¯ 1 )
q = 1046,0 Дж
3) Остальное досталось калориметру:
2615,0 − 1046,0 = 1569,0 Дж
4) Найдите теплоемкость калориметра:
1569,0 Дж/10,0°С = 156,9 Дж/°С
Решение №2: Если бы константа была равна нулю, конечная температура 50,0 г воды была бы 42,5 °C.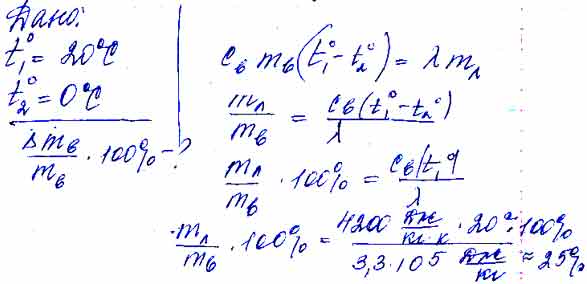
1) Поскольку мы знаем, что реальная конечная точка составляет 35,0 °C, это означает, что мы должны понизить температуру 50,0 г воды до 35,0 °C с 42,5 °C:
(50,0) (4,184) (7,5) = 1569,0 Дж.
2) Калориметр был при 25,0 °C и поднялся до 35,0 °C, используя 1569,0 Дж энергии. Единицей постоянной является джоуль/градус, поэтому:
1569,0 Дж / 10,0°С = 156,9 Дж/°С
Определение постоянной калориметра I
Определение постоянной калориметра II
Пример №3: Калориметр подлежит калибровке: 72,55 г воды при 71,6 °С добавляют в калориметр, содержащий 58,85 г воды при 22,4 °С. После перемешивания и ожидания уравновешивания системы конечная температура достигла 47,3°С. Рассчитайте теплоемкость калориметра. (Удельная теплоемкость воды 4,184 Дж/г¯ 1 °С¯ 1 ).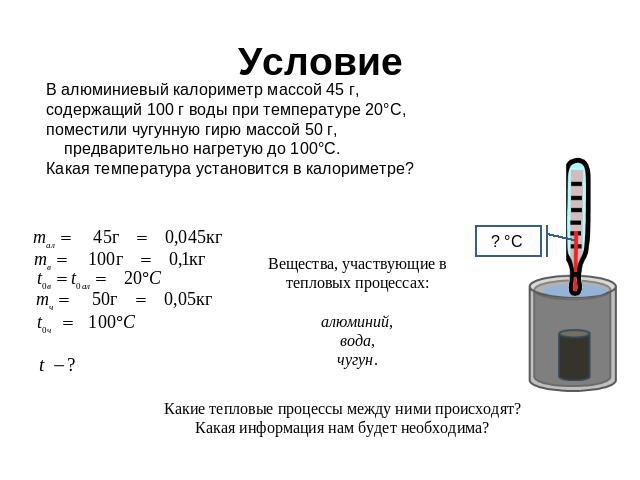
Решение:
1) Потери энергии с горячей водой:
q = м С p ΔTq = (72,55 г) (4,184 Дж г¯ 1 °С¯ 1 ) (24,3 °С)
q = 7376,24 Дж
2) Энергия, получаемая холодной водой:
q = м С p ΔTq = (58,85 г) (4,184 Дж г¯ 1 °C¯ 1 ) (24,9 °C)
q = 5818,54 Дж
3) Остальное досталось калориметру:
7376,24 − 5818,54 = 1557,7 Дж
4) Теплоемкость калориметра:
1557,7 Дж / 24,9°С = 62,6 Дж/°С
Пример #4: Студент хочет определить теплоемкость калориметра кофейной чашки. После смешивания 100,0 г воды при 58,5 °С со 100,0 г воды уже в калориметре при 22,8 °С конечная температура воды составляет 39,7 °С. Рассчитайте теплоемкость калориметра в Дж/°С. (Используйте 4,184 Дж г¯ 1 °C¯ 1 в качестве удельной теплоемкости воды.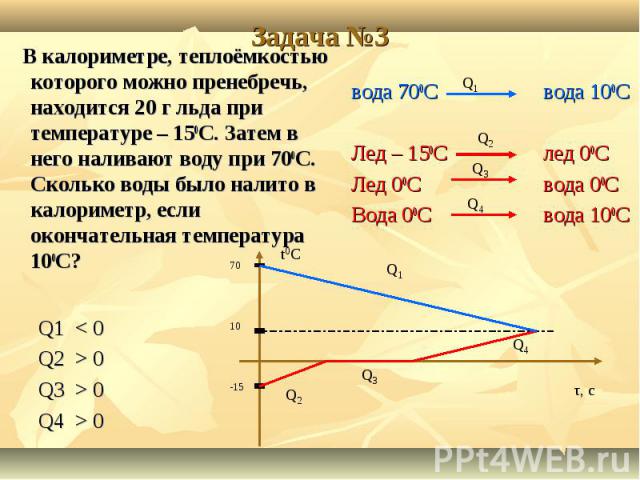

Leave A Comment